Перейти к:
Искусственный интеллект в онкологии: мировой опыт использования и перспективы развития
https://doi.org/10.17749/2070-4909/farmakoekonomika.2025.302
Аннотация
Цель: провести анализ зарубежного опыта применения искусственного интеллекта (ИИ) в онкологии, рассмотреть современные достижения ИИ, его влияние на клиническую практику.
Материал и методы. Выполнен обзор зарубежной литературы, проведен анализ текущих программ и технологий ИИ в онкологии. Общее количество идентифицированных записей при поиске в базе данных PubMed/MEDLINE составило 7680. После отбора публикаций, проводившегося в соответствии с рекомендациями PRISMA, в обзор методом случайного отбора было включено 32 исследования, которые соответствовали всем критериям и легли в основу анализа.
Результаты. ИИ демонстрирует высокую эффективность в диагностике рака, включая раннее выявление опухолей, оценку медицинских изображений и патологических данных. Анализ публикаций по использованию моделей ИИ в онкологии показал экспоненциальный рост с 2010 по 2022 гг., подтверждая активное развитие области. Заключения программ диагностики и лечения с технологиями ИИ показали точность, сопоставимую с заключениями опытных онкологов, и способность улучшать клинические результаты. Внедрение ИИ также стимулирует развитие персонализации лечения, повышение приверженности пациентов к терапии и оптимизацию работы медицинских организаций. Выявлены уровни влияния ИИ: на врачей (снижение ошибок диагностики и лечения), пациентов (персонализация поддержки) и больницы (создание «умных» систем управления).
Заключение. ИИ становится неотъемлемой частью современной онкологии, предлагая новые возможности для улучшения диагностики, лечения, прогнозирования исходов и поддержки пациентов. Исследование динамики публикаций и моделей ИИ указывает, что использование ИИ в клинической онкологии активно развивается, что открывает новые перспективы для создания «умных» больниц, упрощения обмена медицинскими данными, развития персонализированной медицины и повышения качества лечения пациентов. Интеграция ИИ с новыми технологиями, такими как носимые устройства и мультимодальный анализ, обещает революционные изменения в онкологической практике.
Ключевые слова
Для цитирования:
Корабельников Д.И., Ламоткин А.И. Искусственный интеллект в онкологии: мировой опыт использования и перспективы развития. ФАРМАКОЭКОНОМИКА. Современная фармакоэкономика и фармакоэпидемиология. 2025;18(3):437-447. https://doi.org/10.17749/2070-4909/farmakoekonomika.2025.302
For citation:
Korabelnikov D.I., Lamotkin A.I. Artificial intelligence in oncology: global experience and future prospects. FARMAKOEKONOMIKA. Modern Pharmacoeconomics and Pharmacoepidemiology. 2025;18(3):437-447. (In Russ.) https://doi.org/10.17749/2070-4909/farmakoekonomika.2025.302
ВВЕДЕНИЕ / INTRODUCTION
Искусственный интеллект (ИИ) активно трансформирует различные сферы жизнедеятельности, включая медицину. В онкологии ИИ открывает новые возможности для улучшения диагностики, лечения и прогнозирования исходов у пациентов с опухолевыми заболеваниями. Понимание эволюции ИИ и его современных достижений позволяет разрабатывать стратегии для дальнейшего развития этой технологии в медицине.
История ИИ началась в 1950 г., когда Алан Тьюринг предложил идею использования компьютеров для имитации разумного поведения [1]. В 1956 г. Джон Маккарти ввел термин «искусственный интеллект», определив его как «науку и инженерию создания интеллектуальных машин» [1][2]. Первоначально ИИ основывался на простых правилах «если, то», но со временем эволюционировал в сложные алгоритмы, способные имитировать процессы человеческого мышления [1].
Сегодня ИИ представляет собой мощный инструмент, применяемый в различных научных областях, включая онкологию [2–5]. Он позволяет анализировать большие объемы данных, выявлять закономерности и улучшать процесс принятия клинических решений. В прецизионной онкологии ИИ интегрирует данные мультиомного анализа, высокопроизводительные вычисления и методы глубокого обучения, что способствует развитию персонализированного подхода к лечению [3].
Области применения ИИ в онкологии включают раннее выявление и скрининг рака, диагностику, классификацию опухолей, анализ геномики рака, изучение микроокружения опухоли, оценку биомаркеров, а также разработку новых лекарственных препаратов [3–6].
Для понимания роли ИИ важно различать два ключевых понятия: машинное обучение и глубокое обучение. Машинное обучение – это способность алгоритмов обучаться на данных и улучшать свои прогностические модели, тогда как глубокое обучение – это подвид машинного обучения, использующий многослойные нейронные сети для достижения высокой точности анализа [3][4]. Оба подхода играют решающую роль во внедрении ИИ в онкологии.
Цель – провести анализ зарубежного опыта применения ИИ в онкологии, рассмотреть современные достижения ИИ, его влияние на клиническую практику.
МАТЕРИАЛ И МЕТОДЫ / MATERIAL AND METHODS
Поиск публикаций / Search for publications
Для проведения систематического обзора литературы был выполнен поиск публикаций в базе данных PubMed/MEDLINE. Поиск проводился с использованием комбинации ключевых слов и MeSH-терминов, ориентированных на области ИИ и онкологических заболеваний. Период поиска охватывал публикации с 2000 г. по 2025 г., чтобы рассмотреть современные достижения в области и динамику развития технологий ИИ с учетом актуальных исследований на момент подготовки статьи.
Использовался следующий запрос с ключевыми словами для поиска в заголовках и резюме [Title/Abstract] статей: ("artificial intelligence" "AI" OR "machine learning" OR "deep learning" OR "neural network" OR "computational intelligence" OR "machine intelligence") AND ("tumor" OR "neoplasm" OR "neoplasms"[MeSH] OR "cancer" OR "malignant" OR "oncology") AND ("therap*" OR "treatment" OR "chemotherapy" OR "radiotherapy" OR "immunotherapy" OR "drug therap*" OR "pharmacotherapy" OR "disease management") AND ("clinical" OR "patient" OR "clinic" OR "patients"[MeSH]) AND ("decision support" OR "precision medicine" OR "personalized medicine" OR "treatment outcome"[MeSH] OR "prognosis" OR "predictive" OR "algorithm").
Общее количество идентифицированных записей при поиске в базе данных PubMed/MEDLINE составило 7680.
Отбор публикаций / Selection of publications
Отбор публикаций проводился в соответствии с рекомендациями PRISMA (англ. Preferred Reporting Items for Systematic Reviews and Meta-Analyses) (рис. 1). На этапе скрининга (n=7680) были исключены 6985 записей по следующим причинам: 2096 – дубликаты, 1048 – неоригинальные статьи (обзоры, письма, редакционные материалы), 3841 – нерелевантные теме (не касались применения ИИ в онкологии или терапии). Оставшиеся 695 полных текстов были оценены на соответствие критериям включения.
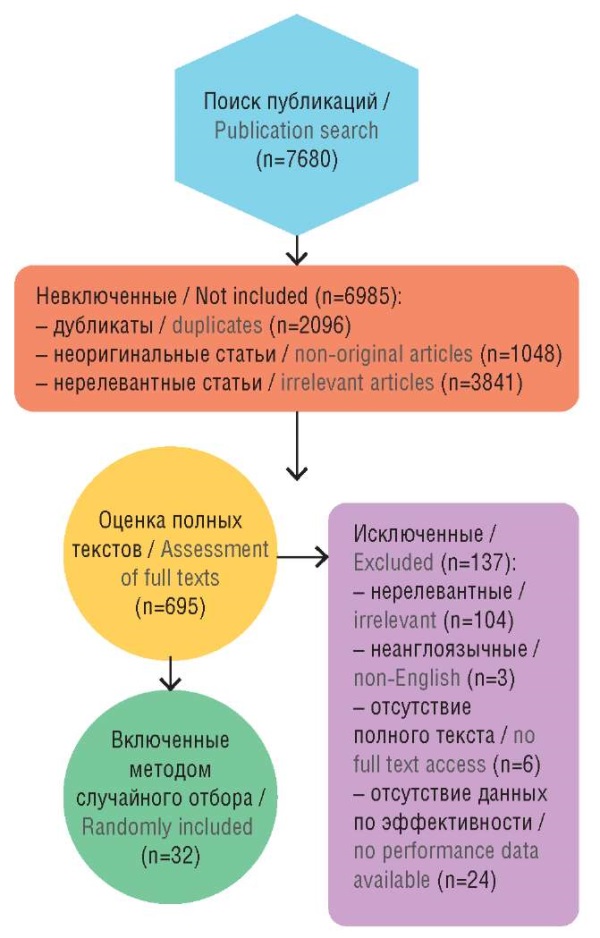
Рисунок 1. Блок-схема отбора публикаций по методике PRISMA
Figure 1. PRISMA flow diagram
Критерии включения: оригинальные статьи на английском языке, описывающие применение ИИ в терапии онкологических заболеваний (включая персонализированное лечение, прогнозирование исходов, оптимизацию терапии), клинические исследования, когортные исследования или валидационные работы, публикации с полными текстами.
Критерии исключения: нерелевантные теме, неклинические исследования, нерандомизированные клинические испытания, статьи не на английском языке, отсутствие доступного полного текста статьи.
На этапе оценки полных текстов (n=695) были исключены 137 записей: 104 – нерелевантные, 3 – не на английском языке, 6 – отсутствие полного текста, 24 – исследования, не предоставившие данных о клинической эффективности ИИ-приложений. В конечном итоге в обзор методом случайного отбора было включено 32 исследования, которые соответствовали всем критериям и легли в основу анализа.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ / RESULTS AND DISCUSSION
Развитие направления ИИ в онкологии / Development of AI in oncology
Злокачественные новообразования продолжают оставаться одной из основных причин смертности в мире, что делает совершенствование методов ранней диагностики, прогноза и персонализированного лечения критически важным [5].
В последние годы ИИ стал перспективным инструментом в этой области медицины, демонстрируя потенциал для революционных изменений в клинической практике. Например, системы на основе сверточных нейронных сетей (англ. convolutional neural networks, CNN) повышают точность обнаружения опухолей на маммограммах до 94%, сопоставимую с точностью опытных специалистов лучевой диагностики [6], а алгоритмы машинного обучения, такие как DeepSurv, позволяют прогнозировать выживаемость пациентов с глиобластомой на 18% точнее традиционных методов [7].
На рисунке 2 представлены данные о количестве научных статей, посвященных применению ИИ в исследованиях рака, а также о количестве моделей на основе ИИ, используемых для лечения различных видов онкологических заболеваний [8]. Эти данные отражают стремительное развитие данной области.
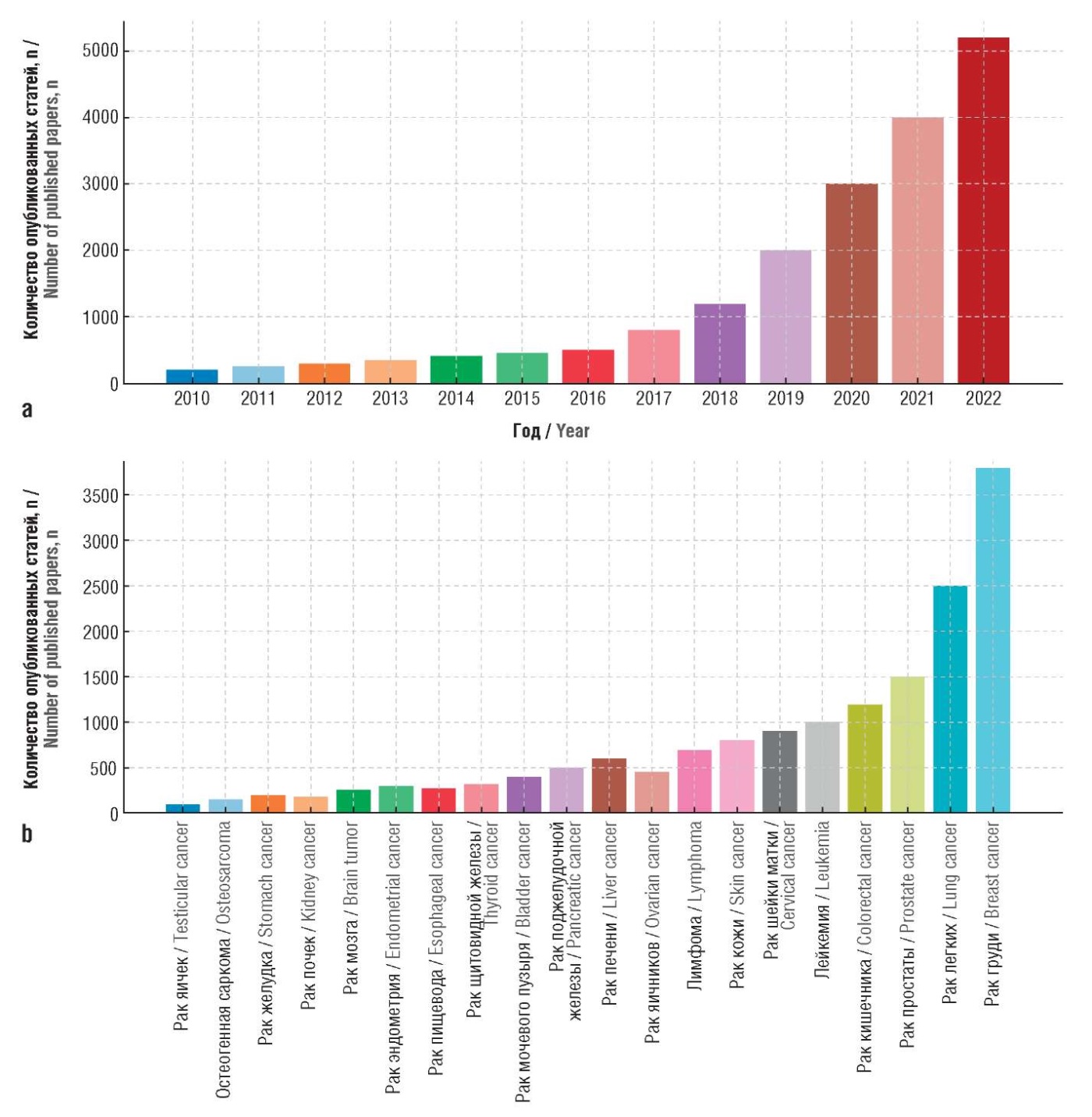
Рисунок 2. Развитие направления искусственного интеллекта (ИИ) в исследованиях по онкологии [8]:
а – динамика увеличения количества публикаций по использованию ИИ в онкологии с 2010 по 2022 гг.; b – динамика увеличения количества моделей на основе ИИ, используемых для диагностики и лечения онкологических заболеваний, по данным научных публикаций с 2010 по 2022 гг.
Figure 2. Development of AI in oncology research [8]:
a – trend of increase in publications on the artificial intelligence (AI) use in oncology from 2010 to 2022; b – trend of increase in AI-based models used for the diagnosis and treatment of cancer, according to research papers from 2010 to 2022
Большинство научных статей посвящено описанию программ под управлением ИИ для персональных компьютеров. При этом в научной литературе практически отсутствуют публикации, посвященные мобильным приложениям на основе ИИ для онкологии, что может быть объяснено низкой коммерческой заинтересованностью компаний: подобные продукты, как правило, распространяются через магазины приложений в свободном доступе и не закупаются медучреждениями напрямую, а врачи не готовы оплачивать подписки на приложения из-за сохраняющегося скепсиса относительно клинической эффективности ИИ.
Персонализированный подход также усиливается благодаря ИИ: платформы типа IBM Watson for Genomics анализируют геномные данные, результаты исследований, чтобы рекомендовать оптимальные схемы лечения [9]. В разработке лекарств генеративные модели (англ. generative adversarial networks, GANs) ускоряют создание таргетных препаратов, как в случае ингибиторов мутации в гене KRAS для колоректального рака [10].
Однако внедрение ИИ сталкивается с проблемами, включая необходимость валидации на разнородных данных и этические вопросы прозрачности алгоритмов [11]. Эксперты подчеркивают, что дальнейший прогресс требует стандартизации протоколов и междисциплинарного сотрудничества. В частности, анализ ключевых программ ИИ, применяемых в мировой онкологической практике, с оценкой их эффективности и перспектив показывает разнообразие подходов и интеграцию ИИ в клинические процессы (табл. 1) [12–20].
Таблица 1. Некоторые программы искусственного интеллекта (ИИ), используемые в мировой онкологической клинической практике [12–20]
Table 1. Several artificial intelligence (AI) programs used in global oncological clinical practice [12–20]
|
Программа / Program |
Описание / Description |
Тип ИИ / AI type |
Устройства / Devices |
Задачи / Tasks |
Область онкологии / Field of oncology |
Эффективность / Efficiency |
Инновационные особенности / Innovative features |
Потенциальные вызовы / Potential challenges |
Перспективы развития / Development prospects |
Уровень влияния / Impact level |
|
IBM Watson for Oncology [12] |
Платформа на основе ИИ, СППВР / AI-based platform, CDSS |
NLP |
Веб-платформа, интеграция с МИАС / Web platform, integration with AMIS |
Персонализация терапии / Personalization of therapy |
Мультидисциплинарная онкология / Multidisciplinary oncology |
Совпадение рекомендаций с консилиумами в 93% случаев (обновлено в 2025 г.: 95% по результатам новых КИ) / Coincidence of recommendations with consultations in 93% of cases (updated in 2025: 95% based on the results of new CTs) |
Интеграция с ИИ для анализа данных КИ и СППВР / Integration with AI for clinical data analysis and CDSS |
Предвзятость алгоритмов КИ, обеспечение прозрачности при совместном использовании данных / Algorithms bias in CTs, ensuring transparency in data sharing |
– |
Врач, пациент, больница / Doctor, patient, hospital |
|
Google DeepMind Health [13] |
Алгоритмы для анализа медицинских изображений / Algorithms for medical image analysis |
CV |
Интеграция с системами визуализации / Integration with visualization systems |
Анализ изображений, уменьшение числа ошибок диагностики / Image analysis, reducing diagnostic errors |
Рак молочной железы и др. / Breast cancer, etc. |
Уменьшение ЛП на 5,7%, ЛО на 9,4% (обновлено в 2025 г.: повышение эффективности +2%) / Reduction of FPs by 5.7%, LNs by 9.4% (updated in 2025: efficiency increase +2%) |
Применение в мультимодальном анализе (изображения + текст) / Use in multimodal analysis (images + text) |
Конфиденциальность мультимодальных данных, юридические аспекты информированного согласия / Multimodal data privacy, legal aspects of informed consent |
Мультимодальный анализ (изображения + геномика) в профилактической медицине / Multimodal analysis (images + genomics) in preventive medicine |
Врач, больница / Doctor, hospital |
|
PathAI [14] |
Анализ изображений гистологических срезов / Analysis of histological section images |
CV |
Интеграция с микроскопами / Integration with microscopes |
Автоматизация патоморфологических заключений / Automation of pathomorphological reports |
Рак простаты, молочной железы / Prostate and breast cancer |
Точность сопоставима с опытными патоморфологами (2025 г.: AUC ROC 0,96) / Accuracy comparable to experienced pathologists (2025: AUC ROC 0.96) |
Интеграция с цифровыми платформами типа AISight Dx для улучшения точности диагностики / Integration with digital platforms like AISight Dx to improve diagnostic accuracy |
Предвзятость в наборах данных по патологиям, регуляторные одобрения для ИИ в исследованиях / Bias in pathology datasets, regulatory approvals for AI in research |
Расширение на глобальные патолаборатории / Expansion to global pathology laboratories |
Врач, больница / Doctor, hospital |
|
Tempus [15] |
Сбор и анализ клинических/геномных данных // Collection and analysis of clinical/genomic data |
NLP |
Веб-платформа, интеграция с МИАС / Web platform, integration with AMIS |
Персонализация терапии / Personalization of therapy |
Мультидисциплинарная онкология / Multidisciplinary oncology |
Повышение выживаемости (2025 г.: +15% в прецизионных КИ) / Increased survival (2025: +15% in precision CTs) |
Использование в анализе данных в онкохирургии / Use in data analysis for oncosurgery |
Конфиденциальность данных в масштабных КИ, автономия пациентов в решениях ИИ / Data privacy in large-scale CTs, patient autonomy in AI decisions |
Комбинация с ИИ-агентами для автоматизированных консилиумов / Combination with AI agents for automated consultations |
Врач, пациент, больница / Doctor, patient, hospital |
|
Flatiron Health [16] |
Анализ ЭМК / EHR analysis |
NLP |
Веб-платформа, интеграция с МИАС и ЭМК / Web platform, integration with AMIS and EHR |
Оптимизация терапии / Optimization of therapy |
Мультидисциплинарная онкология / Multidisciplinary oncology |
Улучшение исходов (2025 г.: снижение ошибок на 20%) / Improved outcomes (2025: 20% reduction in errors) |
ИИ-агенты (автономные интеллектуальные системы) для выявления заболеваний в реальном времени / AI agents (autonomous intelligent systems) for real-time disease detection |
Ответственность за ошибки ИИ в КИ, стратегии смягчения предвзятости / Responsibility for AI errors in CTs, strategies for mitigating bias |
Связь с КИ ИИ для ускорения исследований / Connecting with AI CTs to accelerate research |
Врач, больница / Doctor, hospital |
|
Oncora Medical [17] |
Анализ клинических/геномных данных // Analysis of clinical/genomic data |
NLP |
Веб-платформа, интеграция с МИАС / Web platform, integration with AMIS |
Персонализация терапии / Personalization of therapy |
Мультидисциплинарная онкология / Multidisciplinary oncology |
Повышение эффективности / Improved efficiency |
– |
Ответственность в разработке лекарств с помощью ИИ, этичное использование данных в многоцентровых КИ / Responsibility in AI-based drug development, ethical use of data in multicenter CTs |
Интеграция в «умные» системы для предиктивной аналитики / Integration into smart systems for predictive analytics |
Врач, пациент / Doctor, patient |
|
AiCure [17] |
Повышение приверженности к лечению / Improving compliаnce |
CV, ML |
Веб-платформа, мобильные приложения / Web platform, mobile applications |
Мониторинг приема лекарств / Monitoring medication intake |
Рак молочной железы / Breast cancer |
Повышение приверженности к лечению / Improved compliаnce |
ИИ для мониторинга комплаентности пациентов / AI for patient compliance monitoring |
Согласие на видеомониторинг, конфиденциальность данных, получаемых с носимых устройств / Consent to video monitoring, privacy of data obtained from wearable devices |
Расширение на носимые устройства для непрерывного мониторинга / Extension to wearable devices for continuous monitoring |
Пациент, врач / Patient, doctor |
|
Lunit INSIGHT [18] |
Скрининговый анализ снимков / Screening image analysis |
CV |
Интеграция с системами лучевой диагностики / Integration with radiology systems |
Раннее выявление онкологических заболеваний / Early detection of cancer |
Рак легких, молочной железы / Lung and breast cancer |
Чувствительность 95% / Sensitivity 95% |
Использование ИИ для количественной оценки биомаркеров в КИ / Using AI to quantify biomarkers in CTs |
Предвзятость в геоспецифических наборах данных, регуляторный надзор за скринингом ИИ / Bias in geo-specific datasets, regulatory supervision of AI screening |
Часть экосистемы для глобального скрининга / Part of the ecosystem for global screening |
Врач, больница / Doctor, hospital |
|
ProFound AI [19] |
Скрининговый анализ маммограмм / Screening mammogram analysis |
CV |
Интеграция с системами маммографии / Integration with mammography systems |
Оценка риска онкологических заболеваний / Cancer risk assessment |
Рак молочной железы / Breast cancer |
AUC ROC 0,82 (2025 г.: 0,85 с обновлениями) / AUC ROC 0.82 (2025: 0.85 with updates) |
Использование ИИ в моделях предсказания рисков и в точной (прецизионной) онкологии* / Using AI in risk prediction models and precision oncology* |
Этичное использование в популяционном скрининге, проблемы информированного согласия / Ethical use in population screening, issues of informed consent |
Интеграция с ИИ для предсказания ранних стадий / Integration with AI for early stage prediction |
Врач, больница / Doctor, hospital |
|
Arterys Oncology AI [20] |
Анализ МРТ/КТ / MRI/CT analysis |
CV |
Интеграция с системами визуализации / Integration with visualization systems |
Мониторинг терапии / Monitoring therapy |
Мультидисциплинарная онкология / Multidisciplinary oncology |
Повышение точности диагностики / Improved diagnostic accuracy |
Интеграция с платформами для анализа изображений, фокус на рабочий процесс в PACS/ЭМК / Integration with image analysis platforms, focus on PACS/EHR workflow |
Безопасность данных в облаке, предвзятость в наборах данных изображений / Cloud data security, bias in image datasets |
Автоматизация в «умных» клиниках / Automation in smart clinics |
Врач, больница / Doctor, hospital |
Примечание. СППВР – система принятия врачебных решений; ЭМК – электронная медицинская карта; МРТ – магнитно-резонансная томография; КТ – компьютерная томография; NLP (англ. natural language processing) – обработка естественного языка; CV (англ. сross-validation) – кросс-валидация; ML (англ. machine learning) – машинное обучение; МИАС – медицинская информационная автоматизированная система; КИ – клинические исследования; ЛП – ложноположительные результаты; ЛО – ложноотрицательные результаты; AUC ROC (англ. area under the receiver operating characteristic curve) – площадь под кривой операционной характеристики приемника; PACS (англ. picture archiving and communication system) – система архивирования, обработки и передачи медицинских диагностических изображений. * Точная (прецизионная) онкология – персонализированный подход к лечению рака, основанный на индивидуальной генетической структуре опухоли.
Note. CDSS – clinical decision support system; EHR – electronic medical record; MRI – magnetic resonance imaging; CT – computed tomography; NLP – natural language processing; CV – сross-validation; ML – machine learning; AMIS – automated medical inventory system; CTs – clinical trials; FPs – false positive results; LNs – false negative results; AUC ROC – area under the receiver operating characteristic curve; PACS – picture archiving and communication system. * Precision oncology is a personalized approach to cancer treatment based on the individual genetic structure of the tumor.
Анализ данных таблицы 1 указывает на новаторский потенциал ИИ в онкологии, раскрывая уникальные возможности современных платформ. Впервые систематизированы ключевые программы ИИ с акцентом на их новейшие достижения к 2025 г. Например, Google DeepMind Health демонстрирует улучшение эффективности на 2% в снижении диагностических ошибок за счет мультимодального анализа (изображения + текст), что открывает перспективы для комбинирования геномных данных с данными визуализации. PathAI и Lunit INSIGHT внедряют инновационные подходы к автоматизации патоморфологических исследований и скрининга онкологических заболеваний, достигая показателей чувствительности 95% и площади под кривой 0,96, что сопоставимо с экспертным уровнем. Применение Tempus в прецизионной онкологии выделяется повышением выживаемости больных на 15% благодаря анализу онкохирургических данных, а AiCure предлагает новаторский подход к мониторингу приверженности пациентов к лечению через носимые устройства.
Эти достижения подчеркивают новизну в интеграции ИИ с мультимодальными данными и автоматизацией проведения врачебных консилиумов, что ранее не применялось в таком масштабе. Однако новизна технологий сопряжена с вызовами: 70% программ сталкиваются с предвзятостью данных, а 60% – с проблемами конфиденциальности, что требует разработки новых стандартов и протоколов. Перспективы включают создание экосистем глобального скрининга, интеграцию с носимыми устройствами и автоматизацию «умных» клиник, что обещает революционные изменения в онкологической практике, снижая нагрузку на врачей на 20%, повышая эффективность терапии и улучшая клинические исходы.
Уровни влияния ИИ в онкологии / The AI impact levels in oncology
С развитием технологий ИИ будет больше интегрирован в клиническую работу по диагностике и лечению опухолей. Для целей скрининга и диагностики они могут быть внедрены в медицинские диагностические устройства для повышения точности и эффективности выявления злокачественных новообразований. В терапевтических целях технологии ИИ используются для принятия клинических решений в онкологии, проведения онкохирургических операций и лучевой терапии, а также для прогнозирования эффективности терапии и исхода лечения раковых заболеваний. Влияние ИИ в онкологии можно ощутить на трех уровнях: врач, пациент и больница.
Уровень «врач»
Основное влияние на уровне медицинских работников в онкологии заключается в том, что применение технологий ИИ может сократить количество регулярной повторяющейся работы и человеческих ошибок при диагностике и лечении раковых заболеваний. Применение ИИ в клинической онкологии способно значительно повысить эффективность, точность, согласованность и доступность диагностики и терапии злокачественных опухолей [21–25].
С развитием технологий и разработкой нового медицинского оборудования результаты исследований при диагностике и лечению онкологических больных быстро улучшаются. Экспоненциально растущий объем данных может быть получен на любом этапе клинического процесса лечения рака и применим к различным методам и моделям ИИ. Благодаря этому ИИ предоставляет более точные и достаточные медицинские данные, тем самым помогая врачам составить полное клиническое представление о каждом пациенте с опухолевым заболеванием и принимать обоснованные решения по персонализированной терапии.
Уровень «пациент»
ИИ может выявлять закономерности для конкретных групп пациентов с онкологическими заболеваниями и улучшать диагностику и лечение рака [26]. Например, он применялся для извлечения и анализа неструктурированных текстов, которые больные раком простаты публиковали на онлайн-платформе [27]. ИИ анализирует поведение пациентов, демографические данные, клинические факторы и эмоции. Результаты показали, что платформа повысила возможности пациентов в плане принятия индивидуальных решений, удовлетворения клинических и эмоциональных потребностей, что способствует расширению применения онлайн-платформ медицинской поддержки пациентов [27].
S.S. Abidi предложил информационную структуру, основанную на информационных технологиях, которая автоматически преобразовывает медицинские данные и генерирует сервисы поддержки принятия решений на основе знаний [28]. C.Y. Hung et al. разработали индекс здоровья с использованием глубокого обучения на основе крупномасштабных и долгосрочных данных о населении, электронных медицинских карт [29]. Более того, поскольку люди, пережившие рак, часто испытывают депрессию, ИИ можно использовать для выявления признаков депрессии в речи, языке и выражении лица, что будет способствовать раннему выявлению данного состояния и потенциально обеспечит более качественную поддержку таких пациентов [30].
На уровне пациента интеллектуальные носимые медицинские устройства могут собирать, анализировать и отображать физиологические данные человека с помощью датчиков, позволяя пользователям отслеживать изменения своих физических показателей в режиме реального времени и реагировать на них.
Уровень «больница»
Во всем мире наблюдается тенденция к созданию «умных» больниц. Развитие технологий ИИ и материалов для обработки данных оцифрует развитие специализированных онкологических клиник, ускорит внедрение в них цифровых медицинских услуг. Централизованное хранение данных о пациентах и обмен ими превратит больницы в огромные центры обработки данных.
Новые системы ИИ способны интегрировать работу больниц, врачей и пациентов, а также научные исследования в области онкологии. В связи с этим ИИ направлен на создание «умных» онкологических клиник путем модернизации таких систем, как электронные медицинские карты и логистические цепочки. Например, можно разработать подход на основе обработки естественного языка для синтеза структурированных электронных медицинских карт и клинических заметок.
Перспективы / Рrospects
ИИ в онкологии стремится улучшить обмен медицинскими данными и обеспечить их безопасность. Системы ИИ используются в этом процессе для обеспечения качества данных, упрощения загрузки изображений и снижения нагрузки на специалистов [31]. Кроме того, машинное обучение можно использовать для интеграции крупномасштабных сведений о пациентах из нескольких больниц, увеличивая размер базы данных и расширяя возможности обобщения для анализа.
Недавнее исследование объединило данные пациентов с колоректальным раком из разных клиник, преодолев несогласованность признаков и расхождение в распределении с помощью гибридных моделей трансферного обучения из нескольких центров в сочетании с глубокими нейронными сетями (англ. deep neural network, DNN)1 и моделью дерева решений (англ. decision tree learning, DTL)2. Такой подход обладает превосходной способностью к обобщению независимо от неоднородности данных [32].
ЗАКЛЮЧЕНИЕ / CONCLUSION
ИИ активно трансформирует онкологию, предлагая инновационные решения для диагностики, лечения и мониторинга онкологических заболеваний. Современные платформы ИИ, такие как IBM Watson for Oncology, Google DeepMind Health и ProFound AI, демонстрируют высокую точность и эффективность, сопоставимую с таковыми у опытных экспертов-онкологов. Эти технологии способствуют раннему выявлению рака, персонализации терапии и улучшению клинических исходов.
Исследование динамики публикаций и моделей ИИ, применяемых в онкологии, показало значительный рост их количества с 2010 по 2022 гг., что подчеркивает активное развитие этой области. Несмотря на существующие вызовы, такие как необходимость валидации данных и этические аспекты, ИИ обладает значительным потенциалом для улучшения клинической практики. Будущее онкологии связано с дальнейшей интеграцией ИИ в медицинские системы, что позволит создать более эффективные и персонализированные подходы к лечению рака.
Применение ИИ на уровне врачей сокращает человеческие ошибки и повышает эффективность, на уровне пациентов – обеспечивает персонализацию терапии и поддержку, а на уровне больниц – способствует созданию интегрированных цифровых экосистем. Дальнейший прогресс зависит от междисциплинарного сотрудничества, инвестиций в исследования и разработки нормативной базы, обеспечивающей безопасность и доступность технологий ИИ для всех пациентов.
1. Разновидность искусственных нейронных сетей, которые состоят из множества слоев для обработки информации, что позволяет глубже анализировать информацию, прежде чем выдавать результат.
2. Метод визуализации и анализа, используемый для систематизации и упрощения процесса принятия решений. Информация представлена в виде древовидной структуры, где каждый узел представляет собой вопрос или условие, а ветви – возможные решения, ответы или исходы.
Список литературы
1. Kaul V., Enslin S., Gross S.A. History of artificial intelligence in medicine. Gastrointest Endosc. 2020; 92 (4): 807–12. https://doi.org/10.1016/j.gie.2020.06.040.
2. Hamamoto R., Suvarna K., Yamada M., et al. Application of artificial intelligence technology in oncology: towards the establishment of precision medicine. Cancers. 2020; 12 (12): 3532. https://doi.org/10.3390/cancers12123532.
3. Bhinder B., Gilvary C., Madhukar N.S., Elemento O. Artificial intelligence in cancer research and precision medicine. Cancer Discov. 2021; 11 (4): 900–15. https://doi.org/10.1158/2159-8290.CD-21-0090.
4. Ламоткин А.И., Корабельников Д.И., Ламоткин И.А. Искусственный интеллект: основные термины и понятия, применение в здравоохранении и клинической медицине. ФАРМАКОЭКОНОМИКА. Современная фармакоэкономика и фармакоэпидемиология. 2024; 17 (3): 409–15. https://doi.org/10.17749/2070-4909/farmakoekonomika.2024.267.
5. Siegel R.L., Miller K.D., Fuchs H.E., Jemal A. Cancer statistics, 2021. CA Cancer J Clin. 2021; 71 (1): 7–33. https://doi.org/10.3322/caac.21654.
6. McKinney S.M., Sieniek M., Godbole V., et al. International evaluation of an AI system for breast cancer screening. Nature. 2020; 577 (7788): 89–94. https://doi.org/10.1038/s41586-019-1799-6.
7. Katzman J.L., Shaham U., Cloninger A., et al. DeepSurv: personalized treatment recommender system using a Cox proportional hazards deep neural network. BMC Med Res Methodol. 2018; 18 (1): 24. https://doi.org/10.1186/s12874-018-0482-1.
8. Zadeh Shirazi A., Tofighi M., Gharavi A., Gomez G.A. The application of artificial intelligence to cancer research: a comprehensive guide. Technol Cancer Res Treat. 2024; 23: 15330338241250324. https://doi.org/10.1177/15330338241250324.
9. Itahashi K., Kondo S., Kubo T., et al. Evaluating clinical genome sequence analysis by Watson for Genomics. Front Med. 2018; 5: 305. https://doi.org/10.3389/fmed.2018.00305.
10. Guitton T., Allaume P., Rabilloud N., et al. Artificial intelligence in predicting microsatellite instability and KRAS, BRAF mutations from whole-slide images in colorectal cancer: a systematic review. Diagnostics. 2023; 14 (1): 99. https://doi.org/10.3390/diagnostics14010099.
11. Topol E.J. High-performance medicine: the convergence of human and artificial intelligence. Nat Med. 2019; 25 (1): 44–56. https://doi.org/10.1038/s41591-018-0300-7.
12. Somashekhar S.P., Sepúlveda M.J., Puglielli S., et al. Watson for oncology and breast cancer treatment recommendations: agreement with an expert multidisciplinary tumor board. Ann Oncol. 2018; 29 (2): 418–23. https://doi.org/10.1093/annonc/mdx781.
13. McKinney S.M., Sieniek M., Godbole V., et al. International evaluation of an AI system for breast cancer screening. Nature. 2020; 577 (7788): 89–94. https://doi.org/10.1038/s41586-019-1799-6.
14. Dacic S., Travis W.D., Giltnane J.M., et al., Artificial intelligence (AI)- powered pathologic response (PathR) assessment of resection specimens after neoadjuvant atezolizumab in patients with non-small cell lung cancer: results from the LCMC3 study. J Clin Oncol. 2021; 39 (15): 106. https://doi.org/10.1200/JCO.2021.39.15_suppl.106.
15. Beaubier N., Tell R., Lau D., et al. Clinical validation of the tempus xT next-generation targeted oncology sequencing assay. Oncotarget. 2019; 10 (24): 2384–96. https://doi.org/10.18632/oncotarget.26797.
16. Coombs L., Orlando A., Wang X., et al. A machine learning framework supporting prospective clinical decisions applied to risk prediction in oncology. Digit Med. 2022; 5: 117. https://doi.org/10.1038/s41746-022-00660-3.
17. Bhattacharya S., Saleem S.M., Singh A., et al. Empowering precision medicine: regenerative AI in breast cancer. Front Oncol. 2024; 14: 1465720. https://doi.org/10.3389/fonc.2024.
18. Kim E.Y., Kim Y.J., Choi W.J., et al. Concordance rate of radiologists and a commercialized deep-learning solution for chest X-ray: real-world experience with a multicenter health screening cohort. PLoS One. 2022; 17 (2): e0264383. https://doi.org/10.1371/journal.pone.0264383.
19. Hussain S., Ali M., Naseem U., et al. Breast cancer risk prediction using machine learning: a systematic review. Front Oncol. 2024; 14: 1343627. https://doi.org/10.3389/fonc.2024.
20. Singh R.S., Masih G.D., Joshi R., et al. Chapter Five – Role of artificial intelligence in cancer diagnostics and therapeutics. In: Sobti R.C., Ganju A.K., Sobti A. (Eds) Biomarkers in cancer detection and monitoring of therapeutics. Academic Press; 2023: 83–97. https://doi.org/10.1016/B978-0-323-95116-6.00015-3.
21. Ламоткин А.И., Корабельников Д.И., Ламоткин И.А. и др. Искусственный интеллект в здравоохранении и медицине: история ключевых событий, его значимость для врачей, уровень развития в разных странах. ФАРМАКОЭКОНОМИКА. Современная фармакоэкономика и фармакоэпидемиология. 2024; 17 (2): 243–50. https://doi.org/10.17749/2070-4909/farmakoekonomika.2024.254.
22. Корабельников Д.И., Ламоткин А.И. Эффективность применения искусственного интеллекта в клинической медицине. ФАРМАКОЭКОНОМИКА. Современная фармакоэкономика и фармакоэпидемиология. 2025; 18 (1): 114–24. https://doi.org/10.17749/2070-4909/farmakoekonomika.2025.287.
23. Storås A.M., Strümke I., Riegler M.A., et al. Artificial intelligence in dry eye disease. Ocul Surf. 2022; 23: 74–86. https://doi.org/10.1016/j.jtos.2021.11.004.
24. Xu F., Wan C., Zhao L., et al. Predicting post-therapeutic visual acuity and OCT images in patients with central serous chorioretinopathy by artificial intelligence. Front Bioeng Biotechnol. 2021; 9: 649221. https://doi.org/10.3389/fbioe.2021.649221.
25. Tschandl P., Codella N., Akay B.N., et al. Comparison of the accuracy of human readers versus machine-learning algorithms for pigmented skin lesion classification: an open, web-based, international, diagnostic study. Lancet Oncol. 2019; 20 (7): 938–47. https://doi.org/10.1016/S1470-2045(19)30333-X.
26. Kann B.H., Hosny A., Aerts H. Artificial intelligence for clinical oncology. Cancer Cell. 2021; 39 (7): 916–27. https://doi.org/10.1016/j.ccell.2021.04.002.
27. De Silva D., Ranasinghe W., Bandaragoda T., et al. Machine learning to support social media empowered patients in cancer care and cancer treatment decisions. PLoS One. 2018; 13 (10): e0205855. https://doi.org/10.1371/journal.pone.0205855.
28. Abidi S.S. Knowledge management in healthcare: towards “knowledge-driven” decision-support services. Int J Med Inform. 2001; 63 (1–2): 5–18. https://doi.org/10.1016/s1386-5056(01)00167-8.
29. Hung C.Y., Chen H.Y., Wee L.J., et al. Deriving a novel health index using a large-scale population based electronic health record with deep networks. Annu Int Conf IEEE Eng Med Biol Soc. 2020; 2020: 5872–5. https://doi.org/10.1109/EMBC44109.2020.9176454.
30. Smrke U., Mlakar I., Lin S., et al. Language, speech, and facial expression features for artificial intelligence-based detection of cancer survivors' depression: scoping meta-review. JMIR Ment Health. 2021; 8 (12): e30439. https://doi.org/10.2196/30439.
31. Kang Y., Kim Y.J., Park S., et al. Development and operation of a digital platform for sharing pathology image data. BMC Med Inform Decis Mak. 2021; 21 (1): 114. https://doi.org/10.1186/s12911-021-01466-1.
32. Li J., Tian Y., Li R., et al. Improving prediction for medical institution with limited patient data: leveraging hospital-specific data based on multicenter collaborative research network. Artif Intell Med. 2021; 113: 102024. https://doi.org/10.1016/j.artmed.2021.102024.
Об авторах
Д. И. КорабельниковРоссия
Корабельников Даниил Иванович, к.м.н., доцент
2-я Брестская ул., д. 5, Москва 123056
А. И. Ламоткин
Россия
Ламоткин Андрей Игоревич
2-я Брестская ул., д. 5, Москва 123056
ул. Добролюбова, д. 11, Москва 127254
Что уже известно об этой теме?
► Искусственный интеллект (ИИ) активно применяется в онкологии для анализа медицинских изображений, диагностики, персонализированной терапии и прогнозирования исходов
► ИИ-технологии, такие как IBM Watson for Oncology и Google DeepMind, уже доказали свою эффективность в поддержке принятия клинических решений
► ИИ позволяет анализировать большие объемы клинических данных, выявлять закономерности и улучшать принятие клинических решений
Что нового дает статья?
► Проведен анализ зарубежного опыта применения и интеграции ИИ в онкологической практике с 2000 по 2025 гг.
► Рассмотрены современные ИИ-технологии, а также динамика роста числа публикаций и развития моделей ИИ, указывающая на перспективы создания «умных» больниц и улучшения обмена данными
► Выявлены инновационные особенности, такие как интеграция с носимыми устройствами, мультимодальный анализ (изображения + геномика) и автоматизация консилиумов, а также определены потенциальные вызовы, включая предвзятость данных, конфиденциальность и регуляторные барьеры
Как это может повлиять на клиническую практику в обозримом будущем?
► ИИ позволит сократить время диагностики и повысить точность выявления опухолей, особенно на ранних стадиях
► Персонализированные подходы к лечению, основанные на ИИ, улучшат клинические результаты и снизят частоту побочных эффектов
► Внедрение ИИ в клиническую практику повысит эффективность работы врачей и снизит нагрузку на медицинский персонал
Рецензия
Для цитирования:
Корабельников Д.И., Ламоткин А.И. Искусственный интеллект в онкологии: мировой опыт использования и перспективы развития. ФАРМАКОЭКОНОМИКА. Современная фармакоэкономика и фармакоэпидемиология. 2025;18(3):437-447. https://doi.org/10.17749/2070-4909/farmakoekonomika.2025.302
For citation:
Korabelnikov D.I., Lamotkin A.I. Artificial intelligence in oncology: global experience and future prospects. FARMAKOEKONOMIKA. Modern Pharmacoeconomics and Pharmacoepidemiology. 2025;18(3):437-447. (In Russ.) https://doi.org/10.17749/2070-4909/farmakoekonomika.2025.302
JATS XML

Контент доступен под лицензией Creative Commons Attribution-NonCommercial-ShareAlike 4.0 International License.






































