Перейти к:
Обновленный фармакоэкономический анализ эффективности применения препарата атезолизумаб в сравнении с другими ингибиторами PD-1 у пациентов с распространенным немелкоклеточным раком легкого после предшествующей химиотерапии
https://doi.org/10.17749/2070-4909/farmakoekonomika.2023.211
Аннотация
Цель: оценить фармакоэкономическую эффективность применения препарата атезолизумаб (ингибитор лиганда рецептора программируемой клеточной гибели 1 (англ. рrogrammed death ligand 1, PD-L1)) в сравнении с другими ингибиторами контрольных точек (ингибиторы белка программируемой клеточной гибели 1 (англ. рrogrammed cell death protein 1, PD-1)) у пациентов с распространенным немелкоклеточным раком легкого (НМРЛ) после предшествующей химиотерапии в актуальных условиях системы здравоохранения России.
Материал и методы. Дизайн исследования – ретроспективный анализ литературных данных и моделирование. Проведено обновление выполненного ранее фармакоэкономического исследования с учетом снижения стоимости препарата пембролизумаб после выхода на рынок дженерической формы и актуализации расчета целевой популяции. Выполнен анализ минимизации затрат, оценено влияние на бюджет системы здравоохранения при лечении всех пациентов с НМРЛ, обеспечиваемых ингибиторами PD-1/PD-L1 во второй и третьей линиях терапии, препаратом атезолизумаб. Для расчетов использовали зарегистрированные цены согласно государственному реестру предельных отпускных цен, средневзвешенную предельную оптовую надбавку – по данным Федеральной антимонопольной службы.
Результаты. В анализе минимизации затрат атезолизумаб показывает бо́льшую клинико-экономическую эффективность – его применение позволяет снизить затраты на 28,6% за 3 года в сравнении с ниволумабом и на 8,8% в сравнении с пембролизумабом во второй и третьей линиях терапии НМРЛ. Анализ влияния на бюджет продемонстрировал, что если бы все пациенты целевой группы, в настоящее время получающие различные ингибиторы PD-1/PD-L1 во второй и третьей линиях терапии НМРЛ, изначально были обеспечены препаратом атезолизумаб, то это позволило бы снизить нагрузку на бюджет за 3 года на 11,6%, или на 722,4 млн руб.
Заключение. Применение атезолизумаба является фармакоэкономически обоснованным и целесообразным по сравнению с использованием ниволумаба и пембролизумаба даже после выхода дженерика последнего и позволит снизить расходы на ингибиторы PD-1/PD-L1 во второй и третьей линиях терапии НМРЛ.
Ключевые слова
Для цитирования:
Зырянов С.К., Дьяков И.Н. Обновленный фармакоэкономический анализ эффективности применения препарата атезолизумаб в сравнении с другими ингибиторами PD-1 у пациентов с распространенным немелкоклеточным раком легкого после предшествующей химиотерапии. ФАРМАКОЭКОНОМИКА. Современная фармакоэкономика и фармакоэпидемиология. 2023;16(3):422-430. https://doi.org/10.17749/2070-4909/farmakoekonomika.2023.211
For citation:
Zyryanov S.K., Dyakov I.N. Updated pharmacoeconomic analysis of atesolizumab efficiency compared with other PD-1 inhibitors in patients with advanced non-small cell lung cancer after chemotherapy. FARMAKOEKONOMIKA. Modern Pharmacoeconomics and Pharmacoepidemiology. 2023;16(3):422-430. (In Russ.) https://doi.org/10.17749/2070-4909/farmakoekonomika.2023.211
ВВЕДЕНИЕ / INTRODUCTION
Рак легкого – острейшая проблема современной онкологии. По заболеваемости он занимает 1-е место среди других злокачественных опухолей у мужчин в России, а по смертности – 1-е место среди мужчин и женщин как в России, так и в мире. В 2022 г. в нашей стране 44 981 пациент был взят на учет с диагнозом онкологического заболевания трахеи, бронхов и легкого [1]. Из них больные немелкоклеточным раком легкого (НМРЛ) составляют 85%. Частота выявления этой группы онкологических заболеваний на поздних стадиях онкологического процесса (III–IV) достаточно высока и достигает суммарно 69,8%. Неплоскоклеточный рак составляет 45%, из них мутация киназы анапластической лимфомы (англ. anaplastic lymphoma kinase, ALK) выявляется у 5% пациентов, а мутация рецептора эпидермального фактора роста (англ. epidermal growth factor receptor, EGFR) – у 17,5%. Показатель ECOG 0–1 (отсутствие способности к выполнению тяжелого физического труда) по шкале Восточной кооперативной онкологической группы (англ. Eastern Cooperative Oncology Group, ECOG) характерен в 74% случаев [1].
Основной целью лечения онкологического заболевания является увеличение продолжительности жизни пациента – общей выживаемости (англ. оverall survival, OS). Второстепенная цель терапии – повышение продолжительности жизни пациента без прогрессии заболевания (англ. рrogression-free survival, PFS). Режимы химиотерапии при НМРЛ зависят от стадии опухолевого процесса и линии терапии. Распространенная форма относится к терминальным стадиям заболевания. Согласно клиническим рекомендациям Минздрава Росии [2] в первой линии терапии таких больных применяют двухкомпонентные химиотерапевтические режимы на основе производных платины в комбинации с этопозидом, винорелбином, гемцитабином, таксанами и пеметрекседом, которые могут увеличивать продолжительность жизни, улучшать ее качество и эффективно контролировать симптомы заболевания.
При прогрессировании заболевания на фоне первой линии терапии показана вторая линия химиотерапии. Ее применение может уменьшать выраженность симптомов рака легкого и увеличивать продолжительность жизни отдельных больных. Оценку эффекта лечения выполняют каждые 6–8 нед (предпочтительный метод – компьютерная томография). Пациентам в общем удовлетворительном состоянии (ECOG 0–1) с НМРЛ без активирующих мутаций возможно назначение доцетаксела, а ослабленным больным (ECOG 2) – монотерапии пеметрекседом, гемцитабином или винорелбином до клинического прогрессирования, если эти препараты не использовались в первой линии. Предпочтительным является назначение ингибиторов контрольных точек иммунитета анти-PD-1/PD-L11 – моноклональных антител ниволумаб, пембролизумаб или атезолизумаб. Пембролизумаб назначают пациентам с плоскоклеточным и неплоскоклеточным НМРЛ с экспрессией PD-L1 в ≥1% опухолевых клеток [3]. Ниволумаб и атезолизумаб применяют у больных плоскоклеточным и неплоскоклеточным НМРЛ, при их назначении во второй и третьей линиях терапии исследования экспрессии PD-L1 не требуется [4, 5].
Таким образом, в настоящее время из ингибиторов PD-1/PD-L1, используемых для иммунотерапии НМРЛ, рекомендовано три препарата: ниволумаб, пембролизумаб и атезолизумаб. Все они входят в перечень жизненно необходимых и важнейших препаратов, и их применение может обеспечиваться за счет бюджетных средств. Учитывая ограниченность финансирования системы здравоохранения, при выборе препарата большое значение имеет не только его эффективность, но и стоимость терапии при его использовании. Ранее мы проводили сравнение фармакоэкономической эффективности ингибиторов PD-1/PD-L1 и их влияния на бюджет системы здравоохранения России, показав, что при сопоставимой эффективности наименьшие затраты отмечены при применении препарата атезолизумаб [6]. На момент выполнения анализа все три варианта терапии были представлены оригинальными лекарственными средствами.
В мае 2023 г. зарегистрирована цена на дженерический пембролизумаб, которая оказалась на 25% ниже, чем у оригинального препарата (по состоянию на 24 августа 2023 г.). Кроме того, на момент проведения предыдущего исследования препарат атезолизумаб только вышел на российский рынок и занимал минимальные объемы в текущей практике. В настоящее время распределение между препаратами анти-PD1 существенно отличается от рассчитанного на основе данных продаж значения, представленного в предыдущие годы. Доля атезолизумаба существенно возросла. Таким образом, в связи с изменением экономических условий представляется актуальным обновить проведенный анализ с учетом выхода дженерического пембролизумаба и изменений в распределении пациентов по препаратам ингибиторов контрольных точек в текущей практике.
Цель – оценить фармакоэкономическую эффективность применения препарата атезолизумаб (ингибитор PD-L1) в сравнении с другими ингибиторами контрольных точек (ингибиторы PD-1) у пациентов с НМРЛ после предшествующей химиотерапии в актуальных условиях системы здравоохранения России.
МАТЕРИАЛ И МЕТОДЫ / MATERIAL AND METHODS
Препараты сравнения / Comparators
Пембролизумаб представляет собой гуманизированное моноклональное антитело, селективно блокирующее взаимодействие между рецептором PD-1 и его лигандами (PD-L1 и PD-L2),
и выпускается в форме концентрата для приготовления раствора для инфузии [3].
Препарат ниволумаб – это человеческое моноклональное антитело, которое блокирует взаимодействие между рецептором PD-1 и его лигандами (PD-L1 и PD-L2) и выпускается в форме концентрата для приготовления раствора для внутривенной инфузии [4].
Атезолизумаб представляет собой гуманизированное моноклональное антитело иммуноглобулина G1 с видоизмененным Fc-фрагментом, которое непосредственно связывается с PD-L1 и блокирует его взаимодействие с рецепторами PD-1 и В7-1. Атезолизумаб не затрагивает взаимодействие рецептора PD-1 с лигандом PD-L2 [5].
Режимы терапии / Therapy regimens
Режимы терапии сравниваемыми препаратами приведены в таблице 1. Атезолизумаб применяется в фиксированной дозировке независимо от массы тела больного. Расчет проводили для пациента с массой тела 70 кг и площадью поверхности тела 1,97 м2. Согласно инструкциям по применению пембролизумаба и ниволумаба [3, 4] неиспользованный остаток препарата во флаконе выбрасывается. В связи с этим при оценке количества препарата на 1 введение учитывали число расходуемых флаконов.
Введение перечисленных препаратов проводят в течение 30–60 мин под контролем врача, поэтому на момент инфузии пациентам требуется наблюдение со стороны медицинского персонала.
Описание и допущения модели / Model description and assumptions
Анализ проводили в соответствии с моделью Маркова, представленной на рисунке 1. Модель учитывает переходы между тремя состояниями:
– вторая/третья линии терапии распространенного НМРЛ – пациенты получают сравниваемые режимы терапии (атезолизумаб, пембролизумаб, ниволумаб) до момента прогрессии (компоненты затрат включают лекарственные затраты на сравниваемые режимы терапии и затраты на введение препаратов);
– прогрессия – пациенты, у которых наступила прогрессия на терапии анти-PD-1 препаратами во второй/третьей линии, переводятся на доцетаксел и получают его в соответствии с указанным режимом терапии (затраты включают стоимость терапии доцетакселом и затраты на введение);
– смерть – состояние, учитывающее летальные исходы, переход в него означает выход из анализа (затраты, ассоциированные с летальным исходом, не учитываются).
Продолжительность марковского цикла составила 4 нед. Вероятность пребывания пациента в одном из состояний модели в каждом цикле рассчитывали с использованием экспоненциальной функции, как описано ранее [6]. Сравниваемые препараты сопоставимы по эффективности. В то же время отношение угроз (англ. hazard ratio, HR) как для OS, так и для PFS отлично от 1, что учитывалось при расчете этих показателей для препаратов в рамках модели.
Анализ эффективности / Effectiveness analysis
Данная статья является обновлением опубликованного ранее исследования. Поскольку методика сравнения клинической эффективности препаратов не изменилась, с ее подробным описанием можно ознакомиться в исходном варианте [6]. Использовали данные сетевого метаанализа P. Créquit et al. (2017 г.) [7].
Сопоставление эффективности препаратов проводили по первичным и вторичным конечным точкам: PFS и OS. Согласно результатам сравнения эффективность атезолизумаба по обоим показателям сопоставима с эффективностью ниволумаба и пембролизумаба. Исходя из этого, в клинико-экономическом анализе использовали метод минимизации затрат.
Расчет затрат / Cost calculation
Учитывали только прямые медицинские затраты на применение сравниваемых режимов терапии, в т.ч. затраты на ингибиторы контрольных точек, химиотерапию (препарат доцетаксел), на которую пациентов переводят при прогрессии, и прямые затраты на пребывание больного в дневном стационаре для введения препаратов.
В качестве базовых показателей в расчетах использовали значения медиан PFS и OS при лечении пациентов с НМРЛ с применением атезолизумаба, полученные в исследовании A. Rittmeyer et al. (2017 г.) [8], – 13,8 и 2,8 мес соответственно. При этом общая выживаемость через 12 мес составила 55%. Поскольку HR не равно 1, проводили коррекцию значений показателей эффективности PFS и OS для ниволумаба и пембролизумаба относительно указанных значений для атезолизумаба. Для этого вероятность выживаемости при применении атезолизумаба умножали на значение HR в сравнении с атезолизумабом. Методика расчета прогрессии для препарата атезолизумаб и скорректированных значений PFS и OS для препаратов ниволумаб и пембролизумаб с указанием формул была подробно описана ранее [6].
При проведении клинико-экономического анализа учитывали следующие прямые медицинские затраты:
– прямые лекарственные затраты на терапию пациентов с использованием сравниваемых препаратов (стоимость лекарственных средств);
– прямые медицинские затраты на введение препаратов.
Стоимость «внутривенного введения лекарственных средств: инфузии (капельницы)» согласно прейскуранту платных услуг ФГБУ «Национальный медицинский исследовательский центр онкологии им. Н.Н. Блохина» Минздрава России составляет 3600,00 руб. [9]. Это значение использовалось для расчета затрат на введение препаратов.
При расчетах затрат на лекарственную терапию использовали зарегистрированные цены на лекарственные средства с учетом 10% налога на добавленную стоимость и средней оптовой надбавки 11,98%.
Стоимость анализируемых препаратов представлена в таблице 2. Для препаратов атезолизумаб, ниволумаб и пембролизумаб указана цена за упаковку. Для доцетаксела существует много дженерических препаратов, выпускаемых в разных дозировках, в связи с чем высчитывалась стоимость 1 мг вещества для каждой из зарегистрированных упаковок и в расчетах использовалась медиана полученных значений (согласно требованиям постановления Правительства Российской Федерации от 28 августа 2014 г. № 871 в актуальной редакции на момент проведения анализа) [10].
Стоимость терапии для атезолизумаба и пембролизумаба рассчитывали на 3-недельный курс, для ниволумаба – на 2-недельный (1 введение), определяли среднюю стоимость 1-недельного цикла и пересчитывали на 4-недельный марковский цикл. Затраты на тестирование на PD-L1-статус не учитывали.
Затраты на 1 марковский цикл рассчитывали, умножая долю пациентов, пребывающих в состоянии «Выживание без прогрессии», на средние затраты на терапию за 1 марковский цикл с учетом дисконтирования 5% в год. Дисконтирование рассчитывали с шагом в 1 марковский цикл (4 нед). Средневзвешенные затраты за год определяли, суммируя затраты за входящие в него марковские циклы.
Анализ минимизации затрат / Cost minimization analysis
Расчет показателя минимизации затрат (англ. сost minimization ratio, CMR) на лекарственную терапию пациентов при замене пембролизумаба или ниволумаба на атезолизумаб проводили по формуле:
CMR = DC2 – DC1,
где DC2 – прямые затраты на рассматриваемый режим терапии (атезолизумаб), DC1 – прямые затраты на режим терапии сравнения (ниволумаб или пембролизумаб).
Полученная разность представляла собой разницу в затратах на лекарственное лечение пациентов с использованием атезолизумаба и препарата сравнения и показывала объем сэкономленных средств при использовании атезолизумаба вместо препарата сравнения.
Анализ влияния на бюджет / Budget impact analysis
В анализе влияния на бюджет при определении размера целевой популяции применяли методику, отличную от использованной в опубликованной ранее статье [6]. В обновленном анализе учитывали пациентов, впервые поставленных на учет с НМРЛ III–IV стадий без мутаций ALK и EGFR, с общим состоянием не хуже ECOG 0–1. Частота встречаемости перечисленных состояний указана выше (во введении).
В первой линии иммунотерапию не получают 65% пациентов, причем до применения терапии второй линии из них доживают около 61%. При проведении анализа было сделано допущение (основанное на результатах опроса врачей-онкологов), что из пациентов, не получивших ингибиторы контрольных точек в первой линии и доживших до применения второй линии терапии, только 35% получат препараты этой группы. Из них атезолизумаб получат 13%, ниволумаб и пембролизумаб – по 11%. Указанное распределение было принято за текущую терапевтическую практику. В качестве терапевтической практики рассматривали вариант с обеспечением всех пациентов целевой популяции препаратом атезолизумаб.
Горизонт исследования для анализа минимизации затрат и анализа влияния на бюджет был одинаковым и составил 3 года.
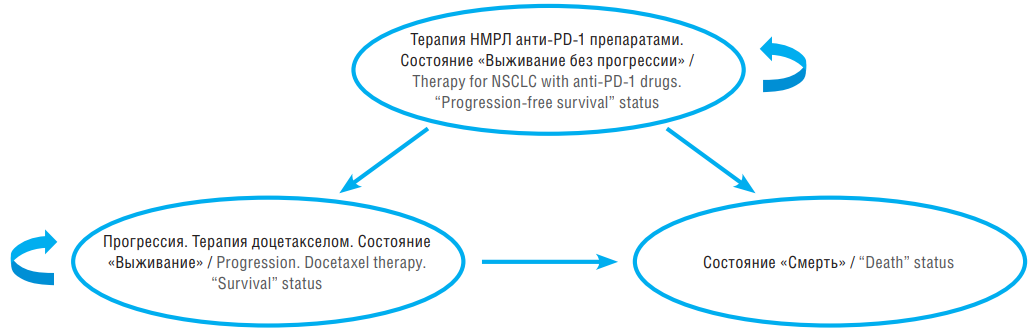
Рисунок 1. Модель Маркова для оценки эффективности второй и третьей линий терапии немелкоклеточного рака легкого (НМРЛ) ингибиторами белка программируемой клеточной гибели 1 (англ. рrogrammed cell death protein 1, PD-1)
Figure 1. Markov model to assess the efficiency of second and third line non-small cell lung cancer (NSCLC) therapy with inhibitors of рrogrammed cell death protein 1 (PD-1)
Таблица 1. Режимы терапии сравниваемыми препаратами для лечения немелкоклеточного рака легкого во второй и третьей линиях
Table 1. Therapy regimens with comparators for second and third line treatment of non-small cell lung cancer
|
МНН / INN |
Режим применения / Regimen |
Число флаконов на 1 введение / |
|
Атезолизумаб / Atezolizumab |
1200 мг каждые 3 нед / 1200 mg every 3 weeks |
1 флакон 1200 мг / 1 vial 1200 mg |
|
Ниволумаб / Nivolumab |
3 мг/кг массы тела каждые 2 нед // |
2 флакона по 100 мг, 1 флакон 40 мг / |
|
Пембролизумаб / Pembrolizumab |
2 мг/кг массы тела каждые 3 нед // |
2 флакона по 100 мг / 2 vials 100 mg each |
|
Доцетаксел / Docetaxel |
75 мг/м2 площади поверхности тела каждые 3 нед / |
– |
Примечание. МНН – межждународное непатентованное наименование.
Note. INN – international nonproprietary name
Таблица 2. Стоимость анализируемых препаратов
Table 2. Cost of analyzed drugs
|
МНН (ТН) / INN (TN) |
Лекарственная форма, упаковка / |
Зарегистрированная цена упаковки, руб. / Registered package price, rub. |
Стоимость упаковки*, руб. / Cost of package*, rub. |
|
Атезолизумаб (Тецентрик®) / Atezolizumab (Tecentriq®) |
Концентрат для приготовления раствора для инфузий, 1200 мг / Concentrate for preparation of solution for infusion, 1200 mg |
215 930,09 |
265 978,37 |
|
Ниволумаб (Опдиво®) / |
Концентрат для приготовления раствора для инфузий, 100 мг / Concentrate for preparation of solution for infusion, 100 mg |
78 988,51 |
97 296,47 |
|
Концентрат для приготовления раствора для инфузий, 40 мг / Concentrate for preparation of solution for infusion, 40 mg |
31 595,11 |
38 918,22 |
|
|
Пембролизумаб (Пемброриа®) / Pembrolizumab (Pembroria®) |
Концентрат для приготовления раствора для инфузий, 100 мг / Concentrate for preparation of solution for infusion, 100 mg |
116 233,10 |
143 173,61 |
|
Доцетаксел / Docetaxel |
Концентрат для приготовления раствора для инфузий / Concentrate for preparation of solution for infusion |
124,15** |
152,93** |
Примечание. МНН – международное непатентованное наименование. * С налогом на добавленную стоимость 10% и средней торговой надбавкой 11,98%. ** Стоимость 1 мг вещества (медианное значение среди зарегистрированных цен).
Note. INN – international nonproprietary name; TN – trade name. * With value added tax of 10% and average trade markup of 11.98%. ** Cost of 1 mg of substance (median value among registered prices).
РЕЗУЛЬТАТЫ / RESULTS
Анализ эффективности / Effectiveness analysis
Исходные значения медиан PFS и OS для препарата атезолизумаб, использованные для расчета значений при моделировании, составили 2,8 и 13,8 мес соответственно, выживаемость через 12 мес составила 55%. Рассчитанные значения PFS и OS для сравниваемых препаратов, скорректированные с учетом HR, приведены в таблице 3.
Расчет затрат / Cost calculation
В таблице 4 представлен расчет затрат на 1 марковский цикл (4 нед) при использовании сравниваемых режимов терапии. В таблице 5 показаны средневзвешенные затраты на 1 пациента по годам и суммарно за 3 года.
Анализ минимизации затрат / Cost minimization analysis
Как видно из приведенных данных, суммарные затраты на лечение пациентов атезолизумабом ниже таковых при применении ниволумаба и пембролизумаба. В таблице 6 приведены результаты расчета показателя CMR при применении сравниваемых режимов терапии. Полученные данные свидетельствуют о большей клинико-экономической эффективности препарата атезолизумаб в сравнении с ниволумабом и пембролизумабом во второй и третьей линиях терапии распространенного НМРЛ.
Анализ влияния на бюджет / Budget impact analysis
В рамках анализа влияния на бюджет определяли размер целевой популяции пациентов. В 2022 г. 44 981 человек впервые взят на учет с диагнозом рака трахеи, бронхов, легких. Из них НМРЛ диагностирован у 85% (38 234 человека). Среди впервые выявленных случаев III–IV стадии составляют 69,8% (26 688 пациентов). За вычетом случаев с мутациями ALK и EGFR число таких больных составит 23 985. Состояние ECOG 0–1 характерно для 74% (17 749 человек). Из них 65% (11 537) не получат иммунобиологические препараты в первой линии. До назначения второй линии, как отмечено выше, доживает 61% – в проводимом анализе расчетное значение 7038 человек.
Учитывая приведенное выше распределение пациентов по ингибиторам контрольных точек, можно ожидать, что атезолизумаб в текущей терапевтической практике будут получать 915 больных, а ниволумаб и пембролизумаб – по 774 пациента. Суммарно размер целевой популяции составит 2463 человек. Как уже было указано, в качестве терапевтической практики учитывали вариант, при котором все пациенты будут получать атезолизумаб – соответственно, соотношение атезолизумаб/пембролизумаб/ниволумаб составит 2463/0/0.
Результаты анализа влияния на бюджет приведены в таблицах 7, 8. Анализ представлен в рамках 3-летнего горизонта с указанием результатов по годам. Дисконтирование в анализе не учитывали. В таблице 9 указано изменение нагрузки на бюджет при гипотетическом применении у всех пациентов атезолизумаба вместо ниволумаба и пембролизумаба.
Таблица 3. Скорректированные значения показателей эффективности терапии через 12 мес, ٪
Table 3. Adjusted values of therapy efficiency indicators after 12 months, ٪
|
МНН / INN |
Выживаемость без прогрессии / Progression-free survival |
Общая выживаемость / Overall survival |
|
Атезолизумаб / Atezolizumab |
5,18* |
55,00 |
|
Ниволумаб / Nivolumab |
6,27* |
58,30* |
|
Пембролизумаб / Pembrolizumab |
5,54* |
56,65* |
Примечание. МНН – международное непатентованное наименование. * Расчет авторов.
Note. INN – international nonproprietary name. * Authors’ calculation.
Таблица 4. Затраты на 1 марковский цикл в проводимом анализе
Table 4. Costs per 1 Markov cycle in the current analysis
|
МНН / INN |
Лекарственные затраты, руб. / |
Затраты на дневной стационар, руб. / |
Суммарные |
Доля лекарственных затрат, % / |
|
Атезолизумаб / Atezolizumab |
354 637,83 |
4800,00 |
359 437,83 |
98,66 |
|
Ниволумаб / Nivolumab |
467 022,32 |
7200,00 |
474 222,32 |
98,48 |
|
Пембролизумаб / Pembrolizumab |
381 796,29 |
4800,00 |
386 596,29 |
98,76 |
|
Доцетаксел / Docetaxel |
30 127,21 |
4800,00 |
34 927,21 |
86,26 |
Примечание. МНН – международное непатентованное наименование.
Note. INN – international nonproprietary name.
Таблица 5. Средневзвешенные затраты на терапию 1 пациента по годам для сравниваемых режимов терапии, руб.
Table 5. Average weighted costs for therapy of 1 patient by years for the compared therapy regimens, rub.
|
Период / Period |
Атезолизумаб / Atezolizumab |
Ниволумаб / Nivolumab |
Пембролизумаб / Pembrolizumab |
|
1 год / 1 year |
1 631 535 |
2 287 652 |
1 808 329 |
|
2 года / 2 years |
80 481 |
136 544 |
95 446 |
|
3 года / 3 years |
3970 |
8150 |
5038 |
|
Суммарно за 3 года / Total for 3 years |
1 715 986 |
2 432 346 |
1 908 813 |
Таблица 6. Минимизация затрат при сравнении терапии атезолизумабом с применением ниволумаба и пембролизумаба
Table 6. Costs minimization when comparing atezolizumab therapy with nivolumab and pembrolizumab
|
Период / Period |
CMR, руб. (%) / CMR, rub. (%) |
|
|
Атезолизумаб – ниволумаб / |
Атезолизумаб – пембролизумаб / Atezolizumab – pembrolizumab |
|
|
1 год / 1 year |
–634 035 (–27,7) |
–154 712 (–8,6) |
|
2 года / 2 years |
–54 974 (–40,3) |
–13 876 (–14,5) |
|
3 года / 3 years |
–4126 (–50,6) |
–1014 (–20,1) |
|
Суммарно за 3 года / Total for 3 years |
–693 135 (–28,5) |
–169 602 (–8,9) |
Примечание. CMR (англ. сost minimization ratio) – показатель минимизации затрат.
Note. CMR – сost minimization ratio.
Таблица 7. Анализ влияния на бюджет при текущей терапевтической практике лечения немелкоклеточного рака легких во второй и третьей линиях терапии, руб.
Table 7. Budget impact analysis for the current therapeutic practice of non-small cell lung cancer treatment in the second and third lines of therapy, rub.
|
Период / Period |
Атезолизумаб / Atezolizumab (n=915) |
Ниволумаб / Nivolumab (n=774) |
Пембролизумаб / Pembrolizumab (n=774) |
Всего / Total (n=2463) |
|
1 год / 1 year |
1709,50 |
1944,00 |
1566,50 |
5220,00 |
|
2 года / 2 years |
247,30 |
263,50 |
231,20 |
742,00 |
|
3 года / 3 years |
97,60 |
97,60 |
95,20 |
290,30 |
|
Суммарно за 3 года / Total for 3 years |
2054,40 |
2305,20 |
1892,80 |
6252,40 |
Таблица 8. Анализ влияния на бюджет при текущем и предполагаемом сценариях лечения немелкоклеточного рака легких во второй и третьей линиях терапии, руб.
Table 8. Budget impact analysis for current and assumed scenarios of treatment of non-small cell lung cancer in the second and third lines of therapy, rub.
|
Период / Period |
Атезолизумаб / Atezolizumab (n=2463) |
Ниволумаб / Nivolumab (n=0) |
Пембролизумаб / Pembrolizumab (n=0) |
Всего / Total (n=2463) |
|
1 год / 1 year |
4 601,70 |
0,00 |
0,00 |
4 601,70 |
|
2 года / 2 years |
665,70 |
0,00 |
0,00 |
665,70 |
|
3 года / 3 years |
262,60 |
0,00 |
0,00 |
262,60 |
|
Суммарно за 3 года / Total for 3 years |
5 530,00 |
0,00 |
0,00 |
5 530,00 |
Таблица 9. Изменение нагрузки на бюджет при гипотетическом применении у всех пациентов атезолизумаба вместо ниволумаба и пембролизумаба, млн руб. (٪)
Table 9. Change in budget load in the hypothetical use of atezolizumab instead of nivolumab and pembrolizumab in all patients, mln rub. (٪)
|
Период / Period |
Изменение нагрузки на бюджет / Change in budget load |
|
1 год / 1 year |
–618,3 (–11,85) |
|
2 года / 2 years |
–76,3 (–10,29) |
|
3 года / 3 years |
–27,7 (–9,54) |
|
Суммарно за 3 года / Total for 3 years |
–722,4 (–11,55) |
ОБСУЖДЕНИЕ / DISCISSION
Режимы химиотерапии при НМРЛ зависят от стадии опухолевого процесса и линии терапии. При прогрессировании заболевания на фоне первой линии показана вторая линия системной терапии, благодаря которой возможны уменьшение выраженности симптомов заболевания и увеличение продолжительности жизни отдельных пациентов. Оценку эффекта лечения проводят каждые 6–8 нед, обычно методом компьютерной томографии. Предпочтительным является назначение ингибиторов контрольных точек иммунитета анти-PD-1/PD-L1 – моноклональных антител ниволумаб, пембролизумаб или атезолизумаб (в том случае, если иммунотерапия не была использована в первой линии лечения).
Одной из причин проведения обновленного анализа был выход на рынок дженерического пембролизумаба с заведомо более низкой ценой, что снижало стоимость терапии этим препаратом. В опубликованной ранее работе [6] при минимизации затрат применение атезолизумаба вместо пембролизумаба позволяло снизить затраты на 31,3%, а вместо ниволумаба – на 28,6%. Проведенный в данной работе анализ минимизации затрат показал, что суммарные затраты на лечение пациентов во второй и третьей линиях терапии препаратом атезолизумаб остаются ниже затрат на применение ниволумаба и пембролизумаба даже после снижения стоимости последнего на 25%. Так, назначение атезолизумаба во второй и третьей линиях терапии НМРЛ позволит за 3 года сократить средневзвешенные затраты из расчета на 1 пациента в сравнении с применением ниволумаба на 24,6%, а в сравнении с использованием пембролизумаба – на 8,2%. Таким образом, несмотря на выход дженерика пембролизумаба и снижение цены на этот препарат на 25%, атезолизумаб остается наименее затратным препаратом из сравниваемых ингибиторов контрольных точек.
Как уже отмечалось выше при описании методик, при обновлении анализа использовали совершенно другой подход к оценке размера целевой популяции. Если ранее размер популяции рассчитывали исходя из объема закупленных препаратов, деля его на средневзвешенную потребность в препарате за год, то при обновлении было учтено, что атезолизумаб применяется у сопоставимого числа пациентов в сравнении с другими ингибиторами. Поэтому размер целевой популяции вычисляли исходя из ожидаемого числа пациентов, которым показано назначение ингибиторов PD-1/PD-L1. Согласно проведенным расчетам потенциальный размер целевой популяции впервые выявленных пациентов составляет 2463 человека. При этом больные распределяются по сравниваемым препаратам примерно поровну, с небольшим преобладанием атезолизумаба (915 пациентов против 774 для ниволумаба и пембролизумаба).
Поскольку при достоверно не различающейся эффективности сравниваемых препаратов применение атезолизумаба остается наименее затратным, увеличение охвата пациентов целевой популяции этим препаратом приведет к снижению нагрузки на бюджет. Максимальная выгода может быть получена при полной замене препаратов ниволумаб и пембролизумаб на атезолизумаб. В 1-й год снижение нагрузки на бюджет составит 11,9% (618,3 млн руб.), во 2-й год – 10,3% (76,3 млн руб.), в 3-й год – 9,6% (27,7 млн руб.). Суммарно за 3 года снижение нагрузки на бюджет составит 11,6% (722,4 млн руб.).
ЗАКЛЮЧЕНИЕ / CONCLUSION
Исходя из полученных данных можно заключить, что применение препарата атезолизумаб вместо ниволумаба и пембролизумаба в современных условиях российской системы здравоохранения является фармакоэкономически обоснованным и целесообразным и позволит снизить расходы на лекарственную терапию ингибиторами контрольных точек во второй и третьей линиях терапии НМРЛ.
1. PD-1 (англ рrogrammed cell death protein 1) – белок программируемой клеточной гибели 1; PD-L1 (англ. рrogrammed death ligand 1) – лиганд рецептора программируемой клеточной гибели 1.
Список литературы
1. Каприн А.Д., Старинский В.В., Шахзадова А.О. (ред.) Состояние онкологической помощи населению России в 2022 году. М.: МНИОИ им. П.А. Герцена – филиал ФГБУ «НМИЦ радиологии» Минздрава России; 2022: 239 с.
2. Злокачественное новообразование бронхов и легкого. Клинические рекомендации. 2022. URL: https://cr.minzdrav.gov.ru/recomend/30_4 (дата обращения 03.09.2023).
3. Инструкция по медицинскому применению лекарственного препарата Китруда®. URL: http://grls.rosminzdrav.ru/Grls_View_v2.aspx?routingGuid=88450c76-24e5-43ee-bbd3-afd10dc1e7c8&t= (дата обращения 03.09.2023).
4. Инструкция по медицинскому применению лекарственного препарата Опдиво® URL: http://grls.rosminzdrav.ru/Grls_View_v2.aspx?routingGuid=f6ac1a6a-9f33-4eaa-a603-b2928d720378&t= (дата обращения 03.09.2023).
5. Инструкция по медицинскому применению лекарственного препарата Тецентрик®. URL: https://grls.rosminzdrav.ru/Grls_View_v2.aspx?routingGuid=c210e8ba-5f80-4dc6-90bc-98e51fb468ed&t= (дата обращения 03.09.2023).
6. Зырянов С.К., Дьяков И.Н. Фармакоэкономическая эффективность применения препарата атезолизумаб в сравнении с другими ингибиторами PD-1 у пациентов с распространенным немелкоклеточным раком легкого после предшествующей химиотерапии. ФАРМАКОЭКОНОМИКА. Современная фармакоэкономика и фармакоэпидемиология. 2020; 13 (1): 5–12. https://doi.org/10.17749/20704909.2020.13.1.5-12.
7. Créquit P., Chaimani A., Yavchitz A., et al. Comparative efficacy and safety of second-line treatments for advanced non-small cell lung cancer with wild-type or unknown status for epidermal growth factor receptor: a systematic review and network meta-analysis. BMC Med. 2017; 15 (1): 193. https://doi.org/10.1186/s12916-017-0954-x.
8. Rittmeyer A., Barlesi F., Waterkamp D., et al. Atezolizumab versus docetaxel in patients with previously treated non-small-cell lung cancer (OAK): a phase 3, open-label, multicentre randomised controlled trial. Lancet. 2017; 389 (10066): 255–65. https://doi.org/10.1016/S01406736(16)32517-X.
9. НМИЦ oнкологии им. Н.Н. Блохина. Прейскурант. URL: https://www.ronc.ru/platnye-uslugi/prays-list-uslug/ (дата обращения 03.09.2023).
10. Постановление Правительства РФ от 28.08.2014 № 871 «Об утверждении Правил формирования перечней лекарственных препаратов для медицинского применения и минимального ассортимента лекарственных препаратов, необходимых для оказания медицинской помощи». URL: https://base.garant.ru/70728348/ (дата обращения 03.09.2023).
Об авторах
С. К. ЗыряновРоссия
д.м.н., профессор, заведующий кафедрой общей и клинической фармакологии ФГАОУ ВО «Российский университет дружбы народов»
ул. Миклухо-Маклая, д. 10, корп. 3, Москва 117198
И. Н. Дьяков
Россия
к.б.н., ведущий научный сотрудник, заведующий лабораторией биосинтеза иммуноглобулинов ФГБНУ «Научно-исследовательский институт вакцин и сывороток им. И.И. Мечникова», генеральный директор АНО «Научно-практический центр исследования проблем рациональной фармакотерапии и фармакоэкономики»
Малый Казенный пер., д. 5А, Москва 105064
ул. Авиамоторная, д. 50, стр. 2, Москва 111024
Рецензия
Для цитирования:
Зырянов С.К., Дьяков И.Н. Обновленный фармакоэкономический анализ эффективности применения препарата атезолизумаб в сравнении с другими ингибиторами PD-1 у пациентов с распространенным немелкоклеточным раком легкого после предшествующей химиотерапии. ФАРМАКОЭКОНОМИКА. Современная фармакоэкономика и фармакоэпидемиология. 2023;16(3):422-430. https://doi.org/10.17749/2070-4909/farmakoekonomika.2023.211
For citation:
Zyryanov S.K., Dyakov I.N. Updated pharmacoeconomic analysis of atesolizumab efficiency compared with other PD-1 inhibitors in patients with advanced non-small cell lung cancer after chemotherapy. FARMAKOEKONOMIKA. Modern Pharmacoeconomics and Pharmacoepidemiology. 2023;16(3):422-430. (In Russ.) https://doi.org/10.17749/2070-4909/farmakoekonomika.2023.211

Контент доступен под лицензией Creative Commons Attribution-NonCommercial-ShareAlike 4.0 International License.






































