Перейти к:
Основные принципы лекарственной терапии пациентов с хроническим миелоидным лейкозом
https://doi.org/10.17749/2070-4909/farmakoekonomika.2023.166
Аннотация
Цель: обобщить научные сведения об основных принципах современной лекарственной терапии пациентов с хроническим миелоидным лейкозом (ХМЛ) с учетом их индивидуальных особенностей.
Материал и методы. В основу исследования взяты современные научные статьи о ХМЛ, клинические рекомендации по диагностике и лечению ХМЛ 2021 г., данные Государственного реестра лекарственных средств (ГРЛС) Российской Федерации, аннотации по применению лекарственных препаратов. Использовались следующие методы: структурный анализ, аналитический метод, контент-анализ, ретроспективный анализ, системный подход, ситуационно-логический и графический методы анализа.
Результаты. Проблема терапии ХМЛ на сегодняшний день является актуальной, т.к. с каждым годом наблюдается рост заболеваемости по данной нозологии. В настоящее время наиболее значимым является назначение ингибиторов тирозинкиназ (ИТК), поскольку они способны оказывать выраженные эффекты и достаточно хорошо переносятся пациентами. Терапия ХМЛ при назначении ИТК состоит из нескольких линий. В первой линии чаще всего применяется иматиниб, т.к. он более безопасен. Существуют комбинации с иматинибом, например его используют совместно с интерфероном-альфа, что позволяет в некоторых случаях усилить ответ на лечение. Во второй линии терапии применяются следующие препараты: нилотиниб, дазатиниб, бозутиниб, понатиниб. При неэффективности терапии ИТК возможно назначение стандартной химиотерапии, интерферонотерапии либо трансплантации костного мозга при отсутствии противопоказаний. Проводятся исследования возможности применения и включения в клинические рекомендации таких препаратов, как триоксид мышьяка, децитабин, омацетаксим, а также ингибиторов фарнезилтрансфераз, гранулоцитарно-макрофагальных факторов, противоопухолевых вакцин. По результатам анализа ГРЛС выявлено, что количество внесенных ИТК составляет 27 торговых наименований, среди которых доля отечественных препаратов – 60%. Отсутствуют российские биоаналоги бозутиниба и понатиниба, которые рекомендуется использовать при неэффективности терапии ИТК предшествующих линий.
Заключение. Изучение лекарственного обеспечения пациентов с ХМЛ является актуальной задачей для фармацевтической практики и для системы здравоохранения в целом. На сегодняшний день остро стоят вопросы о персонифицированном подходе к лечению каждого пациента с учетом сопутствующих заболеваний и о поиске новых, более эффективных лекарственных препаратов, способных увеличить продолжительность и качество жизни больных ХМЛ.
Ключевые слова
Для цитирования:
Журавлев А.В., Кныш О.И. Основные принципы лекарственной терапии пациентов с хроническим миелоидным лейкозом. ФАРМАКОЭКОНОМИКА. Современная фармакоэкономика и фармакоэпидемиология. 2023;16(2):332-344. https://doi.org/10.17749/2070-4909/farmakoekonomika.2023.166
For citation:
Zhuravlev A.V., Knysh O.I. Key principles of drug therapy in patients with chronic myeloid leukemia. FARMAKOEKONOMIKA. Modern Pharmacoeconomics and Pharmacoepidemiology. 2023;16(2):332-344. (In Russ.) https://doi.org/10.17749/2070-4909/farmakoekonomika.2023.166
ВВЕДЕНИЕ / INTRODUCTION
В последнее время особое внимание уделяется профилактике и лечению онкологических заболеваний, среди которых выделяются хронические миелоидные лейкозы (ХМЛ), характеризующиеся распространенностью во всех возрастных группах, сокращением продолжительности жизни, ростом заболеваемости. Лекарственная терапия данной нозологии является избирательной и включает множество лекарственных препаратов (ЛП) – как таргетных, так и для лечения сопутствующих заболеваний.
Регистрируемая заболеваемость ХМЛ, по данным мировой литературы, колеблется от 1 до 1,5 случая на 100 тыс. взрослого населения. Среди лейкозов около 15–20% приходится на долю ХМЛ. В 2016 г. Всероссийский регистр пациентов с ХМЛ содержал данные о 7609 пациентах с ХМЛ. Хроническая фаза (ХФ) диагностирована у 6560 (93,8%) больных, фаза акселерации (ФА) – у 380 (5,5%), фаза бластного криза (БК) – у 47 (0,7%) [1].
К 2020 г. количество пациентов с ХМЛ, находящихся на терапии ингибиторами тирозинкиназ, увеличилось примерно до 12 тыс. [2]. В конце 2021 г. в России среди онкобольных, наблюдавшихся 5 лет и более, число больных с опухолями лимфатической и кроветворной тканей увеличилось на 10,8% [3]. Ежегодно в Тюменской обл. выявляется около 15–20 случаев ХМЛ, которые берутся на программную химиотерапию. На сегодняшний день согласно регистру пациентов, приобретающих ЛП для лечения ХМЛ, 145 человек получают лечение и динамическое наблюдение в гематологическом отделении ГБУЗ Тюменской обл. «Областная клиническая больница № 1».
Хронический миелоидный лейкоз — это клональное миелопролиферативное заболевание, которое развивается из-за злокачественной трансформации ранних гемопоэтических предшественников миелопоэза. Обнаружить ХМЛ возможно благодаря наличию специального маркера в опухолевых клетках – филадельфийской хромосомы (Ph"-хромосома). Химерный ген BCR-ABL продуцирует белок р210 (тирозинкиназу), обладающий высокой активностью. Этот белок регулирует сигналы, которые отвечают за рост клеток, дифференцировку, активацию, апоптоз и адгезию. Для установления диагноза ХМЛ обязательным является обнаружение Ph"-хромосомы или гена BCR-ABL [4].
Первые попытки лечения ХМЛ были предприняты только через 20 лет после его описания. В 1865 г. для лечения использовался мышьяк в виде фовлерова раствора. Продолжительность жизни больных оставалась короткой (не более 2–3 лет), и такое лечение часто приводило к инвалидизации. В 1895 г., после открытия рентгеновских лучей, Н. Сенн впервые использовал их для облучения селезенки при ХМЛ, в результате чего происходило значительное уменьшение органа, снижение числа лейкоцитов. Данный метод стал широко применяться, но с каждым разом эффекты становились все менее выраженными. Попытки использования других средств не увенчались успехом: бензол, уретан, радиоактивный фосфор, эмбихин, допан не показали большей эффективности и проявили высокую токсичность [5].
Прорывом в лечении ХМЛ стало открытие бусульфана в 1953 г. Когда подробно были изучены механизм действия и эффекты препарата, стало очевидно, что он эффективен практически у всех ранее не леченных больных и нередко вызывает ремиссии у пациентов, ставших резистентными к рентгенотерапии. Применение бусульфана значительно улучшило качество жизни больных ХМЛ, поскольку появилась возможность на протяжении всей хронической фазы заболевания контролировать количество лейкоцитов, удерживая его на нормальном или незначительно повышенном уровне, и сохранять нормальные размеры селезенки. Большинство пациентов сохраняли соматическую компенсацию и трудоспособность. Однако средняя продолжительность жизни увеличилась незначительно [5].
Цель – обобщить научные сведения об основных принципах современной лекарственной терапии пациентов с ХМЛ с учетом их индивидуальных особенностей.
МАТЕРИАЛ И МЕТОДЫ / MATERIAL AND METHODS
Задачи исследования / Study tasks
В рамках подготовки обзора были поставлены следующие задачи:
- на основе современной научной литературы изучить основные принципы лекарственной терапии ХМЛ у различных групп пациентов;
- на основе клинических рекомендаций по диагностике и лечению ХМЛ проанализировать принципы выбора тактики терапии ХМЛ;
- на основе научной литературы и Государственного реестра лекарственных средств (ГРЛС) Российской Федерации обобщить сведения о ЛП отечественных и зарубежных производителей, которые используются при лечении ХМЛ.
Источники данных / Data sources
В качестве материалов за основу были взяты публикации о ХМЛ из российских и зарубежных научных баз данных: Научная электронная библиотека eLibrary, КиберЛенинка, Scopus, Web of Science, PubMed/MEDLINE. Поиск проводили по ключевым словам: для русскоязычных источников – «хронический миелоидный лейкоз», «ХМЛ», «химиотерапия», «ингибиторы тирозинкиназ», «ИТК», «таргетные препараты», «химиотерапия», «клинические рекомендации», «лекарственный препарат», «иматиниб», «нилотиниб», «дазатиниб», «бозутиниб», «гидроксикарбамид», «интерферон альфа», «аллогенная трансплантация»; для англоязычных источников – “chronic myeloid leukemia”, “CML”, “chemotherapy”, “tyrosine kinase inhibitors”, “TKIs”, “targeted drugs”, “chemotherapy”, “clinical guidelines”, “drug”, “imatinib”, “nilotinib”, “dasatinib”, “bosutinib”, “hydroxyurea”, “interferon alfa”, “allogeneic” “transplantation”.
Также использовали клинические рекомендации по диагностике и лечению ХМЛ за период 2019–2021 г. общероссийского национального союза «Ассоциация онкологов России» и справочник для медицинских работников MedElement, данные регистрационных удостоверений на ЛП из ГРЛС, аннотации по применению ЛП из справочника лекарственных средств «Видаль» и регистра лекарственных средств России «РЛС».
Методы анализа / Methods of analysis
Применяли следующие методы: структурный анализ, аналитический метод, контент-анализ, ретроспективный анализ, системный подход, ситуационно-логический и графический методы анализа.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ / RESULTS AND DISCUSSION
Основные принципы терапии ХМЛ / Basic principles of CML therapy
На основе современной научной литературы и клинических рекомендаций нами изучены основные принципы фармакотерапии ХМЛ у различных групп пациентов. На сегодняшний день для лечения ХМЛ используют:
- химиотерапию;
- интерферонотерапию (интерферон альфа-2a и -2b);
- ингибиторы тирозинкиназ (ИТК);
- трансплантацию гемопоэтических стволовых клеток;
- симптоматическую терапию.
Стандартная химиотерапия
Для лечения ХМЛ при непереносимости ИТК, прогрессировании заболевания либо невозможности проведения трансплантации костного мозга используются препараты гидроксикарбамида или бусульфан [6]. Часто в качестве препарата выбора назначают гидроксикарбамид, поскольку он реже дает побочные эффекты [7].
Гидроксикарбамид является антиметаболитом, который специфически ингибирует синтез ДНК. Он показан пациентам для уменьшения опухолевого очага на этапе первичного обнаружения признаков заболевания и для дальнейшего решения вопроса о стратегии лечения. Преимуществом гидроксикарбамида является то, что он хорошо переносится, но иногда вызывает диарею и мукозит (поражение слизистых оболочек). Из нежелательных явлений (НЯ) могут возникнуть: макроцитоз, повышение уровня мегалобластов, гигантские нейтрофилы в костном мозге и крови.
Бусульфан – алкилирующее соединение. Его механизм действия основан на том, что он связывается с аминосульфгидрильными и тиоловыми группами белков, после чего образуются циклические соединения. Это приводит к резкому падению роста и деления клеток. Антилейкозный эффект бусульфана объясняется тем, что он оказывает угнетающее действие на клеточную пролиферацию в костном мозге. Стартовая доза препарата – 2–8 мг/сут (1–4 таблетки), на выбор дозировки влияет количество лейкоцитов. При уменьшении количества лейкоцитов в 2 раза дозировки обычно снижают вдвое. Бусульфан переносится хорошо, но может вызвать осложнения: ухудшение потенции, отсутствие менструаций у женщин, разрастание соединительной ткани в легких и за брюшиной, панцитопения, гиперпигментация кожных покровов.
Интерферонотерапия
Интерферон альфа (ИФН-α) является достаточно важным компонентом для эффективной комплексной терапии пациентов с ХМЛ. Применение ИФН-α приводит к большей выживаемости пациентов, чем использование бусульфана и гидроксикарбамида [8]. Изучена эффективность препаратов ИФН-α в ХФ, а также проводятся исследования эффективности интерферонотерапии в ФА и БК. Эффективность определяется по достижению выраженного цитогенетического ответа.
Способ применения препаратов ИФН-α – инъекции внутримышечные и подкожные в дозе 5 млн МЕ/(м2•сут) каждый день со снижением и переходом на поддерживающие дозировки, если достигнута клинико-гематологическая и цитогенетическая ремиссия. Имеются данные, что при комбинации интерферонов с иматинибом увеличивается количество и частота ответных реакций на лечение [9]. При применении ИФН-α совместно с иматинибом в 87% случаев наблюдался большой молекулярный ответ [10]. Молекулярная ремиссия достигается редко. Хотя интерферонотерапия и оказывает множество положительных эффектов, у большинства пациентов после достижения полной ремиссии имеется высокий риск развития рецидивов.
Довольно частые осложнения при интерферонотерапии: гриппоподобный синдром, симптомами которого являются лихорадка и миалгии, развитие аллергических реакций, артериальная гипотония, бронхоспазмы [11].
Комбинация ИФН-α и цитарабина позволяла незначительно увеличить общую выживаемость пациентов до 6–7 лет, но на данный момент она не используется [12].
Ингибиторы тирозинкиназ
Применение ИТК для терапии пациентов с ХМЛ показывает бо́льшую эффективность, чем использование бусульфана, гидроксикарбамида и интерферонов [13]. ИТК являются важными препаратами, которые дают возможность пациентам быть социально активными, увеличивают продолжительность и качество жизни. Перед тем как выбрать наиболее приемлемый ЛП, обращают внимание на фазу ХМЛ, сопутствующие нозологии в анамнезе и возможность развития НЯ при проведении лечения.
В первой линии терапии чаще всего используют менее токсичные ЛП, учитывая при этом индивидуальные особенности пациента: возраст, сопутствующие заболевания и способность больного переносить лечение конкретным препаратом. Помимо прочего, выбор ИТК первой и второй линий основывается на предполагаемой наибольшей эффективности в совокупности с наименьшим риском развития НЯ. Каждый из препаратов имеет свои особенности, противопоказания и побочные эффекты, которые представлены в таблице 1.
Таблица 1. Обобщенные данные о лекарственных препаратах из группы ингибиторов тирозинкиназ, используемых при терапии хронического миелоидного лейкоза
Table 1. Summary of data on drugs from the group of tyrosine kinase inhibitors used in the treatment for chronic myeloid leukemia
|
МНН (ТН) / INN (TN) |
Форма выпуска и дозы / Form and dosage |
Варианты корректировки дозировок / Dose adjustment options |
Способ применения / Method of administration |
Противопоказания / Contraindications |
Частые побочные эффекты / Сommon side effects |
|
Иматиниб (Неопакс®, Глемихиб®, Цитониб® онко) / Imatinib (Neopax®, Glemihib®, Cytonib® onco) |
Таблетки, покрытые оболочкой, капсулы 50 мг, 100 мг, 400 мг / Coated tablets, capsules 50 mg, 100 mg, 400 mg |
Стартовая доза: 400 мг/сут (ХФ), 600 мг/сут (ФА и БК) Повышение (неудача лечения): 600 мг/сут (ХФ), 800 мг/сут (ФА и БК) Снижение дозы (вследствие токсического действия): 300 мг/сут (ХФ), 400 мг/сут (ФА и БК) / Starting dose: 400 mg/day (CF), 600 mg/day (AF and BC) Increase (treatment failure): 600 mg/day (CF), 800 mg/day (AF and BC) Dose reduction (due to toxic effects): 300 mg/day (CF), 400 mg/day (AF and BC) |
Принимать во время приема пищи, запивать полным стаканом воды / To be taken with a meal with a full glass of water |
Повышенная чувствительность, беременность, грудное вскармливание, детский возраст: до 1 года при ОЛЛ, до 2 лет при ХМЛ. Соблюдать осторожность при тяжелой печеночной недостаточности, тяжелых нарушениях функций почек, проведении гемодиализа, применении парацетамола, варфарина, риске развития сердечной недостаточности / Hypersensitivity, pregnancy, breast-feeding, childhood: up to 1 year in ALL, up to 2 years in CML. Caution with severe hepatic insufficiency, severe renal impairment, hemodialysis, use of paracetamol, warfarin, risk of heart failure |
Нейтропения, тромбоцитопения, анемия, фебрильная нейтропения, набор массы тела, анорексия, бессонница, головная боль, головокружение, нарушение вкуса, отек век, конъюнктивит, сухость в глазах, кровоизлияния, носовые кровотечения, одышка, кашель, диспепсические расстройства, вздутие, метеоризм, повышение активности печеночных трансаминаз, дерматиты, экзема, мышечные спазмы, судороги / Neutropenia, thrombocytopenia, anemia, febrile neutropenia, weight gain, anorexia, insomnia, headache, dizziness, impaired taste, eyelid edema, conjunctivitis, dry eyes, hemorrhages, nose bleeding, dyspnea, cough, dyspeptic disorders, bloating, meteorism, increased liver transaminase activity, dermatitis, eczema, muscle cramps, seizures |
|
Нилотиниб (Тасигна®) / Nilotinib (Tasigna®) |
Капсулы 150 мг, 200 мг / Capsules 150 mg, 200 mg |
1-я линия терапии (ХФ) Стартовая доза: 600 мг/сут Снижение дозы (вследствие токсического действия): 400 мг/сут 2-я линия терапии (ХФ и ФА) Стартовая доза: 800 мг/сут Снижение дозы (вследствие токсического действия): 600 мг/сут, дальнейшее снижение до 400 мг/сут // 1st line therapy (CF) Starting dose: 600 mg/day Dose reduction (due to toxic effects): 400 mg/day 2nd line therapy (CF and AF) Starting dose: 800 mg/day Dose reduction (due to toxicity): 600 mg/day, further reduction to 400 mg/day |
Принимать натощак или через 2 ч после еды, запивать полным стаканом воды. После приема пищу следует принимать не ранее чем через 1 ч / To be taken on an empty stomach or 2 hours after a meal with a full glass of water. After the meal, the food should be taken not earlier than in 1 hour |
Беременность, лактация, возраст до 18 лет, повышенная чувствительность. Соблюдать осторожность при печеночной недостаточности, панкреатите в анамнезе, сахарном диабете, атеросклерозе / Pregnancy, lactation, age under 18 years, hypersensitivity. Caution with liver failure, pancreatitis in the history, diabetes mellitus, atherosclerosis |
Нейтропения, тромбоцитопения, анемия, фебрильная нейтропения, головная боль, головокружение, бессонница, диспепсические расстройства, вертиго, сыпь, зуд, повышение артериального давления, одышка, кашель, миалгии, артралгии, повышенная утомляемость, астения / Neutropenia, thrombocytopenia, anemia, febrile neutropenia, headache, dizziness, insomnia, dyspeptic disorders, vertigo, rash, itching, increased blood pressure, shortness of breath, cough, myalgia, arthralgia, increased fatigue, asthenia |
|
Дазатиниб (Мирсониб®, Спрайсел®) / Dasatinib (Mirsonib®, Sprysel®) |
Таблетки, покрытые оболочкой 20 мг, 50 мг, 70 мг, 80 мг, 100 мг, 140 мг / Coated tablets 20 mg, 50 mg, 70 mg, 80 mg, 100 mg, 140 mg |
1-я и 2-я линии терапии (ХФ) Стартовая доза: 100 мг/сут Снижение дозы (вследствие токсического действия): 80 мг/сут, дальнейшее снижение до 50 мг/сут 1-я и 2-я линии терапии (ФА и БК) Стартовая доза: 140 мг/сут Снижение дозы (вследствие токсического действия): 100 мг/сут, дальнейшее снижение до 80 мг/сут // 1st and 2nd lines therapy (CF) Starting dose: 100 mg/day Dose reduction (due to toxic effects): 80 mg/day, further reduction to 50 mg/day 1st and 2nd lines therapy (АF and BC) Starting dose: 140 mg/day Dose reduction (due to toxic effects): 100 mg/day, further reduction to 80 mg/day |
Прием возможен вне зависимости от употребления пищи, следует запивать полным стаканом воды / Can be taken regardless of food intake with a full glass of water |
Беременность, лактация, возраст до 18 лет, повышенная чувствительность. Соблюдать осторожность при печеночной недостаточности, хронических заболеваниях ССС, хронических заболеваниях дыхательной системы, бронхиальной астме, пневмонии, хронических заболеваниях ЖКТ с повышением риска кровоизлияний / Pregnancy, lactation, age under 18 years, hypersensitivity. Caution with liver failure, chronic CVS diseases, chronic respiratory diseases, bronchial asthma, pneumonia, chronic GI diseases with increased risk of hemorrhage |
Задержка жидкости, диарея, одышка, усталость, миалгия, развитие инфекций (бактериальных, вирусных, грибковых) вплоть до сепсиса с летальным исходом, головная боль, фебрильная нейтропения, геморрагии / Fluid retention, diarrhea, shortness of breath, fatigue, myalgia, development of infections (bacterial, viral, fungal) up to sepsis with lethal outcome, headache, febrile neutropenia, hemorrhages |
|
Бозутиниб (Бозулиф®) / Bosutinib (Bosulife®) |
Таблетки, покрытые оболочкой 100 мг, 400 мг, 500 мг / Coated tablets 100 mg, 400 mg, 500 mg |
2-я и следующие линии терапии (ХФ, ФА, БК) Стартовая доза: 500 мг/сут Снижение дозы (вследствие токсического действия): 400 мг/сут, дальнейшее снижение до 300 мг/сут // 2nd and the following lines therapy (CF, AF, BC) Starting dose: 500 mg/day Dose reduction (due to toxic effects): 400 mg/day, further reduction to 300 mg/day |
Принимать во время приема пищи, запивать полным стаканом воды. Если доза пропущена, дополнительную дозу принимать не следует / Take with a meal with a full glass of water. If a dose is missed, no additional dose should be taken |
Беременность, грудное вскармливание, возраст до 18 лет, повышенная чувствительность к препарату, одновременное применение ингибиторов или индукторов изофермента CYP3A. Соблюдать осторожность при недавно перенесенном инфаркте миокарда, застойной сердечной недостаточности, нестабильной стенокардии / Pregnancy, breast-feeding, age under 18 years, hypersensitivity, concomitant use of CYP3A isoenzyme inhibitors or inducers. Caution with recent myocardial infarction, congestive heart failure, unstable angina |
Перикардиальный выпот, звон в ушах, диспепсические расстройства, тромбоцитопения, анемия, нейтропения, инфекционные осложнения (вирусные инфекции дыхательных путей), гепатотоксичность, снижение аппетита, диспноэ, кашель, сыпь, почечная недостаточность / Pericardial effusion, tinnitus, dyspeptic disorders, thrombocytopenia, anemia, neutropenia, infectious complications (viral respiratory infections), hepatotoxicity, decreased appetite, dyspnea, cough, rash, renal failure |
Примечание. МНН – международное непатентованное наименование; ТН – торговое наименование; ХФ – хроническая фаза; ФА – фаза акселерации; БК – бластный криз; ОЛЛ – острый лимфобластный лейкоз; ХМЛ – хронический миелоидный лейкоз; ССС – сердечно-сосудистая система; ЖКТ – желудочно-кишечный тракт.
Note. INN – international nonproprietary name; TN – trade name; CF – chronic phase; AF – acceleration phase; BC – blast crisis; ALL – acute lymphoblastic leukemia; CML – chronic myeloid leukemia; CVS – cardiovascular system; GI – gastrointestinal tract
Аллогенная трансплантация
Аллогенная трансплантация стволовых кроветворных клеток (АлТСКК) или аллогенная трансплантация костного мозга (АлТКМ)на сегодняшний день являются эффективными вариантами излечения больного ХМЛ, но используются только в тех случаях, если терапия ИТК оказалась неэффективной и заболевание прогрессирует в фазу БК [14]. Данный метод лечения может привести к серьезным осложнениям и летальному исходу с вероятностью 10–35% [15], возможны рецидивы [16]. Трансплантацию можно проводить пациентам не старше 30 лет в начальной ХФ, если имеется совместимый донор [17][18]. Данную процедуру рекомендуется выполнять как можно скорее после обнаружения ХМЛ.
Больше чем у половины пациентов в ранней стадии обнаружения ХМЛ (50–70%) рецидивы не проявляются в течение 5 лет после АлТКМ. Результаты трансплантации на более ранних стадиях заболевания заметно лучше, полный молекулярный ответ достигается в 80% случаев, также отмечается низкая частота возникновения рецидивов (до 11%) [13]. Существуют возможности проведения АлТСКК, материалы для этой процедуры получают, когда достигается полная ремиссии.
Для терапии рецидивов после трансплантации прибегают к инфузии аллогенных лимфоцитов [19]. При наличии больших рисков данный метод используют в последнюю очередь.
Симптоматическая терапия
При болевом синдроме различной степени выраженности рекомендуется назначение соответствующей терапии, возможно применение наркотических и психотропных препаратов [19].
При терапии вторичной тромбоцитемии для снижения риска тромбоза используют антиагреганты (анагрелид или агрилин). В случае цитопении или при выраженном синдроме диссеминированного внутрисосудистого свертывания показано переливание крови [20]. При симптомах гиперлейкоцитоза и поражения центральной нервной системы назначаются лейкаферез и гидроксикарбамид. Аллопуринол используется для профилактики поражения почек на фоне подагры.
Спленэктомия применяется редко из-за риска инфекционных осложнений при спленомегалии, которая не контролируется химиотерапией. За 6 нед до спленэктомии проводится иммунизация пневмококковой, менингококковой вакцинами и вакциной против гемофильной палочки, каждая за 2 нед [21]. Спленэктомия или облучение селезенки при трансплантации стволовых клеток не повышала выживаемость [22].
Тактика терапии ХМЛ / Tactics of CML therapy
Терапия ХМЛ требует грамотного составления тактики лечения, выбор которой зависит от стадии и характера течения заболевания. При назначении терапии необходимо постоянно контролировать показатели здоровья пациента на данный промежуток времени. Дело в том, что препарат в стартовой дозировке не всегда дает планируемые результаты, поэтому следует всегда ориентироваться на клинические рекомендации с целью принятия конкретных мер, если ответ на терапию отсутствует [20]. Тактика терапии ХМЛ на амбулаторном и стационарном уровнях в соответствии с клиническими рекомендациями по диагностике и лечению ХМЛ 2021 г. представлена в таблице 2.
Таблица 2. Тактики терапии хронического миелоидного лейкоза на амбулаторном и стационарном уровнях в соответствии с клиническими рекомендациями 2021 г. [20]
Table 2. Therapy tactics for chronic myeloid leukemia at the outpatient and inpatient levels according to 2021 clinical guidelines [20]
|
Линия терапии / Therapy line |
Клиническая ситуация / Clinical situation |
Тактика терапии / Therapy tactics |
|
Хроническая фаза / Chronic phase |
||
|
1-я линия / 1st line |
Все пациенты / All patients |
Иматиниб или нилотиниб HLA-типирование пациента и родственного донора (выполняется только у пациентов с высоким риском и при обнаружении клинически значимых дополнительных хромосомных аномалий в клетках Ph+) Определить мутационный статус у пациентов с дебютом фазы акселерации и бластного криза с определением чувствительности к ИТК / Imatinib or nilotinib HLA typing of patient and related donor (performed only in high-risk patients and when clinically significant additional chromosomal abnormalities are found in Ph+ cells) Determine mutational status in patients with acceleration phase debut and blast crisis with determination of sensitivity to TKI |
|
Субоптимальный ответ / Suboptimal response |
Продолжить прием ИТК1 в прежней дозе / Continue TKI1 at the same dose |
|
|
2-я линия / 2nd line |
Токсичность, непереносимость ИТК1 / Toxicity, intolerance of TKI1 |
Нилотиниб или дазатиниб HLA-типирование пациента и родственного донора / Nilotinib or dasatinib HLA typing of patient and related donor |
|
Неудача иматиниба в первой линии / Failure of imatinib in the 1st line |
Нилотиниб, дазатиниб или клинические исследования, HLA-типирование пациента и родственного донора / Nilotinib, dasatinib or clinical studies, HLA typing of patient and related donor |
|
|
Неудача нилотиниба в первой линии / Failure of nilotinib in the 1st line |
Дазатиниб, бозутиниб или клинические исследования (понатиниб, другие препараты) HLA-типирование пациента и родственного донора, решение вопроса об АлТСКК / Dasatinib, bosutinib or clinical trials (ponatinib, other drugs) HLA typing of patient and related donor, decision on alloHCT |
|
|
Неудача дазатиниба в первой линии / Failure of dasatinib in the 1st line |
Нилотиниб, бозутиниб или клинические исследования (понатиниб, другие препараты) HLA-типирование пациента и родственного донора, решение вопроса об АлТСКК / Nilotinib, bosutinib or clinical trials (ponatinib, other drugs) HLA typing of patient and related donor, decision on alloHCT |
|
|
Субоптимальный ответ / Suboptimal response |
Продолжить прием ИТК2 в прежней дозе HLA-типирование пациента и родственного донора, при потере цитогенетического ответа обсудить АлТКМ / Continue TKI2 at the same dose HLA typing of patient and related donor, in case of loss of cytogenetic response discuss alloBMT |
|
|
3-я линия / 3rd line |
Неудача и/или непереносимость ИТК2 / Failure and/or intolerance of TKI2 |
Любой из доступных ИТК Клинические исследования Омацетаксин – это вариант лечения для пациентов с прогрессирующим до фазы акселерации заболеванием ХМЛ, а также терапия пациентов с резистентностью и/или непереносимостью двух или более ИТК. АлТКМ для пациентов, имеющих донора / Any of the available TKI Clinical trials Omacetaxin is a treatment option for patients with advancing to acceleration phase of CML, as well as therapy for patients with resistance and/or intolerance to two or more TKIs; alloBMT for patients who have a donor |
|
Мутация Т315I / Mutation T315I |
Вне зависимости от стадии заболевания / Regardless of the disease stage |
Гидроксикарбамид, понатиниб или омацетаксин Клинические исследования HLA-типирование пациента и родственного донора, решение вопроса об АлТКМ / Hydroxycarbamide, ponatinib, or omacetaxine Clinical studies HLA-typing of patient and related donor, decision on alloBMT |
|
Фаза акселерации / Acceleration phase |
||
|
2-я другая линия / Another 2nd line |
Отсутствие ответа / No response |
Нилотиниб или дазатиниб Обсудить АлТКМ / Nilotinib or dasatinib Discuss alloBMT |
|
Бластный криз / Blast crisis |
||
|
Лимфоидный вариант / Lymphoid variant |
Терапия по программе лечения Ph+ ОЛЛ Дазатиниб 140 мг/сут как этап подготовки к АлТСКК АлТСКК (если достигнута 2-я хроническая фаза) с последующим продолжением ИТК (выбор ИТК в зависимости от предшествующего лечения, переносимости, мутационного анализа) Паллиативная терапия / Ph+ ALL therapy program Dasatinib 140 mg/day as preparation for alloHCT alloHCT (if chronic phase 2 is achieved) followed by continuation of TKI (choice of TKI depending on previous treatment, tolerance, mutation analysis) Palliative therapy |
|
|
Миелоидный вариант / Myeloid variant |
Терапия по программе лечения ОМЛ Дазатиниб 140 мг/сут как этап подготовки к АлТСКК с последующим продолжением ИТК (выбор ИТК в зависимости от предшествующего лечения, переносимости, мутационного анализа) Паллиативная терапия / AML therapy program Dasatinib 140 mg/day as preparation for alloHCT, followed by continuation of TKI (choice of TKI depending on previous treatment, tolerance, mutation analysis) Palliative therapy |
|
Примечание. ИТК – ингибитор тирозинкиназ; HLA (англ. human leukocyte antigens) – человеческие лейкоцитарные антигены; АлТСКК – аллогенная трансплантация стволовых кроветворных клеток; АлТКМ – аллогенная трансплантация костного мозга; ХМЛ – хронический миелоидный лейкоз; ОЛЛ – острый лимфобластный лейкоз; ОМЛ – острый миелоидный лейкоз.
Note. TKI – tyrosine kinase inhibitor; HLA – human leukocyte antigens; alloHCT – allogeneic hematopoietic cell transplantation; alloBMT – allogeneic bone marrow transplantation;
CML – chronic myeloid leukemia; ALL – acute lymphoblastic leukemia; AML – acute myeloid leukemia.
Анализ сведений о лекарственных препаратах для лечения ХМЛ / Analysis of information about drugs for CML treatment
Новые препараты
По данным научной литературы нами проанализированы возможности использования новых ЛП для лечения ХМЛ.
Децитабин является ингибитором гиперметилирования. Данное состояние наблюдается при разрастании опухоли и встречается у 50% пациентов в ХФ и у 100% в периоде БК. Использование децитабина приводило к полной гематологической ремиссии у 30% больных в ФА и у 10% в терминальной стадии. Но данный способ терапии сопровождался множественными побочными эффектами, а также частыми инфекционными осложнениями [23].
Гранулоцитарно-макрофагальный колониестимулирующий фактор (англ. granulocyte-macrophage colony stimulating factor, GM-CSF) назначали пациентам до начала терапии ИТК, которые после лечения ИФН-α достигли полной клинико-гематологической ремиссии, но не было получено выраженного цитогенетического ответа. При дальнейшей комбинации GM-CSF и ИФН-α цитогенетический ответ был получен у 28% больных, а полный молекулярный ответ – у 19% [24].
Гомохаррингтонин (омацетаксина мепесукцинат) — искусственно синтезированный аналог китайского растительного алкалоида, испытан в комбинации с цитозин-арабинозидом в позднем периоде ХФ ХМЛ у пациентов, которые устойчивы к эффектам ИФН-α. Получен высокий процент полных ремиссий, хотя в настоящее время неизвестно, насколько продолжительным будет этот эффект [25].
Имеются сведения, что применение противоопухолевых вакцин против пептида р210 (продукта гена BCR-ABL) может привести к снижению дозировки ИТК и увеличению шансов ремиссии [26][27].
Ингибиторы фарнезилтрансфераз в ряде исследований показали синергизм с иматинибом, что позволяет принимать их в качестве комбинированной терапии [28].
Триоксид мышьяка возможно использовать при ХМЛ, когда наблюдается резистентность к ИТК [29]. Триоксид мышьяка показал активность при совместном использовании с ИНФ-α и способность вызывать длительные ремиссии в испытаниях на мышах [30].
Препараты, включенные в ГРЛС
Также нами был проведен анализ лекарственных препаратов для терапии ХМЛ, включенных в ГРЛС [32], который содержит перечень отечественных и зарубежных лекарственных средств, разрешенных к медицинскому применению в Российской Федерации. В ходе анализа определены торговые наименования (ТН), страны – держатели или владельцы регистрационного удостоверения препаратов и даты государственных регистраций.
Что касается ИТК первого и второго поколений для терапии ХМЛ, внесенных в ГРЛС, иматиниб впервые зарегистрирован в 2010 г. под ТН Генфатиниб® аргентинской фармацевтической компанией «Лаборатория Тютор С.А.С.И.Ф.И.А.» [33]. В 2011 г. был зарегистрирован и внесен в реестр швейцарский препарат Гливек®. Держателем регистрационного удостоверения первого отечественного ЛП с МНН иматиниб является российская фармацевтическая компания «ООО «ФармМентал групп» [34]. Данный препарат был зарегистрирован в 2012 г. под ТН Филахроним®.
По данным ГРЛС, ежегодно регистрируются новые ЛП на основе иматиниба. За 12 лет было зарегистрировано 17 ЛП с действующим веществом иматиниб. Из них 10 (58,8%) принадлежат российским фармацевтическим компаниям, 3 (17,6%) – индийским и по 1 (5,9%) – компаниям из Исландии, Латвии, Аргентины и Швейцарии.
В отношении нилотиниба в ГРЛС имеется 3 ТН: препараты Тасигна® швейцарской компании «Новартис Фарма АГ» [35] с двумя датами государственной регистрации (2008 и 2011 гг.) и Нилотиниб® российской компании ООО «АМЕДАРТ» с датой государственной регистрации 2021 г. [36].
Дазатиниб числится в реестре под ТН Спрайсел® американской фармацевтической компании «Бристол-Майерс Сквибб Компани» [37]. Внесен в реестр в 2008 и 2010 гг. Остальные ТН принадлежат отечественным компаниям и вносились в реестр с 2017 по 2022 гг. Их доля составляет 75% (6 из 8 ТН).
Бозутиниб занесен в ГРЛС под ТН Бозулиф® и является единственным ЛП с данным действующим веществом в реестре. Владелец регистрационного удостоверения – американская фармацевтическая компания «Пфайзер Инк.» [38].
Данные ЛП широко используются для терапии ХМЛ как препараты первой и второй линий.
Встречаются мутации Т315I, при которых наблюдается резистентность к ИТК первого и второго поколений. В таком случае рекомендуется начинать лечение с омацетаксима или понатиниба [20][31], и только последний на данный момент находится в ГРЛС под ТН Айклусиг®. Держателем регистрационного удостоверения является швейцарская фармацевтическая компания «Инсайт Биосайенсес Интернешнл Сарл» [39].
При данной мутации используется также гидроксикарбамид, в ГРЛС он представлен в виде 5 ТН, 2 из которых были внесены в реестр в 2009 г.: Гидреа® (американская компания «Бристол-Майерс Сквибб Компани») [40] и Гидроксикарбамид® (немецкая компания «Медак ГмбХ») [41]. Два препарата на основе гидроксикарбамида включены в ГРЛС в 2017 и 2019 гг., держателями их регистрационных удостоверений являются российские фармацевтические компании ООО «ФармМентал групп» [42] и ООО «Озон Медика» [43] соответственно. И 1 препарат вошел в реестр в 2018 г., держатель регистрационного удостоверения – компания РУП «Белмедпрепараты» из Республики Беларусь [44].
Следует отметить, что применение ИФН-α предлагается в клинических рекомендациях и приемлемо на всех стадиях заболевания, в т.ч. и при мутации T315I [20]. По данным научных исследований, при мутации Т315I сопутствующая интерферонотерапия увеличивает общую 5-летнюю выживаемость на 25–30% [31]. В частности, при обнаружении беременности, комбинированной с ХМЛ, терапия ИФН-α является единственным наиболее безопасным для матери и плода способом лечения. В ГРЛС внесены 4 ЛП в виде лиофилизата для приготовления раствора для инъекций. Держателями регистрационных удостоверений являются российские фармацевтические компании. Препараты представлены под ТН Реаферон-ЕС® (дата государственной регистрации 2008 г., АО «Вектор-Медика») [45], Альфарона® (2010 г., ООО «Научно-производственное предприятие «Фармаклон») [46], Лайфферон® (2011 г., АО «Вектор-Медика») [47], Бинноферон альфа® (2022 г., АО «Биннофарм») [48].
На основе анализа ГРЛС составлена обобщающая наглядная диаграмма препаратов для терапии ХМЛ (рис. 1).
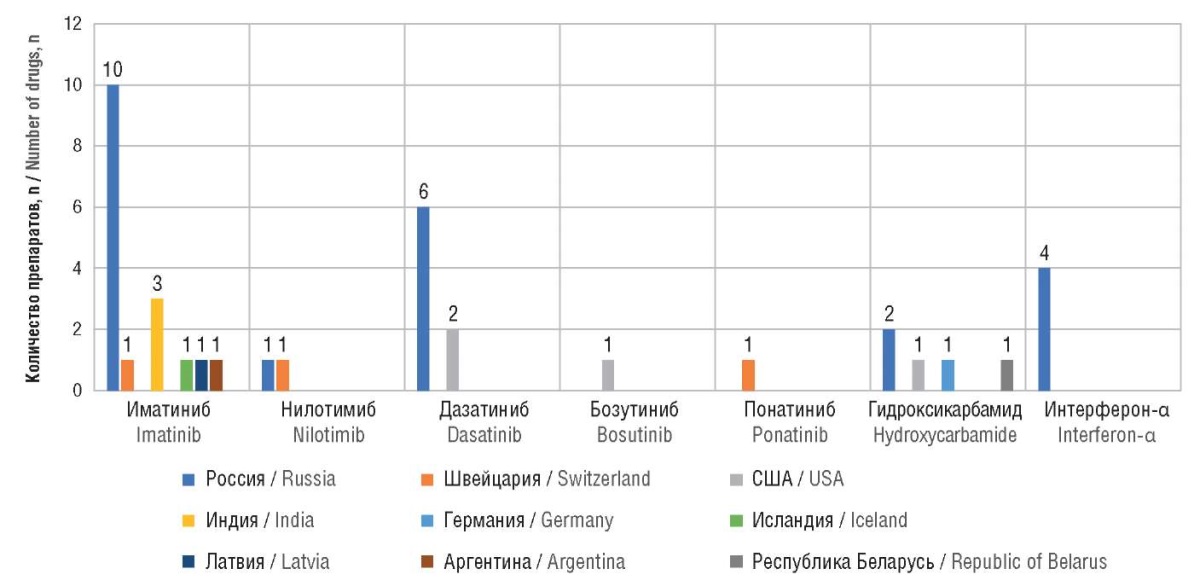
Рисунок 1. Страны происхождения препаратов для терапии хронических миелоидных лейкозов, включенных в Государственный реестр лекарственных средств
Fig. 1. Countries of origin of drugs for chronic myeloid leukemia therapy included in the State Register of Medicines
В результате анализа ЛП для терапии ХМЛ, включенных в ГРЛС, выявлено, что доля ЛП, держателями регистрационных удостоверений которых являются российские фармацевтические компании, составляет 60%, 40% приходится на производителей из других стран, в т.ч.: Швейцария – 8%, США – 9%, Индия – 8%, Германия, Исландия, Латвия, Аргентина, Республика Беларусь – по 3%. Следует отметить, что в ГРЛС отсутствуют зарегистрированные отечественные ЛП бозутиниб и понатиниб, которые рекомендуется использовать при неэффективности терапии ИТК предшествующих линий.
ЗАКЛЮЧЕНИЕ / CONCLUSION
Проведенный обзор позволил систематизировать и обобщить научные сведения об основных принципах современной лекарственной терапии пациентов, страдающих ХМЛ, а также о ЛП, разрешенных к применению на российском рынке.
Изучение лекарственного обеспечения пациентов с ХМЛ является актуальной задачей для фармацевтической практики и системы здравоохранения в целом. На сегодняшний день остро стоят вопросы о персонифицированном подходе к лечению каждого пациента с учетом сопутствующих заболеваний, а также о поиске новых, более эффективных ЛП, способных увеличить продолжительность и качество жизни пациентов, страдающих данным заболеванием.
Список литературы
1. Туркина А.Г., Новицкая Н.В., Голенков А.К. и др. Регистр больных хроническим миелолейкозом в Российской Федерации: от наблюдательного исследования к оценке эффективности терапии в клинической практике. Клиническая онкогематология. Фундаментальные исследования и клиническая практика. 2017; 10 (3): 390–401. https://doi.org/10.21320/2500-2139-2017-10-3-390-401.
2. Шуваев В.А., Абдулкадыров К.М., Туркина А.Г. и др. Фармакоэкономический анализ ремиссии хронического миелолейкоза без лечения. Гематология и трансфузиология. 2015; 60 (4): 14–20.
3. Каприн А.Д., Старинский В.В., Шахзадова А.О. (ред.) Состояние онкологической помощи населению России в 2021 году. М.; 2022: 239 с. URL: https://oncology-association.ru/wp-content/uploads/2022/05/sostoyanie-onkologicheskoj-pomoshhi-naseleniyu-rossii-v-2021-godu.pdf (дата обращения 16.11.2022).
4. Воробьев А.И., Абдулкадыров К.М., Хорошко Н.Д. Диагностика и терапия хронического миелолейкоза. М.; 2011: 53 с.
5. Волкова М.А. Хронический миелолейкоз: вчера, сегодня, завтра. К 165-летию первого описания. Клиническая онкогематология. Фундаментальные исследования и клиническая практика. 2010; 4: 316–24.
6. Hehlmann R., Heimpel H., Hasford J., et al. Randomized comparison of busulfan and hydroxyurea in chronic myelogenous leukemia: prolongation of survival by hydroxyurea. The German CML Study Group. Blood. 1993; 82 (2): 398–407.
7. Lengfelder E., Hehlmann R. Intensive combination chemotherapy in treatment of CML. Bone Marrow Transplant. 1996; 17 (Suppl. 3): S55–7.
8. Tura S., Baccarani M., Zuffa E., et al. Interferon alfa-2a as compared with conventional chemotherapy for the treatment of chronic myeloid leukemia. N Engl J Med. 1994; 330 (12): 820–5. https://doi.org/10.1056/NEJM199403243301204.
9. Talpaz M., Mercer J., Hehlmann R. The interferon-alpha revival in CML. Ann Hematol. 2015; 94 (Suppl. 2): S195–207. https://doi.org/10.1007/s00277-015-2326-y.
10. Simonsson B., Gedde-Dahl T., Markevärn B., et al. Combination of pegylated IFN-a2b with imatinib increases molecular response rates in patients with low- or intermediate-risk chronic myeloid leukemia. Blood. 2011; 118 (12): 3228–35. https://doi.org/10.1182/blood2011-02-336685.
11. Nicolini F.E., Etienne G., Dubruille V., et al. Nilotinib and peginterferon alfa-2a for newly diagnosed chronic-phase chronic myeloid leukaemia (NiloPeg): a multicentre, non-randomised, open-label phase 2 study. Lancet Haematol. 2015; 2 (1): e37–46. https://doi.org/10.1016/S2352-3026(14)00027-1.
12. Guilhot F., Chastang C., Michallet M., et al. Interferon alfa-2b combined with cytarabine versus interferon alone in chronic myelogenous leukemia. French Chronic Myeloid Leukemia Study Group. N Engl J Med. 1997; 337 (4): 223–9. https://doi.org/10.1056/NEJM199707243370402.
13. Любимова Л.С., Кузьмина Л.А., Урнова Е.С. и др. Hla-идентичная трансплантация костного мозга в первой хронической фазе хронического миелолейкоза в ранние сроки заболевания или длительная терапия ингибиторами тирозинкиназ? Гематология и трансфузиология. 2012; 3: 6–10.
14. Radich J. When to consider allogeneic transplantation in CML. Clin Lymphoma Myeloma Leuk. 2016; 16 (Suppl.): S93–5. https://doi.org/10.1016/j.clml.2016.02.008.
15. Мелкова К.Н. Аллогенная трансплантация костного мозга: ключевые аспекты и основные этапы развития. Клиническая онкогематология. Фундаментальные исследования и клиническая практика. 2012; 5 (1): 1–12.
16. Socié G., Salooja N., Cohen A., et al. Late Effects Working Party of the European Study Group for Blood and Marrow Transplantation. Nonmalignant late effects after allogeneic stem cell transplantation. Blood. 2003; 101 (9): 3373–85. https://doi.org/10.1182/blood-2002-07-2231.
17. Хамаганова Е.Г., Кузьмина Л.А. Оценка НМ-совместимости и требования к НМ-типированию больного и донора при трансплантации аллогенных гемопоэтических стволовых клеток. Гематология и трансфузиология. 2019; 64 (2): 175–87. https://doi.org/10.35754/234-5730-2019-64-2-175-187.
18. Fernandez H.F., Kharfan-Dabaja M.A. Tyrosine kinase inhibitors and allogeneic hematopoietic cell transplantation for chronic myeloid leukemia: targeting both therapeutic modalities. Cancer Control. 2009; 16 (2): 153–7. https://doi.org/10.1177/107327480901600207.
19. Поддубная И.В., Савченко В.Г. (ред.) Российские клинические рекомендации по диагностике и лечению злокачественных лимфопролиферативных заболеваний. М.; 2018: 278–88.
20. Клинические рекомендации «Хронический миелолейкоз». 2020. URL: https://oncology-association.ru/wp-content/uploads/2020/09/hronicheskij_mielolejkoz.pdf (дата обращения 16.11.2022).
21. Кислова М.И., Петренко А.А., Костинов М.П., Никитин Е.А. Вакцинопрофилактика у больных с хроническим лимфолейкозом: текущие проблемы. Эпидемиология и вакцинопрофилактика. 2021; 20 (3): 91–106. https://doi.org/10.31631/2073-3046-2021-20-3-91-106.
22. Gratwohl A., Goldman J., Gluckman E., Zwaan F. Effect of splenectomy before bone-marrow transplantation on survival in chronic granulocytic leukaemia. Lancet. 1985; 2 (8467): 1290–1. https://doi.org/10.1016/s0140-6736(85)91566-1.
23. Hackanson B., Daskalakis M. Decitabine. Recent Results Cancer Res. 2014; 201: 269–97. https://doi.org/10.1007/978-3-642-54490-3_18.
24. Zeidner J.F., Gladstone D.E., Zahurak M., et al. Granulocyte-macrophage colony stimulating factor (GM-CSF) enhances the clinical responses to interferon-α (IFN) in newly diagnosed chronic myeloid leukemia (CML). Leuk Res. 2014; 38 (8): 886–90. https://doi.org/10.1016/j.leukres.2014.05.012.
25. Novotny L., Al-Tannak N.F., Hunakova L. Protein synthesis inhibitors of natural origin for CML therapy: semisynthetic homoharringtonine (Omacetaxine mepesuccinate). Neoplasma. 2016; 63 (4): 495–503. https://doi.org/10.4149/neo_2016_401.
26. Bocchia M., Gentili S., Abruzzese E., et al. Effect of a p210 multipeptide vaccine associated with imatinib or interferon in patients with chronic myeloid leukaemia and persistent residual disease: a multicentre observational trial. Lancet. 2005; 365 (9460): 657–62. https://doi.org/10.1016/S0140-6736(05)17945-8.
27. Breccia M., Bocchia M., Cannella L., et al. Reduction of imatinib dose and persistence of complete molecular response after p210 multipeptide vaccine in chronic myeloid leukaemia treated with dose escalation for acquired resistance. Br J Haematol. 2010; 150 (2): 240–2. https://doi.org/10.1111/j.1365-2141.2010.08187.x.
28. Radujkovic A., Topaly J., Fruehauf S., Zeller W.J. Combination treatment of imatinib-sensitive and -resistant BCR-ABL-positive CML cells with imatinib and farnesyltransferase inhibitors. Anticancer Res. 2006; 26 (3A): 2169–77.
29. Wang X.B., Yuan L.H., Yan L.P., et al. UNC13B promote arsenic trioxide resistance in chronic lymphoid leukemia through mitochondria quality control. Front Oncol. 2022; 12: 920999. https://doi.org/10.3389/fonc.2022.920999.
30. El Eit R., Itani A.R., Nassar F., et al. Antitumor efficacy of arsenic/interferon in preclinical models of chronic myeloid leukemia resistant to tyrosine kinase inhibitors. Cancer. 2019; 125 (16): 2818–28. https://doi.org/10.1002/cncr.32130.
31. Власова Ю.Ю., Морозова Е.В., Барабанщикова М.В. и др. Пациенты ХМЛ с мутацией Т315I: характеристика и исходы лечения. Клеточная терапия и трансплантация. 2018; 3 (7): 131–2.
32. Государственный реестр лекарственных средств. URL: https://grls.rosminzdrav.ru/default.aspx (дата обращения 16.11.2022).
33. Государственный реестр лекарственных средств. Регистрационное удостоверение препарата Генфатиниб®. URL: https://grls.rosminzdrav.ru/Grls_View_v2.aspx?routingGuid=d3aa2183-a7e9-41c8-8b7d-52bcd02e984b (дата обращения 14.04.2023).
34. Государственный реестр лекарственных средств. Регистрационное удостоверение препарата Филахромин®. URL: https://grls.rosminzdrav.ru/Grls_View_v2.aspx?routingGuid=906bb4ab-f156-462c-9b67-34fa1b18a64f (дата обращения 14.04.2023).
35. Государственный реестр лекарственных средств. Регистрационное удостоверение препарата Тасигна®. URL: https://grls.rosminzdrav.ru/Grls_View_v2.aspx?routingGuid=d9b05202-7031-4fdf-8dc5-d159c730fc31 (дата обращения 14.04.2023).
36. Государственный реестр лекарственных средств. Регистрационное удостоверение препарата Нилотиниб®. URL: https://grls.rosminzdrav.ru/Grls_View_v2.aspx?routingGuid=c1a7b122-69ee-4d07-9748-d30204ce5643 (дата обращения 14.04.2023).
37. Государственный реестр лекарственных средств. Регистрационное удостоверение препарата Спрайсел®. URL: https://grls.rosminzdrav.ru/Grls_View_v2.aspx?routingGuid=aba92ba7-6dc8-4b14-88e8-a219f455a629 (дата обращения 14.04.2023).
38. Государственный реестр лекарственных средств. Регистрационное удостоверение препарата Бозулиф®. URL: https://grls.rosminzdrav.ru/Grls_View_v2.aspx?routingGuid=59adefae-5a27-453b-90ff-43d02ba87e2e (дата обращения 14.04.2023).
39. Государственный реестр лекарственных средств. Регистрационное удостоверение препарата Айклусиг®. URL: https://grls.rosminzdrav.ru/Grls_View_v2.aspx?routingGuid=dcc203ed-3a4b-483b-b1be-9b5e94b76a17 (дата обращения 14.04.2023).
40. Государственный реестр лекарственных средств. Регистрационное удостоверение препарата Гидреа®. URL: https://grls.rosminzdrav.ru/Grls_View_v2.aspx?routingGuid=bfc737d4-bbee-49a0-af70-7c3c89c6e44c (дата обращения 14.04.2023).
41. Государственный реестр лекарственных средств. Регистрационное удостоверение препарата Гидроксикарбамид медак®. URL: https://grls.rosminzdrav.ru/Grls_View_v2.aspx?routingGuid=b558e4a5-d0e8-422d-af1d-f9b99e2e4763 (дата обращения 14.04.2023).
42. Государственный реестр лекарственных средств. Регистрационное удостоверение препарата Гидроксикарбамид-натив®. URL: https://grls.rosminzdrav.ru/Grls_View_v2.aspx?routingGuid=c75a589c-e5f6-49a5-87c6-7a18bac37e74 (дата обращения 14.04.2023).
43. Государственный реестр лекарственных средств. Регистрационное удостоверение препарата Гидроксикарбамид® (Россия). URL: https://grls.rosminzdrav.ru/Grls_View_v2.aspx?routingGuid=d53bc540-8dba-40f0-873a-cc4eb1736692 (дата обращения 14.04.2023).
44. Государственный реестр лекарственных средств. Регистрационное удостоверение препарата Гидроксикарбамид® (Республика Беларусь). URL: https://grls.rosminzdrav.ru/Grls_View_v2.aspx?routingGuid=043f8398-16e9-4eac-a1a0-7b88ae97c273 (дата обращения 14.04.2023).
45. Государственный реестр лекарственных средств. Регистрационное удостоверение препарата Реаферон-ЕС®. URL: https://grls.rosminzdrav.ru/Grls_View_v2.aspx?routingGuid=779d695f-3c9d-4217-b15d-1b76383b90ca (дата обращения 14.04.2023).
46. Государственный реестр лекарственных средств. Регистрационное удостоверение препарата Альфарона®. URL: https://grls.rosminzdrav.ru/Grls_View_v2.aspx?routingGuid=9bfb4a29-4545-4fba-bc5e-deda650e3215 (дата обращения 14.04.2023).
47. Государственный реестр лекарственных средств. Регистрационное удостоверение препарата Лайфферон®. URL: https://grls.rosminzdrav.ru/Grls_View_v2.aspx?routingGuid=e0dc2278-af7e-4f6d-b5cf-92ff194b3f52 (дата обращения 14.04.2023).
48. Государственный реестр лекарственных средств. Регистрационное удостоверение препарата Бинноферон альфа®. URL: https://grls.rosminzdrav.ru/Grls_View_v2.aspx?routingGuid=468dde0c-240c-48a4-9f0f-254a6c568e75 (дата обращения 14.04.2023).
Об авторах
А. В. ЖуравлевРоссия
Журавлев Артём Вадимович – аспирант кафедры фармацевтических дисциплин
ул. Одесская, д. 54, Тюмень 625023
О. И. Кныш
Россия
Кныш Ольга Ивановна – д.фарм.н., профессор, заведующая кафедрой фармацевтических дисциплин
ул. Одесская, д. 54, Тюмень 625023
Рецензия
Для цитирования:
Журавлев А.В., Кныш О.И. Основные принципы лекарственной терапии пациентов с хроническим миелоидным лейкозом. ФАРМАКОЭКОНОМИКА. Современная фармакоэкономика и фармакоэпидемиология. 2023;16(2):332-344. https://doi.org/10.17749/2070-4909/farmakoekonomika.2023.166
For citation:
Zhuravlev A.V., Knysh O.I. Key principles of drug therapy in patients with chronic myeloid leukemia. FARMAKOEKONOMIKA. Modern Pharmacoeconomics and Pharmacoepidemiology. 2023;16(2):332-344. (In Russ.) https://doi.org/10.17749/2070-4909/farmakoekonomika.2023.166

Контент доступен под лицензией Creative Commons Attribution-NonCommercial-ShareAlike 4.0 International License.






































