Перейти к:
Лекарственная терапия ожирения в Российской Федерации: фармакоэпидемиологическое исследование
https://doi.org/10.17749/2070-4909/farmakoekonomika.2022.149
Аннотация
Цель: оценка объемов потребления препаратов орлистат, лираглутид и сибутрамин в Российской Федерации как средств, рекомендованных Российской ассоциацией эндокринологов и Российской ассоциацией бариатрических хирургов в качестве медикаментозной терапии ожирения.
Материал и методы. Из базы данных IQVIA была отобрана информация об объемах продаж в розничной сети, закупок за счет средств федерального и региональных бюджетов указанных лекарственных средств в период 2011–2021 гг. Проведен перерасчет потребленных объемов каждого препарата в количество средних установленных суточных доз (англ. defined daily dose, DDD) по каждому международному непатентованному наименованию в соответствии с методологией Всемирной организации здравоохранения.
Результаты. Продемонстрировано, что за 10-летний период имеется тенденция к сокращению потребления лекарственных средств для лечения ожирения с 83,03 млн DDD в 2011 г. до 71,7 млн в 2021 г. В структуре потребления на всем протяжении наблюдения доминировал сибутрамин: его доля составляла от 76% до 84%. Доля лиц, получающих фармакотерапию ожирения в России, составляет около 0,5%. При этом 58–66% продаж DDD были осуществлены в трех регионах: г. Москва, Московская обл. и г. Санкт-Петербург.
Заключение. Низкая эффективность, высокая частота нежелательных реакций, частый набор веса после отмены терапии, а также недостаточная ориентированность врачей на необходимость проведения фармакотерапии – вероятно, основные факторы, определяющие низкую распространенность применения медикаментозных методов лечения ожирения в России.
Ключевые слова
Для цитирования:
Стрижелецкий В.В., Гомон Ю.М., Спичакова Е.А., Колбин А.С., Каляпин А.А., Макаров С.А., Ломия А.Б., Султанова Ф.М. Лекарственная терапия ожирения в Российской Федерации: фармакоэпидемиологическое исследование. ФАРМАКОЭКОНОМИКА. Современная фармакоэкономика и фармакоэпидемиология. 2022;15(3):320-331. https://doi.org/10.17749/2070-4909/farmakoekonomika.2022.149
For citation:
Strizheletsky V.V., Gomon Yu.М., Spichakova Е.А., Kolbin А.S., Kalyapin А.А., Makarov S.А., Lomiya А.B., Sultanova F.М. Drug therapy for obesity in the Russian Federation: pharmacoepidemiological study. FARMAKOEKONOMIKA. Modern Pharmacoeconomics and Pharmacoepidemiology. 2022;15(3):320-331. (In Russ.) https://doi.org/10.17749/2070-4909/farmakoekonomika.2022.149
ВВЕДЕНИЕ / INTRODUCTION
В последнее время «эпидемия ожирения» стала одной из основных проблем глобального здравоохранения. В период с 1975 по 2016 гг. распространенность ожирения во всем мире утроилась, что объясняется сочетанием потребления высококалорийной пищи и малоподвижного образа жизни [1]. В Российской Федерации (РФ) согласно данным государственного статистического наблюдения в 2020 г. зарегистрировано 1 909 700 пациентов с ожирением [2].
Ожирение – хроническое заболевание, часто ассоциированное с множественной коморбидной патологией: артериальной гипертензией, сахарным диабетом 2-го типа (СД2), остеоартритом, сонным апноэ и другими заболеваниями [3–6]. Также ожирение связано с повышенным риском развития некоторых видов рака: увеличение индекса массы тела (ИМТ) сверх верхней границы нормы на 5 кг/м2 повышает риск развития у мужчин аденокарциномы пищевода, рака щитовидной железы, почки и толстой кишки, у женщин – рака эндометрия, желчного пузыря, почек и пищевода [7].
Ожирение является не только медицинской, но и экономической проблемой: прямые медицинские расходы, связанные с лечением его осложнений, обусловливают значительное социально-экономическое бремя заболевания [8]. Кроме медицинских и экономических аспектов люди, страдающие ожирением, подвергаются значимой социальной стигматизации [9]. Все это определяет потребность в разработке эффективных и безопасных стратегий лечения ожирения.
В историческом контексте использование лекарственных средств (ЛС) для контроля массы тела было сопряжено со значимыми сложностями, связанными прежде всего с оценкой соотношения «риск/польза» применяемых терапевтических стратегий [10]. Многие фармакотерапевтические средства для снижения веса, которые первоначально были одобрены для лечения ожирения, впоследствии были изъяты с фармацевтического рынка, поскольку проблемы безопасности стали доминировать над их клиническими преимуществами [11][12].
Согласно российским клиническим рекомендациям по лечению ожирения фармакотерапия показана пациентам, которые не могут достичь клинически значимого снижения массы тела на фоне немедикаментозных методов лечения и/или на этапе удержания достигнутого результата. При этом в случае средней или тяжелой стадии течения ожирения при наличии хотя бы одного осложнения, ассоциированного с ним, назначение фармакотерапии рекомендовано сразу на фоне немедикаментозных методов лечения [13]. Также указано, что ЛС для терапии ожирения можно назначать при ИМТ≥30 кг/м2 или при ИМТ≥27 кг/м2 и наличии факторов риска и/или коморбидных заболеваний. При этом оценку эффективности лекарственной терапии рекомендуется проводить спустя 3 мес после начала лечения. Неэффективным может считаться снижение массы тела менее чем на 5% от исходной в течение 3 мес. Оценку безопасности терапии следует проводить спустя 1–3 мес от момента назначения ЛС и не реже чем 1 раз в 3 мес в дальнейшем [13].
В настоящее время сведения о частоте проведения фармакотерапии у пациентов с ожирением в РФ отсутствуют. В то же время с учетом растущего количества лиц с морбидным ожирением принципиально важно понимать степень доступности в реальной клинической практике всех терапевтических подходов, рекомендованных к использованию в этой группе больных.
Цель – оценка объемов потребления препаратов орлистат, лираглутид и сибутрамин в РФ как средств, рекомендованных Российской ассоциацией эндокринологов и Российской ассоциацией бариатрических хирургов в качестве медикаментозной терапии ожирения.
МАТЕРИАЛ И МЕТОДЫ / MATERIAL AND METHODS
Характеристика препаратов / Drugs characteristics
В РФ в качестве средств фармакотерапии ожирения рекомендованы три ЛС: лираглутид, сибутрамин и орлистат [13]. Ни одно из них не входит в перечень жизненно необходимых и важнейших лекарственных препаратов (ЖНВЛП). В то же время в 2022 г. в дополнение к ликсисенатиду, уже включенному в перечень ЖНВЛП в 2018 г., в него вошли и другие агонисты рецептора глюкогоноподобного пептида-1 (англ. glucagon-like peptide-1, GLP-1) – дулаглутид, семаглутид [14]. Характеристика ЛС, рекомендованных для лечения ожирения в РФ, приведена в таблице 1.
Таблица 1. Характеристики лекарственных средств, рекомендованных в Российской Федерации в качестве фармакотерапии ожирения
Table 1. Characteristics of drugs recommended in the Russian Federation as a pharmacotherapy for obesity

Примечание. АТХ – анатомо-терапевтическо-химическая классификация; DDD (англ. defined daily dose) – установленная суточная доза; ДИ – доверительный интервал. * Частота события «очень часто» (более 1 на 10 случаев). ** По данным сетевого метаанализа [15]: эффективность оценивали как разницу в потере веса (в кг) к 52-й неделе по сравнению с группой плацебо, безопасность – как отношение шансов прекращения терапии вследствие нежелательных реакций. Эффективность и безопасность сибутрамина не учитывали, т.к. препарат отозван Управлением по санитарному надзору за качеством пищевых продуктов и медикаментов США (англ. U.S. Food and Drug Administration, FDA) в 2010 г.
Note. ATC – anatomical-therapeutic-chemical classification; DDD – defined daily dose; CI – confidence interval. * The frequency of the event is “very often” (more than 1 in 10 cases). ** According to a network meta-analysis [15]: efficacy was assessed as the difference in weight loss (in kg) by Week 52 compared to the placebo group, safety – as odds ratio of therapy termination due to adverse effects. The efficacy and safety of sibutramine were not taken into account, because the drug was withdrawn by the U.S. Food and Drug Administration (FDA) in 2010.
Сибутрамин
В 1997 г. Управление по санитарному надзору за качеством пищевых продуктов и медикаментов США (англ. U.S. Food and Drug Administration, FDA) одобрило сибутрамин (ингибитор обратного захвата серотонина и норадреналина) в качестве ЛС для лечения ожирения. В отличие от других ингибиторов обратного захвата моноаминов сибутрамин снижает массу тела за счет подавления аппетита и стимуляции расхода энергии [16]. Потеря веса, связанная с приемом препарата, зависит от дозы и продолжительности лечения и обычно находится в диапазоне 1,7–4,8 кг (1–5%) к 52-й неделе терапии [17][18]. Также наблюдается нормализация уровня инсулина, триглицеридов и холестерина натощак [17–19].
В исследовании оценки эффективности сибутрамина в отношении рисков сердечно-сосудистых событий (SCOUT), проведенном в период 2002–2009 гг., было продемонстрировано, что частота серьезных сердечно-сосудистых событий, определяемых как сердечно-сосудистая смерть, нефатальный инфаркт миокарда, нефатальный инсульт или остановка сердца, составила 11,4% в группе сибутрамина и 10% в группе плацебо (отношение рисков 1,16; 95% доверительный интервал 1,03–1,31; р=0,02) [20]. На основании полученных результатов в 2010 г. FDA отозвало сибутрамин из дистрибуции [21].
В РФ сибутрамин зарегистрирован и рекомендован к использованию у пациентов с ожирением. Тем не менее в инструкции по медицинскому применению препарата внесены такие противопоказания, как сердечно-сосудистые заболевания в анамнезе или в настоящее время, неконтролируемая артериальная гипертензия, а также возраст старше 65 лет.
Орлистат
Орлистат является ингибитором активности желудочно-кишечной липазы, за счет чего ограничивается доступность жирных кислот для всасывания в тонкой кишке [22]. Возникающая мальабсорбция жира способствует потере веса, которая на 2,6% превышает таковую в группе плацебо [23].
Показано, что орлистат оказывает дополнительное положительное влияние на контроль гликемии и течение неалкогольной жировой болезни печени [24][25].
Наиболее распространенные нежелательные реакции (НР) обусловлены механизмом действия: боль и дискомфорт в животе, маслянистые выделения из прямой кишки, стеаторея, метеоризм, дефицит жирорастворимых витаминов [26].
Агонисты глюкагоноподобного пептида
Секретируемый из L-клеток кишечника при воздействии пищи GLP-1 действует на поджелудочную железу, усиливая экспрессию и секрецию инсулина и ингибируя высвобождение глюкагона [27]. Помимо своей роли в качестве стимулятора секреции инсулина агонизм GLP-1 может приводить к снижению веса за счет центрально-опосредованного снижения аппетита [28]. Кроме того, агонисты GLP-1 уменьшают выработку глюкозы в печени путем ингибирования глюконеогенеза [29], повышают чувствительность к инсулину в скелетных мышцах [30], замедляют опорожнение желудка [31], улучшают сократительную функцию миокарда [32].
Нативный гормон имеет очень короткий период полураспада, составляющий минуты [33].
Лираглутид является аналогом, основанным на нативной последовательности аминокислот GLP-1, за исключением того, что лизин в остатке 28 заменен аргинином, что обеспечивает его меньшую восприимчивость к протеолизу дипептидилпептидазой IV типа, а дополнительное присоединение к молекуле пальмитиновой кислоты способствует образованию самоассоциированного мультимолекулярного комплекса в месте инъекции для замедления диффузии из него. Пальмитиновая кислота также содействует нековалентной ассоциации пептида с альбумином, что приводит к задержке почечного клиренса и увеличению периода полувыведения, который у людей составляет около 12 ч [34].
Лираглутид вместе с другими структурно оптимизированными агонистами GLP-1 образуют класс ЛС с эффективностью, более чем в 10 раз превышающей естественно продуцируемый гормон, и продолжительностью действия, которая позволяет вводить ЛС с частотой от 2 раз в день до 1 раза в неделю. Как класс аналоги GLP-1 обеспечивают клинически значимое улучшение гликемического контроля практически без риска гипогликемии [35][36].
С агонизмом GLP-1 связаны дозозависимые НР со стороны желудочно-кишечного тракта, которые ограничивают эскалацию дозировок [37]. Средняя потеря массы тела, ассоциированная с приемом лираглутида через 56 нед терапии, составила 8,4 кг по сравнению с 2,8 кг в контрольной группе, получавшей плацебо [38].
Источники данных / Data sources
Для оценки объемов потребления орлистата, лираглутида и сибутрамина в РФ из базы данных компании IQVIA (США) была отобрана информация об объемах продаж в розничной сети, закупок за счет средств федерального и региональных бюджетов указанных ЛС за период 2011–2021 гг. в РФ [39]. База данных IQVIA является коммерческим ресурсом, содержащим информацию о продажах ЛС как в абсолютных количествах, так и в абсолютных затратах на их приобретение на территории РФ во всех сегментах рынка (розница, бюджетное финансирование, дополнительное лекарственное обеспечение, региональная льгота).
Методы расчета / Calculation methods
Был проведен перерасчет потребленных объемов каждого ЛС в количество средних установленных суточных доз (англ. defined daily dose, DDD) по каждому международному непатентованному наименованию в соответствии с методологией Всемирной организации здравоохранения (ВОЗ) [40][41].
Существующая система анализа использования ЛС предполагает следующие варианты расчета:
- средняя установленная суточная доза ЛС по результатам мониторинга врачебных назначений ВОЗ по всему миру;
- данные по конкретному учреждению, выраженные в количестве суточных доз за год.
Система DDD является нормирующей мерой сравнения потребления ЛС. Формулы для расчета DDD [41]:
Dфв = D × N / 1000, (1)
где Dфв – доза в форме выпуска (г); D – дозировка (мг); N – количество (таб., мл);
ОП = Dфв × Nфв, (2)
где ОП – общее потребление ЛС (г); Nфв – количество форм выпуска;
NDDD = ОП / DDD, (3)
где NDDD – количество потребленных средних суточных доз ЛС (г).
РЕЗУЛЬТАТЫ / RESULTS
Результаты анализа потребления сибутрамина (в т.ч. в комбинации с метилцеллюлозой), лираглутида и орлистата в РФ за период 2011–2021 гг. представлены на рисунках 1 и 2.
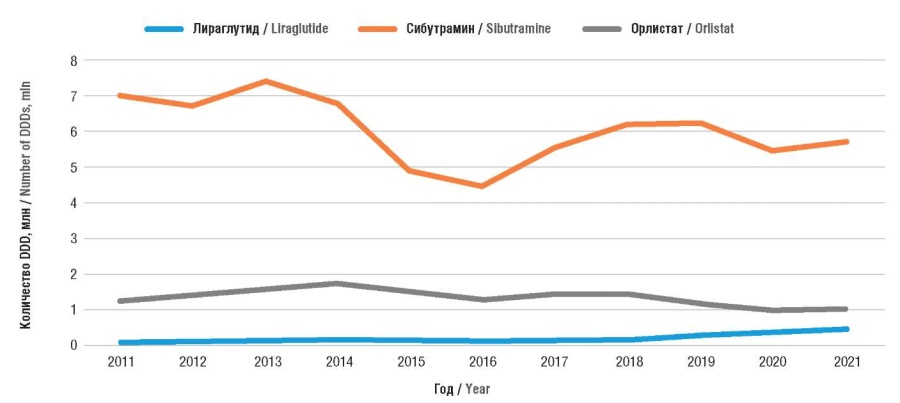
Рисунок 1. Данные о потреблении сибутрамина, лираглутида и орлистата в Российской Федерации в 2011–2021 гг.
DDD (англ. defined daily dose) – установленная суточная доза
Figure 1. Data on consumption of sibutramine, liraglutide and orlistat in the Russian Federation in 2011–2021.
DDDs – defined daily doses
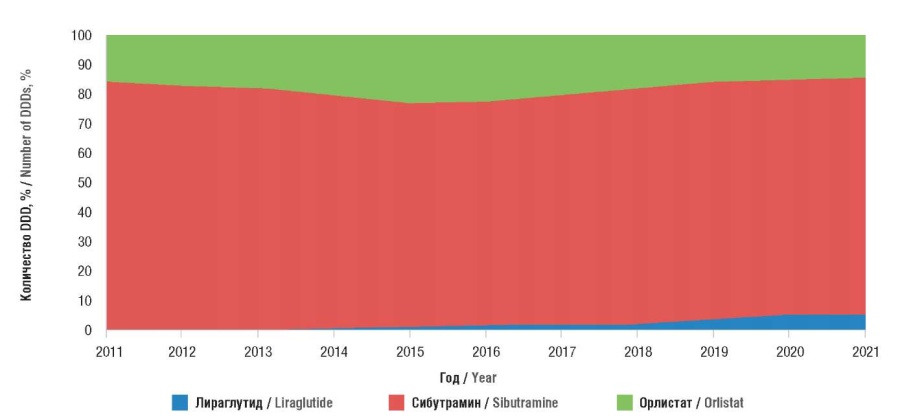
Рисунок 2. Ежегодное распределение закупок сибутрамина, лираглутида и орлистата в Российской Федерации в 2011–2021 гг. DDD (англ. defined daily dose) – установленная суточная доза
Figure 2. Annual distribution of purchases of sibutramine, liraglutide and orlistat in the Russian Federation in 2011–2021. DDDs – defined daily doses
Анализ полученных данных продемонстрировал, что за 10-летний период имеется тенденция к сокращению потребления ЛС для лечения ожирения с 83,03 млн DDD в 2011 г. до 71,7 млн в 2021 г. (см. рис. 1). При этом в структуре потребления на всем протяжении наблюдения доминировал сибутрамин: его доля среди ЛС для лечения ожирения составляла от 76% до 84%. Отмечена некоторая положительная динамика потребления лираглутида (с 1% в 2011 г. до 6% в 2021 г.). Потребление орлистата колебалось в пределах от 14% до 24% с максимальным значением в период 2015–2016 гг. (см. рис. 2).
Соотношение числа зарегистрированных в РФ пациентов с диагнозом «ожирение» и суммарного количества годовых курсов (DDD в год / 365) сибутрамина, орлистата и лираглутида отражено на рисунке 3.
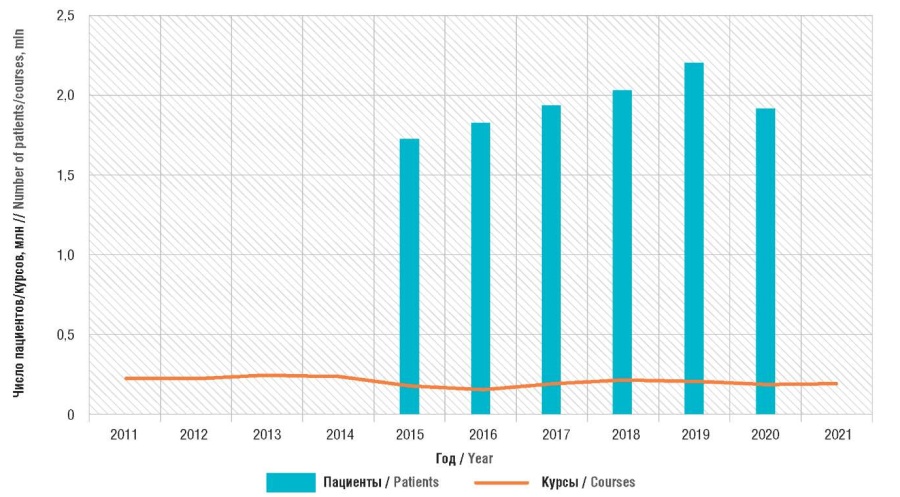
Рисунок 3. Соотношение числа зарегистрированных в Российской Федерации пациентов с диагнозом «ожирение» и суммарного количества годовых курсов сибутрамина, орлистата и лираглутида в 2011–2021 гг.
Figure 3. The ratio of the number of patients registered in the Russian Federation with a diagnosis of obesity and the total number of annual courses of sibutramine, orlistat and liraglutide in 2011–2021
Финансирование закупок всех указанных ЛС осуществлялось из трех источников: личные средства граждан, средства федерального и региональных бюджетов. Динамика затрат с учетом источников финансирования закупок сибутрамина, лираглутида и орлистата представлена на рисунке 4.
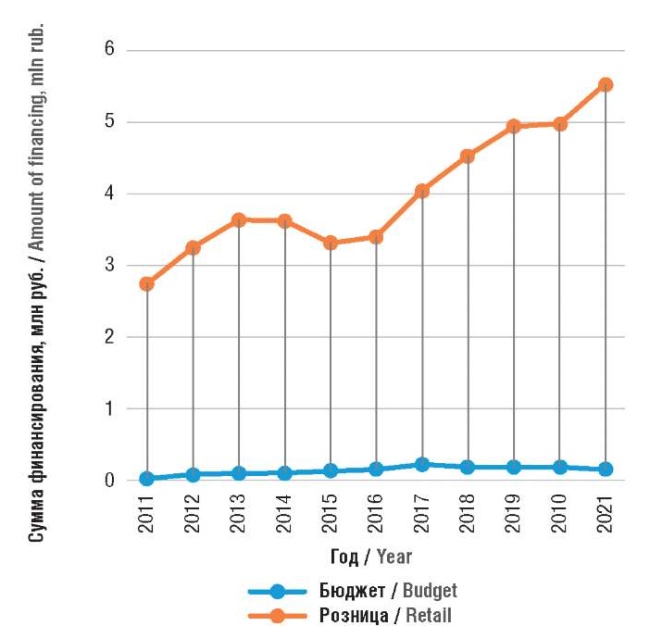
Рисунок 4. Источники финансирования закупок орлистата, лираглутида и сибутрамина в 2011–2021 гг.
Figure 4. Sources of financing for purchases of orlistat, liraglutide and sibutramine in 2011–2021
Доля бюджетных средств, затраченных на приобретение указанных ЛС, составляла от 2% до 5% всех затрат на фармакотерапию (от 16 млн в 2011 г. до 22,5 млн в 2017 г.). Личные расходы пациентов имели тенденцию к росту и многократно превышали затраты федерального и региональных бюджетов: от 2,7 млрд руб. в 2011 г. до 5,5 млрд руб. в 2021 г.
Анализ потребления ЛС также продемонстрировал, что в 2011– 2021 гг. продажи 58–66% DDD были осуществлены в трех регионах: г. Москва, Московская обл. и г. Санкт-Петербург.
ОБСУЖДЕНИЕ / DISCUSSION
В соответствии с доступными данными государственного статистического наблюдения в период 2015–2020 гг. в РФ наблюдался рост числа пациентов с ожирением от 1,7 до 2,1 млн чел. [2]. Ранее 2015 г. сведения о числе лиц с ожирением в рамках статистического наблюдения учитывались совместно с данными о зарегистрированных пациентах с сахарным диабетом (рубрика «Болезни эндокринной системы, расстройства питания, нарушения обмена веществ»). Даже если брать в расчет только пациентов с ожирением, сведения о которых учтены государственной статистикой, согласно полученным данным ежегодно на постоянной основе фармакотерапию получают не более 10% пациентов. В то же время, по результатам эпидемиологического исследования NATION, в 2016 г. доля лиц с ожирением в РФ составила 26,2% [42]. С учетом численности взрослого населения в РФ в 2016 г. (120 185 149 чел.) реальное количество пациентов с ожирением может составлять около 31,5 млн чел., а соответственно, доля лиц, получающих фармакотерапию ожирения в РФ, окажется значительно меньше (примерно 0,5%) [43].
Результаты проведенного исследования демонстрируют общемировую тенденцию, касающуюся низкой частоты проведения фармакотерапии ожирения: только 2% взрослых с ожирением, которым показана фармакотерапия, получают рецепты на эти ЛС от своего лечащего врача [44][45]. Ввиду высокой стигматизации пациентов и заболевания сохраняется ошибочное представление о том, что ожирение в основном связано с недостатком силы воли у человека и является проявлением лени. Таким образом, пациентов считают не заслуживающими надлежащего лечения [46]. Высокая стоимость фармакотерапии, приобретаемой чаще всего на средства больного, является еще одной причиной ограничений в проведении медикаментозного лечения. Вероятно, именно с фактором цены терапии связана преимущественная ее распространенность в г. Москве и г. Санкт-Петербурге.
Важным фактором в принятии решения о выборе варианта фармакотерапии является ее переносимость, а высокая частота НР заметно влияет на приверженность пациентов к лечению [47].
Целью фармакотерапии ожирения является долгосрочное поддержание снижения веса и улучшение общего состояния здоровья. В то же время для ЛС, используемых для лечения ожирения, снижение веса через 1 год терапии составляет от 4% до 8%, а после ее прекращения (максимальная зарегистрированная длительность приема сибутрамина – 1 год, орлистата – 4 года) вес обычно восстанавливается [15].
В сравнении с эффектом бариатрических вмешательств в виде устойчивой потери веса на 13–27% от исходного в течение последующих 10 лет с доказанным снижением смертности и высокой частотой полной ремиссии СД2 клинические эффекты фармакотерапии выглядят весьма скромными [48–50]. Более того, по данным регистра пациентов, подвергшихся бариатрическим вмешательствам, все они ранее уже предпринимали неудачные попытки похудеть с помощью консервативных методов: диеты (87%), лекарственных средств (52%), психотерапии (27%). Причем 49% больных безуспешно применяли как минимум два из указанных способов [51].
На сегодняшний день бариатрическая хирургия остается наиболее эффективным способом достижения значительного снижения веса. Среди часто используемых процедур – классическое желудочное шунтирование по Ру, продольная резекция желудка или бандажирование желудка. Продолжающееся совершенствование методик проведения бариатрических вмешательств привело к улучшению их исходов и сокращению сроков госпитализации (не более 1–2 дней) [52]. Однако, несмотря на то что бариатрическая хирургия является единственным доступным в настоящее время подходом, обеспечивающим устойчивую потерю веса и лечение СД2, применение данного метода ассоциировано со всеми известными рисками оперативных вмешательств [53]. В связи с этим в ряде стран бариатрические вмешательства рекомендованы при ожирении с ИМТ>40 кг/м2 или с ИМТ>35 кг/м2 в сочетании со значительными сопутствующими заболеваниями, требующими немедленного снижения веса [54].
В настоящее время в РФ рестриктивные и мальабсорбтивные операции при СД2 входят в Перечень видов высокотехнологичной медицинской помощи, включенных в базовую программу обязательного медицинского страхования и рекомендованы пациентам с СД2 и морбидным ожирением с ИМТ≥40 кг/м2 [55]. В то же время согласно данным российского регистра бариатрических вмешательств с 2018 по 2022 гг. были прооперированы только 28 020 пациентов, причем доля лиц с ИМТ<40 кг/м2 составила 40% [51]. Учитывая тот факт, что обязательное медицинское страхование не покрывает стоимость таких вмешательств, как минимум 40% больных, подвергшихся бариатрическим вмешательствам, оплачивали их за собственный счет.
Таким образом, в настоящее время в РФ стоимость медикаментозной терапии и практически половины случаев бариатрических вмешательств при ожирении покрывается за счет средств пациентов, в то время как медицинская помощь при осложнениях ожирения (сахарном диабете, инфарктах, инсультах и пр.) оказывается полностью за счет средств системы здравоохранения. Требуются дальнейшие исследования по оценке не только эффективности и безопасности лекарственной терапии и хирургических вмешательств при ожирении, но и экономической целесообразности возмещения их стоимости в условиях российской системы здравоохранения, в т.ч. при применении в более широкой популяции пациентов.
ЗАКЛЮЧЕНИЕ / CONCLUSION
Анализ результатов проведенного исследования позволяет сделать следующие выводы:
- фармакотерапевтические подходы к лечению ожирения в РФ применяются не более чем у 0,5% лиц, которым они показаны;
- за весь период наблюдения (2011–2021 гг.) от 76% до 84% потребляемых объемов ЛС, рекомендованных в РФ в качестве фармакотерапии ожирения, составлял сибутрамин;
- низкая эффективность, высокая стоимость, значительная частота НР, частый набор веса после отмены терапии, а также низкая ориентированность врачей на необходимость проведения фармакотерапии – вероятно, основные факторы, определяющие недостаточную распространенность применения ЛС в лечении ожирения;
- требуется проведение клинико-экономических исследований по оценке экономической эффективности использования различных вариантов лекарственной терапии и бариатрических вмешательств при ожирении в условиях российской системы здравоохранения.
Список литературы
1. Всемирная организация здравоохранения. Ожирение и избыточный вес. URL: https://www.who.int/ru/news-room/fact-sheets/detail/obesity-and-overweight (дата обращения 16.04.2022).
2. Здравоохранение в России 2021. URL: https://rosstat.gov.ru/folder/210/document/13218 (дата обращения 16.04.2022).
3. Wilson P., D’Agostino R., Sullivan L., et al. Overweight and obesity as determinants of cardiovascular risk: the Framingham experience. Arch Intern Med. 2002; 162 (16): 1867–72. https://doi.org/10.1001/archinte.162.16.1867.
4. Poirier P., Giles T., Bray G., et al. Obesity and cardiovascular disease: pathophysiology, evaluation, and effect of weight loss: an update of the 1997 American Heart Association Scientific Statement on Obesity and Heart Disease from the Obesity Committee of the Council on Nutrition, Physical Activity, and Metabolism. Circulation. 2006; 113 (6): 898– 918. https://doi.org/10.1161/CIRCULATIONAHA.106.171016.
5. Manninen P., Riihimäki H., Heliövaara M., Mäkelä P. Overweight, gender, and knee osteoarthritis. Int J Obes Relat Metab Disord. 1996; 20 (6): 595–7.
6. Ferini-Strambi L., Fantini M.L., Castronovo C. Epidemiology of obstructive sleep apnea syndrome. Minerva Med. 2004; 95 (3): 187–202.
7. Basen-Engquist K., Chang M. Obesity and cancer risk: recent review and evidence. Curr Oncol Rep. 2011; 13 (1): 71–6. https://doi.org/10.1007/s11912-010-0139-7.
8. Tremmel M., Gerdtham U.G., Nilsson P.M., Saha S. Economic burden of obesity: a systematic literature review. Int J Environ Res Public Health. 2017; 14 (4): 435. https://doi.org/10.3390/ijerph14040435.
9. Puhl R., Heuer C. The stigma of obesity: a review and update. Obesity (Silver Spring). 2009; 17 (5): 941–64. https://doi.org/10.1038/oby.2008.636.
10. Colman E. Food and Drug Administration's Obesity Drug Guidance Document: a short history. Circulation. 2012; 125 (17): 2156–64. https://doi.org/10.1161/CIRCULATIONAHA.111.028381.
11. Astrup A. Drug management of obesity – efficacy versus safety. N Engl J Med. 2010; 363 (3): 288–90. https://doi.org/10.1056/NEJMe1004076.
12. Adan R.A. Mechanisms underlying current and future anti-obesity drugs. Trends Neurosci. 2013; 36 (2): 133–40. https://doi.org/10.1016/j.tins.2012.12.001.
13. Ожирение. Клинические рекомендации. 2020 г. URL: https://edu.endocrincentr.ru/sites/default/files/recommendation_pdf/kr28.pdf (дата обращения 16.04.2022).
14. Распоряжение Правительства РФ от 23.12.2021 № 3781-р. URL: http://publication.pravo.gov.ru/Document/View/0001202112290013 (дата обращения 16.04.2022).
15. Khera R., Murad M.H., Chandar A.K., et al. Association of pharmacological treatments for obesity with weight loss and adverse events: a systematic review and meta-analysis. JAMA. 2016; 315 (22): 2424–34. https://doi.org/10.1001/jama.2016.7602.
16. Nelson D.L., Gehlert D.R. Central nervous system biogenic amine targets for control of appetite and energy expenditure. Endocrine. 2016; 29 (1): 49–60. https://doi.org/10.1385/endo:29:1:49.
17. McMahon F.G., Fujioka K., Singh B.N., et al. Efficacy and safety of sibutramine in obese white and African American patients with hypertension: a 1-year, double-blind, placebo-controlled, multicenter trial. Arch Intern Med. 2000; 160 (14): 2185–91. https://doi.org/10.1001/archinte.160.14.2185.
18. Smith I.G., Goulder M.A. Randomized placebo-controlled trial of long-term treatment with sibutramine in mild to moderate obesity. J Fam Pract. 2001; 50 (6): 505–12.
19. Fujioka K., Seaton T.B., Rowe E., et al. Weight loss with sibutramine improves glycaemic control and other metabolic parameters in obese patients with type 2 diabetes mellitus. Diabetes Obes Metab. 2000; 2 (3): 175–87. https://doi.org/10.1046/j.1463-1326.2000.00081.x.
20. Jame W., Caterson I., Coutinho W., et al. Effect of sibutramine on cardiovascular outcomes in overweight and obese subjects. N Engl J Med. 2010; 363 (10): 905–17. https://doi.org/10.1056/NEJMoa1003114.
21. Kang J.G., Park C.Y. Anti-obesity drugs: a review about their effects and safety. Diabetes Metab J. 2012; 36 (1): 13–25. https://doi.org/10.4093/dmj.2012.36.1.13.
22. Drent M.L., Larsson I., William-Olsson T., et al. Orlistat (Ro 180647), a lipase inhibitor, in the treatment of human obesity: a multiple dose study. Int J Obes Relat Metab Disord. 1995; 19 (4): 221–6.
23. Davidson M.H., Hauptman J., DiGirolamo M., et al. Weight control and risk factor reduction in obese subjects treated for 2 years with orlistat: a randomized controlled trial. JAMA. 1999; 281 (3): 235–42. https://doi.org/10.1001/jama.281.3.235.
24. Hollander P.A., Elbein S.C., Hirsch I.B., et al. Role of orlistat in the treatment of obese patients with type 2 diabetes. 1-year randomized double-blind study. Diabetes Care. 1998; 21 (8): 1288–94. https://doi.org/10.2337/diacare.21.8.1288.
25. Zelber-Sagi S., Kessler A., Brazowsky E., et al. A double-blind randomized placebo-controlled trial of orlistat for the treatment of nonalcoholic fatty liver disease. Clin Gastroenterol Hepatol. 2006; 4 (5): 639–44. https://doi.org/10.1016/j.cgh.2006.02.004.
26. McDuffie J.R., Calis K.A., Booth S.L., et al. Effects of orlistat on fat soluble vitamins in obese adolescents. Pharmacotherapy. 2002; 22 (7): 814–22. https://doi.org/10.1592/phco.22.11.814.33627.
27. Drucker D.J. The biology of incretin hormones. Cell Metab. 2006; 3 (3): 153–65. https://doi.org/10.1016/j.cmet.2006.01.004.
28. Sisley S., Gutierrez-Aguilar R., Scott M., et al. Neuronal GLP1R mediates liraglutide’s anorectic but not glucose-lowering effect. J Clin Invest. 2014; 124 (6): 2456–63. https://doi.org/10.1172/JCI72434.
29. Prigeon R.L., Quddusi S., Paty B., D’Alessio D.A. Suppression of glucose production by GLP-1 independent of islet hormones: a novel extrapancreatic effect. Am J Physiol Endocrinol Metab. 2003; 285 (4): E701–7. https://doi.org/10.1152/ajpendo.00024.2003.
30. González N., Acitores A., Sancho V., et al. Effect of GLP-1 on glucose transport and its cell signalling in human myocytes. Regul Pept. 2005; 126 (3): 203–11. https://doi.org/10.1016/j.regpep.2004.10.002.
31. Willms B., Werner J., Holst J.J., et al. Gastric emptying, glucose responses, and insulin secretion after a liquid test meal: effects of exogenous glucagon-like peptide-1 (GLP-1)-(7-36) amide in type 2 (noninsulin-dependent) diabetic patients. J Clin Endocrinol Metab. 1996; 81 (1): 327–32. https://doi.org/10.1210/jcem.81.1.8550773.
32. Timmers L., Henriques J.P., de Kleijn D.P., et al. Exenatide reduces infarct size and improves cardiac function in a porcine model of ischemia and reperfusion injury. J Am Coll Cardiol. 2009; 53 (6): 501– 10. https://doi.org/10.1016/j.jacc.2008.10.033.
33. Hui H., Farilla L., Merkel P., Perfetti R. The short half-life of glucagon-like peptide-1 in plasma does not reflect its long-lasting beneficial effects. Eur J Endocrinol. 2002; 146 (6): 863–9. https://doi.org/10.1530/eje.0.1460863.
34. Agersø H., Jensen L.B., Elbrønd B., et al. The pharmacokinetics, pharmacodynamics, safety and tolerability of NN2211, a new longacting GLP-1 derivative, in healthy men. Diabetologia. 2002; 45 (2): 195–202. https://doi.org/10.1007/s00125-001-0719-z.
35. Degn K.B., Juhl C.B., Sturis J., et al. One week’s treatment with the long-acting glucagon-like peptide 1 derivative liraglutide (NN2211) markedly improves 24-h glycemia and alphaand beta-cell function and reduces endogenous glucose release in patients with type 2 diabetes. Diabetes. 2004; 53 (5): 1187–94. https://doi.org/10.2337/diabetes.53.5.1187.
36. Vilsbøll T., Zdravkovic M., Le-Thi T., et al. Liraglutide, a long-acting human glucagon-like peptide-1 analog, given as monotherapy significantly improves glycemic control and lowers body weight without risk of hypoglycemia in patients with type 2 diabetes. Diabetes Care. 2007; 30 (6): 1608–10. https://doi.org/10.2337/dc06-2593.
37. Bettge K., Kahle M., Abd El Aziz M.S., et al. Occurrence of nausea, vomiting and diarrhoea reported as adverse events in clinical trials studying glucagon-like peptide-1 receptor agonists: a systematic analysis of published clinical trials. Diabetes Obes Metab. 2017; 19 (3): 336–47. https://doi.org/10.1111/dom.12824.
38. Pi-Sunyer X., Astrup A., Fujioka K., et al. A randomized, controlled trial of 3.0 mg of liraglutide in weight management. N Engl J Med. 2015; 373 (1): 11–22. https://doi.org/10.1056/NEJMoa1411892.
39. IQVIA Россия и СНГ. URL: https://www.iqvia.com/ru-ru/locations/russia (дата обращения 16.04.2022).
40. WHO Collaborating Centre for Drug Statistics Methodology. ATC/ DDD Index 2018. URL: https://www.whocc.no/atc_ddd_index/ (дата обращения 16.04.2022).
41. WHO Collaborating Centre for Drug Statistics Methodology. Guidelines for ATC classification and DDD assignment. 2022. URL: https://www.whocc.no/filearchive/publications/2022_guidelines_web.pdf (дата обращения 16.04.2022).
42. Дедов И.И., Шестакова М.В., Галстян Г.Р. Распространенность сахарного диабета 2 типа у взрослого населения России (исследование NATION). Сахарный диабет. 2016; 19 (2): 104–12. https://doi.org/10.14341/DM2004116-17.
43. Федеральная служба государственной статистики. Численность населения Российской Федерации по полу и возрасту на 1 января 2016 года. URL: https://gks.ru/bgd/regl/B16_111/Main.htm (дата обращения 16.04.2022).
44. Xia Y., Kelton C.M., Guo J.J., et al. Treatment of obesity: pharmacotherapy trends in the United States from 1999 to 2010. Obesity (Silver Spring). 2015; 23 (8): 1721–8. https://doi.org/10.1002/oby.21136.
45. Thomas C.E., Mauer E.A., Shukla A.P., et al. Low adoption of weight loss medications: a comparison of prescribing patterns of antiobesity pharmacotherapies and SGLT2s. Obesity (Silver Spring). 2016; 24 (9): 1955–61. https://doi.org/10.1002/oby.21533.
46. Colbert J.A., Jangi S. Training physicians to manage obesity – back to the drawing board. N Engl J Med. 2013; 369 (15): 1389–91. https://doi.org/10.1056/NEJMp1306460.
47. Jensen M.D., Ryan D.H., Apovian C.M., et al. 2013 AHA/ACC/TOS guideline for the management of overweight and obesity in adults: a report of the American College of Cardiology/American Heart Association Task Force on Practice Guidelines and The Obesity Society. Circulation. 2014; 129 (25 Suppl. 2): S102–38. https://doi.org/10.1161/01.cir.0000437739.71477.ee.
48. Sjöström L., Lindroos A.K., Peltonen M., et al. Lifestyle, diabetes, and cardiovascular risk factors 10 years after bariatric surgery. N Engl J Med. 2004; 351 (26): 2683–93. https://doi.org/10.1056/NEJMoa035622.
49. Pories W.J., Swanson M.S., MacDonald K.G., et al. Who would have thought it? An operation proves to be the most effective therapy for adult-onset diabetes mellitus. Ann Surg. 1995; 222 (3): 339–52. https://doi.org/10.1097/00000658-199509000-00011.
50. Carlsson L.M., Peltonen M., Ahlin S., et al. Bariatric surgery and prevention of type 2 diabetes in Swedish obese subjects. N Engl J Med. 2012; 367 (8): 695–704. https://doi.org/10.1056/NEJMoa1112082.
51. Российский национальный бариатрический реестр. URL: https://bareoreg.ru/ (дата обращения 16.04.2022).
52. Robinson M.K. Surgical treatment of obesity – weighing the facts. N Engl J Med. 2009; 361 (5): 520–1. https://doi.org/10.1056/NEJMe0904837.
53. Marcotte E., Chand B. Management and prevention of surgical and nutritional complications after bariatric surgery. Surg Clin North Am. 2016; 96 (4): 843–56. https://doi.org/10.1016/j.suc.2016.03.006.
54. Shikora S.A., Kruger R.S. Jr., Blackburn G.L. Best practices in policy and access (coding and reimbursement) for weight loss surgery. Obesity (Silver Spring). 2009; 17 (5): 918–23. https://doi.org/10.1038/oby.2008.573.
55. Постановление Правительства РФ от 28.12.2021 № 2505 «О Программе государственных гарантий бесплатного оказания гражданам медицинской помощи на 2022 год и на плановый период 2023 и 2024 годов». URL: https://base.garant.ru/403335795/ (дата обращения 16.04.2022).
Об авторах
В. В. СтрижелецкийРоссия
Стрижелецкий Валерий Викторович – доктор медицинских наук, профессор кафедры факультетской хирургии медицинского факультета Санкт-Петербургский ГУ, главный врач СПб ГБУЗ «Городская больница Святого Великомученика Георгия; WoS ResearcherID: G-6004-2015; РИНЦ SPIN-код: 9802-2920.
Университетская наб., д. 7–9, Санкт-Петербург 199034; Северный пр-т, д. 1, Санкт-Петербург 194354
Ю. М. Гомон
Россия
фармакологии и доказательной медицины Первый Санкт-Петербургский ГМУ им. академика И.П. Павлова» Минздрава России, врач – клинический фармаколог СПб ГБУЗ ГБ Святого Великомученика Георгия; WoS ResearcherID: O-9443-2018; Scopus Author ID: 57217520417; РИНЦ SPIN-код: 1839-9558.
Северный пр-т, д. 1, Санкт-Петербург 194354; ул. Льва Толстого, д. 6-8, Санкт-Петербург 197022
Е. А. Спичакова
Россия
Спичакова Ева Александровна – врач-хирург Городского центра инновационных медицинских технологий.
Северный пр-т, д. 1, Санкт-Петербург 194354
А. С. Колбин
Россия
Колбин Алексей Сергеевич – доктор медицинских наук, профессор кафедры фармакологии медицинского факультета Санкт-Петербургский ГУ, заведующий кафедрой клинической фармакологии и доказательной медицины ФГБОУ ВО Первый Санкт-Петербургский ГМУ им. академика И.П. Павлова. WoS ResearcherID: G-5537-2015; Scopus Author ID: 19836020100; РИНЦ SPIN-код: 7966-0845.
Университетская наб., д. 7–9, Санкт-Петербург 199034; ул. Льва Толстого, д. 6-8, Санкт-Петербург 197022
А. А. Каляпин
Россия
Каляпин Антон Андреевич – заместитель директора по продажам и связям с поставщиками компании.
Ленинградский пр-т, д. 37А, корп. 14, Москва 125167
С. А. Макаров
Россия
Макаров Сергей Анатольевич – кандидат медицинских наук, руководитель Городского центра инновационных медицинских технологий.
Северный пр-т, д. 1, Санкт-Петербург 194354
А. Б. Ломия
Россия
Ломия Александр Бадриевич – врач-хирург Городского центра инновационных медицинских технологий.
Северный пр-т, д. 1, Санкт-Петербург 194354
Ф. М. Султанова
Россия
Султанова Флора Миргалимовна – врач-хирург, координатор учебного центра Российского общества эндоскопических хирургов.
Северный пр-т, д. 1, Санкт-Петербург 194354
Рецензия
Для цитирования:
Стрижелецкий В.В., Гомон Ю.М., Спичакова Е.А., Колбин А.С., Каляпин А.А., Макаров С.А., Ломия А.Б., Султанова Ф.М. Лекарственная терапия ожирения в Российской Федерации: фармакоэпидемиологическое исследование. ФАРМАКОЭКОНОМИКА. Современная фармакоэкономика и фармакоэпидемиология. 2022;15(3):320-331. https://doi.org/10.17749/2070-4909/farmakoekonomika.2022.149
For citation:
Strizheletsky V.V., Gomon Yu.М., Spichakova Е.А., Kolbin А.S., Kalyapin А.А., Makarov S.А., Lomiya А.B., Sultanova F.М. Drug therapy for obesity in the Russian Federation: pharmacoepidemiological study. FARMAKOEKONOMIKA. Modern Pharmacoeconomics and Pharmacoepidemiology. 2022;15(3):320-331. (In Russ.) https://doi.org/10.17749/2070-4909/farmakoekonomika.2022.149

Контент доступен под лицензией Creative Commons Attribution-NonCommercial-ShareAlike 4.0 International License.






































