Перейти к:
Биофизическое моделирование указывает на высокое сродство этиловых эфиров омега-3 полиненасыщенных жирных кислот к ферментам провоспалительного каскада арахидоновой кислоты
https://doi.org/10.17749/2070-4909/farmakoekonomika.2022.142
Аннотация
Актуальность. Омега-3 полиненасыщенные жирные кислоты (ω-3 ПНЖК) широко используются в современной кардиологии. Противовоспалительный эффект эйкозапентаеновой кислоты (ЭПК) и докозагексаеновой кислоты (ДГК) осуществляется, в частности, за счет модуляции активности каскада арахидоновой кислоты (АРК).
Цель: провести биофизический анализ взаимодействий различных форм ПНЖК (АРК, ЭПК, ДГК, этиловые эфиры ЭПК и ДГК) с тремя таргетными белками – ферментами каскада АРК (циклооксигеназа-1 (ЦОГ-1), ЦОГ-2, 5-липоксигеназа (5-ЛПОГ)).
Материал и методы. Минимизацию энергии комплексов «лиганд–рецептор» при различных начальных расположениях молекулы относительно кармана рецептора и молекулярные энергетические профили белка (энергии переноса боковой цепи из растворителя в белок) вычисляли посредством пакета ECMMS.
Результаты. Этиловые эфиры ЭПК и ДГК характеризовались значительно бо́льшими абсолютными значениями энергий специфического связывания таргетных белков, чем АРК или просто ЭПК/ДГК. Например, в случае ЦОГ-2 ЭПК, ДГК и этиловый эфир ЭПК имели близкие значения ∆∆G (–3,0...–3,1 ккал/моль), в то время как комплекс ЦОГ-2 с этиловым эфиром ДГК был несколько более стабилен (∆∆G = –3,4 ккал/моль). В случае фермента 5-ЛПОГ наиболее стабильным был комплекс с этиловым эфиром ЭПК (∆∆G = –1,62 ккал/моль). Более высокие абсолютные значения энергий связывания указывают на более высокое сродство этиловых эфиров ЭПК и ДГК к ферментам каскада АРК.
Заключение. Полученные результаты позволяют предположить, что высокое сродство этиловых эфиров ЭПК и ДГК к таргетным белкам каскада АРК является одной из молекулярных основ терапевтической эффективности препаратов ω-3 ПНЖК с высокой степенью стандартизации.
Ключевые слова
Для цитирования:
Торшин И.Ю., Громова О.А. Биофизическое моделирование указывает на высокое сродство этиловых эфиров омега-3 полиненасыщенных жирных кислот к ферментам провоспалительного каскада арахидоновой кислоты. ФАРМАКОЭКОНОМИКА. Современная фармакоэкономика и фармакоэпидемиология. 2022;15(2):221-229. https://doi.org/10.17749/2070-4909/farmakoekonomika.2022.142
For citation:
Torshin I.Yu., Gromova O.A. Biophysical modeling indicates a high affinity of ethyl esters of omega-3 polyunsaturated fatty acids to the enzymes of the pro-inflammatory arachidonic acid cascade. FARMAKOEKONOMIKA. Modern Pharmacoeconomics and Pharmacoepidemiology. 2022;15(2):221-229. (In Russ.) https://doi.org/10.17749/2070-4909/farmakoekonomika.2022.142
ВВЕДЕНИЕ / INTRODUCTION
Увеличение потребления омега-3 полиненасыщенных жирных кислот (ω-3 ПНЖК) достоверно ассоциировано с дозозависимым снижением смертности от всех причин [1]. Детальный аудит доказательных публикаций по ω-3 ПНЖК, проведенный посредством современных математических методов анализа больших данных [2], подтвердил существование обширной клинической базы, указывающей на обоснованность использования стандартизированных препаратов на основе ω-3 ПНЖК для снижения сердечно-сосудистой смертности.
Аудит доказательных публикаций [2] указал на необходимость изучения количественного состава препаратов на основе ω-3 ПНЖК. Сравнительное исследование состава 10 образцов ω-3 ПНЖК с хроматографическим определением более 40 метаболитов жирных кислот и других соединений позволило разработать количественные маркеры для идентификации более стандартизированных образцов ω-3 ПНЖК – «эйкозапентаеновая кислота (ЭПК) + докозагексаеновая кислота (ДГК)», «ω-6 + ω-11», коэффициент стандартизации и др. [3].
Анализ количественного и качественного состава фармацевтических образцов ω-3 ПНЖК показал, что в них входят разные формы ω-3 ПНЖК (триглицериды, карбоновые кислоты, этиловые эфиры) (рис. 1, а). Каждая из этих форм имеет химические особенности, отражающиеся на их фармакологических свойствах. Молекулы триглицеридов (сложные эфиры с глицерином) достаточно громоздки: остаток глицерина – многоато́мный спирт, он включает три гидроксильные (-ОН) группы (рис. 1, b). Для взаимодействия с таргетными белками триглицериды должны предварительно гидролизоваться до свободных ПНЖК, что неизбежно сказывается на фармакокинетике образцов ω-3 ПНЖК, содержащих триглицериды.
Свободные ПНЖК, как правило, представлены в организме в диссоциированной форме и характеризуются отрицательным зарядом в карбоксильной группе (-СОО–). Заряд карбоксила меняется в зависимости от рН и может воспрепятствовать взаимодействию с таргетными белками. Этиловые эфиры, в отличие от триглицеридов, могут взаимодействовать с таргетными белками без предварительного гидролиза эфира до ПНЖК и спирта (см. рис. 1, b). В отличие от свободных жирных кислот в этиловых эфирах ω-3 ПНЖК некомпенсированный отрицательный заряд карбоксильной группы отсутствует.
Приведенные выше аргументы носят качественный характер, так что их следует дополнить количественными оценками взаимодействия рассматриваемых молекул с таргетными белками. Как известно, ω-3 ПНЖК характеризуются значительными противовоспалительными и вазодилаторными свойствами в связи с их влиянием на метаболизм простагландинов через каскад арахидоновой кислоты (АРК) [4]. В ходе биотрансформаций в каскаде АРК ПНЖК трансформируются циклооксигеназами (ЦОГ) в простаноиды (простагландины, простациклины, тромбоксаны), а посредством липоксигеназ (ЛПОГ) – в лейкотриены. В отличие от АРК ω-3 ПНЖК и их производные проявляют гораздо меньшее провоспалительное действие – наоборот, предотвращают синтез провоспалительных простаноидов [5][6] и способствуют синтезу противовоспалительных [7], нейропротекторных [8] и вазодилаторных простаноидов [9]. Более того, ω-3 ПНЖК необходимы для биосинтеза медиаторов разрешения воспаления – резолвинов, нейропротектинов, маресинов и др. [10].
Как видно из приведенного выше краткого экскурса в биохимию ω-3 ПНЖК, наиболее важными белками – рецепторами ω-3 ПНЖК являются ЦОГ и ЛПОГ. Взаимодействия различных форм ω-3 ПНЖК перспективно исследовать именно с этими ферментами. Расчет значений энергий взаимодействия исследуемых таргетных молекул с вышеупомянутыми таргетными белками ранее не проводился. Оценка сродства различных форм ПНЖК к этим таргетным белкам позволяет выявить те формы ω-3, от которых следует ожидать наибольшего терапевтическего эффекта.
Цель – провести биофизический анализ взаимодействий различных форм ПНЖК (АРК, ЭПК, ДГК, этиловые эфиры ЭПК и ДГК) с тремя таргетными белками – ферментами каскада АРК (ЦОГ-1, ЦОГ-2, 5-ЛПОГ).
МАТЕРИАЛ И МЕТОДЫ / MATERIAL AND METHODS
Исследование проводилось современными методами биофизического моделирования и биоинформатики, включающими расчет энергий взаимодействий в комплексах «молекула–рецептор».
Химические структуры исследованных ПНЖК приведены на рисунке 1. Выбор молекул для исследования очевиден: АРК – основной субстрат каскада АРК, ЭПК и ДГК – формы «морских» ω-3 ПНЖК с наибольшей базой клинико эпидемиологических исследований. Этиловые эфиры ДГК и ЭПК – действующие начала препарата ω-3 ПНЖК, который характеризуется наибольшей доказательной базой среди препаратов ω-3 ПНЖК.
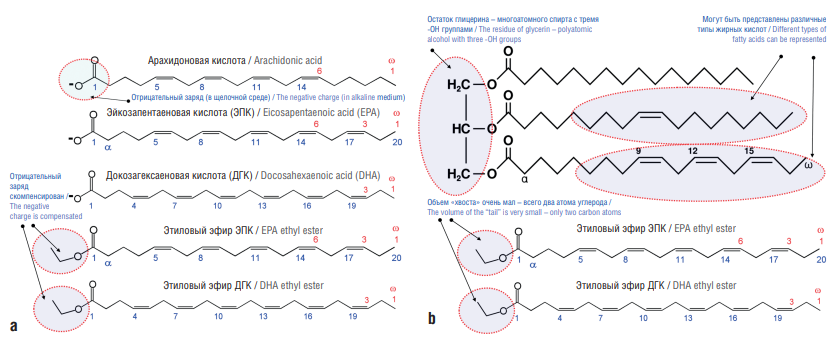
Рисунок 1. Полиненасыщенные жирные кислоты и их производные, изученные в настоящем исследовании:
а – химические структуры; b – сравнение структур триглицеридов и этиловых эфиров
Figure 1. The studied polyunsaturated fatty acids and their derivatives:
a – chemical structures; b – comparison of the structures of triglycerides and ethyl esters
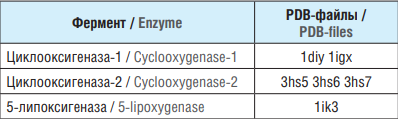
В работе исследовались взаимодействия этих ПНЖК с ЦОГ-1, ЦОГ-2 и 5-ЛПОГ. Модели пространственных структур указанных ферментов были приготовлены на основе структур, имеющихся в базе данных Protein Data Bank (PDB)1, содержащей все известные к настоящему времени структуры белков, определенные посредством диффракционных экспериментов или ядерного магнитного резонанса (табл. 1). Структуры из PDB были отобраны с учетом: 1) наличия в соответствующих файлах информации о сайтах связывания лигандов (жирных кислот и коферментов); 2) качества эксперимента по установлению пространственной структуры. В случае ЦОГ коферментами являлись протопорфирин с ионом кобальта, а в случае 5-ЛПОГ – ион трехвалентного железа.
Таблица 1. Использованные в исследовании файлы базы данных Protein Data Bank (PDB) по пространственным структурам ферментов каскада арахидоновой кислоты
Table 1. The Protein Data Bank (PDB) database files on the spatial structures of enzymes of the arachidonic acid cascade used in thе study
На основе отобранных из базы данных PDB-файлов были приготовлены модели структур ферментов человека (методика описана в [11]). Затем были исследованы возможности размещения молекул ω-3 ПНЖК в связывающих карманах ферментов. Для этого проводилась минимизация энергии комплексов «лиганд– рецептор» при различных начальных расположениях молекулы относительно кармана рецептора.
Метод молекулярных энергетических профилей / The method of molecular energy profiles
В данной работе для анализа структур комплексов ферментов с ПНЖК использовался метод молекулярных энергетических профилей. Молекулярные энергетические профили являются новой концепцией в биоинформатике и биофизике белка. Они используются для определения аминокислотных остатков в структуре белка, которые обладают экстремальными (наиболее высокими или наиболее низкими) значениями энергии переноса боковой цепи из растворителя в белок (ΔGост). Остатки с экстремальными значениями ΔGост часто являются наиболее важными для реализации биологических функций белка [11].
Молекулярные энергетические профили представляет собой список значений ΔGост для каждого остатка в белке. Список упорядочен в соответствии с порядковыми номерами остатков в аминокислотной последовательности белка-рецептора. Для заданной трехмерной структуры белка значения ΔGост рассчитываются с использованием методов классической молекулярной механики. Процедура расчета состоит из двух этапов: минимизации энергии молекулярной системы и собственно расчета ΔGост. Ниже приводится детальное описание этого вычислительного метода.
Минимизация энергии
Минимизация полной энергии осуществлялась посредством алгоритмической комбинации, которая включает перемежающиеся стадии минимизации энергии посредством конъюгированных градиентов и коротких периодов молекулярной динамики. Подобного рода комбинация (названная «интерактивной оптимизацией») позволяет избежать «застревания» системы в локальных минимумах. Интерактивная оптимизация является итеративной процедурой. Один цикл минимизации состоит из 50...200 шагов минимизации конъюгированных градиентов, за которой следует 100...1000 фемтосекунд молекулярной динамики. Применение метода конъюгированных градиентов в молекулярной механике заключается в смещении каждого атома в направлении действующих на этот атом сил. Для молекулы из N атомов сила, действующая на каждый атом, определяется как:

где Uполн – полная внутренняя энергия молекулярной системы, j = 1...N.
Для i-го шага минимизации по конъюгированным градиентам новые координаты каждого атома определяются как:
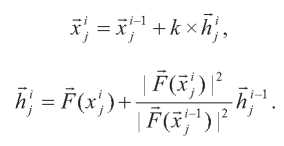
Uполн молекулярной системы, содержащей N атомов, B ковалентных связей (связывающих термов), A угловых термов и T торсионных термов, определяется как
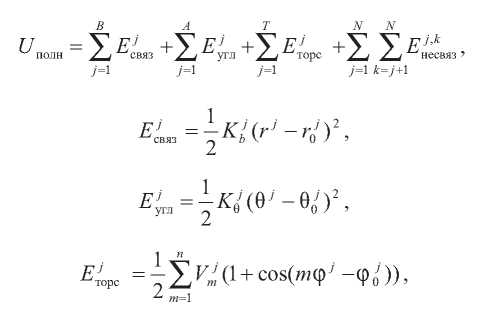
где Ejсвяз – терм энергии j-й ковалентной связи; Ejугл – терм энергии j-го углового изгиба двух ковалентных связей; Ejторс – терм энергии вращения j-го диэдрального угла.
Терм несвязывающих взаимодействий определяется как сумма электростатического и Вандерваальсового термов:
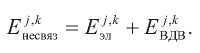
Электростатические взаимодействия описываются законом Кулона:
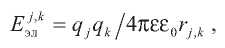
а Вандерваальсовы – посредством потенциала Леннарда–Джонса:
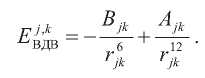
Силовые константы Kb, Kθ, Vm, равновесные значения связей и углов r0, θ0, φ0, а также константы Ajk, Bjk определены в соответствии с потенциалом UFF. Значения частичных атомных зарядов qj, qk определены на основе потенциала AMBER при составлении которого использовались квантово-механические расчеты. Вычисления проводили посредством пакета ECMMS [10].
Молекулярная динамика
Процедура молекулярной динамики основана на втором законе Ньютона
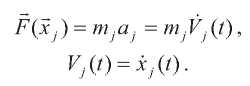
Значения ускорений aj индивидуальных атомов находятся на основе Uполн (см. выше), а затем численно интегрируются с использованием алгоритма Верле. Скорости и координаты в следующий момент времени t + Δt:
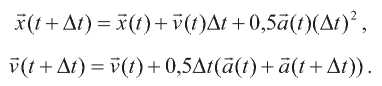
Начальные скорости атомов были рандомизированы в соответствии с распределением Максвелла:
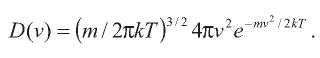
Температура системы фиксировалась в соответствии с равенством:

Для расчетов использовались T = 300K и ε = 1.
Расчет энергий переноса
Расчеты энергий переноса боковой цепи из растворителя в белок (ΔGост) проводили на основе несвязывающего потенциала, определяемого на основании вышеприведенных уравнений молекулярной механики и терма энергии сольватации. Таким образом, ΔGост i-го аминокислотного остатка, состоящего из k атомов:
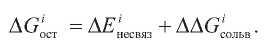
В данном случае ΔEiнесвяз представляет собой разность между несвязывающей энергией взаимодействия атомов аминокислотного остатка со всеми атомами белка и энергией взаимодействия атомов внутри аминокислотного остатка:
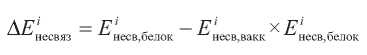
и определяется как:
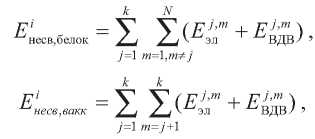
где j = 1...k соответствует суммированию по атомам i-го аминокислотного остатка [10].
ΔΔGiсольв вычислялась как разность между термами сольватации внутри и вне белка:
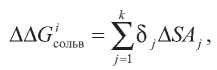
где δj– атомный сольватационный параметр, полученный на основании экспериментов по определению LogP в системе «октанол– вода», a ΔSAj– изменение доступности поверхности растворителю при переносе остатка из вакуума в белок.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ / RESULTS AND DISCUSSION
Получены полноатомные пространственные структуры комплексов исследованных молекул с таргетными белками. Затем проведен расчет энергий связывания и измерены молекулярные энергетические профили. В последующих разделах полученные результаты расчетов предваряются краткими введениями по биологии соответствующих ферментов.
Основным параметром, позволяющим оценить сродство той или иной молекулы к определенному белку-рецептору, является ∆∆G – изменение свободной энергии (∆G) образования комплекса «молекула–рецептор» минус изменение свободной энергии молекулы рецептора при отсутствии связанного лиганда. Для стабильных комплексов значения ∆∆G отрицательны. Чем меньше значение ∆∆G (т.е. чем больше абсолютное значение ∆∆G), тем больше стабильность комплекса и тем выше сродство соответствующего лиганда к таргетному белку.
Результаты расчетов ∆∆G комплексов «лиганд–белок» / Results of calculations of ligand-protein complexes ∆∆G
В таблице 2 и на рисунке 2 суммированы результаты расчетов ∆∆G по всем вычислительным экспериментам, проведенным в ходе исследования. Как видно из расчета энергий связывания, ω-3 ПНЖК и их производные характеризовались бóльшими по сравнению с АРК абсолютными значениями энергий связывания ∆∆G с белками-рецепторами.
Таблица 2. Энергии связывания исследованных молекул полиненасыщенных жирных кислот с ферментами каскада арахидоновой кислоты, ккал/моль
Table 2. Binding energies of the studied polyunsaturated fatty acids molecules with enzymes of the arachidonic acid cascade, kcal/mol
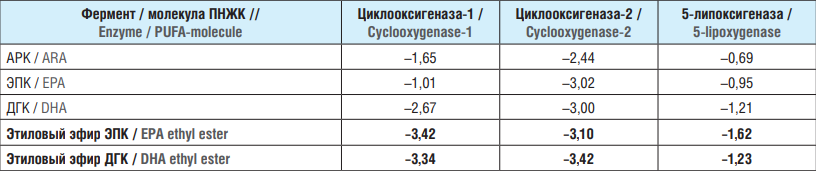
Примечание. ПНЖТ – полиненасыщенная жирная кислота; АРК – арахидоновая кислота; ЭПК – эйкозапентаеновая кислота; ДГК – докозагексаеновая кислота. Расчет был проведен на основе приготовленных моделей комплексов «ПНЖК–белок». Приведены значения относительных энергий образования комплекса «молекула–рецептор». Жирным шрифтом выделены молекулы с наименьшими значениями энергий связывания (т.е. с наибольшим сродством к таргетным белкам).
Note. PUFA – polyunsaturated fatty acid; ARA – arachidonic acid; EPA – eicosapentaenoic acid; DHA – docosahexaenoic acid. The calculation was carried out on the basis of the prepared models of PUFA-protein complexes. Values of relative energies of formation of the molecule-receptor complex are given. Molecules with the lowest binding energies (i.e., with the highest affinity to target proteins) are highlighted in bold.
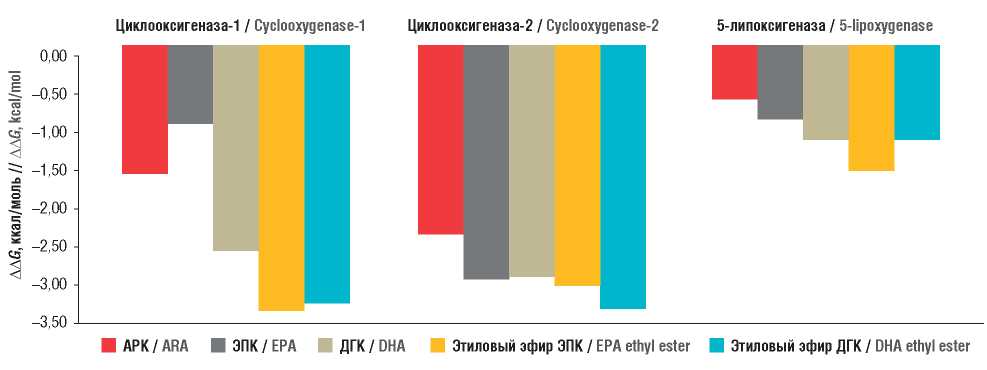
Рисунок 2. Энергии связывания исследованных молекул полиненасыщенных жирных кислот с ферментами каскада арахидоновой кислоты.
АРК – арахидоновая кислота; ЭПК – эйкозапентаеновая кислота; ДГК – докозагексаеновая кислота
Figure 2. Binding energies of the studied polyunsaturated fatty acids molecules with the enzymes of the arachidonic acid cascade.
ARA – arachidonic acid; EPA – eicosapentaenoic acid; DHA – docosahexaenoic acid
Циклооксигеназы-1 и -2: основные ферменты синтеза простагландинов / Cyclooxygenases-1 and -2: the main enzymes of prostaglandin synthesis
Существует две разновидности циклооксигеназ (также известных как простагландин Н2 синтетазы) – ЦОГ-1 и ЦОГ-2. Обе разновидности на 65% идентичны по аминокислотной последовательности и практически идентичны по пространственной структуре. Ткани организма отличаются друг от друга по уровням экспрессии ЦОГ-1 и ЦОГ-2. ЦОГ-1 экспрессируется в большинстве клеток и является необходимым ферментом для биосинтеза простагландинов. ЦОГ-2 – индуцибельный фермент, который экспрессируется в активированных макрофагах и других клетках при воспалении.
Результаты расчета энергий связывания (см. рис. 2) показывают, что ЭПК, ДГК и их этиловые эфиры характеризуются более высокими абсолютными значениями энергий связывания с ЦОГ-1 и ЦОГ-2 по сравнению с ω-6 АРК. За исключением комплекса ЭПК–ЦОГ-1, энергии связывания ЭПК и ДГК на 0,4…1,8 ккал/моль превышали абсолютные значения энергии стабилизации комплексов АРК–ЦОГ-1 и АРК–ЦОГ-2. В случае ЦОГ-2 ЭПК, ДГК и этиловый эфир ЭПК характеризовались близкими значениями ∆∆G (–3,0...–3,1 ккал/моль), в то время как комплекс ЦОГ-2 с этиловым эфиром ДГК был несколько более стабилен (∆∆G = –3,4 ккал/моль).
Анализ молекулярно-энергетических профилей (рис. 3) показал, что этот выигрыш в энергии стабилизации комплексов обусловлен не изменениями в характере взаимодействий каких-либо отдельных аминокислотных остатков, а более эффективной (по сравнению с АРК) аккомодацией молекул ω-3 ПНЖК и их производных в структуре таргетных белков ЦОГ-1 и ЦОГ-2.
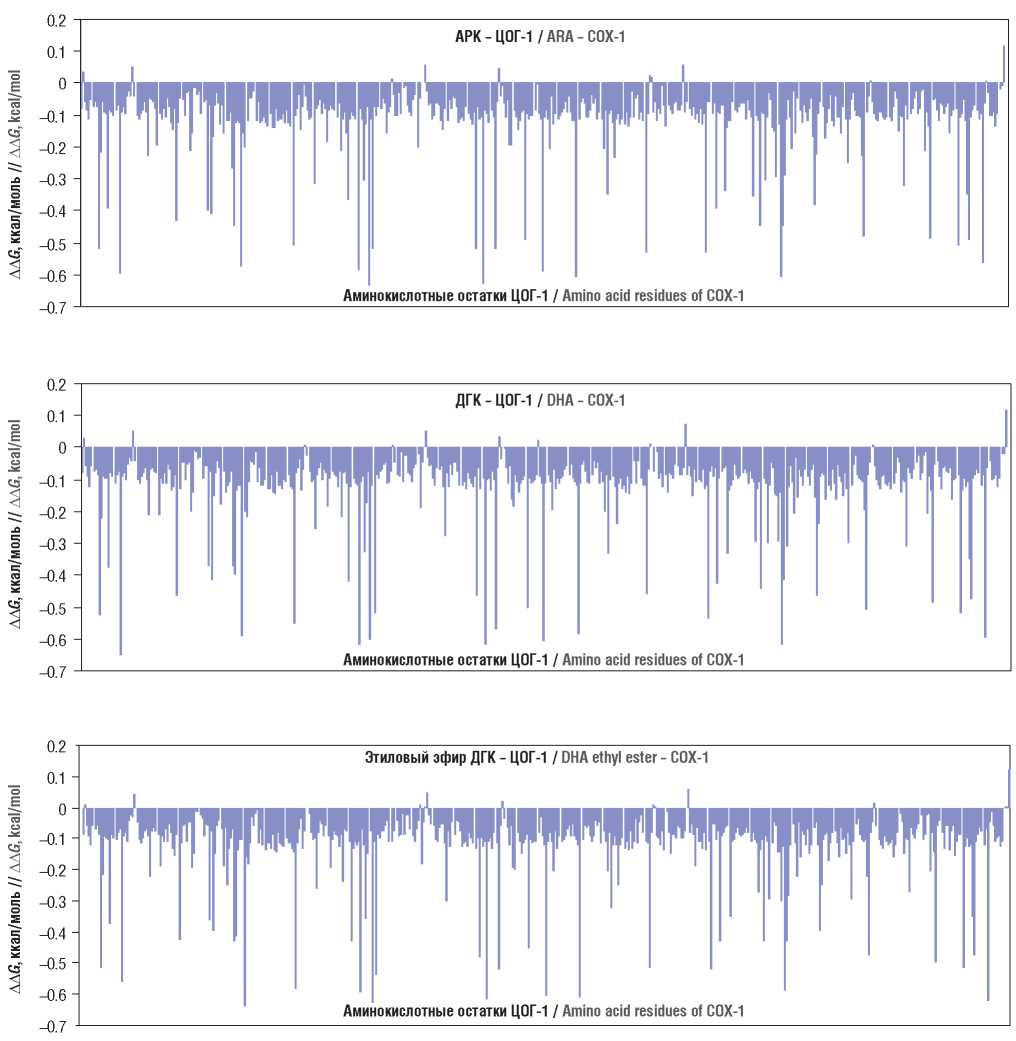
Рисунок 3. Молекулярно-энергетические профили комплексов полиненасыщенных жирных кислот с циклооксигеназой-1 (ЦОГ-1):
а – комплекс арахидоновой кислоты (АРК) с ЦОГ-1; b – комплекс докозагексаеновой кислоты (ДГК) с ЦОГ-1; c – комплекс этилового эфира ДГК с ЦОГ-1
Figure 3. Molecular energy profiles of polyunsaturated fatty acids complexes with cyclooxygenase-1 (COX-1):
a – arachidonic acid (ARA) with COX-1; b – docosahexaenoic acid (DHA) with COX-1; c – DHA ethyl ester with COX-1
Анализ молекулярно-энергетических профилей, представленных на рисунке 3, позволил сделать вывод, что более высокая стабильность структур этиловых эфиров ЭПК и ДГК обусловлена взаимодействиями этилового «хвоста» с гидрофобным карманом в структуре ЦОГ (рис. 4). Например, в структуре ЦОГ-1 гидрофобный карман сформирован аминокислотами валин-116, аргинин-120, аланин-527, лейцин-531. Этиловый «хвост» молекулы эфира увеличивает площадь ее поверхности по сравнению со свободной ПНЖК, тем самым увеличивая площадь поверхности взаимодействия этиловых эфиров ЭПК и ДГК с рецептором. Поскольку взаимодействия гидрофобные, увеличение площади взаимодействия молекул с ЦОГ приводит к увеличению стабильности комплексов «лиганд–ЦОГ».
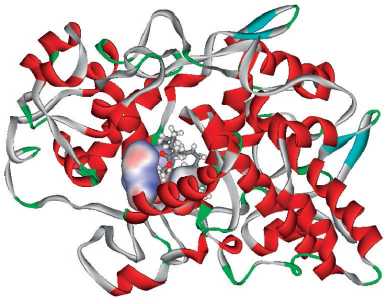
Рисунок 4. Пространственная структура комплекса этилового эфира эйкозапентаеновой кислоты (ЭПК) с циклооксигеназой-2 (ЦОГ-2). Показан гидрофобный карман, в котором расположен этиловый «хвост» молекулы. Структура комплекса ЭПК с ЦОГ-1 практически идентична
Figure 4. Spatial structure of the complex of eicosapentaenoic acid (EPA) ethyl ester with cyclooxygenase-2 (COX-2). A hydrophobic pocket is shown, in which the ethyl “tail” of the molecule is located. The structure of the EPA with COX-1 complex is almost identical
Арахидонат 5-липоксигеназа: основной фермент биосинтеза лейкотриенов / Arachidonate 5-lipoxygenase: the main enzyme of leukotriene biosynthesis
Арахидонат 5-ЛПОГ (ген Alox5) преобразует ПНЖК в лейкотриены. Липоксигеназный путь синтеза лейкотриенов существует в различных лейкоцитах, включая мастоциты (тучные клетки), эозинофилы, нейтрофилы, моноциты и базофилы. Трансформации АРК посредством 5-ЛПОГ приводят к образованию провоспалительных лейкотриенов 4-й группы (LTB4, LTC4, LTD4, LTE4). При действии 5-ЛПОГ на ЭПК синтезируются противовоспалительные лейкотриены 5-й группы (LTB5, LTC5, LTD5, LTE5).
Расчеты, представленные в настоящей работе, показывают, что комплексы ω-3 ПНЖК с 5-ЛПОГ намного более стабильны (∆∆G = –0,95...–1,62 ккал/моль), чем комплекс АРК с 5-ЛПОГ (∆∆G = –0,69 ккал/моль). Наиболее стабильным был комплекс 5-ЛПОГ с этиловым эфиром ЭПК (∆∆G = –1,62 ккал/моль). Анализ молекулярно-энергетических профилей комплексов 5-ЛПОГ с ДГК и этиловым эфиром ДГК продемонстрировал, что обе молекулы имеют близкие значения энергии связывания (∆∆G = –1,21... –1,23 ккал/моль) вследствие сравнительно малого объема связывающего сайта ПНЖК в структуре фермента 5-ЛПОГ.
Меньший объем сайта связывания ДГК приводит к тому, что добавление этилового «хвоста» не только обеспечивает увеличение поверхности взаимодействия с белком-рецептором, но и усиливает стерические препятствия (пространственные напряжения) в структуре фермента. Поэтому увеличение поверхности молекулы этилового эфира ДГК компенсируется возрастанием стерических препятствий, так что не происходит значительного увеличения энергии связывания с 5-ЛПОГ. В то же время объем молекулы ЭПК меньше, чем объем ДГК на 5...10 Å3, поэтому этиловый эфир ЭПК образует более стабильный комплекс с 5-ЛПОГ (рис. 5).

Рисунок 5. Пространственная структура комплекса этилового эфира эйкозапентаеновой кислоты с 5-липоксигеназой. Показан гидрофобный карман связывания молекулы омега-3 полиненасыщенной жирной кислоты
Figure 5. Spatial structure of the eicosapentaenoic acid ethyl ester complex with 5-lipoxygenase. Hydrophobic binding pocket of omega-3 polyunsaturated fatty acid molecule is shown
ЗАКЛЮЧЕНИЕ / CONCLUSION
В работе представлены результаты биофизического анализа взаимодействий АРК, ЭПК, ДГК и этиловых эфиров ЭПК и ДГК с ЦОГ-1/2 и 5-ЛПОГ. Исследование привело к нескольким выводам, весьма интересным с точки зрения молекулярной фармакологии ЭПК и ДГК.
Во-первых, ЭПК и ДГК могут образовывать намного более стабильные комплексы с ферментами ЦОГ-1/2 и 5-ЛПОГ, чем АРК. С одной стороны, этот результат соответствует вытеснению АРК из активных центров таргетных ферментов, что приводит к замедлению образования провоспалительных эйкозаноидов. С другой стороны, более стабильные комплексы с таргетными белками соответствуют более интенсивному образованию противовоспалительных эйкозаноидов из ЭПК и ДГК.
Во-вторых, этиловые эфиры ЭПК и ДГК образуют более стабильные комплексы с ферментами каскада АРК, чем свободные ЭПК и ДГК. Результаты биофизического моделирования показали, что это обусловлено увеличением площади поверхности молекулы при присоединении этилового «хвоста» в составе сложных эфиров ЭПК и ДГК.
В-третьих, разница в молекулярном объеме между ЭПК и ДГК (ЭПК – меньший объем, ДГК – больший объем) и их этиловыми эфирами обеспечивает разницу в связывании белками-рецепторами с различными объемами сайта связывания лигандов. Например, более объемный этиловый эфир ДГК лучше связывается с бо́льшим сайтом в ферментах ЦОГ-1/2, а этиловый эфир ЭПК с меньшим объемом лучше связывается с меньшим по объему сайтом связывания 5-ЛПОГ. Поэтому препараты, содержащие этиловые эфиры и ЭПК, и ДГК, могут более эффективно взаимодействовать с различными ферментами, чем препараты, содержащие этиловые эфиры только ЭПК или только ДГК.
Большее сродство этиловых эфиров ЭПК и ДГК к молекулам ферментов каскада АРК является одной из фундаментальных основ высокой терапевтической эффективности препаратов ω-3 ПНЖК с высокой степенью стандартизации.
1. www.rcsb.org.
Список литературы
1. Li W.L., Zhang N.H., Ge S.W., Xu G. Dietary omega-3 fatty acid intake and mortality in CKD population: a 1999–2014 NHANES analysis. Am J Nephrol. 2021; 52 (12): 909–18. https://doi.org/10.1159/000520027.
2. Торшин И.Ю., Громова О.А., Кобалава Ж.Д. О репрессиях ω-3 полиненасыщенных жирных кислот адептами доказательной медицины. ФАРМАКОЭКОНОМИКА. Современная фармакоэкономика и фармакоэпидемиология. 2019; 12 (2): 91–114. https://doi.org/10.17749/2070-4909.2019.12.2.91-114.
3. Торшин И.Ю., Громова О.А., Зайчик Б.Ц., Ружицкий А.О. Комплексное исследование состава экстрактов жира рыб и количественные критерии для различения стандартизированных экстрактов омега-3 полиненасыщенных жирных кислот. Кардиология. 2020; 60 (5): 47–56. https://doi.org/10.18087/cardio.2020.5.n1053.
4. Simopoulos A.P. Omega-3 fatty acids in inflammation and autoimmune diseases. J Am Coll Nutr. 2002; 21 (6): 495–505. https://doi.org/10.1080/07315724.2002.10719248.
5. González-Périz A., Planagumà A., Gronert K., et al. Docosahexaenoic acid (DHA) blunts liver injury by conversion to protective lipid mediators: protectin D1 and 17S-hydroxy-DHA. FASEB J. 2006; 20 (14): 2537–9. https://doi.org/10.1096/fj.06-6250fje.
6. Khalfoun B., Thibault F., Watier H., et al. Docosahexaenoic and eicosapentaenoic acids inhibit in vitro human endothelial cell production of interleukin-6. Adv Exp Med Biol. 1997; 400B: 589–97.
7. Wada M., DeLong C.J., Hong Y.H., et al. Enzymes and receptors of prostaglandin pathways with arachidonic acid-derived versus eicosapentaenoic acid-derived substrates and products. J Biol Chem. 2007; 282 (31): 22254–66. https://doi.org/10.1074/jbc.M703169200.
8. Serhan C.N., Chiang N., Van Dyke T.E. Resolving inflammation: dual anti-inflammatory and pro-resolution lipid mediators. Nat Rev Immunol. 2008; 8 (5): 349–61. https://doi.org/10.1038/nri2294.
9. Mori T.A. Omega-3 fatty acids and blood pressure. Cell Mol Biol (Noisy-le-grand). 2010; 56 (1): 83–92.
10. Serhan C.N., Libreros S., Nshimiyimana R. E-series resolvin metabolome, biosynthesis and critical role of stereochemistry of specialized pro-resolving mediators (SPMs) in inflammation-resolution: preparing SPMs for long COVID-19, human clinical trials, and targeted precision nutrition. Semin Immunol. 2022: 101597. https://doi.org/10.1016/j.smim.2022.101597.
11. Torshin I.Yu. Bioinformatics in the post-genomic era: the role of biophysics. NY: Nova Science Publishers; 2013: 255 pp.
Об авторах
И. Ю. ТоршинРоссия
Торшин Иван Юрьевич – к.ф-м.н., к.х.н., старший научный сотрудник Института фармакоинформатики. WoS ResearcherID: C-7683-2018; Scopus Author ID: 7003300274; РИНЦ SPIN-код: 1375-1114
ул. Вавилова, д. 44, корп. 2, Москва 119333
О. А. Громова
Россия
Громова Ольга Алексеевна – д.м.н., профессор, научный руководитель Института фармакоинформатики. WoS ResearcherID: J-4946-2017; Scopus Author ID: 7003589812; РИНЦ SPIN-код: 6317-9833
ул. Вавилова, д. 44, корп. 2, Москва 119333
Рецензия
Для цитирования:
Торшин И.Ю., Громова О.А. Биофизическое моделирование указывает на высокое сродство этиловых эфиров омега-3 полиненасыщенных жирных кислот к ферментам провоспалительного каскада арахидоновой кислоты. ФАРМАКОЭКОНОМИКА. Современная фармакоэкономика и фармакоэпидемиология. 2022;15(2):221-229. https://doi.org/10.17749/2070-4909/farmakoekonomika.2022.142
For citation:
Torshin I.Yu., Gromova O.A. Biophysical modeling indicates a high affinity of ethyl esters of omega-3 polyunsaturated fatty acids to the enzymes of the pro-inflammatory arachidonic acid cascade. FARMAKOEKONOMIKA. Modern Pharmacoeconomics and Pharmacoepidemiology. 2022;15(2):221-229. (In Russ.) https://doi.org/10.17749/2070-4909/farmakoekonomika.2022.142

Контент доступен под лицензией Creative Commons Attribution-NonCommercial-ShareAlike 4.0 International License.






































