Перейти к:
Хемопротеомный анализ теноксикама в сравнении с другими нестероидными противовоспалительными препаратами
https://doi.org/10.17749/2070-4909/farmakoekonomika.2025.307
Аннотация
Актуальность. Для планирования эффективной и безопасной фармакотерапии боли и воспаления важно оценивать механизмы и спектр действия нестероидных противовоспалительных препаратов (НПВП): противовоспалительные, противоболевые (в т.ч. центральные) эффекты, воздействия на протеом, обмен микронутриентов и на другие аспекты метаболизма организма в зависимости от способа введения НПВП.
Цель: сравнение эффектов молекул теноксикама, мелоксикама, целекоксиба, кетопрофена, нимесулида, диклофенака, ибупрофена методом хемореактомного, хемопротеомного и фармакоинформационного анализа.
Материал и методы. Сравнение теноксикама с другими НПВП проведено на основе методов топологического анализа научной школы Ю.И. Журавлева и К.В. Рудакова, разработанных в рамках комбинаторной теории разрешимости и теории классификации значений признаков в применении к хемографам – математчиеским структурам, разработанным для описания химических структур молекул.
Результаты. Получены in silico оценки противовоспалительных и противоболевых эффектов теноксикама и молекул сравнения. Проанализированы профили принадлежности к различным группам анатомо-терапевтическо-химической классификации и профили частот побочных эффектов НПВП (включая воздействие на микронутриентный обмен – потери витаминов и микроэлементов). Проведено сравнение действия молекул при пероральном, топическом и парентеральном введении. Профиль фармакологических эффектов теноксикама существенно отличался от таковых у других НПВП, указывая, в частности, на потенциальные антитромботические, гипогликемические, антигистаминные свойства. Теноксикам, в отличие от других молекул, может существенно влиять на синтез, секрецию и активность лейкотриена В4 и проявлять ингибирующее действие на рецепторы кининов. Теноксикам не стимулирует более сильные потери микронутриентов, чем другие НПВП. Хемореактомные оценки центральных эффектов показали, что теноксикам проявляет их сопоставимо с другими НПВП. Противовоспалительное действие теноксикама при топическом, пероральном и парентеральном введении также сопоставимо с другими НПВП. По результатам анализа частот встречаемости различных побочных эффектов, усредненных по исследованной выборке, теноксикам характеризовался наименьшим показателем (3%; другие молекулы: 4–7%).
Заключение. Хемореактомное, хемопротеомное и фармакоинформационное профилирование теноксикама указало на более благоприятный баланс эффективности и безопасности у теноксикама, чем у молекул сравнения.
Ключевые слова
Для цитирования:
Торшин И.Ю., Громов А.Н., Громова О.А. Хемопротеомный анализ теноксикама в сравнении с другими нестероидными противовоспалительными препаратами. ФАРМАКОЭКОНОМИКА. Современная фармакоэкономика и фармакоэпидемиология. 2025;18(3):340-356. https://doi.org/10.17749/2070-4909/farmakoekonomika.2025.307
For citation:
Torshin I.Yu., Gromov A.N., Gromova O.A. Chemoproteomic analysis of tenoxicam compared with other nonsteroidal anti-inflammatory drugs. FARMAKOEKONOMIKA. Modern Pharmacoeconomics and Pharmacoepidemiology. 2025;18(3):340-356. (In Russ.) https://doi.org/10.17749/2070-4909/farmakoekonomika.2025.307
ВВЕДЕНИЕ / INTRODUCTION
Нестероидные противовоспалительные препараты (НПВП) очень широко используются в современной медицине. Анализ базы данных (БД) FAERS (англ. FDA Adverse Event Reporting System), содержащей отчеты о побочных эффектах лекарств у конкретных пациентов, показал, что применение подавляющего большинства НПВП связано с высоким уровнем жалоб на осложнения со стороны желудочно-кишечного тракта (ЖКТ). Некоторые НПВП, несмотря на очевидное противовоспалительное действие, даже могут стимулировать формирование злокачественных новообразований [1].
Согласно данным информационной системы Росздравнадзора наиболее часто нежелательные эффекты были зафиксированы для парацетамола (20%), метамизола (11%), ибупрофена (10%), ацетилсалициловой кислоты (10%) и кеторолака (7%). В России НПВП занимают третье место среди препаратов, подозреваемых в развитии анафилактических реакций (10%): парацетамол (21%), метамизол (21%), ибупрофен (15%). Среди НПВП анафилактические осложнения наиболее редко отмечались для оксикамов (мелоксикам – 1%, лорноксикам – 1%) и нимесулида (0,4%) [2].
Для снижения нежелательных эффектов перспективно комбинировать прием НПВП per os с топическим и, в ряде случаев, парентеральным (внутримышечным или внутривенным) применением. Даже длительное топическое назначение НПВП не повышает риск развития системных токсических эффектов. Повышение приверженности пациентов к терапии достигается при использовании топического НПВП 1–2 раза в сутки [2][3].
Нежелательные побочные эффекты НПВП связаны, к сожалению, с основным механизмом их действия: ингибированием ферментов циклооксигеназ (ЦОГ). В частности, ферменты ЦОГ-1 и ЦОГ-2 в заметных количествах экспрессируются в почках, и их ингибирование приводит к диаметрально противоположным последствиям. В случае блокады ЦОГ-1 усиливается натрийурез, увеличивается диурез, артериальное давление снижается. Блокада ЦОГ-2 приводит к сужению сосудов почек, нарушению кровотока в мозговом веществе почки, в итоге снижается натрийурез и диурез, усиливаются прессорные эффекты ангиотензина II, растет артериальное давление [2]. Поэтому, казалось бы, более селективные ингибиторы ЦОГ-2 могли бы характеризоваться улучшенным профилем безопасности.
Однако результаты клинических исследований не показали преимуществ в эффективности и безопасности селективных ингибиторов ЦОГ-2 по сравнению с неселективными ингибиторами ни с точки зрения эффективности, ни с точки зрения безопасности. Более того, применение селективных ингибиторов ЦОГ-2 с учетом указанного выше «почечного» механизма опосредует развитие кардиотоксичных эффектов [3].
Например, селективные ингибиторы ЦОГ-2 коксибы продемонстрировали повышенный риск развития кардиотоксичности. Хотя неселективные ингибиторы ЦОГ-2 не проявляют выраженной кардиотоксичности, спектр их побочного действия весьма широк и включает не только осложнения со стороны ЖКТ, но и различные системные эффекты. Представляется более рациональным применять НПВП, умеренно селективные по отношению к ЦОГ-2 [2].
Среди умеренно селективных ингибиторов ЦОГ-2 следует выделить оксикамы, отличающиеся приемлемым балансом противовоспалительной эффективности и безопасности. Такому препарату из группы оксикамов, как теноксикам, присуще весьма продолжительное действие (до нескольких суток), что важно для лечения опорно-двигательной патологии. Действительно, в соответствии с фармакокинетическими данными теноксикам быстро и полностью всасывается из ЖКТ (биодоступность 100%), причем максимальная концентрация достигается через 2 ч, а период полувыведения – 72 ч [2–4].
При внутривенном введении теноксикам увеличивает уровни эндогенных опиоидов динорфина и бета-эндорфина, способствуя активации физиологической антиноцицептивной системы организма [5]. Оценка эффективности и безопасности теноксикама (препарат Артоксан® – Уорлд Медицин Илач Сан. Ве Тидж. А.Ш., Турция) при внутримышечном введении пациентам с дорсалгией (n=70) показала, что в сравнении с мелоксикамом и диклофенаком он статистически достоверно уменьшает болевые проявления в спине, улучшает качество жизни пациентов при отсутствии побочных эффектов [6].
В качестве критерия безопасности НПВП необходимо использовать оценки взаимодействия НПВП не только с ЦОГ-1 и ЦОГ-2, но и с другими белками протеома. Например, теноксикам может влиять на активность протеогликаназ (на 68%) и коллагеназ (на 37% ) – белков, разрушающих хрящ [7].
В целом данные о противовоспалительных и других механизмах действия НПВП «разбросаны» по тысячам научных статей, БД (FAERS, SIDER и др.), которые содержат более подробную информацию, нежели просто инструкция к препарату. Кроме того, даже содержащиеся в БД сведения о побочных действиях не всегда полны и не позволяют сравнивать препараты по тому или иному набору побочных эффектов.
Поэтому возникает необходимость применения новых методов оценки фармакологических и других свойств молекул действующих начал НПВП [8], разрабатываемых в научной школе академиков РАН Ю.И. Журавлёва и К.В. Рудакова по направлению «хемореактомный анализ» [9–11]. Такие алгоритмы производят унифицированные спектры фармакологических свойств различных молекул, которые могут непосредственно сравниваться друг с другом [12], и позволяют делать выводы о молекулярных механизмах препаратов [13], оценивать эффекты на уровне организма пациента (фармакоинформационный анализ), получать диапазон всех вероятных применений лекарства (классы анатомо-терапевтическо-химической классификации (АТХ)), прогнозировать частоты встречаемости нежелательных эффектов.
Цель – сравнение эффектов молекул теноксикама, мелоксикама, целекоксиба, кетопрофена, нимесулида, диклофенака, ибупрофена методами хемореактомного, хемопротеомного и фармакоинформационного анализа.
МАТЕРИАЛ И МЕТОДЫ / MATERIAL AND METHODS
Исследуемые молекулы / Studied molecules
Сходство химических структур молекул указывает на похожие фармакологические свойства соответствующих действующих начал лекарств. Для количественных оценок, во-первых, степени сходства структур молекул и, во-вторых, их фармакологических свойств на основании схожести структур используются методы математических теорий комбинаторной разрешимости, метрического и топологического анализа данных [10]. Для применения этих методов необходимы структуры исследуемых молекул (рис. 1).
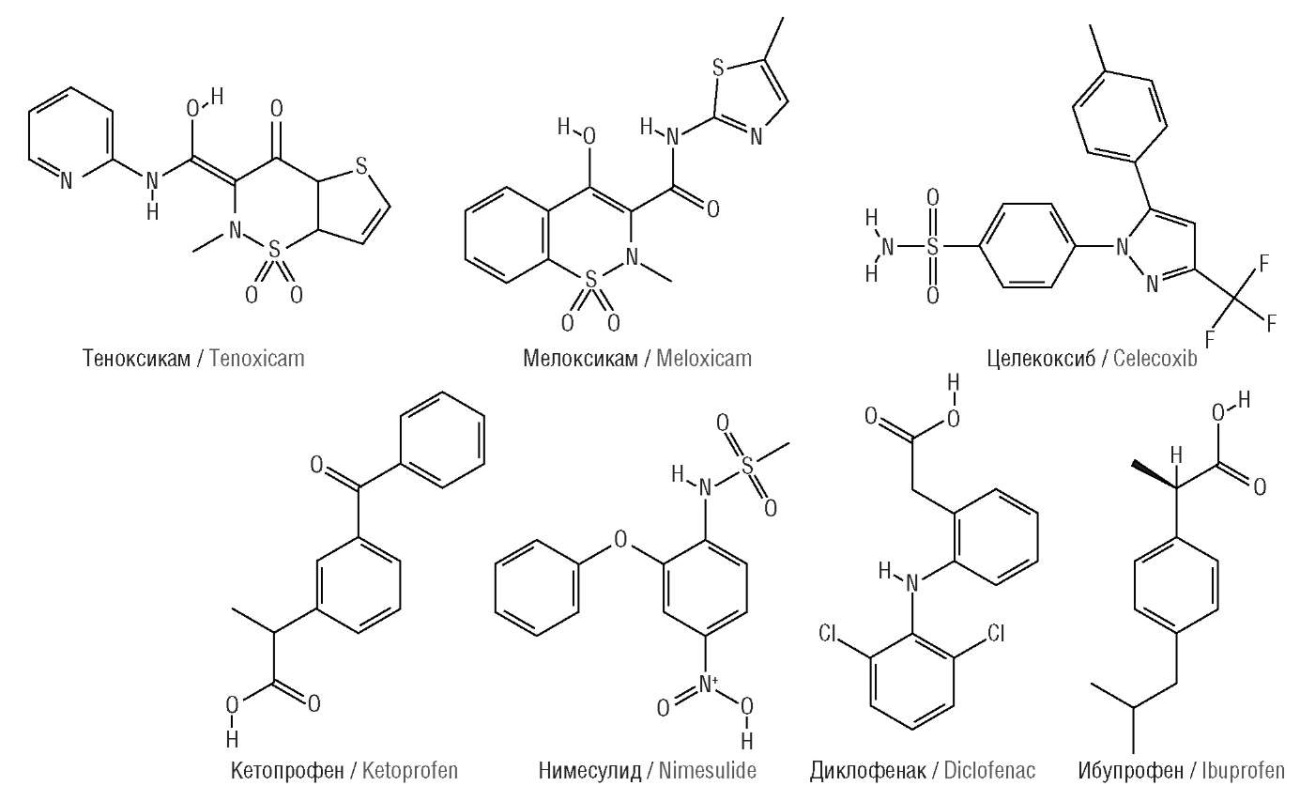
Рисунок 1. Химические формулы исследованных молекул
Figure 1. Chemical formulas of the studied molecules
Хемореактомный, хемопротеомный и фармакоинформационный анализ / Chemoreactomic, chemoproteomic, and pharmacoinformatic analysis
При прогнозировании свойств молекул комбинаторная теория разрешимости применяется к специальным математическим объектам – хемогрáфам (или χ-графам): конечным связным неориентированным размеченным графам без петель, с кликовым числом менее 3. Графом в дискретной математике называется совокупность двух множеств: множества вершин и множества связей между вершинами (так называемых ребер). Для количественной оценки расстояния между хемографами вводится метрика химического расстояния dχ, на основании оценки которой определяются и фармакологические свойства молекул [10].
Хемореактомный анализ (оценка биологических активностей), хемопротеомный анализ (оценка взаимодействий с белками протеома) и фармакоинформационный анализ (оценка фармакологического профиля, в т.ч. побочных эффектов и их частот) молекул, формирующих действующие начала НПВП, проводят посредством единого алгоритмического подхода, но с использованием разных БД. Для обучения алгоритмов хемореактомного и хемопротеомного анализа применяется информация из базы PubChem и производных БД [12]. Для обучения алгоритмов фармакоинформационного анализа используются данные международной классификации АТХ, БД TTD, SuperTarget, MATADOR, PDTD, как описано в работах [8][10][12]. Три этапа единого алгоритмического подхода включают:
1) формирование выборки исходных данных на основе заданной БД посредством поиска по ключевым словам (например, 1627 активностей из PubChem для 25 129 при проведении хемореактомного анализа; 4012 активностей для 42 300 молекул из PubChem при проведении хемопротеомного анализа; 5418 активностей из АТХ/TTD/SuperTarget при проведении фармакоинформационного анализа);
2) вычисление расстояний dχ между молекулами из сформированной таким образом выборки из PubChem и каждой из изучаемых молекул (см. рис. 1) [9];
3) вычисление оценок показателей фармакологических свойств молекул – констант концентрации полумаксимального ингибирования (англ. half-maximal inhibitory concentration, IC50), максимальной концентрации (Emax), полуэффективной дозы (англ. median effective dose, ЕD50) [10].
При вычислении показателей, представленных в таблицах далее, анализировались результаты от 3 до 15 независимых вычислительных экспериментов по каждой из указанных активностей (т.е. упомянутых ранее 1627 активностей для хемореактомного анализа, 4012 активностей для хемопротеомного анализа, 5418 активностей для фармакоинформационного анализа).
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ / RESULTS AND DISCUSSION
В результате проведения хемореактомного, хемопротеомного и фармакоинформационного анализа получены сравнительные in silico оценки противовоспалительных, противоболевых (в т.ч. центральных ) эффектов теноксикама и молекул сравнения. Также проанализированы профили принадлежности молекул к различным группам АТХ-классификации и профили частот побочных эффектов НПВП (включая нежелательные воздействия на обмен витаминов и микроэлементов). Проведено сравнение эффектов изученных молекул при пероральном, топическом и парентеральном введении.
Противовоспалительные эффекты / Anti-inflammatory effects
В таблице 1 суммированы хемореактомные оценки воздействия исследованных молекул на метаболизм простагландинов. Теноксикам может ингибировать ЦОГ-1 и ЦОГ-2. В случае ЦОГ-2 ингибирование теноксикамом и мелоксикамом сопоставимо (IC50 42–56 нМ) и более выражено, чем для других НПВП (98–8016 нМ). При фиксированной концентрации веществ (10 мкМ) ингибирование теноксикамом фермента ЦОГ-2 оценено в 73% (другие НПВП: 39–71%).
Таблица 1. Хемореактомные оценки воздействия теноксикама и других нестероидных противовоспалительных препаратов на простагландиновый метаболизм человека
Table 1. Chemoreactomic evaluations of the effects of tenoxicam and other nonsteroidal anti-inflammatory drugs on human prostaglandin metabolism
|
Активность / Activity |
Константа / Constant |
TNX |
MLX |
CLX |
KPF |
NMS |
DFN |
IPF |
|
Ингибирование синтеза LTB4 в цельной крови посредством ингибирования 5-липоксигеназы, нМ / LTB4 synthesis inhibition in whole blood via 5-lipoxygenase inhibition, nM |
IC50 |
359,9 |
2271,0 |
401,9 |
4162,8 |
459,5 |
4066,9 |
3880,0 |
|
Ингибирование ЦОГ-1 in vitro, нМ / In vitro COX-1 inhibition, nM |
IC50 |
276,5 |
3961,0 |
71,8 |
4466,0 |
2954,0 |
4045,5 |
3439,6 |
|
Ингибирование ЦОГ-2 in vitro, нМ / In vitro COX-2 inhibition, nM |
IC50 |
55,9 |
42,0 |
97,6 |
8016,8 |
116,1 |
401,2 |
8016,8 |
|
Ингибирование ЦОГ-2 в концентрации вещества 10 мкМ в цельной крови человека, % / COX-2 inhibition at concentration of 10 μM in human whole blood, % |
– |
73,3 |
52,8 |
39,4 |
38,9 |
39,0 |
53,6 |
70,6 |
|
Ингибирование биосинтеза LTB4 в цельной крови, нМ / LTB4 biosynthesis inhibition in whole blood, nM |
IC50 |
132,0 |
531,0 |
329,6 |
582,4 |
487,5 |
506,1 |
551,6 |
|
Ингибирование рецептора LTB4 in vitro в концентрации вещества 10 мкM, % / In vitro LTB4 receptor inhibition at concentration of 10 μM, % |
– |
72,2 |
11,5 |
77,0 |
74,9 |
15,3 |
73,6 |
23,2 |
|
Ингибирование рецептора LTB4 в клетках PMN, нМ / LTB4 receptor inhibition in PMN cells, nM |
IC50 |
171,6 |
6968,0 |
6968,0 |
6968,0 |
6968,0 |
729,8 |
6968,0 |
|
Ингибирование связывания PGD2 с рецептором PGD2 в тромбоцитах, нМ / Inhibition of PGD2 binding to PGD2 receptor in platelets, nM |
IC50 |
600,0 |
5200,0 |
5200,0 |
1152,9 |
5200,0 |
5200,0 |
1300,2 |
Примечание. TNX (англ. tenoxicam) – теноксикам; MLX (англ. meloxicam) – мелоксикам; CLX (англ. сelecoxib) – целекоксиб; KPF (англ. ketoprofen) – кетопрофен; NMS (англ. nimesulide) – нимесулид; DFN (англ. diclofenac) – диклофенак; IPF (англ. ibuprofen) – ибупрофен; LTB4 (англ. leukotriene B4) – лейкотриен B4; ЦОГ – циклооксигеназа; PMN (англ. polymorphonuclear leukocytes) – полиморфноядерные лейкоциты; PGD2 (англ. prostaglandin 2) – простагландин-2; IC50 (англ. half-maximal inhibitory concentration) – константа концентрации полумаксимального ингибирования.
Note. TNX – tenoxicam; MLX – meloxicam; CLX – сelecoxib; KPF – ketoprofen; NMS – nimesulide; DFN – diclofenac; IPF – ibuprofen; LTB4 – leukotriene B4; COX – cyclooxygenase; PMN – polymorphonuclear leukocytes; PGD2 – prostaglandin 2; IC50 – half-maximal inhibitory concentration.
В отличие от молекул сравнения, теноксикам может ингибировать синтез и активность провоспалительных лейкотриенов, в т.ч. лейкотриена В4 (англ. leukotriene B4, LTB4), ингибируя LTB4-гидролазу (IC50 132 нМ; другие НПВП: 330–551 нМ) и арахидонат-5-липоксигеназу (IC50 360 нМ; другие НПВП: 400–4066 нМ). Дополнительно теноксикам способен ингибировать рецептор LTB4 (IC50 172 нМ; другие НПВП: 730–6968 нМ). При фиксированной концентрации веществ (10 мкМ) рецептор LTB4 может ингибироваться теноксикамом на 72% (другие НПВП: 11–77%).
В таблице 2 суммированы противовоспалительные эффекты теноксикама, связанные с ингибированием обмена цитокинов: кининов, фактора некроза опухоли альфа и транскрипционного ядерного фактора каппа B (англ. nuclear factor kappa B, NF-κB), реализующего эффекты провоспалительных цитокинов. Например, при оценке ингибирования транскрипционной активности NF-κB в клетках линии Jurkat наилучшие результаты найдены для теноксикама, мелоксикама и нимесулида (IC50 227–298 нМ), в то время как другие НПВП характеризовались намного более высокими значениями констант (2082–8581 нМ).
Таблица 2. Противовоспалительные эффекты теноксикама и других нестероидных противовоспалительных препаратов: воздействие на уровни и активность цитокинов человека (по результатам хемореактомного анализа)
Table 2. Anti-inflammatory effects of tenoxicam and other nonsteroidal anti-inflammatory drugs: effects on human cytokine levels and activity (based on chemoreactomic analysis)
|
Активность / Activity |
Константа / Constant |
TNX |
MLX |
CLX |
KPF |
NMS |
DFN |
IPF |
|
Ингибирование рецептора брадикинина B1, нМ / Bradykinin B1 receptor inhibition, nM |
IC50 |
270,7 |
478,0 |
477,9 |
491,2 |
484,0 |
400,7 |
481,5 |
|
Противовоспалительная активность как снижение экспрессии ICAM1, индуцированной ФНО-α в клетках HUVEC, предварительно обработанных исследованными соединениями, мкг/ мл // Anti-inflammatory activity as reduced TNF-α-induced ICAM1 expression in HUVEC cells pre-treated with the tested compounds, μg/ml |
IC50 |
19,4 |
89,7 |
20,8 |
95,6 |
20,9 |
95,5 |
96,3 |
|
Противовоспалительная активность как снижение экспрессии ICAM1, индуцированной ФНО-α в клетках линии HUVEC в концентрации, максимально переносимой клетками, % / Anti-inflammatory activity as reduced ICAM1 expression induced by TNF-α in HUVEC cells at the maximum tolerated concentration, % |
– |
73,0 |
74,0 |
47,2 |
39,1 |
46,8 |
46,7 |
41,3 |
|
Противовоспалительная активность в моноцитах как ингибирование продукции ФНО-α, индуцированной ЛПС, с предварительной инкубацией в течение 15 мин с последующим добавлением ЛПС в концентрации 50 мкМ, % / Anti-inflammatory activity in monocytes as inhibition of LPS-induced TNF-α production with 15 min pre-incubation followed by addition of 50 μM LPS, % |
– |
100,0 |
100,0 |
18,9 |
16,8 |
100,0 |
100,0 |
100,0 |
|
Ингибирование NK1, нМ / NK1 inhibition, nM |
IC50 |
95,8 |
76,8 |
535,6 |
546,5 |
237,0 |
82,2 |
720,8 |
|
Сродство к рецептору тахикинина-2, измеренное с использованием радиолиганда, нМ / Affinity for tachykinin-2 receptor measured using radioligand, nM |
IC50 |
849,9 |
2888,9 |
2939,7 |
920,5 |
2527,3 |
933,7 |
2581,0 |
|
Ингибирование транскрипционной активности NF-κB в клетках линии Jurkat, нМ / Inhibition of NF-κB transcriptional activity in Jurkat cells, nM |
IC50 |
298,9 |
227,2 |
2082,0 |
4092,0 |
252,7 |
9685,0 |
8581,0 |
|
Противовоспалительная активность в клетках линии PBMC как ингибирование индуцированного ЛПС высвобождения ФНО-α при обработке за 5 мин до воздействия ЛПС, нМ / Anti-inflammatory activity in PBMC cells as inhibition of LPS-induced TNF-α release when treated 5 min before LPS exposure, nM |
IC50 |
372,4 |
1900,0 |
371,0 |
381,2 |
583,6 |
544,5 |
381,2 |
|
Противовоспалительная активность в клетках линии THP1 как ингибирование продукции ИЛ-23, индуцированной ЛПС, нМ / Anti-inflammatory activity in THP1 cells as inhibition of IL-23 production induced by LPS, nM |
IC50 |
255,2 |
3315,7 |
3315,7 |
3315,7 |
3315,7 |
2674,3 |
3315,7 |
|
Противовоспалительная активность в клетках линии THP-1 как ингибирование выработки ФНО-α, индуцированной ЛПС при концентрации вещества 10 мкМ с инкубацией в течение 30 мин до воздействия ЛПС, % / Anti-inflammatory activity in THP-1 cells as inhibition of TNF-α production induced by LPS at concentration of 10 μM with incubation for 30 min before exposure to LPS, % |
– |
73,0 |
39,3 |
45,7 |
28,7 |
37,8 |
37,0 |
28,7 |
|
Ингибирование активации NF-κB в клетках линии HEK293, нМ / Inhibition of NF-κB activation in HEK293 cells, nM |
IC50 |
551,4 |
908,6 |
1180,7 |
933,7 |
1583,7 |
1140,8 |
1071,2 |
|
Ингибирование транскрипционной активности NF-κB в клетках линии HeLa при концентрации вещества 10 мкМ, % / Inhibition of NF-κB transcriptional activity in HeLa cells at substance concentration of 10 μM, % |
– |
50,8 |
49,3 |
21,3 |
48,4 |
3,3 |
0,0 |
50,3 |
|
Активация NF-κB, % / NF-κB activation, % |
Emax |
21,1 |
20,0 |
17,0 |
13,1 |
13,3 |
13,9 |
12,6 |
|
Противовоспалительная активность в нейтрофилах как ингибирование образования супероксид-аниона при концентрации вещества 10 мкг/мл, % / Anti-inflammatory activity in neutrophils as inhibition of superoxide anion formation at substance concentration of 10 μg/ml, % |
– |
20,6 |
16,5 |
7,0 |
3,5 |
9,3 |
16,0 |
4,3 |
Примечание. TNX (англ. tenoxicam) – теноксикам; MLX (англ. meloxicam) – мелоксикам; CLX (англ. сelecoxib) – целекоксиб; KPF (англ. ketoprofen) – кетопрофен; NMS (англ. nimesulide) – нимесулид; DFN (англ. diclofenac) – диклофенак; IPF (англ. ibuprofen) – ибупрофен; ICAM1 (англ. intercellular adhesion molecule 1) – молекула межклеточной адгезии 1; ФНО-α – фактор некроза опухоли альфа; HUVEC (англ. human umbilical vein endothelial cells) – эндотелиальные клетки пупочной вены человека; ЛПС – липополисахариды; NF-κB (англ. nuclear factor kappa B) – ядерный фактор каппа В; NK1R (англ. neurokinin 1 receptor) – рецептор нейрокинина-1; PBMC (англ. peripheral blood mononuclear cells) – мононуклеарные клетки периферической крови; THP1 – моноцитарная клеточная линия человека, полученная от пациента с острым моноцитарным лейкозом; ИЛ-23 – интерлейкин-23; HEK293 (англ. intercellular adhesion molecule 1) – молекула межклеточной адгезии 1; HeLa – линия «бессмертных» клеток, полученная от пациентки с опухолью шейки матки; IC50 (англ. half-maximal inhibitory concentration) – константа концентрации полумаксимального ингибирования; Emax – константа максимальной концентрации.
Note. TNX – tenoxicam; MLX – meloxicam; CLX – сelecoxib; KPF – ketoprofen; NMS – nimesulide; DFN – diclofenac; IPF – ibuprofen; ICAM1 – intercellular adhesion molecule 1; TNF-α – tumor necrosis factor alpha; HUVEC – human umbilical vein endothelial cells; LPS – lipopolysaccharides; NF-κB – nuclear factor kappa B; NK1R – neurokinin 1 receptor; PBMC – peripheral blood mononuclear cells; THP1 – a human monocytic cell line obtained from a patient with acute monocytic leukemia; ИЛ-23 – interleukin-23; HEK293 – intercellular adhesion molecule 1; HeLa – a line of “immortal” cells obtained from a patient with a cervical tumor; IC50 – half-maximal inhibitory concentration; Emax – maximal concentration constant.
Кроме того, теноксикам потенциально ингибирует эффекты проболевых кининов, в т.ч. посредством ингибирования взаимодействия эндогенных кининов с рецепторами брадикинина В1 (IC50 271 нМ; другие НПВП: IC50 400–481 нМ). Напомним, что брадикинин и нейрокинины – важные составляющие механизмов ноцицепции боли [14].
Противоболевые (в т.ч. центральные) эффекты / Analgesic (including central) effects
Центральные эффекты теноксикама сопоставимы с действием других НПВП (рис. 2). Анализ показал, что ингибирование адренергических рецепторов типа ADRA1 было более выражено для теноксикама и мелоксикама (IC50 645–684 нМ), чем для молекул сравнения (701–1805 нМ). Сопоставимые эффекты наблюдались и для рецепторов типа ADRA2, рецепторов ангиотензина AGTR1 (IC50 94–129 нМ) и AGTR2 (IC50 200–556 нМ).
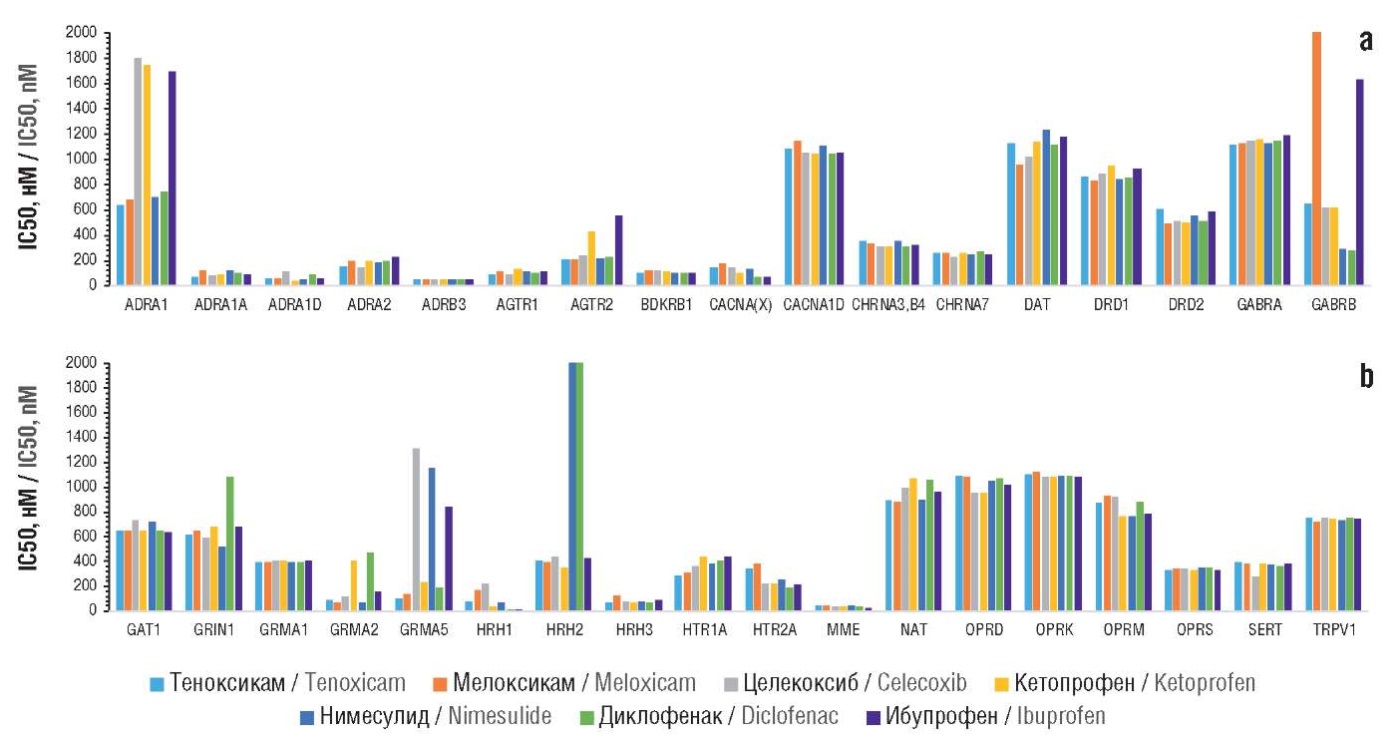
Рисунок 2. Хемореактомные оценки центральных эффектов теноксикама и других нестероидных противовоспалительных препаратов на белках протеома крысы (Rattus norvegicus). Приведены оценки констант концентрации полумаксимального ингибирования (англ. half-maximal inhibitory concentration, IC50) перечисленных таргетных белков.
ADRA1 – адренергический рецептор альфа-1; ADRA1A – адренергический рецептор альфа-1А; ADRA1D – адренергический рецептор альфа-1D; ADRA2 – адренергический рецептор альфа-2; ADRB3 – адренергический рецептор бета-3; AGTR1 – ангиотензиновый рецептор II, тип 1; AGTR2 – ангиотензиновый рецептор II, тип 2; BDKRB1 – брадикининовый рецептор B1; CACNA(X) – кальциевый канал L-типа; CACNA1D – кальциевый канал L-типа; CHRNA3,B4 – нейрональный ацетилхолиновый рецептор альфа-3, бета-4; CHRNA7 – субъединица белка альфа-7 нейронального рецептора ацетилхолина; DAT – переносчик дофамина; DRD1 – рецептор дофамина D1; DRD2 – рецептор дофамина D2; GABRA – рецептор А гамма-аминомасляной кислоты; GABRB – рецептор В гамма-аминомасляной кислоты; GAT1 – транспортер 1 гамма-аминомасляной кислоты; GRIN1 – глутаматный НМDA-рецептор 1; GRMA1 – метаботропный глутаматный рецептор 1; GRMA2 – метаботропный глутаматный рецептор 2; GRMA5 – метаботропный глутаматный рецептор 5; HRH1 – гистаминовый рецептор H1; HRH2 – гистаминовый рецептор H2; HRH3 – гистаминовый рецептор H3; HTR1A – рецептор серотонина 1а; HTR2A – рецептор серотонина 2а; HTR3 – рецептор серотонина 3; MME – мембранная металлоэндопептидаза (неприлизин); NAT – переносчик норадреналина; OPRD – опиоидный рецептор дельта; OPRK – опиоидный рецептор каппа; OPRM – опиоидный рецептор мю; OPRM1 – опиоидный рецептор мю-1; OPRS – опиоидный рецептор сигма; SERT – транспортер серотонина; TRPV1 – ваниллоидный рецептор.
Figure 2. Chemoreactome evaluations of the central effects of tenoxicam and other nonsteroidal anti-inflammatory drugs on rat (Rattus norvegicus) proteome proteins. Estimates of half-maximal inhibitory concentration (IC50) constants of the listed target proteins are presented.
ADRA1 – alpha-1 adrenergic receptor; ADRA1A – alpha-1a adrenergic receptor; ADRA1D – alpha-1d adrenergic receptor; ADRA2 – alpha-2 adrenergic receptor; ADRB3 – beta-3 adrenergic receptor; AGTR1 – angiotensin II receptor type 1; AGTR2 – angiotensin II receptor type 2; BDKRB1 – bradykinin B1 receptor; CACNA(X) – L-type calcium channel; CACNA1D – L-type calcium channel; CHRNA3,B4 – neuronal acetylcholine receptor alpha-3, beta-4; CHRNA7 – neuronal acetylcholine receptor protein alpha-7 subunit; DAT – dopamine transporter; DRD1 – dopamine D1 receptor; DRD2 – dopamine D2 receptor; GABRA – gamma-aminobutyric acid A receptor; GABRB – gamma-aminobutyric acid B receptor; GAT1 – gamma-aminobutyric acid transporter 1; GRIN1 – glutamate HMDA receptor; GRMA1 – metabotropic glutamate receptor 1; GRMA2 – metabotropic glutamate receptor 2; GRMA5 – metabotropic glutamate receptor 5; HRH1 – histamine H1 receptor; HRH2 – histamine H2 receptor; HRH3 – histamine H3 Receptor; HTR1A – serotonin 1a receptor; HTR2A – serotonin 2a receptor; HTR3 – serotonin 3 receptor; MME – membrane metal endopeptidase (neprilysin); NAT – norepinephrine transporter; OPRD – delta оpioid receptor; OPRK – kappa opioid receptor; OPRM – mu opioid receptor; OPRM1 – mu-1 opioid receptor; OPRS – sigma opioid receptor; SERT – serotonin transporter; TRPV1 – vanilloid receptor.
Не установлено существенных различий между молекулами по отношению к ацетилхолиновым рецепторам CHRNA3,B4 (313–350 нМ) и CHRNA7 (227–264 нМ), рецепторам дофамина DRD1 (IC50 833–944 нМ), DRD2 (IC50 492–603 нМ) и транспортеру дофамина DAT (IC50 962–1183 нМ), рецепторам гамма-аминомасляной кислоты (ГАМК) типов GABRA (IC50 1112–1188 нМ), GABRB (IC50 285–1633 нМ) и ГАМК-транспортеру GAT1 (IC50 642–727 нМ), глутаматным рецепторам: ионотропному GRIN1 (IC50 515–1086 нМ), метаботропным GRMA1 (IC50 389–401 нМ) и GRMA2 (IC50 62–465 нМ).
Также не получено выраженных отличий воздействия молекул по отношению к гистаминовым рецепторам HRH3 (IC50 64–125 нМ), серотониновым рецепторам HTR1A (IC50 291–434 нМ), HTR2A (IC50 118–378 нМ), HTR3 (IC50 14–20 нМ), транспортеру обратного захвата SERT (IC50 276–380 нМ), опиоидным рецепторам типов дельта (IC50 953–1010 нМ), каппа (IC50 1081–1126 нМ), мю (IC50 769–935 нМ) и сигма (IC50 325–353 нМ).
В целом теноксикам не проявляет нежелательных действий центрального характера в большей степени, чем другие широко используемые НПВП. В то же время для метаботропного рецептора глутамата GRMA5 теноксикам (IC50 100 нМ) и мелоксикам (IC50 134 нМ) показали существенно лучшие результаты ингибирования, чем другие молекулы (IC50 235–1313 нМ).
При хемореактомном моделировании ряда тестов in vitro по ингибированию рецепторов ноцицептина теноксикам показал эффекты, сопоставимые с другими НПВП. В некоторых тестах эффекты теноксикама превосходили свойства других молекул. Например, при моделировании взаимодействия с рецептором ноцицептина при высоких концентрациях ноцицептина (10 нМ) значение константы ингибирования было самым низким именно в случае теноксикама (53,5 нМ; мелоксикам: 96,3 нМ; другие НПВП: 146–306 нМ) (табл. 3).
Таблица 3. Результаты хемореактомного моделирования ингибирования рецептора ноцицептина человека в различных тестах in vitro
Table 3. Results of chemoreactomic modeling of human nociceptin receptor inhibition in various in vitro tests
|
Активность / Activity |
Константа / Constant |
TNX |
MLX |
CLX |
KPF |
NMS |
DFN |
IPF |
|
Ингибирование связывания радиолиганда 3H-ноцицептина с рецептором ORL1 (0,5 нМ 3H-ноцицептина; 50 мМ HEPES; pH 7,4; 10 мМ MgCl2 и 1 мМ ЭДТА; 25 °С), нМ / Inhibition of 3H-nociceptin radioligand binding to ORL1 receptor (3H-nociceptin 0.5 nM; HEPES 50 mM; pH 7.4; MgCl2 10 mM and EDTA 1 mM; 25 °C), nM |
IC50 |
18,0 |
26,0 |
58,4 |
39,0 |
712,0 |
560,2 |
623,0 |
|
Ингибирование связывания радиолиганда 3H-ноцицептина (10 нМ) с 10–20 мкг мембранного белка при объеме буфера 500 мкл (10 мМ MgCl2; 1 мМ ЭДТА; 5% ДМСО; 50 мМ HEPES; pH 7,4), нМ / Inhibition of 3H-nociceptin radioligand binding (10 nM) to 10–20 μg membrane protein in a buffer volume of 500 μl (10 mM MgCl2; 1 mM EDTA; 5% DMSO; 50 mM HEPES; pH 7.4), nM |
IC50 |
53,5 |
96,3 |
269,5 |
306,4 |
146,2 |
218,7 |
277,9 |
|
Вытеснение 125I-ноцицептина из рецептора ноцицептина, нМ / Displacement of 125I-nociceptin from the nociceptin receptor, nM |
IC50 |
28,2 |
65,1 |
15,0 |
55,5 |
49,0 |
43,1 |
68,7 |
Примечание. TNX (англ. tenoxicam) – теноксикам; MLX (англ. meloxicam) – мелоксикам; CLX (англ. сelecoxib) – целекоксиб; KPF (англ. ketoprofen) – кетопрофен; NMS (англ. nimesulide) – нимесулид; DFN (англ. diclofenac) – диклофенак; IPF (англ. ibuprofen) – ибупрофен; ORL1 (англ. opioid receptor like receptor 1) – рецептор, подобный опиоидному рецептору 1; HEPES (англ. 4-(2-hydroxyethyl)-1-piperazineethanesulfonic acid) – 4-(2-гидроксиэтил)-1-пиперазинэтансульфоновая кислота; ЭДТА – этилендиаминтетрауксусная кислота; ДМСО – диметилсульфоксид; IC50 (англ. half-maximal inhibitory concentration) – константа концентрации полумаксимального ингибирования.
Note. TNX – tenoxicam; MLX – meloxicam; CLX – сelecoxib; KPF – ketoprofen; NMS – nimesulide; DFN – diclofenac; IPF – ibuprofen; ORL1 – opioid receptor like receptor 1; HEPES – 4-(2-hydroxyethyl)-1-piperazineethanesulfonic acid; EDTA – ethylenediaminetetraacetic acid; DMSO – dimethyl sulfoxide; IC50 – half-maximal inhibitory concentration.
Хемореактомное моделирование противоболевого действия per os у мышей (табл. 4) указало на выраженные противоболевые эффекты теноксикама. При анализе констант ED50 методом фенилхиноновых корчей и в тесте отдергивания хвоста эффекты теноксикама были сопоставимы с действием других НПВП. В случае теста против корчей, вызванных уксусной кислотой, теноксикам отличался наибольшей эффективностью – 50% эффективность (ED50) отмечена при 5 мг/кг (другие НПВП: 11–21 мг/кг). При анализе процентов животных с ингибированием корчей при дозе 100 мг/кг наибольший эффект также был найден для теноксикама (79,6%; другие НПВП: 47–58%).
Таблица 4. Результаты хемореактомного моделирования противоболевого действия у мышей при пероральном приеме веществ
Table 4. Results of chemoreactomic modeling of analgesic action in mice with oral administration of substances
|
Активность / Activity |
Константа / Constant |
TNX |
MLX |
CLX |
KPF |
NMS |
DFN |
IPF |
|
Процент анальгезии*, определенный с помощью теста на горячей пластине (5 мг/кг), % / Percentage of analgesia* determined using hot plate test (5 mg/kg), % |
– |
39,5 |
49,5 |
56,6 |
21,2 |
7,8 |
5,4 |
0,0 |
|
Ингибирование корчей, вызванных уксусной кислотой, при дозе 100 мг/кг per os за 1 ч, % // Inhibition of writhing induced by acetic acid at a dose of 100 mg/kg per os for 1 hour, % |
– |
79,6 |
51,5 |
49,4 |
46,7 |
56,6 |
58,2 |
46,7 |
|
Ингибирование корчей, вызванных уксусной кислотой, при дозе 10 мг/кг, % // Inhibition of writhing induced by acetic acid at a dose of 10 mg/kg, % |
– |
44,9 |
52,6 |
7,1 |
6,9 |
7,4 |
30,8 |
7,0 |
|
Анальгетическая активность у мышей линии ICR, оцененная как изменение болевого порога при дозе 25 мкмоль/кг после однократного приема per os, % // Analgesic activity in ICR mice, assessed as a change in pain threshold at a dose of 25 μmol/kg after a single per os dose, % |
– |
18,0 |
9,1 |
17,3 |
11,8 |
16,9 |
18,4 |
6,7 |
|
Анальгетическая активность против корчей, вызванных уксусной кислотой per os, мг/ кг // Analgesic activity against writhing caused by acetic acid per os, mg/kg |
ED50 |
4,8 |
11,2 |
20,7 |
21,0 |
18,8 |
19,5 |
21,3 |
|
Анальгетическая активность методом фенилхиноновых корчей, мг/ кг // Analgesic activity by phenylquinone writhing method, mg/kg |
ED50 |
18,9 |
22,2 |
43,2 |
37,0 |
33,9 |
23,4 |
19,4 |
|
Анальгезирующая активность в тесте отдергивания хвоста, мг/ кг // Analgesic activity in tail flick test, mg/kg |
ED50 |
10,2 |
9,5 |
20,4 |
14,7 |
10,1 |
10,3 |
17,7 |
Примечание. TNX (англ. tenoxicam) – теноксикам; MLX (англ. meloxicam) – мелоксикам; CLX (англ. сelecoxib) – целекоксиб; KPF (англ. ketoprofen) – кетопрофен; NMS (англ. nimesulide) – нимесулид; DFN (англ. diclofenac) – диклофенак; IPF (англ. ibuprofen) – ибупрофен; ICR (англ. Institute of Cancer Research) – линия белых мышей, выведенная в Швейцарии (поскольку мыши этой линии были отправлены в различные учреждения Института исследований рака в США, линия получила название ICR); ЕD50 (англ. median effective dose) – полуэффективная доза. * Процент анальгезии измерялся по сравнению с контролем (плацебо), применение плацебо соответствовало 0% анальгезии.
Note. TNX – tenoxicam; MLX – meloxicam; CLX – сelecoxib; KPF – ketoprofen; NMS – nimesulide; DFN – diclofenac; IPF – ibuprofen; ICR (Institute of Cancer Research) – a line of white mice bred in Switzerland (was called ICR, since mice of this line were sent to various ICR departments in the United States); ЕD50 – median effective dose. * Percentage of analgesia was measured in comparison with the control (placebo); the use of placebo corresponded to 0% analgesia.
Хемореактомный анализ анальгезии у крыс (подкожное введение) у теноксикама выявил наибольшее противоболевое действие в формалиновом тесте (32%; другие НПВП: 24–26%) (табл. 5).
Таблица 5. Результаты хемореактомного моделирования противоболевого действия изученных молекул у крыс при подкожном введении
Table 5. Results of chemoreactomic modeling of the analgesic effect of the studied molecules in rats upon subcutaneous administration
|
Активность / Activity |
Константа / Constant |
TNX |
MLX |
CLX |
KPF |
NMS |
DFN |
IPF |
|
Ингибирование реакции облизывания и кусания при 20 мг/кг, формалиновый ноцицептивный тест, % // Inhibition of licking and biting response at 20 mg/kg, formalin nociceptive test, % |
– |
31,6 |
24,4 |
23,9 |
24,1 |
24,2 |
26,3 |
24,1 |
|
Ингибирование гипералгезии, вызванной трипсином, при 20 мг/кг, % // Inhibition of trypsin-induced hyperalgesia at 20 mg/kg, % |
– |
26,8 |
23,1 |
24,8 |
20,6 |
20,1 |
25,1 |
24,0 |
|
Анальгетическая активность при подкожном введении как ингибирование боли, вызванной феназоцином, в тесте отдергивания хвоста Д'Амура–Смита, мг / Analgesic activity when administered subcutaneously as inhibition of pain induced by phenazocine in the D'Amour–Smith tail flick test, mg |
– |
44,7 |
31,2 |
21,3 |
24,4 |
25,4 |
48,0 |
25,0 |
|
Эффективность блокады натриевых каналов в нейронах ганглиев задних корешков, нМ / Efficiency of sodium channel blockade in dorsal root ganglia neurons, nM |
IC50 |
135,7 |
130,7 |
207,8 |
295,8 |
130,7 |
265,6 |
295,8 |
Примечание. TNX (англ. tenoxicam) – теноксикам; MLX (англ. meloxicam) – мелоксикам; CLX (англ. сelecoxib) – целекоксиб; KPF (англ. ketoprofen) – кетопрофен; NMS (англ. nimesulide) – нимесулид; DFN (англ. diclofenac) – диклофенак; IPF (англ. ibuprofen) – ибупрофен; IC50 (англ. half-maximal inhibitory concentration) – константа концентрации полумаксимального ингибирования.
Note. TNX – tenoxicam; MLX – meloxicam; CLX – сelecoxib; KPF – ketoprofen; NMS – nimesulide; DFN – diclofenac; IPF – ibuprofen; IC50 – half-maximal inhibitory concentration.
Имеющиеся результаты отдельных экспериментальных и клинических исследований подтверждают выводы, сделанные на основе хемореактомного анализа. В экспериментальном исследовании теноксикам показал достоверное превосходство по величине противовоспалительного и анальгетического действия над остальными исследуемыми НПВП, за исключением эторикоксиба. Оценка противовоспалительного действия различных НПВП у крыс в условиях острой воспалительной реакции («фетровая» модель) показала наибольшее (относительно плацебо) уменьшение отека конечностей при применении теноксикама и эторикоксиба (60%; p<0,05). В случае введения животным мелоксикама, нимесулида, целекоксиба, кетопрофена, декскетопрофена, диклофенака, ибупрофена и напроксена отек лапы снизился по сравнению с контролем на 43–55%. Применение теноксикама и эторикоксиба также уменьшало выраженность фазы экссудации на 57–61%, что было достоверно выше (p<0,05), чем в случае использования мелоксикама, нимесулида, целекоксиба, кетопрофена, декскетопрофена, диклофенака, ибупрофена и напроксена, и более выраженно снижало уровни провоспалительного интерлейкина-6 (на 52–56%; другие молекулы: 38–39%) [5].
В клиническом исследовании эффекты 20 или 40 мг теноксикама на выраженность послеоперационной боли у пациентов, перенесших торакотомию, показали достоверное снижение выраженности боли по визуальной аналоговой шкале [15].
Фармакоинформационное профилирование / Pharmacoinformatiс profiling
Группы АТХ-классификации
В рамках фармакоинформационного профилирования исследуемых молекул методом хемореактомного анализа была оценена принадлежность каждой к различным классам фармакологического действия по АТХ-системе и найдены достоверно значимые отличия для 142 классов АТХ. При попарном сравнении полученные АТХ-профили молекул заметно отличались (табл. 6): наиболее схожи были теноксикам и мелоксикам (59%), кетопрофен и диклофенак (54%).
Таблица 6. Схожесть фармакологического действия исследованных нестероидных противовоспалительных препаратов (НПВП) по результатам фармакоинформационного профилирования, %*
Table 6. Similarity of the pharmacological action of the studied nonsteroidal anti-inflammatory drugs (NSAIDs) based on the results of pharmacoinformatic profiling, %*
|
НПВП / NSAIDs |
TNX |
MLX |
CLX |
KPF |
NMS |
DFN |
IPF |
|
TNX |
100 |
59 |
25 |
22 |
37 |
19 |
2 |
|
MLX |
59 |
100 |
27 |
33 |
24 |
17 |
14 |
|
CLX |
25 |
27 |
100 |
17 |
8 |
10 |
15 |
|
KPF |
22 |
33 |
17 |
100 |
2 |
54 |
38 |
|
NMS |
37 |
24 |
8 |
2 |
100 |
4 |
4 |
|
DFN |
19 |
17 |
10 |
54 |
4 |
100 |
38 |
|
IPF |
2 |
14 |
15 |
38 |
4 |
38 |
100 |
Примечание. TNX (англ. tenoxicam) – теноксикам; MLX (англ. meloxicam) – мелоксикам; CLX (англ. сelecoxib) – целекоксиб; KPF (англ. ketoprofen) – кетопрофен; NMS (англ. nimesulide) – нимесулид; DFN (англ. diclofenac) – диклофенак; IPF (англ. ibuprofen) – ибупрофен. * Проценты оценены на основании сравнения 142-мерных векторов, каждый компонент которых соответствует определенному фармакологическому эффекту по анатомо-терапевтическо-химической классификации.
Note. TNX – tenoxicam; MLX – meloxicam; CLX – сelecoxib; KPF – ketoprofen; NMS – nimesulide; DFN – diclofenac; IPF – ibuprofen. * The percentages were estimated based on a comparison of 142-dimensional vectors, each component of which corresponded to a specific pharmacological effect according to anatomical-therapeutic-chemical classification.
На метрической карте (рис. 3) отображены данные таблицы 6 в наглядной графической форме. Из рисунка 4 очевидно, что профиль фармакологических эффектов теноксикама (и, отчасти, мелоксикама) существенно отличается от профилей фармакологических эффектов других НПВП.
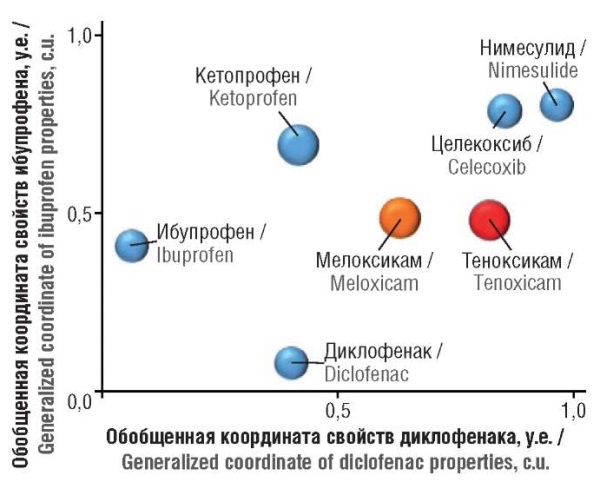
Рисунок 3. Метрическая диаграмма схожести профилей фармакологического действия исследованных соединений. Каждому соединению соответствует одна точка, которой, в свою очередь, соответствует 142-мерный вектор, отражающий комплекс оценок фармакологических активностей, полученный в результате проведения фармакоинформационного анализа. Диаграмма составлена посредством проецирования матрицы расстояний между 142-мерными векторами (см. табл. 6) для каждого соединения на плоскость. Чем больше расстояние между точками, тем больше различия в фармакоинформационных профилях соответствующих соединений
Figure 3. Metric diagram of the similarity of the pharmacological action profiles of the studied compounds. Each compound corresponds to one point, which in turn corresponds to a 142-dimensional vector reflecting a set of pharmacological activity assessments obtained as a result of pharmacoinformatic analysis. The diagram was obtained by projecting the matrix of distances between 142-dimensional vectors (see Table 6) for each compound onto a plane. The greater the distance between the points, the greater the differences in the pharmacoinformatic profiles of the corresponding compounds
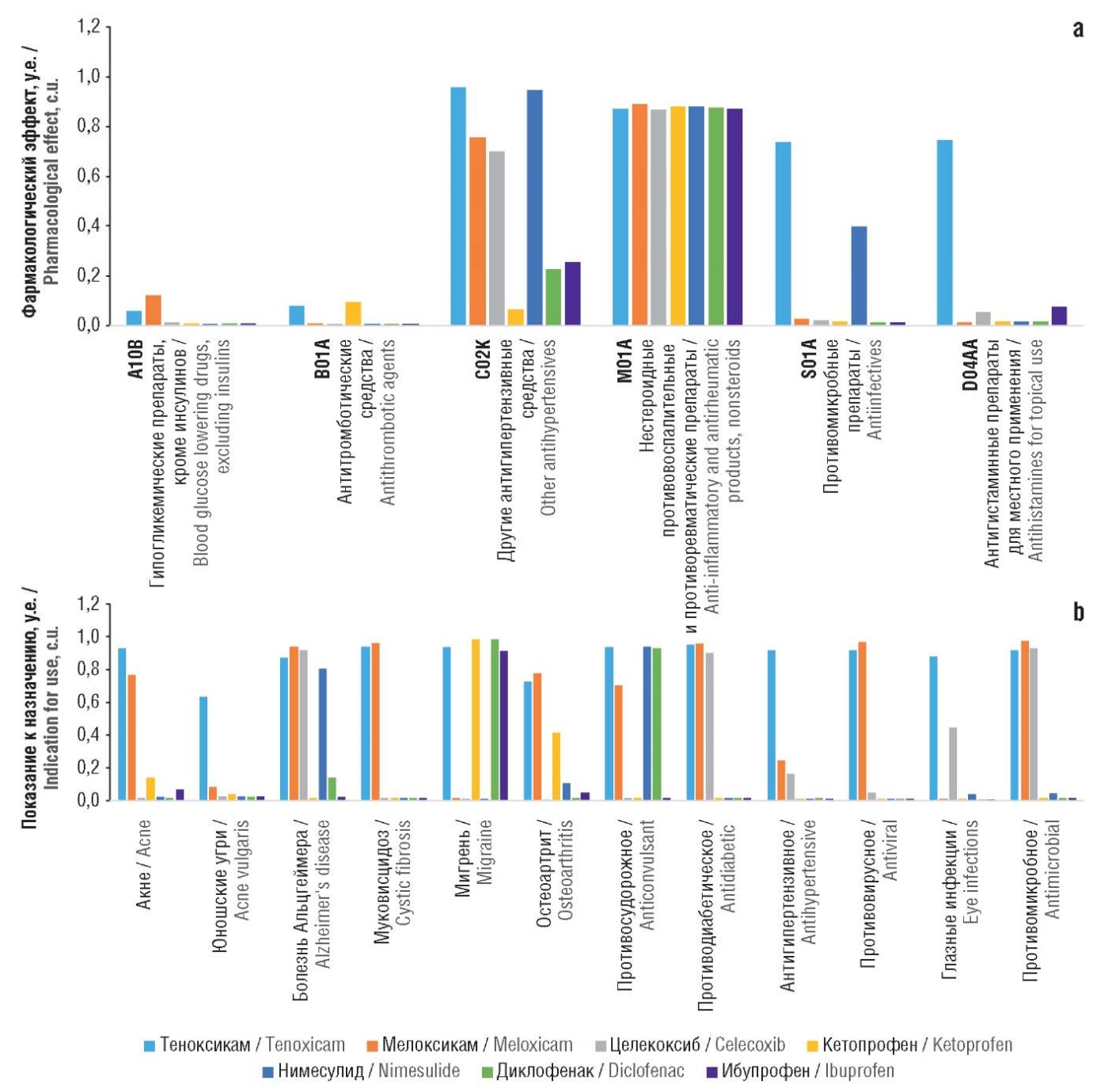
Рисунок 4. Фармакоинформационные профили исследованных нестероидных противовоспалительных препаратов:
а – классы по анатомо-терапевтическо-химической классификации; b – показания к назначению препаратов
Figure 4. Рharmacoinformatic profiles of the studied nonsteroidal anti-inflammatory drugs:
a – classes of anatomical-therapeutic-chemical classification; b – indications for prescribing the drugs
Более подробный анализ фармакоинформационых профилей веществ позволяет детализировать различия между эффектами молекул. Естественно, что фармакоинформационный анализ подтвердил принадлежность всех исследованных НПВП к группе АТХ M01A Нестероидные противовоспалительные и противоревматические препараты. В то же время результаты указали на определенные свойства теноксикама, которые отличают эту молекулу от других исследованных НПВП (см. рис. 4а). В частности, теноксикам отличается принадлежностью к группам препаратов B01A Антитромботические средства и A10B Гипогликемические препараты, кроме инсулинов. Антигипертензивные свойства (группа АТХ C02K) возможны для теноксикама, мелоксикама, целекоксиба, нимесулида. К группам S01A Противомикробные препараты и D04AA Антигистаминные препараты для местного применения из исследованных действующих начал препаратов был отнесен только теноксикам.
Анализ показаний к потенциальному назначению препаратов (см. рис. 4b) продемонстрировал, что среди исследованных НПВП только теноксикам и мелоксикам характеризовались наибольшими вероятностями для назначения при акне, муковисцидозе, остеоартрите, как противовирусное или как противомикробное средство. При этом только для теноксикама была предсказана возможность назначения при глазных инфекциях и при юношеских угрях (acne vulgaris). Следует также отметить потенциальные противодиабетические свойства теноксикама (наряду с мелоксикамом и целекоксибом) и использование при мигрени (наряду с кетопрофеном).
Побочные эффекты
Фармакоинформационный анализ частот встречаемости побочных действий для 7 исследованных НПВП выявил достоверные отличия между препаратами для 17 групп побочных эффектов. Корреляционный и кластерный анализ продемонстрировал, что частоты большинства побочных действий коррелировали друг с другом (рис. 5). В этот кластер вошли побочные эффекты, связанные с астенией, отеком, гипогликемией и дерматитом. В то же время тромбоцитопения, желудочно-кишечные расстройства и головная боль не коррелировали с другими побочными действиями, т.е. являлись более независимыми показателями, чем побочные эффекты, сгруппированные в кластере.
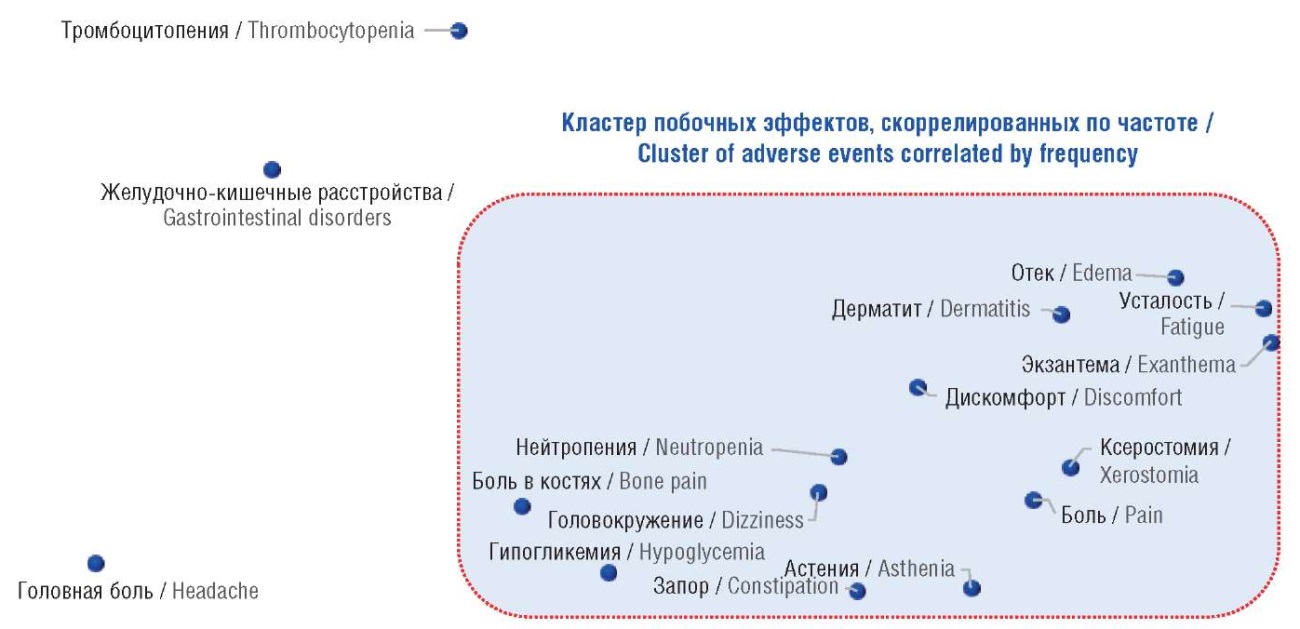
Рисунок 5. Кластерный анализ частот встречаемости различных побочных эффектов исследованных нестероидных противовоспалительных препаратов. Каждой точке на диаграмме соответствует вектор из 7 значений оценок частот встречаемости соответствующего эффекта, полученных для исследованных веществ. Расстояние между точками оценивалось косинус-метрикой, после чего проведено проецирование полученной таким образом матрицы расстояний на плоскость (методом многомерного шкалирования)
Figure 5. Cluster analysis of the frequencies of occurrence of various side effects of the studied nonsteroidal anti-inflammatory drugs. Each point on the diagram corresponds to a vector of 7 values of the estimates of corresponding effect frequencies obtained for the studied substances. The distance between the points was estimated by the cosine metric, after which the resulting distance matrix was projected onto a plane (using the multidimensional scaling method)
По результатам фармакоинформационного анализа частоты встречаемости конкретных побочных эффектов (рис. 6) установлено отсутствие характерных для теноксикама побочных действий, которые встречались бы у него более часто по сравнению с молекулами сравнения. В случае других НПВП такие побочные эффекты были спрогнозированы: например, дерматит для диклофенака, запор для ибупрофена и т.д.
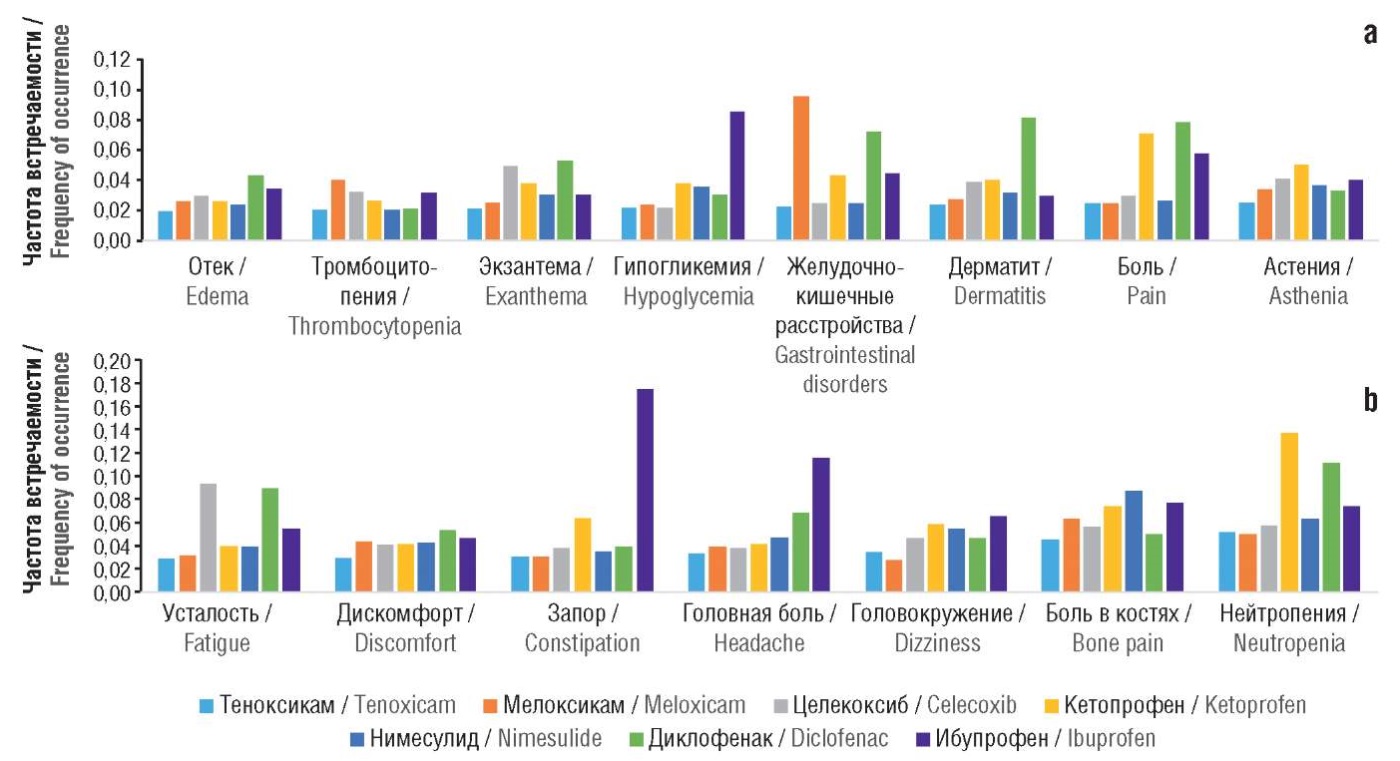
Рисунок 6. Фармакоинформационный анализ частот встречаемости конкретных побочных эффектов исследованных молекул (а, b)
Figure 6. Pharmacoinformatic analysis of the frequencies of occurrence of specific side effects of the studied molecules (а, b)
Анализ частот встречаемости побочных эффектов, усредненных по их исследованной выборке, показал, что теноксикам характеризовался наименьшей частотой всех указанных побочных действий, тогда как наибольшая частота была найдена для ибупрофена (рис. 7).
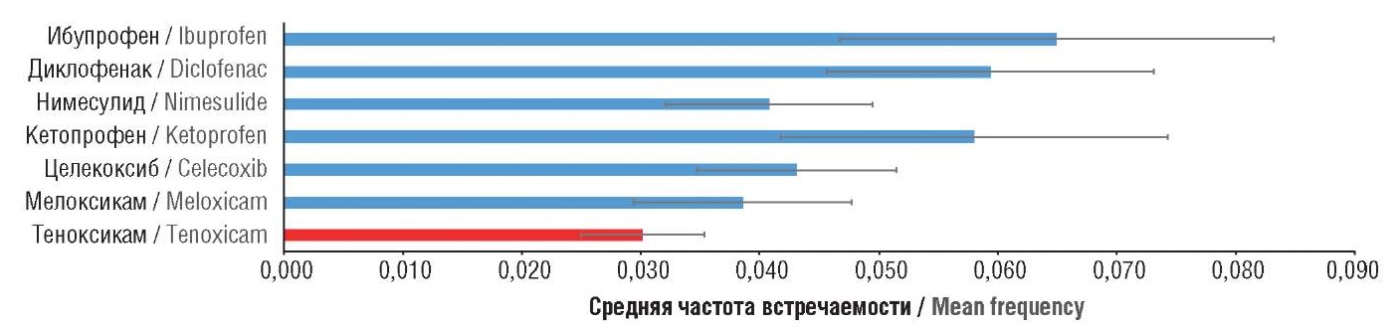
Рисунок 7. Средняя частота встречаемости побочных эффектов всех разновидностей для исследованных нестероидных противовоспалительных препаратов
Figure 7. Mean frequency of adverse events of all types for the studied nonsteroidal anti-inflammatory drugs
Антивитаминные и антиминеральные эффекты / Аntivitamin and antimineral effects
Негативное влияние фармпрепаратов (в т.ч. НПВП) на организм человека связано, в частности, с усилением потерь витаминов и микроэлементов. Поскольку все витамины и многие микроэлементы проявляют выраженные противовоспалительные, антиоксидантные и даже противоболевые свойства (например, витамин В12) [16], то выведение микронутриентов препаратами утяжеляет состояние пациента, особенно при долговременном приеме НПВП. Поэтому важной частью фармакоинформационного анализа является сопоставление антивитаминных и антиминеральных профилей препаратов (рис. 8).
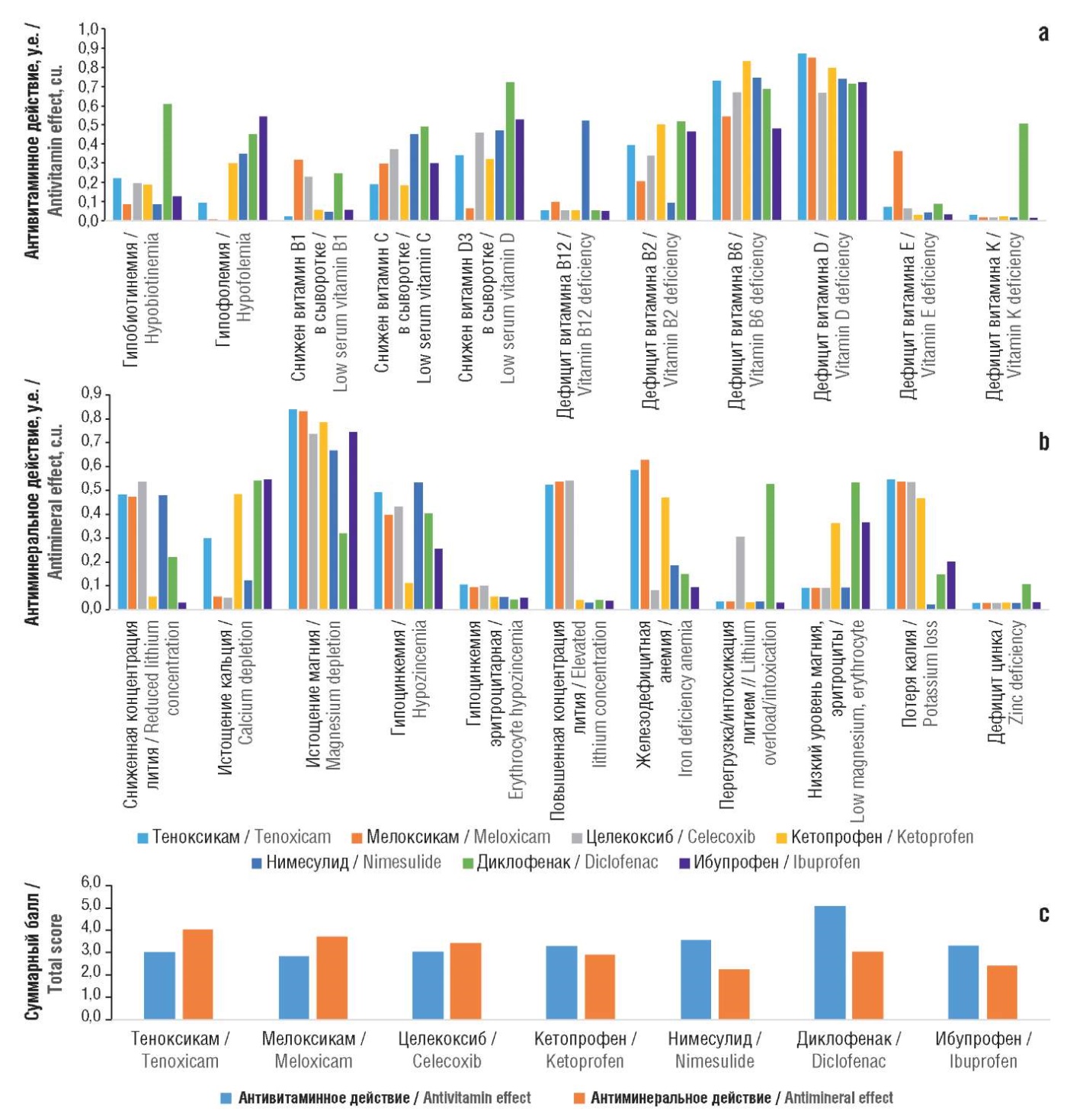
Рисунок 8. Фармакоинформационные оценки антивитаминных и антиминеральных свойств исследованных молекул:
а – антивитаминное действие; b – антиминеральное действие; c – суммарные баллы
Figure 8. Pharmacoinformatic assessments of antivitamin and antimineral properties of the studied molecules:
а – antivitamin action; b – antimineral action; c – total scores
В соответствии с полученными результатами максимальные антивитаминные и антимикроэлементные эффекты проявляли диклофенак и нимесулид, которые могут стимулировать выведение лития, кальция, магния, цинка, витаминов групп В, С и D. Общий антимикронутриентный балл теноксикама – 7,03, что не превышает существенно антимикронутриентные свойства других НПВП (суммарные баллы 5,7–6,54) и значительно отличается в лучшую сторону от показателя диклофенака (8,11). Таким образом, теноксикам не стимулирует более сильных потерь микронутриентов, чем другие НПВП (за исключением диклофенака).
Эффекты парентерального и топического применения / Effects of parenteral and topical administration
Хемореактомное моделирование противовоспалительных эффектов изученных НПВП на разных организмах (Cavia porcellus, Mus musculus) показало, что топические эффекты теноксикама сопоставимы с противовоспалительным действием других НПВП при топическом применении (табл. 7).
Таблица 7. Хемореактомное моделирование топических эффектов изученных нестероидных противовоспалительных препаратов на разных модельных организмах
Table 7. Chemoreactomic modeling of topical effects of the studied nonsteroidal anti-inflammatory drugs on different model organism
|
Активность / Activity |
Организм / Organism |
TNX |
MLX |
CLX |
KPF |
NMS |
DFN |
IPF |
|
In vivo противогрибковая активность при местном лечении дерматофитоза, вызванного Trichophyton mentagrophytes, % / In vivo antifungal activity in topical treatment of dermatophytosis caused by Trichophyton mentagrophytes, % |
||||||||
|
Доза 0,1% / Dose 0.1% |
Cavia porcellus |
13,9 |
13,9 |
13,9 |
13,9 |
13,9 |
13,9 |
13,9 |
|
Доза 0,5% / Dose 0.5% |
46,4 |
50,1 |
46,6 |
46,6 |
46,7 |
47,5 |
46,5 |
|
|
Доза 2% / Dose 2% |
83,8 |
99,1 |
54,1 |
94,9 |
96,7 |
95,7 |
99,2 |
|
|
Противовоспалительная активность в модели дерматита уха у мышей как ингибирование отека уха, вызванного кротоновым маслом, % / Anti-inflammatory activity in mouse ear dermatitis model as inhibition of croton oil-induced ear edema, % |
||||||||
|
При нанесении 0,10 мкмоль местно / When applied topically at 0.10 μmol |
Mus musculus |
16,4 |
15,7 |
16,4 |
16,3 |
15,2 |
16,7 |
16,9 |
|
При нанесении 0,30 мкмоль местно / When applied topically at 0.30 μmol |
36,8 |
36,7 |
36,8 |
36,7 |
36,6 |
36,6 |
36,6 |
|
|
При нанесении 1 мкмоль местно / When applied topically at 1 μmol |
74,1 |
74,2 |
43,2 |
74,3 |
74,0 |
74,2 |
74,2 |
|
|
Противовоспалительная активность у мышей как ингибирование отека уха, вызванного PMA, % / Anti-inflammatory activity in mice as inhibition of PMA-induced ear swelling, % |
||||||||
|
При нанесении 25 мкг на ухо однократно после воздействия PMA / When applied to the ear once at 25 mcg after exposure to PMA |
Mus musculus |
45,4 |
45,4 |
45,7 |
45,4 |
45,4 |
45,4 |
45,4 |
|
При нанесении 500 мкг на ухо однократно после воздействия PMA / When applied to the ear once at 500 mcg after exposure to PMA |
57,4 |
57,0 |
57,1 |
57,1 |
57,4 |
57,1 |
57,1 |
|
|
Системная активность кортикостероидов после местного применения по сравнению с флуоцинолона ацетонидом, у.е. / Systemic activity of corticosteroids after topical application compared with fluocinolone acetonide, c.u. |
||||||||
|
У мышей / In mice |
Mus musculus |
27,0 |
27,0 |
31,2 |
56,7 |
27,0 |
56,7 |
36,1 |
|
У крыс / In rats |
Rattus norvegicus |
1,5 |
1,5 |
1,5 |
1,5 |
1,5 |
1,5 |
1,5 |
|
Коэффициент селективности местного и системного путей введения, у.е. / Selectivity coefficient of local and systemic routes of administration, c.u. |
||||||||
|
У крыс / In rats |
Rattus norvegicus |
0,6 |
0,6 |
0,7 |
0,7 |
0,6 |
0,7 |
0,7 |
Примечание. TNX (англ. tenoxicam) – теноксикам; MLX (англ. meloxicam) – мелоксикам; CLX (англ. сelecoxib) – целекоксиб; KPF (англ. ketoprofen) – кетопрофен; NMS (англ. nimesulide) – нимесулид; DFN (англ. diclofenac) – диклофенак; IPF (англ. ibuprofen) – ибупрофен; PMA (англ. phorbol 12-myristate 13-acetate) – форбол-12-миристат-13-ацетат.
Note. TNX – tenoxicam; MLX – meloxicam; CLX – сelecoxib; KPF – ketoprofen; NMS – nimesulide; DFN – diclofenac; IPF – ibuprofen; PMA – phorbol 12-myristate 13-acetate.
Данные об эффективности топического использования теноксикама подтверждены в клиническом исследовании пациентов с остеоартитом коленных суставов II–III стадий (n=60, возраст 41–78 лет). Топическое применение теноксима (в форме Артоксан® гель 1%) в течение 14 сут позитивно влияло на снижение боли, скованности, улучшение функционального состояния суставов и качество жизни. По сравнению с диклофенаком отмечено более быстрое и выраженное развитие обезболивающего эффекта [17].
Сравнение хемореактомных оценок эффектов НПВП при внутривенном введении модельным животным (Cavia porcellus, Mus musculus, Mustela putorius, Rattus norvegicus) не показало существенных отличий эффектов теноксикама от других НПВП (табл. 8). Тем не менее в ряде случаев эффекты теноксикама были более выражены. Например, противосудорожные эффекты в бикукуллиновом тесте (у мышей) наиболее проявлены для теноксикама (ED50 12,0 мг/кг; другие НПВП: 12,3–56,8 мг/кг). Аналогичная картина наблюдалась в тесте на кожную анафилаксию у крыс (ID50 38,1 мкмол/кг; другие НПВП: 56–77 мкмол/кг).
Таблица 8. Хемореактомное моделирование эффектов теноксикама и других нестероидных противовоспалительных препаратов при внутривенном введении модельным животным
Table 8. Chemoreactomic modeling of the effects of tenoxicam and other nonsteroidal anti-inflammatory drugs upon intravenous administration to model animals
|
Активность / Activity |
Организм / Organism |
Константа / Constant |
TNX |
MLX |
CLX |
KPF |
NMS |
DFN |
IPF |
|
Ингибирование LTD4, вызывающего бронхоспазм у анестезированных морских свинок после в/в введения в дозе 10 мг/кг, % // Inhibition of LTD4 causing bronchospasm in anesthetized guinea pigs after intravenous administration at a dose of 10 mg/kg, % |
Cavia porcellus |
– |
64,9 |
65,2 |
61,4 |
51,9 |
50,7 |
52,7 |
50,0 |
|
Доза, ингибирующая бронхоконстрикцию, вызванную PAF, у морских свинок при в/в введении после предварительной обработки (за 1 мин), мг/кг // Inhibitory dose of PAF-induced bronchoconstriction in guinea pigs when administered i/v after pretreatment (1 min), mg/kg |
Cavia porcellus |
ID50 |
0,1 |
0,0 |
0,0 |
0,0 |
0,2 |
0,1 |
0,0 |
|
Противосудорожная активность с использованием в/в теста с бикукуллином у мышей, мг/кг // Anticonvulsant activity using i/v bicuculline test in mice, mg/kg |
Mus musculus |
ED50 |
12,0 |
12,3 |
15,3 |
24,9 |
56,8 |
17,5 |
27,9 |
|
Средняя площадь под кривой при в/в введении хорьку в дозе 1 мг/кг, нг/мл/ч // Mean area under curve after i/v administration to a ferret at a dose of 1 mg/kg, ng/ml/h |
Mustela putorius furo |
AUC |
1238,8 |
706,9 |
1238,8 |
706,9 |
706,9 |
706,9 |
706,9 |
|
Ингибирование реакции пассивной кожной анафилаксии при в/в введении у крыс, мкМ/кг // Inhibition of passive cutaneous anaphylaxis reaction after i/v administration in rats, μM/kg |
Rattus norvegicus |
ID50 |
38,1 |
77,2 |
56,5 |
56,1 |
56,9 |
56,0 |
56,0 |
|
Средняя площадь под кривой у крыс после в/в введения в дозе 1 мг/кг, нг/мл/ч // Mean area under the curve in rats after i/v administration at a dose of 1 mg/kg, ng/ml/h |
Rattus norvegicus |
AUC |
333,5 |
228,7 |
340,7 |
228,7 |
228,7 |
228,7 |
228,7 |
|
Эффективная доза, вызывающая 50% снижение эффекта серотонина у крыс после в/в введения, мкМ/кг // Effective dose causing 50% reduction in the effect of serotonin in rats after i/v administration, μM/kg |
Rattus norvegicus |
ED50 |
0,2 |
0,1 |
0,06 |
0,8 |
0,04 |
0,01 |
0,7 |
|
Изменение частоты сердечных сокращений у анестезированных крыс после в/в введения, % / Change in heart rate in anesthetized rats after i/v administration, % |
Rattus norvegicus |
– |
–5,6 |
–5,2 |
–10,8 |
–7,4 |
–5,8 |
–7,6 |
–12,0 |
Примечание. TNX (англ. tenoxicam) – теноксикам; MLX (англ. meloxicam) – мелоксикам; CLX (англ. сelecoxib) – целекоксиб; KPF (англ. ketoprofen) – кетопрофен; NMS (англ. nimesulide) – нимесулид; DFN (англ. diclofenac) – диклофенак; IPF (англ. ibuprofen) – ибупрофен; LTD4 (англ. leukotriene D4) – лейкотриен D4; PAF (англ. platelet activating factor) – фактор активации тромбоцитов; в/в – внутривенно; ID50 (англ. median infective dose) – средняя неэффективная доза; ЕD50 (англ. median effective dose) – средняя эффективная доза; AUC (англ. area under curve) – площадь под кривой.
Note. TNX – tenoxicam; MLX – meloxicam; CLX – сelecoxib; KPF – ketoprofen; NMS – nimesulide; DFN – diclofenac; IPF – ibuprofen; LTD4 – leukotriene D4; PAF – platelet activating factor; i/v – intravenously; ID50 – median infective dose; ЕD50 – median effective dose; AUC – area under curve.
Ограничения исследования / Limitations of the study
Возможные ограничения исследования, связанные с использованием in silico моделей, включают ограничения по точности используемых алгоритмов (коэффициент корреляции между рассчитанными и экспериментальными значениями активностей равен 0,87±0,12 в среднем по выборке активностей). Поэтому перспективными направлениями дальнейшей работы являются дополнительные экспериментальные и клинические исследования (например, клинические испытания для подтверждения антитромботических эффектов теноксикама).
ЗАКЛЮЧЕНИЕ / CONCLUSION
Проблема нежелательных эффектов, возникающих при клиническом использовании НПВП, является одной из основных. Кардио- и гепатотоксичность многих НПВП ставит задачу поиска действующих начал НПВП с наилучшим профилем безопасности. Пациенты, нуждающиеся в долговременном применении НПВП (например, при остеоартрите), особенно уязвимы к побочным действиям. Для сравнения различных НПВП с точки зрения баланса между эффективностью и безопасностью необходимо получить стандартизированные профили желательных и нежелательных эффектов препаратов.
В настоящей работе оценены противовоспалительные, противоболевые и центральные эффекты теноксикама и молекул сравнения, а также получены профили частот побочных действий НПВП. Интересным результатом исследования стало установление потенциальных антитромботических, гипогликемических и антигистаминных свойств теноксикама. Кроме того, для противовоспалительных и противоболевых эффектов данного препарата спрогнозирован уникальный механизм действия, включающий ингибирование уровней и активности провоспалительного LTB4 и проболевых кининов (брадикинин и др.). Теноксикам характеризуется наименьшей частотой изученных побочных эффектов (астения, отек, гипогликемия, дерматит, нейтропения, тромбоцитопения, запор, другие желудочно-кишечные расстройства) по сравнению с остальными НПВП и не стимулирует более сильных потерь витаминов и микроэлементов, чем другие НПВП.
Важно отметить, что при различных путях введения (топическом, пероральном, парентеральном) эффекты теноксикама сопоставимы с действием других изученных НПВП. Перспективным направлением в повышении безопасности терапии НПВП является комбинирование нескольких путей введения (топического и перорального, внутримышечного и топического и др.). Поэтому наличие у теноксикама дополнительных механизмов противоболевого действия (антигистаминный, ингибирование эффектов LTB4 и кининов) может позволить снизить дозу, а при необходимости – увеличить длительность курса лечения, причем без угрозы повышения риска побочных эффектов терапии.
Препараты линии Артоксан® выпускаются в трех формах: для перорального, внутримышечного/внутривенного и наружного применения (в виде геля). Гель Артоксан® для наружного применения 1% легко проникает через гистогематический барьер, достигая даже синовиальной жидкости суставов пропорционально площади, на которую он наносится. Поскольку теноксикам характеризуется длительным периодом полувыведения (до 75 ч), использование геля позволит существенно улучшить баланс эффективности и безопасности терапии.
Список литературы
1. Richy F. NSAIDS, malignancies and GI adverse events: a FAERS analysis. Gen Med Open. 2018; 2 (4). https://doi.org/10.15761/GMO.1000137.
2. Серова О.Ф., Пырегов А.В., Гаспарян С.А. и др. Консенсус терапии воспаления и боли. Медицина у истоков жизни. 2024; 1: 2–7.
3. Бутранова О.И., Зырянов С.К. Выбор нестероидных противовоспалительных препаратов для рациональной фармакотерапии хронической скелетно-мышечной боли: взгляд клинического фармаколога. Неврология, нейропсихиатрия, психосоматика. 2024; 16 (2): 87–94. https://doi.org/10.14412/2074-2711-2024-2-87-94
4. Теноксикам. Регистр лекарственных средств России. URL: https://www.rlsnet.ru/active-substance/tenoksikam-981 (дата обращения 29.03.2025).
5. Кукес И.В., Поздняков Д.И. Оценка фармакодинамических параметров теноксикама на моделях in vitro и in vivo. Лекарственные средства и рациональная фармакотерапия. 2024; 3 (12): 47–58.
6. Рачин А.П., Выговская С.Н., Нувахова М.Б. и др. Наблюдательное исследование по оценке эффективности и безопасности теноксикама при дорсалгии в сравнении с мелоксикамом и диклофенаком натрия. Русский медицинский журнал. 2018; 26 (4-2): 43–6.
7. Vignon E., Mathieu P., Louisot P., Richard M. In vitro effect of nonsteroidal antiinflammatory drugs on proteoglycanase and collagenase activity in human osteoarthritic cartilage. Arthritis Rheum. 1991; 34 (10): 1332–5. https://doi.org/10.1002/art.1780341021.
8. Торшин И.Ю. О задачах оптимизации, возникающих при применении топологического анализа данных к поиску алгоритмов прогнозирования с фиксированными корректорами. Информатика и ее применения. 2023; 17 (2): 2–10. https://doi.org/10.14357/19922264230201.
9. Торшин И.Ю. О применении топологического подхода к анализу плохо формализуемых задач для построения алгоритмов виртуального скрининга квантово-механических свойств органических молекул I: Основы проблемно ориентированной теории. Информатика и ее применения. 2022; 16 (1): 39–44. https://doi.org/10.14357/19922264220106.
10. Торшин И.Ю. О применении топологического подхода к анализу плохо формализуемых задач для построения алгоритмов виртуального скрининга квантово-механических свойств органических молекул. Часть 2. Сопоставление формализма с конструктами квантовой механики и экспериментальная апробация предложенных алгоритмов. Информатика и ее применения. 2022; 16 (2): 35–43. https://doi.org/10.14357/19922264220205.
11. Torshin I.Yu. On solvability, regularity, and locality of the problem of genome annotation. Pattern Recognit Image Anal. 2010; 20: 386–95. https://doi.org/10.1134/S1054661810030156.
12. Торшин И.Ю., Громова О.А., Сардарян И.С., Федотова Л.Э. Сравнительный хемореактомный анализ мексидола. Журнал неврологии и психиатрии им. С.С. Корсакова. Спецвыпуски. 2017; 117 (1-2): 75–83. https://doi.org/10.17116/jnevro20171171275-84.
13. Громова О.А., Торшин И.Ю., Федотова Л.Э. и др. Хемоинформационный анализ молекулы оротовой кислоты указывает на противовоспалительные, нейропротекторные и кардиопротекторные свойства лиганда магния. Фарматека. 2013; 13: 95–104. https://pharmateca.ru/ru/archive/article/12025.
14. Donkin J.J., Turner R.J., Hassan I., Vink R. Substance P in traumatic brain injury. Prog Brain Res. 2007; 161: 97–109. https://doi.org/10.1016/S0079-6123(06)61007-8.
15. Merry A.F., Sidebotham D.A., Middleton N.G., et al. Tenoxicam 20 mg or 40 mg after thoracotomy: a prospective, randomized, double-blind, placebo-controlled study. Anaesth Intensive Care. 2002; 30 (2): 160–6. https://doi.org/10.1177/0310057X0203000206.
16. Громова О.А., Торшин И.Ю. Микронутриенты и репродуктивное здоровье. Руководство. 2-е изд. М.: ГЭОТАР-Медиа; 2022: 832 c.
17. Кашеварова Н.Г., Таскина Е.А., Стребкова Е.А. и др. Проспективное сравнительное рандомизированное исследование эффективности и безопасности топических форм теноксикама и диклофенака у пациентов с остеоартритом коленных суставов. Современная ревматология. 2023; 17 (3): 51–9. https://doi.org/10.14412/1996-7012-2023-3-51-59.
Об авторах
И. Ю. ТоршинRussian Federation
Торшин Иван Юрьевич, к.ф-м.н., к.х.н.
WoS ResearcherID: C-7683-2018.
Scopus Author ID: 7003300274.
ул. Вавилова, д. 44, корп. 2, Москва 119333
А. Н. Громов
Russian Federation
Громов Андрей Николаевич
WoS ResearcherID: C-7476-2018.
Scopus Author ID: 7102053964.
ул. Вавилова, д. 44, корп. 2, Москва 119333
О. А. Громова
Russian Federation
Громова Ольга Алексеевна, д.м.н., проф.
WoS ResearcherID: J-4946-2017.
Scopus Author ID: 7003589812.
ул. Вавилова, д. 44, корп. 2, Москва 119333
Что уже известно об этой теме?
► Анализ базы данных FAERS, содержащей отчеты о побочных эффектах лекарств у конкретных пациентов, показал, что применение подавляющего большинства нестероидных противовоспалительных препаратов (НПВП) связано с высоким уровнем жалоб на осложнения
► В качестве критерия безопасности НПВП необходимо использовать оценки их взаимодействия не только с циклооксигеназой-1 и -2, но и с другими белками протеома
Что нового дает статья?
► Применение методов хемоинформационного анализа молекул позволяет оценивать спектры фармакологического действия препаратов, определяя различия в молекулярно-фармакологических механизмах действия НПВП и других препаратов
► Теноксикам, в отличие от других молекул, может существенно влиять на синтез, секрецию и активность лейкотриена В4 и проявлять ингибирующие эффекты на рецепторы кининов. Он не стимулирует более сильные потери микронутриентов, чем другие НПВП
► Анализ частот встречаемости различных побочных эффектов, усредненных по их исследованной выборке, выявил, что теноксикам характеризуется наименьшим показателем
Как это может повлиять на клиническую практику в обозримом будущем?
► Хемореактомное, хемопротеомное и фармакоинформационное профилирование указало на более благоприятный баланс эффективности и безопасности у теноксикама, чем у молекул сравнения
Рецензия
Для цитирования:
Торшин И.Ю., Громов А.Н., Громова О.А. Хемопротеомный анализ теноксикама в сравнении с другими нестероидными противовоспалительными препаратами. ФАРМАКОЭКОНОМИКА. Современная фармакоэкономика и фармакоэпидемиология. 2025;18(3):340-356. https://doi.org/10.17749/2070-4909/farmakoekonomika.2025.307
For citation:
Torshin I.Yu., Gromov A.N., Gromova O.A. Chemoproteomic analysis of tenoxicam compared with other nonsteroidal anti-inflammatory drugs. FARMAKOEKONOMIKA. Modern Pharmacoeconomics and Pharmacoepidemiology. 2025;18(3):340-356. (In Russ.) https://doi.org/10.17749/2070-4909/farmakoekonomika.2025.307
JATS XML

Контент доступен под лицензией Creative Commons Attribution-NonCommercial-ShareAlike 4.0 International License.






































