Перейти к:
Хемопротеомный анализ фармакологических свойств производных витамина В12
https://doi.org/10.17749/2070-4909/farmakoekonomika.2024.214
Аннотация
Актуальность. Химические производные витамина В12 характеризуются широким спектром фармакологического действия. Важно научиться устанавливать взаимосвязи между изменениями структуры корринового кольца в производных витамина В12 и изменениями фармакологических свойств.
Цель: оценка взаимодействия шести производных витамина В12 (аквакобаламин, диаквакобинамид, аквациано-формы гептаэтаноламин-, гептаэтилендиамин-, гептаметил- и гептабутилкобиринатов) с белками протеома человека.
Материал и методы. Методом хемоинформационного (хемопротеомного) анализа, реализованного в рамках алгебраической теории распознавания и топологического анализа данных, проведены оценки констант концентрации полумаксимального ингибирования (англ. half-maximal inhibitory concentration, IC50) и полумаксимальной эффективной концентрации (англ. half-maximal effective concentration, ЕС50) белков протеома человека.
Результаты. Найдены достоверные отличия во взаимодействиях исследованных молекул с 1200 белками. Показано, что хемопротеомные профили каждого из соединений формируют три группы молекул с близкими протеомными свойствами: 1) аквакобаламин; 2) диаквакобинамид, аквациано-формы гептаэтаноламин- и гептаэтилендиаминкобиринатов; 3) аквациано-формы гептаметил- и гептабутилкобиринатов. Более детальный анализ хемопротеомных профилей исследуемых соединений с использованием номенклатуры биологических функций белков GO (англ. Gene Ontology) позволил выделить функциональные категории GO, указывающие на различия в биологических эффектах исследуемых соединений: нейропротективная регуляция активности нейротрансмиттеров (активность рецептора серотонина, холинергические синапсы, регуляция секреции дофамина, рецептор гормонов щитовидной железы), снижение воспаления (ингибирование биосинтеза цитокинов, в т.ч. фактора некроза опухоли альфа и интерлейкина 1-бета, I-каппа-B киназы / ядерного фактора каппа-B, миграции лейкоцитов) и др.
Заключение. Выявлены и описаны профили отличий фармакологических свойств исследуемых соединений относительно воздействия на нейропротекцию, обмен нейротрансмиттеров и воспаление.
Ключевые слова
Для цитирования:
Торшин И.Ю., Громова О.А., Деревеньков И.А., Майорова Л.А. Хемопротеомный анализ фармакологических свойств производных витамина В12. ФАРМАКОЭКОНОМИКА. Современная фармакоэкономика и фармакоэпидемиология. 2024;17(3):345-357. https://doi.org/10.17749/2070-4909/farmakoekonomika.2024.214
For citation:
Torshin I.Yu., Gromova O.A., Dereven’kov I.A., Maiorova L.A. Chemoproteomic analysis of the pharmacological properties of vitamin В12 derivatives. FARMAKOEKONOMIKA. Modern Pharmacoeconomics and Pharmacoepidemiology. 2024;17(3):345-357. (In Russ.) https://doi.org/10.17749/2070-4909/farmakoekonomika.2024.214
ВВЕДЕНИЕ / INTRODUCTION
Широкий круг биологических ролей витамина В12 обусловлен высокоспецифичными (целевыми) взаимодействиями с белками протеома (не менее 24 витамин-В12-зависимых белков в протеоме человека [1]). Помимо влияния на протеом человека витамин также служит своего рода каркасом для направленного органического синтеза молекул с желаемыми свойствами, в т.ч. для таргетной доставки лекарств, использования в качестве антидотов, разработки химических сенсоров и др. [2–5].
Представленная в работе [2] систематизация информации о таргетной модуляции свойств корринов посредством химических модификаций показала, каким образом можно регулировать свойства производных витамина В12 путем введения специфических замещений групп в корриновом кольце. Результаты систематического компьютерного анализа публикаций о корринах позволили сформировать выборку молекул – кандидатов для исследований корринов in silico, in vitro и in vivo: аквакобаламин и его безнуклеотидное производное – диаквакобинамид (DACbi), производные аквацианокобириновой кислоты – амиды, содержащие остатки этаноламина и этилендиамина, гептаметиловый и гептабутиловый сложные эфиры.
Эти соединения обладают различным сродством к кобаламин-зависимым и неспецифическим по отношению к корриноидам белкам. В частности, транскобаламин II (транспортный белок крови, участвующий в доставке кобаламинов в клетки) обладает высокой чувствительностью к изменениям в их структуре [6], что способствует транспорту витамина B12 и затрудняет поступление корриноидов c модифицированной периферией из крови внутрь клеток. Изменения в структуре корриноидов заметно отражаются на их реакционной способности по отношению к сывороточному альбумину: аквакобаламин реагирует с бычьим сывороточным альбумином (БСА) с относительно низкой скоростью, образуя аминокомплекс [7], обладающий высокой инертностью в реакциях лигандного обмена и редокс-взаимодействиях [8], тогда как DACbi реагирует с БСА с более высокой скоростью и связывается с ним в эквимолярном соотношении [9]. Гидролиз всех амидных связей в кобинамиде приводит к образованию кобириновой кислоты, которая очень слабо связывается с БСА, что обусловлено электростатическим отталкиванием между этими молекулами, имеющими в нейтральной среде отрицательный заряд. Этерификация карбоксильных групп в кобириновой кислоте приводит к повышению ее гидрофобности и увеличивает прочность связывания с БСА [10]. Реакционная способность амидов кобириновой кислоты, содержащих остатки этаноламина и этилендиамина, по отношению к белкам неизвестна, однако можно предположить, что данная модификация ее структуры приведет к увеличению прочности связывания с сывороточными белками за счет электростатического притяжения (в случае амида с остатками этилендиамина, молекула которого имеет большой положительный заряд в нейтральной среде) и умеренной липофильности (в случае амида с остатками этаноламина). Таким образом, выбранные соединения обладают различной реакционной способностью по отношению к белкам, что позволяет предположить наличие у них широкого спектра биологических свойств.
Ранее методом хемореактомного анализа была проведена оценка более 3500 биологических свойств пяти корриновых производных – цианокобаламина, аквакобаламина, гептаметилового эфира цианоаквакобириновой кислоты (аквациано-форма гептаметилкобирината, ACMeCby), гептаметилового эфира дицианокобириновой кислоты (дициано-форма гептаметилкобирината) и стабильного желтого корриноида. Показано, что аквакобаламин и ACMeCby можно рекомендовать для дальнейшего изучения в качестве обезболивающих и противовоспалительных средств [11]. Позднее в экспериментах на животных было установлено, что данное соединение обладает биологической активностью [12].
Кроме того, установлено, что макроциклические тетрапиррольные соединения, такие как коррины, корролы и порфирины, могут образовывать двумерные и трехмерные наноструктуры [13–18], а также наночастицы [3][19][20] с регулируемыми свойствами, что делает их актуальной группой веществ для изучения в качестве перспективных наноформ лекарственных препаратов. Получены супермолекулярные наноструктуры производного витамина В12 – гептабутилового эфира цианоаквакобириновой кислоты (аквациано-форма гептабутилкобирината, ACBuCby). Это уникальные наночастицы с сильными нековалентными межмолекулярными взаимодействиями, особыми свойствами и активностью [20]. Показано, что полученные наночастицы не только воспроизводят функциональные свойства комплексов витамина В12 с белками в живых организмах и действуют как витамин-В12-зависимые ферменты, но и демонстрируют важные преимущества перед витамином В12. Они более эффективны в реакциях восстановления/выделения кислорода и превращениях в другие формы [20]. Подобные наночастицы могут стать альтернативой широко используемым в медицине препаратам (в частности, витамину В12).
Для адекватного планирования дальнейших экспериментальных исследований (in vitro, in vivo) сначала необходимо провести моделирование фармакологических свойств отобранных молекул in silico (в частности, посредством масштабного хемоинформационного моделирования). Хемоинформатика основана на применении современных методов машинного обучения (в частности, топологической теории анализа данных [21–23]) к анализу химической структуры молекул и кристаллов. Используя методы теории размеченных графов, развиваемые в научной школе Ю.И. Журавлёва и К.В. Рудакова, становится возможным преобразовать химические формулы в наборы чисел, которые подаются на вход нейронных сетей, алгоритмов логических правил и т.д. Хемоинформационные исследования включают оценку взаимодействий изучаемых молекул с белками протеома и позволяют прогнозировать нейропротекторные, гепатопротекторные, антибактериальные, противоопухолевые и другие свойства молекул, включая моделирование результатов исследований на культурах клеток.
Цель – оценка взаимодействия шести производных витамина В12 (аквакобаламин, диаквакобинамид, аквациано-формы гептаэтаноламин-, гептаэтилендиамин-, гептаметил- и гептабутилкобиринатов) с белками протеома человека.
МАТЕРИАЛ И МЕТОДЫ / MATERIAL AND METHODS
Исследуемые соединения / Studied compounds
В работе представлены результаты сравнительного хемопротеомного анализа витамина В12 и его производных: аквакобаламина, диаквакобинамида (DACbi), аквациано-форм гептаэтаноламин-, гептаэтилендиамин-, гептаметил- и гептабутилкобиринатов (ACEACby, ACEDCby, ACMeCby и ACBuCby соответственно), структурные формулы которых приведены на рисунке 1.
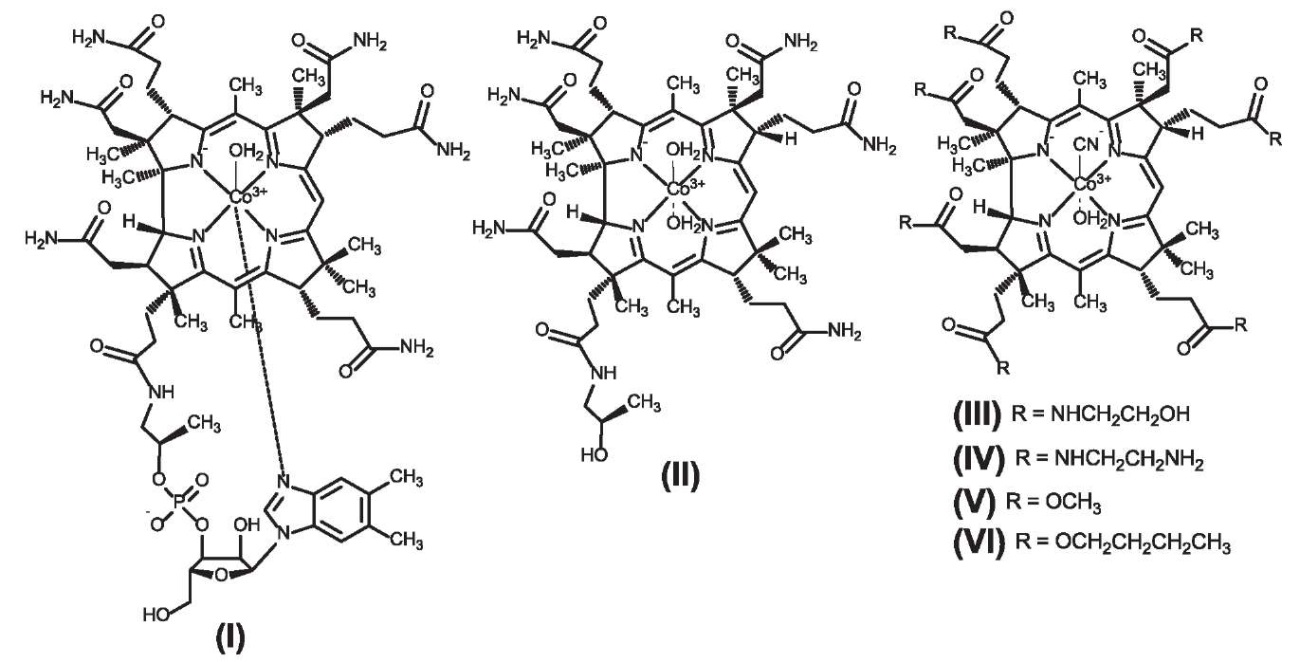
Рисунок 1. Структурные формулы аквакобаламина (I), диаквакобинамида (II), аквациано-формы гептаэтаноламинкобирината (III), аквациано-формы гептаэтилендиаминкобирината (IV), аквациано-формы гептаметилкобирината (V) и аквациано-формы гептабутилкобирината (VI)
Figure 1. Structural formulas of aquacobalamin (I), diaquacobinamide (II), aquacyano-form of heptaethanolamine cobyrinate (III), aquacyano-form of heptaethylenediamine cobyrinate (IV), aquacyano-form of heptamethyl cobyrinate (V), and aquacyano-form of heptabutyl cobyrinate (VI)
Хемоинформационный анализ / Chemoinformatics analysis
Сравнение соединений проводили методом хемореактомного анализа, основанного на теории изоморфизма размеченных графов и современных методов прогнозирования числовых таргетных переменных [21].
Для осуществления хемоинформационного анализа нами разработана проблемно-ориентированная теория в границах комбинаторной теории разрешимости [22–24]. Последняя является расширением алгебраического подхода к задачам машинного обучения и представляет исследователю современный математический инструментарий для анализа качества порождаемых признаковых описаний объектов [25].
При математической постановке задач анализа молекул объектами исследования являются хемографы. Хемограф (χ-граф) – особая разновидность графа, т.е. математического объекта, являющегося совокупностью множества вершин и множества ребер – связей между вершинами. Хемографом называется конечный, связный, неориентированный и размеченный граф без петель, с кликовым числом, не превышающим 3 [26].
В соответствии с постулатами комбинаторной теории разрешимости χ-графы являются объектами, инварианты χ-графов – признаками. По отношению к χ-графам исключительно важны теорема полноты инвариантов и теорема о критерии соответствия разрешимости/регулярности полноте инвариантов. Главным математическим результатом этих теорем является следующее выражение:
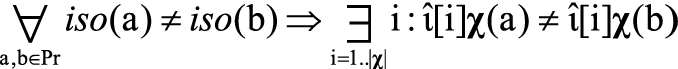 , (1)
, (1)
где Pr⊂Iн×Iк – исследуемое множество прецедентов χ-графов; Iн – множество начальных информаций (вектора ι̂χ); ); Iк – множество конечных информаций; iso(G) – метка принадлежности χ-графа G к определенному классу изоморфизма графов; χ – множество элементарных χ-инвариантов (например, соответствующих фрагментам химических структур молекул); ι̂χ – кортеж-инвариант, т.е. упорядоченная совокупность элементарных инвариантов.
Когда условие (1) выполнено при заданном χ, то множество χ гарантирует существование решения задачи для заданного множества прецедентов Pr, что, в свою очередь, делает возможным систематическое исследование углеродных скелетов молекул. При условии регулярности множества Pr (попарное различие признаковых описаний χ-графов) множество χ вычисляется как характеристическая функция множества наиболее информативных значений признаков Т(α) [26]:
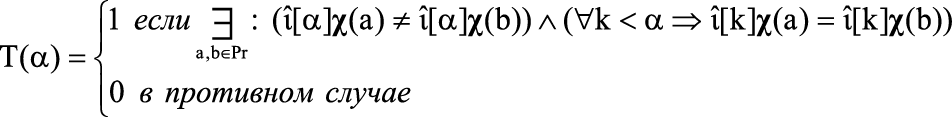 , (2)
, (2)
где α – ранг информативности инварианта.
Комбинаторный анализ условий (1, 2) позволяет вычислять кортеж-инварианты, гарантирующие разрешимость и регулярность признаковых описаний молекул. Например, тестирование условий (1, 2) на выборках 50 тыс. попарно различных молекул из базы данных PubChem [27] было проведено с применением бинарных кортеж-инвариантов над множеством цепных фрагментов химических структур длиной n=1…7. Результаты тестирования показали, что длина цепи n=7 позволяет достигать аккуратности различения одной молекулы от другой более 99%.
С использованием множества χ, полученного в результате тестирования условий (1, 2), и определения метрики Хэмминга функция расстояния между χ-графами dχ определяется как:
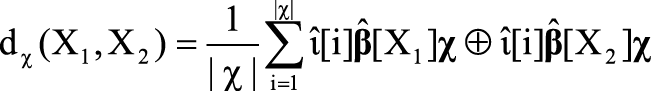 . (3)
. (3)
В ходе хемоинформационного анализа формула (3) позволяет вычислять своего рода «химические расстояния» между парами сравниваемых молекул. Первым шагом анализа является установление списка молекул, наиболее близких по структуре к оцениваемой молекуле (т.е. вычисление dχ). Второй шаг – извлечение из баз данных экспериментальной информации о молекулах, схожих с заданной. Третий шаг – оценка биологических активностей исследуемой молекулы (в т.ч. моделирование взаимодействия с протеомом), т.е. собственно хемореактомный анализ.
Хемореактомный анализ подразумевает определение упоминаемых ранее множеств Iн и Iк. Элементами множества Iн являются вектора, соответствующие бинарным или численным кортеж-инвариантам хемографов, обладающих свойством локальной полноты [22], найденные для заданного алфавита меток χ-графов [26]. Элементами множества Iк являются вектора, соответствующие теоретико-множественным формам профилей сродства молекул к таргетным белкам. После вычисления (1, 2) для каждой из изучаемых биологических констант (связывания, ингибирования и др.) строится эмпирическая функция распределения значений этой константы.
Представленные в проведенном исследовании оценки значений биологических констант концентрации полумаксимального ингибирования (англ. half-maximal inhibitory concentration, IC50) и полумаксимальной эффективной концентрации (англ. half-maximal effective concentration, ЕС50) белков протеома человека были получены как математическое ожидание и дисперсия соответствующих эмпирических функций распределений.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ / RESULTS AND DISCUSSION
Хемореактомный анализ / Chemoreactomic analysis
В рамках хемопротеомного профилирования исследуемых производных методом хемореактомного анализа были оценены потенциальные взаимодействия каждой молекулы с различными белками протеома человека. Найдены достоверные различия между молекулами для 1200 белков, причем проценты схожести взаимодействия с протеомом (при сравнении по 1200 белкам) заметно отличались между другими парами молекул (табл. 1): наиболее схожи были DACbi, ACEACby и ACEDCby (80–82%), ACMeCby и ACBuCby (77%).
Таблица 1. Cхожесть протеомных взаимодействий исследованных молекул по результатам хемопротеомного профилирования, %*
Table 1. Similarity of proteomic interactions of the studied molecules according to the results of chemoproteomic profiling, %*
|
Соединение / Compound |
Аквакобаламин / Aquacobalamin |
DACbi |
ACEACby |
ACEDCby |
ACMeCby |
ACBuCby |
|
Аквакобаламин / Aquacobalamin |
100 |
37 |
43 |
40 |
13 |
17 |
|
DACbi |
37 |
100 |
81 |
80 |
33 |
40 |
|
ACEACby |
43 |
81 |
100 |
82 |
34 |
36 |
|
ACEDCby |
40 |
80 |
82 |
100 |
36 |
38 |
|
ACMeCby |
13 |
33 |
34 |
36 |
100 |
77 |
|
ACBuCby |
17 |
40 |
36 |
38 |
77 |
100 |
Примечание. DACbi – диаквакобинамид; ACEACby – аквациано-форма гептаэтаноламинкобирината; ACEDCby – аквациано-форма гептаэтилендиаминкобирината; ACMeCby – аквациано-форма гептаметилкобирината; ACBuCby – аквациано-форма гептабутилкобирината. * Процент оценен на основании сравнения 1200-мерных векторов, каждый компонент которых соответствует взаимодействию с определенным белком протеома.
Note. DACbi – diaquacobinamide; ACEACby – aquacyano-form of heptaethanolamine cobyrinate; ACEDCby – aquacyano-form of heptaethylenediamine cobyrinate; ACMeCby – aquacyano-form of heptamethyl cobyrinate; ACBuCby – aquacyano-form of heptabutyl cobyrinate. * The percentage was estimated based on a comparison of 1200-dimensional vectors, each component of which corresponded to an interaction with a specific protein in the proteome.
На метрической диаграмме (рис. 2) каждому соединению соответствует одна точка, которой, в свою очередь, соответствует 1200-мерный вектор, отражающий комплекс взаимодействий с протеомом. Очевидно существование трех кластеров молекул с близкими протеомными свойствами: аквакобаламин, кластер из DACbi, ACEACby и ACEDCby и кластер гидрофобных производных (ACMeCby и ACBuCby).
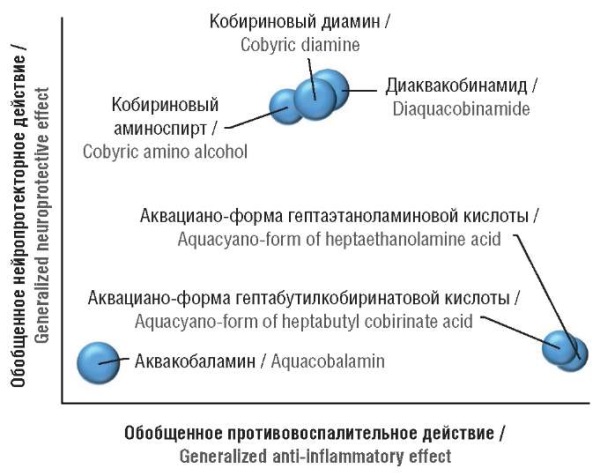
Рисунок 2. Метрическая диаграмма схожести профилей протеомных взаимодействий исследованных производных витамина В12. Диаграмма получена посредством проецирования 1200-мерных векторов для каждого соединения на плоскость. Чем больше расстояние между точками, тем больше различия в хемопротеомных профилях соответствующих производных. Значения координат не имеют физического числового выражения, диаграмма предназначена только для визуальной иллюстрации расстояния между соответствующими значениями
Figure 2. Metric diagram of the similarity of proteomic interaction profiles of the studied vitamin B12 derivatives. The diagram is obtained by projecting 1200-dimensional vectors for each connection onto a plane. The greater the distance between the points, the greater the differences in the chemoproteomic profiles of the corresponding derivatives. The coordinate values do not have a physical numerical expression, the diagram is intended only to visually illustrate the distance between the corresponding values
Функции белков / Functions of proteins
Анализ хемопротеомных профилей исследуемых соединений с использованием номенклатуры биологических функций белков GO (англ. Gene Ontology) позволил выделить функциональные категории GO, указывающие на различия в биологических эффектах (рис. 3).
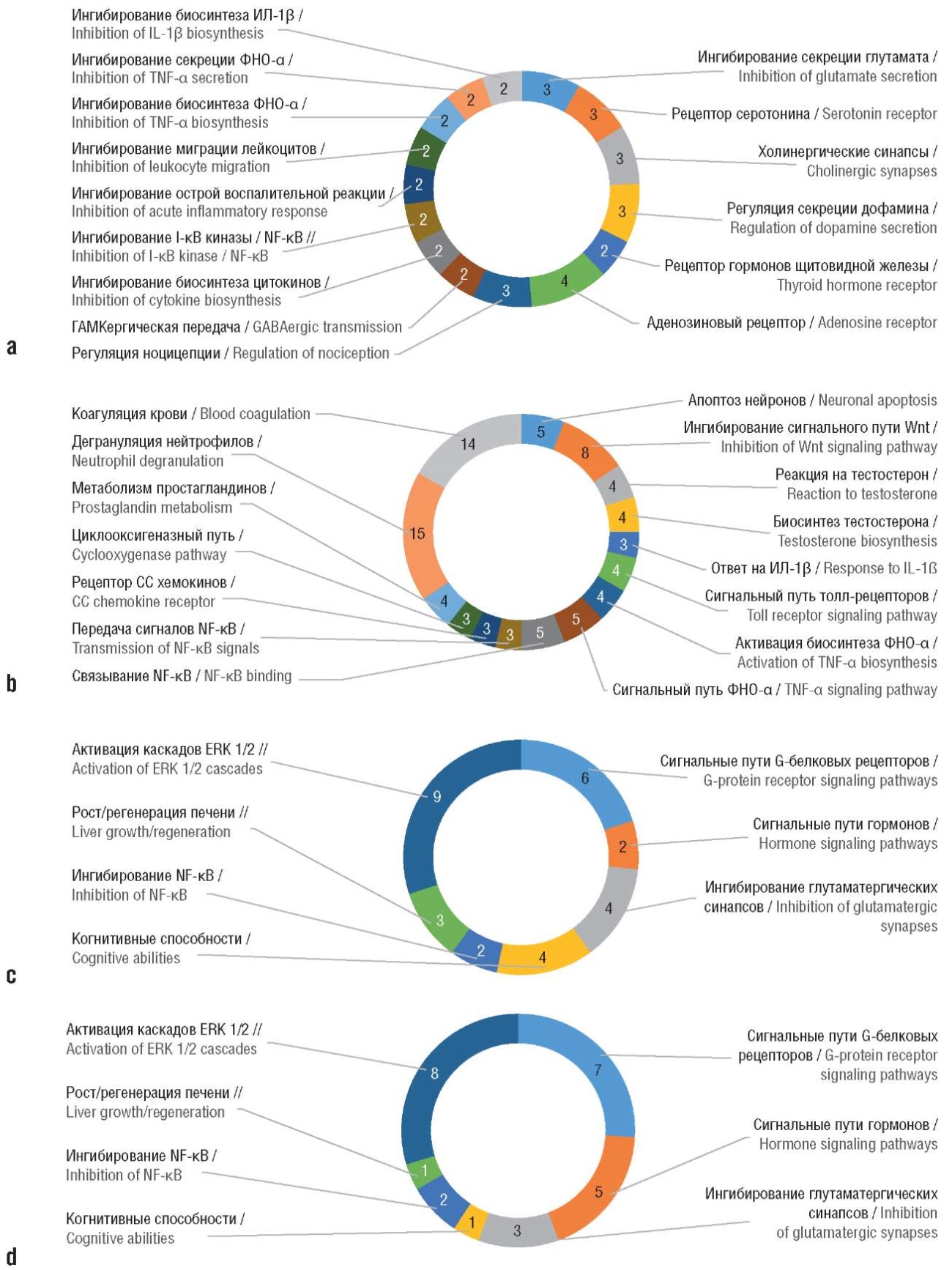
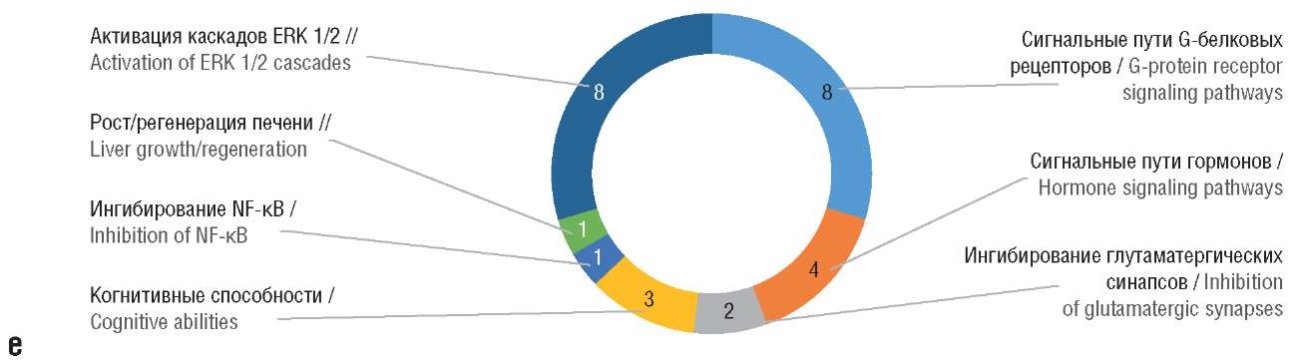
Рисунок 3. Анализ различий хемопротеомных профилей производных витамина В12 с использованием номенклатуры функций белков GO (англ. Gene Ontology):
a, b – функции белков, активируемых всеми исследованными производными витамина В12;
c – функции белков, активируемых аквакобаламином;
d – функции белков, активируемых диаквакобинамидом.
ИЛ-1β – интерлейкин 1-бета; ФНО-α – фактор некроза опухоли альфа; NF-κB (англ. nuclear factor kappa B) – ядерный фактор каппа-B; ГАМК – гамма-аминомасляная кислота; ERK 1/2 (англ. extracellular signal-regulated kinase 1/2) – внеклеточная сигнально-регулируемая киназа
e – функции белков, активируемых аквациано-формой гептаметилкобирината.
ERK 1/2 (англ. extracellular signal-regulated kinase 1/2) – внеклеточная сигнально-регулируемая киназа; NF-κB (англ. nuclear factor kappa B) – ядерный фактор каппа-B
Figure 3. Analysis of differences in chemoproteomic profiles of vitamin B12 derivatives using the GO (Gene Ontology) protein function nomenclature:
a, b – functions of proteins activated by all studied vitamin B12 derivatives;
c – functions of proteins activated by aquacobalamin;
d – functions of proteins activated by diaquacobinamide.
IL-1β – interleukin 1 beta; TNF-α – tumor necrosis factor alpha; NF-κB – nuclear factor kappa B; GABA – gamma-aminobutyric acid; ERK 1/2 – extracellular signal-regulated kinase ½
e – functions of proteins activated by aquacyano-form of heptamethyl cobyrinate.
ERK 1/2 – extracellular signal-regulated kinase 1/2; NF-κB – nuclear factor kappa B
Функции белков, активируемых всеми исследованными производными витамина В12: нейропротективная регуляция активности нейротрансмиттеров (ингибирование секреции глутамата, активность рецептора серотонина, холинергические синапсы, регуляция секреции дофамина, рецептор гормонов щитовидной железы), снижение воспаления (ингибирование биосинтеза цитокинов, в т.ч. фактора некроза опухоли альфа (ФНО-α) и интерлейкина 1-бета (ИЛ-1β), I-κB киназы / ядерного фактора каппа-B (англ. nuclear factor kappa B, NF-κB), миграции лейкоцитов). Функции белков, дифференцированно активируемых репрезентативными соединениями: сигнальные пути G-белковых рецепторов, в т.ч. гормональных, ингибирование NF-κB, рост/регенерация печени, активация каскадов внеклеточной сигнально-регулируемой киназы (англ. extracellular signal-regulated kinase 1/2, ERK1/2).
Функции белков, ингибируемых всеми исследованными производными витамина В12: снижение нейроапоптоза (апоптоз нейронов), нейротрофические эффекты (сигнальный путь Wnt), противовоспалительное действие (ответ на ИЛ-1β, толл-рецепторы, активность ФНО-α, передача сигналов NF-κB, рецептор CC хемокинов, метаболизм простагландинов, коагуляция крови.
Более детальный анализ хемопротеомных профилей исследуемых соединений позволяет утверждать, что функции белков, активируемых всеми исследованными производными витамина В12, включают нейропротективную регуляцию активности нейротрансмиттеров и снижение воспаления (рис. 4).
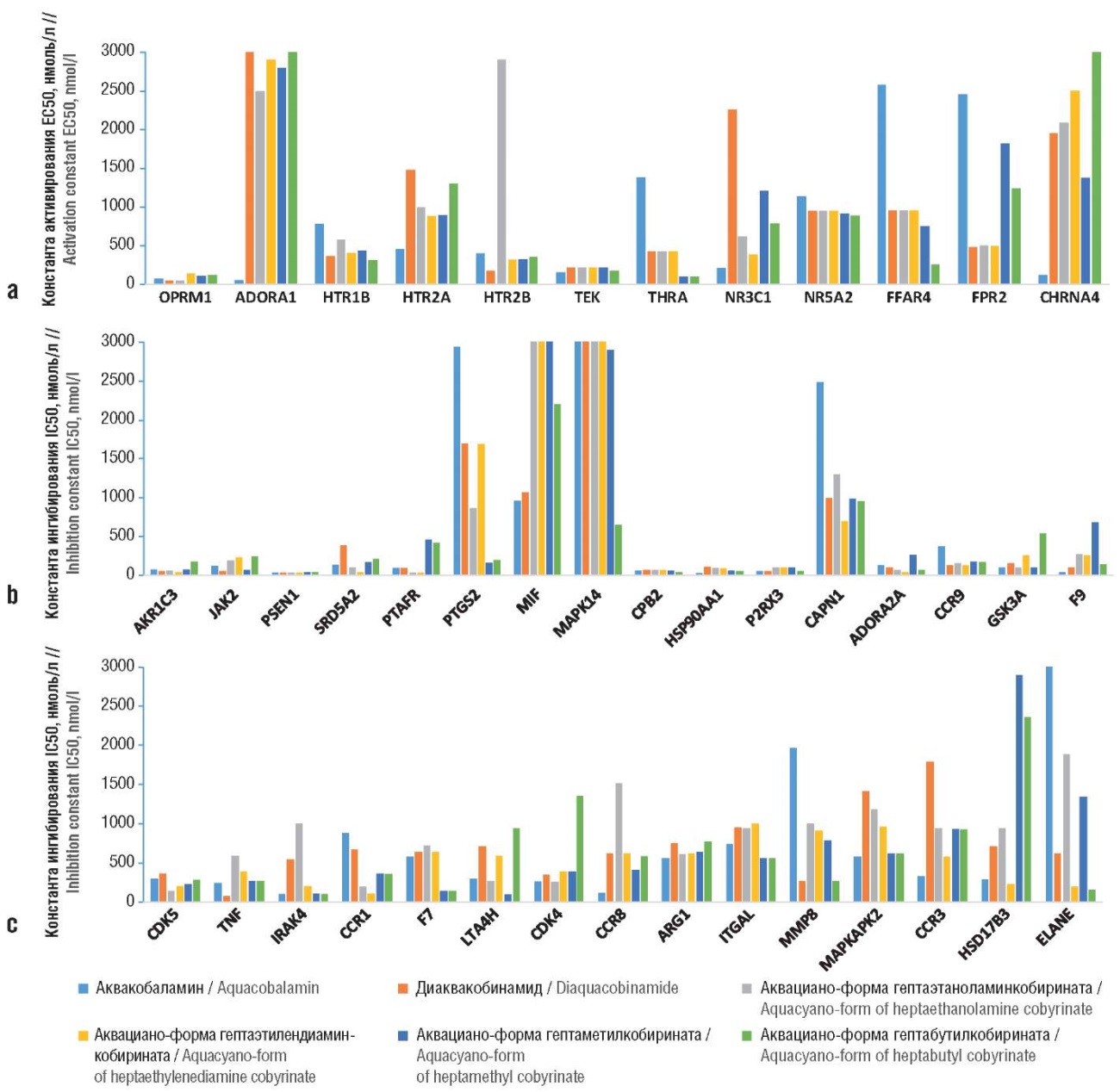
Рисунок 4. Константы активирования и ингибирования отдельных белков протеома человека исследованными производными витамина В12:
a – активирование (half-maximal effective concentration, ЕС50);
b, c – ингибирование (англ. half-maximal inhibitory concentration, IC50).
OPRM1 – каннабиноидный рецептор 1 / опиоидный рецептор мю-типа; ADORA1 – аденозиновый рецептор А1; HTR1B – рецептор 5-гидрокситриптамина 1B; HTR2A – рецептор 5-гидрокситриптамина 2А; HTR2B – рецептор серотонина (2b и 2c); TEK – рецептор ангиопоэтина-1; THRA – рецептор гормона щитовидной железы; NR3C1 – член 1 группы D подсемейства 1 ядерных рецепторов; NR5A2 – гомолог печеночного рецептора 1; FFAR4 – рецептор 120, связанный с G-белком; FPR2 – рецептор 2 N-формилпептидов; CHRNA4 – субъединица альфа-4 нейронального рецептора ацетилхолина; AKR1C3 – альдо-кето-редуктаза C3; JAK2 – янус-киназа 2; PSEN1 – гамма-секретаза; SRD5A2 – стероид 5-альфа-редуктаза; PTAFR – рецептор фактора активации тромбоцитов; PTGS2 – простагландин E-синтаза/G/H-синтаза 2; MIF – фактор ингибирования миграции макрофагов; MAPK14 – митоген-активируемая протеинкиназа 14; CPB2 – карбоксипептидаза В2; HSP90AA1 – белок теплового шока HSP 90-альфа; P2RX3 – P2X пуринорецептор 3; CAPN1 – кальпаин 1/2; ADORA2A – аденозиновый рецептор А2а; CCR9 – рецептор хемокинов CC типа 9; GSK3A – киназа гликогенсинтазы-3; F9 – фактор свертывания крови IX; CDK5 – циклинзависимая киназа 5; TNF – фактор некроза опухоли; IRAK4 – киназа 4, связанная с рецептором интерлейкина-1; CCR1 – рецептор хемокинов CC типа 1; F7 – фактор свертывания крови III/фактор VIIa (fVIIa); LTA4H – лейкотриен А4 гидролаза; CDK4 – циклинзависимая киназа 4; CCR8 – рецептор хемокинов CC типа 8; ARG1 – аргиназа-1; ITGAL – интегрин бета-2/гликопротеин адгезии лейкоцитов LFA-1 альфа; MMP8 – матриксная металлопротеиназа-8; MAPKAPK2 – МАРК-активируемая протеинкиназа 2; CCR3 – рецептор хемокинов CC типа 3; HSD17B3 – 17-бета-гидроксистероиддегидрогеназа типа 3; ELANE – лейкоцитарная эластаза.
Figure 4. Activation and inhibition constants of individual proteins of the human proteome by the studied vitamin B12 derivatives:
a – activation (half-maximal effective concentration, ЕС50);
b, c – inhibition (half-maximal inhibitory concentration, IC50).
OPRM1 – cannabinoid receptor 1/mu-type opioid receptor; ADORA1 – adenosine receptor A1; HTR1B – 5-hydroxytryptamine receptor 1B; HTR2A – 5-hydroxytryptamine receptor 2A; HTR2B – serotonin receptor (2b and 2c); TEK – angiopoietin receptor-1; THRA – thyroid hormone receptor; NR3C1 – nuclear receptor subfamily 1 group D member 1; NR5A2 – liver receptor homolog 1; FFAR4 – G protein-coupled receptor 120; FPR2 – N-formyl peptide receptor 2; CHRNA4 – alpha 4 subunit of the neuronal acetylcholine receptor; AKR1C3 – aldo-keto reductase C3; JAK2 – janus kinase 2; PSEN1 – gamma secretase; SRD5A2 – steroid 5-alpha reductase; PTAFR – platelet activating factor receptor; PTGS2 – prostaglandin E synthase/G/H synthase 2; MIF – macrophage migration inhibitory factor; MAPK14 – mitogen-activated protein kinase 14; CPB2 – carboxypeptidase B2; HSP90AA1 – heat shock protein HSP 90 alpha; P2RX3 – P2X purinoceptor 3; CAPN1 – calpain 1/2; ADORA2A – adenosine receptor A2a; CCR9 – CC chemokine receptor type 9; GSK3A – glycogen synthase kinase-3; F9 – blood clotting factor IX; CDK5 – cyclin-dependent kinase 5; TNF – tumor necrosis factor; IRAK4 – interleukin-1 receptor associated kinase 4; CCR1 – CC chemokine receptor type 1; F7 – coagulation factor III/factor VIIa (fVIIa); LTA4H – leukotriene A4 hydrolase; CDK4 – cyclin-dependent kinase 4; CCR8 – CC chemokine receptor type 8; ARG1 – arginase-1; ITGAL – integrin beta 2/leukocyte adhesion glycoprotein LFA-1 alpha; MMP8 – matrix metalloproteinase-8; MAPKAPK2 – MAPK-activated protein kinase 2; CCR3 – CC chemokine receptor type 3; HSD17B3 – 17-beta-hydroxysteroid dehydrogenase type 3; ELANE – leukocyte elastase
Функции белков, ингибируемых всеми исследованными производными витамина В12, включают снижение нейроапоптоза и нейропротекцию, нейротрофические эффекты, противовоспалительное и антикоагулянтное действие.
Нейропротективная регуляция активности нейротрансмиттеров
Под нейропротективной регуляцией активности нейротрансмиттеров подразумевается активность рецептора серотонина, холинергические синапсы. Рецепторы 5-гидрокситриптамина 1B и 2А (гены HTR1B, HTR2A) реализуют биологические эффекты серотонина, в т.ч. анксиолитический и нейропротекторный эффекты. Для рецепторов 5-НТ1В наименьшее значение ЕС50 317 нМ отмечено для ACBuCby, для рецепторов 5HT-2A – для аквакобаламина (ЕС50 460 нМ), для рецептора 5HT-2B – для DACbi (ЕС50 178 нМ).
Субъединица альфа-4 нейронального рецептора ацетилхолина (ген CHRNA4), взаимодействуя с агонистами, приводит к активации холинергической нейротрансмиссии. Для белка-рецептора CHRNA4 наименьшее значение ЕС50 129 нМ установлено для аквакобаламина. Активация каннабиноидного рецептора 1 / опиоидного рецептора мю-типа (ген OPRM1) приводит к противоболевому эффекту; наименьшие значения ЕС50 в диапазоне 53–56 нМ установлены для ACEACby и DACbi.
Следует указать и на возможные антиастенические эффекты исследованных молекул. Активация аденозиновых рецепторов типа А1 (ген ADORA1) снижает утомляемость скелетных мышц in vitro [28] (EC50 60 нМ для аквакобаламина). Активация рецептора гормона щитовидной железы (ген THRA) также способствует прекращению астении; наименьшие значения ЕС50 105 нМ отмечены для ACMeCby и ACBuCby.
Снижение воспаления
Снижение воспаления обусловлено активацией белков протеома, участвующих в ингибировании биосинтеза цитокинов, в т.ч. ФНО-α и ИЛ-1β, I-κB киназы / NF-κB. Например, рецептор ангиопоэтина-1 (ген TEK) регулирует ангиогенез, выживаемость эндотелиальных клеток, миграцию, адгезию, тонус сосудов и оказывает противовоспалительное действие, предотвращая утечку провоспалительных белков плазмы и лейкоцитов из кровеносных сосудов. Исследованные молекулы являются умеренными активаторами ТЕК (ЕС50 в диапазоне 157–218 нМ).
Ядерный рецептор D1 (ген NR3C1) регулирует гены, участвующие в метаболизме липидов и желчных кислот, адипогенезе, глюконеогенезе, свертывании крови, воспалительной реакции макрофагов, подавляет экспрессию прокоагулянтного белка SERPINE1/PAI1, а также экспрессию воспалительных цитокинов и хемокинов в макрофагах [29]. Наименьшее значение ЕС50 207 нМ получено для аквакобаламина. Аналогичный белок, гомолог печеночного рецептора 1 (ген NR5A2), играет решающую роль в регуляции развития, транспорта холестерина, гомеостаза желчных кислот и стероидогенеза. LRH-1 индуцирует гепатопротекторные заменимые аминокислоты в ответ на острое повреждение печени и снижает воспаление в печени [30] (EC50 в диапазоне 890–1140 нМ для исследуемых молекул).
Рецептор-120, связанный с G-белком (ген FFAR4), участвует в ингибировании высвобождения провоспалительных цитокинов и опосредует антиапоптотические эффекты полиненасыщенных жирных кислот [31] (EC50 260 нМ для ACBuCby). Активация рецептора 2 N-формилпептидов (ген FPR2) может усиливать результат активации FFAR4 и противодействовать провоспалительным сигналам от лейкотриена B4 (LTB4).
Снижение апоптоза нейронов и нейропротекция
Снижение апоптоза нейронов и нейропротекция обусловлены ингибированием кальпаина, аденозинового и пуринового рецепторов. Кальпаин 1/2 (ген CAPN1) представляет собой активируемую кальцием протеазу, которая существует в цитозоле в виде неактивного профермента. Когда уровень внутриклеточного кальция перегружен, происходит преобразование профермента в его активную форму. Активированный кальпаин затем расщепляет цитоплазматические и ядерные субстраты, что приводит к апоптозу. Кальпаин-1 представляет собой активируемую кальцием цистеиновую протеазу, которая играет важную роль в подвижности нейтрофилов. Таким образом, он является потенциальной мишенью для лечения воспалительных заболеваний, таких как ревматоидный артрит [32]. Селективные ингибиторы кальпаина 1 известны как потенциальные средства лечения болезни Альцгеймера [33]. Лучшим ингибитором оказался ACEDCby (IC50 697 нМ).
Селективные антагонисты рецепторов А2А (аденозиновый рецептор А2а, ген ADORA2A) используются при лечении болезни Паркинсона, ишемии мозга и рассеянного склероза. Считается, что селективные антагонисты рецепторов А2А являются нейропротекторами благодаря их способности уменьшать нейровоспаление [34]. Рецепторы ADORA2A могут ингибироваться молекулами ACEACby и ACEDCby с константами в наномолярном диапазоне (IC50 в диапазоне 43–62 нМ).
P2X пуринорецептор 3 (ген P2RX3) – рецептор производных аденозинтрифосфата, действующий как лиганд-управляемый ионный канал. Антагонисты P2X3 не только проявляют нейропротекторные эффекты, но и уменьшают тяжесть и частоту кашля у взрослых пациентов с хроническим кашлем, улучшая качество жизни. Лучший ингибитор P2X3 среди исследованных молекул – аквакобаламин (IC50 47 нМ).
Нейротрофические эффекты
Нейротрофические эффекты исследованных производных витамина В12 могут быть обусловлены поддержанием активности сигнального пути Wnt посредством ингибирования гамма-секретазы и киназы гликогенсинтазы-3 и циклинзависимой киназы 5.
Гамма-секретаза (пресенилин, ген PSEN1) катализирует внутримембранное расщепление интегральных мембранных белков (таких как рецепторы Notch и APP – белок-предшественник бета-амилоида) [35]), участвующих в апоптозе. Гамма-секретаза отрицательно регулирует передачу сигналов Wnt [36]. Все исследуемые молекулы могут достаточно эффективно ингибировать гамма-секретазу (IC50 в диапазоне 27–33 нМ), тем самым стимулируя нейропротекторные и нейротрофические эффекты.
Киназа гликогенсинтазы-3 (ген GSK3A) – негативный регулятор не только гормонального контроля гомеостаза глюкозы, но и нейротрофической передачи сигналов по каскаду Wnt. Активность GSK3A может также опосредовать развитие резистентности к инсулину путем регулирования активации факторов транскрипции [37]. Лучшие ингибиторы – DACbi, ACEACby и ACMeCby (IC в диапазоне 99–150 нМ).
Циклинзависимая киназа 5 (ген CDK5) регулирует развитие некоторых нейронов и физиологические процессы (включая выживание, миграцию и дифференцировку нейронов), участвующие в апоптотической гибели клеток при заболеваниях нейронов. Это отрицательный регулятор нейротрофического сигнального пути Wnt/бета-катенин [38]. Наилучшие ингибиторы – ACEACby и ACEDCby (IC50 в диапазоне 146–198 нМ).
Противовоспалительное действие
Противовоспалительное действие изученных корриновых производных может осуществляться через множественные молекулярные механизмы – синтез и активность ФНО-α, передачу сигналов по каскаду NF-κB, модуляцию ответа на интерлейкины, толл-рецепторы, рецепторы CC хемокинов, метаболизм простагландинов и другие воздействия на лейкоциты.
ФНО-α (ген TNF) – провоспалительный цитокин, секретируемый макрофагами, вызывает лихорадку прямым действием или путем стимуляции секреции ИЛ-1 и участвует в индукции кахексии. Нарушает регуляторную функцию Т-клеток у пациентов с ревматоидным артритом посредством дефосфорилирования FOXP3. Из исследованных соединений лучшим ингибитором ФНО-α может являться DACbi (IC50 75 нМ).
В реализации эффектов ФНО-α принимает участие МАРК-активируемая протеинкиназа МК2 (ген MAPKAPK2), необходимая для производства цитокинов, эндоцитоза, воспалительной реакции путем регуляции продукции ФНО-α и ИЛ-6. Аллостерические ингибиторы MAPKAPK2 снижают выработку ФНО-α, обладают противовоспалительным действием и могут улучшить стабильность бляшек при прогрессирующем атеросклерозе [39]. Лучшими ингибиторами MAPKAPK2 оказались аквакобаламин, ACMeCby и ACBuCby (IC50 в диапазоне 575–620 нМ).
Биологические эффекты ФНО-α, других провоспалительных цитокинов (в т.ч. CC хемокинов) и толл-рецепторов (рецепторов бактериальных липополисахаридов (ЛПС)) реализуются посредством особых белков, активирующих сигнальный каскад NF-κB. Митоген-активируемая протеинкиназа 14 (ген MAPK14) вовлечена в каскады внутриклеточных ответов, вызванных провоспалительными цитокинами, активирует факторы транскрипции NF-κB, белки STAT1/3. По результатам хемопротеомного анализа ACBuCby может ингибировать MAPK14 (IC50 944 нМ).
Каскад NF-κB вовлечен в реализацию эффектов ЛПС-рецепторов. Например, белок теплового шока HSP 90-альфа (ген HSP90AA1) связывает ЛПС и опосредует вызванную ими воспалительную реакцию, включая секрецию ФНО-α моноцитами [40]. Лучшим ингибитором являлся аквакобаламин (IC50 27 нМ). Киназа-4, связанная с рецептором ИЛ-1 (ген IRAK4) участвует в сигнальных путях толл-рецепторов ЛПС и рецептора ИЛ-1β [41]. IRAK4 активируется MYD88 в отношении рецепторно-сигнального комплекса при активации ЛПС-рецепторов, что приводит к внутриядерной транслокации и активации NF-κB. Аквакобаламин, ACMeCby и ACBuCby ингибировали IRAK4 со схожими значениями констант (IC50 в диапазоне 99–112 нМ).
Каскад NF-κB также включен в реализацию провоспалительных эффектов рецепторов CC хемокинов. Ингибиторы этих рецепторов проявляют не только противовоспалительные, но и противоопухолевые свойства. В частности, ингибиторы рецептора хемокинов CC типа 9 (ген CCR9) тормозят пролиферацию опухолей и патофизиологию воспалительных заболеваний (воспалительное заболевание кишечника, инфаркт миокарда). Изученные молекулы ингибировали CCR9 (IC50 в диапазоне 124–376 нМ). Рецептор хемокинов CC типа 1 (ген CCR1) связывается с провоспалительными сигнальными белками MIP-1α, MIP-1-δ, RANTES и MCP-3, а ингибиторы оказывают противовоспалительное и противоопухолевое действие [42]. Лучшие ингибирующие свойства по отношению к CCR1 были найдены для ACEACby и ACEDCby (IC50 в диапазоне 105–193 нМ).
Рецептор хемокинов CC типа 8 (ген CCR8) регулирует хемотаксис моноцитов, играет важную роль в обеспечении рекрутирования и иммуносупрессивной функции Т-регуляторных (Treg) лимфоцитов в микроокружении опухоли. Разработка специфических антагонистов CCR8 представляет собой потенциальную терапевтическую стратегию против солидных раков, причем противораковое действие осуществляется посредством модуляции Treg и цитотоксических CD8+ Т-лимфоцитов [43]. Лучшим ингибитором CCR8 был аквакобаламин (IC50 122 нМ). Рецептор хемокинов CC типа 3 (ген CCR3) играет роль в развитии аллергических заболеваний (бронхиальная астма, атопический дерматит, аллергический ринит). Ингибирование этого рецептора может представлять собой ценный подход к лечению данных заболеваний [44]. Наилучшим ингибитором CCR3 был аквакобаламин (IC50 152 нМ).
Противовоспалительные эффекты производных витамина В12 могут осуществляться и посредством модуляции метаболизма простагландинов. Простагландин E-синтаза/G/H-синтаза 2 (ген PTGS2) преобразует арахидонат в простагландин H2 (PGH2), что является важным этапом биосинтеза провоспалительных простагландинов и простаноидов. Повышение регуляции PTGS2 также связано с усилением клеточной адгезии, фенотипическими изменениями, устойчивостью к апоптозу и опухолевому ангиогенезу. В раковых клетках PTGS2 является ключевым этапом в производстве простагландина E2 (PGE2), который играет важную роль в модуляции подвижности раковых клеток, их пролиферации и устойчивости к апоптозу [45]. По хемопротеомным оценкам, ACMeCby и ACBuCby могут ингибировать PTGS2 (IC50 в диапазоне 156–198 нМ).
Фермент альдокеторедуктаза C3 (ген AKR1C3) катализирует восстановление простагландинов D2 (PGD2), PGH2 и окисление 9α-, 11β-PGF2 до PGD2, а также может взаимопревращать активные андрогены, эстрогены и прогестины с их неактивными метаболитами (превращает андростендион в тестостерон и т.д.). Наиболее эффективно AKR1C3 может ингибироваться DACbi, ACEACby и ACEDCby (IC50 в диапазоне 55–79 нМ).
Влияние на тестостероновый метаболизм (который необходимо модулировать при борьбе с опухолевыми заболеваниями) может осуществляться исследованными молекулами не только через AKR1C3, но и через стероид 5-альфа-редуктазу (ген SRD5A2). Данный фермент преобразует тестостерон в 5-альфа-дигидротестостерон, а прогестерон или кортикостерон – в соответствующие 5α-3-оксостероиды [46]. Стероидные ингибиторы 5α-редуктазы – препараты с антиандрогенным действием, которые используются преимущественно при лечении гиперплазии простаты и выпадения волос на коже головы. Из исследованных молекул потенциально наилучший ингибитор SRD5A2 – ACEDCby (IC50 42 нМ). 17β-гидроксистероиддегидрогеназа типа 3 (ген HSD17B3) контролирует восстановление андростендиона до тестостерона. Ингибирование может быть полезно в терапии опухолевых заболеваний. Аквакобаламин и ACEDCby ингибировали HSD17B3 (IC50 в диапазоне 227–284 нМ).
Фермент лейкотриен-А4-гидролаза (ген LTA4H) катализирует заключительный этап биосинтеза провоспалительного медиатора лейкотриена В4 [47]. Среди изученных соединений фермент LTA4H в наибольшей степени ингибируется ACMeCby (IC50 96 нМ).
Противоопухолевые эффекты веществ могут осуществляться и через ингибирование циклинзависимой киназы 4 (ген CDK4), которая участвует в регуляции цикла клеточного деления/пролиферации. Ингибиторы CDK4/6 представляют собой класс лекарств, используемых для лечения определенных типов гормоно-рецепторположительного и HER2-негативного рака молочной железы. Аквакобаламин и ACEACby, по результатам настоящего анализа, могут ингибировать CDK4 (IC50 250 нМ).
Исследованные молекулы могут оказывать другие воздействия на лейкоциты, приводящие к снижению воспаления. С молекулярно-физиологической точки зрения эти механизмы весьма разнородны. В частности, JAK2 (ген JAK2) опосредует важные сигнальные события как врожденного, так и адаптивного иммунитета. Ингибиторы JAK2, вмешивающиеся в сигнальный путь JAK-STAT в лимфоцитах, используются при лечении рака и воспалительных заболеваний (ревматоидный артрит, различные кожные заболевания). Наилучшим ингибитором являлся DACbi (IC50 42 нМ).
Фактор ингибирования миграции макрофагов (ген MIF) – провоспалительный цитокин, который противодействует противовоспалительной активности глюкокортикоидов. Слабыми ингибиторами MIF были аквакобаламин и DACbi (IC50 в диапазоне 958–1070 нМ).
Аргиназа-1 (ген ARG1) – ключевой элемент цикла мочевины, превращающий L-аргинин в мочевину и L-орнитин в контексте метаболических путей, важных для пролиферации клеток, и способствует острому воспалению в легких [48]. Все молекулы умеренно ингибировали аргиназу-1 (IC50 в диапазоне 555–768 нМ).
Интегрин бета-2 / гликопротеин адгезии лейкоцитов LFA-1 альфа (ген ITGAL) участвует во взаимодействиях лейкоцитов и эндотелиальных клеток, разрушении клеток цитотоксическими Т-лимфоцитами, гранулоцитами и моноцитами, адгезии лейкоцитов, миграции Т-лимфоцитов и нейтрофилов [49]. Лучшими ингибиторами ITGAL оказались ACMeCby и ACBuCby (IC50 557 нМ).
Матриксная металлопротеиназа-8 (ген MMP8) может разрушать фибриллярные коллагены I, II и III типов. Ингибитор матриксной металлопротеиназы-8 улучшает воспалительные реакции и поведенческие нарушения на модели болезни Паркинсона у мышей [50]. Лучшие ингибиторы MMP8 – DACbi и ACBuCby (IC50 270 нМ).
Лейкоцитарная эластаза (ген ELANE) регулирует функции естественных клеток-киллеров, моноцитов и гранулоцитов. Ингибиторы эластазы могут предотвратить развитие псориаза, хронической болезни почек, респираторных заболеваний (включая COVID-19), иммунных нарушений и даже рака. Обнаружено, что среди полифенольных соединений некоторые флавоноиды и их производные (которые в основном встречаются в лекарственных растениях) влияют на высвобождение эластазы и ее действие на клетки человека [51]. ACEDCby и ACBuCby ингибировали ELANE (IC50 в диапазоне 150–297 нМ).
Коагуляция крови и агрегация тромбоцитов
Наконец, исследованные соединения могут (потенциально) ингибировать белки, участвующие в коагуляции крови и агрегации тромбоцитов, тем самым тормозя избыточное тромбообразование. Рецептор фактора активации тромбоцитов (ген PTAFR) – рецептор хемотаксического фосфолипидного медиатора, который проявляет выраженный провоспалительный и протромботический эффекты [52]. Лучшие ингибиторы PTAFR – ACEACby и ACEDCby (IC50 33 нМ).
Активированный тромбин-активируемый ингибитор фибринолиза (ген CPB2) снижает регуляцию фибринолиза путем удаления остатков C-концевого лизина из фибрина, который уже частично расщеплен плазмином [53]. Все исследованные молекулы ингибировали фактор CPB2 с сопоставимыми значениями констант (IC50 в диапазоне 37–70 нМ).
Фактор свертывания крови IX (ген F9) представляет собой витамин К-зависимый белок плазмы, который участвует в свертывании крови путем преобразования фактора X в его активную форму в присутствии ионов Ca(2+), фосфолипидов и фактора VIIIa [54]. Лучший ингибитор F9 – аквакобаламин (IC50 40 нМ). Фактор свертывания крови III / фактор VIIa (fVIIa) (ген F7) – белковый фактор инициации свертывания крови. Наименьшие значения констант ингибирования F7 были найдены для ACMeCby и ACBuCby (IC50 в диапазоне 140–145 нМ).
ЗАКЛЮЧЕНИЕ / CONCLUSION
Методом хемоинформационного (хемопротеомного) анализа проведена оценка взаимодействия шести производных витамина В12 (аквакобаламина, DACbi, ACEACby, ACEDCby, ACMeCby и ACBuCby) с белками протеома человека. Найдены достоверные отличия во взаимодействиях исследованных молекул с 1200 белками. Показано, что хемопротеомные профили каждого из соединений формируют три группы молекул с близкими протеомными свойствами: 1) аквакобаламин; 2) DACbi, ACEACby, ACEDCby; 3) ACMeCby и ACBuCby.
Более детальный анализ хемопротеомных профилей исследуемых соединений с использованием номенклатуры биологических функций белков GO позволил выделить функциональные категории GO, указывающие на различия в биологических эффектах исследуемых соединений: нейропротективная регуляция активности нейротрансмиттеров (ингибирование секреции глутамата, активность рецептора серотонина, холинергические синапсы, регуляция секреции дофамина, рецептор гормонов щитовидной железы) и снижение воспаления (ингибирование биосинтеза цитокинов, в т.ч. ФНО-α и ИЛ-1β, I-κB киназы/NF-κB, миграции лейкоцитов).
Полученные данные могут быть использованы для проведения углубленных исследований на моделях опухолевых клеток и нейроцитов, а также в моделях у животных с целью выбора наиболее перспективных молекул для создания лекарственного прототипа.
Список литературы
1. Громова О.А., Торшин И.Ю., Гусев Е.И. Синергидные нейропротекторные эффекты тиамина, пиридоксина и цианокобаламина в рамках протеома человека. Фармакокинетика и фармакодинамика. 2017; 1: 40–51.
2. Торшин И.Ю., Громова О.А., Майорова Л.А. О перспективах применения производных витамина В12 в фармакологии. ФАРМАКОЭКОНОМИКА. Современная фармакоэкономика и фармакоэпидемиология. 2023; 16 (3): 501–11. https://doi.org/10.17749/2070-4909/farmakoekonomika.2023.198.
3. Карлюк М.В., Крыгин Ю.Ю., Майорова-Валькова Л.А. и др. Формирование двумерных (M) и трехмерных (V) наноагрегатов замещенного порфирина кобальта в ленгмюровских слоях и пленках Ленгмюра–Шефера. Известия Академии наук. Серия химическая. 2013; 62 (2): 471–9 (на англ. яз). https://doi.org/10.1007/s11172-013-0066-5.
4. Петровa M.В., Майоровa Л.А., Громова O.A. и др. Наноструктура ленгмюровских М-монослоев тетрафенилпорфирината цинка(II), сформированных с использованием раствора низкой концентрации. Макрогетероциклы. 2014; 7 (3): 267–71 (на англ. яз.). https://doi.org/10.6060/mhc131163m.
5. Maiorova L.A., Vu T.T., Gromova O.A., et al. Nanostructured stable floating М-mono- and bilayers and Langmuir–Schaefer films of 5,10,15-triphenylcorrole. BioNanoSci. 2018; 8 (1): 81–9. https://doi.org/10.1007/s12668-017-0424-0.
6. Stupperich E., Nexø E.. Effect of the cobalt-N coordination on the cobamide recognition by the human vitamin B12 binding proteins intrinsic factor, transcobalamin and haptocorrin. Eur J Biochem. 1991; 199 (2): 299–303. https://doi.org/10.1111/j.1432-1033.1991.tb16124.x.
7. Dereven’kov I.A., Hannibal L., Makarov S.V., et al. Characterization of the complex between native and reduced bovine serum albumin with aquacobalamin and evidence of dual tetrapyrrole binding. J Biol Inorg Chem. 2018; 23 (5): 725–38. https://doi.org/10.1007/s00775-018-1562-8.
8. Деревеньков И.А., Макаров С.В., Молодцов П.А. Влияние бычьего сывороточного альбумина на редокс реакции и лигандный обмен с участием аквакобаламина. Макрогетероциклы. 2020; 13 (3): 223–8 (на англ. яз). https://doi.org/10.6060/mhc200498d.
9. Dereven’kov I.A., Osokin V.S., Molodtsov P.A., et al. Effect of complexation between cobinamides and bovine serum albumin on their reactivity toward cyanide. React Kinet Mech Cat. 2022; 135 (3): 1469–83. https://doi.org/10.1007/s11144-022-02216-8.
10. Dereven’kov I.A., Dzvinkas I.I., Osokin V.S., Makarov S.V. Effect of bovine serum albumin on the water solubility of hydrophobic corrinoids. J Porphyrins Phthalocyanines. 2023; 27 (5): 811–7. https://doi.org/10.1142/S1088424623500633.
11. Gromova O.A., Torshin I.Yu., Maiorova L.A., et al. Bioinformatic and chemoneurocytological analysis of the pharmacological properties of vitamin B12 and some of its derivatives. J Porphyrins Phthalocyanines. 2021; 25 (9): 835–42. https://doi.org/10.1142/S1088424621500644.
12. Gromova O.A., Maiorova L.A., Salnikov D.S., et al. Vitamin B12 hydrophobic derivative exhibits bioactivity: biomedical and photophysical study. BioNanoSci. 2022; 12 (7): 74–82. https://doi.org/10.1007/s12668-021-00916-4.
13. Valkova L.A., Glibin A.S., Valli L. Quantitative analysis of compression isotherms of fullerene C60 Langmuir layers. Colloid J. 2008; 70: 6–11. https://doi.org/10.1134/S1061933X0801002X.
14. Valkova L.A., Glibin A.S., Koifman O.I. Influence of the solvent nature on the structure of two-dimensional nanoaggregates in Langmuir layers of copper tetra-tert-butyltetrabenzotriazaporphyrin. Macroheterocycles. 2011; 4 (3): 222–6.
15. Erokhin V., Carrara S., Paternolli C., et al. X-ray study of structural reorganization in phthalocyanine containing Langmuir–Blodgett heterostructures. Appl Surf Sci. 2005; 245 (1): 369–75. https://doi.org/10.1016/j.apsusc.2004.10.047.
16. Valkova L.A., Erokhin V.V., Glibin A.S., Koifman O.I. The influence of molecular structure and π-system extent on nano- and microstructure of Langmuir layers of copper azaporphyrins. J Porphyr Phthalocyanines. 2011; 15 (09n10): 1044–51. https://doi.org/10.1142/S1088424611004026.
17. Valkova L.A., Shabyshev L.S., Feigin L.A., Akopova O.B. Formation and X-ray diffraction investigation of Langmuir–Blodgett films of liquid crystalline substituted crown esters. Mol Cryst Liquid Cryst. 1996; 6 (4): 291–8.
18. Valkova L., Borovkov N., Maccioni E., et al. Influence of molecular and supramolecular factors on sensor properties of Langmuir–Blodgett films of tert-butyl-substituted copper azaporphyrines towards hydrocarbons. Coll Surf Physicochem Eng Aspects. 2002; 198–200: 891–6. https://doi.org/10.1016/S0927-7757(01)01016-0.
19. Valkova L.A., Betrencourt C., Hochapfel A., et al. Monolayer study of monensin and lasalocid in the gas state. Mol Cryst Liquid Cryst. 1996; 287: 269–73. https://doi.org/10.1080/10587259608038763.
20. Maiorova L.A., Kobayashi N., Salnikov D.S., et al. Supermolecular nanoentities of vitamin B12 derivative as a link in the evolution of the parent molecules during self-assembly at the air-water interface. Langmuir. 2023; 39 (9): 3246–54. https://doi.org/10.1021/acs.langmuir.2c02964.
21. Torshin I.Yu., Rudakov K.V. On the procedures of generation of numerical features over partitions of sets of objects in the problem of predicting numerical target variables. Pattern Recogni Image Anal. 2019; 29 (4): 654–67. https://doi.org/10.1134/S1054661819040175.
22. Torshin I.Yu. The study of the solvability of the genome annotation problem on sets of elementary motifs. Pattern Recognit Image Anal. 2011; 21 (4): 652–62. https://doi.org/10.1134/S1054661811040171.
23. Torshin I.Yu., Rudakov K.V. On the application of the combinatorial theory of solvability to the analysis of chemographs. Part 1: Fundamentals of modern chemical bonding theory and the concept of the chemograph. Pattern Recognit Image Anal. 2014; 24 (1): 11–23. https://doi.org/10.1134/S1054661814010209.
24. Torshin I.Yu., Rudakov K.V. On the application of the combinatorial theory of solvability to the analysis of chemographs. Part 2: Local completeness of invariants of chemographs in view of the combinatorial theory of solvability. Pattern Recognit Image Anal. 2014; 24 (2): 196–208. https://doi.org/10.1134/S1054661814020151.
25. Рудаков К.В., Торшин И.Ю. Об отборе информативных значений признаков на базе критериев разрешимости в задаче распознавания вторичной структуры белка. Доклады Aкадемии наук. 2011; 441 (1): 24–8.
26. Torshin I.Yu., Rudakov K.V. Topological chemograph analysis theory as a promising approach to simulation modeling of quantum-mechanical properties of molecules. Part II: Quantum-chemical interpretations of chemograph theory. Pattern Recognit Image Anal. 2021; 31 (4): 884–96. https://doi.org/10.1134/S1054661821040258.
27. Bolton E., Wang Y., Thiessen P.A., Bryant S.H. Chapter 12 – PubChem: Integrated Platform of Small Molecules and Biological Activities. Ann Rep Comput Chem. 2008; 4: 217–41. https://doi.org/10.1016/S1574-1400(08)00012-1.
28. Reading S.A., Barclay J.K. A1 receptor activation decreases fatigue in mammalian slow-twitch skeletal muscle in vitro. Can J Physiol Pharmacol. 2001; 79 (6): 496–501.
29. Chini C.C., Escande C., Nin V., Chini E.N. DBC1 (Deleted in Breast Cancer 1) modulates the stability and function of the nuclear receptor Rev-erbα. Biochem J. 2013; 451 (Pt. 3): 453–61. https://doi.org/10.1042/BJ20121085.
30. Klatt K.C., Petviashvili E.J., Moore D.D. LRH-1 induces hepatoprotective nonessential amino acids in response to acute liver injury. J Clin Invest. 2023; 133 (7): e168805. https://doi.org/10.1172/JCI168805.
31. Yan Y., Jiang W., Spinetti T., et al. Omega-3 fatty acids prevent inflammation and metabolic disorder through inhibition of NLRP3 inflammasome activation. Immunity. 2013; 38 (6): 1154–63. https://doi.org/10.1016/j.immuni.2013.05.015.
32. Miller D.J., Adams S.E., Hallett M.B., Allemann R.K. Calpain-1 inhibitors for selective treatment of rheumatoid arthritis: what is the future? Future Med Chem. 2013; 5 (17): 2057–74. https://doi.org/10.4155/fmc.13.172.
33. Fà M., Zhang H., Staniszewski A., et al. Novel selective calpain 1 inhibitors as potential therapeutics in Alzheimer's disease. J Alzheimers Dis. 2016; 49 (3): 707–21. https://doi.org/10.3233/JAD-150618.
34. Hurtado-Alvarado G., Domínguez-Salazar E., Velázquez-Moctezuma J., Gómez-González B. A2A adenosine receptor antagonism reverts the blood-brain barrier dysfunction induced by sleep restriction. PLoS One. 2016; 11 (11): e0167236. https://doi.org/10.1371/journal.pone.0167236.
35. Fraering P.C., Ye W., Strub J.M., et al. Purification and characterization of the human gamma-secretase complex. Biochemistry. 2004; 43 (30): 9774–89. https://doi.org/10.1021/bi0494976.
36. Marambaud P., Shioi J., Serban G., et al. A presenilin-1/gamma-secretase cleavage releases the E-cadherin intracellular domain and regulates disassembly of adherens junctions. EMBO J. 2002; 21 (8): 1948–56. https://doi.org/10.1093/emboj/21.8.1948.
37. Asuni A.A., Hooper C., Reynolds C.H., et al. GSK3alpha exhibits beta-catenin and tau directed kinase activities that are modulated by Wnt. Eur J Neurosci. 2006; 24 (12): 3387–92. https://doi.org/10.1111/j.1460-9568.2006.05243.x.
38. Wong A.S., Lee R.H., Cheung A.Y., et al. Cdk5-mediated phosphorylation of endophilin B1 is required for induced autophagy in models of Parkinson's disease. Nat Cell Biol. 2011; 13 (5): 568–79. https://doi.org/10.1038/ncb2217.
39. Ozcan L., Kasikara C., Yurdagul A. Jr., et al. Allosteric MAPKAPK2 inhibitors improve plaque stability in advanced atherosclerosis. PLoS One. 2021; 16 (5): e0246600. https://doi.org/10.1371/journal.pone.0246600.
40. Triantafilou K., Triantafilou M., Dedrick R.L. A CD14-independent LPS receptor cluster. Nat Immunol. 2001; 2 (4): 338–45. https://doi.org/10.1038/86342.
41. Hoarau C., Gérard B., Lescanne E., et al. TLR9 activation induces normal neutrophil responses in a child with IRAK-4 deficiency: involvement of the direct PI3K pathway. J Immunol. 2007; 179 (7): 4754–65. https://doi.org/10.4049/jimmunol.179.7.4754.
42. Gilchrist A., Echeverria S.L. Targeting chemokine receptor CCR1 as a potential therapeutic approach for multiple myeloma. Front Endocrinol. 2022; 13: 846310. https://doi.org/10.3389/fendo.2022.846310.
43. Wu Y., Xi J., Li Y., et al. Discovery of a potent and selective CCR8 small molecular antagonist IPG7236 for the treatment of cancer. J Med Chem. 2023; 66 (7): 4548–64. https://doi.org/10.1021/acs.jmedchem.3c00030.
44. Willems L.I., Ijzerman A.P. Small molecule antagonists for chemokine CCR3 receptors. Med Res Rev. 2010; 30 (5): 778–817. https://doi.org/10.1002/med.20181.
45. Kim S.F., Huri D.A, Snyder S.H. Inducible nitric oxide synthase binds, S-nitrosylates, and activates cyclooxygenase-2. Science. 2005; 310 (5756): 1966–70. https://doi.org/10.1126/science.1119407.
46. Makridakis N.M., di Salle E., Reichardt J.K. Biochemical and pharmacogenetic dissection of human steroid 5 alpha-reductase type II. Pharmacogenetics. 2000; 10 (5): 407–13. https://doi.org/10.1097/00008571-200007000-00004.
47. Haeggström J.Z., Wetterholm A., Shapiro R., et al. Leukotriene A4 hydrolase: a zinc metalloenzyme. Biochem Biophys Res Commun. 1990; 172 (3): 965–70. https://doi.org/10.1016/0006-291x(90)91540-9.
48. Oberlies J., Watzl C., Giese T., et al. Regulation of NK cell function by human granulocyte arginase. J Immunol. 2009; 182 (9): 5259–67. https://doi.org/10.4049/jimmunol.0803523.
49. Ostermann G., Weber K.S., Zernecke A., et al. JAM-1 is a ligand of the beta(2) integrin LFA-1 involved in transendothelial migration of leukocytes. Nat Immunol. 2002; 3 (2): 151–8. https://doi.org/10.1038/ni755.
50. Kim T., Jeon J., Park J.S., et al. Matrix metalloproteinase-8 inhibitor ameliorates inflammatory responses and behavioral deficits in LRRK2 G2019S Parkinson's disease model mice. Biomol Ther. 2021; 29 (5): 483–91. https://doi.org/10.4062/biomolther.2020.181.
51. Jakimiuk K., Gesek J., Atanasov A.G., Tomczyk M. Flavonoids as inhibitors of human neutrophil elastase. J Enzyme Inhib Med Chem. 2021; 36 (1): 1016–28. https://doi.org/10.1080/14756366.2021.1927006.
52. Kunz D., Gerard N.P., Gerard C. The human leukocyte platelet-activating factor receptor. cDNA cloning, cell surface expression, and construction of a novel epitope-bearing analog. J Biol Chem. 1992; 267 (13): 9101–6.
53. Mao S.S., Cooper C.M., Wood T., et al. Characterization of plasmin-mediated activation of plasma procarboxypeptidase B. Modulation by glycosaminoglycans. J Biol Chem. 1999; 274 (49): 35046–52. https://doi.org/10.1074/jbc.274.49.35046.
54. Wang S., Beck R., Blench T., et al. Studies of benzothiophene template as potent factor IXa (FIXa) inhibitors in thrombosis. J Med Chem. 2010; 53 (4): 1465–72. https://doi.org/10.1021/jm901475e.
Об авторах
И. Ю. ТоршинРоссия
Торшин Иван Юрьевич – к.ф-м.н., к.х.н., старший научный сотрудник
WoS ResearcherID: C-7683-2018; Scopus Author ID: 7003300274
ул. Вавилова, д. 44, корп. 2, Москва 119334
О. А. Громова
Россия
Громова Ольга Алексеевна – д.м.н., профессор, ведущий научный сотрудник
WoS ResearcherID: J-4946-2017; Scopus Author ID: 7003589812
ул. Вавилова, д. 44, корп. 2, Москва 119334
И. А. Деревеньков
Россия
Деревеньков Илья Александрович – к.х.н., доцент кафедры «Технологии пищевых продуктов и биотехнологии»
WoS ResearcherID: F-2847-2017; Scopus Author ID: 37107505500
пр-т Шереметевский, д. 7, Иваново 153000
Л. А. Майорова
Россия
Майорова Лариса Александровна – д.ф.-м.н., ведущий научный сотрудник
WoS ResearcherID: B-6288-2016; Scopus Author ID: 58079684100
ул. Вавилова, д. 44, корп. 2, Москва 119334
Что уже известно об этой теме?
► Витамин B12 важен для поддержания многих процессов (метаболизм фолатов, гомоцистеина, метилирование ДНК)
► Таргетная модуляция производных витамина В12 посредством специфических модификаций корринового ядра позволяет получать соединения с разными фармакологическими свойствами
► Для адекватного планирования дальнейших экспериментальных исследований (in vitro, in vivo) сначала необходимо провести моделирование фармакологических свойств отобранных молекул in silico
Что нового дает статья?
► Методом хемопротеомного анализа получены оценки взаимодействия шести производных витамина В12 (аквакобаламин, диаквакобинамид, кобириновый аминоспирт, кобириновый диамин, гептаметилцианаквакобириновая кислота, гептабутилцианаквакобириновая кислота), достоверно отличающихся для 1200 белков протеома человека
► Хемопротеомные профили каждого из соединений сгруппированы в три кластера веществ с близкими свойствами (аквакобаламин, диаквакобинамид – кобириновый аминоспирт – кобириновый диамин, гептаметилцианаквакобириновая кислота – гептабутилцианаквакобириновая кислота)
► Установленные различия в биологических эффектах исследуемых соединений относятся к нейропротективной, нейротрофической, противоопухолевой и противовоспалительной активности. Описаны механизмы реализации этих фармакологических эффектов
Как это может повлиять на клиническую практику в обозримом будущем?
► Взаимодействия со специфическими белками протеома человека важны для модуляции активности протеома и для целевой доставки лекарств
► Различия в нейропротективной, нейротрофической, противоопухолевой и противовоспалительной активности изученных производных позволяют более эффективно планировать экспериментальные и клинические исследования этих соединений
Рецензия
Для цитирования:
Торшин И.Ю., Громова О.А., Деревеньков И.А., Майорова Л.А. Хемопротеомный анализ фармакологических свойств производных витамина В12. ФАРМАКОЭКОНОМИКА. Современная фармакоэкономика и фармакоэпидемиология. 2024;17(3):345-357. https://doi.org/10.17749/2070-4909/farmakoekonomika.2024.214
For citation:
Torshin I.Yu., Gromova O.A., Dereven’kov I.A., Maiorova L.A. Chemoproteomic analysis of the pharmacological properties of vitamin В12 derivatives. FARMAKOEKONOMIKA. Modern Pharmacoeconomics and Pharmacoepidemiology. 2024;17(3):345-357. (In Russ.) https://doi.org/10.17749/2070-4909/farmakoekonomika.2024.214

Контент доступен под лицензией Creative Commons Attribution-NonCommercial-ShareAlike 4.0 International License.






































