Перейти к:
Нефропротекторные пептиды препарата Лаеннек® в контексте фармакотерапии нефрогепатометаболических нарушений
https://doi.org/10.17749/2070-4909/farmakoekonomika.2023.215
Аннотация
Актуальность. Почечно-печеночная дисфункция, часто возникающая на фоне нарушений функции печени, требует использования эффективных и безопасных нефропротекторных средств. Гидролизаты плаценты человека (ГПЧ) являются гепатопротекторами, при этом нефропротекторные свойства ГПЧ и молекулярные механизмы их реализации малоизвестны.
Цель: выявление потенциальных молекулярных механизмов нефропротекторного действия ГПЧ Лаеннек® на основании биоинформационного анализа собранных масс-спектрометрических данных.
Материал и методы. Использовались методы протеомного анализа пептидных препаратов. Анализ пептидного состава ГПЧ Лаеннек® включал четыре этапа: очистка препарата, хроматографическое разделение пептидов, определение многомерного масс-спектра пептидной фракции и de novo секвенирование выделенных пептидов.
Результаты. Исследование пептидного состава ГПЧ Лаеннек® позволило выявить 48 пептидов, которые могут оказывать нефропротекторные эффекты. Показано, что ГПЧ содержит биологически активные фрагменты нефропротекторных адреномедуллинов, пептиды – ингибиторы ряда киназ (FYN, SHH, WNK1/4, SGK1, IRAK4, ROCK1/2) и фиброгенных рецепторов (PDGFR, TGFB1I1).
Заключение. Ингибируя перечисленные таргетные белки, пептиды ГПЧ осуществляют нефропротекцию через снижение воспаления, антистрессорные эффекты и предотвращение фибротических изменений ткани почек.
Ключевые слова
Для цитирования:
Громова О.А., Торшин И.Ю., Громов А.Н., Тихонова О.В. Нефропротекторные пептиды препарата Лаеннек® в контексте фармакотерапии нефрогепатометаболических нарушений. ФАРМАКОЭКОНОМИКА. Современная фармакоэкономика и фармакоэпидемиология. 2023;16(4):570-586. https://doi.org/10.17749/2070-4909/farmakoekonomika.2023.215
For citation:
Gromova O.A., Torshin I.Yu., Gromov A.N., Tikhonova O.V. Nephroprotective peptides of Laennec® in the context of pharmacotherapy for nephro-hepato-metabolic disorders. FARMAKOEKONOMIKA. Modern Pharmacoeconomics and Pharmacoepidemiology. 2023;16(4):570-586. (In Russ.) https://doi.org/10.17749/2070-4909/farmakoekonomika.2023.215
ВВЕДЕНИЕ / INTRODUCTION
Совместные нарушения метаболизма печени и почек существенно утяжеляют состояние пациентов с хронической патологией (сахарный диабет, артериальная гипертония, атеросклероз, остеоартит и др.) и вирусными/бактериальными инфекционными заболеваниями, особенно с затяжным течением. В частности, острая печеночно-почечная недостаточность (ОППН) – функциональное, прогрессирующее, олигурическое, обратимое заболевание почек, которое возникает во время тяжелых заболеваний печени с печеночной недостаточностью. ОППН является одной из наиболее распространенных форм полиорганной недостаточности, отличается характерным повышением уровней мочевины и креатинина в крови и другими метаболическими нарушениями.
Актуальность разработки эффективной и безопасной коррекции нефрогепатометаболических повреждений обусловлена тем, что при совместном нарушении функции печени и почек между этими пораженными органами формируются так называемые порочные круги (включая сосудистый порторенальный рефлекс), приводящие к взаимному ускорению дисфункции обоих органов [1]. В результате частота летального исхода при ОППН в 3 раза выше, чем при изолированном остром поражении печени. От 80% до 90% случаев тяжелой формы ОППН приводит к летальному исходу, что связано с метаболической катастрофой на фоне критического накопления уремических и печеночных токсинов [2]. При этом вследствие большого разнообразия механизмов формирования ОППН смертность не зависит от степени тяжести острого почечного поражения (например, уровня креатинина) [1].
Среди уремических механизмов, повреждающих печень, выделяют метаболический ацидоз, снижение синтеза аргинина с накоплением метаболита – асимметричного диметиларгинина (англ. asymmetric dimethylarginine, ADMA) [3], аккумуляцию индоксилсульфата [4], гиперфосфатемию [5], гиперпродукцию интерлейкина-2 (ИЛ-2) [6]. Иногда ОППН формируется в результате тяжелого кардиогенного шока, при ишемическом поражении почек, остром бактериальном сепсисе, тяжелой ожоговой болезни [7], алкогольном гепатите, стеатогепатите, лекарственном гепатите, тяжелой экзогенной интоксикации (отравление дихлорэтаном, четыреххлористым углеродом, токсином бледной поганки и др.), антифосфолипидном синдроме, тромбофилии, синдроме Бадда–Киари [8], поствакцинальном гепатите [9].
Нефрогепатометаболические нарушения могут быть спровоцированы фульминантной инфекцией (в т.ч. вирусной). Например, для фульминантного вирусного гепатита характерны быстро прогрессирующее течение, высокий уровень смертности и быстрый исход в постнекротический цирроз печени у немногих выживших пациентов. Сочетанные поражения печени и почек часто встречаются у пациентов с острой инфекцией SARS-CoV-2 [10], а субклиническое воспаление и повреждение печени и почек могут сохраняться в течение многих месяцев после формального «выздоровления» пациента с COVID-19 (как компонент так называемого постковидного синдрома) [11].
Очевидно, что для коррекции нефрогепатометаболических нарушений важно использовать фармакотерапию, оказывающую гепатопротекторный и нефропротекторный эффекты. Одним из наиболее перспективных направлений является использование экстрактов природного происхождения. В частности, сочетанный нефрогепатопротекторный эффект установлен для силимарина (растительный экстракт, содержащий флаволигнаны, флавоноиды, полифенолы, жирные кислоты) на модели нефрогепатоинтоксикации салиномицином у кроликов [12] и для экстрактов сердечницы крупковидной (Lepidium draba) на модели нефрогепатоинтоксикации оксиметолоном у крыс [13]. Гепатопротекторное и нефропротекторное действие отмечено при приеме масла семян моринги масличной (Moringa leifera) на модели дихлофос-индуцированной нефрогепатоинтоксикации у крыс [14]. Гиполипидемический, гепатопротекторный и нефропротекторный эффекты подтверждены при применении экстракта айвы продолговатой (Cydonia oblonga mill.) у крыс с диабетом, индуцированным стрептозотоцином [15].
Для лечения нефрогепатометаболических нарушений перспективно использовать гидролизаты плаценты человека (ГПЧ), характеризующиеся мультимодальным фармакологическим действием. Результаты исследований научной школы В.П. Филатова легли в основу нового направления в фармакологии, связанного с изучением и применением стандартизированных ГПЧ в терапии заболеваний печени, атопического дерматита, вирусных инфекций (вирусного гепатита, герпеса, COVID-19), болезней перегрузки железом и синдрома хронической усталости [16]. ГПЧ Лаеннек® (Japan Bio Products, Япония), полученный в результате высокотехнологичной переработки тканей плаценты, проявляет противовоспалительное, антиоксидантное действие, уменьшает проявления инсулинорезистентности, фиброза, способствует улучшению показателей липидного обмена и нормализации функции печени. На фоне терапии данным препаратом отмечена положительная динамика регрессии фиброза печени [17].
В настоящее время Лаеннек® является единственным в мире ГПЧ, пептидный состав которого исследовался методами современной протеомики (многопоточная хроматография с последующим масс-спектрометрическим de novo секвенированием пептидов). Найденные в составе ГПЧ Лаеннек® пептиды фактора роста гепатоцитов, инсулиноподобного фактора роста 1, пептиды – ингибиторы транскрипционного ядерного фактора каппа В (англ. nuclear factor kappa В, NF-κB), активируемой MAP-киназой протеинкиназы 2 (англ. MAP kinase-activated protein kinase 2, MAPKAPK2), киназы гликогенсинтазы-3-бета (англ. glycogen synthase kinase-3-beta, GSK3β), тирозинкиназы Брутона, каспазы-3 способствуют патогенетической терапии метаболического синдрома посредством устранения инсулинорезистентности, дислипидемии, хронического воспаления и жировой инфильтрации печени. Выявлены 27 гепатопротекторных пептидов ГПЧ Лаеннек®, которые поддерживают инозитолфосфат-зависимые сигнальные пути гепатоцитов, активируют таргетные белки (RARA, AMPK), ингибируют другие таргетные белки (Notch1, GSK-3, PAK1, TLR4) и в целом могут проявить противовоспалительные, антифибротические, вазодилаторные, антиатеросклеротические и антидиабетические свойства [17][18]. Исследование патоморфологической структуры различных тканей на моделях интоксикации алкоголем или парацетамолом у крыс показало, что ГПЧ Лаеннек® оказывает не только гепатопротекторное, но и нефропротекторное действие [17].
В настоящей работе представлены результаты масс-спектрометрического de novo секвенирования пептидов в составе препарата на основе ГПЧ Лаеннек®.
Цель – выявление потенциальных молекулярных механизмов нефропротекторного действия ГПЧ Лаеннек® на основании биоинформационного анализа собранных масс-спектрометрических данных.
МАТЕРИАЛ И МЕТОДЫ / MATERIAL AND METHODS
Методы протеомного анализа пептидных препаратов более детально описаны в работе [19]. Анализ пептидного состава ГПЧ Лаеннек® включал четыре этапа:
1) очистка препарата;
2) хроматографическое разделение пептидов;
3) определение многомерного масс-спектра пептидной фракции;
4) de novo секвенирование выделенных пептидов.
Очистка препарата / Drug purification
Очистка препарата состояла в отделении липидной фракции и обессоливании для получения очищенной пептидной фракции.
Для отделения липидной фракции использовали модифицированный метод Брокерхоффа–Даусона–Хюбшера. Сначала проводили мягкое щелочное дезацилирование фосфолипидов. Методику отрабатывали на смеси 1 мл протеолипосом из 1–20 мг фосфатидилхолина и 0,05–0,20 мг бацитрацина или грамицидина А: 1 мл образца очищенного препарата лиофилизировали, доливали гексан, метанол (1:1 объемной части) и разводили в 2 раза раствором 0,25 М NaOH в метаноле. Затем 45 мин инкубировали при встряхивании при комнатной температуре, включая 15 мин при температуре 75 °C. Последовательно приливали метанол, гексан и воду (1:4:4 объемным частям), перемешивали и центрифугировали 1 мин при 1000 g. Фракцию с гексаном отделяли, водно-метанольную – нейтрализовали HCl до pH 4–6. К нейтрализованной водно-метанольной фракции добавляли гексан, перемешивали, центрифугировали 1 мин при 1000 g, осторожно отсасывали фракцию с гексаном, не затрагивая осадок на границе раздела фаз. Повторяли процедуру 4 раза. Водно-метанольную фракцию объединяли, лиофилизировали, осадок ресуспендировали сначала в смеси метанола и воды (1:1 объемной части), супернатант сливали, затем в смеси хлороформа и метанола (1:1 объемной части), 0,2% трифторуксусной кислоты супернатанты объединяли, высушивали от хлороформа и обессоливали.
Обессоливание пептидной фракции проводили на мини-колонке при помощи центрифугирования. В мини-колонку размерами 0,75×4,5 см (Raining Instrument, США) наливали 2 мл сефадекса G-10 (Pharmacia, Швеция), декантированного в смеси метанола и воды (85:15 объемным частям), каплями наливали 160 мкл того же раствора и уравновешивали на центрифуге 1 мин при 1000 g. Процедуру повторяли до тех пор, пока на выходе не остался 150 мкл раствора. Тогда 150 мкл образца каплями наносили на гель и центрифугировали как описано выше. Гель после однократного использования заменяли. После процедуры обессоливания потери белка составляли не более 35%.
Хроматографическое разделение пептидов / Chromatographic separation of peptides
Пептиды в составе выделенной пептидной фракции разделяли с использованием параллельной системы хроматографического разделения пептидов Ultimate 3000 RSLC nano-system (Dionex, США).
Исследуемые образцы пептидной фракции помещали в хроматографическую колонку-ловушку Acclaim PepMap (Thermo Fisher Scientific, США) (2 см, внутренний диаметр 75 мкм, C18, 3 мкм, 100 A) со скоростью 2 мкл/мин в сочетании с 0,1% раствором муравьиной кислоты в воде. Через 5 мин колонка-ловушка автоматически подсоединялась к колонке для аналитической хроматографии Zorbax 300SB-С18 (Agilent Technologies, США) (15 см, внутренний диаметр 75 мкм, 3,5 мкм).
Элюирование пептидов проводили с применением смеси растворителей А (0,1% раствор муравьиной кислоты в дистилированной воде для высокоэффективной жидкостной хроматографии) и В (0,1% раствор муравьиной кислоты в 80% растворе ацетонитрила в воде). Хроматографическое разделение пептидов выполняли с применением линейного градиента растворителя В (от 5% до 40%) при скорости 300 нл/мин в течение 120 мин с последующими стадией промывки (промывка 10 мин 99% растворителем В) и стадией уравновешивания (промывка 10 мин 5% растворителем В).
Масс-спектрометрия с параллельной идентификацией пептидов / Mass spectrometry with parallel peptide identification
Масс-спектрометрию (МС) осуществляли с помощью масс-спектрометра Q-Exactive (Thermo Fisher Scientific, США). МС-данные включали результаты диссоциации пептидов, вызванной столкновением, – так называемые данные CID (англ. сollision-induced dissociation). Были использованы наноаэрозольный источник ионов Flex с напряжением ионизации 1800 В и температурой капилляра 200 °C. Данные масс-спектра собирали в соответствии с количеством имеющегося в МС-камере пептида-прекурсора. Получали данные о частицах пептидов, возникающих при фрагментации исходных пептидов в МС-камере.
Предварительное сканирование осуществляли при разрешении 70 000, диапазон сканирования 400–1200 m/z, целевые значения Automatic gain control автоматической регулировки усиления 1×10⁶, максимальное время впрыскивания 50 мс. Фрагментацию пептидных частиц в МС-камере проводили для 20 наиболее часто встречающихся ионов при нормированной энергии столкновения 30, динамическом исключении 10 с. Сканирование МС/МС образующихся ионов выполняли с разрешением 17 500, целевые значения составили 10⁵, максимальное время впрыска 100 мс, окно изоляции 2,0. Последовательности пептидов определяли с помощью программного обеспечения Mascot1, базы данных аминокислотных последовательностей SwissProt и посредством de novo секвенирования.
De novo секвенирование / De novo sequencing
De novo секвенирование пептидов проводили на основании данных CID с использованием программного комплекса DNVSEQP. При проведении процедуры CID исследуемые ионы пептидов ускоряются в электростатическом поле и сталкиваются с нейтральными частицами (аргон). При столкновении кинетическая энергия преобразуется во внутреннюю, что приводит к фрагментации пептидного иона на более мелкие фрагменты. Эти фрагменты анализируются посредством тандемной МС, в результате чего получается CID-масс-спектр молекулярных фрагментов пептида. CID-масс-спектр состоит из «массовой» компоненты (список наблюдаемых масс фрагментов) и «интенсивностной» компоненты (список наблюдаемых интенсивностей фрагментов).
Комплекс программ DNVSEQP для проведения de novo секвенирования пептидов аминокислотных последовательностей по данным CID основан на математической теории топологического, метрического, комбинаторного подходов к анализу больших данных и на теории анализа хемографов [20][21] в применении к задаче идентификации аминокислотных последовательностей по CID-масс-спектрам.
Хемограф – размеченный конечный граф без петель с кликовым числом не более 3. Множество вершин хемографа изоморфно множеству атомов молекулы, множество ребер изоморфно множеству химических связей молекулы, а матрица смежности содержит кратности химических связей. Пусть заданы множество меток Y (в качестве меток используются химические типы атомов C, N, O и т.д.), функция разметки вершин μ: V → Y и определена функция оценки метки w: Y→R. Разновидностью функции оценки метки является функция взвешивания m, вычисляющая атомарную массу для соответствующей метки вершины хемографа.
Пусть X=X(V,E) – хемограф c матрицей смежности M(X)={mij}, соответствующий исследуемому пептиду. Множество Γ = {(V,E) | V ⊂ N,E ⊂ N²}, являющееся множеством всех подграфов бесконечного полного графа G = (N,N²) , будем называть множеством всех возможных графов, ∀X ∈ Γ,N – натуральный ряд. Произвольный структурный фрагмент молекулы соответствует некоторому подграфу соответствующего хемографа X – т.е. графу, содержащему некое подмножество вершин данного графа и подмножество инцидентных этим вершинам ребер. Иначе говоря, множество всех структурных фрагментов молекулы изоморфно множеству всех замкнутых подграфов Π(X) хемографа:
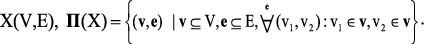
Введем оператор модификации хемографов 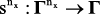 , где nx – небольшое натуральное число. В практическом случае nx редко превышает 2, т.к. вероятности тримолекулярных и, тем более, тетрамолекулярных реакций близки к нулю. Определим множество модификаций хемографов
, где nx – небольшое натуральное число. В практическом случае nx редко превышает 2, т.к. вероятности тримолекулярных и, тем более, тетрамолекулярных реакций близки к нулю. Определим множество модификаций хемографов 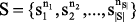 , элементы которого соответствуют посттрансляционным модификациям белков, добавлению/удалению ОН-групп и др. Множество возможных МС-фрагментов определяется как S×Г. Соответственно, произвольному фрагменту молекулы X, наблюдаемому в ходе проведения МС-эксперимента с CID-расщеплением молекул, соответствует определенный элемент множества S×Π(X).
, элементы которого соответствуют посттрансляционным модификациям белков, добавлению/удалению ОН-групп и др. Множество возможных МС-фрагментов определяется как S×Г. Соответственно, произвольному фрагменту молекулы X, наблюдаемому в ходе проведения МС-эксперимента с CID-расщеплением молекул, соответствует определенный элемент множества S×Π(X).
Таким образом, хемографу Х соответствует множество хемографов S×Π(X), описывающих возможные фрагменты молекулы Х. Для каждого из этих фрагментов может быть определен инвариант графа – числовая характеристика или упорядоченный список таких характеристик (кортеж), значение которой одинаково для каждого элемента произвольного класса изоморфных графов. Элементарным будем называть инвариант ι:Γ→R; кортеж-инвариантом – инвариант ι:Γ→Rn, n≥2 . Для каждого элемента a = (v(a), e(a)) множества S×Π(X), 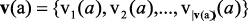 определим аддитивный числовой инвариант хемографа Х как:
определим аддитивный числовой инвариант хемографа Х как:
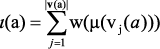 ,
,
так что множеству S×Π(X) соответствует кортеж-инвариант 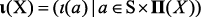 . Молекулярная масса любого элемента a = (v(a), e(a)) вычисляется как частный случай элементарного инварианта ι(a) при условии, что функция w суть функция взвешивания m.
. Молекулярная масса любого элемента a = (v(a), e(a)) вычисляется как частный случай элементарного инварианта ι(a) при условии, что функция w суть функция взвешивания m.
Кортеж-инвариант ι(Х) соответствует массовому компоненту CID-масс-спектра молекулы X и включает все МС-пики, возможные для X. Экспериментально наблюдаемый массовый компонент CID-масс-спектра молекулы, ιe(Х) является подмножеством кортежа ι(Х), ιe(Х) ⊆ ι(Х). Анализ разрешимости/регулярности задачи оценки изоморфизма по кортеж-инвариантам позволяет отобрать наиболее информативные элементы кортежа инвариантов ι(Х). Затем, применяя методы машинного обучения на множествах прецедентов ((ι(Х), ιe(Х))) и получая функцию 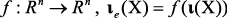 , можно вычислить массовый компонент CID-масс-спектра по кортежу ι(Х). Расчет значений функции является ключевым компонентом алгоритма de novo секвенирования, использованного в настоящей работе.
, можно вычислить массовый компонент CID-масс-спектра по кортежу ι(Х). Расчет значений функции является ключевым компонентом алгоритма de novo секвенирования, использованного в настоящей работе.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ / RESULTS AND DISCUSSION
Протеомные эксперименты (n=15) на образцах ГПЧ Лаеннек® выявили 95 290 откликов в координатах «молекулярная масса – хроматографическое время удержания», соответствующих последовательностям 293 452 пептидов. При этом 55 434 из 293 452 последовательностей пептидов найдены более чем в одном образце препарата. Биоинформационная аннотация данного массива пептидов в легкой (до 1000 Да) пептидной фракции препарата позволила обнаружить 48 пептидов, которые могут проявлять нефропротекторные свойства (табл. 1). Выявленные пептиды включают фрагменты адреномедуллинов и пептиды – ингибиторы таргетных белков FYN, PCSK5, PDGFR, SHH, TGFB1I1, WNK1/4, APH1A, SGK1, STAT1, PRMT1, CARM1, IRAK4, CAMK1, ROCK1/2 (табл. 2), которые проявляют антифибротические и противовоспалительные свойства в тканях почек.
Таблица 1. Нефропротекторные пептиды препарата Лаеннек®
и схожие с ними пептиды в протеоме человека
Table 1. Nephroprotective peptides of Laennec®
and similar peptides in the human proteome
|
Встречаемость* / Frequency rate* |
Пептид препарата Лаеннек® / |
Пептид белка протеома человека / Human proteome protein peptide |
п1 / p1 |
п2 / p2 |
Белок / Protein |
Таргетный белок / Targeted protein |
|
100% |
LGTGGF |
LGTGGF |
21 |
26 |
CHUK |
SGK1 |
|
87% |
MVDGLSDF |
MDGLSDF |
382 |
388 |
HHIP |
SHH |
|
80% |
DGLSDF |
DGLSDF |
383 |
388 |
HHIP |
SHH |
|
73% |
GTCT |
GTCT |
113 |
116 |
ADM |
Адреномедуллин / Adrenomedulline |
|
73% |
HLLFVA |
HLLFVA |
270 |
275 |
SHH |
SHH |
|
67% |
RRME |
RRME |
603 |
606 |
EP300 |
CARM1 |
|
67% |
PPVVAS |
PPVVSS |
182 |
187 |
TGFB1I1 |
TGFB1I1 |
|
60% |
QGAY |
QGAY |
436 |
439 |
SH2B1 |
PDGFR |
|
47% |
CAVQNL |
CQVQNL |
115 |
120 |
ADM2 |
Адреномедуллин / Adrenomedulline |
|
47% |
APGQL |
APGQL |
2287 |
2291 |
WNK1 |
WNK1/4 |
|
47% |
LYST |
LYST |
59 |
62 |
TGFB1I1 |
FYN, TGFB1I1 |
|
40% |
FLAVGGDV |
FLAVGRDV |
611 |
618 |
APBB1 |
SGK1 |
|
40% |
GAGGFG |
GTGGFG |
22 |
27 |
CHUK |
SGK1 |
|
40% |
GLPLLV |
GLPLLV |
192 |
197 |
TGFBR1 |
TGFBR2 |
|
40% |
FLAAEE |
FLTAEE |
307 |
312 |
TGFBR2 |
TGFBR2 |
|
40% |
HASGTF |
HAEGTF |
98 |
103 |
GCG |
PCSK5 |
|
33% |
EPPN |
EPPN |
505 |
508 |
LINGO4 |
ROCK1/2 |
|
33% |
TPTPAG |
TPTPAG |
243 |
248 |
QKI |
CARM1 |
|
27% |
NVGVCA |
NAGVCA |
529 |
534 |
KLHL3 |
WNK1/4 |
|
27% |
LGAGGF |
LGTGGF |
21 |
26 |
CHUK |
SGK1 |
|
27% |
DDGGGS |
DDGSGS |
2024 |
2029 |
WNK1 |
WNK1 |
|
27% |
FSDLEH |
FSELEH |
538 |
543 |
TGFBR2 |
TGFBR2 |
|
20% |
ELCS |
ELCS |
138 |
141 |
PRND |
ROCK1/2 |
|
20% |
SSPNQG |
SSPTQG |
364 |
369 |
MAPK8IP3 |
ROCK1/2 |
|
20% |
PLLVNQP |
PLLINQP |
97 |
103 |
B3GNT9 |
PRMT1 |
|
20% |
LLLLF |
LLLLF |
726 |
730 |
CDH1 |
APH1A |
|
20% |
LLLLVF |
LLLLLF |
725 |
730 |
CDH1 |
APH1A |
|
20% |
GPGLPL |
GSGLPL |
190 |
195 |
TGFBR1 |
TGFBR2 |
|
20% |
FHMDHF |
FHPDHF |
424 |
429 |
TGFB1I1 |
TGFB1I1 |
|
20% |
CGHL |
CGHL |
366 |
369 |
CBLC |
TGFB1I1 |
|
20% |
YLSSHR |
YLSSER |
146 |
151 |
EZR |
PDGFR |
|
13% |
NNFDGL |
NNFQGL |
100 |
105 |
ADM |
Адреномедуллин / Adrenomedulline |
|
13% |
DASSPH |
DPSSPH |
140 |
145 |
ADM2 |
Адреномедуллин / Adrenomedulline |
|
13% |
VQNLTH |
VQNLSH |
117 |
122 |
ADM2 |
Адреномедуллин / Adrenomedulline |
|
13% |
SVTDGV |
SVTDAV |
342 |
347 |
NEDD4L |
WNK1/4 |
|
13% |
DTTGSD |
DTTDSD |
381 |
386 |
PTEN |
ROCK1/2 |
|
13% |
DDVLLGL |
DDVLLEL |
99 |
105 |
MYD88 |
IRAK4, NFkB |
|
13% |
LSLFL |
LSLFL |
33 |
37 |
MYD88 |
IRAK4, NFkB |
|
13% |
TPTPSGP |
TPTPAGP |
243 |
249 |
QKI |
CARM1 |
|
13% |
GDGGVY |
GDGGIY |
272 |
277 |
DVL3 |
PRMT1 |
|
13% |
GTWL |
GTWL |
205 |
208 |
DCAF8 |
PRMT1 |
|
13% |
TGYLKT |
TGYIKT |
699 |
704 |
STAT1 |
JAK1/2 |
|
13% |
YLYL |
YLYL |
454 |
457 |
EPOR |
STAT1/3, JAK2 |
|
13% |
MVDGVV |
MVGGVV |
706 |
711 |
APP |
APH1A |
|
13% |
DHLYRT |
DHLYST |
57 |
62 |
TGFB1I1 |
FYN |
|
13% |
YGGLPD |
YGGLSD |
439 |
444 |
SH2B1 |
PDGFR |
|
13% |
HAAGSF |
HADGSF |
146 |
151 |
GCG |
PCSK5 |
|
13% |
FPEEV |
FPEEV |
132 |
136 |
GCG |
PCSK5 |
Примечание. * Пептиды упорядочены по убыванию встречаемости
в исследованных образцах препарата Лаеннек®.
п1 – левая граница (позиция) пептида в белке;
п2 – правая граница (позиция) пептида в белке.
Note. * Peptides are presented in descending order of frequency rate
in the studied samples of Laennec®.
p1 – the peptide left border (position) in the protein;
p2 – the peptide right border (position) in the protein.
Таблица 2. Таргетные белки нефропротекторных пептидов препарата Лаеннек®
Table 2. Target proteins of nephroprotective peptides of Laennec®
|
Ген / Gene |
Таргетный белок / Targeted protein |
Функция белка / Protein function |
|
ADM |
Адреномедуллин / Adrenomedulline |
Гипотензивный и вазодилататорный пептид, нефропротекторное действие / Hypotensive and vasodilatory peptide, nephroprotective effect |
|
FYN |
Тирозин-протеинкиназа Fyn / Tyrosine protein kinase Fyn |
Рост, выживание, адгезия клеток / Growth, survival, cell adhesion |
|
PCSK5 |
Пробелок конвертаза-5 / Proprotein convertase-5 |
Протеолиз пробелков, таргетный белок для нефропротекции / Proprotein proteolysis, a targeted protein for nephroprotection |
|
PDGFR |
Рецептор тромбоцитарного фактора роста бета / Platelet-derived growth factor beta-receptor |
Деление, выживание, дифференцировка клеток, профибротическое действие / Division, survival, cell differentiation, profibrotic action |
|
SHH |
Белок «сверхзвуковой ежик» / Supersonic hedgehog |
Морфоген с фибротическим эффектом / Morphogen with fibrotic effect |
|
TGFB1I1 |
Рецептор трансформирущих факторов роста / Transforming growth factor receptors |
Рецептор TGF-цитокинов, продукция внеклеточного матрикса / TGF cytokine receptor, extracellular matrix production |
|
WNK1 |
Серин/треонин-протеинкиназа // Serine/threonine protein kinase |
Электролитный гомеостаз, воспаление / Electrolyte homeostasis, inflammation |
|
APH1A |
Гамма-секретаза APH-1A / Gamma secretase APH-1A |
Вызревание сигнальных мембранных белков / Signaling membrane proteins maturation |
|
SGK1 |
Серин/треонин-протеинкиназа Sgk1 // Serine/threonine protein kinase Sgk1 |
Регуляция ионных каналов, мембранных транспортеров, факторов транскрипции / Regulation of ion channels, membrane transporters, and transcription factors |
|
STAT1 |
Преобразователь сигнала и активатор транскрипции 1-альфа/бета // Signal transducer and transcription activator 1-alpha/beta |
Опосредует клеточные ответы на цитокины и факторы роста / Mediates cellular responses to cytokines and growth factors |
|
PRMT1 |
Аргинин-N-метилтрансфераза-1 / Arginine-N-methyltransferase-1 |
Метилирует гуанидиновую группу аргинина в белках, оказывает эпигенетический эффект / Methylates the guanidine group of arginine in proteins, has an epigenetic effect |
|
CARM1 |
Гистон-аргинин метилтрансфераза / Histone-arginine methyltransferase |
Метилирует остатки аргинина в белках-гистонах (упаковка ДНК), воспаление / Methylates arginine residues in histone proteins (DNA packaging), inflammation |
|
IRAK4 |
Киназа-4, ассоциированная с рецептором интерлейкина-1 / Interleukin-1 receptor-associated kinase 4 |
Сигнальные пути воспаления (рецепторы TLR, IL-1R и др.) / Inflammatory signaling pathways (TLR, IL-1R receptors, etc.) |
|
CAMK1 |
Кальций/кальмодулин-зависимая протеинкиназа-1 // Calcium/calmodulin-dependent protein kinase-1 |
Регулировка транскрипции, в т.ч. для воспалительного ответа макрофагов / Transcription regulation, including for the inflammatory response of macrophages |
|
ROCK1/2 |
Rho-ассоциированные протеинкиназы 1/2 // Rho-associated protein kinases 1/2 |
Регуляция клеточной адгезии, фиброз / Regulation of cell adhesion, fibrosis |
|
WNK4 |
Серин/треонин-протеинкиназа WNK4 // Serine/threonine protein kinase WNK4 |
Регуляция электролитного гомеостаза, фиброз / Regulation of electrolyte homeostasis, fibrosis |
Примечание. TGF (англ. transforming growth factor) –
трансформирующий фактор роста;
ДНК – дезоксирибонуклеиновая кислота;
TLR (англ. toll-like receptor) – толл-подобный рецептор;
IL-1R (англ interleukin 1R) – интерлейкин 1R.
Note. TGF – transforming growth factor;
DNA – deoxyribonucleic acid;
TLR – toll-like receptor;
IL-1R – interleukin 1R.
Нефропротекторные пептиды группы адреномедуллинов / Nephroprotective peptides of adrenomedulline group
Адреномедуллины – гипотензивные и вазодилататорные пептиды, участвующие в физиологическом контроле водно-электролитного гомеостаза и осуществляющие диуретическое, натрийуретическое и нефропротекторное действие [22]. Адреномедуллины увеличивают выработку оксида азота почками и уменьшают повреждение почек в модели односторонней обструкции мочеточника у мышей [23]. Биологические эффекты адреномедуллинов опосредованы [24]:
– G-белок-зависимыми рецепторами пептида CGRP, связанного с геном кальцитонина (CGRPR-1);
– кальцитонин-рецептор-подобным рецептором (CRLR).
Специфичность взаимодействия этих рецепторов с адреномедуллинами определяется белками, модифицирующими активность рецепторов, – так называемыми RAMP-белками (англ. repeat associated mysterious proteins).
В составе препарата Лаеннек® найдено четыре пептидных фрагмента адреномедуллинов, которые взаимодействуют с перечисленными выше рецепторными белками. Пептид GTCT соответствует фрагменту 113-116 GTCT адреномедуллина, который взаимодействует c кальцитониновым рецептором CGRPR-1 (рис. 1а). Пептиды CAVQNL (соответствует фрагменту 115-120 CQVQNL адреномедуллина-2), VQNLTH (117-122 VQNLSH белка адреномедуллина-2), DASSPH (140-145 DPSSPH адреномедуллина-2) взаимодействуют с комплексом рецептора CRLR (рис. 1b). Пептид DASSPH соответствует фрагменту 140-145 DPSSPH адреномедуллина-2, который взаимодействует с рецепторным комплексом CRLR:RAMP1 (рис. 1с). Таким образом, имеющиеся структуры белков – рецепторов адреномедуллинов указывают на биологическую нефропротекторную активность соответствующих пептидов препарата Лаеннек®.
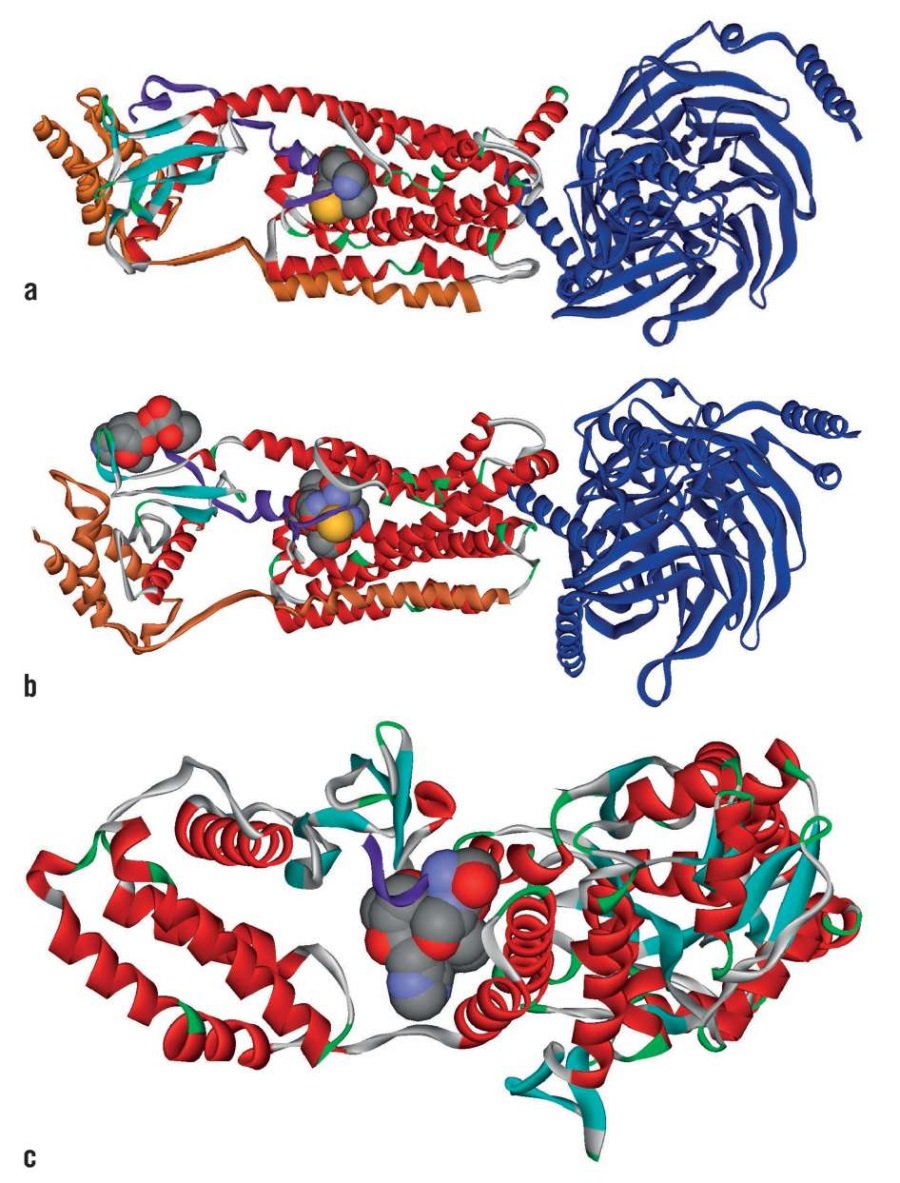
Рисунок 1. Взаимодействия пептидных фрагментов адреномедуллинов,
найденных в составе препарата Лаеннек®,
с соответствующими белками-рецепторами.
Показаны собственно молекула рецептора (красный цвет),
G-белок (синий цвет), RAMP-белок (оранжевый цвет)
и адреномедуллин (фиолетовый цвет):
а – комплекс CGRPR-1 рецептора и пептид GTCT (PDB 6uun), пептид GTCT
в контексте аминокислотной последовательности адреномедуллина
показан в виде сферической модели;
b – взаимодействие пептидов CAVQNL, VQNLTH и DASSPH
(сферическая модель) с CRLR-рецептором адреномедуллина-2 (PDB 6uva);
с – взаимодействие пептида DASSPH в контексте адреномедуллина-2
с рецепторным комплексом CRLR:RAMP1 (PDB 6d1u)
Figure 1. Interactions of peptide fragments of adrenomedullin
found in Laennec® with the corresponding receptor proteins.
The receptor molecule itself (red), G protein (blue), RAMP protein (orange)
and adrenomedullin (purple) are shown:
a – CGRPR-1 receptor complex and GTCT peptide (PDB 6uun),
the GTCT peptide in the context of the amino acid sequence
of adrenomedullin is shown as a spherical model;
b – interaction of the peptides CAVQNL, VQNLTH and DASSPH
(spherical model) with the CRLR receptor adrenomedullin-2 (PDB 6uva);
c – interaction of the DASSPH peptide in the context
of adrenomedullin-2 with the CRLR:RAMP1 receptor complex (PDB 6d1u)
Пептиды с антифибротическим действием на ткани почек / Peptides with antifibrotic effect on kidney tissue
Рецептор тромбоцитарного фактора роста-бета (PDGFR) необходим для регуляции деления, выживаемости, дифференцировки, хемотаксиса клеток и формирования разветвленной сети капилляров в клубочках почек. Передача сигналов от PDGF-рецептора усиливается при гломерулярном нефрите и Ig2A-нефропатии, что стимулирует развитие фиброза почек [25]. Апробируемые в настоящее время антагонисты PDGFR проявляют низкую специфичность, а их долгосрочные эффекты практически не изучены. Пептид препарата Лаеннек® QGAY соответствует фрагменту 436-439 QGAY белка SH2B1, где остаток тирозин-439 фосфорилируется PDGFR. Данный остаток является концевым в пептиде QGAY, который, таким образом, не содержит правую половину сайта фосфорилирования и поэтому может ингибировать обсуждаемый таргетный белок (PDGFR) посредством специфичного связывания. Пептид YLSSHR соответствует фрагменту 146-151 YLSSER белка EZR, где остаток тирозин-146 фосфорилируется белком PDGFR. Аналогично пептид YGGLPD соответствует фрагменту 439-444 YGGLSD белка SH2B1, где остаток тирозин-439 также фосфорилируется белком PDGFR [26] (рис. 2).
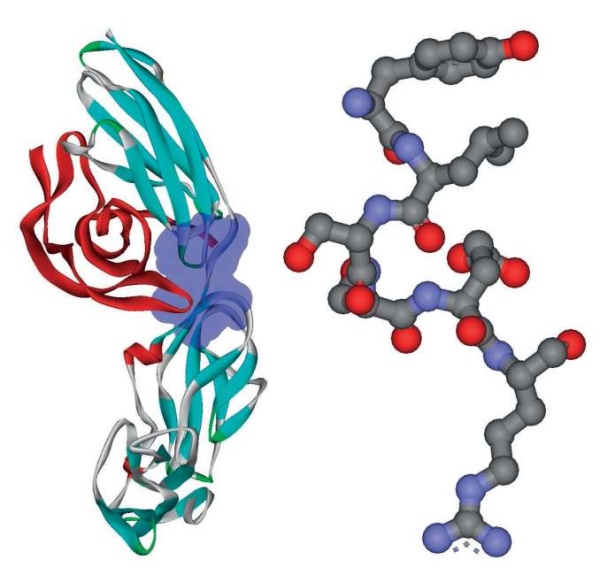
Рисунок 2. Структура рецептора PDGFR-бета.
Слева – рецептор PDGFR (PDB 3mjg),
показана молекула фактора PDGF (красный цвет)
и сайт связывания пептидов препарата Лаеннек® (выделен синим).
Справа – структура пептида YLSSHR, связывающегося с рецептором
(PDB 4RMA, TURN 144-149)
Figure 2. Structure of the PDGFR-beta receptor.
On the left, the PDGFR receptor (PDB 3mjg), the PDGF factor molecule (red)
and the Laennec® peptide binding site (highlighted in blue) are shown.
On the right, there is the structure of the YLSSHR peptide
binding to the receptor (PDB 4RMA, TURN 144-149)
TGF-бета-рецептор TGFB1I1 – рецептор трансформирующих факторов роста (англ. transforming growth factor) TGFВ, TGFB1, TGFB2 и TGFB3, который регулирует деление и дифференцировку мезенхимальных клеток, заживление ран, продукцию внеклеточного матрикса, иммуносупрессию и фиброзные изменения в тканях [27]. Ингибирование передачи сигналов от рецептора TGFВ снижает интерстициальный фиброз почек в модели гипертонической нефропатии у мышей [28]. Ингибитор рецептора TGF предотвращал гломерулярный склероз в модели нефрита у крыс (линия Thy1) [29]. Пептид препарата Лаеннек® FHMDHF соответствует фрагменту 424-429 FHPDHF белка TGFB1I1, где замена остатка гистидин-428 приводит к потере активации белка [30], так что данный пептид может ингибировать активность рецептора TGFB1I1. Пептид CGHL, соответствующий фрагменту 366-369 CGHL белка CBLC, также может предотвращать активацию рецептора TGFB1I1 [31].
Найдено четыре пептида препарата Лаеннек®, которые могут ингибировать профибротический рецептор TGFBR2. Пептид FLAAEE соответствует фрагменту 307-312 FLTAEE белка TGFBR2, где замена близлежащего аминокислотного остатка лейцин-308 тормозит сигналы от рецептора TGFBR2 [32]. Пептид GLPLLV соответствует фрагменту 192-197 GLPLLV белка TGFBR1, где аминокислота серин-191 фосфорилируется белком TGFBR2 [33]. Данная аминокислота не входит в пептид GLPLLV (который, таким образом, может ингибировать рецептор TGFBR2). Пептид FSDLEH соответствует фрагменту 538-543 FSELEH белка TGFBR2, где замена близлежащего аминокислотного остатка аргинин-537 тормозит сигналы от рецептора TGFBR2 [32]. Пептид GPGLPL соответствует фрагменту 190-195 GSGLPL белка TGFBR1, где близлежащие серин-189 и серин-191 не входят в состав пептида GPGLPL. Эти остатки серина фосфорилируются белком TGFBR2 [33], и, таким образом, пептид GPGLPL может ингибировать таргетный белок TGFBR2 (рис. 3).
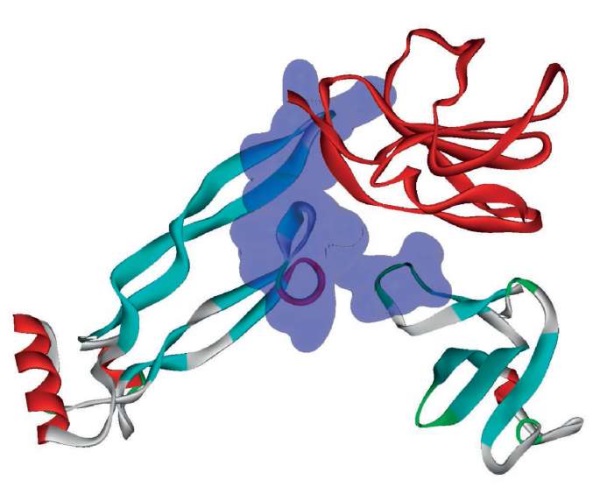
Рисунок 3. Структура рецепторов TGFB1I1/TGFBR2 (PDB 3kfd).
Показаны структура трансформирующего фактора роста (красный цвет)
и потенциальный сайт связывания пептидов препарата Лаеннек® (выделен синим)
Figure 3. Structure of TGFB1I1/TGFBR2 receptors (PDB 3kfd).
The structure of the transforming growth factor TGF (red)
and the potential binding site for Laennec® peptides (highlighted in blue) are shown
Белок SHH («сверхзвуковой ежик», англ. sonic hedgehog) является белком-морфогеном, необходимым для формирования органов во время морфогенеза. Избыточная активность передачи сигналов по сигнальному каскаду sonic hedgehog способствует почечному фиброзу [34]. Пептид препарата Лаеннек® MVDGLSDF соответствует фрагменту 382-388 MDGLSDF белка HHIP, где аминокислоты Мет-382 и Глу-383 принципиально важны для взаимодействия с SHH [35]. Данный пептид, специфически связываясь с белком SHH, может являться пептидом – миметиком белка HHIP, который в соответствии со структурой комплекса «HHIP + SHH» ингибирует белок SHH [35]. Пептид DGLSDF соответствует фрагменту 383-388 DGLSDF белка HHIP, который взаимодействует с белком SHH. Пептид HLLFVA соответствует фрагменту 270-275 HLLFVA белка SHH, где остаток гистидин-270 принципиально важен для аутоактивации SHH [36]. Поэтому пептид HLLFVA также является потенциальным ингибитором белка SHH.
Серин/треонин-протеинкиназа WNK1 участвует в регуляции электролитного гомеостаза, внутриклеточной передаче сигналов и выживании клеток, модулирует активность натрий-калиевых котранспортеров хлоридов и активирует киназу SGK1, вызывающую воспаление и фиброз тканей. Серин/треонин-протеинкиназа WNK4 также необходима для регуляции электролитного гомеостаза и активации кииназы SGK1. Последняя вызывает почечный фиброз и ингибирует куллин-3, который является компонентом комплекса BTB-CUL3-RBX1 убиквитин-протеинлигазы Е3. Комплекс BTB-CUL3-RBX1 опосредует убиквитинирование и последующую протеасомную деградацию сигнальных белков [37]. Нарушение куллин-3-опосредованного убиквитинирования вызывает повреждение проксимальных канальцев и фиброз почек. Куллин-3 регулирует гомеостаз электролитов посредством убиквитинирования и деградации WNK4 [38]. WNK4 ингибирует Ca(2+)-активируемые калиевые каналы «большой проводимости» (BK-каналы) посредством сигнального пути митоген-активируемых протеинкиназ [39].
Пептиды препарата Лаеннек® NVGVCA и SVTDGV могут ингибировать обе WNK-киназы. Пептид NVGVCA соответствует фрагменту 529-534 NAGVCA белка KLHL3, где близлежащий аргинин-528 нарушает взаимодействие с WNK1 [40]. Это специфическое взаимодействие пептида с WNK1 позволяет говорить о блокаде эффектов WNK1 пептидом NVGVCA. Пептид SVTDGV соответствует фрагменту 342-347 SVTDAV белка NEDD4L, где остаток серин-342 фосфорилируется WNK1/4 [41], так что пептид SVTDGV может ингибировать эти две WNK-киназы (рис. 4).
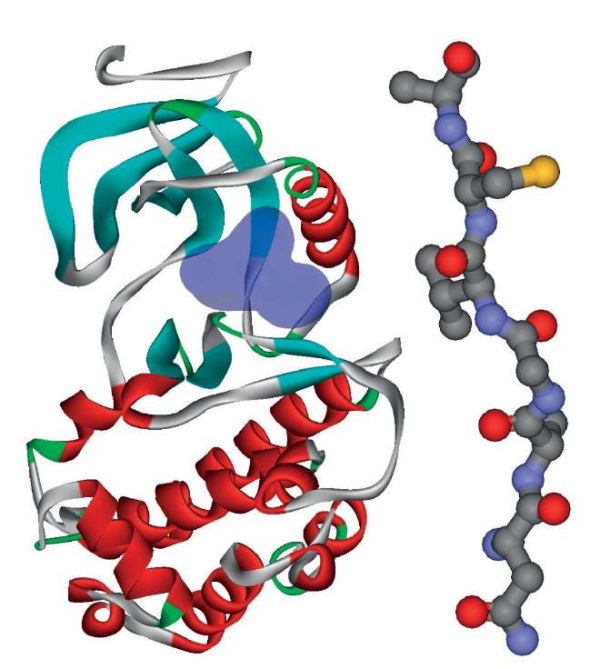
Рисунок 4. Структура киназ WNK1/4 (PDB 5wdy).
Слева показана структура киназы WNK4 с сайтом связывания
пептидов препарата Лаеннек® (выделен синим),
справа – структура пептида NVGVCA (PDB 4CH9)
Figure 4. Structure of WNK1/4 kinases (PDB 5wdy).
On the left, the structure of WNK4 kinase
with the Laennec® peptide binding site (highlighted in blue) is shown.
On the right, there is the structure of the NVGVCA peptide (PDB 4CH9)
Аргинин-N-метилтрансфераза PRMT1 метилирует гуанидиновую группу аргинина в белках [42], опосредуя эпигенетические эффекты, осуществляемые гистонами – белками упаковки ДНК. Фермент PRMT1 активирует экспрессию генов и опосредует активацию почечных фибробластов и фиброгенез посредством передачи сигналов через белки STAT/SMAD [43]. Пептид препарата Лаеннек® PLLVNQP соответствует фрагменту 97-103 PLLINQP белка B3GNT9, в котором слева от данного пептида расположен аргинин-96, модифицируемый ферментом PRMT1 [44]. Соответствующий аргинин отсутствует в аминокислотной последовательности пептида PLLVNQP, поэтому данный пептид может ингибировать фермент PRMT1. Пептид GDGGVY соответствует фрагменту 272-277 GDGGIY белка DVL3, где аргинин-271 слева (не входит в аминокислотную последовательность GDGGVY) модифицируется ферментом PRMT1 [45]. Пептид GTWL соответствует фрагменту 205-208 GTWL белка DCAF8. Известно, что в белке DCAF8 аргинин-204, расположенный слева от фрагмента 205-208 GTWL, модифицируется ферментом PRMT1 [46], поэтому GTWL – потенциальный ингибитор фермента PRMT1.
Rho-ассоциированные протеинкиназы ROCK1/2 – регулятор клеточной адгезии. Ингибирование белков ROCK1/2 тормозит развитие почечного фиброза и метаболических нарушений в эпителиальных клетках проксимальных канальцев, также улучшая функцию почек при острой ишемии почек у крыс [47]. Четыре пептида препарата Лаеннек® могут ингибировать киназы ROCK1/2. Пептид EPPN соответствует фрагменту 505-508 EPPT белка LINGO4, где треонин-508 фосфорилируется посредством ROCK1 [48]. Пептид ELCS соответствует фрагменту 138-141 SLCS белка PRND, где серин-138 фосфорилируется ROCK1 [49]. Пептид SSPNQG соответствует фрагменту 364-369 SSPTQG белка MAPK8IP3, где серин-364 фосфорилируется посредством ROCK1 [50]. Пептид DTTGSD соответствует фрагменту 381-386 DTTDSD белка PTEN, где серин-380 (не представлен в пептиде DTTGSD) фосфорилируется ROCK1 [51], треонин-382 фосфорилируется ROCK1 (рис. 5).
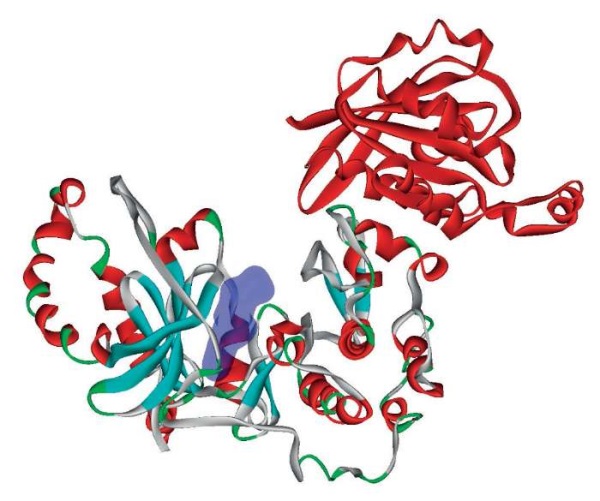
Рисунок 5. Структура киназ ROCK1/2,
в которой указано расположение сайта связывания
ингибирующих пептидов препарата Лаеннек® (выделен синим).
Красным цветом показана цепь белка RHOE,
взаимодействующего с киназами ROCK1/2
Figure 5. Structure of ROCK1/2 kinases,
indicating the location of the binding site for
the inhibitory peptides of Laennec® (highlighted in blue).
The chain of the RHOE protein interacting with ROCK1/2 kinases is shown in red
Пептиды, снижающие метаболический стресс нефроцитов / Peptides that reduce the metabolic stress of nephrocytes
Пробелок конвертаза PCSK5 участвует в протеолизе пробелков с аминокислотным мотивом RXXX[K/R]R [52]. Исследование пептидома мочи в сочетании с транскриптомным анализом позволило определить конвертазу PCSK5 как таргетный белок, избыточная активность которого ассоциирована с наличием у пациентов хронической почечной недостаточности [53].
Пептид препарата Лаеннек® HASGTF соответствует фрагменту 98-103 HAEGTF белка GCG, слева от которого расположен сайт 97-98, подвергающийся протеолизу посредством конвертаз PCSK1/5. Очевидно, что пептид 98-103 HAEGTF не содержит остаток, соответствующий остатку 97 белка GCG, что указывает на ингибиторные свойства пептида HASGTF по отношению к конвертазам PCSK1/5. Пептид HAAGSF соответствует фрагменту 146-151 HADGSF белка GCG, где расположенный слева сайт 145-146 подвергается протеолизу посредством конвертаз PCSK1/5. Поэтому пептид HADGSF – ингибитор конвертаз PCSK1/5. Пептид FPEEV соответствует фрагменту 132-136 FPEEV белка GCG, где расположенный рядом сайт 130-131 подвергается протеолизу посредством конвертаз PCSK1/5, так что пептид FPEEV – также ингибитор PCSK1/5.
Тирозин-протеинкиназа Fyn участвует в регуляции роста и выживания клеток, интегрин-опосредованной передаче сигналов, ремоделировании цитоскелета, формировании иммунного ответа. После активации посредством киназы PKA киназа Fyn связывается с белковым комплексом PTK2/FAK1, обеспечивая фосфорилирование и активацию комплекса PTK2/FAK1 [54]. Ингибиторы FYN ослабляют диабетическое повреждение почек, блокируя стресс эндоплазматического ретикулума (который связан с накоплением неправильно свернутых белков) [55]. Пептид препарата Лаеннек® LYST соответствует фрагменту 59-62 LYST белка TGFB1I1 (где остаток тирозин-60 фосфорилируется киназой FYN [56]) и может являться частичным антагонистом FYN. Пептид DHLYRT соответствует фрагменту 57-62 DHLYST белка TGFB1I1, где в пептиде DHLYRT вместо серина-61 присутствует аргинин, что будет ингибировать киназу FYN. Таким образом, пептиды LYST и DHLYRT, ингибируя киназу FYN, могут снижать диабетическое повреждение почек.
Гамма-секретаза APH-1A катализирует внутримембранное расщепление интегральных мембранных белков, таких как рецепторы Notch [57], тем самым регулируя сигнальные каскады Notch и Wnt. Notch представляет собой мембранный белок, активируемый встроенным в мембрану протеолитическим комплексом секретазы. Путь Notch является потенциальной терапевтической мишенью для лечения почечных заболеваний. Нефрозащитные эффекты ингибиторов секретазы были исследованы на модели острого повреждения тканей почек у мышей, вызванного введением нефротоксичного фитоэкстракта цветковых растений Aristolochiacea [58].
Три пептида препарата Лаеннек® могут ингибировать гамма-секретазу. Пептид LLLLF соответствует фрагменту 726-730 LLLLF белка CDH1, где расположенный справа сайт 731-732 (не входит в пептид LLLLF) протеолизируется гамма-секретазой. Пептид LLLLVF соответствует фрагменту 725-730 LLLLLF белка CDH1, где расположенный справа сайт 731-732 протеолизируется гамма-секретазой. Пептид MVDGVV соответствует фрагменту 706-711 MVGGVV белка APP, где расположенный справа и не входящий в пептид MVDGVV сайт 711-712 подвергается протеолизу гамма-секретазой. Таким образом, все три пептида – потенциальные ингибиторы APH-1A, снижение активности которой может способствовать облегчению течения острого повреждения почек нефротоксикантами.
Нефропротекторные пептиды с противовоспалительным действием / Nephroprotective peptides with anti-inflammatory effect
Серин/треонин-протеинкиназа Sgk1 вовлечена в регуляцию ионных каналов, мембранных транспортеров, клеточных ферментов, факторов транскрипции, влияет на рост, выживание, миграцию и апоптоз клеток. SGK1 способствует регуляции задержки Na+ в почках, элиминации K+ почками, инсулинозависимой солевой чувствительности артериального давления, проявляет профибротические эффекты. SGK1 активирует Na+-каналы ENAC, SCN5A и ASIC1, K+-каналы KCNJ1/ROMK1 и провоспалительный фактор NF-κB. Высокая активность SGK1 способствует развитию артериальной гипертонии и диабетической нефропатии [59]. SGK1 индуцирует кальцификацию гладкомышечных клеток сосудов посредством передачи сигналов NF-κB [60]. Повышенная активность SGK1 усиливает повреждение почек, индуцированное минералокортикоидами, хлоридом натрия [61], и TH17-зависимое повреждение почек [62]. SGK1 ингибирует деградацию TGF-бета-зависимыми факторами транскрипции Smad2/3, приводя к воспалению и фиброзу тканей почек [63]. Ингибирование SGK1 подавляет эпителиально-мезенхимальный переход и способствует аутофагии эпителиальных клеток почечных канальцев при диабетической нефропатии, указывая на то, что SGK1 – важный таргетный белок в фармакотерапии заболеваний почек [64].
В настоящем исследовании найдено четыре нефропротекторных пептида препарата Лаеннек®. Пептид LGTGGF соответствует фрагменту 21-26 LGTGGF белка CHUK, где аминокислота треонин-23 фосфорилируется SGK1 [65]. Пептид FLAVGGDV соответствует фрагменту 611-618 FLAVGRDV белка APBB1, где расположенный слева серин-610 (не входящий в пептид FLAVGGDV) фосфорилируется SGK1. Пептид GAGGFG соответствует фрагменту 22-27 GTGGFG белка CHUK, где треонин-23, который фосфорилируется SGK1 [66], отсутствует в пептиде GAGGFG, так что последний будет блокировать активный сайт киназы SGK1. Пептид LGAGGF соответствует фрагменту 21-26 LGTGGF белка CHUK, так что вместо треонина-23 (который фосфорилируется SGK1 [66]) в пептиде LGAGGF представлен остаток аланина. Поэтому пептид LGAGGF будет ингибировать SGK1 (рис. 6), снижая воспаление и фиброз в тканях почек, способствуя нормализации артериального давления и нефропротекции при сахарном диабете.
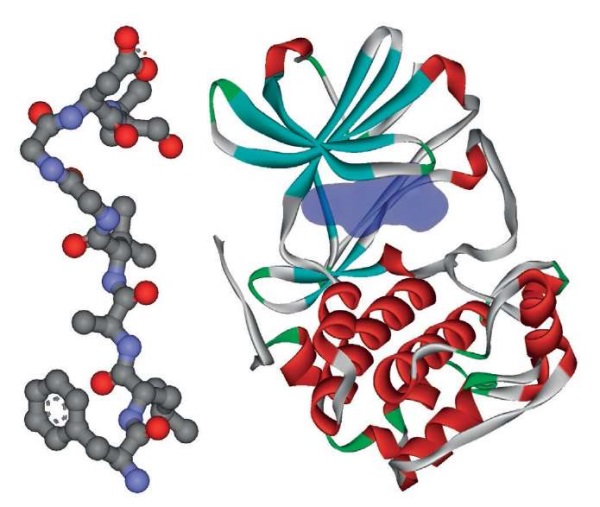
Рисунок 6. Структура пептида препарата Лаеннек® FLAVGGDV
(PDB 3DXE, слева) и киназы SGK1 (PDB 2r5t, справа)
Figure 6. Structure of the Laennec® FLAVGGDV peptide
(PDB 3DXE, left) and SGK1 kinase (PDB 2r5t, right)
Преобразователь сигнала и активатор транскрипции STAT1 опосредует клеточные ответы на цитокины и факторы роста через протеинкиназы, которые приводят к активации киназ TYK2/JAK1. Фосфорилированный STAT1/2 димеризуется и связывается с другими белками с образованием активного комплекса транскрипционного фактора [ 28753426]. Флувастатин ингибирует активацию белков JAK и STAT1/2 в почечных клубочках и мезангиальных клетках у крыс со стрептозотоциновой моделью диабета. Ингибирование фосфорилирования JAK/STAT флувастатином проявляет нефропротекторный эффект при диабетической нефропатии [67].
Пептид препарата Лаеннек® TGYLKT соответствует фрагменту 699-704 TGYIKT белка STAT1, где остаток тирозин-701 фосфорилируется JAK1/2 киназами [68]. Пептид YLYL соответствует фрагменту 454-457 YLYL белка EPOR, где аминокислота тирозин-456 необходима для взаимодействия с STAT1/3 и его активации, тирозин-454 и тирозин-456 фосфорилируются JAK2 [69]. Поэтому пептид YLYL может одновременно ингибировать активацию STAT1/3 и киназу JAK2, тем самым способствуя нефропротекции.
Гистон-аргининметилтрансфераза CARM1 метилирует остатки аргинина в белках, участвующих в упаковке ДНК, регуляции транскрипции, сплайсинге и стабильности мРНК. При воспалительной стимуляции моноцитов белок CARM1 действует как активатор NF-κB-зависимых провоспалительных цитокинов IP10 и MCP1 в клетках почек [70]. Пептид препарата Лаеннек® RRME соответствует фрагменту 603-606 RRME белка EP300, где аргинин-604 взаимодействует с CARM1 [71]. Пептид TPTPAG соответствует фрагменту 243-248 TPTPAG белка QKI, где аргинин-242 слева взаимодействует с CARM1, также как и в пептиде TPTPSGP [46] (рис. 7). Оба эти пептида будут ингибировать белок CARM1, снижая активацию провоспалительного фактора NF-κB.
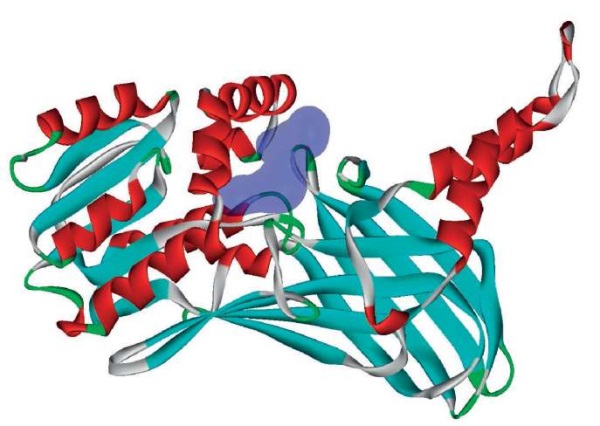
Рисунок 7. Структура гистон-аргининметилтрансферазы CARM1 (PDB 6arv)
с указанием сайта связывания пептидов препарата Лаеннек® (выделен синим)
Figure 7. Structure of histone arginine methyltransferase CARM1 (PDB 6arv)
showing the Laennec® peptide binding site (highlighted in blue)
Киназа IRAK4, ассоциированная с рецептором ИЛ-1, участвует в провоспалительных сигнальных путях толл-подобных рецепторов и ИЛ-1R [72]. IRAK4 фосфорилирует белок IRAK1, тем самым стимулируя его убиквитинирование (которое, в свою очередь, приводит к деградации этого белка на протеасомах клетки). Затем убиквитин-связывающий домен киназы IKBKG объединяет комплексы IRAK1-MAP3K7 и TAK1-TRAF6, тем самым активируя киназы IKKA и IKKB, транслокацию и активацию фактора NF-κB [73]. Нефропротекторные эффекты ингибитора IRAK4 осуществляются посредством их противовоспалительного действия [74]. Пептид препарата Лаеннек® DDVLLGL соответствует фрагменту 99-105 DDVLLEL белка MYD88, где расположенный слева аргинин-98 взаимодействует с IRAK4, а также с фактором NF-κB [75]. Пептид LSLFL соответствует фрагменту 33-37 LSLFL белка MYD88, где серин-34 взаимодействует с NF-κB и IRAK4 [75]. Поэтому пептиды DDVLLGL и LSLFL могут тормозить воспаление и осуществлять нефропротекцию одновременно по двум механизмам: ингибирование IRAK1 и ингибирование NF-κB.
Таким образом, исследованный ГПЧ содержит нефропротекторные пептиды – фрагменты адреномедуллинов, пептидов-ингибиторов киназ (FYN, WNK1/4, SGK1 и др.) и фибротических рецепторов PDGFR, TGFB1I1 (рис. 8). Действуя через описанные молекулярные механизмы, эти пептиды ГПЧ Лаеннек® могут реализовывать нефропротекторные эффекты посредством снижения воспаления, фиброза, стрессовых состояний клеток тканей почек, способствуя коррекции нефрогепатометаболических нарушений.
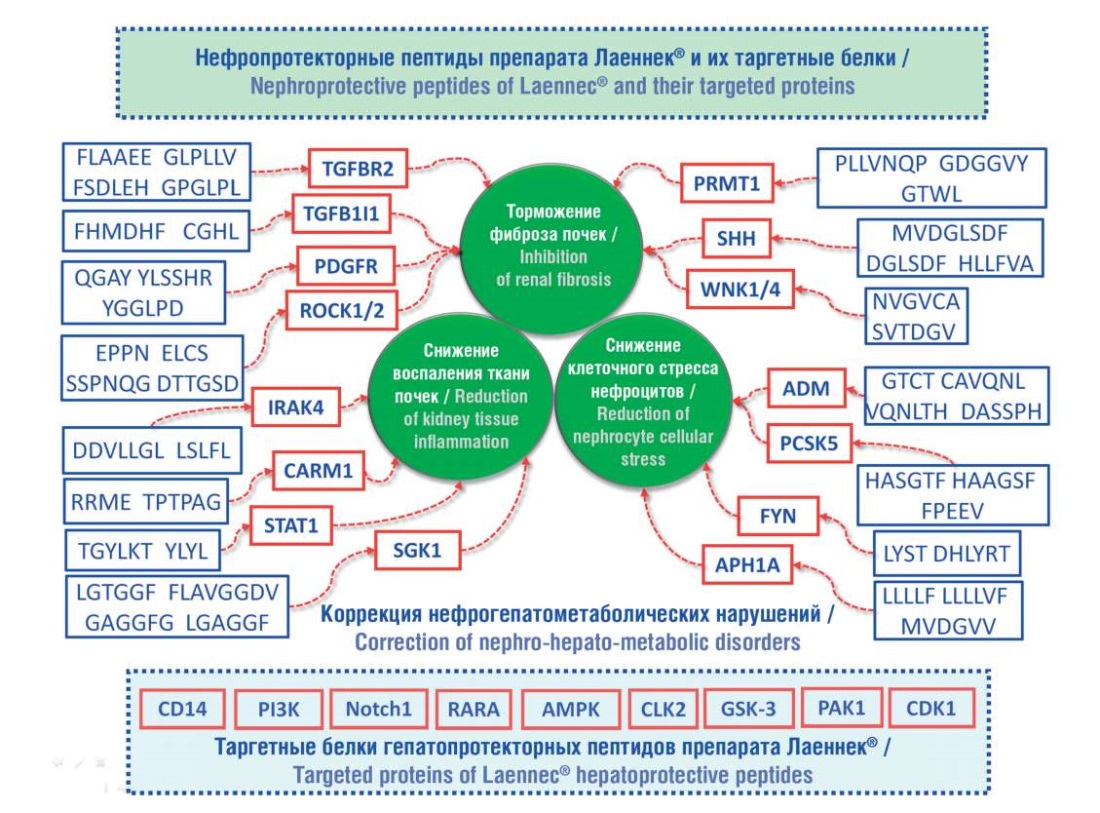
Рисунок 8. Молекулярные механизмы коррекции нефрогепатометаболических нарушений
Figure 8. Molecular mechanisms of correction of nephrohepatometabolic disorders
ЗАКЛЮЧЕНИЕ / CONCLUSION
Нефрогепатометаболические нарушения, связанные с одновременной дисфункцией печени и почек, существенно усложняют задачи гепатопротекторной фармакотерапии. Во-первых, сочетанная патология важнейших органов детоксикации требует использования препаратов с высоким уровнем безопасности, в т.ч. с минимальной нагрузкой на выводящие системы организма. Во-вторых, учитывая высокий уровень воспаления и фибротических трансформаций при совместном поражении печени и почек, фармакотерапия должна быть дополнена противовоспалительными и антифибротическими препаратами. В-третьих, в связи с множественностью молекулярных механизмов формирования воспаления и фиброза необходимо, чтобы данные препараты воздействовали на разные таргетные белки. В-четвертых, при инфекционном генезе поражений печени и почек следует включать в фармакотерапию препараты с противовирусными (антибактериальными) свойствами.
Очевидно, что буквалистское применение указанных принципов приведет к выраженной полипрагмазии. В то же время стандартизированные ГПЧ характеризуются описанными выше свойствами. В частности, в настоящей работе описаны 48 пептидов ГПЧ Лаеннек®, которые могут проявлять нефропротекторные и антифибротические эффекты (пептиды с гепатопротекторным, противовоспалительным, противовирусным действием были описаны нами ранее).
1. http://www.matrixscience.com.
2. IgA (англ. immunoglobulin A) – иммуноглобулин А.
Список литературы
1. Ермоленко В.М., Николаев А.Ю. Острая почечная недостаточность. М.: ГЭОТАР-Медиа; 2010: 240 с.
2. Arroyo V. The liver and the kidney: mutual clearance or mixed intoxication. Contrib Nephrol. 2007; 156: 17–23. https://doi.org/10.1159/000102011.
3. Mookerjee R.P., Malaki M., Davies N.A., et al. Increasing dimethylarginine levels are associated with adverse clinical outcome in severe alcoholic hepatitis. Hepatology. 2007; 45 (1): 62–71. https://doi.org/10.1002/hep.21491.
4. Shoji T., Wada A., Inoue K., et al. Prospective randomized study evaluating the efficacy of the spherical adsorptive carbon AST-120 in chronic kidney disease patients with moderate decrease in renal function. Nephron Clin Pract. 2007; 105 (3): c99–107. https://doi.org/10.1159/000097985.
5. Baquerizo A., Anselmo D., Shackleton C., et al. Phosphorus ans an early predictive factor in patients with acute liver failure. Transplantation. 2003; 75 (12): 2007–14. https://doi.org/10.1097/01.TP.0000063219.21313.32.
6. Fraunberger P., Wang Y., Holler E., et al. Prognostic value of interleukin 6, procalcitonin, and C-reactive protein levels in intensive care unit patients during first increase of fever. Shock. 2006; 26 (1): 10–2. https://doi.org/10.1097/01.shk.0000215319.06866.bd.
7. Lane K., Dixon J.J., MacPhee I.A., Philips B.J. Renohepatic crosstalk: does acute kidney injury cause liver dysfunction? Nephrol Dial Transplant. 2013; 28 (7): 1634-47. https://doi.org/10.1093/ndt/gft091.
8. Fisher E.S., Curry S.C. Evaluation and treatment of acetaminophen toxicity. Adv Pharmacol. 2019; 85: 263–72. https://doi.org/10.1016/bs.apha.2018.12.004.
9. Avci E., Abasiyanik F. Autoimmune hepatitis after SARS-CoV-2 vaccine: new-onset or flare-up? J Autoimmun. 2021; 125: 102745. https://doi.org/10.1016/j.jaut.2021.102745.
10. Silva-Aguiar R.P., Teixeira D.E., Peres R.A.S., et al. Subclinical acute kidney injury in COVID-19: possible mechanisms and future perspectives. Int J Mol Sci. 2022; 23 (22): 14193. https://doi.org/10.3390/ijms232214193.
11. Yende S., Parikh C.R. Long COVID and kidney disease. Nat Rev Nephrol. 2021; 17 (12): 792–3. https://doi.org/10.1038/s41581-021-00487-3.
12. Ghonaim A.H., Hopo M.G., Ismail A.K., et al. Hepatoprotective and renoprotective effects of silymarin against salinomycin-induced toxicity in adult rabbits. Vet World. 2022; 15 (9): 2244–52. https://doi.org/10.14202/vetworld.2022.2244-2252.
13. Feng J., Gao H., Yang L., et al. Renoprotective and hepatoprotective activity of Lepidiumdraba L. extracts on oxymetholone-induced oxidative stress in rat. J Food Biochem. 2022; 46 (9): e14250. https://doi.org/10.1111/jfbc.14250.
14. Adeoye S.W.A., Adeshina O.S., Yusuf M.G., Omole A. Hepatoprotective and renoprotective effect of moringa oleifera seed oil on dichlorvos-induced toxicity in male Wistar rats. Niger J Physiol Sci. 2022; 37 (1): 119–26. https://doi.org/10.54548/njps.v37i1.15.
15. Mirmohammadlu M., Hosseini S.H., Kamalinejad M., et al. Hypolipidemic, hepatoprotective and renoprotective effects of Cydonia oblonga Mill. Fruit in streptozotocin-induced diabetic rats. Iran J Pharm Res. 2015; 14 (4): 1207–14.
16. Громова О.А., Торшин И.Ю., Чучалин А.Г., Максимов В.А. Гидролизаты плаценты человека: от В.П. Филатова до наших дней. Терапевтический архив. 2022; 94 (3): 434–41. https://doi.org/10.26442/00403660.2022.03.201408.
17. Громова О.А., Торшин И.Ю., Демидов В.И. и др. Экспериментальный лекарственный гепатит. Гепатопротекторные эффекты препарата Лаеннек на моделях токсического повреждения печени парацетамолом или алкоголем. Экспериментальная и клиническая гастроэнтерология. 2022; 3: 86–92. https://doi.org/10.31146/1682-8658-ecg-199-3-86-92.
18. Торшин И.Ю., Громова О.А., Тихонова О.В., Згода В.Г. Гепатопротекторные пептиды препарата Лаеннек. Экспериментальная и клиническая гастроэнтерология. 2022; 7: 21–30. https://doi.org/10.31146/1682-8658-ecg-203-7-21-3019.
19. Громова О.А., Торшин И.Ю., Максимов В.А. и др. Пептиды в составе препарата Лаеннек, способствующие устранению гиперферритинемии и перегрузки железом. ФАРМАКОЭКОНОМИКА. Современная фармакоэкономика и фармакоэпидемиология. 2020; 13 (4): 413–25. https://doi.org/10.17749/2070-4909/farmakoekonomika.2020.070.
20. Torshin I.Y., Rudakov K.V. On the application of the combinatorial theory of solvability to the analysis of chemographs. Part 1: Fundamentals of modern chemical bonding theory and the concept of the chemograph. Pattern Recognit Image Anal. 2014; 24 (1): 11–23. https://doi.org/10.1134/S1054661814010209.
21. Torshin I.Yu., Rudakov K.V. On the procedures of generation of numerical features over partitions of sets of objects in the problem of predicting numerical target variables. Pattern Recognit Image Anal. 2019; 29 (4): 654–67. https://doi.org/10.1134/S1054661819040175.
22. Takahashi K., Hirose T., Mori N., et al. The renin-angiotensin system, adrenomedullins and urotensin II in the kidney: possible renoprotection via the kidney peptide systems. Peptides. 2009; 30 (8): 1575–85. https://doi.org/10.1016/j.peptides.2009.05.018.
23. Ito K., Yoshii H., Asano T., et al. Adrenomedullin increases renal nitric oxide production and ameliorates renal injury in mice with unilateral ureteral obstruction. J Urol. 2010; 183 (4): 1630–5. https://doi.org/10.1016/j.juro.2009.12.002.
24. Smith D.M., Coppock H.A., Withers D.J., et al. Adrenomedullin: receptor and signal transduction. Biochem Soc Trans. 2002; 30 (4): 432–7. https://doi.org/10.1042/bst0300432.
25. Buhl E.M., Djudjaj S., Klinkhammer B.M., et al. Dysregulated mesenchymal PDGFR-β drives kidney fibrosis. EMBO Mol Med. 2020; 12 (3): e11021. https://doi.org/10.15252/emmm.201911021.
26. Naba A., Reverdy C., Louvard D., Arpin M. Spatial recruitment and activation of the Fes kinase by ezrin promotes HGF-induced cell scattering. EMBO J. 2008; 27 (1): 38–50. https://doi.org/10.1038/sj.emboj.7601943.
27. Ozdamar B., Bose R., Barrios-Rodiles M., et al. Regulation of the polarity protein Par6 by TGFbeta receptors controls epithelial cell plasticity. Science. 2005; 307 (5715): 1603–9. https://doi.org/10.1126/science.1105718.
28. Wu J.C., Wang X.J., Zhu J.H., et al. GPR97 deficiency ameliorates renal interstitial fibrosis in mouse hypertensive nephropathy. Acta Pharmacol Sin. 2023; 44 (6): 1206–16. https://doi.org/10.1038/s41401-022-01041-y.
29. Terashima H., Kato M., Ebisawa M., et al. R-268712, an orally active transforming growth factor-β type I receptor inhibitor, prevents glomerular sclerosis in a Thy1 nephritis model. Eur J Pharmacol. 2014; 734: 60–6. https://doi.org/10.1016/j.ejphar.2014.03.045.
30. Saelzler M.P., Spackman C.C., Liu Y., et al. ERK8 down-regulates transactivation of the glucocorticoid receptor through Hic-5. J Biol Chem. 2006; 281 (24): 16821–32. https://doi.org/10.1074/jbc.M512418200.
31. Ryan P.E., Kales S.C., Yadavalli R., et al. Cbl-c ubiquitin ligase activity is increased via the interaction of its RING finger domain with a LIM domain of the paxillin homolog, Hic 5. PLoS One. 2012; 7 (11): e49428. https://doi.org/10.1371/journal.pone.0049428.
32. Mizuguchi T., Collod-Beroud G., Akiyama T., et al. Heterozygous TGFBR2 mutations in Marfan syndrome. Nat Genet. 2004; 36 (8): 855–60. https://doi.org/10.1038/ng1392.
33. Wieser R., Wrana J.L., Massagué J. GS domain mutations that constitutively activate T beta R-I, the downstream signaling component in the TGF-beta receptor complex. EMBO J. 1995; 14 (10): 2199–208. https://doi.org/10.1002/j.1460-2075.1995.tb07214.x.
34. Ding H., Zhou D., Hao S., et al. Sonic hedgehog signaling mediates epithelial-mesenchymal communication and promotes renal fibrosis. J Am Soc Nephrol. 2012; 23 (5): 801–13. https://doi.org/10.1681/ASN.2011060614.
35. Bosanac I., Maun H.R., Scales S.J., et al. The structure of SHH in complex with HHIP reveals a recognition role for the Shh pseudo active site in signaling. Nat Struct Mol Biol. 2009; 16 (7): 691–7. https://doi.org/10.1038/nsmb.1632.
36. Nanni L., Ming J.E., Bocian M., et al. The mutational spectrum of the sonic hedgehog gene in holoprosencephaly: SHH mutations cause a significant proportion of autosomal dominant holoprosencephaly. Hum Mol Genet. 1999; 8 (13): 2479–88. https://doi.org/10.1093/hmg/8.13.2479.
37. Scott D.C., Rhee D.Y., Duda D.M., et al. Two distinct types of E3 ligases work in unison to regulate substrate ubiquitylation. Cell. 2016; 166 (5): 1198–214.e24. https://doi.org/10.1016/j.cell.2016.07.027.
38. Shibata S., Zhang J., Puthumana J., et al. Kelch-like 3 and cullin 3 regulate electrolyte homeostasis via ubiquitination and degradation of WNK4. Proc Natl Acad Sci USA. 2013; 110 (19): 7838–43. https://doi.org/10.1073/pnas.1304592110.
39. Yue P., Zhang C., Lin D.H., et al. WNK4 inhibits Ca(2+)-activated big-conductance potassium channels (BK) via mitogen-activated protein kinase-dependent pathway. Biochim Biophys Acta. 2013; 1833 (10): 2101–10. https://doi.org/10.1016/j.bbamcr.2013.05.004.
40. Boyden L.M., Choi M., Choate K.A., et al. Mutations in kelch-like 3 and cullin 3 cause hypertension and electrolyte abnormalities. Nature. 2012; 482 (7383): 98–102. https://doi.org/10.1038/nature10814.
41. Dephoure N., Zhou C., Villén J., et al. A quantitative atlas of mitotic phosphorylation. Proc Natl Acad Sci USA. 2008; 105 (31): 10762–7. https://doi.org/10.1073/pnas.0805139105.
42. Passos D.O., Bressan G.C., Nery F.C., Kobarg J. Ki-1/57 interacts with PRMT1 and is a substrate for arginine methylation. FEBS J. 2006; 273 (17): 3946–61. https://doi.org/10.1111/j.1742-4658.2006.05399.x.
43. Zhu Y., Yu C., Zhuang S. Protein arginine methyltransferase 1 mediates renal fibroblast activation and fibrogenesis through activation of Smad3 signaling. Am J Physiol Renal Physiol. 2020; 318 (2): F375–87. https://doi.org/10.1152/ajprenal.00487.2019.
44. Sakamaki J., Daitoku H., Ueno K., et al. Arginine methylation of BCL-2 antagonist of cell death (BAD) counteracts its phosphorylation and inactivation by Akt. Proc Natl Acad Sci USA. 2011; 108 (15): 6085–90. https://doi.org/10.1073/pnas.1015328108.
45. Bikkavilli R.K., Avasarala S., Vanscoyk M., et al. Dishevelled3 is a novel arginine methyl transferase substrate. Sci Rep. 2012; 2: 805. https://doi.org/10.1038/srep00805.
46. Weimann M., Grossmann A., Woodsmith J., et al. A Y2H-seq approach defines the human protein methyltransferase interactome. Nat Methods. 2013; 10 (4): 339–42. https://doi.org/10.1038/nmeth.2397.
47. Kentrup D., Reuter S., Schnöckel U., et al. Hydroxyfasudil-mediated inhibition of ROCK1 and ROCK2 improves kidney function in rat renal acute ischemia-reperfusion injury. PLoS One. 2011; 6 (10): e26419. https://doi.org/10.1371/journal.pone.0026419.
48. Edwards D.C., Sanders L.C., Bokoch G.M., Gill G.N. Activation of LIM-kinase by Pak1 couples Rac/Cdc42 GTPase signalling to actin cytoskeletal dynamics. Nat Cell Biol. 1999; 1 (5): 253–9. https://doi.org/10.1038/12963.
49. Shao J., Welch W.J., Diprospero N.A., Diamond M.I. Phosphorylation of profilin by ROCK1 regulates polyglutamine aggregation. Mol Cell Biol. 2008; 28 (17): 5196–208. https://doi.org/10.1128/MCB.00079-08.
50. Ongusaha P.P., Qi H.H., Raj L., et al. Identification of ROCK1 as an upstream activator of the JIP-3 to JNK signaling axis in response to UVB damage. Sci Signal. 2008; 1 (47): ra14. https://doi.org/10.1126/scisignal.1161938.
51. Torres J., Pulido R. The tumor suppressor PTEN is phosphorylated by the protein kinase CK2 at its C terminus. Implications for PTEN stability to proteasome-mediated degradation. J Biol Chem. 2001; 276 (2): 993–8. https://doi.org/10.1074/jbc.M009134200.
52. Paule S., Aljofan M., Simon C., et al. Cleavage of endometrial α-integrins into their functional forms is mediated by proprotein convertase 5/6. Hum Reprod. 2012; 27 (9): 2766–74. https://doi.org/10.1093/humrep/des203.
53. Petra E., Siwy J., Vlahou A., Jankowski J. Urine peptidome in combination with transcriptomics analysis highlights MMP7, MMP14 and PCSK5 for further investigation in chronic kidney disease. PLoS One. 2022; 17 (1): e0262667. https://doi.org/10.1371/journal.pone.0262667.
54. Meriane M., Tcherkezian J., Webber C.A., et al. Phosphorylation of DCC by Fyn mediates Netrin-1 signaling in growth cone guidance. J Cell Biol. 2004; 167 (4): 687–98. https://doi.org/10.1083/jcb.200405053.
55. Dorotea D., Jiang S., Pak E.S., et al. Pan-Src kinase inhibitor treatment attenuates diabetic kidney injury via inhibition of Fyn kinasemediated endoplasmic reticulum stress. Exp Mol Med. 2022; 54 (8): 1086–97. https://doi.org/10.1038/s12276-022-00810-3.
56. Ishino M., Aoto H., Sasaski H., et al. Phosphorylation of Hic-5 at tyrosine 60 by CAKbeta and Fyn. FEBS Lett. 2000; 474 (2-3): 179–83. https://doi.org/10.1016/s0014-5793(00)01597-0.
57. Bai X.C., Yan C., Yang G., et al. An atomic structure of human γ-secretase. Nature. 2015; 525 (7568): 212–7. https://doi.org/10.1038/nature14892.
58. Juillerat-Jeanneret L., Flohr A., Schneider M., et al. Targeted γ-secretase inhibition to control the Notch pathway in renal diseases. J Med Chem. 2015; 58 (20): 8097–109. https://doi.org/10.1021/acs.jmedchem.5b00912.
59. Wiemuth D., Lott J.S., Ly K., et al. Interaction of serum- and glucocorticoid regulated kinase 1 (SGK1) with the WW-domains of Nedd4-2 is required for epithelial sodium channel regulation. PLoS One. 2010; 5 (8): e12163. https://doi.org/10.1371/journal.pone.0012163.
60. Voelkl J., Luong T.T., Tuffaha R., et al. SGK1 induces vascular smooth muscle cell calcification through NF-κB signaling. J Clin Invest. 2018; 128 (7): 3024–40. https://doi.org/10.1172/JCI96477.
61. Sierra-Ramos C., Velazquez-Garcia S., Keskus A.G., et al. Increased SGK1 activity potentiates mineralocorticoid/NaCl-induced kidney injury. Am J Physiol Renal Physiol. 2021; 320 (4): F628–43. https://doi.org/10.1152/ajprenal.00505.2020.
62. Donadei C., Angeletti A., Cantarelli C., et al. Erythropoietin inhibits SGK1-dependent TH17 induction and TH17-dependent kidney disease. JCI Insight. 2019; 5 (10): e127428. https://doi.org/10.1172/jci.insight.127428.
63. Artunc F., Lang F. Mineralocorticoid and SGK1-sensitive inflammation and tissue fibrosis. Nephron Physiol. 2014; 128 (1-2): 35–9. https://doi.org/10.1159/000368267.
64. Zhuang L., Jin G., Hu X., et al. The inhibition of SGK1 suppresses epithelial-mesenchymal transition and promotes renal tubular epithelial cell autophagy in diabetic nephropathy. Am J Transl Res. 2019; 11 (8): 4946–56.
65. Tai D.J., Su C.C., Ma Y.L., Lee E.H. SGK1 phosphorylation of IkappaB kinase alpha and p300 up-regulates NF-kappaB activity and increases N-methyl-D-aspartate receptor NR2A and NR2B expression. J Biol Chem. 2009; 284 (7): 4073–89. https://doi.org/10.1074/jbc.M805055200.
66. Ozes O.N., Mayo L.D., Gustin J.A., et al. NF-kappaB activation by tumour necrosis factor requires the Akt serine-threonine kinase. Nature. 1999; 401 (6748): 82–5. https://doi.org/10.1038/43466.
67. Shi Y.H., Zhao S., Wang C., et al. Fluvastatin inhibits activation of JAK and STAT proteins in diabetic rat glomeruli and mesangial cells under high glucose conditions. Acta Pharmacol Sin. 2007; 28 (12): 1938–46. https://doi.org/10.1111/j.1745-7254.2007.00653.x.
68. Harada D., Yamanaka Y., Ueda K., et al. Sustained phosphorylation of mutated FGFR3 is a crucial feature of genetic dwarfism and induces apoptosis in the ATDC5 chondrogenic cell line via PLCgamma-activated STAT1. Bone. 2007; 41 (2): 273–81. https://doi.org/10.1016/j.bone.2006.11.030.
69. Hörtner M., Nielsch U., Mayr L.M., et al. A new high affinity binding site for suppressor of cytokine signaling-3 on the erythropoietin receptor. Eur J Biochem. 2002; 269 (10): 2516–26. https://doi.org/10.1046/j.1432-1033.2002.02916.x.
70. Liu X., Wang L., Li H., et al. Coactivator-associated arginine methyltransferase 1 targeted by miR-15a regulates inflammation in acute coronary syndrome. Atherosclerosis. 2014; 233 (2): 349–56. https://doi.org/10.1016/j.atherosclerosis.2014.01.039.
71. Xu W., Chen H., Du K., et al. A transcriptional switch mediated by cofactor methylation. Science. 2001; 294 (5551): 2507–11. https://doi.org/10.1126/science.1065961.
72. Hoarau C., Gérard B., Lescanne E., et al. TLR9 activation induces normal neutrophil responses in a child with IRAK-4 deficiency: involvement of the direct PI3K pathway. J Immunol. 2007; 179 (7): 4754–65. https://doi.org/10.4049/jimmunol.179.7.4754.
73. Yamamoto T., Tsutsumi N., Tochio H., et al. Functional assessment of the mutational effects of human IRAK4 and MyD88 genes. Mol Immunol. 2014; 58 (1): 66–76. https://doi.org/10.1016/j.molimm.2013.11.008.
74. Kondo M., Tahara A., Hayashi K., et al. Renoprotective effects of novel interleukin-1 receptor-associated kinase 4 inhibitor AS2444697 through anti-inflammatory action in 5/6 nephrectomized rats. Naunyn Schmiedebergs Arch Pharmacol. 2014; 387 (10): 909–19. https://doi.org/10.1007/s00210-014-1023-z.
75. George J., Motshwene P.G., Wang H., et al. Two human MYD88 variants, S34Y and R98C, interfere with MyD88-IRAK4-myddosome assembly. J Biol Chem. 2011; 286 (2): 1341–53. https://doi.org/10.1074/jbc.M110.159996.
Об авторах
О. А. ГромоваРоссия
д.м.н., профессор, ведущий научный сотрудник
WoS ResearcherID: J-4946-2017; Scopus Author ID: 7003589812
ул. Вавилова, д. 44, корп. 2, Москва 119333, Россия
И. Ю. Торшин
Россия
к.ф-м.н., к.х.н., ведущий научный сотрудник
WoS ResearcherID: C-7683-2018; Scopus Author ID: 7003300274
ул. Вавилова, д. 44, корп. 2, Москва 119333, Россия
А. Н. Громов
Россия
инженер-исследователь
WoS ResearcherID: C-7476-2018; Scopus Author ID: 7102053964;
ул. Вавилова, д. 44, корп. 2, Москва 119333, Россия
О. В. Тихонова
Россия
к.б.н., руководитель ЦКП «Протеом человека»
WoS ResearcherID: F-5115-2017; Scopus Author ID: 57189102916
ул. Погодинская, д. 10, стр. 8, Москва 119121, Россия
Рецензия
Для цитирования:
Громова О.А., Торшин И.Ю., Громов А.Н., Тихонова О.В. Нефропротекторные пептиды препарата Лаеннек® в контексте фармакотерапии нефрогепатометаболических нарушений. ФАРМАКОЭКОНОМИКА. Современная фармакоэкономика и фармакоэпидемиология. 2023;16(4):570-586. https://doi.org/10.17749/2070-4909/farmakoekonomika.2023.215
For citation:
Gromova O.A., Torshin I.Yu., Gromov A.N., Tikhonova O.V. Nephroprotective peptides of Laennec® in the context of pharmacotherapy for nephro-hepato-metabolic disorders. FARMAKOEKONOMIKA. Modern Pharmacoeconomics and Pharmacoepidemiology. 2023;16(4):570-586. (In Russ.) https://doi.org/10.17749/2070-4909/farmakoekonomika.2023.215

Контент доступен под лицензией Creative Commons Attribution-NonCommercial-ShareAlike 4.0 International License.






































