Перейти к:
Фармакоэкономический анализ применения лекарственного препарата эмпэгфилграстим для лечения раннего и местно-распространенного HER2+ рака молочной железы в Российской Федерации
https://doi.org/10.17749/2070-4909/farmakoekonomika.2023.220
Аннотация
Цель: провести анализ влияния на бюджет применения лекарственного препарата эмпэгфилграстим для первичной профилактики фебрильной нейтропении у пациенток, получающих неоадъювантную терапию по схеме «доцетаксел / карбоплатин / трастузумаб + пертузумаб» при раннем и местно-распространненом раке молочной железы (РМЖ), положительном на рецептор эпидермального фактора роста 2-го типа (англ. human epidermal growth factor receptor 2, HER2+), с учетом возможной последующей адъювантной терапии трастузумаб эмтанзином или трастузумабом в условиях Российской Федерации.
Материал и методы. Проведен поиск и анализ опубликованных результатов отечественных клинических, эпидемиологических и фармакоэкономических исследований, а также нормативных правовых актов. Построена модель дерева решений, в которой отражены вероятности перехода на различные схемы адъювантной терапии в зависимости от достижения или недостижения в опухоли полного патоморфологического ответа (ypT0/is, ypN0) у пациенток с ранним и местно-распространенным HER2+ РМЖ. Выполнен анализ влияния на бюджет со сравнением двух опций первичной профилактики: эмпэгфилграстим и филграстим.
Результаты. Несмотря на более высокие затраты на профилактику эмпэгфилграстимом по сравнению с филграстимом (249 против 134 тыс. руб.), за счет более высокой частоты достижения полного патоморфологического ответа и, соответственно, меньшего числа случаев, требующих адъювантной терапии более дорогостоящим трастузумаб эмтанзином, возможна экономия 916 тыс. руб. на 1 пациентку за 1 год терапии. В целом профилактика целевой популяции с ранним и местно-распространенным HER2+ РМЖ с применением эмпэгфилграстима позволит снизить затраты на 9,4 млрд руб. за 1 год терапии по сравнению с филграстимом.
Заключение. Профилактика эмпэгфилграстимом, несмотря на более высокие затраты за 1 год терапии, является экономически целесообразной опцией сопроводительной терапии в условиях российской системы здравоохранения. В дополнение к снижению частоты развития фебрильной нейтропении сохраняются частота и доза химиотерапии, что приводит к повышению эффективности первичной терапии.
Ключевые слова
Для цитирования:
Журавлева М.В., Кокушкин К.А., Лучинин Е.А., Лучинина Е.В., Каменева Т.Р., Кузнецова Е.В., Крысанова В.С., Макарова Е.В., Жукова Л.Г. Фармакоэкономический анализ применения лекарственного препарата эмпэгфилграстим для лечения раннего и местно-распространенного HER2+ рака молочной железы в Российской Федерации. ФАРМАКОЭКОНОМИКА. Современная фармакоэкономика и фармакоэпидемиология. 2023;16(4):537-549. https://doi.org/10.17749/2070-4909/farmakoekonomika.2023.220
For citation:
Zhuravleva M.V., Kokushkin K.A., Luchinin E.A., Luchinina E.V., Kameneva T.R., Kuznetsova E.V., Krysanova V.S., Makarova E.V., Zhukova L.G. Pharmacoeconomic analysis of using empegfilgrastim for the treatment of early and locally advanced HER2+ breast cancer in the Russian Federation. FARMAKOEKONOMIKA. Modern Pharmacoeconomics and Pharmacoepidemiology. 2023;16(4):537-549. (In Russ.) https://doi.org/10.17749/2070-4909/farmakoekonomika.2023.220
ВВЕДЕНИЕ / INTRODUCTION
Предоперационная, или неоадъювантная системная лекарственная терапия у пациенток с местно-распространенным раком молочной железы (РМЖ) предназначена как для достижения операбельности опухоли или снижения объема радикального оперативного вмешательства, так и при первично-операбельном процессе – для оценки чувствительности опухоли на проводимое лечение в каждом конкретном случае с целью возможной своевременной коррекции схемы терапии в дальнейшем, оценки прогноза заболевания. Адъювантная системная терапия РМЖ применяется после радикальной операции с целью снижения риска рецидива заболевания путем эрадикации микрометастазов [1].
Ранее проведенные исследования показали прямую взаимосвязь относительной дозовой интенсивности лекарственной терапии (количество препарата в единицу времени) с возрастанием гибели клеток опухоли и торможением ее роста в интервале между циклами. Следовательно, соблюдение относительной дозоинтенсивности лечения может позволить достигать оптимальных результатов терапии и повышать вероятность излечения. Данное обстоятельство особенно важно для пациенток с быстро делящимися клетками в опухоли и ранними формами злокачественных новообразований (ЗНО), у которых основная цель лечения – ремиссия без возврата болезни на долгие годы.
Нейтропения и вызванные ею осложнения, в т.ч. фебрильная нейтропения (ФН), являются самыми частыми осложнениями противоопухолевого лечения, особенно содержащего цитостатические препараты. К последствиям развития нейтропении относится вынужденная редукция доз препаратов и/или удлинение интервалов между циклами, что снижает относительную дозоинтенсивность лечения.
На настоящий момент существуют эффективные опции поддерживающей терапии и профилактики развития осложнений, которые позволяют применять современные лекарственные средства безопасно и максимально эффективно. Назначение антибиотиков и препаратов класса гранулоцитарных колониестимулирующих факторов (Г-КСФ) нивелирует случаи развития ФН, индуцированной цитотоксической терапией [2]. Следует отметить, что Европейская организация по изучению и лечению рака (англ. European Organization for Research and Treatment of Cancer, EORTC) не рекомендует антибиотикопрофилактику пациентам, получающим миелосупрессивную терапию по поводу ЗНО по причине нежелательных явлений и формирования резистентности к множеству возбудителей [3].
Препараты класса Г-КСФ ускоряют дифференцировку нейтрофилов в костном мозге, сокращая период их созревания с 5 до 1 дня, повышают их способность к хемотаксису и активируют зрелые моноциты [4], таким образом восстанавливая абсолютное число нейтрофилов к началу следующего цикла. Объединенные результаты эффективности профилактики препаратами класса Г-КСФ опубликованы в системном обзоре 61 рандомизированного клинического исследования, в котором показано, что первичная профилактика Г-КСФ при проведении химиотерапии достоверно снижает вероятность редукции доз химиопрепаратов и абсолютный риск смертности от любой причины. Снижение смертности для пациенток с РМЖ наиболее значимо выражено при проведении химиотерапии в высоких дозах и дозоуплотненных режимах (относительный риск 0,959 и 0,858 соответственно). Была доказана корреляция исхода лечения и увеличения общей выживаемости (ОВ) за счет наилучшего контроля над болезнью благодаря профилактике Г-КСФ [5]. Исследование, включившее 819 больных с диагнозом РМЖ, получавших терапию платиносодержащими препаратами или доцетакселом, показало, что снижение относительной дозоинтесивности ниже 85% ухудшает ОВ на 16 мес (p=0,0195) [6]. Сегодня в клинической практике дозоуплотненные режимы терапии ранних форм РМЖ (особенно для пациенток с высоким риском рецидива) на фоне первичной профилактики препаратами класса Г-КСФ являются наилучшей опцией для достижения длительной ремиссии и увеличения ОВ.
Препараты класса Г-КСФ представлены в двух формах: короткого действия (например, филграстим требует ежедневного подкожного введения) и пролонгированного действия (например, в случае эмпэгфилграстима или пэгфилграстима требуется только одна подкожная инъекция после каждого цикла химиотерапии). Необходимость ежедневного введения обусловлена быстрым почечным клиренсом. Пролонгированные формы филграстима представляют собой его ковалентные конъюгаты с одной молекулой полиэтиленгликоля (ПЭГ). Изменение структуры молекулы повлекло за собой изменение ее фармакокинетических и фармакодинамических свойств [7][8], отразившееся в трансформации основного пути выведения как нейтрофил-опосредованного клиренса. Средний период естественного полувыведения пегилированного филграстима увеличивается до 42 ч по сравнению с 3,5–3,8 ч для филграстима. Продукция нейтрофилов в ответ на введение пегилированной формы филграстима обеспечивает контроль концентрации, обратную связь, позволяющую с определенной скоростью выводить вещество из организма. Такой уникальный эффект саморегуляции обусловливает снижение концентрации пегилированного филграстима в крови по мере увеличения нейтрофилов [9].
В проведенных ранее оригинальных исследованиях, а также систематических обзорах показано, что риски развития ФН и других осложнений, связанных с ФН, у пациенток с РМЖ были более низкими при применении ПЭГ-Г-КСФ, снижалось число ФН-опосредованных госпитализаций и антибиотикотерапии [10][11].
В 2016 г. Минздрав России зарегистрировал первый оригинальный отечественный препарат для профилактики ФН, разработанный биотехнологической компанией АО «Биокад». В его основу легла молекула с инновационной структурой – эмпэгфилграстим. Главные его отличия от других зарегистрированных препаратов пегилированного филграстима заключаются в еще более длительной циркуляции препарата в крови и его более выраженном терапевтическом эффекте. Данные преимущества достигаются за счет присоединения к филграстиму молекулы ПЭГ с молекулярной массой 30 кДа, в то время как другие препараты пегилированного филграстима имеют меньшую молекулярную массу [12].
Эффективность и безопасность эмпэгфилграстима для применения в качестве профилактики нейтропении у пациенток с РМЖ доказаны в регистрационном клиническом исследовании фазы III. Препарат продемонстрировал превосходящую над филграстимом эффективность: частота развития нейтропении 3–4-й степеней тяжести составила 44% в группе пациенток, получавших эмпэгфилграстим, и 79% в группе филграстима; длительность нейтропении любой степени тяжести – 2 и 4 сут соответственно; длительность нейтропении 4-й степени тяжести – 0,8 и 1,7 сут соответственно. Профиль безопасности был сопоставим в обеих группах [13]. Промежуточные результаты масштабного наблюдательного исследования реальной клинической практики DEFENDOR (NCT04811443) показывают эффективность эмпэгфилграстима для поддержания относительной дозоинтенсивности лечения в широком спектре нозологий [14].
В наблюдательном исследовании DEFENDOR SPECIAL (NCT04905329) у пациенток когорты раннего и местно-распространенного РМЖ, положительного на рецептор эпидермального фактора роста 2-го типа (англ. human epidermal growth factor receptor 2, HER2+), оценивали эффективность и безопасность комбинированной неоадъювантной терапии в режиме «доцетаксел / карбоплатин / трастузумаб + пертузумаб» (TCHP1) в сочетании с первичной профилактикой ФН эмпэгфилграстимом. На данный момент доступны промежуточные результаты исследования, которые показывают превосходство эмпэгфилграстима над филграстимом в общей популяции включенных больных, а также в подгруппе HER2 (3+).
Учитывая наблюдаемые эффекты от реализуемого федерального проекта «Борьба с онкологическими заболеваниями», а именно увеличение доли ЗНО, выявленных на ранних стадиях [15], лечение которых направлено на достижение периода без возврата болезни на долгие годы или излечение, вопрос объема бюджета на профилактику ФН с использованием Г-КСФ является актуальным.
Цель – провести анализ влияния на бюджет применения лекарственного препарата эмпэгфилграстим для первичной профилактики ФН у пациенток, получающих неоадъювантную терапию по схеме TCHP при раннем и местно-распространненом HER2+ РМЖ, с учетом возможной последующей адъювантной терапии трастузумаб эмтанзином или трастузумабом в условиях Российской Федерации.
МАТЕРИАЛ И МЕТОДЫ / MATERIAL AND METHODS
Моделирование / Modeling
Анализ проводили путем моделирования, для этого в Office Excel (Microsoft, США) была построена фармакоэкономическая модель. Учитывая особенности клинической ситуации (однонаправленный переход состояний и отсутствие необходимости учета времени нахождения в каждом из состояний) и цели исследования, оптимальным дизайном модели посчитали дерево решений (рис. 1).
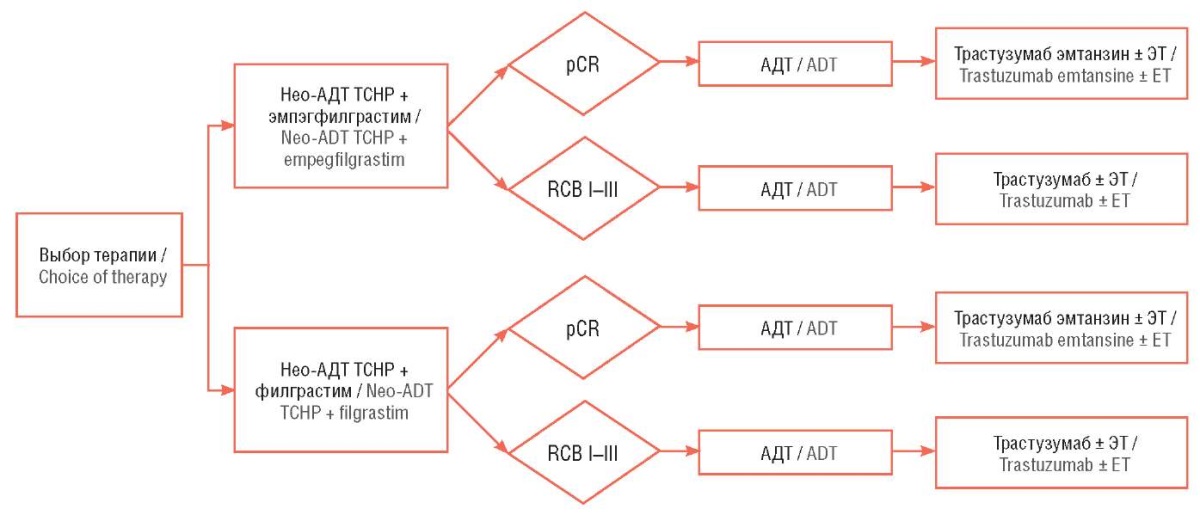
Рисунок 1. Модель дерева решений.
Нео-АДТ TCHP – неоадъювантная терапия
в режиме «доцетаксел / карбоплатин / трастузумаб + пертузумаб»;
pCR (англ. pathomorphological complete response) –
полный патоморфологический ответ;
RCB (англ. residual tumor burden) – остаточная опухолевая нагрузка;
АДТ – адъювантная терапия;
ЭТ – эндокринная терапия
Figure 1. Decision tree model.
Neo-ADT TCHP – neoadjuvant therapy
in “docetaxel / carboplatinum / trastuzumab + pertuzumab” regimen;
pCR – pathomorphological complete response;
RCB – residual tumor burden;
ADT – adjuvant therapy;
ET – endocrine therapy
Рассматриваемый сценарий учитывал клинические рекомендации и общемировые стандарты терапии [16]. Горизонт анализа соответствовал средней длительности проведения всех этапов лечения около 6 циклов неоадъювантной и до 14 циклов адъювантной терапии около 60 нед.
В соответствии с действующими рекомендациями по проведению анализа влияния на бюджет [17] дисконтирование затрат не проводили, т.к. горизонт моделирования составлял 1 год.
Характеристика популяции / Population characteristics
В качестве целевой группы выступили больные ранним и местно-распространенным HER2+ РМЖ, получавшие высокотоксичную химиотерапию по схеме ТСНР, которым, согласно клиническим рекомендациям Минздрава России, требуется профилактика Г-КСФ, что соответствовало критериям участников исследования DEFENDOR SPECIAL [18][19].
В связи с тем, что расчет вводимых доз лекарственных препаратов в рассматриваемых схемах осуществляется на основании антропометрических данных, было принято, что средняя масса тела пациентки составляет 73,2 кг [20], а площадь поверхности тела – 1,71 м² [21] на основе средних описательных статистик.
При расчете численности популяции исходили из наиболее актуальных данных российских статистических наблюдений, которые показали, что в 2022 г. было выявлено 75 789 больных РМЖ, из которых 61,5% – II–III стадии. Учитывая среднюю распространенность подтипа HER2+ среди больных РМЖ 25%, число пациенток в рассматриваемой клинической ситуации составило 11 653 человека (табл. 1).
Таблица 1. Расчет численности целевой популяции
Table 1. Calculation of target population size
|
Параметр / Parameter |
Значение / Value |
Источник / Reference |
|
Зарегистрировано ЗНО*, n / Registered malignant cases*, n |
75 789 |
[22] |
|
Стадии II–III, % / Stages II-III, % |
61,5 |
[22] |
|
HER2+ РМЖ, % / HER2+ breast cancer, % |
25 |
[23][24] |
|
Численность целевой популяции, n / Target population size, n |
11 653 |
– |
Примечание. ЗНО – злокачественные новообразования;
РМЖ – рак молочной железы;
HER2 (англ. human epidermal growth factor receptor 2) –
рецептор эпидермального фактора роста 2-го типа.
* Без учтенных посмертно.
Note. HER2 – human epidermal growth factor receptor type 2.
* Without postmortem cases.
Анализ эффективности / Effectiveness analysis
Рандомизированные клинические исследования, сравнивающие один и тот же режим лечения, применяемый до или после операции, показали, что полный патоморфологический ответ (англ. pathomorphological complete response, pCR) может предсказать долгосрочный исход у отдельных пациенток с диагнозом РМЖ на ранней стадии, получавших предоперационную системную терапию, в частности при HER2+ подтипах [25–28].
В наблюдательном исследовании DEFENDOR SPECIAL достижение рCR, которое отражает наличие резидуальной опухоли и, согласно российским и мировым клиническим рекомендациям, используется при принятии решения о назначении адъювантной терапии, является одной из конечных вторичных точек.
На момент среза данных (январь 2023 г.) 199 пациенток с диагнозом HER2+ РМЖ II–III стадий завершили плановую неоадъювантную терапию и последующее оперативное лечение (71 пациентка в группе «TCHP + эмпэгфилграстим» (TCHP + Э); 128 пациенток в группе «TCHP + филграстим» (TCHP + Ф)). В группе TCHP + Э частота достижения pCR превысила данные рандомизированного исследования KRISTINE по применению неоадъювантного режима TCHP (исторический контроль), несмотря на популяцию, обогащенную пациентками негативного прогноза (34% со стадиями IIIB–IIIC по сравнению с 17% в исследовании KRISTINE), в то время как схема TCHP + Ф показала сопоставимые результаты с историческим контролем. Более высокая частота достижения pCR при первичной профилактике ФН с эмпэгфилграстимом также наблюдалась независимо от уровня экспрессии HER2. Однако в подгруппе HER2 (2+/ISH+2) показатели частоты достижения pCR были значимо ниже в целом, возможно, отражая сопоставимые по силе другие молекулярные процессы онкогенеза в опухоли (табл. 2). Для расчетов использовали результаты смешанной подгруппы – популяции всех пациенток, включенных в исследование (англ. intention to treat, ITT).
Таблица 2. Частота достижения полного патоморфологического ответа
(англ. pathomorphological complete response, pCR)
в зависимости от статуса рецептора эпидермального фактора роста 2-го типа
(англ. human epidermal growth factor receptor 2, HER2)
в опухоли в двух группах терапии препаратами
класса гранулоцитарных колониестимулирующих факторов [18]
Table 2. Rate of pathomorphological complete response (pCR)
depending on the status of human epidermal growth factor receptor type 2 (HER2)
in the tumor in two groups of therapy
with granulocyte colony-stimulating factor class drugs [18]
|
Параметр / Parameter |
pCR (ypT0/is, N0), % |
|
|
TCHP + Э / TCHP + E |
TCHP + Ф / TCHP + F |
|
|
HER2 (3+) |
79 |
64 |
|
HER (2+ ISH+) |
22 |
16 |
|
ITT |
72 |
52 |
Примечание.
TCHP – режим «доцетаксел / карбоплатин / трастузумаб + пертузумаб»;
Э – эмпэгфилграстим; Ф – филграстим;
ITT (англ. intention to treat) – согласно назначенному лечению
(популяция всех пациенток, включенных в исследование).
Note.
TCHP – “docetaxel / carboplatin / trastuzumab + pertuzumab” regimen;
E – empegfilgrastim; F – filgrastim;
ITT – intention to treat (population of all patients included in the study).
Анализ затрат / Cost analysis
Принимая во внимание, что исследование проводили с позиции системы здравоохранения (бюджета на лекарственное обеспечение), учитывали затраты только на лекарственные препараты. При этом использовали зарегистрированные предельные отпускные цены с учетом налога на добавленную стоимость и без учета оптовой надбавки (табл. 3) [29]. В базовом варианте применяли средние значения, рассчитанные на 1 ЕД препарата.
Таблица 3. Предельные зарегистрированные цены
на лекарственные препараты (без надбавок), руб. [29]
Table 3. Maximum registered prices for drugs (without surcharges), rub. [29]
|
МНН / INN |
Среднее / Mean |
Минимум / Min |
Максимум / Max |
|
Эмпэгфилграстим / Empegfilgrastim |
37 763,00 |
37 763,00 |
37 763,00 |
|
Филграстим / Filgrastim |
2026,65 |
208,63 |
4172,58 |
|
Трастузумаб / Trastuzumab |
17 561,76 |
3479,50 |
23 723,85 |
|
Трастузумаб эмтанзин / Trastuzumab emtansine |
169 167,01 |
169 161,01 |
169 173,01 |
|
Доцетаксел / Docetaxel |
2468,73 |
706,75 |
5640,02 |
|
Карбоплатин / Carboplatin |
1700,49 |
922,06 |
2755,80 |
|
Пертузумаб / Pertuzumab |
147 831,58 |
147 831,58 |
147 831,58 |
Примечание. МНН – международное непатентованное наименование.
Note. INN – international nonproprietary name.
Режимы приема препаратов соответствовали российским клиническим рекомендациям [19]:
– доцетаксел 75 мг/м² внутривенно (в/в) в 1-й день 1 раз в 3 нед + карбоплатин AUC-6 в/в в 1-й день 1 раз в 3 нед + трастузумаб 6 мг/кг (нагрузочная доза 8 мг/кг) в/в в 1-й день 1 раз в 3 нед + пертузумаб 420 мг (нагрузочная доза 840 мг) в/в в 1-й день 1 раз в 3 нед, 6 циклов; общая длительность введения трастузумаба и пертузумаба составляет 12 мес;
– филграстим 5 мкг/кг подкожно (п/к) через 24–72 ч после окончания введения химиопрепаратов и до восстановления нормального числа нейтрофилов после надира;
– или эмпэгфилграстим в дозе 7,5 мг п/к, однократно, не менее чем через 24 ч после окончания введения химиопрепаратов;
– трастузумаб эмтанзин 3,6 мг/кг в/в в 1-й день 1 раз в 3 нед, до 14 циклов.
Учитывая, что количество инъекций филграстима может варьироваться, для базового сценария использовали средние значения, согласно экспертной оценке – 5 инъекций. Для инъекционных лекарственных препаратов проводили округление расходуемых объемов до одной лекарственной формы выпуска.
Анализ влияния на бюджет / Budget impact analysis
В анализе влияния на бюджет (АВБ) рассматривали ситуацию, при которой все больные получали эмпэгфилграстим вместо филграстима, т.е. осуществляли определение экономических последствий (снижение/увеличение затрат) при назначении указанной схемы вместо альтернативной.
В общем виде математический аппарат может быть выражен формулой:
АВБ = S1 – S2,
где S1 – затраты на терапию сравнения (руб.); S2 – затраты на исследуемую терапию (руб.).
Положительное значение показателя АВБ (>0) демонстрирует дополнительные затраты со стороны бюджета здравоохранения, отрицательное (<0) – экономию.
РЕЗУЛЬТАТЫ / RESULTS
Анализ затрат / Cost analysis
Результаты моделирования затрат на 1 пациентку за 1 год терапии показали, что на лекарственные препараты для неоадъювантной терапии будет затрачено 2,3 млн руб. вне зависимости от того, профилактика ФН каким классом Г-КСФ была выбрана. При этом, несмотря на более высокие затраты на профилактику эмпэгфилграстимом по сравнению с филграстимом (249 против 134 тыс. руб.), за счет более высокой частоты достижения pCR и, соответственно, меньшего числа случаев, требующих адъювантной терапии более дорогостоящим трастузумаб эмтанзином, возможна экономия 916 тыс. руб. на 1 пациентку за 1 год терапии (табл. 4).
Таблица 4. Расчет затрат на 1 пациентку за 1 год терапии, руб.
Table 4. Calculation of costs per 1 patient for 1 year of therapy, rub.
|
Затраты / Costs |
Филграстим / Filgrastim |
Эмпэгфилграстим / Empegfilgrastim |
Разница* / Difference* |
|
Неоадъювантная терапия / Neoadjuvant therapy |
2 303 528 |
2 303 528 |
0 |
|
Г-КСФ / G-CSF |
133 759 |
249 236 |
+115 477 |
|
Адъювантная терапия / Adjuvant therapy |
2 475 955 |
1 444 307 |
–1 031 648 |
|
Итого / Total |
4 913 242 |
3 997 071 |
–916 171 |
Примечание. Г-КСФ – гранулоцитарный колониестимулирующий фактор.
* Со знаком (–) – экономия расходов, со знаком (+) – увеличение расходов.
Note. G-CSF – granulocyte colony-stimulating factor.
* Sign (–) means cost savings, sign (+) means cost increase.
Анализ влияния на бюджет / Budget impact analysis
Проведенный АВБ показал, что обеспечение 11 653 больных лекарственными препаратами для неоадъювантной терапии с профилактикой ФН эмпэгфилграстимом вместо филграстима и возможной последующей адъювантной терапией позволяет снизить затраты на 10,7 млрд руб. (с 57,3 до 46,6 млрд руб.) за 1 год терапии (рис. 2).
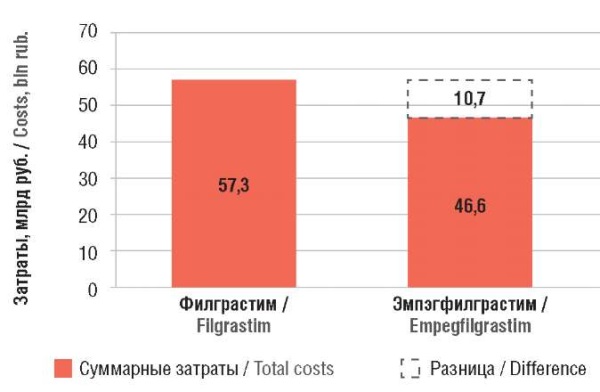
Рисунок 2. Результаты анализа влияния на бюджет
(суммарные затраты на лекарственную терапию)
Figure 2. Results of budget impact analysis (total costs of drug therapy)
ОБСУЖДЕНИЕ / DISCUSSION
В контексте лечения РМЖ профилактика ФН играет одну из центральных ролей в достижении качества и полноты проведения химиотерапии. Применение Г-КСФ как средства превенции критического угнетения миелоидного ростка кроветворения направлено на обеспечение ряда аспектов успешности противоопухолевой терапии.
Так, адекватная химиотерапия РМЖ зачастую включает высокотоксичные препараты, что, в свою очередь, увеличивает риск развития осложнений (в т.ч. нейтропений), которые существенно ограничивают возможности химиотерапевта по поддержанию дозоинтенсивности: тактика лечения корректируется в сторону либо уменьшения количества вводимых лекарственных препаратов, либо отсрочки начала следующей итерации химиотерапии до восстановления организма пациентки. По данным крупного метаанализа, адекватная нагрузка химиотерапевтическими опциями при РМЖ сопряжена со снижением риска не только рецидива, но и смерти пациенток [30][31]. С этой точки зрения Г-КСФ, позволяющие пациенткам получить требуемый объем лечения с сохранением как дозы, так и состава и количества циклов, можно рассматривать как один из позитивных предикторов, влияющих на общий исход лечения и выживаемость. Также следует отметить, что увеличение частоты патоморфологического ответа и снижение риска рецидива опухоли, в свою очередь, снижают потребность в назначении адъювантной терапии. Это было продемонстрировано в исследовании DEFENDOR SPECIAL в отношении пролонгированных форм Г-КСФ, применение которых позволило не только снизить терапевтическую нагрузку на организм пациенток, но и обеспечить существенную финансовую экономию.
Помимо риска снижения дозоинтенсивности и негативных последствий вынужденной коррекции тактики лечения, ФН увеличивает риск развития тяжелых инфекций, что особенно опасно для пациенток с ослабленной иммунной системой и может привести к летальным исходам. В данном случае важен не только клинический аспект – увеличивается нагрузка на стационар за счет госпитализации и интенсивной терапии пациенток с инфекционными осложнениями химиотерапии. Профилактика с помощью Г-КСФ значительно уменьшает этот риск, не только сохраняя выживаемость больных, но и уменьшая нагрузку на госпитальное звено онкологической службы [32]. Снижение частоты осложнений и сокращение необходимости длительной госпитализации для лечения инфекций на фоне ФН помогает оптимизировать медицинские ресурсы. Со временем стоимость курса пролонгированных Г-КСФ будет снижаться из-за выхода биоаналогов, что приведет к значительному росту инкрементального показателя «затраты–эффективность» [33][34]. Данные российской реальной клинической практики показывают, что внедрение Г-КСФ в рутинную профилактику угнетения миелоидного ростка кроветворения позволяет экономить бюджет медицинских организаций, повышая доступность и качество онкологической помощи прикрепленному населению [32].
Одним из факторов негативных последствий применяемой химиотерапии является возраст пациенток. Так, инволютивные процессы в стареющем организме представляют собой грозный фактор не только нарушений в миелоидном ростке, но и снижения общей резистентности организма к высокотоксичным схемам химиотерапии, что требует отдельного подхода к ведению таких больных [35][36]. В частности, считается, что возраст является самостоятельной причиной для назначения Г-КСФ [37]. В исследовании DEFENDOR SPECIAL у пациенток старшей возрастной группы не выявлено значимых в клиническом плане отличий по переносимости и эффективности Г-КСФ по сравнению с более молодой популяцией, что может свидетельствовать о сохранении не только клинической, но и экономической эффективности данного класса препаратов в пожилом и старческом возрасте.
Несмотря на идентичные точки приложения и структурное сходство между непегилированными и пегилированными Г-КСФ, имеются отличия с точки зрения клинико-экономической эффективности. Так, при профилактике филграстимом требуются ежедневные инъекции до восстановления уровня нейтрофилов, в отличие от пролонгированных форм, которые обычно вводятся один раз за цикл химиотерапии. Это значительно упрощает схему лечения для пациенток и снижает общий дискомфорт. Профилактика с использованием пролонгированных Г-КСФ ожидаемо облегчит проведение терапии, т.к., по данным реальной клинической практики, короткие Г-КСФ дозируются недостаточно (не в соответствии с инструкциями по медицинскому применению) [38][39].
Ограничения исследования / Study limitations
В настоящем фармакоэкономическом исследовании дана сравнительная оценка экономической эффективности двух Г-КСФ, показавшая превосходство пролонгированных форм, однако на момент проведения анализа доступны только промежуточные результаты наблюдательного исследования DEFENDOR SPECIAL, где сопоставление эффективности и безопасности эмпэгфилграстима проводится с исторической группой, получавшей филграстим. Поэтому на данный момент невозможно оценить статистическую значимость демонстрируемой разницы в эффективности и безопасности рассматриваемых схем, что явилось определенным ограничением исследования.
ЗАКЛЮЧЕНИЕ / CONCLUSION
На момент проведения АВБ доступны только промежуточные результаты наблюдательного исследования DEFENDOR SPECIAL, в котором изучается влияние первичной профилактики ФН эмпэгфилграстимом на достижение клинически значимых результатов терапии РМЖ.
Учитывая отмеченные выше допущения, в результате АВБ установлено, что проведение неоадъювантной терапии в режиме TCHP на фоне первичной профилактики ФН эмпэгфилграстимом позволяет чаще достигать pCR (ypT0/is, ypN0), что предотвращает необходимость адъювантной терапии трастузумаб эмтанзином и в итоге потенциально приводит к экономии бюджета на терапию пациенток с ранним и местно-распространенным HER2+ РМЖ за 1 год в размере 10,7 млрд руб., несмотря на изначально более высокие затраты на Г-КСФ.
1. Англ. расшифровка TCHP по первым буквам препаратов: docetaxel (Taxotere®) / carboplatin / trastuzumab (Herceptin®) + pertuzumab (Perjeta®). В тексте не указываются торговое наименования, т.к. для расчета были использованы средние цены.
2. ISH (англ. in situ hybridization) – гибридизация in situ.
Список литературы
1. U.S. Department of Health and Human Services, Food and Drug Administration, Oncology Center of Excellence, Center for Drug Evaluation and Research (CDER), Center for Biologics Evaluation and Research (CBER). Pathological complete response in neoadjuvant treatment of high-risk early-stage breast cancer: use as an endpoint to support accelerated approval guidance for industry. 2020. URL: https://www.fda.gov/media/83507/download#:~:text=Pathologic (дата обращения 02.11.2023).
2. Mayordomo J.I., López A., Viñolas N., et al. Retrospective cost analysis of management of febrile neutropenia in cancer patients in Spain. Curr Med Res Opin. 2009; 25 (10): 2533–42. https://doi.org/10.1185/03007990903209563.
3. Aapro M.S., Bohlius J., Cameron D.A., et al. 2010 update of EORTC guidelines for the use of granulocyte-colony stimulating factor to reduce the incidence of chemotherapy-induced febrile neutropenia in adult patients with lymphoproliferative disorders and solid tumours. Eur J Cancer. 2011; 47 (1): 8–32. https://doi.org/10.1016/j.ejca.2010.10.013.
4. Smith T.J., Khatcheressian J., Lyman G.H., et al. 2006 update of recommendations for the use of white blood cell growth factors: an evidence-based clinical practice guideline. J Clin Oncol. 2006; 24 (19): 3187–205. https://doi.org/10.1200/JCO.2006.06.4451.
5. Lyman G.H., Eckert L., Wang Y., et al. Venous thromboembolism risk in patients with cancer receiving chemotherapy: a real-world analysis. Oncologist. 2013; 18 (12): 1321–9. https://doi.org/10.1634/theoncologist.2013-0226.
6. Denduluri N., Lyman G.H., Wang Y., et al. Chemotherapy dose intensity and overall survival among patients with advanced breast or ovarian cancer. Clin Breast Cancer. 2018; 18 (5): 380–6. https://doi.org/10.1016/j.clbc.2018.02.003.
7. Green M.D., Koelbl H., Baselga J., et al. A randomized double-blind multicenter phase III study of fixed-dose single-administration pegfilgrastim versus daily filgrastim in patients receiving myelosuppressive chemotherapy. Ann Oncol. 2003; 14 (1): 29–35. https://doi.org/10.1093/annonc/mdg019.
8. Holmes F.A., O'Shaughnessy J.A., Vukelja S., et al. Blinded, randomized, multicenter study to evaluate single administration pegfilgrastim once per cycle versus daily filgrastim as an adjunct to chemotherapy in patients with high-risk stage II or stage III/IV breast cancer. J Clin Oncol. 2002; 20 (3): 727–31. https://doi.org/10.1200/JCO.2002.20.3.727.
9. Кононенко И.Б., Снеговой А.В., Гребенникова О.П. и др. Роль пролонгированных гранулоцитарных колониестимулирующих факторов в профилактике фебрильной нейтропении у пациентов, получающих двухнедельные режимы химиотерапии. Современная онкология. 2020; 22 (3): 133–41. https://doi.org/10.26442/18151434.2020.3.200279.
10. Mitchell S., Li X., Woods M., et al. Comparative effectiveness of granulocyte colony-stimulating factors to prevent febrile neutropenia and related complications in cancer patients in clinical practice: a systematic review. J Oncol Pharm Pract. 2016; 22 (5): 702–16. https://doi.org/10.1177/1078155215625459.
11. Cornes P., Gascon P., Chan S., et al. Systematic review and metaanalysis of short- versus long-acting granulocyte colony-stimulating factors for reduction of chemotherapy-induced febrile neutropenia. Adv Ther. 2018; 35 (11): 1816–29. https://doi.org/10.1007/s12325-018-0798-6.
12. Инструкция по медицинскому применению лекарственного препарата Экстимия® (эмпэгфилграстим). URL: https://grls.rosminzdrav.ru/Grls_View_v2.aspx?routingGuid=7c6855ba-f8b2-4e37-bc14-06a45435d948 (дата обращения 02.11.2023).
13. Криворотько П.В., Бурдаева О.Н., Нечаева М.Н. и др. Эффективность и безопасность препарата Экстимия® (эмпэгфилграстим) у пациентов с диагнозом «рак молочной железы», получающих миелосупрессивную химиотерапию: результаты двойного слепого сравнительного клинического исследования III фазы. Современная онкология. 2015; 17 (2): 45–52.
14. Snegovoy A., Dergunov A., Tatyanenko A., et al. Defendor: Realworld evidence of primary prolonged G-CSF prophylaxis by empegfilgrastim for relative dose intensity compliance in patients with solid tumors – the primary analysis. J Clin Oncol. 2022; 40 (16 Suppl.): e18788. https://doi.org/10.1200/JCO.2022.40.16_suppl.e18788.
15. Министерство здравоохранения Российской Федерации. Федеральный проект «Борьба с онкологическими заболеваниями». URL: https://minzdrav.gov.ru/poleznye-resursy/natsproektzdravoohranenie/onko (дата обращения 02.11.2023).
16. Gradishar W.J., Moran M.S., Abraham J., et al. NCCN Guidelines® Insights: Breast Cancer, Version 4.2023. J Natl Compr Canc Netw. 2023; 21 (6): 594–608. https://doi.org/10.6004/jnccn.2023.0031.
17. Sullivan S.D., Mauskopf J.A., Augustovski F., et al. Budget impact analysis-principles of good practice: report of the ISPOR 2012 Budget Impact Analysis Good Practice II Task Force. Value Health. 2014; 17 (1): 5–14. https://doi.org/10.1016/j.jval.2013.08.2291.
18. Zhukova L., Ibragimova T., Ganshina I., et al. Defendor special: interim analysis of TCHP with primary empegfilgrastim prophylaxis (long-acting G-CSF) for treatment outcomes in early HER2+ breast cancer. J Clin Oncol. 2023; 41 (16 Suppl.): e12586. https://doi.org/10.1200/JCO.2023.41.16_suppl.e12586.
19. Рубрикатор клинических рекомендаций. Рак молочной железы. 2021. URL: https://cr.minzdrav.gov.ru/schema/379_4 (дата обращения 02.11.2023).
20. Рудакова А.В., Толкачева Д.Г., Гаврилова О.Н., Ваганов А.С. Эффективность затрат на эмпэгфилграстим (Экстимия®) при профилактике тяжелой нейтропении у пациенток со злокачественными новообразованиями молочной железы. Современная онкология. 2016; 8 (2): 48–51.
21. Sacco J.J., Botten J., Macbeth F., et al. The average body surface area of adult cancer patients in the UK: a multicentre retrospective study. PLoS One. 2010; 5 (1): e8933. https://doi.org/10.1371/journal.pone.0008933.
22. Каприн А., Старинский В.В., Шахзадова А.О. (ред.) Состояние онкологической помощи населению России в 2021 году. М.: МНИОИ им. П.А. Герцена – филиал ФГБУ «НМИЦ радиологии» Минздрава России; 2022: 239 с.
23. Naoum V., Antonaki M., Kakouros M., et al. Cost-effectiveness analysis of trastuzumab emtansine for the adjuvant treatment of patients with residual invasive HER2+ early breast cancer in Greece. URL: https://www.ispor.org/docs/default-source/euro2022/isporeu22ouzounelli-pdf.pdf?sfvrsn=b7acbb4_0 (дата обращения 02.11.2023).
24. Li S., Wu J., Huang O., et al. HER2 positivity is not associated with adverse prognosis in high-risk estrogen receptor-positive early breast cancer patients treated with chemotherapy and trastuzumab. Breast. 2020; 54: 235–41. https://doi.org/10.1016/j.breast.2020.10.002.
25. Cortazar P., Zhang L., Untch M., et al. Meta-analysis results from the collaborative trials in neoadjuvant breast cancer (CTNeoBC). Cancer Res. 2012; 72 (24 Suppl.): S1–11. https://doi.org/10.1158/0008-5472.SABCS12-S1-11.
26. Bear H., Anderson S., Smith R.E., et al. Sequential preoperative or postoperative docetaxel added to preoperative doxorubicin plus cyclophosphamide for operable breast cancer: National Surgical Adjuvant Breast and Bowel Project Protocol B-27. J Clin Oncol. 2006; 24 (13): 2019–27. https://doi.org/10.1200/JCO.2005.04.1665.
27. Mieog J.S., van der Hage J.A., van de Velde C.J. Preoperative chemotherapy for women with operable breast cancer. Cochrane Database Syst Rev. 2007; 2007 (2): CD005002. https://doi.org/10.1002/14651858.CD005002.pub2.
28. Rastogi P., Anderson S.J., Bear H.D., et al. Preoperative chemotherapy: updates of National Surgical Adjuvant Breast and Bowel Project Protocols B-18 and B-27. J Clin Oncol. 2008; 26 (5): 778–85. https://doi.org/10.1200/JCO.2007.15.0235.
29. Государственный реестр предельных отпускных цен. URL: https://grls.rosminzdrav.ru/pricelims.aspx (дата обращения 02.11.2023).
30. You Z., Zhang H., Huang Y., et al. Assessing the optimal regimen: a systematic review and network meta-analysis of the efficacy and safety of long-acting granulocyte colony-stimulating factors in patients with breast cancer. Cancers. 2023; 15 (14): 3675. https://doi.org/10.3390/cancers15143675.
31. Early Breast Cancer Trialists' Collaborative Group (EBCTCG). Increasing the dose intensity of chemotherapy by more frequent administration or sequential scheduling: a patient-level meta-analysis of 37 298 women with early breast cancer in 26 randomised trials. Lancet. 2019; 393 (10179): 1440–52. https://doi.org/10.1016/S0140-6736(18)33137-4.
32. Громова Г.А. Реальная клиническая практика профилактики и лечения нейтропении. Как повысить качество онкологической помощи и сэкономить? Опухоли женской репродуктивной системы. 2023; 19 (2): 69–81. https://doi.org/10.17650/1994-4098-2023-19-2-69-81.
33. MacDonald K., McBride A., Alrawashdh N., Abraham I. Costefficiency and expanded access of prophylaxis for chemotherapyinduced (febrile) neutropenia: economic simulation analysis for the US of conversion from reference pegfilgrastim to biosimilar pegfilgrastimcbqv. J Med Econ. 2020; 23 (12): 1466–76. https://doi.org/10.1080/13696998.2020.1833339.
34. Cornes P., Kelton J., Liu R., et al. Real-world cost-effectiveness of primary prophylaxis with G-CSF biosimilars in patients at intermediate/high risk of febrile neutropenia. Future Oncol. 2022; Mar 31. https://doi.org/10.2217/fon-2022-0095.
35. Ашоур А.З., Литовкин А.В., Белов В.Г. и др. Анализ медикосоциальных потребностей онкологических пациентов старшей возрастной группы при оказании паллиативной помощи. Современные проблемы науки и образования. 2015; 5: 335.
36. Литовкин А.В., Парфенов Ю.А., Парфенов С.А., Сапожников К.В. Формы оказания паллиативной помощи лицам старшей возрастной группы с онкологией. Современные проблемы науки и образования. 2017; 4: 58.
37. Klastersky J.A., Dal Lago L., Lalami Y. Use of granulocyte-colony stimulating factors in older patients: a review of recently published data. Curr Opin Oncol. 2020; 32 (4): 258–61. https://doi.org/10.1097/CCO.0000000000000632.
38. Cornes P., Gascon P., Chan S., et al. Systematic review and metaanalysis of short- versus long-acting granulocyte colony-stimulating factors for reduction of chemotherapy-induced febrile neutropenia. Adv Ther. 2018; 35 (11): 1816–29. https://doi.org/10.1007/s12325-018-0798-6.
39. Сапожников К.В., Сорокина И.В., Гусев А.В. и др. Профилактика фебрильной нейтропении у онкологических пациентов: данные реальной клинической практики. Современная oнкология. 2023; 25 (1): 115–22. https://doi.org/10.26442/18151434.2023.1.202138.
Об авторах
М. В. ЖуравлеваРоссия
д.м.н., профессор кафедры клинической фармакологии и пропедевтики внутренних болезней; заместитель начальника научного отдела клинической фармакологии Института исследований и разработок
WoS ResearcherID: AAO-6689-2020; Scopus Author ID:
55878917900;
ул. Трубецкая, д. 8/2, Москва 119048, Россия
Петровский б-р, д. 8, стр. 2, Москва 127051, Россия
К. А. Кокушкин
Россия
научный руководитель
ул. Карбышева, д. 4, лит. А, Красногорск 143403, Россия
Е. А. Лучинин
Россия
преподаватель кафедры профпатологии, гематологии и клинической фармакологии
Scopus Author ID: 57220079650
ул. Большая Казачья, д. 112, Саратов 410012, Россия
Е. В. Лучинина
Россия
к.м.н., доцент кафедры профпатологии, гематологии и клинической фармакологии, начальник отдела контроля за обращением лекарственных средств и медицинских изделий клинического центра
WoS ResearcherID: AAD-4774-2021; Scopus Author ID: 57217133083
ул. Большая Казачья, д. 112, Саратов 410012, Россия
Т. Р. Каменева
Россия
к.м.н., доцент, ведущий специалист организационно-методического отдела по клинической фармакологии;, врач-клинический фармаколог
ул. Шарикоподшипниковская, д. 9, Москва 115088, Россия
Каштановая аллея, д. 2, стр. 1, Москва, Зеленоград 124489, Россия
Е. В. Кузнецова
Россия
заведующая организационно-методическим отделом по клинической фармакологии
ул. Шарикоподшипниковская, д. 9, Москва 115088, Россия
В. С. Крысанова
Россия
преподаватель кафедры терапии с курсом фармакологии и фармации Медицинского института непрерывного образования
WoS ResearcherID: AAE-2346-2019; Scopus Author ID: 57193874403
Волоколамское ш., д. 11, Москва 125080, Россия
Е. В. Макарова
Россия
к.м.н., научный сотрудник
Scopus Author ID: 57201075018
ул. Делегатская, д. 20, стр. 1, Москва 127473, Россия
Л. Г. Жукова
Россия
д.м.н., чл.-кор. РАН, заместитель директора по онкологии
Новогиреевская ул., д. 1, корп. 1, Москва 111123,
Россия
Рецензия
Для цитирования:
Журавлева М.В., Кокушкин К.А., Лучинин Е.А., Лучинина Е.В., Каменева Т.Р., Кузнецова Е.В., Крысанова В.С., Макарова Е.В., Жукова Л.Г. Фармакоэкономический анализ применения лекарственного препарата эмпэгфилграстим для лечения раннего и местно-распространенного HER2+ рака молочной железы в Российской Федерации. ФАРМАКОЭКОНОМИКА. Современная фармакоэкономика и фармакоэпидемиология. 2023;16(4):537-549. https://doi.org/10.17749/2070-4909/farmakoekonomika.2023.220
For citation:
Zhuravleva M.V., Kokushkin K.A., Luchinin E.A., Luchinina E.V., Kameneva T.R., Kuznetsova E.V., Krysanova V.S., Makarova E.V., Zhukova L.G. Pharmacoeconomic analysis of using empegfilgrastim for the treatment of early and locally advanced HER2+ breast cancer in the Russian Federation. FARMAKOEKONOMIKA. Modern Pharmacoeconomics and Pharmacoepidemiology. 2023;16(4):537-549. (In Russ.) https://doi.org/10.17749/2070-4909/farmakoekonomika.2023.220

Контент доступен под лицензией Creative Commons Attribution-NonCommercial-ShareAlike 4.0 International License.






































