Перейти к:
Хемореактомный скрининг цитотоксических эффектов аквакобаламина и гептаметилового эфира цианоаквакобириновой кислоты на опухолевые клетки с экспериментальными подтверждениями на линиях клеток ВТ-474 и А549
https://doi.org/10.17749/2070-4909/farmakoekonomika.2023.209
Аннотация
Актуальность. Поиск эффективной и безопасной фармакотерапии онкозаболеваний включает оценку влияния молекул-кандидатов на различные типы опухолевых клеток. Витамин В12 и его производные – перспективные биологически активные соединения, свойства которых могут регулироваться посредством модификации их химической структуры.
Цель: проведение хемореактомного скрининга in silico и экспериментального исследования цитотоксической активности in vitro аквакобаламина и гептаметилового эфира цианоаквакобириновой кислоты (ГЭЦАКК).
Материал и методы. Хемореактомный скрининг проводили на основании проблемно-ориентированной теории анализа изоморфизма хемографов, которая является расширением алгебраического подхода к задачам машинного обучения и распознавания. Использовали обучаемые алгоритмы вычисления химических расстояний между молекулами, на основе которых определяли значения констант полуингибирования (IC50). Скрининг выполнен для 470 культур опухолевых клеток человека, в т.ч. клеточных линий SNB19 (астроцитома), HCT116 (рак толстой кишки), HeLa (карцинома шейки матки), BT-474 (карцинома протока молочной железы), A549 (карцинома легкого). Гептаметиловый эфир дицианокобириновой кислоты ((CN)2Cby(OCH3)7) получали кипячением раствора витамина В12 в метаноле с серной кислотой (1,0 М) в течение 4 сут. ГЭЦАКК ((CN)(H2O)Cby(OCH3)7) получали путем вакуумной сушки водного раствора (CN)2Cby(OCH3)7 (pH 4,0 и 25 °С). Строение и чистота эфира подтверждены данными ядерного магнитного резонанса 1Н, элементным анализом, масс-спектроскопией MALDI-TоF (англ. matrix-assisted laser desorption/ionization time of flight). Экспериментальные исследования культур опухолевых клеток проводили посредством МТТ-теста с аквакобаламином и ГЭЦАКК на клеточных линиях иммортализированных (теломеризованных) фибробластов (Фб-hTERT), карциномы легкого (А549), рака протока молочной железы (ВТ-474).
Результаты. Хемореактомный скрининг эффектов молекул позволил получить оценки IC50 роста клеток для 470 линий опухолевых клеток. В зависимости от клеточной линии и молекулы производного витамина В12 значения IC50 изменялись в достаточно широком диапазоне – от 15 до 2000 нМ. Для 120 из 470 линий клеток (включая экспериментально исследованные линии A549, BT-474) противоопухолевая активность ГЭЦАКК была достоверно выше, чем для аквакобаламина. В исследованиях in vitro на культурах двух опухолевых клеточных линий человека (ВТ-474 и А549) и теломеризованных фибробластов Фб-hTERT подтверждено цитотоксическое действие аквакобаламина и его гидрофобного производного ГЭЦАКК. Показано, что аквакобаламин обладает слабыми цитотоксическими свойствами в диапазоне концентраций 3,125–200 мкг/л (IC50 > 200 нМ), а ГЭЦАКК заметно снижает выживаемость опухолевых линий клеток ВТ-474 и А549 при высоких концентрациях (100–200 мкг/л, IC50 порядка 100 нМ).
Заключение. Показано соответствие между результатами хемореактомного скрининга in silico и данными исследований клеточных культур in vitro: значения IC50 для ГЭЦАКК были существенно ниже, чем для аквакобаламина, а коэффициент пересчета с хемореактомных оценок на экспериментальные практически одинаков (2,64 для BT-474 и 2,63 для A549). Результаты хемореактомного скрининга для других опухолевых линий клеток могут быть использованы для планирования последующих клеточных экспериментов с производными витамина В12.
Ключевые слова
Для цитирования:
Торшин И.Ю., Филимонова М.В., Громова О.А., Майорова Л.А., Сорокина М.А., Фролова Д.Е., Громов А.Н., Рейер И.А. Хемореактомный скрининг цитотоксических эффектов аквакобаламина и гептаметилового эфира цианоаквакобириновой кислоты на опухолевые клетки с экспериментальными подтверждениями на линиях клеток ВТ-474 и А549. ФАРМАКОЭКОНОМИКА. Современная фармакоэкономика и фармакоэпидемиология. 2024;17(1):95-105. https://doi.org/10.17749/2070-4909/farmakoekonomika.2023.209
For citation:
Torshin I.Yu., Filimonova M.V., Gromova O.A., Maiorova L.A., Sorokina M.A., Frolova D.E., Gromov A.N., Reyer I.A. Chemoreactome screening of aquacobalamin and heptamethyl ester of cyanoaquacobyrinic acid cytotoxic effects on tumor cells with experimental confirmation on BT-474 and A549 cell. FARMAKOEKONOMIKA. Modern Pharmacoeconomics and Pharmacoepidemiology. 2024;17(1):95-105. (In Russ.) https://doi.org/10.17749/2070-4909/farmakoekonomika.2023.209
ВВЕДЕНИЕ / INTRODUCTION
Химиотерапия опухолей предполагает разработку и применение цитотоксических препаратов, таргетно нарушающих жизненный цикл опухолевых клеток (тормозящих деление или метастазирование, вызывающих апоптоз и т.д.). Очевидно, что искомые молекулы-кандидаты должны проявлять дифференцированное действие на опухолевые и нормальные клетки. Витамин В12 и его производные являются перспективными молекулами-кандидатами, свойства которых могут регулироваться посредством внесения химических модификаций [1].
Известно, что практически все витамины группы В проявляют противоопухолевые эффекты. Например, при сниженных уровнях витамина B12 в сыворотке крови у женщин в постменопаузе риск развития рака молочной железы достоверно повышается [2]. Витамин B12, тиамин, рибофлавин, фолаты играют защитную роль в отношении плоскоклеточного рака шейки матки [3]. Адъювантная терапия витаминами группы В за счет снижения гипергомоцистеинемии и уровней метилмалоната в крови уменьшает тяжелые токсические осложнения при проведении химиотерапии у пациентов с немелкоклеточным раком легкого препаратом пеметрексед [4].
Витамин В12 и его производные являются универсальными модуляторами активности протеома вследствие специфических коферментных и некоферментных взаимодействий с белками. Витамин В12 принципиально необходим для фолатного метаболизма и обезвреживания гомоцистеина, метилирования ДНК, биосинтеза нуклеотидов, профилактики анемических состояний. Нарушения фолатного метаболизма, обезвреживания гомоцистеина, метилирования ДНК, биосинтеза нуклеотидов, возникающие на фоне дефицита витамина В12, способствуют канцерогенезу [5].
Экспериментальные и клинические исследования подтвердили противоопухолевые эффекты витамина В12, связанные с его воздействием на организм в целом. У мышей с перевиваемой эпидермоидной карциномой легких Льюиса совместное введение витаминов В1, В6, В12 сопровождалось нарастающей тенденцией торможения роста опухоли на 10–20% (р=0,059) [6]. Систематический анализ доказательных исследований витаминов в противоопухолевой терапии [7] показал значимое снижение опухолевых рисков при более высоких уровнях витамина B12 в сыворотке крови (отношение рисков (ОР) 0,74; 95% доверительный интервал (ДИ) 0,56–0,98; р=0,04). Метаанализ 17 исследований (n=10601) продемонстрировал дозозависимую ассоциацию между диетарным потреблением витамина B12 и риском развития колоректального рака: прирост потребления витамина B12 на 4,5 мкг/сут соответствовал снижению риска заболевания на 4% (ОР 0,96; 95% ДИ 0,93–1,00; р<0,001) [8]. Результаты клинических исследований показывают, что взаимосвязь между низкой обеспеченностью витамином В12 и риском опухолевых заболеваний опосредуется такими факторами, как потребление красного мяса, алкоголя и дефицит других витаминов группы В [9]. Показана перспективность использования препаратов витамина В12 в качестве адъювантной терапии у пациентов с опухолевыми заболеваниями, проходящих химиотерапию [10].
Обилие возможных модификаций витамина В12 (цианокобаламина) [1] позволяет предположить, что некоторые его производ-
ные могут проявлять еще более выраженные противоопухолевые свойства, чем сам цианокобаламин. Фармакологические свойства молекулы цианокобаламина хорошо изучены, тогда как информация о фармакологии синтетических производных витамина В12 весьма ограниченна. Поэтому для оценки свойств перспективных синтетических производных витамина В12 и других корриноидов перспективно использовать информационную технологию хемо-
реактомного анализа – новейшего направления постгеномной фармакологии, подразумевающего оценку биологических активностей исследуемого соединения в контексте реактома (т.е. совокупности всех известных химических реакций данного организма).
В частности, методом хемореактомного анализа была проведена оценка более 3500 биологических свойств пяти корриновых производных – цианокобаламина, аквакобаламина, гептаметилового эфира цианоаквакобириновой кислоты (ГЭЦАКК), гептаметилового эфира дицианокобириновой кислоты и стабильного желтого корриноида. Показано, что аквакобаламин и гидрофобное производное витамина В12 ГЭЦАКК можно рекомендовать для дальнейшего изучения в качестве обезболивающих, противовоспалительных, а также противоопухолевых средств, направленных на терапию глиобластомы, гепатобластомы и Т-клеточной лейкемии [11].
Изучение цитотоксичности производных витамина В12 важно для отбора молекул-кандидатов с онкопротекторыми свойствами. Цитологический скрининг – необходимый шаг для отбора перспективных молекул и дальнейшего планирования эксперимента. Производные витамина В12 с цитологическими свойствами, направленными на определенные линии онкологических клеток, могут рассматриваться как перспективные «результативные» соединения для создания высокоэффективных лекарственных средств [12]. В экспериментах на животных установлено, что данное соединение обладает биологической активностью [12].
Органические, в т.ч. макроциклические, тетрапиррольные соединения, такие как коррины, корролы и порфирины, могут образовывать двумерные и трехмерные наноструктуры [13–17], а также наночастицы [18–20] с регулируемыми свойствами, что делает их актуальной группой веществ для изучения в качестве перспективных компонентов адресной доставки лекарств. Получены супермолекулярные наноструктуры производного витамина В12 – гептабутилового эфира цианоаквакобириновой кислоты (ГбЭЦАКК): уникальные наночастицы с сильными нековалентными межмолекулярными взаимодействиями, особыми свойствами и активностью [20]. Они были созданы как звено в цепи эволюции исходных молекул, когда при критической плотности ансамбли молекул выступают в роли нанореакторов, в которых происходит формирование наночастиц. Показано, что полученные наночастицы ГбЭЦАКК не только воспроизводят функциональные свойства комплексов витамина В12 с белками в живых организмах и действуют как витамин В12-зависимые ферменты, но и демонстрируют важные преимущества перед витамином В12. Они более эффективны в реакциях восстановления/выделения кислорода и превращениях в другие формы [20]. Подобные наночастицы могут стать альтернативой широко используемым в медицине препаратам (в частности, витамину В12). Представляет особый интерес их применение в терапевтических целях. В связи с этим актуальной является задача изучения токсичности производных витамина В12.
Онкопротекторные эффекты производных витамина В12 в цитологических экспериментах практически не изучены. Поэтому мы провели хемореактомный скрининг эффектов аквакобаламина и ГЭЦАКК на 470 культурах опухолевых клеток человека. Затем экспериментально изучили цитотоксические эффекты аквакобаламина и его производного ГЭЦАКК на клетки карциномы легких А549, проточного рака молочных желез ВТ-474 и иммортализированных фибробластов Фб-hTERT.
Цель – проведение хемореактомного скрининга in silico и экспериментального исследования цитотоксической активности in vitro аквакобаламина и ГЭЦАКК.
МАТЕРИАЛ И МЕТОДЫ / MATERIAL AND METHODS
Хемореактомный скрининг / Chemoreactome screening
Хемореактомный скрининг молекул аквакобаламина и ГЭЦАКК проведен в соответствии с методологией, описанной подробно в предыдущих работах [11][21–23]. На основе проблемно-ориентированной теории анализа изоморфизма хемографов, которая является расширением алгебраического подхода к задачам машинного обучения и распознаванию, были получены обучаемые алгоритмы вычисления химических расстояний между произвольными молекулами. В качестве базы данных для формирования обучающих и тестовых выборок молекул использован ресурс Sanger Institute (США), сформированный на основании геномных исследований чувствительности различных линий опухолевых клеток в культуре к лекарствам (в нем представлен полный список 470 типов клеток) [24].
Первым шагом собственно скрининга является установление списка молекул из базы данных молекул с известными свойствами, которые наиболее близки по структуре к оцениваемой молекуле (т.е. вычисление dχ). Второй шаг – извлечение из базы данных экспериментальной информации о молекулах, схожих с заданной. Третий шаг – оценка биологических активностей исследуемой молекулы (в т.ч. моделирование взаимодействия с протеомом), т.е. собственно хемореактомный анализ, заключающийся в вычислении эмпирических функций распределения оцениваемой величины (выживаемости клеток).
Представленные далее оценки значений биологических констант полуингибирования (англ. half-maximal inhibitory concentration, IC50) получены как математическое ожидание и дисперсия соответствующих эмпирических функций распределений [11]. На каждом этапе анализа проводили оценку переобучения получаемых алгоритмов посредством сравнения аккуратности оценок на обучающих и тестовых выборках данных.
Синтез гидрофобного производного витамина В12 / Synthesis of vitamin B12 hydrophobic derivative
В работе изучались аквакобаламин (рис. 1а) и гидрофобное производное витамина В12 гептаметиловый эфир дицианокобириновой кислоты (рис. 1b). Гептаметиловый эфир дицианокобириновой кислоты ((CN)2Cby(OCH3)7) получали кипячением раствора витамина В12 в метаноле с серной кислотой (1,0 М) в течение 4 сут. ГЭЦАКК ((CN)(H2O)Cby(OCH3)7) получали путем вакуумной сушки водного раствора (CN)2Cby(OCH3)7 (pH 4,0 и 25 °C). Строение и чистота эфира подтверждены данными ядерного магнитного резонанса (ЯМР) 1Н, элементным анализом, масс-спектроскопией MALDI-TоF (англ. matrix-assisted laser desorption/ionization time of flight).
a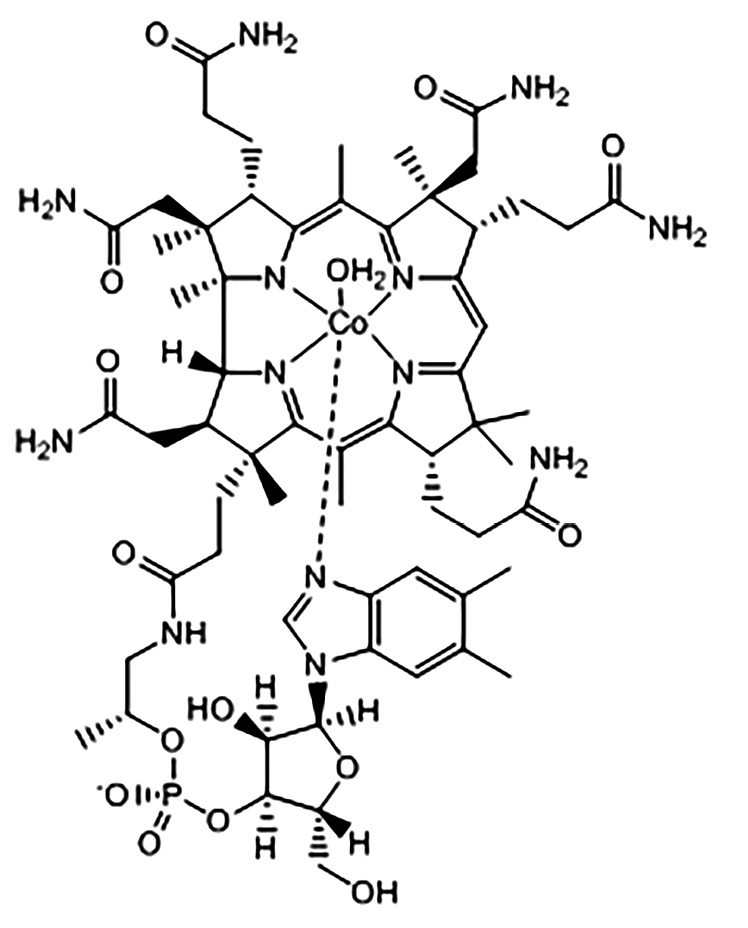
b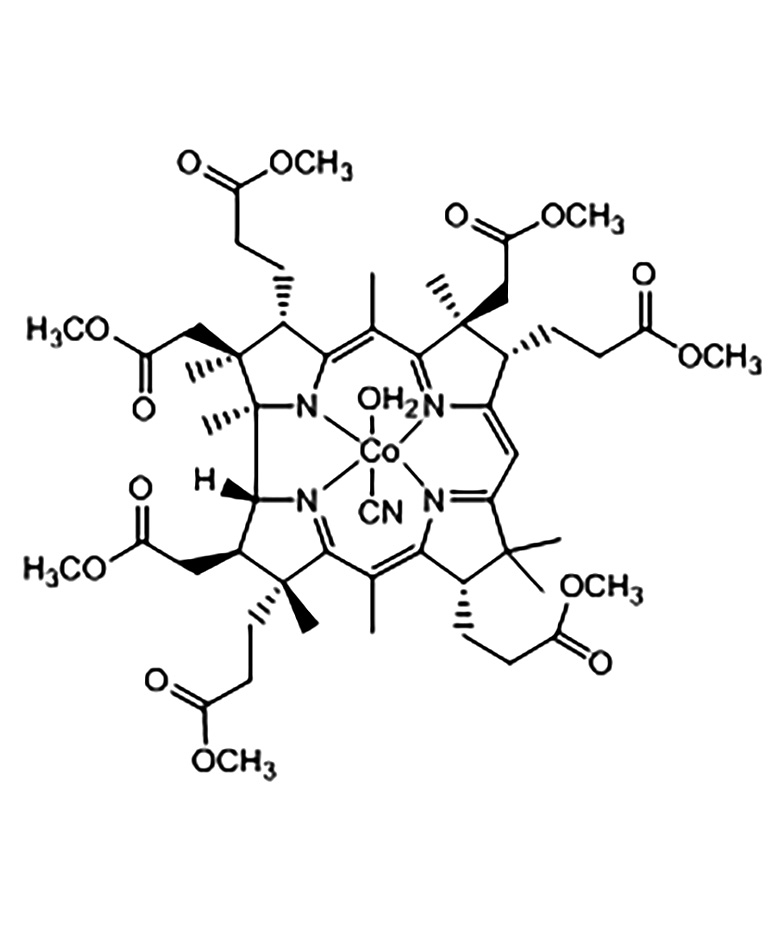
Рисунок 1. Структуры аквакобаламина (а) и гептаметилового эфира дицианокобириновой кислоты (синтез Д.С. Сальникова) (b)
Figure 1. Structures of aquacobalamin (a) and heptamethyl ester of dicyanocobyric acid (Salnikov synthesis) (b)
Исследования цитотоксичности / Cytotoxicity studies
Исследования цитотоксичности выполняли для двух производных витамина В12 (аквакобаламин и гидрофобное производное ГЭЦАКК) на культурах нормальных и опухолевых клеток: клеточные линии иммортализированых (теломеризованных) фибробластов (Фб-hTERT), карциномы легкого (А549), рака протока молочной железы (ВТ-474). Клеточные линии А549 и Фб-hTERT культивировали в питательной среде DMEM (англ. Dulbecco’s modified Eagle medium), содержащей 10% эмбриональной сыворотки крупного рогатого скота, пенициллин 50 ед/мл, стрептомицин 50 мкг/мл и L-глутамин 292 мкг/мл в CO2-инкубаторе при температуре 37 °C. Клеточную линию BT-474 культивировали в питательной среде RPMI (англ. Roswell Park Memorial Institute medium), содержащей 10% эмбриональной сыворотки крупного рогатого скота, пенициллин 50 ед/мл, стрептомицин 50 мкг/мл и L-глутамин 292 мкг/мл в CO2-инкубаторе при температуре 37 °C. Пересев всех клеточных линий проводили каждые 3–4 сут.
Для открепления клеток от субстрата из культурального флакона удаляли питательную среду и промывали клетки 1 мл 0,02% раствора Версена, затем добавляли 2 мл 0,02% раствора Версена и инкубировали в течение 1 мин при комнатной температуре, добавляли 630–660 мкл 0,25% раствора трипсина и инкубировали при 37 °C в течение 3 мин (в случае клеточных линий А549 и Фб-hTERT). В случае клеточной линии BT-474 добавляли только раствор Версена и инкубировали 40 мин при 37 °C. Убедившись, что клетки готовы открепиться, их переносили из монослоя в суспензию в полной питательной среде, осуществляли подсчет клеток с использованием камеры Горяева.
Для проведения МТТ-теста в лунки 96-луночных микротитрационных планшетов вносили 5000 клеток в 100 мкл культуральной среды. Лунка А1 использовалась в качестве бланка, в нее помещали 100 мкл культуральной среды без содержания клеток. Затем клетки культивировали в СО2-инкубаторе в стандартных условиях в течение 24 ч для адгезии клеток к субстрату.
Методом раститровки с добавлением полной питательной среды готовили серию разведений исходного препарата так, чтобы получить растворы с последовательно снижающейся в 2 раза концентрацией исследуемых веществ. Полученные растворы добавляли в лунки, содержащие культуру клеток в объеме 100 мкл. В контрольные лунки вносили 100 мкл полной питательной среды. После внесения исследуемых веществ клетки культивировали в СО2-инкубаторе в стандартных условиях в течение 72 ч.
Реактив МТТ растворяли в деионизированной воде (5 мг/мл), вносили по 20 мкл полученного раствора в каждую лунку планшета и инкубировали в СО2-инкубаторе в стандартных условиях в течение 4 ч.
По истечении времени инкубации культуральную среду с исследуемым препаратом с осторожностью, стараясь не задевать клетки, удаляли аспирацией с помощью автоматического дозатора и в каждую лунку планшета вносили по 100 мкл диметилсульфоксида, инкубировали 5–10 мин. Появившееся фиолетовое окрашивание детектировали на планшетном ридере при 492 нм (референтная длина волны 630 нм).
Статистический анализ / Statistical analysis
Статистический анализ результатов исследований клеточных культур in vitro проводили с помощью программного обеспечения Excel (Microsoft, США), Statistica 7.0 (StatSoft Inc., США), OriginPro-8 (OriginLab Corp., США). Рассчитывали процент жизнеспособных клеток в каждой опытной лунке относительно лунок положительного контроля, жизнеспособность которых принимали за 100%. Далее строили графики зависимости жизнеспособности клеток, выражаемые в процентах относительно десятичного логарифма концентраций добавленного препарата. Полученную кривую подвергали анализу Non-linear curve fit – Logistic в программном обеспечении OriginPro-8 и рассчитывали концентрацию, при которой наблюдалось полумаксимальное ингибирование роста клеток (IС50) сначала в исходных единицах измерения концентраций (мкг/л), затем в нмоль/л.
РЕЗУЛЬТАТЫ / RESULTS
Хемореактомный скрининг / Chemoreactome screening
Хемореактомный скрининг эффектов молекул на опухолевые клетки позволил получить оценки IC50 роста клеток для 470 линий опухолевых клеток. В зависимости от клеточной линии и молекулы производного витамина В12 значения IC50 изменялись в достаточно широком диапазоне – от 15 до 2000 нМ (рис. 2а). Напомним, что более низкие значения IC50 для данного вещества по сравнению с другими веществами соответствуют его более выраженной противоопухолевой активности для заданной линии клеток. Полный список клеточных линий представлен на ресурсе ChEMBL [24].
Очевидно, что исследованные молекулы по-разному воздействовали на различные линии опухолевых клеток. Приблизительно для 190 клеточных линий аквакобаламин был достоверно более активен, чем ГЭЦАКК (рис. 2b). Для 160 линий клеток активности обеих молекул были практически одинаковы, а для 120 линий противоопухолевая активность ГЭЦАКК была достоверно выше, чем для аквакобаламина. При этом клеточные линии A549, BT-474, экспериментально исследованные в настоящей работе, относились именно к последней категории (ГЭЦАКК более активен, чем аквакобаламин).
Анализ значений IC50, полученных в результате проведения хемореактомного скрининга для отдельных клеточных линий (рис. 2с), показывает, что аквакобаламин более эффективен для клеточных линий SNB19 (астроцитома), PC3 (метастатическая аденокарцинома простаты), HCT116 (рак толстой кишки), HeLa (карцинома шейки матки). Активность обеих молекул была практически одинаковой для лейкозов – МТ-4 (Т-лимфобластный лейкоз), CCRF-SB (В-лимфобластный лейкоз), C8166 (Т-лимфо-
бластный лейкоз), а также линий клеток HT-29 (колоректальная аденокарцинома), 2780 (опухоли яичников) и MDA-MB-435 (метастатический рак молочной железы). Активность ГЭЦАКК была выше для клеток неметастатического рака молочной железы – MCF-7 (рак молочной железы), BT-474 (карцинома протока молочной железы); эпителиальных патологий – SK-MEL-28 (злокачественная меланома), G361 (меланома кожи); линий HTB-4 (рак мочевого пузыря), A498 (рак почки), Hep-2 (карцинома гортани), A549 (рак легких).
Для клеточных линий BT-474 и A549, которые были экспериментально исследованы в рамках настоящей работы, значения IC50 для обеих молекул, полученные в результате хемореактомного скрининга, существенно отличались. В случае линии BT-474 (карцинома протока молочной железы) значение IC50 для аквакобаламина было в 1,3 раза выше, чем для ГЭЦАКК (350,2 и 270,4 нМ соответственно), а для линии A549 (рак легких) – в 2,7 раза выше (725,6 и 265,2 нМ соответственно).
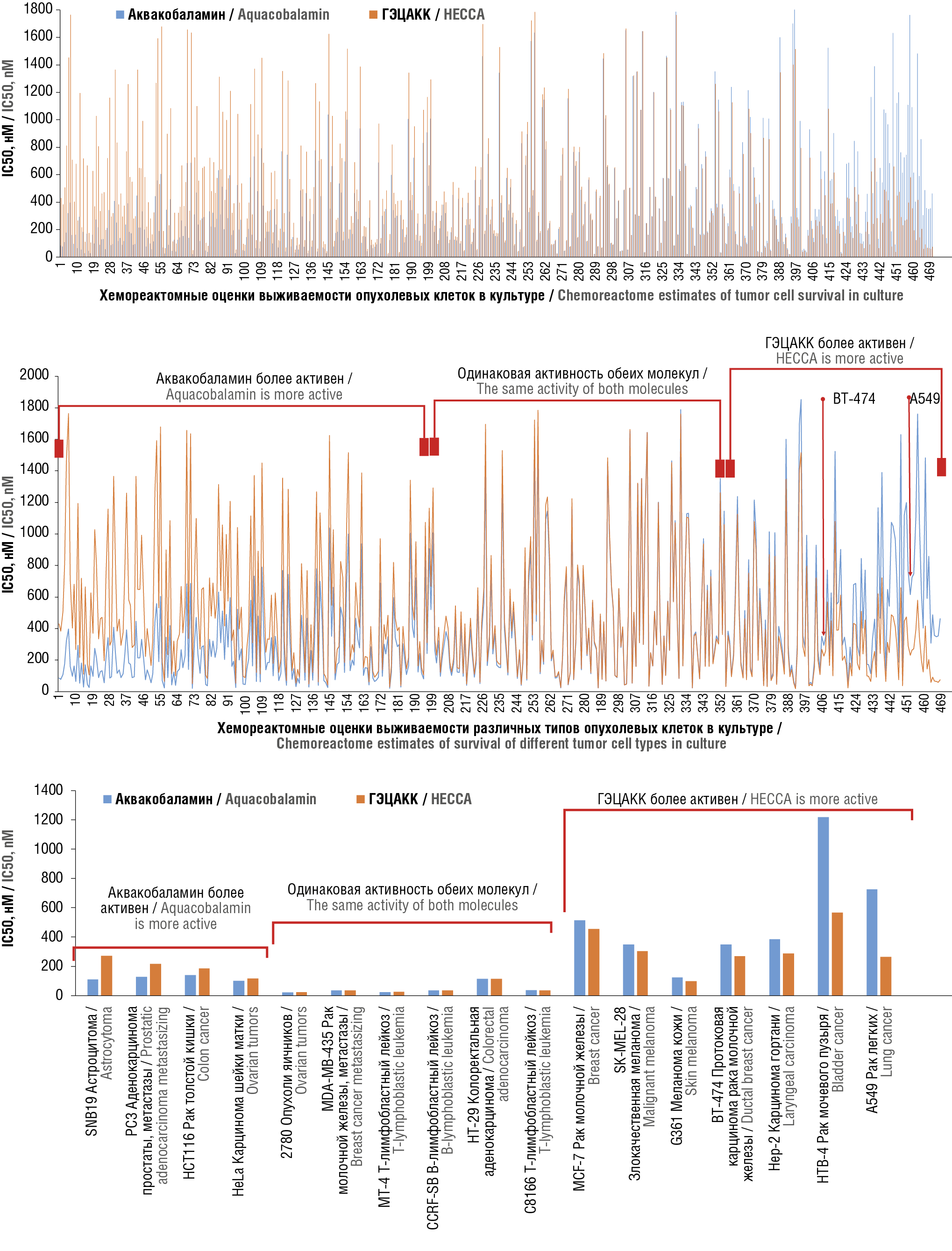
Рисунок 2. Результаты хемореактомного скрининга эффектов аквакобаламина и гептаметилового эфира цианоаквакобириновой кислоты (ГЭЦАКК). Данные упорядочены по возрастанию отношения значения константы полуингибирования (IC50) для аквакобаламина к значению IC50 для ГЭЦАКК:
а – оценки IC50; b – группировка линий клеток по сравнительным эффектам двух молекул, показано расположение результатов, соответствующих клеточным линиям A549 и BT-474, экспериментально исследованным в настоящей работе; с – примеры IC50, полученных в результате проведения хемореактомного скрининга, для отдельных линий опухолевых клеток
Figure 2. Results of chemoreactom screening of the effects of aquacobalamin and heptamethyl ester of cyanoaquacobyrinic acid (HECСA). Data are sorted in ascending order of ratio of half-maximal inhibitory concentration (IC50) for aquacobalamin to IC50 for HECСA:
a – IC50 scores; b – grouping of cell lines according to the comparative effects of two molecules; the location of the results corresponding to A549 and BT-474 cell lines experimentally studied in this work is shown; c – examples of IC50s obtained from chemoreactom screening for selected tumor cell lines
Исследования цитотоксичности / Cytotoxicity studies
При экспериментальном исследовании влияния производных витамина В12 на выживаемость клеточных культур были получены схожие результаты для клеточных линий А549 (аденокарциномные альвеолярные базальные эпителиальные клетки от пациента с раком легких) (рис. 3а) и ВТ-474 (карцинома молочной железы человека, протоковая линия) (рис. 3b). На клеточной линии рака протока молочной железы (ВТ-474) были заметны колебания в выживаемости клеток – до 73% при концентрации 100 мкг/л. Анализ графиков выживаемости обеих линий клеток в культуре позволил получить экспериментальные значения IC50 для ГЭЦАКК: 107,2 мкг/л (100,8 нМ) для А549 и 108,6 мкг/л (102,2 нМ) для ВТ-474. Значения IC50 для аквакобаламина были существенно выше, чем 200 мкг/мл (188 нМ).
Для сравнения использованы теломеризованные фибробласты кожи человека (Фб-hTERT), анализ кривой выживаемости которых (рис. 3с) показал низкую цитотоксичность аквакобаламина (IC50>>200 нМ) и цитотоксичность ГЭЦАКК, сопоставимую с воздействием на опухолевые клетки (IC50 90,4 мкг/л, 85,2 нМ).
Таким образом, экспериментальные результаты для клеток линий BT-474 и A549 подтверждают данные хемореактомного скрининга. Во-первых, в обоих случаях значения IC50 для ГЭЦАКК были существенно ниже, чем для аквакобаламина. Во-вторых, коэффициент пересчета с хемореактомных оценок на экспериментальные (т.е. расчет отношения значений IC50, полученных в двух видах исследования) был весьма близок для обеих линий клеток и составил 2,64 для BT-474 и 2,63 для A549. Поэтому результаты хемореактомного скрининга для других опухолевых линий клеток (см. рис. 2) могут быть использованы для планирования последующих клеточных экспериментов с производными витамина В12.
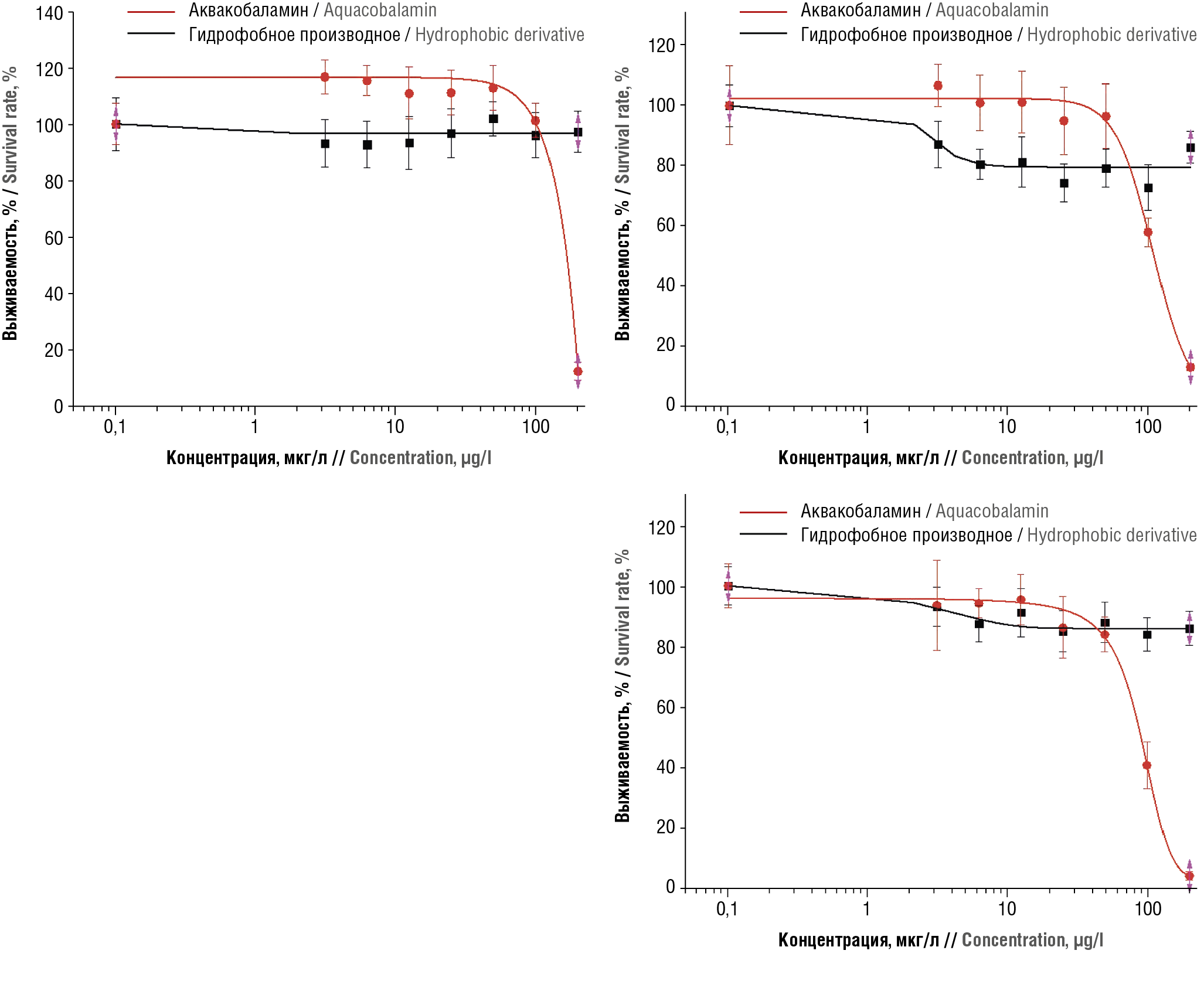
Рисунок 3. Сравнительные графики выживаемости опухолевых клеток в зависимости от концентраций гидрофобного производного и аквакобаламина:
а – линия А549 (аденокарциномные альвеолярные базальные эпителиальные клетки от пациента с раком легких); b – ВТ-474 (карцинома молочной железы человека, протоковая клеточная линия); c – Фб-hTERT (теломеризованные фибробласты кожи человека)
Figure 3. Comparative graphs of tumor cell survival depending on the concentrations of the hydrophobic derivative and aquacobalamin:
a – line A549 (adenocarcinoma alveolar basal epithelial cells from a patient with lung cancer); b – BT-474 (human breast carcinoma, ductal cell line); c – Phb-hTERT (telomerized human skin fibroblasts)
ОБСУЖДЕНИЕ / DISCUSSION
Для оценки цитотоксических эффектов веществ важно определить их воздействия не только на опухолевые, но и на неопухолевые, нормальные клетки. В качестве таковых в настоящем исследовании были использованы теломеризованные фибробласты кожи человека (Фб-hTERT), анализ кривой выживаемости которых (см. рис. 3с) показал низкую цитотоксичность аквакобаламина и цитотоксичность ГЭЦАКК, сопоставимую с воздействием на опухолевые клетки.
Для более адекватного восприятия последнего результата
следует отметить, что клетки линии Фб-hTERT являются не вполне «нормальными» фибробластами кожи – скорее, они близки к фенотипу фибробластов, образующихся при патологических келоидных рубцах (для которых характерна высокая активность теломеразы). Такие келоидные фибробласты весьма схожи с иммортализованными клетками, что определяет перспективность использования Фб-hTERT в качестве модельных клеток при разработке клеточных моделей гиперпластических (келоидных и гипертрофических) рубцов [25].
Преимуществами клеток линии Фб-hTERT, делающими их весьма удобными для экспериментальной работы, являются:
– устойчивый фенотип, воспроизводимый до 200-го пассажа;
– способность к неограниченному числу делений;
– фенотипическая однородность клеток различных пассажей;
– способность образовывать клеточные сфероиды.
Однако сравнительное исследование культур нормальных фибробластов (НФ) кожи (первичные клеточные линии фибробластов третьего пассажа) и теломеризованных фибробластов Фб-hTERT показало существенные отличия в фенотипе и метаболических свойствах этих клеток [26]. Нормальные и иммортализованные фибробласты кожи различались размерами и пролиферативной активностью. НФ по сравнению с Фб-hTERT быстрее восстанавливали дефект монослоя в интактном состоянии (т.е. более быстро регенерировали), а клетки Фб-hTERT, напротив, регенирировали гораздо медленнее, даже при стимуляции трансформирующим фактором роста бета 1 (англ. transforming growth factor beta 1, TGF-β1), вследствие сниженной способности к уплотнению за счет более слабых межклеточных контактов. Фб-hTERT характеризовались и более высокой по сравнению с НФ метаболической активностью клеток в покое и при воздействии TGF-β1 (данные МТТ-теста). Продукция основных фибробласт-специфических белков, используемых для формирования структур волокнистой соединительной ткани (коллаген I и III типов, фибронектин), была снижена в Фб-hTERT по сравнению с НФ (причем даже на фоне стимуляции TGF-β1) [18].
Результаты сравнительного исследования позволяют утверж-
дать, что клетки Фб-hTERT менее жизнестойки, чем нормальные фибробласты человека, что отчасти объясняет полученные выше результаты анализа цитотоксичности ГЭЦАКК.
Благодарности / Acknowledgements
Благодарим проф. Е.Е. Егорова (ФГБУН «Институт молекулярной биологии им. В.А. Энгельгардта» Российской академии наук) за любезно предоставленные клеточные линии А549 (карцинома легкого человека) и линии Фб-hTERT (теломеризированные, т.е. иммортализованные фибробласты кожи человека). Культура была получена в результате введения гена каталитического компонента теломеразы в фибробласты кожи линии 1608 [25]. Также выражаем благодарность Е.И. Шрамовой (ФГБУН «Институт биоорганической химии им. академиков М.М. Шемякина и Ю.А. Овчинникова» Российской академии наук) за любезно предоставленную клеточную линию BT-474.
ЗАКЛЮЧЕНИЕ / CONCLUSION
В исследовании представлены результаты хемореактомного in silico скрининга эффектов воздействия аквакобаламина и ГЭЦАКК на 470 культур опухолевых клеток человека, в т.ч. клеток карциномы протока молочной железы (линия BT-474) и карциномы легкого (линия A549). Экспериментально проанализированы цитотоксические свойства аквакобаламина и его гидрофобного производного в концентрациях от 3,125 мкг/л до 200 мкг/л на линиях клеток BT-474 и A549.
Из полученных экспериментальных данных видно, что в рассматриваемых концентрациях аквакобаламин не обладает явно выраженным цитотоксическим эффектом для клеточных линий BT-474 и A549 (IC50>>200 нМ). На обеих линиях клеток гидрофобное производное ГЭЦАКК показало цитотоксические свойства при высоких концентрациях (IC50 порядка 100 нМ). На нормальной клеточной линии фибробластов Фб-hTERT в указанных концентрациях также было отмечено цитотоксическое действие обоих веществ. Продемонстрировано соответствие между результатами хемореактомного скрининга in silico и данными исследований in vitro.
Список литературы
1. Торшин И.Ю., Громова О.А., Майорова Л.А. О перспективах применения производных витамина В12 в фармакологии. ФАРМАКОЭКОНОМИКА. Современная фармакоэкономика и фармакоэпидемиология. 2023; 16 (3): 501–11. https://doi.org/10.17749/2070-4909/farmakoekonomika.2023.198.
2. Wu K., Helzlsouer K.J., Comstock G.W., et al. A prospective study on folate, B12, and pyridoxal 5'-phosphate (B6) and breast cancer. Cancer Epidemiol Biomarkers Prev. 1999; 8 (3): 209–17.
3. Hernandez B.Y., McDuffie K., Wilkens L.R., et al. Diet and premalignant lesions of the cervix: evidence of a protective role for folate, riboflavin, thiamin, and vitamin B12. Cancer Causes Control. 2003; 14 (9): 859–70. https://doi.org/10.1023/b:caco.0000003841.54413.98.
4. Nakagawa K., Kudoh S., Matsui K., et al. A phase I studyofpemetrexed (LY231514) supplemented with folate and vitamin B12 in Japanese patients with solid tumours. Br J Cancer. 2006; 95 (6): 677–82. https://doi.org/10.1038/sj.bjc.6603321.
5. Громова О.А., Торшин И.Ю., Стаховская Л.В., Федотова Л.Э. Хемореактомный анализ молекул тиамина дисульфида, тиамина гидрохлорида и бенфотиамина. Неврология, нейропсихиатрия, психосоматика. 2017; 9 (2): 50–7. https://doi.org/10.14412/2074-27112017-2-50-57.
6. Громова О.А., Торшин И.Ю., Фролова Д.Е., Филимонова М.В. Противоопухолевые эффекты сочетанного применения витаминов В1, В6 и В12. Неврология и ревматология (Приложение к журналу Consilium Medicum). 2018; 1: 62–6. https://doi.org/10.26442/2414357X_2018.1.62-66.
7. Громова О.А., Торшин И.Ю., Филимонова М.В., Сорокина М.А. Роль витаминов в профилактике рака и их влияние на эффективность противоопухолевой терапии: систематический анализ доказательных исследований. Терапия. 2018; 4: 108–20.
8. Sun N.H., Huang X.Z., Wang S.B., et al. A dose-response metaanalysis reveals an association between vitamin B12 and colorectal cancer risk. Public Health Nutr. 2016; 19 (8): 1446–56. https://doi.org/10.1017/S136898001500261X.
9. Громова О.А., Стаховская Л.В., Торшин И.Ю. и др. О потенциальном противоопухолевом эффекте витамина В12. Российский журнал боли. 2017; 2: 62–73.
10. Stoffregen C.C., Odin E.A., Carlsson G.U., et al. Reduced folate and serum vitamin metabolites in patients with rectal carcinoma: an openlabel feasibility study of pemetrexed with folic acid and vitamin B12 supplementation. Anticancer Drugs. 2016; 27 (5): 439–46. https://doi.org/10.1097/CAD.0000000000000345.
11. Gromova O.A., Torshin I.Yu., Maiorova L.A., et al. Bioinformatic and chemoneurocytological analysis of the pharmacological properties of vitamin B12 and some of its derivatives. J Porphyrins Phthalocyanines. 2021; 25 (09): 835–42. https://doi.org/10.1142/S1088424621500644.
12. Gromova O.A., Maiorova L.A., Salnikov D.S., et al. Vitamin B12 hydrophobic derivative exhibits bioactivity: biomedical and photophysical study. BioNanoSci. 2022; 12: 74–82. https://doi.org/10.1007/s12668-021-00916-4.
13. Valkova L.A., Glibin A.S., Valli L. Quantitative analysis of compression isotherms of fullerene C60 Langmuir layers. Colloid J. 2008; 70: 6–11. https://doi.org/10.1134/S1061933X0801002X.
14. Valkova L.A., Glibin A.S., Koifman O.I. Influence of the solvent nature on the structure of two-dimensional nanoaggregates in Langmuir layers of copper tetra-tert-butyltetrabenzotriazaporphyrin. Macroheterocycles. 2011; 4 (3): 222–6.
15. Valkova L.A., Erokhin V.V., Glibin A.S., Koifman O.I. The influence of molecular structure and π-system extent on nano- and microstructure of Langmuir layers of copper azaporphyrins. J Porphyr Phthalocyanines. 2011; 15: 1044–51. https://doi.org/10.1142/s1088424611004026.
16. Valkova L.A., Shabyshev L.S., Feigin L.A., Akopova O.B. Formation and X-ray diffraction investigation of Langmuir–Blodgett films of liquid crystalline substituted crown esters. Molecular Crystals and Liquid Crystals. 1996; 6 (4): 291–8.
17. Valkova L., Borovkov N., Maccioni E., et al. Influence of molecular and supramolecular factors on sensor properties of Langmuir–Blodgett films of tert-butyl-substituted copper azaporphyrines towards hydrocarbons. Colloids and Surfaces A: Physicochemical and Engineering Aspects. 2002; 198: 891–6. https://doi.org/10.1016/S0927-7757(01)01016-0.
18. Karlyuk M.V., Krygin Yu.Yu., Maiorova-Valkova L.A., et al. Formation of two-dimensional (M) and three-dimensional (V) nanoaggregates of substituted cobalt porphyrin in the Langmuir layers and Langmuir– Schaefer films.russian Chemical Bulletin. 2013; 62: 471–9. https://doi.org/10.1007/s11172-013-0066-5.
19. Valkova L.A., Betrencourt C., Hochapfel A., et al. Monolayer study of monensin and lasalocid in the gas state. Molecular Crystals and Liquid Crystals. 1996; 287 (1): 269–73. https://doi.org/10.1080/10587259608038763.
20. Maiorova L.A., Kobayashi N., Salnikov D.S., et al. Supermolecular nanoentities of vitamin B12 derivative as a link in the evolution of the parent molecules during self-assembly at the air-water interface. Langmuir. 2023; 39 (9): 3246–54. https://doi.org/10.1021/acs.langmuir.2c02964.
21. Торшин И.Ю. О задачах оптимизации, возникающих при применении топологического анализа данных к поиску алгоритмов прогнозирования с фиксированными корректорами. Информатика и ее применения. 2023; 17 (2): 2–10. https://doi.org/10.14357/19922264230201.
22. Торшин И.Ю. О применении топологического подхода к анализу плохо формализуемых задач для построения алгоритмов виртуального скрининга квантово-механических свойств органических молекул. I: Основы проблемно ориентированной теории. Информатика и ее применения. 2022; 16 (1): 39–45. https://doi.org/10.14357/19922264220106.
23. Торшин И.Ю. О применении топологического подхода к анализу плохо формализуемых задач для построения алгоритмов виртуального скрининга квантово-механических свойств органических молекул. II: Сопоставление формализма с конструктами квантовой механики и экспериментальная апробация предложенных алгоритмов. Информатика и ее применения. 2022; 16 (2): 35–43. https://doi.org/10.14357/19922264220205.
24. ChEMBL. Genomics of drug sensitity in cancer screening data. URL: http://www.doi.org/10.6019/CHEMBL1201861 (дата обращения 15.08.2023).
25. Егоров Е.Е., Терехов С.М., Вишнякова К. и др. Теломеризация как метод получения бессмертных клеток человека, сохраняющих нормальные свойства. Ontogenez. 2003; 34 (3): 183–92.
26. Шадрин В.С., Кожин П.М., Шошина О.О. и др. Теломеризованные фибробласты как потенциальный объект для 3D-моделирования патологических гипертрофических рубцов in vitro. Вестник Российского государственного медицинского университета. 2020; 5: 82–90. https://doi.org/10.24075/vrgmu.2020.057.
Об авторах
И. Ю. ТоршинРоссия
Торшин Иван Юрьевич – к.ф-м.н., к.х.н., старший научный сотрудник; WoS ResearcherID: C-7683-2018; Scopus Author ID: 7003300274.
Ул. Вавилова, д. 44, корп. 2, Москва 119333
М. В. Филимонова
Россия
Филимонова Марина Владимировна – к.м.н., д.б.н., заведующая лабораторией радиационной фармакологии Медицинского радиологического научного центра им. А.Ф. Цыба – филиала ФГБУ «Научный медицинский исследовательский центр радиологии» Минздрава России, профессор отделения биотехнологии Обнинского института атомной энергетики – филиала ФГАОУ ВО «НИЯУ «МИФИ».
Ул. Маршала Жукова, д. 10, Обнинск 249031; тер. Студгородок, д. 1, Обнинск 249039
О. А. Громова
Россия
Громова Ольга Алексеевна – д.м.н., профессор, ведущий научный сотрудник; WoS ResearcherID: J-4946-2017; Scopus Author ID: 7003589812.
Ул. Вавилова, д. 44, корп. 2, Москва 119333
Л. А. Майорова
Россия
Майорова Лариса Александровна – д.ф-м.н., профессор, ведущий научный сотрудник; WoS ResearcherID: B-6288-2016; Scopus Author ID: 6701491872.
Ул. Вавилова, д. 44, корп. 2, Москва 119333
М. А. Сорокина
Россия
Сорокина Мария Андреевна – аналитик Нейрокампуса-2030; Scopus Author ID: 57226747037.
Ул. Островитянова, д. 1, Москва 117997
Д. Е. Фролова
Россия
Фролова Дарья Евгеньевна – ассистент кафедры онкологии, акушерства и гинекологии.
Шереметевский пр-т, д. 8, Иваново 153012
А. Н. Громов
Россия
Громов Андрей Николаевич – инженер-исследователь; WoS ResearcherID: C-7476-2018; Scopus Author ID: 7102053964.
Ул. Вавилова, д. 44, корп. 2, Москва 119333
И. А. Рейер
Россия
Рейер Иван Александрович – к.т.н., научный сотрудник; Scopus Author ID: 14042533700.
ул. Вавилова, д. 44, корп. 2, Москва 119333
Рецензия
Для цитирования:
Торшин И.Ю., Филимонова М.В., Громова О.А., Майорова Л.А., Сорокина М.А., Фролова Д.Е., Громов А.Н., Рейер И.А. Хемореактомный скрининг цитотоксических эффектов аквакобаламина и гептаметилового эфира цианоаквакобириновой кислоты на опухолевые клетки с экспериментальными подтверждениями на линиях клеток ВТ-474 и А549. ФАРМАКОЭКОНОМИКА. Современная фармакоэкономика и фармакоэпидемиология. 2024;17(1):95-105. https://doi.org/10.17749/2070-4909/farmakoekonomika.2023.209
For citation:
Torshin I.Yu., Filimonova M.V., Gromova O.A., Maiorova L.A., Sorokina M.A., Frolova D.E., Gromov A.N., Reyer I.A. Chemoreactome screening of aquacobalamin and heptamethyl ester of cyanoaquacobyrinic acid cytotoxic effects on tumor cells with experimental confirmation on BT-474 and A549 cell. FARMAKOEKONOMIKA. Modern Pharmacoeconomics and Pharmacoepidemiology. 2024;17(1):95-105. (In Russ.) https://doi.org/10.17749/2070-4909/farmakoekonomika.2023.209

Контент доступен под лицензией Creative Commons Attribution-NonCommercial-ShareAlike 4.0 International License.






































