Перейти к:
Открытое контролируемое исследование клинических эффектов препарата Лаеннек® у пациентов с неалкогольным стеатогепатитом или циррозом печени
https://doi.org/10.17749/2070-4909/farmakoekonomika.2023.206
Аннотация
Цель: оценка эффективности и безопасности гидролизата плаценты человека (ГПЧ) Лаеннек® при лечении неалкогольной жировой болезни печени (НАЖБП) в рамках клинического исследования.
Материал и методы. В исследовании приняли участие госпитализированные пациенты с НАЖБП (неалкогольный стеатогепатит, цирроз) (n=34, средний возраст 53±14 лет). В группе терапии (n=17) больные получали ГПЧ Лаеннек® (4 мл внутривенная капельная инфузия в растворе 5% глюкозы 5 раз в неделю в течение 2 нед). В контрольной группе (n=17) пациенты, госпитализированные в другие отделения клиники, не получали никакой терапии в связи с НАЖБП. Эффективность лечения оценивали через 2 и 3 нед по субъективным симптомам НАЖБП (утомляемость, анорексия, вздутие живота, запор, тошнота и боль в подреберье) и биохимическим показателям функции печени: уровням аспартатаминотрансферазы (АСТ), аланинаминотрансферазы (АЛТ), гамма-глутамилтрансферазы (ГГТ) в сыворотке крови.
Результаты. На момент начала исследования между группами не было достоверных различий в значениях исследованных показателей функции печени: уровни АСТ, АЛТ, ГГТ и др. К концу 1-й недели в группе получавших Лаеннек® зарегистрировано достоверное снижение уровней АСТ (–35 Ед/л; контроль: –8 Ед/л; р<0,001), АЛТ (–45 Ед/л; контроль: –10 Ед/л; р<0,001) и ГГТ (–23 Ед/л; контроль: –8 Ед/л; р=0,084; тренд). На момент окончания исследования (3-я неделя) снижение уровней АСТ, АЛТ и ГГТ в сторону интервала нормы было еще более выраженно для всех трех биомаркеров: АСТ (–62 Ед/л; контроль: –23 Ед/л; р<0,001), АЛТ (–78 Ед/л; контроль: –20 Ед/л; р<0,001), ГГТ (–40 Ед/л; контроль: –15 Ед/л; р=0,005). Субъективная симптоматика НАЖБП достоверно улучшилась через 3 нед. Не было установлено каких-либо нежелательных эффектов при применении ГПЧ.
Заключение. Лаеннек® – эффективное и безопасное средство лечения НАЖБП.
Ключевые слова
Для цитирования:
Имавари М., Нагасе М., Торшин И.Ю., Громова О.А. Открытое контролируемое исследование клинических эффектов препарата Лаеннек® у пациентов с неалкогольным стеатогепатитом или циррозом печени. ФАРМАКОЭКОНОМИКА. Современная фармакоэкономика и фармакоэпидемиология. 2023;16(3):447-455. https://doi.org/10.17749/2070-4909/farmakoekonomika.2023.206
For citation:
Imawari M., Nagase M., Torshin I.Yu., Gromova O.A. An open-label, controlled trial of the clinical effects of Laennec® in patients with nonalcoholic steatohepatitis or cirrhosis. FARMAKOEKONOMIKA. Modern Pharmacoeconomics and Pharmacoepidemiology. 2023;16(3):447-455. (In Russ.) https://doi.org/10.17749/2070-4909/farmakoekonomika.2023.206
ВВЕДЕНИЕ / INTRODUCTION
Неалкогольная жировая болезнь печени (НАЖБП) является основной причиной цирроза печени и гепатоцеллюлярной карциномы [1]. Метаанализ 86 исследований c участием 8 515 431 пациента с НАЖБП из 22 стран подтвердил, что риск НАЖБП увеличивается с возрастом. В частности, возрастной группе 70–79 лет соответствует самая высокая распространенность НАЖБП (34%) по сравнению с другими возрастными группами (60–69 лет – 29%, 50–59 лет – 27%, 40–49 лет – 26,5%, 30–39 лет – 22%). Наибольшая распространенность НАЖБП отмечается на Ближнем Востоке и в Южной Америке, а наименьшая – в странах Африки [2].
Эпидемиологические исследования показали высокую заболеваемость НАЖБП в отдельных регионах России. Например, при анализе 50 145 пациентов доля больных НАЖБП, первично или повторно обратившихся в амбулаторные лечебно-профилактические учреждения, составила 37% по стране в целом [3] и 57% в Новосибирске (n=3220) [4].
В Японии резкий рост распространенности НАЖБП (в 2–2,4 раза) отмечен в последнюю декаду ХХ века: в начале 1990-х гг. заболеваемость составляла всего 12,6–12,9%, а к началу 2000-х гг. НАЖБП затронула уже 24,6% населения. Основными причинами столь значительного повышения показателей стали распространение так называемого западного типа питания, не свойственного японским традициям (расширение сетей типа «фастфуд»), увеличение потребления высококалорийных искусственных напитков, алкогольных напитков и усиление воздействия других факторов «западного влияния» (гиподинамия и т.д.). Несмотря на относительную стабилизацию ситуации к настоящему времени (не более 35% населения в 2019 г.), в Японии по-прежнему актуальна разработка эффективных стратегий профилактики и лечения данного заболевания. Наиболее важной стратегией профилактики прогрессирования НАЖБП до фибротической стадии является, конечно же, изменение образа жизни и возврат к традиционным ценностям в питании [5].
На данный момент в Японии нет повсеместно одобренной терапии НАЖБП. В доклинических испытаниях фармакологических кандидатов особое внимание уделяют сочетанию НАЖБП с диабетом, нарушениям метаболизма липидов и воспалению. Например, механизм действия эксенатида в смягчении клинического течения НАЖБП объясняется подавлением пироптоза [6]. Несколько препаратов находятся на III–IV стадиях разработки (например, IV фазу исследований проходят орлистат, урсодезоксихолевая кислота, лираглутид, пиоглититазон) [7].
НАЖБП связана с дислипидемией, инсулинорезистентностью и ожирением, вызывающим жировую дистрофию печени. «Стертая» клиническая манифестация НАЖБП, особенно на начальных стадиях, часто приводит к диагностике заболевания на поздних стадиях (фиброз, цирроз печени). Сложная патофизиология и существенная гетерогенность фенотипов пациентов с НАЖБП обусловливают необходимость комплексного лечения и использования комбинированных подходов к терапии.
Препарат Лаеннек® (Japan Bioproducts, Япония), изготовляемый на основе гидролизата плаценты человека (ГПЧ) и содержащий тысячи биологически активных олигопептидов, является весьма перспективным средством для терапии НАЖБП и заболеваний других внутренних органов, вирусных и бактериальных инфекций [8]. Пептиды в составе ГПЧ Лаеннек®:
– поддерживают инозитолфосфат-зависимые сигнальные пути регенерации гепатоцитов;
– активируют таргетные белки RARA, AMPK;
– ингибируют таргетные белки Notch1, GSK-3, PAK1 и TLR4.
Все это способствует проявлению комплексного фармакологического действия (противовоспалительные, антифибротические, вазодилататорные, антиатеросклеротические и антидиабетические эффекты), важного для терапии НАЖБП [9]. Поэтому актуальным является тестирование гипотезы об эффективности препарата Лаеннек® у пациентов с НАЖБП.
Цель – оценка эффективности и безопасности ГПЧ Лаеннек® при лечении НАЖБП в рамках клинического исследования.
МАТЕРИАЛ И МЕТОДЫ / MATERIAL AND METHODS
Пациенты с диагнозом НАЖБП (n=34), госпитализированные на медицинский факультет университета Сева II и в больницу Кохсей (г. Агео, префектура Сайтама, Япония), были включены в предварительное наблюдение без изменения назначений препаратов, которые использовались ранее. Средний возраст пациентов составил 53±14 лет.
Критерии включения и исключения / Inclusion and exclusion criteria
Использовали следующие критерии включения:
– возраст на момент регистрации в исследовании 18 лет или старше;
– диагноз НАЖБП (неалкогольный стеатогепатит (НАСГ), цирроз) согласно клиническим рекомендациям [3, 10, 11];
– расхождение уровней аспартатаминотрансферазы (АСТ), аланинаминотрансферазы (АЛТ), гамма-глутамилтрансферазы (ГГТ) в сыворотке крови в день поступления и на 2-й день пребывания в госпитале менее 10%.
Критерии исключения:
– вирусный гепатит или другие инфекции, гепатоцеллюлярная карцинома, метаболические нарушения, тяжелая дисфункция почек, тяжелое респираторное заболевание, заболевания сердечно-сосудистой системы;
– прием пациентом стероидов, иммунодепрессантов, противовирусных препаратов;
– лекарственная аллергия, в т.ч. на изучаемый препарат или на любой экспериментальный белковый препарат животного происхождения.
Группы пациентов / Patient groups
Пациенты были разделены на две группы (группы терапии и контроля), в каждую из которых вошло по 17 человек с НАЖБП – 12 с НАСГ и 5 с циррозом печени. В группе терапии больные получали Лаеннек® в течение 2 нед. Пациенты контрольной группы, поступившие в госпиталь в кардиологическое или пульмонологическое отделение для обследования по поводу других хронических неинфекционных заболеваний, не получали Лаеннек®.
Способ применения препарата / Method of drug application
В исследовании применялся стандартный курс ГПЧ Лаеннек®, рекомендуемый производителем (всего 20 ампул, т.е. 40 мл на курс). Пациенты группы терапии ежедневно (5 раз в неделю) в течение 2 нед получали инфузию препарата Лаеннек®: две ампулы (4 мл) препарата смешивались с 500 мл 5% раствора глюкозы, весь объем раствора вводился путем внутривенной капельной инфузии через локтевую вену в течение 1,5–2 ч. Затем больные наблюдались в течение еще 1 нед.
Сбор и анализ данных / Data collection and analysis
В течение всего периода исследования (3 нед) в конце каждой недели проводился осмотр и опрос пациентов врачом для установления субъективных и объективных симптомов заболевания, собирались образцы крови и проводились биохимические анализы, включая функциональные тесты печени.
На каждой неделе измерялись 9 биохимических показателей: уровни в сыворотке крови АСТ (Ед/л), АЛТ (Ед/л), ГГТ (Ед/л), щелочной фосфатазы (ЩФ, Ед/л), общего билирубина (мг/дл), альбумина (г/дл, %), общего белка (г/дл), общего холестерина (мг/дл).
Также изучались побочные реакции на терапию. Общее состояние пациента определялось врачом посредством всесторонней оценки улучшения как показателей биохимических тестов функции печени, так и субъективных/объективных симптомов. Степень улучшения функций печени и субъективных/объективных симптомов оценивалась по 5-балльной шкале для каждого испытуемого путем сравнения балльных оценок состояния больного до и после лечения. В соответствии с изменениями баллов пациентов разделяли на пять групп:
– значительное улучшение (повышение оценки более чем на 2 балла);
– улучшение (повышение оценки на 2 балла);
– небольшое улучшение (повышение оценки на 1 балл);
– без изменений (изменение 0 баллов);
– ухудшение (снижение оценки на 1 балл и более).
Статистический анализ / Statistical analysis
Статистическая обработка данных включала расчеты средних значений и стандартных отклонений исследованных параметров состояния пациентов. Статистическую значимость различий в значениях показателей в динамике лечения и между группами оценивали посредством парного t-теста, теста Фишера и теста Вилкоксона. Рассчитывали значения отношения шансов (ОШ) и 95% доверительного интервала (ДИ). Различия считали статистически достоверными при р<0,05.
Этические аспекты / Ethical aspects
Клиническое исследование проведено в соответствии с положениями Хельсинкской декларации Всемирной медицинской ассоциации (Форталеза, Бразилия, 2013 г.), а также с правилами и этическими стандартами министерства здравоохранения Японии. Процедуры и биохимические тесты, использованные в исследовании, не отличались от общепринятых. Пациенты с диагнозом НАЖБП, соответствовавшие критериям включения и пожелавшие принять участие в исследовании, заполнили форму об информированном согласии.
РЕЗУЛЬТАТЫ / RESULTS
Оценка безопасности / Safety assessment
Во время исследования ни у одного испытуемого группы терапии не было зарегистрировано нежелательных явлений, включая побочные реакции на лекарственные препараты, ни один пациент не прекратил прием препарата Лаеннек® и не выбыл из исследования.
Биохимические показатели / Biochemical indicators
В группе пациентов, получавших инфузии ГПЧ Лаеннек®, уже после 1-й недели терапии существенно улучшались значения 3 из 9 биохимических показателей состояния: АСТ, АЛТ и ГГТ. При этом достоверное улучшение наблюдалось и в динамике лечения (табл. 1–3), и при сравнении с контролем (рис. 1).
На 3-й неделе уровни ЩФ продемонстрировали умеренную тенденцию к улучшению (0,05<р<0,10). Известно, что повышение концентрации ЩФ ассоциировано с поражением печени и желчевыводящих путей, в т.ч. вследствие желчнокаменной болезни, цирроза печени и гепатитов различного генеза. Поэтому снижение ЩФ у пациентов с НАЖБП соответствует улучшению функции печени.
Такие параметры, как уровни общего билирубина, альбумина, общего холестерина, общего белка, соотношение сывороточных белков и активность холинэстеразы, находились в пределах нормы в течение всего периода исследования (рис. 2).
При сравнении данных по пациентам, проходившим курс терапии препаратом Лаеннек®, с данными группы контроля на момент начала исследования не обнаружено достоверных различий в значениях показателей функции печени (АСТ, АЛТ, ГГТ). Уже к концу 1-й недели в группе терапии зарегистрировано достоверное снижение уровней АСТ (–35 Ед/л; контроль: –8 Ед/л; р<0,001), АЛТ (–45 Ед/л; контроль: –10 Ед/л; р<0,001) и ГГТ (–23 Ед/л; контроль: –8 Ед/л; р=0,084; тренд) (см. рис. 1).
На момент окончания исследования (3-я неделя) снижение уровней АЛТ, АСТ и ГГТ в сторону интервала нормы было еще более выраженно для всех трех биомаркеров: АСТ (–62 Ед/л; контроль: –23 Ед/л; р<0,001), АЛТ (–78 Ед/л; контроль: –20 Ед/л; р<0,001) и ГГТ (–40 Ед/л; контроль: –15 Ед/л; р=0,005) (см. рис. 1) на фоне отсутствия существенной динамики других биохимических показателей (см. рис. 2).
Субъективные/объективные симптомы // Subjective/objective symptoms
В группе проходивших лечение ГПЧ Лаеннек® (n=17) утомляемость наблюдалась у 7 пациентов, анорексия и вздутие живота – у 2, запор, тошнота и боль в подреберье – у 1. Все эти симптомы уменьшились через 2 нед терапии (табл. 4).
Ни у одного из 4 больных с гепатомегалией после 2 нед лечения ГПЧ Лаеннек® не было зарегистрировано достоверного уменьшения размеров печени. Наблюдалось улучшение у 2 пациентов с болезненностью печени и у 1 больного с асцитом, отеками и нарушением сознания. У последнего отмечено заметное уменьшение асцита, и состояние улучшилось до такого уровня, что пациенту больше не требовалось принимать ранее применявшееся мочегонное средство.
Оценка общего улучшения состояния / Assessment of overall improvement
Общее улучшение состояния пациентов оценивалось баллами от 1 до 5 на основании изменений уровней биомаркеров функций печени и выраженности субъективных/объективных симптомов. Распределение больных по категориям, соответствующим изменениям значений 5-балльной оценки, приведено в таблице 4.
Только у 1 пациентки 55 лет с циррозом печени наблюдалось отсутствие снижения концентраций АСТ и АЛТ: повышение уровня трансаминаз не удалось преодолеть даже после продолжения лечения, хотя симптоматика и самочувствие больной улучшились.
Отсутствие изменений уровней АСТ и АЛТ и/или симптоматики отмечено в целом у 4 больных. В результате разные степени улучшения (+1, +2, +3 балла) наблюдались у 13 пациентов в группе получавших инфузии ГПЧ, так что эффективность терапии составила 76,4% в группе терапии и только 12% (2 человека) в контроле (ОШ 24,4; 95% ДИ 3,8–155,5; р=0,000145).
При стратификации по стадиям НАЖБП (НАСГ / цирроз печени) или по учреждениям (медицинский факультет университета Сева II / больница Кохсей) не было отмечено статистически значимых различий в отношении функциональных тестов печени или субъективных/объективных симптомов. Это свидетельствует об отсутствии различий в клинических эффектах или безопасности применения препарата в зависимости от заболевания или учреждения.
Таким образом, ежедневные внутривенные капельные инфузии ГПЧ Лаеннек® (5 раз в неделю в течение 2 нед) способствовали быстрому улучшению биохимических маркеров функции печени и субъективной симптоматики НАЖБП, в т.ч. у всех пациентов с циррозом печени. Не отмечено каких-либо проблем с безопасностью, включая неблагоприятные изменения уровней других биохимических показателей и возникновение побочных лекарственных реакций. Показатель эффективности в нашем исследовании, основанный на общей оценке состояния пациента по 5-балльной шкале, составил 76,4%, при этом статистически значимой разницы в эффективности между НАСГ и циррозом печени не было. Шансы улучшения состояния пациентов в результате применения курсового лечения препаратом Лаеннек® были в 24 раза выше, чем шансы спонтанной ремиссии НАЖБП в контроле (ОШ 24,4; 95% ДИ 3,8–155,5).
Таблица 1. Значения биохимических показателей в динамике лечения пациентов с неалкогольной жировой болезнью печени с помощью препарата Лаеннек® (1-я неделя наблюдения), Ед/л
Table 1. Values of biochemical indicators in the dynamics of treatment of patients with nonalcoholic fatty liver disease using Laennec® (Week 1), U/l
|
Показатель / Indicator |
Среднее значение / Mean value |
t-значение / t-value |
р-значение / p-value |
||
|
До / Before |
После / After |
Разница / Difference |
|||
|
АСТ / AST |
102,46 |
67,88 |
34,58 |
2,9796 |
0,01<р<0,05 |
|
АЛТ / ALT |
130,23 |
84,82 |
45,41 |
2,7708 |
0,01<р<0,05 |
|
ГГТ / GGT |
103,31 |
89.46 |
13,85 |
2,2627 |
0,01<р<0,05 |
|
ЩФ / ALP |
4,25 |
4,01 |
0,24 |
1,4446 |
>0,10 |
Примечание. АСТ – аспартатаминотрансфераза; АЛТ – аланинаминотрансфераза; ГГТ – гамма-глутамилтрансфераза; ЩФ – щелочная фосфатаза.
Note. AST – aspartate aminotransferase; ALT – alanine aminotransferase; GGT – gamma-glutamyltransferase; ALP – alkaline phosphatase.
Таблица 2. Значения биохимических показателей в динамике лечения пациентов с неалкогольной жировой болезнью печени с помощью препарата Лаеннек® (2-я неделя наблюдения), Ед/л
Table 2. Values of biochemical indicators in the dynamics of treatment of patients with nonalcoholic fatty liver disease using Laennec® (Week 2), U/l
|
Показатель / Indicator |
Среднее значение / Mean value |
t-значение / t-value |
р-значение / p-value |
||
|
До / Before |
После / After |
Разница / Difference |
|||
|
АСТ / AST |
110,71 |
72,72 |
37,99 |
3,0880 |
<0,01 |
|
АЛТ / ALT |
153,53 |
89,32 |
64,21 |
3,0145 |
<0,01 |
|
ГГТ / GGT |
91,25 |
71,75 |
19,50 |
3,5391 |
<0,01 |
|
ЩФ / ALP |
3,88 |
3,69 |
0,19 |
1,1957 |
>0,10 |
Примечание. АСТ – аспартатаминотрансфераза; АЛТ – аланинаминотрансфераза; ГГТ – гамма-глутамилтрансфераза; ЩФ – щелочная фосфатаза.
Note. AST – aspartate aminotransferase; ALT – alanine aminotransferase; GGT – gamma-glutamyltransferase; ALP – alkaline phosphatase.
Таблица 3. Значения биохимических показателей после лечения пациентов с неалкогольной жировой болезнью печени с помощью препарата Лаеннек® (3-я неделя наблюдения)
Table 3. Values of biochemical indicators after treatment of patients with nonalcoholic fatty liver disease using Laennec® (Week 3), U/l
|
Показатель / Indicator |
Среднее значение / Mean value |
t-значение / t-value |
р-значение / p-value |
||
|
До / Before |
После / After |
Разница / Difference |
|||
|
АСТ, Ед/л // AST, U/l |
102,67 |
41,17 |
61,50 |
3,2363 |
0,01<р<0,05 |
|
АЛТ, Ед/л // ALT, U/l |
143,17 |
52,00 |
91,17 |
3,0147 |
0,01<р<0,05 |
|
ГГТ, Ед/л // GGT, U/l |
104,33 |
63,33 |
41,00 |
4,0837 |
<0,01 |
|
ЩФ, Ед/л // ALP, U/l |
4,62 |
4,10 |
0,52 |
2,4192 |
Тренд |
|
Билирубин общий, мг/дл // Total bilirubin, mg/dl |
1,00 |
0,88 |
0,12 |
1,1508 |
>0,10 |
Примечание. АСТ – аспартатаминотрансфераза; АЛТ – аланинаминотрансфераза; ГГТ – гамма-глутамилтрансфераза; ЩФ – щелочная фосфатаза.
Note. AST – aspartate aminotransferase; ALT – alanine aminotransferase; GGT – gamma-glutamyltransferase; ALP – alkaline phosphatase.
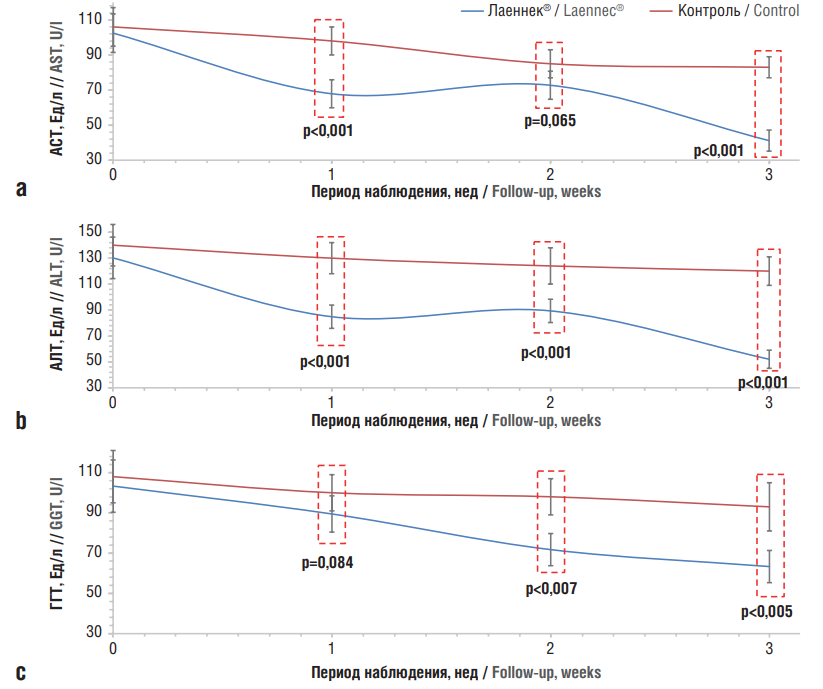
Рисунок 1. Динамика изменения уровней биомаркеров состояния печени в группе на курсовом лечении препаратом Лаеннек® в сравнении с контролем:
а – аспартатаминотрансфераза (АСТ); b – аланинаминотрансфераза (АЛТ); c – гамма-глутамилтрансфераза (ГГТ)
Figure 1. Dynamics of changes in the levels of liver biomarkers in the group of Laennec® course treatment compared to the control:
a – aspartate aminotransferase (AST); b – alanine aminotransferase (ALT); c – gamma-glutamyltransferase (GGT)
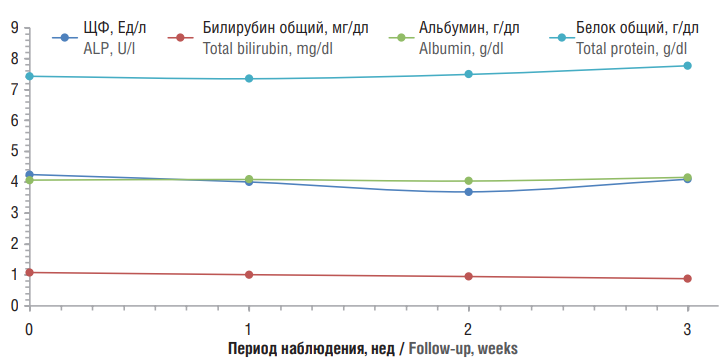
Рисунок 2. Динамика значений концентрации щелочной фосфатазы (ЩФ), общего билирубина, общего белка и альбумина в крови на фоне применения препарата Лаеннек®
Figure 2. Dynamics of alkaline phosphatase (ALP), total bilirubin, total protein and albumin blood concentrations due to Laennec® administration
Таблица 4. Результаты субъективных/объективных исследований после 2-й недели терапии препаратом Лаеннек®
Table 4. Results of subjective/objective examinations after Week 2 of Laennec® therapy
|
Симптом / Symptom |
Число пациентов, n / Number of patients, n |
|||
|
Улучшение / Improvement |
Небольшое улучшение / |
Без изменений / |
Ухудшение / Worsening |
|
|
Субъективные симптомы / Subjective symptoms |
||||
|
Утомляемость / Fatigue |
2 |
5 |
0 |
0 |
|
Анорексия / Anorexia |
0 |
2 |
0 |
0 |
|
Вздутие живота / Abdominal bloating |
1 |
1 |
0 |
0 |
|
Запор / Constipation |
0 |
1 |
0 |
0 |
|
Тошнота / Nausea |
0 |
1 |
0 |
0 |
|
Боль в подреберье / Рain in hypochondrium |
0 |
1 |
0 |
0 |
|
Объективные наблюдения / Objective observation |
||||
|
Гепатомегалия / Hepatomegaly |
0 |
0 |
4 |
0 |
|
Болезненность печени / Liver pain |
0 |
2 |
1 |
0 |
|
Желтуха / Jaundice |
0 |
0 |
1 |
0 |
|
Асцит / Ascites |
1 |
0 |
0 |
0 |
|
Отек / Edema |
1 |
0 |
0 |
0 |
|
Нарушение сознания / Consciousness impairment |
0 |
1 |
0 |
0 |
Примечание. Под «улучшением» понимается повышение оценки на 2 балла и более по 5-балльной шкале, «небольшое улучшение» – повышение на 1 балл, «ухудшение» – снижение оценки на 1 балл и более.
Note. “Improvement” is defined as an increase by 2 or more points on a 5-point scale, “slight improvement” – an increase by 1 point, and “worsening” – a decrease by 1 point or more.
ОБСУЖДЕНИЕ / DISCUSSION
В терапии НАЖБП рекомендуется применение урсодезоксихолевой кислоты (УДХК), витамина Е, S-аденозилметионина (адеметионина) [12]. Пациентам с НАЖБП и нарушениями углеводного обмена назначают прием агонистов рецепторов глюкагоноподобного пептида 1 [13] и тиазолидиндионов (антидиабетических препаратов, повышающих чувствительность тканей к инсулину, – пиоглитазон и др.) [14]. Пациентам с НАЖБП и дислипидемией рекомендуется прием полиненасыщенных жирных кислот омега-3 для уменьшения стеатоза печени и нормализации показателей липидного профиля [15]. Каждый из этих препаратов характеризуется определенными особенностями режима применения.
Например, использование УДХК подразумевает длительный прием per os (12–24 мес). При монотерапии УДХК в дозе 12–15 мг/кг/сут на протяжении 2 лет достигается снижение активности АЛТ по сравнению с плацебо [12]. Применение УДХК в составе комбинированной терапии с витамином Е, фосфатидилхолином и другими препаратами на протяжении 24 мес приводит к улучшению функции печени, в ряде случаев – уменьшению признаков воспаления и стеатоза по данным гистологического исследования [16]. При условии выполнения рекомендаций по модификации образа жизни и диеты прием УДХК (15 мг/кг/сут) приводил к значимому снижению АЛТ, АСТ, ГГТ и индекса стеатоза FLI через 24 нед [17]. Метаанализ подтвердил, что использование УДХК способствует снижению уровней АЛТ, АСТ, ГГТ, ЩФ и билирубина [18] при приеме в течение 12 мес и более.
Терапия витамином Е даже в высоких (терапевтических) дозах (800 МЕ/сут и выше) также требует длительного курса лечения (20–24 мес). Например, при применении в течение 22 мес витамин Е по эффективности превосходил плацебо у пациентов с НАСГ в отношении влияния на стеатоз, воспаление и баллонную дистрофию, но не оказывал значимого воздействия на фиброз [19]. У больных с НАСГ и сахарным диабетом 2-го типа комбинированная терапия витамином E (800 МЕ/сут)
и пиоглитазоном (45 мг/сут) в течение 18 мес оказывала эффект на гистологическую активность заболевания, но влияния на фиброз не отмечено [20].
В нашем исследовании уже к концу 1-й (!) недели терапии в группе получавших Лаеннек® зарегистрировано существенное снижение уровней АСТ (–35 Ед/л), АЛТ (–45 Ед/л) и ГГТ (–23 Ед/л), а через 3 нед результаты были еще более выраженными.
Сравнимые по скорости наступления эффекта наблюдения отмечены для терапии НАЖБП посредством S-аденозилметионина (адеметионина), который, являясь центральным субстратом переноса метильных групп в метаболизме фолатов, выступает в роли основного донатора метиловой группы при метилировании ДНК, биосинтезе компонентов клеточных мембран, гормонов, нейромедиаторов и т.д. В многоцентровом двойном слепом плацебо-контролируемом исследовании пациенты с холестазом получали S-аденозилметионин внутривенно в дозе 800 мг на протяжении 2 нед, затем продолжили прием препарата перорально в дозе 1600 мг в течение 8 нед. При сравнении с контролем в группе приема S-аденозилметионина наблюдалось значительное снижение уровней общего и конъюгированного билирубина, АЛТ, АСТ и ГГТ [21].
По сравнению с данными исследования [21] в настоящей работе отмечено более значительное изменение концентраций ГГТ в динамике терапии. Так, в указанном исследовании снижение уровня ГГТ составило всего –7 Ед/л при вычитании эффекта плацебо. По полученным нами результатам при вычитании эффекта плацебо наблюдался в 3 раза более выраженный эффект (–25 Ед/л).
ЗАКЛЮЧЕНИЕ / CONCLUSION
Терапия НАЖБП, затрагивающей существенную долю населения, актуальна для населения и России, и Японии. Пептидный препарат Лаеннек®, представляющий собой стандартизированный ГПЧ, оказывает полимодальное действие на регенерацию структуры и функции печени.
В работе представлены результаты открытого контролируемого исследования группы пациентов, госпитализированных с НАСГ или циррозом печени (что соответствует среднему и тяжелому течению НАЖБП). На момент начала исследования между группами терапии и контроля не было установлено достоверных различий в значениях показателей функции печени (АСТ, АЛТ, ГГТ и др.).
Субъективная симптоматика НАЖБП (утомляемость, анорексия, вздутие живота, запор, тошнота и боль в подреберье) улучшилась через 2–3 нед наблюдения. Однако уже к концу 1-й недели в группе получавших Лаеннек® зарегистрировано достоверное снижение уровней АСТ, АЛТ и ГГТ. На момент окончания исследования (3-я неделя) снижение концентраций в сторону интервала нормы было еще более выраженно для всех трех биомаркеров. Нежелательных явлений зарегистрировано не было. Таким образом, ГПЧ Лаеннек® является эффективным и безопасным средством лечения НАЖБП.
Список литературы
1. Powell E.E., Wong V.W., Rinella M. Non-alcoholic fatty liver disease. Lancet. 2021; 397 (10290): 2212–24. https://doi.org/10.1016/S0140-6736(20)32511-3.
2. Younossi Z.M., Koenig A.B., Abdelatif D., et al. Global epidemiology of nonalcoholic fatty liver disease – meta-analytic assessment of prevalence, incidence, and outcomes. Hepatology. 2016; 64 (1): 73–84. https://doi.org/10.1002/hep.28431.
3. Ивашкин В.Т., Драпкина О.М., Маев И.В. и др. Распространенность неалкогольной жировой болезни печени у пациентов амбулаторно-поликлинической практики в Российской Федерации: результаты исследования DIREG 2. Российский журнал гастроэнтерологии, гепатологии, колопроктологии. 2015; 25 (6): 31–41.
4. Цуканов В.В., Юркина А.С., Ушакова Т.А., Блинов Д.В. Эпидемиологические особенности неалкогольной жировой болезни печени в Новосибирске (Сибирский федеральный округ): региональные данные открытого многоцентрового проспективного исследования DIREG 2. ФАРМАКОЭКОНОМИКА. Современная фармакоэкономика и фармакоэпидемиология. 2016; 9 (2): 17–27. https://doi.org/10.17749/2070-4909.2016.9.2.017-027.
5. Eguchi Y., Wong G., Lee E.I., et al. Epidemiology of non-alcoholic fatty liver disease and non-alcoholic steatohepatitis in Japan: a focused literature review. JGH Open. 2020; 4 (5): 808–17. https://doi.org/10.1002/jgh3.12349.
6. Liu Y., Wang D.W., Wang D., et al. Exenatide attenuates non-alcoholic steatohepatitis by inhibiting the pyroptosis signaling pathway. Front Endocrinol (Lausanne). 2021; 12: 663039. https://doi.org/10.3389/fendo.2021.663039.
7. Xu X., Poulsen K.L., Wu L., et al. Targeted therapeutics and novel signaling pathways in non-alcohol-associated fatty liver/steatohepatitis (NAFL/NASH). Signal Transduct Target Ther. 2022; 7 (1): 287. https://doi.org/10.1038/s41392-022-01119-3.
8. Громова О.А., Торшин И.Ю., Чучалин А.Г., Максимов В.А. Гидролизаты плаценты человека: от В.П. Филатова до наших дней. Терапевтический архив. 2022; 94 (3): 434–41. https://doi.org/10.26442/00403660.2022.03.201408.
9. Громова О.А., Торшин И.Ю., Тихонова О.В., Згода В.Г. Гепатопротекторные пептиды препарата Лаеннек. Экспериментальная и клиническая гастроэнтерология. 2022; 203 (7): 21–30. https://doi.org/10.31146/1682-8658-ecg-203-7-21-30.
10. European Association for the Study of the Liver (EASL); European Association for the Study of Diabetes (EASD); European Association for the Study of Obesity (EASO). EASL-EASD-EASO Clinical Practice Guidelines for the management of non-alcoholic fatty liver disease. J Hepatol. 2016; 64 (6): 1388–402. https://doi.org/10.1016/j.jhep.2015.11.004.
11. Никонов Е.Л., Аксенов В.А. Современные подходы к диагностике и лечению неалкогольной жировой болезни печени. Профилактическая медицина. 2018; 21 (3): 62–9. https://doi.org/10.17116/profmed201831262.
12. Клинические рекомендации «Неалкогольная жировая болезнь печени» (проект). 2022. URL: https://rsls.ru/files/PR2022.pdf (дата обращения 10.08.2023).
13. Newsome P.N., Buchholtz K., Cusi K., et al. A placebo-controlled trial of subcutaneous semaglutide in nonalcoholic steatohepatitis. N Engl J Med. 2021; 384 (12): 1113–24. https://doi.org/10.1056/NEJMoa2028395.
14. Cusi K., Orsak B., Bril F., et al. Long-term pioglitazone treatment for patients with nonalcoholic steatohepatitis and prediabetes or type 2 diabetes mellitus: a randomized trial. Ann Intern Med. 2016; 165 (5): 305–15. https://doi.org/10.7326/M15-1774.
15. Lee C.H., Fu Y., Yang S.J., Chi C.C. Effects of omega-3 polyunsaturated fatty acid supplementation on non-alcoholic fatty liver: a systematic review and meta-analysis. Nutrients. 2020; 12 (9): 2769. https://doi.org/10.3390/nu12092769.
16. Xiang Z., Chen Y.P., Ma K.F., et al. The role of ursodeoxycholic acid in non-alcoholic steatohepatitis: a systematic review. BMC Gastroenterol. 2013; 23 (13): 140. https://doi.org/10.1186/1471230X-13-140.
17. Nadinskaia M., Maevskaya M., Ivashkin V., et al. Ursodeoxycholic acid as a means of preventing atherosclerosis, steatosis and liver fibrosis in patients with nonalcoholic fatty liver disease. World J Gastroenterol. 2021; 27 (10): 959–75. https://doi.org/10.3748/wjg.v27.i10.959.
18. Simental-Mendía M., Sánchez-García A., Simental-Mendía L.E. Effect of ursodeoxycholic acid on liver markers: a systematic review and meta-analysis of randomized placebo-controlled clinical trials. Br J Clin Pharmacol. 2020; 86 (8): 1476–88. https://doi.org/10.1111/bcp.14311.
19. Sanyal A.J., Chalasani N., Kowdley K.V., et al. Pioglitazone, vitamin E, or placebo for nonalcoholic steatohepatitis. N Engl J Med. 2010; 362 (18): 1675–85. https://doi.org/10.1056/NEJMoa0907929.
20. Bril F., Biernacki D.M., Kalavalapalli S., et al. Role of vitamin E for nonalcoholic steatohepatitis in patients with type 2 diabetes: a randomized controlled trial. Diabetes Care. 2019; 42 (8): 1481–8. https://doi.org/10.2337/dc19-0167.
21. Manzillo G., Piccinino F., Surrenti C., et al. Multicentre double-blind placebo-controlled study of intravenous and oral S-adenosyl-Lmethionine (SAMe) in cholestatic patients with liver disease. Drug Invest. 1994; 24: 90–100. https://doi.org/10.1007/BF03258369.
Об авторах
М. ИмавариЯпония
доктор философии, директор Института желудочно-кишечных заболеваний и заболеваний печени, больница общего профиля Син-Юригаока, Медицинский университет Дзичи
Симоцуке, Тотиги 329-0431, Япония
М. Нагасе
Япония
доктор философии, президент Японского медицинского общества клинической плацентарной медицины и клиники традиционной медицины Кичидзедзи
1-13-6-5F Кичидзёдзи, Мусасино-си, Токио 180-0004
И. Ю. Торшин
Россия
к.ф-м.н., к.х.н., старший научный сотрудник ФИЦ «Информатика и управление» РАН
ул. Вавилова, д. 44, корп. 2, Москва 211933
О. А. Громова
Россия
д.м.н., профессор, ведущий научный сотрудник ФИЦ «Информатика и управление» РАН
ул. Вавилова, д. 44, корп. 2, Москва 211933
Рецензия
Для цитирования:
Имавари М., Нагасе М., Торшин И.Ю., Громова О.А. Открытое контролируемое исследование клинических эффектов препарата Лаеннек® у пациентов с неалкогольным стеатогепатитом или циррозом печени. ФАРМАКОЭКОНОМИКА. Современная фармакоэкономика и фармакоэпидемиология. 2023;16(3):447-455. https://doi.org/10.17749/2070-4909/farmakoekonomika.2023.206
For citation:
Imawari M., Nagase M., Torshin I.Yu., Gromova O.A. An open-label, controlled trial of the clinical effects of Laennec® in patients with nonalcoholic steatohepatitis or cirrhosis. FARMAKOEKONOMIKA. Modern Pharmacoeconomics and Pharmacoepidemiology. 2023;16(3):447-455. (In Russ.) https://doi.org/10.17749/2070-4909/farmakoekonomika.2023.206

Контент доступен под лицензией Creative Commons Attribution-NonCommercial-ShareAlike 4.0 International License.






































