Перейти к:
О перспективах применения производных витамина В12 в фармакологии
https://doi.org/10.17749/2070-4909/farmakoekonomika.2023.198
Аннотация
Актуальность. Структура тетрапиррольных макроциклов корринов (соединений, схожих по строению с витамином В12) представляет собой своего рода универсальный химический шаблон для таргетной доставки лекарств, разработки химических сенсоров и антидотов.
Цель: систематизация информации о таргетной модуляции свойств корринов посредством химических модификаций.
Материал и методы. Проведен анализ литературы с использованием современных методов топологического и метрического анализа данных. Из базы данных PubMed/MEDLINE были извлечены все релевантные публикации (n=863) по запросу “(cobalamin OR Cobyrinic OR vitamin B12) AND (Molecular Conformation [MeSH Terms] OR Vitamin B 12/*analogs & derivatives/*chemistry [MeSH Terms] OR Vitamin B 12/*chemistry [MeSH Terms] OR Structure-Activity Relationship [MeSH Terms])”.
Результаты. Систематизирована информация о том, каким образом можно регулировать свойства производных витамина В12 (кобаламина) путем введения специфических замещений групп в корриновом кольце, о химических модификациях производных кобаламина, биосинтетических подходах к синтезу его производных и эффектах взаимодействий этих модифицированных корринов с «малыми» неорганическими и органическими молекулами.
Заключение. Полученные результаты систематического компьютерного анализа публикаций о корринах позволяет обоснованно формировать выборки молекул – кандидатов для исследований корринов in silico, in vitro и in vivo.
Ключевые слова
Для цитирования:
Торшин И.Ю., Громова О.А., Майорова Л.А. О перспективах применения производных витамина В12 в фармакологии. ФАРМАКОЭКОНОМИКА. Современная фармакоэкономика и фармакоэпидемиология. 2023;16(3):501-511. https://doi.org/10.17749/2070-4909/farmakoekonomika.2023.198
For citation:
Torshin I.Yu., Gromova O.A., Maiorova L.A. The prospects for the use of vitamin B12 derivatives in pharmacology. FARMAKOEKONOMIKA. Modern Pharmacoeconomics and Pharmacoepidemiology. 2023;16(3):501-511. (In Russ.) https://doi.org/10.17749/2070-4909/farmakoekonomika.2023.198
ВВЕДЕНИЕ / INTRODUCTION
Помимо регуляции метаболизма фолатов, уровней гомоцистеина, метилирования ДНК и деления клеток витамин B12 важен для поддержания многих других клеточных процессов. В частности, генетические дефекты метаболизма кобаламина приводят к глобальному нарушению регуляции альтернативного сплайсинга матричных РНК, что негативно сказывается на синтезе функциональных белков и приводит к усилению апоптоза клеток [1]. Однако химическая структура кобаламинов позволяет предполагать еще более широкий круг применения кобаламина и его производных в современной биомедицине.
Кобаламин (витамин В12) является представителем корролов – тетрапиррольных макроциклов, содержащих прямые химические связи между пирроловыми ядрами. Точнее, кобаламин является коррином – т.е. корролом, в котором удален один из метиленовых мостиков между циклами пирролов. Геометрическая конфигурация корринового кольца кобаламина с четырьмя плоскими лигандами азота может стабилизировать центральные атомы металлов в высоких степенях окисления (Co(IV), Cr(V), Mn(IV) и др.). Благодаря множеству возможных вариантов химических модификаций производные корринов могут иметь широкое применение в фармацевтической химии, служа основой для антидотов, систем таргетной доставки лекарств, химических сенсоров (в т.ч. для газов), катализаторов, фотосенсибилизаторов и др. [2]. Ион кобальта в кобаламинах может принимать различные степени окисления (Co(III), Co(II), Co(I)), поэтому эти молекулы весьма перспективно использовать в качестве катализаторов различных окислительно-восстановительных процессов [3], включая синтез лекарств и обезвреживание токсинов.
Коррины способны образовывать наночастицы и тонкопленочные «топологические» органические материалы с регулируемыми свойствами [4], что делает их особо актуальной группой веществ для изучения в качестве перспективных компонентов таргетной (адресной) доставки лекарств. Например, кобаламин, играя роль центрального структурообразующего элемента, может стабилизировать полимерные капсулы (на основе полиаллиламина или полистиролсульфоната) и лиотропные жидкокристаллические наносистемы (на основе фитантриола) [5]. Обозначены перспективы применения производных витамина В12 для адресной доставки перорально активного эритропоэтина [6]. Предложена концепция наноструктурирования соединений данного класса на границе воздуха и воды, а также модель плавающего слоя, структурными единицами которого могут быть как отдельные молекулы (подход Ленгмюра, частный случай), так и их основные наноструктуры (так называемые М-наноструктуры, общий случай) [7–12].
Нами продемонстрирована возможность супрамолекулярного дизайна на границе раздела воды и воздуха путем контролируемой самосборки органических соединений в 2D- и 3D-наноструктурах [13][14]. Созданы супрамолекулярные наноструктуры производного витамина В12 – гептабутилового эфира цианоаквакобириновой кислоты (ГбЭЦАКК), уникальные наночастицы с сильными нековалентными межмолекулярными взаимодействиями, особыми свойствами и активностью [13]. Полученные наноструктуры ГбЭЦАКК не только воспроизводят функциональные свойства комплексов витамина В12 с белками в живых организмах и действуют как витамин В12-зависимые ферменты, но и демонстрируют важные преимущества перед витамином В12. Эти наноструктуры при выполнении перспективных задач являются альтернативой широко используемым материалам на основе благородных металлов для катализа, медицины и защиты окружающей среды. Представляет особый интерес их использование в терапевтических целях [13].
Принимая во внимание достаточно широкий спектр возможных применений корринов в медицине, важно разрабатывать способы таргетной модуляции тех или иных свойств производных витамина В12 посредством специфических модификаций корринового ядра.
Цель – систематизация информации о таргетной модуляции свойств корринов посредством химических модификаций.
МАТЕРИАЛ И МЕТОДЫ / MATERIAL AND METHODS
Поиск публикаций / Search for publications
По запросу “(cobalamin OR Cobyrinic OR vitamin B12) AND (Molecular Conformation [MeSH Terms] OR Vitamin B 12/*analogs & derivatives/*chemistry [MeSH Terms] OR Vitamin B 12/*chemistry [MeSH Terms] OR Structure-Activity Relationship [MeSH Terms])” все релевантные статьи (n=863) были извлечены из базы данных PubMed/ MEDLINE. Контрольная группа была сформирована путем выбора 860 случайных публикаций из 235 955, найденных с помощью запроса “(Molecular Conformation [MeSH Terms] OR analogs & derivatives/*chemistry [MeSH Terms] OR Structure-Activity Relationship [MeSH Terms]) NOT cobalamin NOT Cobyrinic NOT vitamin B12”.
Методы анализа / Methods of analysis
Анализ литературы на основе этих двух выборок проводили с использованием современных методов топологического и метрического анализа больших данных, разрабатываемых в научной школе академика РАН Ю.И. Журавлёва [15–17]. При сравнении двух классов текстов (публикации по теме и контрольная выборка) выполняется комбинаторный анализ условия разрешимости (т.е. условия 100%-го различения всех текстов в одном классе от всех текстов в другом классе) на различных выборках признаков, порождаемых над текстовой информацией. Для порождения признаков над текстами используется топологическая теория анализа данных, в рамках которой информативность каждого из порождаемых признаков («представительных наборов» по Ю.И. Журавлёву) оценивается посредством введения специальных метрик.
В результате метрического анализа литературы были выделены информативные биомедицинские термины, отличающие публикации по теме от использования комбинаторной теории контроля разрешимости задач классификации. Определены наиболее информативные, репрезентативные тексты с максимальной частотой встречаемости полученного набора информативных терминов. Это позволило систематизировать информацию о химических модификациях кобаламина, биосинтетических подходах и взаимодействиях кобаламинов, в т.ч. с малыми молекулами и белками, которая представлена ниже в виде «традиционного» обзора литературы.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ / RESULTS AND DISCUSSION
О химических модификациях производных кобаламина / Chemical modifications of cobalamin derivatives
Витамин B12 (кобаламин) представляет собой специфическое тетрапиррольное соединение с тремя ацетамидами и четырьмя пропионамидами, присоединенными к периферии корринового макроцикла. Пятичленные пиррольные кольца (рис. 1) помечаются заглавными латинскими литерами от A до D, нумерация корринового кольца начинается с кольца A и идет по часовой стрелке вокруг макроцикла. На рисунке 1 каждая амидная группа отмечена красным цветом и обозначена строчными латинскими литерами от a до g.
Центральный ион кобальта координируется четырьмя пиррольными атомами азота и двумя аксиальными (пятым и шестым) лигандами, расположенными по обеим сторонам корринового кольца (альфа-лиганд – под плоскостью рисунка, бета-лиганд – над плоскостью). В кобаламине пятым (т.е. бета-лигандом) является ион цианида, а шестым (т.е. альфа-лигандом) – атом азота, диметилбензимидазольного «хвоста» молекулы. Другой азот диметилбензимидазола связан с пятиуглеродным сахаром (рибозой), несущим группу R5'-OH. Этот фрагмент рибозы присоединен (через фосфатную группу) к пропионамидной группе в f-положении корринового кольца [18].
Модификации кобаламина (Cbl) можно проводить по каждой из указанных позиций, используя технологии органического синтеза, координационной химии или биосинтеза. Например, селективные замены аксиальных лигандов центрального иона кобальта дают широкий спектр новых производных Cbl. Другие селективные реакции могут проводиться в положении 5'-ОН путем взаимодействия с ангидридами. 5'-ОН также может быть преобразован либо в карбоновую кислоту (5'-CO2H), либо в азид (5'-N3). Другие, менее селективные реакции включают частичный гидролиз, который дает монокислоты в положениях b, d или e. Полное удаление фрагмента рибозы дает кобириновую кислоту (Cby), которую можно сочетать с различными простыми и сложными группами для синтеза производных. Частичное расщепление хвостового конца дает кобинамид (Cbi) и т.д.
Модификации макроциклического корринового ядра исследуются достаточно редко. Наиболее часто изучаются производные кобириновой кислоты (в частности, гидрофобные гептаэфиры – сложные эфиры по всем семи позициям от a до g). Как и в случае с кобаламином, возможен синтез Cby(OMe)6(c-лактона), который может быть восстановлен до Cby(OMe)6(c-CO2H) или раскрыт с использованием первичных аминов (с образованием c/d-амидов). В этом случае промежуточный спиролактон можно выделить и восстановить до d-кислоты. Аминолиз Cby(OMe)6(c-лактон) приводит к гидрофобным и гидрофильным кобинамидам [18].
Придерживаясь нескольких простых правил, названия производных витамина B12 можно систематизировать с помощью приведенных выше обозначений. Например, C5-nor-(CN)Cbl относится к цианокобаламину, в котором отсутствует метильная группа в положении C5. Отщепление рибозной части вместе с фосфатной и диметилбензимидазольной группами дает кобинамид (Cbi). Гептаметиловый эфир дицианокобириновой кислоты обозначается как (CN)2Cby(OMe)7, введение хлора в положение 10 этой молекулы записывается как (CN)2Cby(OMe)7(10–Cl) и т.д. [18]. Соответственно, практически любое производное витамина В12 может быть представлено с использованием одной и трех фундаментальных корриновых структур: кобаламина (Cbl), кобириновой кислоты (Cby) или кобинамида (Cbi).
О биосинтетических подходах к синтезу производных кобаламина / Biosynthetic approaches to the synthesis of cobalamin derivatives
Перспективным подходом для тонкого синтеза производных кобаламина является использование фрагментов биосинтетических путей витамина В12, которые были обнаружены в различных организмах – прежде всего, в аэробных бактериях (например, Pseudomonas denitrificans) и в анаэробных бактериях (например, Propionibacterium shermanii). Известны способы получения интермедиатов биосинтеза кобириновой кислоты суспензиями анаэробов Propionibacterium shermanii [19]. В частности, выделены такие редкие производные, как диамид кобириновой кислоты (a,c-изомер), одиночный триамид, Co-(5'-дезокси-5'-аденозил) производное a,c-диамида [20].
Изучение пути биосинтеза корринового ядра молекулы кобаламина в анаэробе Bacillus megaterium позволило выделить все интермедиаты между уропорфириногеном III и кобириновой кислотой, а также охарактеризовать ферменты, катализирующие соответствующие реакции (CbiF, CbiG, CbiD, CbiJ, CbiET, CbiC). Гены cbiA, -D, -F, -J, -L, cysGA необходимы для превращения уропорфириногена III в а,с-диамид кобириновой кислоты [21]. Был осуществлен in vitro синтез кобириновой кислоты из 5-аминолевулиновой посредством смеси 14 очищенных ферментов. В результате выделены уникальные промежуточные соединения – прекоррины-6А, -6В и -8. Ион кобальта в этих соединениях играет важную роль в катализе взаимопревращений промежуточных продуктов. Установлены ультрафиолетовые спектры и спектры электронного парамагнитного резонанса для ряда промежуточных соединений [22]. Выделены и охарактеризованы 14 ферментов/генов, вовлеченных в синтез аденозилкобинамида из уропорфириногена III в анаэробе Propionibacterium freudenreichii (P.shermanii) (полная схема биосинтеза представлена в статье [23]).
Биосинтез витамина B12 в аэробных бактериях Pseudomonas denitrificans использует три центральных фермента (CobG, CobJ, CbiH) для превращения прекоррина-3 в промежуточное соединение с сокращенным кольцом – кобальт-прекоррин-4. Фермент CobG представляет собой монооксигеназу, которая добавляет гидроксильную группу, полученную из молекулярного кислорода, к C-20, тогда как фермент CobJ вводит метильную группу в положение C-17 макроцикла и катализирует сокращение кольца. Фермент CbiH отвечает за сокращение кольца и лактонизацию с образованием кобальт-прекоррина-4. Эти процессы происходят только в присутствии иона кобальта [24].
В целом для превращения уропорфириногена III в кобаламин требуется около 25 ферментов. У аэробов Pseudomonas denitrificans процесс превращения уропорфириногена III в аденозилкобириновую кислоту требует участия не менее 15 ферментов (CobA, -I, -G, -J, -M, -F, -L, -K, -H, -B, -N, -S, -T, -O, -Q). Первый из этих ферментов, трансметилаза уропорфириногена III, превращает последний в прекоррин-2 посредством двух S-аденозил-1-метионинзависимых трансметилирований в положениях 2 и 7. Дальнейшее метилирование в положении С-20 катализируется трансметилазой прекоррина-2 и приводит к образованию прекоррина-3а, который является субстратом для CobG, нуждающегося в молекулярном кислороде. Этот фермент усиливает лактонизацию прекоррина-3а с образованием прекоррина-3b. Сокращение кольца прекоррина-3b способствует последующему трансметилированию положения С-17 (катализируется CobJ) с образованием прекоррина-4. Последующие реакции, в т.ч. S-аденозилметионин-зависимое трансметилирование (посредством CobM, -F и -L), деацилирование (CobF), восстановление макроциклического кольца (CobK), декарбоксилирование (CobL), метильная перегруппировка (CobH) и амидирование (CobB) приводят к образованию а,с-диамида гидрогенобириновой кислоты. Хелатирование кобальта ферментным комплексом CobN/-S/-T с последующим восстановлением кобальта, амидированием остальных периферических боковых цепей и аденозилированием (CobQ) приводит к образованию аденозилкобириновой кислоты (рис. 2).
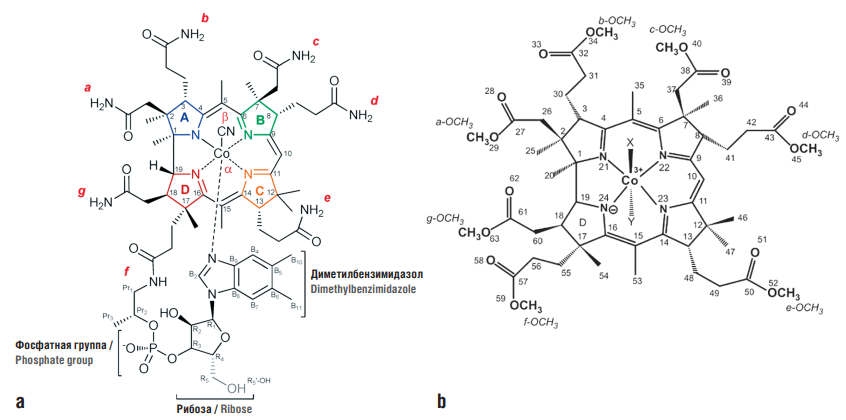
Рисунок 1. Химическая номенклатура модифицируемых позиций в корриновом кольце витамина B12:
a – обозначения пятичленных пиррольных колец и общая нумерации атомов корринового кольца (каждая амидогруппа отмечена красным цветом); b – нумерация в гидрофобном производном – гептаметиловом эфире цианоаквакобириновой кислоты
Figure 1. Chemical nomenclature of modifiable positions in vitamin B12 corrin ring:
a – designations of five-membered pyrrole rings and general numbering of corrine ring atoms (each amido group is marked in red); b – numbering in the hydrophobic derivative – heptamethyl ester of cyanoaquacobyric acid
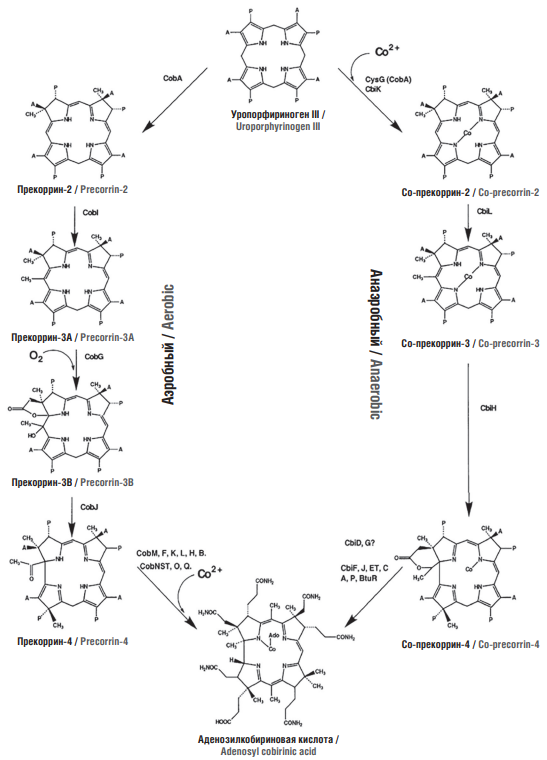
Рисунок 2. Основные этапы анаэробного и аэробного путей биосинтеза аденозилкобириновой кислоты. В аэробном пути в качестве субстрата требуется молекулярный кислород, а кобальт добавляется сравнительно поздно. В анаэробном пути кобальт добавляется уже на стадии прекоррина-2
Figure 2. Major steps in anaerobic and aerobic pathways for adenosylcobyric acid biosynthesis. In the aerobic pathway, molecular oxygen is required as a substrate, and cobalt is added relatively late. In the anaerobic pathway, cobalt is added already at precorrin-2 stage
Сравнение путей биосинтеза аэробных и анаэробных бактерий показало, что у анаэробов происходят обмен кислорода в положении С-27, выделение ацетальдегида и раннее введение кобальта. В аэробах не обнаруживается обмен кислорода в положении С-27, выделяется уксусная кислота, а ион кобальта включается в корриновое кольцо достаточно поздно (после того как произошло сокращение кольца) [24].
Важно отметить, что порядок изменений в корриновом ядре, индуцированных ферментами биосинтеза, может быть изменен путем внесения в структуру фермента специфических мутаций. Например, синтетаза кобириновой кислоты (CbiP), извлеченная из Salmonella typhimurium, катализирует глутамин/АТФ-зависимое1 амидирование карбоксилатов b, d, e и g в a,c-диамиде аденозилкобириновой кислоты. После каждого цикла катализа частично амидированные промежуточные продукты высвобождаются в раствор, так что четыре карбоксилата амидируются в последовательности e, d, b, g. Введение мутации D146N в фермент CbiP изменяет последовательность амидирования (d, e, g, b) [25].
Взаимодействие производных кобаламина с различными лигандами / Interaction of cobalamin derivatives with diverse ligands
Комплексообразующие свойства иона кобальта, находящегося в центре кобаламина, могут модулироваться путем описанных выше преобразований, в т.ч. введением тех или иных аксиальных лигандов (прежде всего, молекул воды). В результате посредством иона кобальта производные витамина В12 могут взаимодействовать с различными «малыми молекулами» как в газообразной, так и в жидкой среде.
Например, аквакобаламин можно использовать как противоядие при отравлении цианидами, нитропруссидом натрия, диаквакобинамид – антидот против цианида, сероводорода, метилмеркаптана [3], восстановленный гидроксокобаламин – антидот при остром отравлении угарным газом [26]. Диаквакобинамид и гидроксиаквакобинамид могут связывать до двух цианид-ионов, что можно использовать для фотометрического определения цианидов в поточном анализаторе [27]. ГбЭЦАКК образует прочные комплексы с цианидом и сероводородом в водных растворах [3]. Аквакобаламин реагирует с нитроксилом (HNO), генерируемым N-гидроксибензолсульфонамидом [28].
Кобаламин Cbl(II) быстро окисляется хлорноватистой кислотой HOCl до аквакобаламина/гидроксикобаламина Cbl(III) [29]. Хлорит-анион ClO2– не реагирует с аквакобаламином, но окисляет кобальт Co(II) до Co(III) в H2O-Cbl(II). Реакция между H2O-Cbl(II) и хлорит-радикалом ClO2• протекает быстро и также приводит к окислению Co(II) [30]. В то же время другая прооксидантная молекула, перекись водорода, обратимо связывается с аквакобаламином, образуя аддукт [31].
Диаквакобинамид реагирует с сероводородом в водном растворе. Данная реакция протекает в три стадии [32]:
1) образование комплексов между кобинамидом и сероводородом – (HO–)(HS-)Cbi(III), (H2O)(HS–)Cbi(III) и (HS–)2Cbi(III);
2) перенос электрона в двух комплексах с одним координированным HS– с образованием восстановленного кобинамидного комплекса [(H)S]Cbi(II);
3) добавление второй молекулы сероводорода к восстановленному кобинамиду (основной продукт этой реакции – комплекс (SSH2–) Cbi(II).
Особый интерес представляют взаимодействия кобаламиновых производных с органическими молекулами. Это направление исследований весьма важно как для поиска лекарств-антидотов при ятрогенной интоксикации, так и для противодействия побочным эффектам некоторых токсичных лекарств. Например, были показаны защитные эффекты витамина B12 в отношении нефротоксичности метотрексата, используемого для химиотерапии [33]. Аквакобаламин ускоряет разрушение азокрасителя Orange II (Acid Orange 7, используется для окрашивания шерсти) анионом пероксимоносульфатом HSO5– в водном растворе [34].
В модели судорог, вызванных токсическим поражением крыс тиосемикарбазидом, аквакобаламин, цианокобаламин и ГбЭЦАКК проявляли спазмолитическое, нейропротекторное и миелинизирующее действие. Установлено и спектрометрически охарактеризовано прямое взаимодействие молекулы тиосемикарбазида с аквакобаламином [3].
Пероральный прием каптоприла широко используется для лечения гипертонии, застойной сердечной недостаточности и других сердечно-сосудистых заболеваний. С повышенными дозами каптоприла ассоциирован ряд нежелательных побочных эффектов. Координация каптоприла с бета-аксиальным сайтом аквакобаламина значительно улучшала абсорбцию терапевтического средства. В данном комплексе каптоприл взаимодействует с кобаламином через тиоловую группу, причем и тиоловая (RSH), и тиолатная (RS–) формы каптоприла быстро реагируют с аквакобаламином [35].
Комплексы имидазолилкобаламина (ImCbl), гистидинилкобаламина (HisCbl), аквакобаламина с транспортным белком транскобаламином были охарактеризованы кристаллографически. Бета-аксиальные расстояния связи Co-N для ImCbl и HisCbl составлили 1,94 Å и 1,95 Å соответственно, а альфа-аксиальные расстояния Co-N – 2,01 Å и 1,98 Å. Такие расстояния типичны для кобаламинов со слабыми сигма-донорными лигандами в бета-аксиальном сайте [36].
Витамин В2 (рибофлавин) оказывает каталитическое действие на перенос электронов от восстановленной формы никотинамидадениндинуклеотида (НАДН) к аквакобаламину. Это взаимодействие приводит к образованию восстановленного кобаламина и протекает через замещение воды на аквакобаламине на НАДН с дальнейшим распадом комплекса НАДН-Сbl(III) до Сbl(II) и НАДН+. Рибофлавин катализирует восстановление аквакобаламина [37].
Сравнение взаимодействий ГбЭЦАКК и гексаметилового эфира желтой кобириновой кислоты (аквациано-стабильный желтый корриноид, AЦСЖК) с алифатическими и ароматическими аминами указало на существенные отличия. При окислении углерода С5 корринового кольца в AЦСЖК частично нарушается делокализация электронов в кольце коррина, снижая электронную плотность вокруг иона кобальта. Данные ультрафиолетовых спектров и квантовомеханические расчеты указывают на большее перекрытие между орбиталями коррина и металла в ГбЭЦАКК по сравнению с AЦСЖК [38]. Модификация электронной структуры экваториального лиганда в корринах кобальта может изменить термодинамику и кинетику его реакций с экзогенными лигандами [39].
Действительно, нарушение пи-системы в AЦСЖК изменяет взаимодействия иона кобальта с N-донорными лигандами (аммиак, этаноламин, 2-метоксиэтиламин, N-метилимидазол, 4-метилпиридин и др.). Комплексы алифатических аминов с ГбЭЦАКК образуют более короткие и прочные связи Co-N с менее ионным характером по сравнению со связями Co-N этих лигандов с AЦСЖК. И наоборот, связи Co-N с ароматическими аминами короче, прочнее и носят несколько менее ионный характер в комплексах с AЦСЖК, чем в комплексах с ГбЭЦАКК [40].
Белковые комплексы производных углеводов В12 / Protein complexes of B12 carbohydrate derivatives
Производные кобаламина проявляют неспецифические и специфические взаимодействия с белками. Исследование неспецифических кобаламин-белковых взаимодействий (например, с альбумином) различных производных важно для решения задач нанокапсулирования лекарств. Взаимодействия со специфическими белками протеома человека (в частности, с упоминаемыми ранее транскобаламинами) представляют интерес для модуляции активности протеома и для целевой доставки лекарств.
Изучен комплекс между бычьим сывороточным альбумином (БСА) и аквакобаламином. Сывороточный альбумин связывается с различными эндогенными лигандами и лекарствами. N-аксиальное положение кобаламина может быть занято аминокислотным остатком белка. Вследствие отсутствия специфических взаимодействий с БСА кобаламин связывается с БСА только при избытке белка, причем два тетрапиррольных кольца взаимодействуют с БСА через разные его сайты [41].
Изучение специфических взаимодействий витамина В12 и его производных с белками транскобаламинами позволяет использовать молекулярно-физиологические структуры организма для переноса молекул действующих начал лекарств. Прежде чем клетки смогут использовать кобаламин, входящий в состав пищи, витамин В12 должен быть доставлен внутрь клеток посредством особых транспортных систем. Во-первых, кобаламин из пищи связывается с внутренним фактором желудка, затем взаимодействует с эпителием подвздошной кишки через рецептор кубилин и транспортируется через кишечный эпителий посредством транскобаламина II. Во-вторых, транскобаламин II в комплексе с кобаламином поглощается клетками через белок-рецептор транскобаламина II (рецептор CD320 [34], димерный белок с молекулярной массой 62 кДа, экспрессируемый в клеточных плазматических мембранах) [43].
Анализ структуры комплексов цианокобаламина и кобинамида с белком транскобаламином показал, что структура специфических взаимодействий кобаламин-связывающих белков с корриновым кольцом аналогична для различных белков протеома человека. Центральный связывающий мотив этих белков взаимодействует с e- и f-боковыми цепями корринового кольца. Следовательно, группы в положениях е и f корринового кольца имеют принципиальное значение для взаимодействия производных витамина В12 с транспортными белками [44].
Производные кобириновой кислоты специфически взаимодействуют с растворимой гуанилатциклазой (рГЦ), ключевым ферментом сигнального пути NO/цГМФ2. Наличие амидной группы в c-/d-положении в производных кобириновой кислоты сильно влияет на уровень активации рГЦ. Такие производные могут активировать рГЦ через гем-связывающий или каталитический домен. Замена группы в d-положении корринового кольца оказывает сильное влияние на взаимодействия с рГЦ гидрофобных, но не гидрофильных производных витамина В12 [45].
Хемореактомный анализ in silico пяти производных витамина В12 (цианокобаламин, аквакобаламин, ГбЭЦАКК, ГЭ-дициано-КK и стабильный желтый корриноид) позволил нам получить оценки более 3500 фармакологических свойств этих молекул. Достоверных различий в токсичности исследуемых веществ не обнаружено. По классификации лекарственных веществ все исследованные соединения относятся к классу IV «Малотоксичные» (LD50 76–500 мг/кг)3 [46].
Судя по полученным оценкам полнопротеомных взаимодействий, цианокобаламин и аквакобаламин более безопасны, чем другие корриновые производные, а также характеризуются более низкими кумулятивными свойствами. Иследованные соединения накапливаются в различных тканях – например, стабильный желтый корриноид более эффективно накапливается в миелине, кератиноцитах и нейтрофилах. Кроме того, он обладает противовоспалительными свойствами, поэтому его накопление в нейтрофилах важно для более эффективного купирования воспаления. В то же время коррины ГбЭЦАКК, дициано-ГбЭЦАКК и стабильный желтый корриноид могут оказывать несколько большее противовоспалительное, антиагрегантное и обезболивающее действие, чем другие производные, что позволяет рекомендовать эти вещества для дальнейшего изучения в качестве болеутоляющих средств. Эти соединения также перспективны для исследований, направленных на лечение глиобластомы, гепатобластомы и Т-клеточного лейкоза (линии клеток SF-268, HepG2 и CEM-SS), поэтому могут быть полезны при лечении опухолей, соответствующих остальным изучаемым опухолевым клеточным линиям (SW480, BXPC-3, PT-45, NCI-H69, NCI-H446, CEM-SS). Хемонейроцитологический анализ соединений показал, что наибольшим нейропротекторным действием могут характеризоваться цианокобаламин и аквакобаламин: увеличение концентрации веществ на 1 ммоль/л приводит к увеличению оценки выживаемости нейронов на 25% [46].
Специфические взаимодействия с белками обусловливают нейропротекторные и микробиологические эффекты производных витамина В12. В модели судорог у крыс, вызванных тиосемикарбазидом, аквакобаламин, цианокобаламин и ГбЭЦАКК проявляли спазмолитическое, нейропротекторное и миелинизирующее действие [3]. Нейропротекторная активность кобаламина включает активацию белка PTBP1 и связанных с ним сигнальных сетей (при исследовании H2O2-индуцированного апоптоза в нейронах линии SH-SY5Y) [47].
Важно отметить, что нарушение специфического взаимодействия витамина В12 с протеомом может стимулировать развитие неврогенного, навязчивого кашля (характерного, в частности, для COVID-19). Дефицит кобаламина способствует развитию неврогенного кашля, приводя к появлению сенсорной невропатии и дисфункции вегетативной нервной системы, о чем свидетельствует гиперреактивность гортани у пациентов. Поэтому дефицит витамина В12 следует рассматривать среди факторов, поддерживающих хронический кашель, особенно когда триггеры кашля не могут быть идентифицированы [48].
Показана микробиологическая активность гидрофобных производных витамина В12 (алкилкобаламинов и ацилцианокобаламинов). Коэффициент распределения между органической и водной фазами показал, что гидрофобность алкилкобаламинов и ацилцианокобаламинов увеличивалась по мере удлинения углеродной цепи алкил/ацильной группы, введенной в кобаламин. Длинноцепочечные алкилкобаламины превращались в аквакобаламины под действием света, причем константа скорости фотолиза первого порядка уменьшалась с увеличением длины алкильной группы. Ацилцианокобаламины постепенно гидролизовались до витамина В12 в нейтральном или щелочном растворе, при этом скорость гидролиза возрастала с увеличением рН. Синтезированные алкилкобаламины поддерживали рост полезной микробиоты родов E. coli и Lactobacillus (хотя активность этих производных составляла всего 15–30% от активности кобаламина) [49].
ЗАКЛЮЧЕНИЕ / CONCLUSION
Систематизация в настоящей работе данных по ряду производных витамина В12 и их взаимодействиях с различными молекулами является важным шагом, предваряющим проведение комплексных оценок свойств этих молекул-кандидатов методами in silico, in vitro, in vivo (в частности, посредством масштабного хемореактомного моделирования фармакологических свойств корринов). Хемоинформационные исследования включают оценку взаимодействий изучаемых молекул с белками протеома и позволяют прогнозировать нейропротекторные, гепатопротекторные, антибактериальные, противоопухолевые и другие свойства молекул, включая моделирование результатов исследований на культурах клеток. Результаты систематического компьютерного анализа литературы позволили отобрать для дальнейших исследований такие производные витамина В12, как аквакобаламин, диаквакобинамид, производные кобириновой кислоты (аминоспирты, диамины, гептаметиловый и гептабутиловый сложные эфиры).
1. АТФ – аденозинтрифосфат.
2. цГМФ – циклический гуанозинмонофосфат.
3. LD50 (англ. lethal dose) – средняя доза вещества, вызывающая гибель половины членов испытуемой группы.
Список литературы
1. Rashka C., Hergalant S., Dreumont N., et al. Analysis of fibroblasts from patients with cblC and cblG genetic defects of cobalamin metabolism reveals global dysregulation of alternative splicing. Hum Mol Genet. 2020; 29 (12): 1969–85. https://doi.org/10.1093/hmg/ddaa027.
2. Vu T.T., Kharitonova N.V., Maiorova L.A., et al. Compression speed as a parameter changing the dimensionality of corrole nanostructures in layers at the air-water interface. Macroheterocycles. 2018; 11 (3): 286–92. https://doi.org/10.6060/mhc171260m.
3. Gromova O.A., Maiorova L.A., Torshin I.Y., et al. Vitamin B12 hydrophobic derivative exhibits bioactivity: biomedical and photophysical study. BioNanoSci. 2022; 12 (7): 74–82. https://doi.org/10.1007/s12668-021-00916-4.
4. Maiorova L.A., Vu T.T., Gromova O.A. Nanostructured stable floating m-monoand bilayers and langmuir-schaefer films of 5,10,15triphenylcorrole. BioNanoSci. 2018; 8 (1): 81–9. https://doi.org/10.1007/s12668-017-0424-0.
5. Maiorova L.A., Erokhina S.I., Pisani M., et al. Encapsulation of vitamin B12 into nanoengineered capsules and soft matter nanosystems for targeted delivery. Colloids Surf B Biointerfaces. 2019; 182: 110366. https://doi.org/10.1016/j.colsurfb.2019.110366.
6. Russell-Jones G.J., Westwood S.W., Habberfield A.D. Vitamin B12 mediated oral delivery systems for granulocyte-colony stimulating factor and erythropoietin. Bioconjug Chem. 1995; 6 (4): 459–65. https://doi.org/10.1021/bc00034a016.
7. Valkova L.A., Glibin A.S., Valli L. Quantitative analysis of compression isotherms of fullerene C60 Langmuir layers. Colloid J. 2008; 70: 6–11. https://doi.org/10.1134/S1061933X0801002X.
8. Valkova L.A., Glibin A.S., Koifman O.I. Influence of the solvent nature on the structure of two-dimensional nanoaggregates in langmuir layers of copper tetra-tert-butyltetrabenzotriazaporphyrin. Macroheterocycles. 2011; 4: 222–6.
9. Valkova L.A., Erokhin V.V., Glibin A.S., Koifman O.I. The influence of molecular structure and π-system extent on nanoand microstructure of Langmuir layers of copper azaporphyrins. J Porphyr Phthalocyanines. 2011; 15 (09n10): 1044–51. https://doi.org/10.1142/S1088424611004026.
10. Valkova L., Borovkov N., Maccioni E., et al. Influence of molecular and supramolecular factors on sensor properties of Langmuir–Blodgett films of tert-butyl-substituted copper azaporphyrines towards hydrocarbons. Colloids and Surfaces A: Physicochemical and Engineering Aspects. 2002; 198–200: 891–6. https://doi.org/10.1016/S0927-7757(01)01016-0.
11. Valkova L.A., Betrencourt C., Hochapfel A., et al. Monolayer study of monensin and lasalocid in the gas state. Molecular Crystals and Liquid Crystals Science and Technology. 1996; 287: 269–73. https://doi.org/10.1080/10587259608038763.
12. Valkova L.A., Shabyshev L.S., Feigin L.A., Akopova O.B. Formation and X-ray diffraction investigation of Langmuir-Blodgett films of liquid crystalline substituted crown esters. Molecular Crystals and Liquid Crystals Science and Technology. 1996; 6: 291–8.
13. Maiorova L.A., Kobayashi N., Salnikov D.S., et al. Supermolecular nanoentities of vitamin B12 derivative as a link in the evolution of the parent molecules during self-assembly at the air-water interface. Langmuir. 2023; 39: 3246–54. https://doi.org/10.1021/acs.langmuir.2c02964.
14. Карлюк М.В., Крыгин Ю.Ю., Майорова-Валькова Л.А. и др. Формирование двумерных (M) и трехмерных (V) наноагрегатов замещенного порфирина кобальта в ленгмюровских слоях и пленках Ленгмюра–Шефера. Известия Академии наук. Серия химическая. 2013; 62 (2): 471.
15. Torshin I.Yu., Rudakov K.V. On metric spaces arising during formalization of recognition and classification problems. Part 1: Properties of compactness. Pattern Recognit Image Anal. 2016; 26 (2): 274–84. https://doi.org/10.1134/S1054661816020255.
16. Torshin I.Yu., Rudakov K.V. Combinatorial analysis of the solvability properties of the problems of recognition and completeness of algorithmic models. Part 2: Metric approach within the framework of the theory of classification of feature values. Pattern Recognit Image Anal. 2017; 27 (2): 184–99. https://doi.org/10.1134/S1054661817020110.
17. Torshin I.Yu., Rudakov K.V. On metric spaces arising during formalization of problems of recognition and classification. Part 2: Density properties. Pattern Recognit Image Anal. 2016; 26 (3): 483–96. https://doi.org/10.1134/S1054661816030202.
18. Proinsias K., Giedyk M., Gryko D. Vitamin B12: chemical modifications. Chem Soc Rev. 2013; 42 (16): 6605–19. https://doi.org/10.1039/c3cs60062a.
19. Bergmann K.H., Deeg R., Gneuss K.D., et al. On the preparation of intermediates in cobyrinic acid biosynthesis by suspensions of Propionibacterium shermanii (author's transl). Hoppe Seylers Z Physiol Chem. 1977; 358 (10): 1315–23 (in German).
20. Kiuchi F., Leeper F.J., Battersby A.R. Biosynthesis of porphyrins and related macrocycles, Part 43. Isolation and characterization of intermediates of coenzyme B12 biosynthesis, a cobyrinic acid triamide, the a,c-diamide and their Co-(5'-deoxy-5'-adenosyl) derivatives, from Propionibacterium. Chem Biol. 1995; 2 (8): 527–32. https://doi.org/10.1016/1074-5521(95)90186-8.
21. Raux E., Lanois A., Rambach A., et al. Cobalamin (vitamin B12) biosynthesis: functional characterization of the Bacillus megaterium cbi genes required to convert uroporphyrinogen III into cobyrinic acid a,cdiamide. Biochem J. 1998; 335 (Pt. 1): 167–73. https://doi.org/10.1042/bj3350167.
22. Moore S.J., Lawrence A.D., Biedendieck R., et al. Elucidation of the anaerobic pathway for the corrin component of cobalamin (vitamin B12). Proc Natl Acad Sci U S A. 2013; 110 (37): 14906–11. https://doi.org/10.1073/pnas.1308098110.
23. Roessner C.A., Huang K.X., Warren M.J., et al. Isolation and characterization of 14 additional genes specifying the anaerobic biosynthesis of cobalamin (vitamin B12) in Propionibacterium freudenreichii (P. shermanii). Microbiology (Reading). 2002; 148 (Pt. 6): 1845–53. https://doi.org/10.1099/00221287-148-6-1845.
24. Santander P.J., Roessner C.A., Stolowich N.J., et al. How corrinoids are synthesized without oxygen: nature's first pathway to vitamin B12. Chem Biol. 1997; 4 (9): 659–66. https://doi.org/10.1016/s10745521(97)90221-0.
25. Fresquet V., Williams L., Raushel F.M. Partial randomization of the four sequential amidation reactions catalyzed by cobyric acid synthetase with a single point mutation. Biochemistry. 2007; 46 (49): 13983–93. https://doi.org/10.1021/bi7016238.
26. Roderique J.D., Josef C.S., Newcomb A.H., et al. Preclinical evaluation of injectable reduced hydroxocobalamin as an antidote to acute carbon monoxide poisoning. J Trauma Acute Care Surg. 2015; 79 (4 Suppl. 2): S116–20. https://doi.org/10.1097/TA.0000000000000740.
27. Ma J., Dasgupta P.K., Zelder F.H., Boss G.R. Cobinamide chemistries for photometric cyanide determination. A merging zone liquid core waveguide cyanide analyzer using cyanoaquacobinamide. Anal Chim Acta. 2012; 736: 78–84. https://doi.org/10.1016/j.aca.2012.05.028.
28. Polaczek J., Subedi H., Orzeł Ł., et al. Mechanistic studies on the reaction between aquacobalamin and the HNO donor piloty's acid over a wide pH range in aqueous solution. Inorg Chem. 2021; 60 (5): 2964– 75. https://doi.org/10.1021/acs.inorgchem.0c02968.
29. Dassanayake R.S., Farhath M.M., Shelley J.T., et al. Kinetic studies on the reaction of cob(II)alamin with hypochlorous acid: Evidence for one electron oxidation of the metal center and corrin ring destruction. J Inorg Biochem. 2016; 163: 81–7. https://doi.org/10.1016/j.jinorgbio.2016.07.009.
30. Dereven'kov I.A., Shpagilev N.I., Valkai L., et al. Reactions of aquacobalamin and cob(II)alamin with chlorite and chlorine dioxide. J Biol Inorg Chem. 2017; 22 (4): 453–9. https://doi.org/10.1007/s00775-016-1417-0.
31. Lehene M., Plesa D., Ionescu-Zinca S., et al. Adduct of aquacobalamin with hydrogen peroxide. Inorg Chem. 2021; 60 (17): 12681– 4. https://doi.org/10.1021/acs.inorgchem.1c01483.
32. Salnikov D.S., Makarov S.V., van Eldik R., et al. Kinetics and mechanism of the reaction of hydrogen sulfide with diaquacobinamide in aqueous solution. Eur J Inorg Chem. 2014; 2014 (25): 4123–33. https://doi.org/10.1002/ejic.201402082.
33. Ozturk E., Karabulut D., Akin A.T., et al. Evaluation by different mechanisms of the protective effects of vitamin B12 on methotrexate nephrotoxicity. J Mol Histol. 2022; 53 (1): 133–43. https://doi.org/10.1007/s10735-021-10027-9.
34. Dereven'kov I.A., Sakharova E.S., Osokin V.S., Makarov S.V. Aquacobalamin accelerates Orange II destruction by peroxymonosulfate via the transient formation of secocorrinoid: a mechanistic study. Int J Mol Sci. 2022; 23 (19): 11907. https://doi.org/10.3390/ijms231911907.
35. Mukherjee R., McCaddon A., Smith C.A., Brasch N.E. Synthesis, synchrotron X-ray diffraction, and kinetic studies on the formation of a novel thiolatocobalamin of captopril: evidence for cis-trans isomerization in the beta-axial ligand. Inorg Chem. 2009; 48 (19): 9526– 34. https://doi.org/10.1021/ic900891y.
36. Hannibal L., Bunge S.D., van Eldik R., et al. X-ray structural characterization of imidazolylcobalamin and histidinylcobalamin: cobalamin models for aquacobalamin bound to the B12 transporter protein transcobalamin. Inorg Chem. 2007; 46 (9): 3613–8. https://doi.org/10.1021/ic070022n.
37. Dereven'kov I.A., Hannibal L., Makarov S.V., Molodtsov P.A. Catalytic effect of riboflavin on electron transfer from NADH to aquacobalamin. J Biol Inorg Chem. 2020; 25 (1): 125–33. https://doi.org/10.1007/s00775-019-01745-3.
38. Chemaly S.M., Brown K.L., Fernandes M.A., et al. Probing the nature of the Co(III) ion in corrins: the structural and electronic properties of dicyanoand aquacyanocobyrinic acid heptamethyl ester and a stable yellow dicyanoand aquacyanocobyrinic acid heptamethyl ester. Inorg Chem. 2011; 50 (18): 8700–18. https://doi.org/10.1021/ic200285k.
39. Chemaly S.M., Florczak M., Dirr H., Marques H.M. Probing the nature of the Co(III) ion in corrins: a comparison of the thermodynamics and kinetics of the ligand substitution reactions of aquacyanocobyrinic acid heptamethyl ester and stable yellow aquacyanocobyrinic acid heptamethyl ester. Inorg Chem. 2011; 50 (18): 8719–27. https://doi.org/10.1021/ic200288b.
40. Chemaly S.M., Kendall L., Nowakowska M., et al. Probing the nature of the Co(III) ion in corrins: comparison of reactions of aquacyanocobyrinic acid heptamethyl ester and aquacyano-stable yellow cobyrinic acid hexamethyl ester with neutral N-donor ligands. Inorg Chem. 2013; 52 (2): 1077–83. https://doi.org/10.1021/ic302386u.
41. Dereven'kov I.A., Hannibal L., Makarov S.V., et al. Characterization of the complex between native and reduced bovine serum albumin with aquacobalamin and evidence of dual tetrapyrrole binding. J Biol Inorg Chem. 2018; 23 (5): 725–38. https://doi.org/10.1007/s00775-0181562-8.
42. Alam A., Woo J.S., Schmitz J., et al. Structural basis of transcobalamin recognition by human CD320 receptor. Nat Commun. 2016; 7: 12100. https://doi.org/10.1038/ncomms12100.
43. Seetharam B., Yammani R.R. Cobalamin transport proteins and their cell-surface receptors. Expert Rev Mol Med. 2003; 5 (18): 1–18. https://doi.org/10.1017/S1462399403006422.
44. Furger E., Frei D.C., Schibli R., et al. Structural basis for universal corrinoid recognition by the cobalamin transport protein haptocorrin. J Biol Chem. 2013; 288 (35): 25466–76. https://doi.org/10.1074/jbc.M113.483271.
45. Giedyk M., ó Proinsias K., Kurcoń S., et al. Small alterations in cobinamide structure significantly influence sGC activation. ChemMedChem. 2014; 9 (10): 2344–50. https://doi.org/10.1002/cmdc.201402209.
46. Gromova O.A., Torshin I.Yu., Maiorova L.A., et al. Bioinformatic and chemoneurocytological analysis of the pharmacological properties of vitamin B12 and some of its derivatives. Journal of Porphyrins and Phthalocyanines. 2021; 25 (9): 835–42. https://doi.org/10.1142/S1088424621500644.
47. Zhong L., Zhou J., Chen X., et al. Quantitative proteomics study of the neuroprotective effects of B12 on hydrogen peroxide-induced apoptosis in SH-SY5Y cells. Sci Rep. 2016; 6: 22635. https://doi.org/10.1038/srep22635.
48. Bucca C.B., Culla B., Guida G., et al. Unexplained chronic cough and vitamin B-12 deficiency. Am J Clin Nutr. 2011; 93 (3): 542–8. https://doi.org/10.3945/ajcn.110.000802.
49. Takahata Y., Nishizawa A., Kojima I., et al. Synthesis, properties and microbiological activity of hydrophobic derivatives of vitamin B12. J Nutr Sci Vitaminol (Tokyo). 1995; 41 (5): 515–26. https://doi.org/10.3177/jnsv.41.515.
Об авторах
И. Ю. ТоршинРоссия
к.ф-м.н., к.х.н., старший научный сотрудник ФИЦ «Информатика и управление» РАН
ул. Вавилова, д. 44, корп. 2, Москва 119333
О. А. Громова
Россия
д.м.н., профессор, ведущий научный сотрудник ФИЦ «Информатика и управление» РАН
ул. Вавилова, д. 44, корп. 2, Москва 119333
Л. А. Майорова
Россия
д.ф-м.н., старший научный сотудник ФИЦ «Информатика и управление»
ул. Вавилова, д. 44, корп. 2, Москва 119333
Рецензия
Для цитирования:
Торшин И.Ю., Громова О.А., Майорова Л.А. О перспективах применения производных витамина В12 в фармакологии. ФАРМАКОЭКОНОМИКА. Современная фармакоэкономика и фармакоэпидемиология. 2023;16(3):501-511. https://doi.org/10.17749/2070-4909/farmakoekonomika.2023.198
For citation:
Torshin I.Yu., Gromova O.A., Maiorova L.A. The prospects for the use of vitamin B12 derivatives in pharmacology. FARMAKOEKONOMIKA. Modern Pharmacoeconomics and Pharmacoepidemiology. 2023;16(3):501-511. (In Russ.) https://doi.org/10.17749/2070-4909/farmakoekonomika.2023.198

Контент доступен под лицензией Creative Commons Attribution-NonCommercial-ShareAlike 4.0 International License.






































