Перейти к:
Возможности применения коэнзима Q10 для лечения заболеваний, сопряженных с дисфункцией митохондрий и хроническим воспалением
https://doi.org/10.17749/2070-4909/farmakoekonomika.2023.187
Аннотация
Актуальность. Ферментативный кофактор коэнзим Q10 (англ. coenzyme Q10, CoQ10) участвует в синтезе аденозинтрифосфата в митохондриях. Биосинтез CoQ10 снижается на фоне использования статиновых препаратов.
Цель: систематизация сведений о воздействии СоQ10 на хроническое вялотекущее системное воспаление, приводящее к развитию атеросклероза, патологий печени, поджелудочной железы и нейродегенерации.
Материал и методы. Проведен систематический компьютерный анализ 16 788 публикаций, найденных по запросу “coenzyme Q10 OR ubiquinone” в базе данных биомедицинских публикаций PubMed/MEDLINE. Использованы современные методы топологического и метрического анализа больших данных, разрабатываемые в научной школе академика РАН Ю.И. Журавлёва.
Результаты. CoQ10 принимает участие в регуляции воспаления, проявляет гиполипидемический, гепатопротекторный, нефро- протекторный, антиастенический, кардиопротекторный и нейропротекторный эффекты. CoQ10 благоприятно влияет на углеводный обмен и широкий круг неврологических заболеваний.
Заключение. Дотации CoQ10 улучшают гликемический контроль при инсулинорезистентности, функцию почек, полезны в терапии мигрени и нейродегенеративных патологий (болезнь Паркинсона и др.).
Ключевые слова
Для цитирования:
Громова О.А., Торшин И.Ю., Громов А.Н. Возможности применения коэнзима Q10 для лечения заболеваний, сопряженных с дисфункцией митохондрий и хроническим воспалением. ФАРМАКОЭКОНОМИКА. Современная фармакоэкономика и фармакоэпидемиология. 2023;16(3):466-480. https://doi.org/10.17749/2070-4909/farmakoekonomika.2023.187
For citation:
Gromova O.A., Torshin I.Yu., Gromov A.N. Possibilities of using coenzyme Q10 for the treatment of diseases associated with mitochondrial dysfunction and chronic inflammation. FARMAKOEKONOMIKA. Modern Pharmacoeconomics and Pharmacoepidemiology. 2023;16(3):466-480. (In Russ.) https://doi.org/10.17749/2070-4909/farmakoekonomika.2023.187
ВВЕДЕНИЕ / INTRODUCTION
Коэнзим Q10 (англ. coenzyme Q10, CoQ10) – неотъемлемый компонент митохондриальной цепи переноса электронов, участвующий в аэробном клеточном дыхании, при котором вырабатывается значительное количество аденозинтрифосфата. Литера «Q» в названии этого соединения соответствует слову «хинон» (англ. quinone), а «10» относится к количеству изопренильных химических субъединиц в «хвосте» молекулы (обычно 6–10) (рис. 1). В органах с самыми высокими потребностями в энергии (печень, сердце, мозг, почки) отмечены самые высокие концентрации CoQ10 [1].
Кроме того, CoQ10 влияет на экспрессию генов, участвующих в передаче сигналов, метаболизме и транспорте веществ в клетках [2]. Синтетические статины блокируют выработку промежуточного соединения мевалоната (биохимический путь, ведущий к выработке CoQ10), что снижает накопление CoQ10 в мышечной ткани, приводя к фибромиалгии, судорогам и рабдомиолизу [3].
Одной из важных особенностей действия СоQ10 является то, что он модулирует процесс так называемого инфламейджинга (англ. inflammation-aging – буквально «воспаление-старение») – хронического вялотекущего системного воспаления, приводящего к развитию атеросклероза, патологий печени, почек, поджелудочной железы, нейродегенерации и т.д. Основными показателями инфламейджинга являются повышенные уровни провоспалительных интерлейкинов ИЛ-1β, ИЛ-6, фактора некроза опухоли альфа (ФНО-α), С-реактивного белка (СРБ) и других маркеров воспаления в крови и тканях. Причины возникновения хронического системного воспаления включают неполноценную диету (в т.ч. гиперкалорийную с низким содержанием эссенциальных микронутриентов), дисбиоз желудочно-кишечного тракта, гиподинамию, хронический стресс и нарушения сна. Хроническое воспаление стимулирует, в частности, дегенерацию клеток черной субстанции среднего мозга (что способствует развитию болезни Паркинсона) [4] и нарушения ремиелинизации при рассеянном склерозе [5].
Цель: систематизация сведений о воздействии СоQ10 на хроническое вялотекущее системное воспаление, приводящее к развитию атеросклероза, патологий печени, поджелудочной железы и нейродегенерации.
МАТЕРИАЛ И МЕТОДЫ / MATERIAL AND METHODS
По запросу “coenzyme Q10 OR ubiquinone” в базе данных биомедицинских публикаций PubMed/MEDLINE было найдено 16 788 статей. Рассматривались все статьи любого формата с 1900 г. по настоящее время, для которых имелись полные абстракты.
Мы провели систематический компьютерный анализ массива публикаций с использованием современных методов топологического и метрического анализа данных научной школы академика РАН Ю.И. Журавлёва [6–8]. Вкратце, множества прецедентов включают описания объектов (т.е. текстов научных публикаций), состоящие из признакового описания (слов и словосочетаний текста) и информации о принадлежности каждого объекта к тому или иному классу (например, класс К1 – «публикации по теме», класс К2 – «контрольная выборка» и др.). Затем исследуется разрешимость поставленной задачи классификации текстов (т.е. непротиворечивость множеств прецедентов при заданном признаковом описании). Для эффективного установления выполнимости условия разрешимости вводится некоторый функционал информативности каждого признака относительно классов К1/К2 [7]. Вычисление условия на множестве прецедентов и лежит в основе использованного метода классификации текстов. В результате отбираются наиболее информативные признаки, гарантирующие разрешимость задачи классификации, далее проводится анализ метрической диаграммы, на которой отображены эти признаки. Нами было выделено 129 информативных биомедицинских терминов, отличающих публикации по фармакологии CoQ10 от всех остальных текстов.
Анализ позволяет утверждать, что в протеоме человека присутствует по крайней мере 192 CoQ10-зависимых белка, 94 из которых участвуют в поддержании функции печени, 26 – функции почек, 54 – функций центральной нервной системы. В настоящей работе рассмотрены противовоспалительные, антидиабетические, гепатопротекторные, нефропротекторные и нейропротекторные эффекты CoQ10.
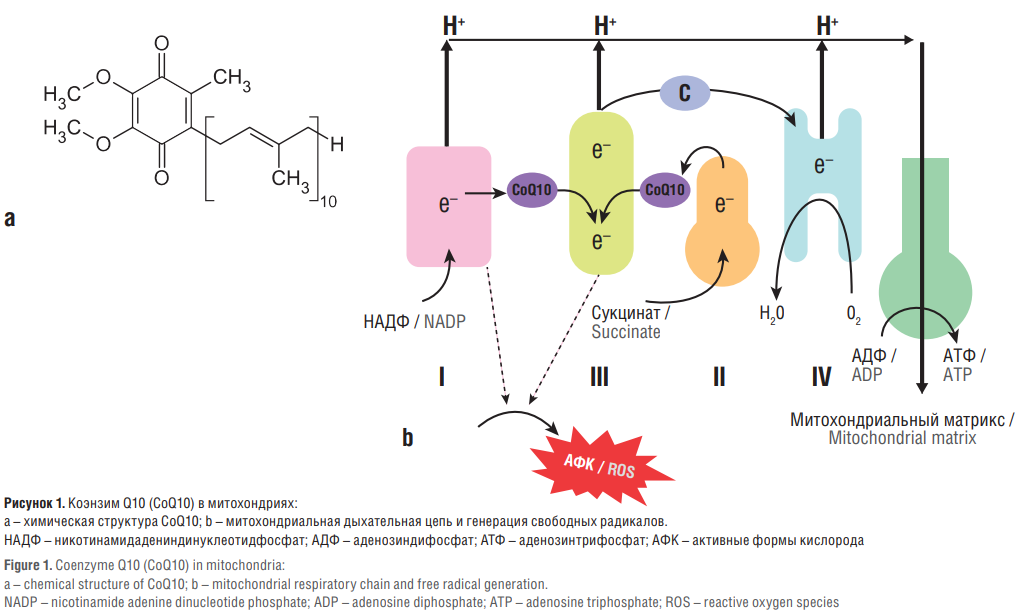
Рисунок 1. Коэнзим Q10 (CoQ10) в митохондриях:
a – химическая структура CoQ10; b – митохондриальная дыхательная цепь и генерация свободных радикалов.
НАДФ – никотинамидадениндинуклеотидфосфат; АДФ – аденозиндифосфат; АТФ – аденозинтрифосфат; АФК – активные формы кислорода
Figure 1. Coenzyme Q10 (CoQ10) in mitochondria:
a – chemical structure of CoQ10; b – mitochondrial respiratory chain and free radical generation.
NADP – nicotinamide adenine dinucleotide phosphate; ADP – adenosine diphosphate; ATP – adenosine triphosphate; ROS – reactive oxygen species
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ / RESULTS AND DISCUSSION
Противовоспалительные эффекты / Anti-inflammatory effects
Противовоспалительное действие CoQ10 может быть связано с антиоксидантными эффектами. Метаанализ 17 клинических исследований (n=972) показал, что CoQ10 повышает общую антиоксидантную способность сыворотки (+0,62 ммоль/л; 95% доверительный интервал (ДИ) 0,18…1,05; p=0,001) и снижает уровни малонового диальдегида (–1,02 ммоль/л; 95% ДИ –1,60…–0,44; р=0,001) [9].
Другим вероятным механизмом противовоспалительного действия CoQ10 является воздействие на транскрипцию определенных генов. В частности, при непрерывной и напряженной тренировке спортсменов в течение 6 дней отмечается повышение уровней моноцитов, экспрессирующих толл-подобный рецептор 4 (англ. toll-like receptor 4, TLR4). Дотации CoQ10 спортсменам (300 мг/сут, 20 дней) способствовали подавлению экспресиии TLR4 (рис. 2) [10].
Противовоспалительный эффект CoQ10 подтвержден в многочисленных клинических исследованиях и метаанализах. Метаанализ 5 рандомизированных исследований (n=159) показал, что дотации CoQ10 снижали уровень высокочувствительного С-реактивного белка (вч-СРБ) в сыворотке у пациентов с повышенными уровнями вч-СРБ (более 3 мг/л) [11]. Метаанализ 9 рандомизированных исследований (n=509) продемонстрировал, что прием CoQ10 (60–500 мг/сут, 8–12 нед) снижает уровни ФНО-α (–0,44 мг/дл; 95% ДИ –0,81…–0,07; p=0,001) и ИЛ-6 (–0,37 пг/мл; 95% ДИ –0,65…–0,09; p=0,01) при хронических воспалительных заболеваниях [12].
Метаанализ 17 рандомизированных исследований подтвердил, что у пациентов с сердечно-сосудистыми заболеваниями, ожирением, неалкогольной жировой болезнью печени (НАЖБП), сахарным диабетом 2-го типа (СД2) или заболеваниями почек дотации CoQ10 значительно снижали уровни маркеров острой фазы воспаления в крови: СРБ (–0,35 мг/л; 95% ДИ –0,64…–0,05; р=0,022), ИЛ-6 (–1,61 пг/мл; 95% ДИ –2,64…–0,58; р=0,002) и ФНО-α (средневзвешенная разница –0,49 пг/мл; 95% ДИ–0,93…–0,06; р=0,027) (рис. 3). Изменения СРБ не зависели от исходного уровня, продолжительности лечения или дозировки. Более высокий исходный уровень ИЛ-6 был ассоциирован с более сильным откликом на применение CoQ10 (р=0,006) [13].
Отметим, что метаанализ 11 клинических исследований продемонстрировал положительное влияние CoQ10 на пародонтит. CoQ10 значительно уменьшил индекс зубного налета (–0,64; 95% ДИ –1,03…–0,26; р=0,002), индекс кровотечения (–1,05; 95% ДИ –1,70…–0,41; р=0,001), глубину карманов (–0,96; 95% ДИ –1,35…–0,58; р=0,001) и десневой индекс (–0,63; 95% ДИ –0,97…–0,28; р=0,001) при пародонтите. Анализ в подгруппах показал, что CoQ10 оказывает более сильное восстанавливающее действие при внутрикарманном введении, чем при топическом [14].
Противовоспалительное действие CoQ10 важно для терапии сердечно-сосудистых патологий. Метаанализ 50 рандомизированных контролируемых исследований (n=2794) подтвердил, что прием CoQ10 в дозе 400–500 мг/сут положительно влияет на липидный профиль при гиперхолестеринемии, снижая уровни общего холестерина, липопротеинов низкой плотности (ЛПНП), триглицеридов и повышая уровень липопротеинов высокой плотности (ЛПВП). Анализ «доза – реакция» показал, что доза 400–500 мг/сут оптимальна для достижения максимального антигиперлипидемического эффекта (р<0,01) [15]. Метаанализ 11 исследований (n=1573) продемонстрировал, что применение CoQ10 у пациентов с хронической сердечной недостаточностью по сравнению с плацебо снижало риск смертности от всех причин на 42% (отношение шансов 0,58; 95% ДИ 0,35…0,95) и риск госпитализации в связи с сердечной недостаточностью на 38% (относительный риск 0,62; 95% ДИ 0,49…0,78) [16].
Метаанализ 12 рандомизированных исследований (n=575) подтвердил влияние CoQ10 на статин-индуцированную миопатию. Дотации CoQ10 уменьшали мышечную боль (–1,60; 95% ДИ –1,75…–1,44; р<0,001), слабость в мышцах (–2,28; 95% ДИ –2,79…–1,77; р=0,006), мышечные спазмы (–1,78; 95% ДИ –2,31…–1,24; р<0,001) и усталость мышц (–1,75; 95% ДИ –2,31…–1,19; р<0,001) [17].
Терапия нарушений углеводного обмена / Therapy of carbohydrate metabolism disorders
В модели диабета, вызванного сиролимусом у крыс, дотации CoQ10 per os (20 мг/кг) и метформина (250 мг/кг) снижали гипергликемию и индекс инсулинорезистентности (англ. Homeostasis Model Assessment of Insulin Resistance, HOMA-IR). Сиролимус индуцировал снижение интенсивности окрашивания инсулином островков поджелудочной железы, что сопровождалось снижением окислительного стресса и апоптоза [18]. Добавление CoQ10 к терапии метформином приводило к восстановлению функциональной ткани поджелудочной железы (рис. 4).
Метаанализ 14 рандомизированных исследований показал, что дотации СоQ10 снижают уровень глюкозы в крови натощак (в среднем на –0,20 г/л; 95% ДИ –0,38...–0,02) [19]. Метаанализ типа «доза – эффект», проведенный на основании данных 40 рандомизированных исследований пациентов с СД2 (n=2424), продемонстрировал, что прием CoQ10 значительно снижал уровень глюкозы натощак (–5,22 мг/дл; 95% ДИ –8,33…–2,11; р<0,001), инсулина натощак (–1,32 МЕ/мл; 95% ДИ –2,06…–0,58; р<0,001), HbA1c (–0,12%; 95% ДИ –0,23…–0,01; р=0,04) и индекс HOMA-IR (–0,69; 95% ДИ –1,00…–0,38; р<0,001) (рис. 5). Кривая зависимости «доза – реакция» в форме буквы U показала, что доза 100–200 мг/сут оптимальна для наибольшего положительного влияния на гликемический контроль при СД2 [20].
Прием CoQ10 пациентками с синдромом поликистозных яичников (n=86) в течение 8 нед оказал значительное влияние на снижение уровня сахара в крови натощак и индекса HOMA-IR. Дотации CoQ10 в сочетании с витамином Е значительно повысили уровень глобулина, связывающего половые гормоны, по сравнению с контролем (р=0,008) [21]. По сравнению с плацебо прием CoQ10 приводил к значительному снижению сывороточных уровней ФНО-α (p=0,009), вч-СРБ (p=0,001) и ИЛ-6 (p=0,007), протромботических белков VCAM-1 (р=0,002) и Е-селектина (р=0,006) в сыворотке по сравнению с контролем [22].
Метаанализ 9 рандомизированных исследований (n=1021) показал эффективность и безопасность дотаций CoQ10 при лечении синдрома поликистозных яичников. Добавление CoQ10 к стандартной терапии оказывало комплексное терапевтическое воздействие: снижались индекс HOMA-IR (–0,67; 95% ДИ –0,87…–0,48; р<0,00001), уровень инсулина натощак (–1,75; 95% ДИ –2,65…– 0,84; р=0,0002), уровень глюкозы в плазме натощак (–5,20; 95% ДИ –8,86…–1,54; р=0,005), уровни фолликулостимулирующего гормона (–0,45; 95% ДИ –0,11…–0,78; р=0,009) и тестостерона (–0,28; 95% ДИ –0,49…–0,06; р=0,01), триглицеридов (–0,494; 95% ДИ –0,89...–0,09; р=0,02), общего холестерина (–0,35; 95% ДИ –0,5…–0,14; р=0,001), ЛПНП (–0,22; 95% ДИ –0,43…–0,01; р=0,04) и повышались уровни ЛПВП (+0,22; 95% ДИ 0,01…0,43; р=0,04). Не было зарегистрировано нежелательных явлений, ассоциированных с приемом CoQ10 [23].
Поддержка функций печени и почек / Liver and kidney function support
В эксперименте у мышей линии C57BL/6J показано, что CoQ10, активируя сигнальный путь AMPK, тормозит развитие НАЖБП, вызванной диетой с высоким содержанием жиров (ВСЖ) у мышей. В течение 24 нед мыши получали обычную диету с ВСЖ или диету с ВСЖ и дотацией CoQ10 (1800 мг/кг). CoQ10 облегчал вызванное ВСЖ увеличение веса и НАЖБП, что сопровождалось антигиперлипидемическим эффектом за счет снижения уровней триглицеридов, общего холестерина и ЛПНП в сыворотке крови. При этом CoQ10 подавлял экспрессию белка SREBP-1c, связывающего ДНК-регуляторные элементы, ацетил-КоА-карбоксилазы и синтазы жирных кислот. Эти белки связаны с синтезом липидов и усиливают экспрессию рецепторов, активируемых пролифератором пероксисом, и карнитин-пальмитоилтрансферазы СРТ-1, ассоциированной с окислением жирных кислот. Ингибитор AMPK блокировал действие CoQ10, указывая на молекулярный путь реализации эффектов последнего (рис. 6) [24].
В модели фиброза почек у крыс CoQ10 снижал фибротические изменения паренхимы, ингибируя сигнальный путь некровоспаления RIP1-RIP3-MLKL, регулируя каскад Wnt/катенин/GSK-3 [25]. В клинике дотации селена (200 мкг/сут) и CoQ10 (200 мг/сут) улучшали функцию почек у пожилых пациентов с дефицитом селена (n=117), снижая концентрации креатинина и цистатина С в сыворотке крови (р=0,0002 по сравнению с плацебо) [26].
У пациентов на гемодиализе дотации CoQ10 (100 мг/сут, 3 мес) снижали уровень СРБ (р<0,001) и повышали уровни альбумина в крови (р=0,044) [27].
Пероральный прием CoQ10 способствует лучшему сохранению функции почек при стероид-резистентном нефротическом синдроме, возникшем вследствие дефицита CoQ10 (n=116). Дотации CoQ10 приводили к значительному и устойчивому снижению протеинурии на 88% через 12 мес и лучшему сохранению функции почек, оцененной как 5-летняя выживаемость без почечной недостаточности (CoQ10 – 62%, контроль – 19%) [28].
Метаанализ 7 клинических исследований продемонстрировал, что дотации CoQ10 существенно улучшали метаболический профиль у пациентов с хронической болезнью почек. Прием CoQ10 приводил к значительному снижению уровней общего холестерина (–0,58; 95% ДИ –0,94…–0,21; р=0,002), ЛПНП (–0,47; 95% ДИ –0,78…–0,17; р=0,003), малонового диальдегида (–3,0; 95% ДИ –5,10…–0,90; р=0,005) и креатинина (–1,65; 95% ДИ –2,75…–0,54; р=0,003) [29].
Применение у пациентов с неврологическими расстройствами / Use in patients with neurological disorders
Митохондриальная дисфункция и окислительный стресс играют ключевую роль в патогенезе различных неврологических расстройств (особенно нейродегенеративных) и вносят значительный вклад в процессы старения мозга. Устранение митохондриальной дисфункции и нейродегенерации с помощью CoQ10 важно для лечения болезни Паркинсона, болезни Гентингтона, бокового амиотрофического склероза и болезни Альцгеймера [30][31]. Кроме того, CoQ10 может ослаблять симптоматику психических расстройств на фоне митохондриальной миопатии и энцефалопатии [32].
В эксперименте CoQ10 ингибировал секрецию глутамата у крыс в цереброкортикальных нервах посредством потенциал-зависимых каналов Cav2.2 (N-тип) и Cav2.1 (P/Q-тип) и сигнального пути MAPK [33]. CoQ10 ингибировал эксайтотоксичность глутамата и окислительный стресс в экспериментальной модели глаукомы (линия мышей DBA/2J). Он способствовал повышению выживания клеток сетчатки на 29% и сохранял аксоны в головке зрительного нерва, ингибировал активацию астроглии за счет снижения экспрессии глиального фибриллярного кислого белка (англ. glial fibrillary acidic protein, GFAP), предотвращал апоптоз посредством снижения экспрессии белка Bax и увеличения экспрессии белка pBad (рис. 7, 8) [34].
Дотации CoQ10 (10 мг/кг, 4 нед) снижали ишемические повреждения мозга, вызванные кратковременной окклюзией средней мозговой артерии у крысы с гипергликемией, индуцированной стрептозотоцином. Предварительный прием CoQ10 значительно уменьшал балл неврологической дисфункции, объем инфаркта и число пикнотических клеток на фоне снижения экспрессии белка Fis1 и увеличения экспрессии белка Mfn2 в мозге [35].
У крыс с гиперхолестеринемией и нейродегенерацией, опосредованной окислительным стрессом, CoQ10 и полиненасыщенные жирные кислоты омега-3 (по отдельности или в комбинации) снижали окислительный стресс и воспаление головного мозга, регулировали холинергическую трансмиссию и улучшали функциональный результат. Нейропротекторный потенциал CoQ10 осуществлялся посредством антиоксидантной, противовоспалительной, антиамилоидной и холинергической активности. Таким образом, CoQ10 может служить важным дополнением к терапии болезни Альцгеймера с гиперхолестеринемией [36].
CoQ10 полезен для торможения диабетической невропатии. Дотации CoQ10 (100 или 600 мг/кг, 90 дней) снижали нарушения долгосрочной потенциации в зернистых клетках зубчатой извилины гиппокампа крыс со стрептозотоцин-индуцированным диабетом. Прием как низкой, так и высокой дозы CoQ10 увеличивал наклон возбуждающих постсинаптических потенциалов и амплитуду пиков долговременной потенциации в зернистых клетках (р<0,05), тем самым ослабляя неврологические эффекты модели диабета [37].
Дотации CoQ10 предотвращали периферическую невропатию и ослабляли потерю нейронов у мышей линии db-/db- (модель СД2). У мышей с этой моделью диабета в возрасте 8 мес наблюдались потеря чувствительности, гипоалгезия (повышение механического порога), холодовая аллодиния и нарушение скорости проведения по седалищному нерву. Эти изменения практически полностью отсутствовали после 6-месячного ежедневного лечения CoQ10 (начиная с возраста 7 нед). При этом потери нейронов в ганглиях задних корешков поясничного отдела были значительно снижены [38].
Комбинированный прием CoQ10 (10 мг/кг перорально, 5 нед) и альфа-липоевой кислоты (100 мг/кг) уменьшал диабетическую невропатию, вызванную стрептозотоцином у крыс. Комбинация «CoQ10 + липоевая кислота» ослабляла двигательную недостаточность, повышала уровни глутатиона, предотвращала апоптоз и дегенерацию нейронов [39].
Нейропротекторный эффект CoQ10 (в дозе 50 или 100 мг/кг, 10 нед) продемонстрирован в модели невропатической боли, вызванной алкоголем у крыс. CoQ10 вводили одновременно после этанола в течение 10 нед, что показало значительное и дозозависимое повышение уровня ноцицептивного порога, концентраций эндогенных антиоксидантов в крови, снижение уровней провоспалительных цитокинов ФНО-α, ИЛ-1β, ИЛ-4 и приводило к восстановлению скорости проводимости сенсорных и двигательных нервов [40].
Повышенный уровень гомоцистеина ускоряет гибель дофаминергических клеток при болезни Паркинсона за счет нейротоксических эффектов. Уровни CoQ10 при данном заболевании позволяют прогнозировать токсичность гомоцистеина. Метаанализ подтвердил, что у пациентов с болезнью Паркинсона снижены уровни CoQ10 в коре мозжечка, тромбоцитах и лимфоцитах, повышены уровни окисленного CoQ10 в спинномозговой жидкости. У больных с множественной системной атрофией наблюдалось снижение уровня CoQ10 в коре мозжечка, сыворотке/плазме, спинномозговой жидкости и фибробластах кожи. У пациентов с деменцией с тельцами Леви отмечено снижение содержания CoQ10 в коре мозжечка, а у больных с прогрессирующим надъядерным параличом – снижение уровня CoQ10 в спинномозговой жидкости [41].
Метаанализ 4 рандомизированных исследований применения СоQ10 (1200 мг/сут, 16 мес) у пациентов с паркинсонизмом (n=452) показал улучшение повседневной активности: снижение балла по единой шкале оценки болезни Паркинсона (англ. Unified Parkinson's Disease Rating Scale, UPDRS) на –3,12 (95% ДИ –5,88…–0,36) и повышение балла по шкале Шваба (+4,43; 95% ДИ 0,05…8,81). При этом прием CoQ10 даже в таких высоких дозах не приводил к достоверному увеличению частоты отказов от лечения вследствие побочных эффектов (относительный риск 0,61; 95% ДИ 0,23…1,62, р>0,1) [42].
Достаточная обеспеченность CoQ10, рибофлавином, никотинамидом, пантотеновой кислотой важна для поддержки функции митохондрий. В частности, дотации рибофлавина и СоQ10 являются безопасной и эффективной профилактической терапией мигрени, поскольку нарушения энергетического метаболизма при мигрени зачастую связаны с дисфункцией митохондрий [43]. Метаанализ 6 исследований роли CoQ10 в профилактике мигрени (n=371) показал, что CoQ10 по сравнению с плацебо уменьшал продолжительность приступов головной боли (–0,19; 95% ДИ –0,27…–0,11; p<0,00001) и частоту мигренозной головной боли (–1,52; 95% ДИ –2,40…–0,65; p<0,001) [44].
Дефицит CoQ10 усиливает нервно-психические расстройства, в т.ч. шизофрению. Рандомизированные контролируемые исследования CoQ10 в качестве единственного вмешательства показали его положительное влияние на утомляемость, когнитивные нарушения и аффективные расстройства у пациентов [45].
Сочетание с другими микронутриентами / Combination with other micronutrients
При сочетанном приеме CoQ10 с другими микронутриентами и нутрицевтиками его действие усиливается. Перспективно применение CoQ10 в комбинации с ферментированными экстрактами красного риса, содержащими полифенолы, проантоцианидины и природные статины.
В России представлен комплекс Lactoflorene® Холестерол (Montefarmaco OTC S.p.A., Италия) на основе ферментированного экстракта красного риса, стандартизированного по монаколину К (350,9 мг, 3% монаколина), который содержит ряд синергидных компонентов: коэнзим Q10 (21 мг), пребиотики сорбитол (1253 мг) и мальтодекстрин (1575,5 мг), пробиотические бифидобактерии лонгум ВВ536 (37,5 мг лиофилизата), витамин РР (никотинамид, 19,4 мг). Никотинамид необходим для синтеза никотинамидадениндинуклеотида, который является коферментом белков, вовлеченных в синтез аденозинтрифосфата из жиров и углеводов. CoQ10 в сочетании с никотинамидом и другими синергидными компонентами способствует снижению системного воспаления, компенсации нарушений обмена углеводов и липидного профиля, поддержке функций нервной системы, печени и почек.
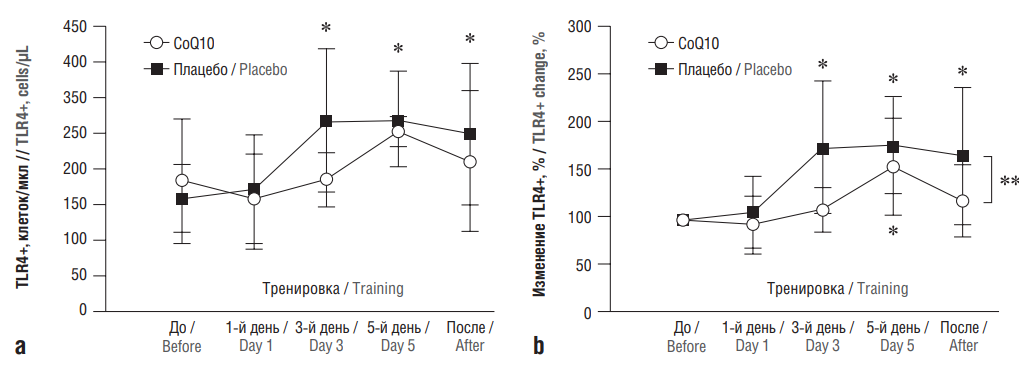
Рисунок 2. Абсолютное количество (a) и процентное изменение (b) клеток толл-подобного рецептора 4+ (англ. toll-like receptor 4+, TLR4+) и кластера дифференциации 14+ (англ. cluster of differentiation 14+, CD14+) у спортсменов, получавших коэнзим Q10 (англ. coenzyme Q10, CoQ10) (по данным [10]).
* Значения достоверно отличаются от дотренировочных внутри группы (p<0,05). ** Сравнение с плацебо
Figure 2. Absolute number (a) and percentage change (b) of toll-like receptor 4+ and cluster of differentiation 14+ (TLR4+/CD14+) cells in athletes treated with coenzyme Q10 (CoQ10) (after [10]).
* The values are significantly different from pre-training within the group (p<0.05). ** Comparison with placebo
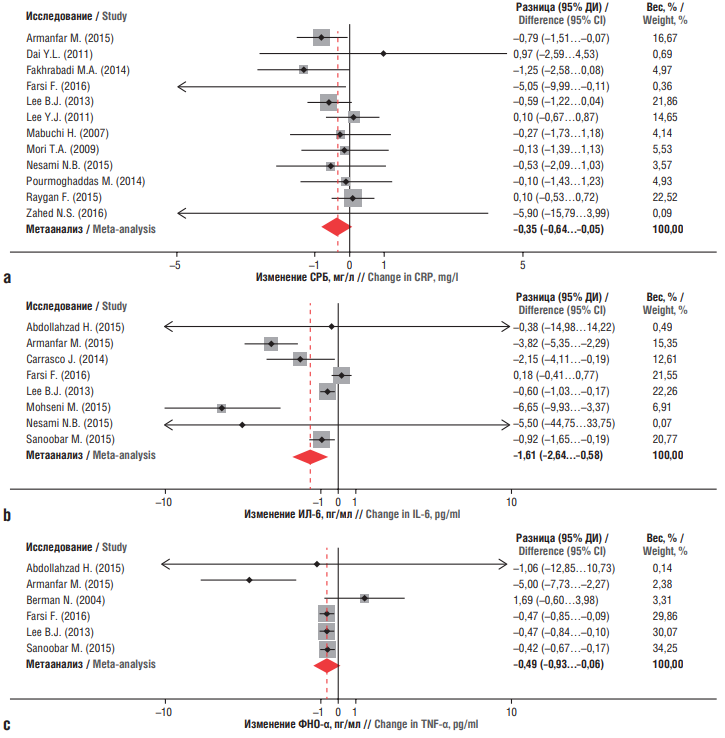
Рисунок 3. Метаанализ эффектов коэнзима Q10 на уровни провоспалительных факторов у пациентов с хронической патологией – сердечно-сосудистыми заболеваниями, ожирением, неалкогольной жировой болезнью печени, сахарным диабетом 2-го типа, заболеваниями почек (по данным [13]):
a – С-реактивный белок (СРБ); b – интерлейкин 6 (ИЛ-6); c – фактор некроза опухоли альфа (ФНО-α).
ДИ – доверительный интервал
Figure 3. Meta-analysis of the effects of coenzyme Q10 on the levels of pro-inflammatory factors in patients with chronic pathology – cardiovascular diseases, obesity,
non-alcoholic fatty liver disease, type 2 diabetes mellitus, kidney disease (after [13]):
a – C-reactive protein (CRP); b – interleukin 6 (IL-6); c – tumor necrosis factor alpha (TNF-α).
CI – confidence interval
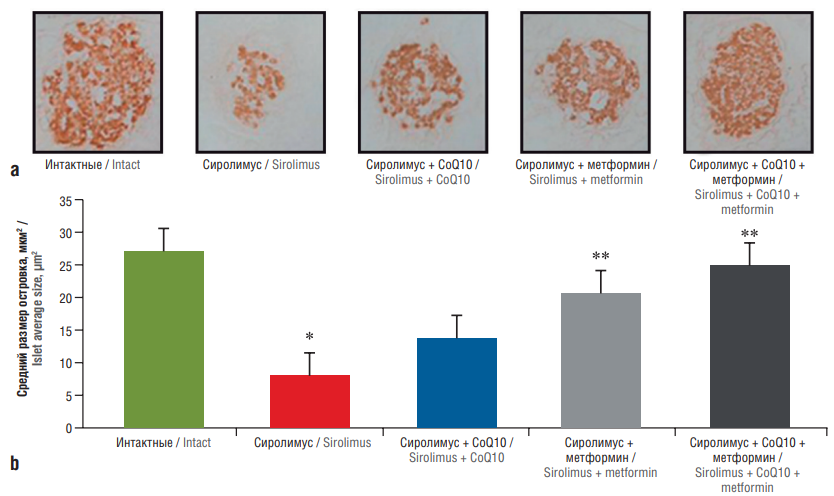
Рисунок 4. Эффекты добавления коэнзима Q10 (англ. coenzyme Q10, CoQ10) к метформину на морфологию и размер островков поджелудочной железы при повреждениях, вызванных сиролимусом. Иммуногистохимия инсулина, показывающая морфологию и размер островков поджелудочной железы в экспериментальных группах (по данным [18]):
a – репрезентативные изображения окрашивания инсулином срезов поджелудочной железы (применение сиролимуса приводило к меньшему размеру островков и более низкой интенсивности окрашивания на инсулин внутри островков, чем в группе интактных животных, увеличение ×400); b – количественный анализ площади островков.
* p<0,05 по сравнению с плацебо; ** p<0,05 по сравнению с сиролимусом
Figure 4. Effects of coenzyme Q10 (CoQ10) addition to metformin on morphology and size of pancreatic islets in sirolimus-induced injury. Immunohistochemistry of insulin showing the morphology and size of the pancreatic islets in the experimental groups (after [18]):
a – representative images of insulin staining of pancreatic sections (the use of sirolimus resulted in smaller islets and lower intensity of intraislet staining for insulin than in the group of intact animals, magnification ×400); b – quantitative analysis of the islet area.
* p<0.05 compared to placebo; ** p<0.05 compared to sirolimus
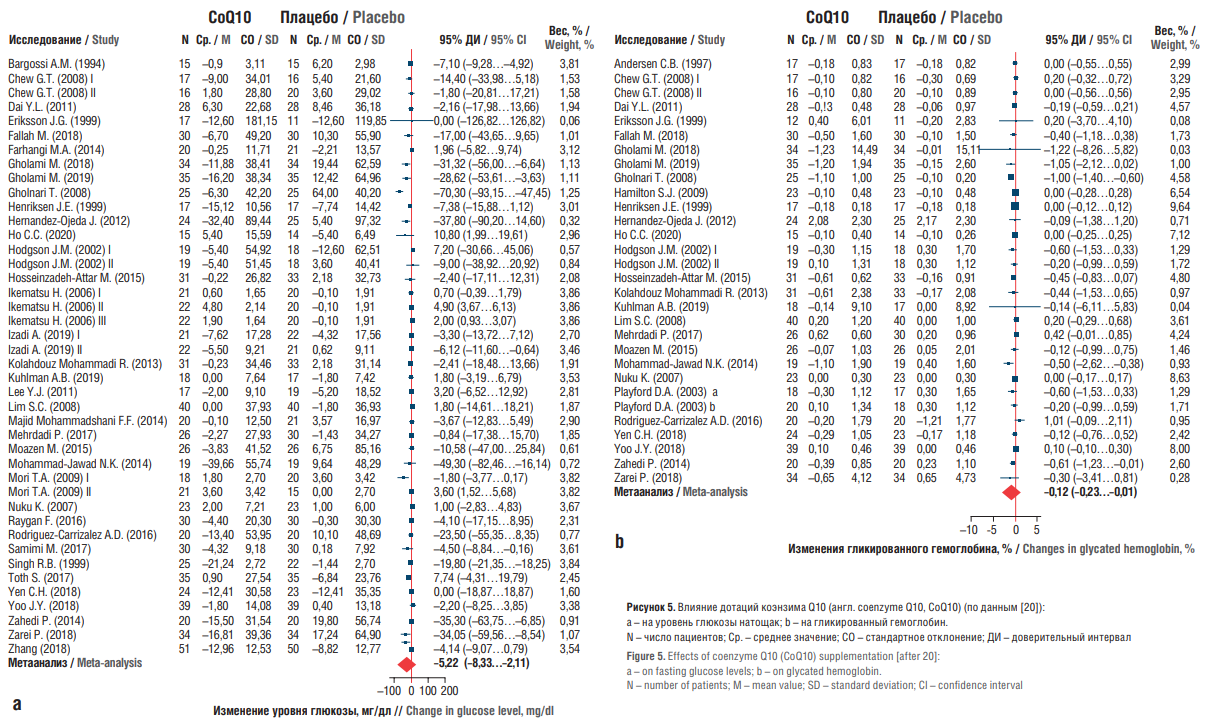
Рисунок 5. Влияние дотаций коэнзима Q10 (англ. coenzyme Q10, CoQ10) (по данным [20]):
a – на уровень глюкозы натощак; b – на гликированный гемоглобин.
N – число пациентов; Ср. – среднее значение; СО – стандартное отклонение; ДИ – доверительный интервал
Figure 5. Effects of coenzyme Q10 (CoQ10) supplementation [after 20]:
a – on fasting glucose levels; b – on glycated hemoglobin.
N – number of patients; M – mean value; SD – standard deviation; CI – confidence interval
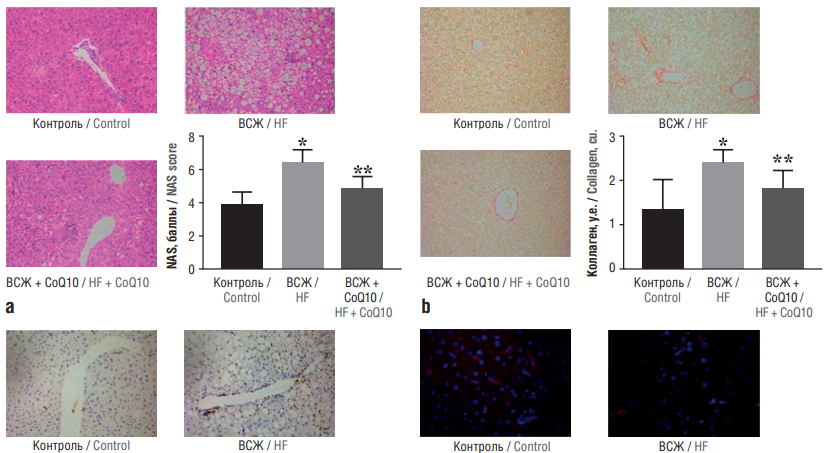
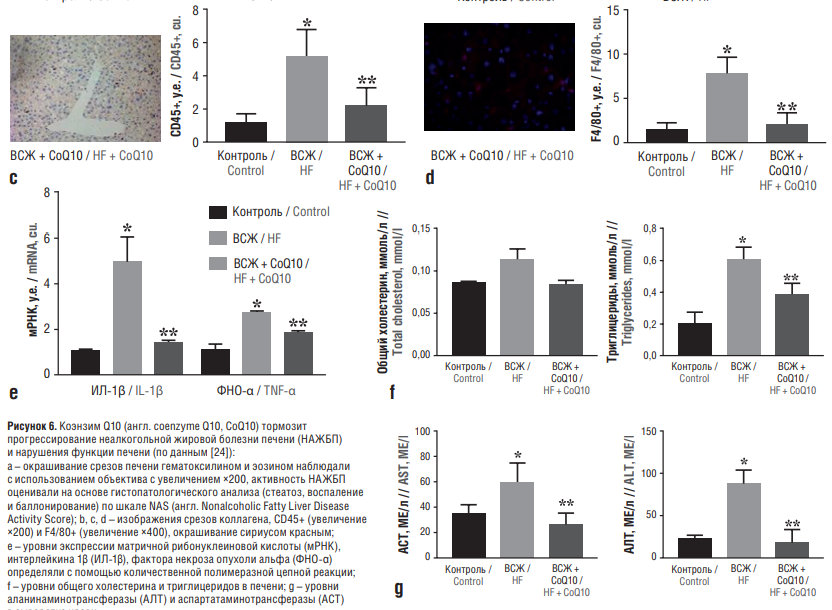
Рисунок 6. Коэнзим Q10 (англ. coenzyme Q10, CoQ10) тормозит прогрессирование неалкогольной жировой болезни печени (НАЖБП) и нарушения функции печени (по данным [24]):
a – oкрашивание срезов печени гематоксилином и эозином наблюдали с использованием объектива с увеличением ×200, активность НАЖБП оценивали на основе гистопатологического анализа (стеатоз, воспаление и баллонирование) по шкале NAS (англ. Nonalcoholic Fatty Liver Disease Activity Score); b, с, d – изображения срезов коллагена, CD45+ (увеличение ×200) и F4/80+ (увеличение ×400), окрашивание сириусом красным; e – уровни экспрессии матричной рибонуклеиновой кислоты (мРНК), интерлейкина 1β (ИЛ-1β), фактора некроза опухоли альфа (ФНО-α) определяли с помощью количественной полимеразной цепной реакции; f – уровни общего холестерина и триглицеридов в печени; g – уровни аланинаминотрансферазы (АЛТ) и аспартатаминотрансферазы (АСТ) в сыворотке крови.
Контроль – мыши на диете с низким содержанием жиров; ВСЖ – мыши на диете с высоким содержанием жиров. В группе ВСЖ + CoQ10 мыши получали CoQ10 в дозе 1800 мг/кг.
* р<0,05 по сравнению с контролем; ** р<0,05 по сравнению с группой ВСЖ
Figure 6. Coenzyme Q10 (CoQ10) inhibits the progression of non-alcoholic fatty liver disease (NAFLD) and liver dysfunction (after [24]):
a – staining of liver sections with hematoxylin and eosin was observed using a ×200 objective, NAFLD activity score (NAS) was determined based on histopathological analysis (steatosis, inflammation and ballooning); b, c, d – slice images of collagen, CD45 (×200 magnification) and F4/80 (×400 magnification), sirius red staining; e – expression levels of matrix ribonucleic acid (mRNA), interleukin 1β (IL-1β), tumor necrosis factor alpha (TNF-α) were determined using quantitative polymerase chain reaction; f – levels of total cholesterol and triglycerides in the liver; g – levels of alanine aminotransferase (ALT) and aspartate aminotransferase (AST) in blood serum.
Control – mice on low fat diet; HF – mice on high fat diet. In the HF + CoQ10 group, mice received CoQ10 at a dose of 1800 mg/kg.
* р<0.05 compared to control; ** р<0.05 compared to HF group
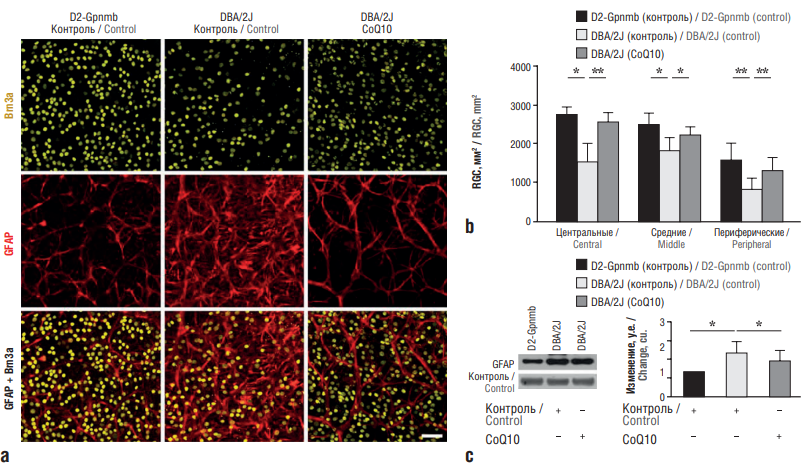
Рисунок 7. Выживаемость ганглионарных клеток сетчатки (англ. retinal ganglion cells, RGC) у мышей DBA/2J с глаукомой, получавших диету с коэнзимом Q10 (англ. coenzyme Q10, CoQ10) (по данным [34]):
а – иммуногистохимия цельного препарата сетчатки с использованием антител против Brn3a и глиального фибриллярного кислого белка (англ. glial fibrillary acidic protein, GFAP) по сравнению с сетчаткой у интактных мышей, получавших контрольную диету (D2-Gpnmb) (сетчатка у мышей с глаукомой DBA/2J, получавших контрольную диету, показала большую потерю RGC и активацию астроглии, диета с CoQ10 значительно способствовала выживанию RGC и блокировала активацию астроглии в сетчатке глаза глаукоматозных мышей DBA/2J (масштабная линейка 50 мкм)); b – количественный анализ выживания RGC; c – у глаукоматозных мышей линии DBA/2J, получавших контрольную диету, значительно увеличивалась экспрессия GFAP по сравнению с интактными мышами D2-Gpnmb, диета с CoQ10 значительно снизила экспрессию GFAP в сетчатке глаукоматозных мышей.
* Достоверные различия (р<0,05) по сравнению с мышами D2-Gpnmb, получавшими контрольную диету. ** Достоверные различия по сравнению с глаукоматозными мышами DBA/2J на контрольной диете
Figire 7. Survival of retinal ganglion cells (RGC) in DBA/2J mice with glaucoma fed a coenzyme Q10 (CoQ10) diet (after [34]):
a – immunohistochemistry of a whole retinal preparation using antibodies against Brn3a and glial fibrillary acidic protein (GFAP) compared to the retinas of intact mice fed a control diet (D2-Gpnmb) (the retinas of DBA/2J mice with glaucoma fed a control diet showed greater RGC loss and astroglial activation, the CoQ10 diet significantly promoted RGC survival and blocked astroglial activation in the retina of glaucomatous DBA/2J mice (scale bar 50 µm)); b – quantitative analysis of RGC survival; c – glaucomatous DBA/2J mice fed a control diet significantly increased GFAP protein expression compared to intact D2-Gpnmb mice, the CoQ10 diet significantly reduced GFAP expression in the retinas of glaucomatous mice.
* Significant difference (p<0.05) compared to D2-Gpnmb mice fed a control diet. ** Significant difference compared to glaucomatous DBA/2J mice on a control diet
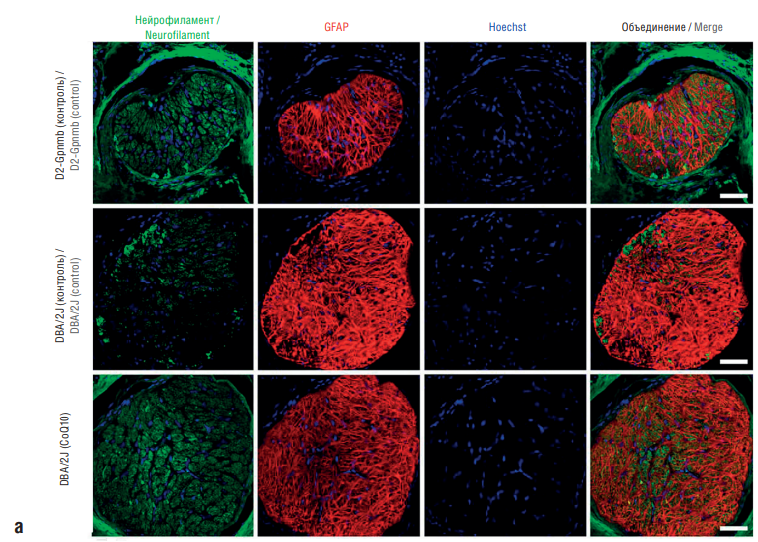
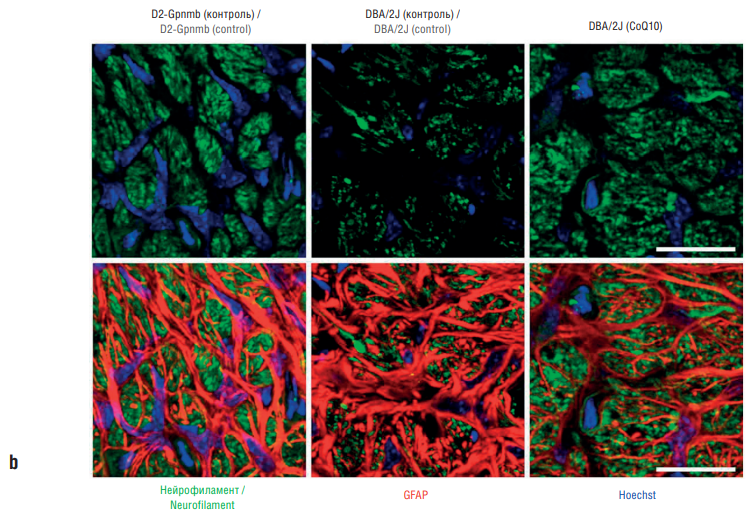
Рисунок 8. Сохранение аксонов ганглионарных клеток сетчатки в глиальной пластинке у мышей с глаукомой, получавших диету с коэнзимом Q10 (англ. coenzyme Q10, CoQ10). Нейрофиламенты и глиальный фибриллярный кислый белок (англ. glial fibrillary acidic protein, GFAP), иммуногистохимия. На контрольной диете отмечена бо́льшая потеря аксонов за счет уменьшения количества нейрофиламентов. Диета с CoQ10 частично восстанавливала иммунореактивность нейрофиламентов (по данным [34]):
а – масштабная планка 100 мкм; b – более высокое увеличение, масштабная планка 20 мкм
Figure 8. Preservation of retinal ganglion cell axons in the glial plate of glaucoma mice fed a coenzyme Q10 (CoQ10) diet. Neurofilaments and glial fibrillary acidic protein (GFAP), immunohistochemistry. On a control diet, a greater loss of axons was noted due to a decrease in the number of neurofilaments. The CoQ10 diet partially restored neurofilament immunoreactivity (after [34]):
a – scale bar 100 µm; b – higher magnification, scale bar 20 µm
ЗАКЛЮЧЕНИЕ / CONCLUSION
Недостаточность СоQ10, способствуя формированию митохондриальной дисфункции, негативно сказывается на функции гепатоцитов, нефроцитов, нейронов, лейкоцитов и бета-клеток островков Лангерганса. В работе систематизированы результаты экспериментальных и клинических исследований CoQ10, указывающие на перспективность его применения не только у пациентов со статиновой миопатией, но и при лечении НАЖБП, атеросклероза, СД2, хронических заболеваний почек и других патологий, сопровождающихся хроническим вялотекущим воспалением. Кроме того, CoQ10 необходим для лечения ряда неврологических заболеваний (мигрень, болезнь Паркинсона, болезнь Гентингтона, болезнь Альцгеймера, боковой амиотрофический склероз, атаксия Фридрейха, рассеянный склероз, аутизм и др.).
Список литературы
1. Shindo Y., Witt E., Han D., et al. Enzymic and non-enzymic antioxidants in epidermis and dermis of human skin. J Invest Dermatol. 1994; 102 (1): 122–4. https://doi.org/10.1111/1523-1747.ep12371744.
2. Garrido-Maraver J., Cordero M.D., Oropesa-Avila M., et al. Clinical applications of coenzyme Q10. Front Biosci (Landmark Ed). 2014; 19 (4): 619–33. https://doi.org/10.2741/4231.
3. Торшин И.Ю., Громова О.А. Альтернативные подходы к коррекции гиперхолестеринемии: эффекты стандартизированных экстрактов красного риса и его синергистов. Лечебное дело. 2021; 1: 89–98. https://doi.org/10.24412/2071-5315-2021-12283.
4. Белова О.В., Арефьева Т.И., Москвина С.Н. Иммуновоспалительные аспекты болезни Паркинсона. Журнал неврологии и психиатрии им. С.С. Корсакова. 2020; 120 (2): 110–9. https://doi.org/10.17116/jnevro2020120021110.
5. Ghorbani S., Yong V.W. The extracellular matrix as modifier of neuroinflammation and remyelination in multiple sclerosis. Brain. 2021; 144 (7): 1958–73. https://doi.org/10.1093/brain/awab059.
6. Torshin I.Yu., Rudakov K.V. On metric spaces arising during formalization of recognition and classification problems. Part 1: Properties of compactness. Pattern Recognit Image Anal. 2016; 26 (2): 274–84. https://doi.org/10.1134/S1054661816020255.
7. Torshin I.Yu., Rudakov K.V. Combinatorial analysis of the solvability properties of the problems of recognition and completeness of algorithmic models. Part 2: Metric approach within the framework of the theory of classification of feature values. Pattern Recognit Image Anal. 2017; 27 (2): 184–99. https://doi.org/10.1134/S1054661817020110.
8. Torshin I.Yu., Rudakov K.V. On metric spaces arising during formalization of problems of recognition and classification. Part 2: Density properties. Pattern Recognit Image Anal. 2016; 26 (3): 483–96. https://doi.org/10.1134/S1054661816030202.
9. Hajiluian G., Heshmati J., Jafari Karegar S., et al. Diabetes, age, and duration of supplementation subgroup analysis for the effect of coenzyme Q10 on oxidative stress: a systematic review and metaanalysis. Complement Med Res. 2021; 28 (6): 557–70. https://doi.org/10.1159/000515249.
10. Shimizu K., Kon M., Tanimura Y., et al. Coenzyme Q10 supplementation downregulates the increase of monocytes expressing tolllike receptor 4 in response to 6-day intensive training in kendo athletes. Appl Physiol Nutr Metab. 2015; 40 (6): 575–81. https://doi.org/10.1139/apnm-2014-0556.
11. Aslani Z., Shab-Bidar S., Fatahi S., Djafarian K. Effect of coenzyme Q10 supplementation on serum of high sensitivity c-reactive protein level in patients with cardiovascular diseases: a systematic review and meta-analysis of randomized controlled trials. Int J Prev Med. 2018; 9: 82. https://doi.org/10.4103/ijpvm.IJPVM_263_17.
12. Farsi F., Heshmati J., Keshtkar A., et al. Can coenzyme Q10 supplementation effectively reduce human tumor necrosis factor-α and interleukin-6 levels in chronic inflammatory diseases? A systematic review and meta-analysis of randomized controlled trials. Pharmacol Res. 2019; 148: 104290. https://doi.org/10.1016/j.phrs.2019.104290.
13. Fan L., Feng Y., Chen G.C., et al. Effects of coenzyme Q10 supplementation on inflammatory markers: a systematic review and metaanalysis of randomized controlled trials. Pharmacol Res. 2017; 119: 128–36. https://doi.org/10.1016/j.phrs.2017.01.032.
14. Rasoolzadeh E.A., Shidfar F., Rasoolzadeh R.A., Hezaveh Z.S. The effect of coenzyme Q10 on periodontitis: a systematic review and metaanalysis of clinical trials. J Evid Based Dent Pract. 2022; 22 (2): 101710. https://doi.org/10.1016/j.jebdp.2022.101710.
15. Liu Z., Tian Z., Zhao D., et al. Effects of coenzyme Q10 supplementation on lipid profiles in adults: a meta-analysis of randomized controlled trials. J Clin Endocrinol Metab. 2022; 108 (1): 232–49. https://doi.org/10.1210/clinem/dgac585.
16. Al Saadi T., Assaf Y., Farwati M., et al. Coenzyme Q10 for heart failure. Cochrane Database Syst Rev. 2021; 2 (2): CD008684. https://doi.org/10.1002/14651858.CD008684.pub3.
17. Qu H., Guo M., Chai H., et al. Effects of coenzyme Q10 on statininduced myopathy: an updated meta-analysis of randomized controlled trials. J Am Heart Assoc. 2018; 7 (19): e009835. https://doi.org/10.1161/JAHA.118.009835.
18. Sun I.O., Jin L., Jin J., et al. The effects of addition of coenzyme Q10 to metformin on sirolimus-induced diabetes mellitus. Korean J Intern Med. 2019; 34 (2): 365–74. https://doi.org/10.3904/kjim.2017.004.
19. Moradi M., Haghighatdoost F., Feizi A., et al. Effect of coenzyme Q10 supplementation on diabetes biomarkers: a systematic review and meta-analysis of randomized controlled clinical trials. Arch Iran Med. 2016; 19 (8): 588–96.
20. Liang Y., Zhao D., Ji Q., et al. Effects of coenzyme Q10 supplementation on glycemic control: a GRADE-assessed systematic review and dose-response meta-analysis of randomized controlled trials. EClinicalMedicine. 2022; 52: 101602. https://doi.org/10.1016/j.eclinm.2022.101602.
21. Izadi A., Ebrahimi S., Shirazi S., et al. Hormonal and metabolic effects of coenzyme Q10 and/or vitamin E in patients with polycystic ovary syndrome. J Clin Endocrinol Metab. 2019; 104 (2): 319–27. https://doi.org/10.1210/jc.2018-01221.
22. Taghizadeh S., Izadi A., Shirazi S., et al. The effect of coenzyme Q10 supplementation on inflammatory and endothelial dysfunction markers in overweight/obese polycystic ovary syndrome patients. Gynecol Endocrinol. 2021; 37 (1): 26–30. https://doi.org/10.1080/09513590.2020.1779689.
23. Zhang T., He Q., Xiu H., et al. Efficacy and safety of coenzyme Q10 supplementation in the treatment of polycystic ovary syndrome: a systematic review and meta-analysis. Reprod Sci. 2023; 30 (4): 1033– 48. https://doi.org/10.1007/s43032-022-01038-2.
24. Chen K., Chen X., Xue H., et al. Coenzyme Q10 attenuates high-fat diet-induced non-alcoholic fatty liver disease through activation of the AMPK pathway. Food Funct. 2019; 10 (2): 814–23. https://doi.org/10.1039/c8fo01236a.
25. Jiang Y.J., Jin J., Nan Q.Y., et al. Coenzyme Q10 attenuates renal fibrosis by inhibiting RIP1-RIP3-MLKL-mediated necroinflammation via Wnt3α/β-catenin/GSK-3β signaling in unilateral ureteral obstruction. Int Immunopharmacol. 2022; 108: 108868. https://doi.org/10.1016/j.intimp.2022.108868.
26. Alehagen U., Aaseth J., Alexander J., et al. Selenium and coenzyme Q10 supplementation improves renal function in elderly deficient in selenium: observational results and results from a subgroup analysis of a prospective randomised double-blind placebo-controlled trial. Nutrients. 2020; 12 (12): 3780. https://doi.org/10.3390/nu12123780.
27. Zahed N.S., Ghassami M., Nikbakht H. Effects of coenzyme Q10 supplementation on C-reactive protein and homocysteine as the inflammatory markers in hemodialysis patients; a randomized clinical trial. J Nephropathol. 2016; 5 (1): 38–43. https://doi.org/10.15171/jnp.2016.07.
28. Drovandi S., Lipska-Ziętkiewicz B.S., Ozaltin F., et al. Oral Coenzyme Q10 supplementation leads to better preservation of kidney function in steroid-resistant nephrotic syndrome due to primary Coenzyme Q10 deficiency. Kidney Int. 2022; 102 (3): 604–12. https://doi.org/10.1016/j.kint.2022.04.029.
29. Bakhshayeshkaram M., Lankarani K.B., Mirhosseini N., et al. The effects of coenzyme Q10 supplementation on metabolic profiles of patients with chronic kidney disease: a systematic review and metaanalysis of randomized controlled trials. Curr Pharm Des. 2018; 24 (31): 3710–23. https://doi.org/10.2174/1381612824666181112112857.
30. Orsucci D., Mancuso M., Ienco E.C., et al. Targeting mitochondrial dysfunction and neurodegeneration by means of coenzyme Q10 and its analogues. Curr Med Chem. 2011; 18 (26): 4053–64. https://doi.org/10.2174/092986711796957257.
31. Yang X., Zhang Y., Xu H., et al. Neuroprotection of coenzyme Q10 in neurodegenerative diseases. Curr Top Med Chem. 2016; 16 (8): 858–66. https://doi.org/10.2174/1568026615666150827095252.
32. Shinkai T., Nakashima M., Ohmori O., et al. Coenzyme Q10 improves psychiatric symptoms in adult-onset mitochondrial myopathy, encephalopathy, lactic acidosis and stroke-like episodes: a case report. Aust N Z J Psychiatry. 2000; 34 (6): 1034–5. https://doi.org/10.1080/000486700286.
33. Chang Y., Huang S.K., Wang S.J. Coenzyme Q10 inhibits the release of glutamate in rat cerebrocortical nerve terminals by suppression of voltage-dependent calcium influx and mitogen-activated protein kinase signaling pathway. J Agric Food Chem. 2012; 60 (48): 11909–18. https://doi.org/10.1021/jf302875k.
34. Lee D., Shim M.S., Kim K.Y., et al. Coenzyme Q10 inhibits glutamate excitotoxicity and oxidative stress-mediated mitochondrial alteration in a mouse model of glaucoma. Invest Ophthalmol Vis Sci. 2014; 55 (2): 993–1005. https://doi.org/10.1167/iovs.13-12564.
35. Lu C.J., Guo Y.Z., Zhang Y., et al. Coenzyme Q10 ameliorates cerebral ischemia reperfusion injury in hyperglycemic rats. Pathol Res Pract. 2017; 213 (9): 1191–9. https://doi.org/10.1016/j.prp.2017.06.005.
36. Ibrahim Fouad G. Combination of omega 3 and coenzyme Q10 exerts neuroprotective potential against hypercholesterolemia-induced Alzheimer's-like disease in rats. Neurochem Res. 2020; 45 (5): 1142– 55. https://doi.org/10.1007/s11064-020-02996-2.
37. Omidi G., Karimi S.A., Shahidi S., et al. Coenzyme Q10 supplementation reverses diabetes-related impairments in long-term potentiation induction in hippocampal dentate gyrus granular cells: an in vivo study. Brain Res. 2020; 1726: 146475. https://doi.org/10.1016/j.brainres.2019.146475.
38. Shi T.J., Zhang M.D., Zeberg H., et al. Coenzyme Q10 prevents peripheral neuropathy and attenuates neuron loss in the db-/dbmouse, a type 2 diabetes model. Proc Natl Acad Sci U S A. 2013; 110 (2): 690– 5. https://doi.org/10.1073/pnas.1220794110.
39. Sadeghiyan Galeshkalami N., Abdollahi M., Najafi R., et al. Alphalipoic acid and coenzyme Q10 combination ameliorates experimental diabetic neuropathy by modulating oxidative stress and apoptosis. Life Sci. 2019; 216: 101–10. https://doi.org/10.1016/j.lfs.2018.10.055.
40. Kandhare A.D., Ghosh P., Ghule A.E., Bodhankar S.L. Elucidation of molecular mechanism involved in neuroprotective effect of coenzyme Q10 in alcohol-induced neuropathic pain. Fundam Clin Pharmacol. 2013; 27 (6): 603–22. https://doi.org/10.1111/fcp.12003.
41. Jiménez-Jiménez F.J., Alonso-Navarro H., García-Martín E., Agúndez J.A.G. Coenzyme Q10 and Parkinsonian syndromes: a systematic review. J Pers Med. 2022; 12 (6): 975. https://doi.org/10.3390/jpm12060975.
42. Liu J., Wang L.N., Zhan S.Y., Xia Y. Coenzyme Q10 for Parkinson's disease. Cochrane Database Syst Rev. 2012; 5: CD008150. https://doi.org/10.1002/14651858.CD008150.pub3.
43. Markley H.G. Coenzyme Q10 and riboflavin: the mitochondrial connection. Headache. 2012; 52 (Suppl. 2): 81–7. https://doi.org/10.1111/j.1526-4610.2012.02233.x.
44. Sazali S., Badrin S., Norhayati M.N., Idris N.S. Coenzyme Q10 supplementation for prophylaxis in adult patients with migraine-a metaanalysis. BMJ Open. 2021; 11 (1): e039358. https://doi.org/10.1136/bmjopen-2020-039358.
45. Maguire Á., Hargreaves A., Gill M. Coenzyme Q10 and neuropsychiatric and neurological disorders: relevance for schizophrenia. Nutr Neurosci. 2020; 23 (10): 756–69. https://doi.org/10.1080/1028415X.2018.1556481.
Об авторах
О. А. ГромоваРоссия
д.м.н., профессор, ведущий научный сотрудник ФИЦ «Информатика и управление» РАН
ул. Вавилова, д. 44, корп. 2, Москва 119333
И. Ю. Торшин
Россия
к.ф-м.н., к.х.н., старший научный сотрудник ФИЦ «Информатика и управление» РАН
ул. Вавилова, д. 44, корп. 2, Москва 119333
А. Н. Громов
Россия
инженер-исследователь ФИЦ «Информатика и управление» РАН
ул. Вавилова, д. 44, корп. 2, Москва 119333
Рецензия
Для цитирования:
Громова О.А., Торшин И.Ю., Громов А.Н. Возможности применения коэнзима Q10 для лечения заболеваний, сопряженных с дисфункцией митохондрий и хроническим воспалением. ФАРМАКОЭКОНОМИКА. Современная фармакоэкономика и фармакоэпидемиология. 2023;16(3):466-480. https://doi.org/10.17749/2070-4909/farmakoekonomika.2023.187
For citation:
Gromova O.A., Torshin I.Yu., Gromov A.N. Possibilities of using coenzyme Q10 for the treatment of diseases associated with mitochondrial dysfunction and chronic inflammation. FARMAKOEKONOMIKA. Modern Pharmacoeconomics and Pharmacoepidemiology. 2023;16(3):466-480. (In Russ.) https://doi.org/10.17749/2070-4909/farmakoekonomika.2023.187

Контент доступен под лицензией Creative Commons Attribution-NonCommercial-ShareAlike 4.0 International License.






































