Перейти к:
Разработка методических подходов к формированию риск-ориентированной модели для минимизации возникновения нежелательных реакций при применении лекарственных препаратов в медицинских организациях города Москвы
https://doi.org/10.17749/2070-4909/farmakoekonomika.2023.184
Аннотация
Цель: разработка подходов, позволяющих прогнозировать вероятность возникновения нежелательных реакций (НР) при применении лекарственных препаратов (ЛП) на основе комплексной оценки факторов риска.
Материал и методы. Использовали базу данных, содержащую 1450 извещений о НР при применении ЛП, поступивших с января по декабрь 2021 г. включительно. В качестве эталонной группы для выполнения различных видов статистического анализа был выбран перечень антибактериальных ЛП по международному непатентованному наименованию (МНН), количество извещений о возникновении НР по которым составляет 4 и более. Суммарно многофакторный регрессионный анализ выполнен на базе данных из 187 извещений о возникновении НР по 13 МНН антибактериальных ЛП. Исследование выполняли в два этапа. На первом этапе применяли статистический метод (классическая множественная регрессия, линейный дискриминантный анализ, факторный анализ, регрессия главных компонент, частичная регрессия методом наименьших квадратов, оценка точности дисперсий), на втором этапе – метод моделирования. В рамках этапа моделирования использовали методику балльной интегральной оценки риска возникновения НР, представленного в виде суммы значений по отдельным факторам риска. Предлагается проводить оценку рисков по двум группам: 1) собственное значение риска для каждого фактора (признака), равное сумме рисков всех факторов (условий), при которых применяется ЛП; 2) собственное значение риска для антибактериальных ЛП по каждому МНН. Суммарное значение риска определяется как сумма риска ЛП и всех факторов (условий), при которых этот ЛП применяется.
Результаты. Результаты визуализированы в виде двухуровневой матрицы риск-ориентированной модели, на которую наложена «тепловая карта» уровня риска. Максимальное суммарное значение риска возникновения НР получено для цефтриаксона – 404,96 балла в зависимости от пола пациента. Минимальное суммарное значение риска рассчитано для азитромицина и цефотаксима в зависимости от кода по Международной классификации болезней 10-го пересмотра – 88,46 балла. Предложенный методический подход также позволяет комбинировать все возможные сочетания ЛП и условий их применения. Например, для применения ванкомицина в стационарных условиях путем внутривенного введения: собственный риск применения – 42,93 балла, риск применения в стационарных условиях – 183,68 балла, риск при внутривенном введении – 209,95 балла, суммарное значение риска в обозначенной ситуации – 436,56 балла.
Заключение. Предложенный подход может позволить медицинским организациям значительно сократить количество случаев возникновения НР при применении ЛП путем категоризации и предотвращения рисков до их появления. Он также обладает значительными перспективами использования на федеральном уровне при условии его модификации на большом объеме данных.
Ключевые слова
Для цитирования:
Кузнецова Е.В., Журавлева М.В., Михайлов И.А., Курносова Т.И. Разработка методических подходов к формированию риск-ориентированной модели для минимизации возникновения нежелательных реакций при применении лекарственных препаратов в медицинских организациях города Москвы. ФАРМАКОЭКОНОМИКА. Современная фармакоэкономика и фармакоэпидемиология. 2023;16(2):248-257. https://doi.org/10.17749/2070-4909/farmakoekonomika.2023.184
For citation:
Kuznetsova E.V., Zhuravleva M.V., Mikhailov I.A., Kurnosova T.I. Development of methodological approaches to the formation of a risk-based model to minimize the prevalence of adverse reactions in drug application in medical organizations of Moscow. FARMAKOEKONOMIKA. Modern Pharmacoeconomics and Pharmacoepidemiology. 2023;16(2):248-257. (In Russ.) https://doi.org/10.17749/2070-4909/farmakoekonomika.2023.184
ВВЕДЕНИЕ / INTRODUCTION
Нежелательные эффекты лекарственных препаратов (ЛП) являются крайне значимой причиной заболеваемости и смертности у пациентов, которым оказывается медицинская помощь в амбулаторных или стационарных условиях [1–5]. По результатам нескольких международных исследований, количественная оценка частоты возникновения нежелательных реакций (НР) при применении ЛП находится в диапазоне 2,4–30% у стационарных пациентов [1][6–10]. Группой австралийских исследователей показано, что 16,6% госпитализаций сопровождались нежелательными явлениями, причем половина из них считалась предотвратимой. Приблизительно 10% этих событий были связаны с приемом ЛП [11].
Высокие затраты на купирование НР являются общепризнанным фактом [1][2][12]. Установлено, что предотвратимые побочные эффекты, включая НР, обходятся Британской национальной службе здравоохранения в сумму, превышающую 2,5 млрд долл. США в год [13]. Также показано, что в США ежегодно тратится около 3,5 млрд долл. на медицинские расходы, связанные с НР [13].
Традиционные усилия по сокращению числа НР в стационаре, как правило, сосредоточены в первую очередь на разработке медицинских информационных систем [14][15]. Показано, что внедрение электронных систем управления лекарствами, включая электронное назначение и автоматическую выдачу, значительно снижает количество ошибок при их назначении [16–18]. Однако такие системы являются дорогостоящими, и если они не будут должным образом внедрены и подвергаться обслуживанию, то могут привести к возникновению новых НР [17][18].
Учитывая, что до 80% НР считаются предсказуемыми [19], а 50% оцениваются как предотвратимые [20][21], необходима разработка и внедрение валидированной модели, включающей все значимые факторы риска, связанные с НР [21–26]. Шкалы риска, которые объединяют значимые факторы риска со стороны пациента и медицинской организации в целях ранжирования пациентов по степени риска, находят все более широкое применение для минимизации и предотвращения НР [27–29].
В настоящее время в рутинной клинической практике используется несколько прогностических показателей риска. К ним относятся инструмент расчета риска повторной госпитализации пациентов (англ. patients at risk of rehospitalisation, PARR), система оценки риска кардиохирургических операций (англ. European System for Cardiac Operative Risk Evaluation, EuroSCORE) [30], Фрамингемская шкала (англ. Framingham Risk Score) [31] для определения риска развития сердечно-сосудистых заболеваний, а также Оттавские правила голеностопного сустава (англ. Ottawa Ankle Rules) [32] в ортопедии. Однако универсальные модели для прогнозирования рисков НР в многопрофильном стационаре немногочисленны. В недавнем систематическом обзоре, проведенном J.M. Stevenson et al., были выделены четыре универсальные модели, прогнозирующие риск НР для госпитализированных пожилых пациентов в возрасте 65 лет и старше [33].
В работах B. Tangiisuran et al. (оценка риска нежелательной лекарственной реакции Брайтона – англ. Brighton Adverse Drug Reactions Risk, BADRI) [34], G. Onder et al. (система оценки GerontoNet) [35], С. Trivalle et al. [36], J.C. McElnay et al. [37], а также M.C. Passarelli и W.J. Filho [38] созданы модели для использования у пожилых стационарных пациентов в реабилитационных и/или неотложных стационарах. В исследованиях M. Sakuma et al. [39], O. Urbina et al. [40], Y. Zopf et al. [41] и T.L. Nguyen et al. [42] разработаны модели для применения у неотложных медицинских и хирургических стационарных взрослых пациентов, а в исследовании F.S. Sharif-Askari et al. [43] – специально для стационарных пациентов с почечной недостаточностью.
Однако в Российской Федерации в настоящее время практически не применяются валидированные риск-ориентированные модели, направленные на минимизацию и предотвращение возникновения НР при применении ЛП в медицинских организациях. Также использование подобных моделей необходимо для оптимизации частоты контрольно-надзорных мероприятий в части фармаконадзора.
Цель – разработка подходов, позволяющих прогнозировать вероятность возникновения НР при применении ЛП на основе комплексной оценки факторов риска.
МАТЕРИАЛ И МЕТОДЫ / MATERIAL AND METHODS
Источники данных / Data sources
В ходе исследования использовали базу данных, содержащую 1450 извещений, предоставленных в ГБУ «Научно-исследовательский институт организации здравоохранения и медицинского менеджмента» Департамента здравоохранения г. Москвы за январь – декабрь 2021 г. включительно, а также информацию, предоставляемую медицинскими организациями государственной системы здравоохранения г. Москвы в рамках ведомственного контроля в Департамент здравоохранения г. Москвы.
Этапы исследования / Study stages
Исследование выполняли в два этапа. На первом этапе применяли статистический анализ, на втором – метод моделирования.
Этап статистического анализа
В качестве эталонной группы для выполнения различных видов многофакторного регрессионного анализа был выбран перечень антибактериальных препаратов по международному непатентованному наименованию (МНН), количество извещений о возникновении НР по которым составляет 4 и более.
Суммарно многофакторный регрессионный анализ проведен на базе данных из 187 извещений о возникновении НР по 13 МНН антибактериальных ЛП (цефтриаксон, левофлоксацин, амоксициллин + [клавулановая кислота], ванкомицин, цефепим, цефотаксим + [сульбактам], меропенем, моксифлоксацин, амоксициллин, ципрофлоксацин, метронидазол, азитромицин, цефотаксим).
Были последовательно применены следующие виды статистического анализа:
- классическая множественная регрессия по всем полям базы данных спонтанных сообщений о НР по всем МНН (в качестве независимой переменной) в целях первичного отбора наиболее значимых факторов;
- повторная классическая множественная регрессия для выборки из базы данных по перечню антибактериальных ЛП по ограниченному набору факторов (признаков): пол пациента, масса тела пациента, возраст пациента, условия оказания медицинской помощи (МП), путь введения, разовая доза в миллиграммах, код по Международной классификации болезней 10-го пересмотра (МКБ-10);
- линейный дискриминантный анализ в целях нахождения линейной комбинации признаков и идентификации линейного классификатора для всех отобранных антибактериальных ЛП, что позволит провести первичную классификацию и стратификацию рисков;
- факторный анализ для описания изменчивости наблюдаемых коррелирующих количественных переменных с точки зрения потенциально меньшего числа ненаблюдаемых переменных, что позволяет оценить влияние тех факторов, которые не были классифицированы по результатам дискриминантного анализа;
- регрессия главных компонент для сведения всех анализируемых факторов (признаков) к двум измерениям в целях получения двух коэффициентов для риск-ориентированной модели;
- частичная регрессия методом наименьших квадратов в целях нахождения модели линейной регрессии, описывающей взаимосвязь имеющихся в модели факторов риска;
- оценка точности дисперсий для визуализации взаимосвязи всех исследуемых факторов риска по величине дисперсии.
После последовательного выполнения всех перечисленных выше видов многофакторного регрессионного анализа сформирована методика риск-ориентированного подхода по предотвращению возникновения НР, возникающих при применении антибактериальных ЛП.
Статистическую обработку данных проводили в программе Statistica 10 (StatSoft Inc., США).
Этап моделирования
В рамках данного этапа использовали методику балльной интегральной оценки. Интегральная оценка риска возникновения НР при применении ЛП представлена в виде суммы значений по отдельным факторам риска.
Предлагается проводить оценку рисков по двум группам:
- значение риска возникновения НР для каждого фактора (признака) – Rфактор, который равен сумме рисков всех факторов (условий), при которых применяется ЛП (если какой-либо из факторов в конкретной ситуации отсутствует, то значение риска по нему принимается равным нулю):
Rфактор = Rпол + Rмасса тела + Rвозраст + Rусловия МП +
Rпуть введения + Rразовая доза + RМКБ-10 ; - собственное значение риска возникновения НР для антибактериальных ЛП по каждому МНН (RМНН).
Суммарное значение риска определяется как сумма риска ЛП и всех факторов (условий), при которых этот ЛП применяется:
Rобщий = Rфактор + RМНН .
Значение риска для каждого фактора (признака) получено на основании всех результатов всех проведенных видов многофакторного регрессионного анализа. Учитывались результаты множественной регрессии, дискриминантного анализа в части факторов, факторного анализа, регрессии главных компонент и частичной регрессии методом наименьших квадратов.
Значение риска для антибактериальных ЛП по каждому МНН определено на основании результатов дискриминантного и факторного анализа.
РЕЗУЛЬТАТЫ / RESULTS
Оценка риска возникновения НР для отдельных факторов (признаков) / Assessing risk of ARs for individual factors (attributes)
Собственное значение риска для каждого фактора (признака) складывалось из следующих составляющих:
- результаты множественной регрессии – учитывались только для тех факторов, для которых было получено p-значение менее 0,05; далее соответствующие этим p-значениям модули стандартизованных b-коэффициентов умножались на 100 баллов (например, для пола пациента b=–0,317973, p=0,013715, тогда значение составляющей риска по данному виду анализа равно 0,317973 × 100 = 31,7973 балла);
- результаты дискриминантного анализа в части признаков – учитывались только факторы, для которых было получено p-значение менее 0,05; для перевода в рисковую шкалу p-значение вычиталось из единицы и полученное значение умножалось на 100 баллов (например, для возраста p-значение по результатам дискриминантного анализа равно 0,019623, тогда значение составляющей риска по данному виду анализа равно (1 – 0,019623) × 100 = 98,0377 балла;
- результаты факторного анализа – учитывались все полученные степени влияния, которые переводились в соответствующее количество баллов путем умножения на 100 баллов (например, для перорального пути введения степень влияния составила 0,810101, тогда значение составляющей риска по данному виду анализа равно 0,810101 × 100 = 81,0101 балла);
- результаты регрессии главных компонент – учитывались все полученные вероятности отнесения признаков, а именно: вычислялась сумма вероятности отнесения признака к факторным группам 1 или 2 с сохранением соответствующих знаков вероятностей, далее модуль полученной суммы умножался на 100 баллов (например, для условий медицинской помощи вероятность отнесения к факторной группе 1 составила –0,331632, а к факторной группе 2 +0,225294, тогда значение составляющей риска по данному виду анализа равно (–0,331632 + 0,225294) × 100 = 10,6338 балла);
- результаты частичной регрессии методом наименьших квадратов – учитывались все значения прогнозируемой важности соответствующей переменной, которые умножались на 100 баллов (например, значение прогнозируемой важности для массы тела пациента составило 0,387799, тогда значение составляющей риска по данному виду анализа равно 0,387799 × 100 = 38,7799 балла).
Для наглядности перевода результатов всех видов многофакторного регрессионного анализа в рисковую балльную шкалу представлена матрица собственных значений риска для факторов (признаков), в которой все результаты переведены в соответствующие баллы по описанной выше методике (табл. 1).
Таблица 1. Матрица собственных значений риска для факторов (признаков), полученных путем перевода результатов различных видов многофакторного регрессионного анализа в балльную рисковую шкалу, баллы
Table 1. Matrix of intrinsic values of risk for factors (attributes), obtained by translating the results of various types of multifactor regression analysis into a score risk scale, points
|
Факторы (признаки) / Factors (attributes) |
Множественная регрессия / Multiple regression |
Дискриминантный анализ / Discriminant analysis |
Факторный анализ / Factor analysis |
Регрессия главных компонент / Principal component regression |
Частичная регрессия методом наименьших квадратов / Partial least squares regression |
Итоговое значение риска / Total risk value |
|
Пол пациента / Patient’s gender |
||||||
|
мужской / male |
31,7973 |
– |
22,4766 |
48,9742 |
192,0513 |
295,2994 |
|
женский / female |
– |
22,4766 |
192,0513 |
295,2994 |
||
|
Масса тела пациента / Patient’s body mass |
– |
95,7376 |
5,4928 |
75,1609 |
38,7799 |
215,1712 |
|
Возраст пациента / Patient’s age |
– |
98,0377 |
6,1760 |
81,1432 |
17,1765 |
202,5334 |
|
Условия медицинской помощи / Medical care conditions |
||||||
|
амбулаторные / outpatient |
– |
– |
77,2113 |
10,6338 |
52,8979 |
140,7430 |
|
стационарные / inpatient |
– |
– |
77,2113 |
52,8979 |
140,7430 |
|
|
Путь введения препарата / Rout of administration |
||||||
|
перорально / oral |
– |
– |
81,0101 |
72,4065 |
9,7770 |
163,1936 |
|
внутримышечно / intramuscular |
– |
– |
57,1827 |
35,0505 |
164,6397 |
|
|
внутривенно / intravenous |
– |
– |
69,8512 |
24,7584 |
167,0161 |
|
|
Разовая доза / Single dose |
– |
100 |
32,9038 |
29,5828 |
130,0009 |
292,4875 |
|
Код по МКБ-10 / ICD-10 code |
26,8897 |
– |
– |
86,3713 |
– |
86,3713 |
Примечание. МКБ-10 – Международная классификация болезней 10-го пересмотра.
Note. ICD-10 – International Classification of Diseases, 10th revision.
Наибольшей итоговой суммой риска характеризовался пол пациента – суммарный риск составил 295,2994 балла. Однако следует отметить, что данное значение риска не позволяет судить о том, какой конкретно пол пациента при каком конкретно ЛП принимает большее или меньшее значение риска. Требуется проведение дополнительных исследований по каждому ЛП в разрезе пола пациентов для оценки соответствующих пороговых значений рисков в каждом из случаев.
Оценка риска возникновения НР для антибактериальных ЛП / Assessing risk of ARs for antibacterial drugs
Собственное значение риска для каждого антибактериального ЛП складывалось из следующих составляющих:
- результаты дискриминантного анализа в части МНН – учитывались все полученные вероятности корректного отнесения; для перевода в рисковую шкалу вероятность корректного отнесения по соответствующему антибактериальному ЛП в процентах напрямую переводилась в соответствующее количество баллов (например, для цефтриаксона вероятность корректного отнесения составляет 63,33%, тогда соответствующее значение риска по данной составляющей равно 63,33 балла);
- результаты факторного анализа – учитывались все полученные степени влияния, которые переводились в соответствующее количество баллов путем умножения на 100 баллов (например, для ванкомицина степень влияния составила 0,116825, тогда значение составляющей риска по данному виду анализа равно 0,116825 × 100 = 11,6825 балла).
Итоговое значение риска по каждого ЛП рассчитывалось как сумма перечисленных выше составляющих. Для наглядности в таблице 2 представлены как исходные параметры многофакторного регрессионного анализа, так и итоговые значения риска в баллах.
Таблица 2. Матрица собственных значений риска для антибактериальных лекарственных препаратов
Table 2. Matrix of intrinsic risk values for antibacterial drugs
|
МНН / INN |
Дискриминантный анализ*, % / Discriminant analysis*, % |
Факторный анализ, % / Factor analysis, % |
Итоговое значение риска, баллы / Total risk value, points |
|
А |
B |
(A + B) × 100 |
|
|
Цефтриаксон / Ceftriaxone |
63,33333 |
0,463229 |
109,65623 |
|
Левофлоксацин / Levofloxacin |
77,27273 |
0,064293 |
83,70203 |
|
Амоксициллин + [клавулановая кислота] / Amoxicillin + [clavulanic acid] |
41,66667 |
0,186015 |
60,26817 |
|
Ванкомицин / Vancomycin |
31,25000 |
0,116825 |
42,93250 |
|
Цефепим / Cefepime |
0 |
0,058617 |
5,86170 |
|
Цефотаксим + [сульбактам] / Cefotaxime + [sulbactam] |
36,36364 |
0,075589 |
43,92254 |
|
Меропенем / Meropenem |
0 |
0,026148 |
2,61480 |
|
Моксифлоксацин / Moxifloxacin |
14,28571 |
0,085324 |
22,81811 |
|
Амоксициллин / Amoxicillin |
0 |
0,243885 |
24,38850 |
|
Ципрофлоксацин / Ciprofloxacin |
0 |
0,009604 |
0,96040 |
|
Метронидазол / Metronidazole |
0 |
0,036602 |
3,66020 |
|
Азитромицин / Azithromycin |
0 |
0,020878 |
2,08780 |
|
Цефотаксим / Cefotaxime |
0 |
0,024481 |
2,44810 |
Примечание. МНН – международное непатентованное наименование. * Вероятность корректного отнесения.
Note. INN – international nonproprietary name. * Probability of correct attribution.
Итоговая оценка суммарного риска возникновения НР для антибактериальных ЛП с учетом различных факторов (признаков) / Final assessing total risk of ARs for antibacterial drugs considering various factors (attributes)
Как уже было обозначено выше, суммарное значение риска определялось как сумма риска ЛП и всех факторов (условий), при которых этот ЛП применяется.
В таблице 3 представлена итоговая двухуровневая матрица риск-ориентированной модели оценки суммарного риска применения антибактериальных ЛП с учетом различных факторов (признаков). По строкам таблицы представлены МНН соответствующих антибактериальных ЛП, а в первых двух столбцах – значения риска в баллах по соответствующим ЛП по результатам дискриминантного и факторного анализа. Далее по всем остальным столбцам представлены соответствующие факторы (признаки), и в первой строке указаны суммарные собственные значения риска для каждого фактора (признака). Соответственно, каждая из оставшихся ячеек таблицы является суммой собственного значения риска ЛП и риска воздействия соответствующего фактора или его значения. На таблицу наложена «тепловая карта», в которой проведено картирование суммарного риска по соответствующей цветовой шкале. Более яркий красный цвет соответствует более высокому суммарному значению риска, более яркий зеленый цвет – более низкому значению риска. Промежуточные желтые и оранжевые цвета отражают соответствующие промежуточные значения суммарного риска.
Таблица 3. «Тепловая карта» (цветовая шкала) риск-ориентированной модели оценки суммарного риска применения антибактериальных лекарственных препаратов с учетом различных факторов (признаков), баллы
Table 3. “Heat map” (color scale) of the risk-based model of total risk assessment for the use of antibacterial drugs taking into account various factors (attributes), points
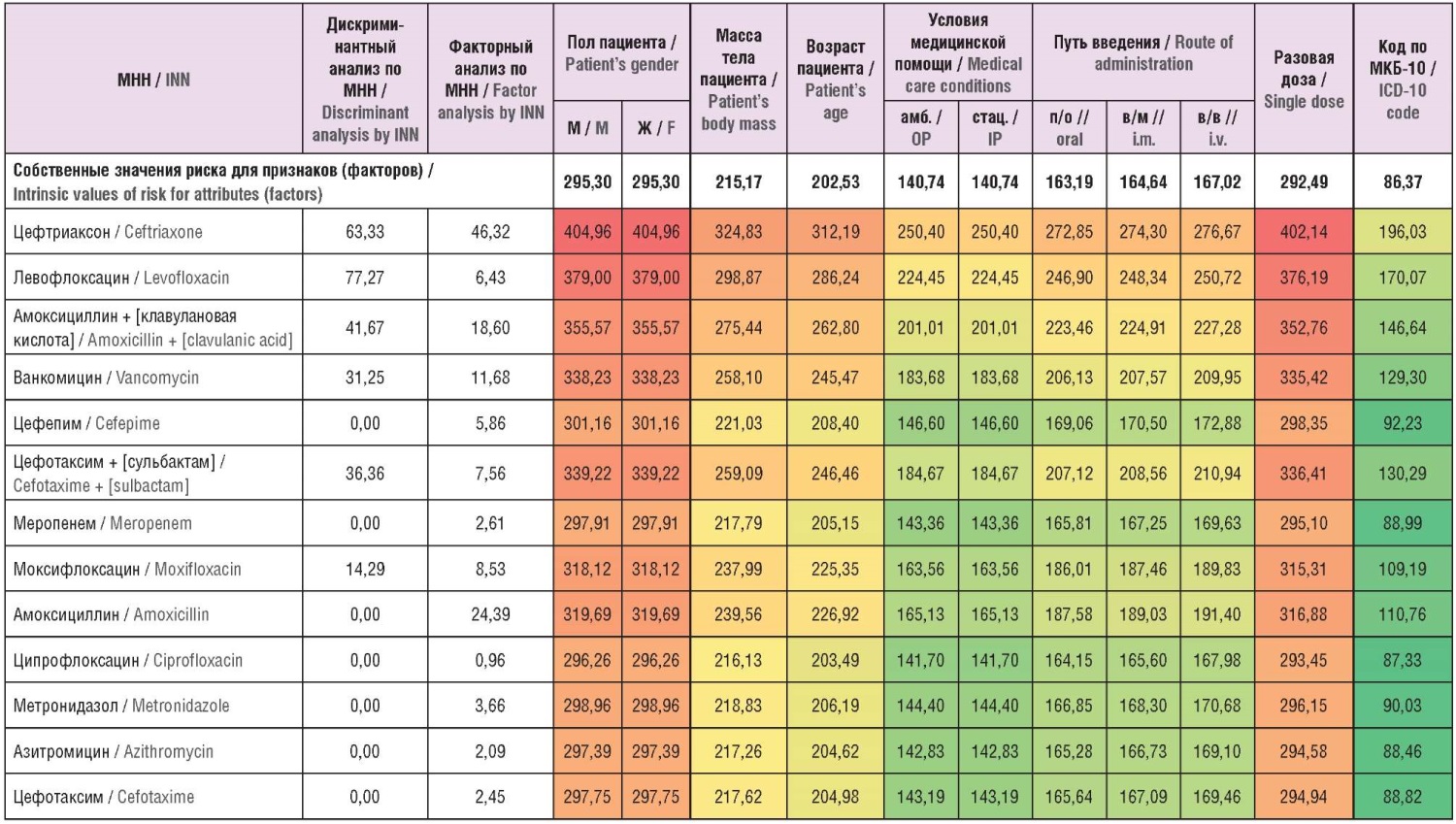
Примечание. Темно-красный цвет на «тепловой карте» соответствует наибольшему риску возникновения нежелательных реакций и явлений при применении лекарственного препарата в обозначенных условиях; красный и светло-красный – высокому риску; оранжевый, желтый и светло-желтый – среднему; светло-зеленый и зеленый – низкому; темно-зеленый – наименьшему риску возникновения нежелательных реакций и явлений. МНН – международное непатентованное наименование; М – мужской; Ж – женский; амб. – амбулаторные; стац. – стационарные; п/o – перорально; в/м – внутримышечно; в/в – внутривенно.
Note. Dark red color on the “heat map” corresponds to the highest risk of adverse reactions and events when using the drug in the designated conditions; red and light red – high risk; orange, yellow and light yellow – medium; light green and green – low; dark green – the lowest risk of adverse reactions and events. INN – international nonproprietary name; M – male; F – female; OP – outpatient; IP – inpatient i.m. – intramuscular; i.v. – intravenous
В таблице 3 показаны все возможные бинарные комбинации соответствующих ЛП с одним из анализируемых факторов (признаков). Максимальное суммарное значение риска получено для цефтриаксона – 404,96 балла в зависимости от пола пациента, что соответствует наибольшей вероятности развития НР при применении данного ЛП. Минимальное суммарное значение риска получено для азитромицина и цефотаксима в зависимости от кода по МКБ-10 – 88,46 балла. Однако следует отметить, что данные значения риска не позволяют судить о том, какой конкретно пол пациента или код МКБ-10 при каком конкретно ЛП принимает большее или меньшее значение риска. Требуется проведение дополнительных исследований по каждому ЛП в разрезе пола пациентов и кодов МКБ-10 для оценки соответствующих пороговых значений рисков в каждом из случаев.
Предложенный методический подход также позволяет комбинировать все возможные сочетания ЛП и условий их применения. Например, для применения ванкомицина в стационарных условиях путем внутривенного введения:
- собственный риск применения – 42,93 балла;
- риск применения в стационарных условиях – 183,68 балла;
- риск при внутривенном введении – 209,95 балла;
- суммарное значение риска в обозначенной ситуации – 436,56 балла.
ОБСУЖДЕНИЕ / DISCUSSION
В ходе исследования был предложен и апробирован методический подход к разработке многофакторной риск-ориентированной модели по предотвращению возникновения НР при применении антибактериальных ЛП.
Можно выделить следующие преимущества представленного методического подхода по сравнению с существующими аналогами [30–33]:
- он достаточно универсален, т.к. позволяет проводить оценку рисков для любого ЛП и для любых факторов (условий);
- возможно его использование по типу «конструктора», т.е. как раздельный учет отдельных рисков, так и суммарный учет нескольких или всех типов рисков;
- возможны перевод данной модели в цифровой формат и интеграция с медицинскими информационными системами различного уровня вследствие примененного матричного подхода;
- оценка рисков по каждому из факторов складывается из нескольких видов анализа, что предотвращает одностороннюю оценку рисков и возникновение необоснованных выбросов по результатам использования модели;
- статистически обоснован принцип формирования значений суммарных рисков в баллах по единой стандартизованной методике перевода различных коэффициентов, получаемых при статистическом анализе, в балльную шкалу.
Также можно отметить следующие недостатки предложенного методического подхода по сравнению с рядом существующих зарубежных подходов [34–41]:
- небольшой «эталонный» массив данных (187 извещений по 13 МНН);
- отсутствие точно определенных пороговых значений для количественных факторов (признаков) риск-ориентированной модели (возраст и масса тела пациента, разовая доза), для определения которых необходимо проведение целой серии отдельных исследований для каждого ЛП на достаточной выборке инцидентов;
- учет ограниченного количества факторов (признаков) в риск-ориентированной модели.
С учетом всех перечисленных преимуществ и недостатков разработанный методический подход к формированию риск-ориентированной модели по предотвращению НР, возникающих при применении антибактериальных ЛП, может быть рекомендован для апробации как на уровне отдельных медицинских организаций в качестве отдельного элемента системы внутреннего контроля качества и безопасности медицинской деятельности, так и на уровне территориального органа Росздравнадзора или органа исполнительной власти субъекта Российской Федерации в сфере охраны здоровья граждан.
ЗАКЛЮЧЕНИЕ / CONCLUSION
Разработанный подход позволит медицинским организациям значительно сократить количество случаев НР, возникающих при применении ЛП, путем категоризации и предотвращения рисков до их возникновения. Кроме того, он может способствовать обоснованному сокращению контрольных мероприятий со стороны Росздравнадзора или органа исполнительной власти субъекта Российской Федерации в сфере охраны здоровья граждан путем включения данного подхода как одного из элементов общего риск-ориентированного подхода к проведению контрольно-надзорных мероприятий соответствующего уровня. Предложенный подход также обладает значительными перспективами применения на федеральном уровне при условии его модификации на большом объеме данных.
Список литературы
1. Classen D.C., Pestotnik S.L., Evans R.S., et al. Adverse drug events in hospitalized patients. Excess length of stay, extra costs, and attributable mortality. JAMA. 1997; 277 (4): 301–6.
2. Roughead E.E., Semple S.J. Medication safety in acute care in Australia: where are we now? Part 1: a review of the extent and causes of medication problems 2002–2008. Aust New Zealand Health Policy. 2009; 6: 18. https://doi.org/10.1186/1743-8462-6-18.
3. Roughead E.E., Semple S.J., Rosenfeld E. The extent of medication errors and adverse drug reactions throughout the patient journey in acute care in Australia. Int J Evid Based Healthc. 2016; 14 (3): 113–22. https://doi.org/10.1097/XEB.0000000000000075.
4. Makary M.A., Daniel M. Medical error – the third leading cause of death in the US. BMJ. 2016; 353: i2139. https://doi.org/10.1136/bmj.i2139.
5. Leape L.L., Brennan T.A., Laird N., et al. The nature of adverse events in hospitalized patients. Results of the Harvard Medical Practice Study II. N Engl J Med. 1991; 324 (6): 377–84. https://doi.org/10.1056/NEJM199102073240605.
6. Lazarou J., Pomeranz B.H., Corey P.N. Incidence of adverse drug reactions in hospitalized patients: a meta-analysis of prospective studies. JAMA. 1998; 279 (15): 1200–5. https://doi.org/10.1001/jama.279.15.1200.
7. Davies E.C., Green C.F., Taylor S., et al. Adverse drug reactions in hospital in-patients: a prospective analysis of 3695 patient-episodes. PLoS One. 2009; 4 (2): e4439. https://doi.org/10.1371/journal.pone.0004439.
8. Runciman W.B., Roughead E.E., Semple S.J., Adams R.J. Adverse drug events and medication errors in Australia. Int J Qual Health Care. 2003; 15 (Suppl. 1): i49–59. https://doi.org/10.1093/intqhc/mzg085.
9. Bates D.W., Cullen D.J., Laird N., et al. Incidence of adverse drug events and potential adverse drug events. Implications for prevention. ADE Prevention Study Group. JAMA. 1995; 274 (1): 29–34.
10. Seddon M.E., Jackson A., Cameron C., et al. The Adverse Drug Event Collaborative: a joint venture to measure medication-related patient harm. N Z Med J. 2012; 126 (1368): 9–20.
11. Wilson R.M., Runciman W.B., Gibberd R.W., et al. The quality in Australian health care study. Med J Aust. 1995; 163 (9): 458–71. https://doi.org/10.5694/j.1326-5377.1995.tb124691.x.
12. Wiffen P., Gill M., Edwards J., Moore A. Adverse drug reactions in hospital patients: a systematic review of the prospective and retrospective studies. Bandolier. 2002; June: 1–14.
13. Aspden P., Wolcott J., Bootman J.L., et al. (Eds.) Preventing medication errors. Washington, DC: The National Academic Press; 2007. https://doi.org/10.17226/11623.
14. Kaboli P.J., Hoth A.B., McClimon B.J., Schnipper J.L. Clinical pharmacists and inpatient medical care: a systematic review. Arch Intern Med. 2006; 166 (9): 955–64. https://doi.org/10.1001/archinte.166.9.955.
15. Chisholm-Burns M.A., Kim Lee J., Spivey C.A., et al. US pharmacists’ effect as team members on patient care: systematic review and meta-analyses. Med Care. 2010; 48 (10): 923–33. https://doi.org/10.1097/MLR.0b013e3181e57962.
16. Westbrook J.I., Gospodarevskaya E., Li L., et al. Cost-effectiveness analysis of a hospital electronic medication management system. J Am Med Inform Assoc. 2015; 22 (4): 784–93. https://doi.org/10.1093/jamia/ocu014.
17. Nuckols T.K., Smith-Spangler C., Morton S.C., et al. The effectiveness of computerized order entry at reducing preventable adverse drug events and medication errors in hospital settings: a systematic review and meta-analysis. Syst Rev. 2014; 3: 56. https://doi.org/10.1186/2046-4053-3-56.
18. Baysari M.T., Westbrook J., Braithwaite J., Day R.O. The role of computerized decision support in reducing errors in selecting medicines for prescription: narrative review. Drug Saf. 2011; 34 (4): 289–98. https://doi.org/10.2165/11588200-000000000-00000.
19. Rawlins M.D., Thompson J.W. Pathogenesis of adverse drug reactions. In: Davies D.M. (Ed.) Textbook of adverse drug reactions. Oxford: Oxford University Press; 1977: 10.
20. Hakkarainen K.M., Hedna K., Petzold M., Hägg S. Percentage of patients with preventable adverse drug reactions and preventability of adverse drug reactions – a meta-analysis. PLoS One. 2012; 7 (3): e33236. https://doi.org/10.1371/journal.pone.0033236.
21. Bates D.W., Miller E.B., Cullen D.J., et al. Patient risk factors for adverse drug events in hospitalized patients. ADE Prevention Study Group. Arch Intern Med. 1999; 159 (21): 2553–60. https://doi.org/10.1001/archinte.159.21.2553.
22. Leendertse A.J., Egberts A.C., Stoker L.J., van den Bemt P.M. Frequency of and risk factors for preventable medication-related hospital admissions in the Netherlands. Arch Intern Med. 2008; 168 (17): 1890–6. https://doi.org/10.1001/archinternmed.2008.3.
23. Kelly W.N. Can the frequency and risks of fatal adverse drug events be determined? Pharmacotherapy. 2001; 21 (5): 521–7. https://doi.org/10.1592/phco.21.6.521.34540.
24. Saedder E.A., Lisby M., Nielsen L.P., et al. Number of drugs most frequently found to be independent risk factors for serious adverse reactions: a systematic literature review. Br J Clin Pharmacol. 2015; 80 (4): 808–17. https://doi.org/10.1111/bcp.12600.
25. Hanlon J.T., Pieper C.F., Hajjar E.R., et al. Incidence and predictors of all and preventable adverse drug reactions in frail elderly persons after hospital stay. J Gerontol A Biol Sci Med Sci. 2006; 61 (5): 511–5. https://doi.org/10.1093/gerona/61.5.511.
26. Ducharme M.M., Boothby L.A. Analysis of adverse drug reactions for preventability. Int J Clin Pract. 2007; 61 (1): 157–61. https://doi.org/10.1111/j.1742-1241.2006.01130.x.
27. Panattoni L.E., Vaithianathan R., Ashton T., Lewis G.H. Predictive risk modelling in health: options for New Zealand and Australia. Aust Health Rev. 2011; 35 (1): 45–51. https://doi.org/10.1071/AH09845.
28. Kansagara D., Englander H., Salanitro A., et al. Risk prediction models for hospital readmission: a systematic review. JAMA. 2011; 306 (15): 1688–98. https://doi.org/10.1001/jama.2011.1515.
29. Toll D.B., Janssen K.J.M., Vergouwe Y., Moons K.G.M. Validation, updating and impact of clinical prediction rules: a review. J Clin Epidemiol. 2008; 61 (11): 1085–94. https://doi.org/10.1016/j.jclinepi.2008.04.008.
30. Nashef S.A., Roques F., Michel P., et al. European system for cardiac operative risk evaluation (EuroSCORE). Eur J Cardiothorac Surg. 1999; 16 (1): 9–13. https://doi.org/10.1016/s1010-7940(99)00134-7.
31. Anderson K.M., Odell P.M., Wilson P.W., Kannel W.B. Cardiovascular disease risk profiles. Am Heart J. 1991; 121 (1 Pt. 2): 293–8. https://doi.org/10.1016/0002-8703(91)90861-b.
32. Stiell I.G., Greenberg G.H., McKnight R.D., et al. A study to develop clinical decision rules for the use of radiography in acute ankle injuries. Ann Emerg Med. 1992; 21 (4): 384–90. https://doi.org/10.1016/s0196-0644(05)82656-3.
33. Stevenson J.M., Williams J.L., Burnham T.G., et al. Predicting adverse drug reactions in older adults; a systematic review of the risk prediction models. Clin Interv Aging. 2014; 9: 1581–93. https://doi.org/10.2147/CIA.S65475.
34. Tangiisuran B., Scutt G., Stevenson J., et al. Development and validation of a risk model for predicting adverse drug reactions in older people during hospital stay: Brighton Adverse Drug Reactions Risk (BADRI) model. PLoS One. 2014; 9 (10): e111254. https://doi.org/10.1371/journal.pone.0111254.
35. Onder G., Petrovic M., Tangiisuran B., et al. Development and validation of a score to assess risk of adverse drug reactions among in-hospital patients 65 years or older. The GerontoNet ADR risk score. Arch Intern Med. 2010; 170 (13): 1142–8. https://doi.org/10.1001/archinternmed.2010.153.
36. Trivalle C., Burlaud A., Ducimetière P. Risk factors for adverse drug events in hospitalized elderly patients: a geriatric score. Eur Geriatr Med. 2011; 2 (5): 284–9. https://doi.org/10.1016/j.eurger.2011.07.002.
37. McElnay J.C., McCallion C.R., Al-Deagi F., Scott M.G. Development of a risk model for adverse drug events in the elderly. Clin Drug Investig. 1997; 13 (1): 47–55. https://doi.org/10.2165/00044011-199713010-00006.
38. Passarelli M.C., Jacob-Filho W. Adverse drug reactions in elderly patients: how to predict them? Einstein. 2007; 5 (3): 246–51.
39. Sakuma M., Bates D.W., Morimoto T. Clinical prediction rule to identify high-risk inpatients for adverse drug events: the JADE Study. Pharmacoepidemiol Drug Saf. 2012; 21 (11): 1221–6. https://doi.org/10.1002/pds.3331.
40. Urbina O., Ferrández O., Grau S., et al. Design of a score to identify hospitalized patients at risk of drug-related problems. Pharmacoepidemiol Drug Saf. 2014; 23 (9): 923–32. https://doi.org/10.1002/pds.3634.
41. Zopf Y., Rabe C., Neubert A., et al. Risk factors associated with adverse drug reactions following hospital admission: a prospective analysis of 907 patients in two German university hospitals. Drug Saf. 2008; 31 (9): 789–98. https://doi.org/10.2165/00002018-200831090-00007.
42. Nguyen T.L., Leguelinel-Blache G., Kinowski J.M., et al. Improving medication safety: development and impact of a multivariate model-based strategy to target high-risk patients. PLoS One. 2017; 12 (2): e0171995. https://doi.org/10.1371/journal.pone.0171995.
43. Sharif-Askari F.S., Syed Sulaiman S.A., Saheb Sharif-Askari N., Al Sayed Hussain A. Development of an adverse drug reaction risk assessment score among hospitalized patients with chronic kidney disease. PLoS One. 2014; 9 (4): e95991. https://doi.org/10.1371/journal.pone.0095991.
Об авторах
Е. В. КузнецоваРоссия
Кузнецова Елена Викторовна – заведующая организационно-методическим отделом по клинической фармакологии
ул. Шарикоподшипниковская, д. 9, Москва 115088
М. В. Журавлева
Россия
Журавлева Марина Владимировна – д.м.н., профессор кафедры клинической фармакологии и пропедевтики внутренних болезней; заместитель директора Центра клинической фармакологии; главный внештатный специалист по клинической фармакологии
Сеченовский университет) (ул. Трубецкая, д. 8/2, Москва 119048
Петровский б-р, д. 8, стр. 2, Москва 127051
Scopus Author ID: 55878917900
И. А. Михайлов
Россия
Михайлов Илья Александрович – главный специалист отдела организационно-методического обеспечения поддержки деятельности национальных медицинских исследовательских центров; ассистент кафедры организации здравоохранения и общественного здоровья с курсом оценки технологий здравоохранения; аспирант
Хохловский пер., д. 10/5, Москва 109028
ул. Баррикадная, д. 2, стр. 1, Москва 123995
ул. Воронцово поле, д. 12, стр. 1, Москва 105064
WoS ResearcherID: I-9035-2017
Scopus Author ID: 57203900904
Т. И. Курносова
Россия
Курносова Татьяна Игоревна – заместитель начальника отдела организационно-методического обеспечения поддержки деятельности национальных медицинских исследовательских центров
Хохловский пер., д. 10/5, Москва 109028
Рецензия
Для цитирования:
Кузнецова Е.В., Журавлева М.В., Михайлов И.А., Курносова Т.И. Разработка методических подходов к формированию риск-ориентированной модели для минимизации возникновения нежелательных реакций при применении лекарственных препаратов в медицинских организациях города Москвы. ФАРМАКОЭКОНОМИКА. Современная фармакоэкономика и фармакоэпидемиология. 2023;16(2):248-257. https://doi.org/10.17749/2070-4909/farmakoekonomika.2023.184
For citation:
Kuznetsova E.V., Zhuravleva M.V., Mikhailov I.A., Kurnosova T.I. Development of methodological approaches to the formation of a risk-based model to minimize the prevalence of adverse reactions in drug application in medical organizations of Moscow. FARMAKOEKONOMIKA. Modern Pharmacoeconomics and Pharmacoepidemiology. 2023;16(2):248-257. (In Russ.) https://doi.org/10.17749/2070-4909/farmakoekonomika.2023.184

Контент доступен под лицензией Creative Commons Attribution-NonCommercial-ShareAlike 4.0 International License.






































