Перейти к:
Концентрация метаболита витамина D – 25(OH)D3 как предиктор прогрессирования рака молочной железы
https://doi.org/10.17749/2070-4909/farmakoekonomika.2022.152
Аннотация
Актуальность. Прогноз прогрессирования рака молочной железы (РМЖ) важен для своевременной коррекции терапии пациенток.
Цель: оценить влияние дефицита метаболитa витамина D3 – 25(OH)D3 в сыворотке крови на прогрессирование РМЖ.
Материал и методы. Выполнено ретроспективное контролируемое исследование. Представлены результаты обследования 67 женщин 29–48 лет с гистологически верифицированным РМЖ и дефицитом витамина D. Пациентки разделены на две группы: основная группа – 34 женщины, получающие препарат витамина D, группа сравнения – 33 пациентки, не принимающие препарат витамина D.
Результаты. Показано, что уровень 25(OH)D3 менее 18,9 нг/мл достоверно ассоциирован с выраженной прогрессией РМЖ, независимо от молекулярного подтипа опухоли. Разработаны дополнительные критерии, позволяющие прогнозировать прогрессирование РМЖ.
Заключение. Для выявления вторичных изменений (наличие отдаленных метастазов у больных РМЖ) и улучшения наблюдения за пациентками рекомендуется привлекать дополнительные методы диагностики и определять промежуточный метаболит витамина D – 25(OH)D3 в периферической крови.
Для цитирования:
Фролова Д.Е., Лапочкина Н.П., Громова О.А., Торшин И.Ю. Концентрация метаболита витамина D – 25(OH)D3 как предиктор прогрессирования рака молочной железы. ФАРМАКОЭКОНОМИКА. Современная фармакоэкономика и фармакоэпидемиология. 2022;15(4):472-477. https://doi.org/10.17749/2070-4909/farmakoekonomika.2022.152
For citation:
Frolova D.Е., Lapochkina N.P., Gromova О.А., Torshin I.Yu. Concentration of vitamin D metabolite – 25(OH)D3 as a predictor of breast cancer progression. FARMAKOEKONOMIKA. Modern Pharmacoeconomics and Pharmacoepidemiology. 2022;15(4):472-477. (In Russ.) https://doi.org/10.17749/2070-4909/farmakoekonomika.2022.152
ВВЕДЕНИЕ / INTRODUCTION
Ежегодно среди 2,3 млн установленных во всем мире диагнозов злокачественных новообразований рак молочной железы (РМЖ) является наиболее часто диагностируемым у женщин и ведущей причиной смертности от злокачественного процесса [1]. Поскольку за последние 20 лет понимание рака расширилось, изменение образа жизни и эффективные программы скрининга, а также новые виды лечения привели к прогрессу в профилактике и лечении злокачественных опухолей [2].
Витамины, в частности витамин D, играют ключевую роль в патофизиологии злокачественных новообразований, в т.ч. и РМЖ. Биологически наиболее активный метаболит витамина D – 1,25-дигидроксивитамин D (1,25(OH)D3) является высокоактивным лигандом, который с помощью рецептора витамина D (англ. vitamin D receptor, VDR) индуцирует изменения в эпигеноме как здоровых, так и опухолевых клеток и таким образом влияет на их транскриптом. Поскольку быстрорастущие иммунные и раковые клетки используют одни и те же пути и гены для контроля своей пролиферации, дифференцировки и апоптоза, не удивительно, что передача сигналов витамина D изменяет эти процессы и в опухолевых клетках [3].
Исследования влияния витамина D на раковые клетки молочной железы показали, что его потребление увеличивает дифференцировку и апоптоз в этих клетках – эффект, который вполне сопоставим с противоопухолевой активностью таких агентов, как антрациклины, таксаны и тамоксифен [4].
В последнее время широко анализируются вопросы о влиянии низкого уровня витамина D на возрастание риска развития рака, а также различных патологических процессов в организме и смерти [5]. Многие исследователи приводят данные о том, что этот нутриент подавляет процесс гликолиза, который необходим опухолевым клеткам для энергетического баланса, роста и выживания. Блокируя гликолитические ферменты, витамин D существенно снижает потребление глюкозы, активирует апоптоз, таким образом уменьшая жизнедеятельность раковых клеток [6]. Отмечается высокая распространенность его недостаточности у большей части пациенток с впервые выявленным РМЖ. Дефицит или недостаточность витамина D может быть патофизиологически связана с развитием или прогрессированием заболевания [7]. Полученные результаты дают основание продолжить исследования противоопухолевого действия витамина D при прогрессировании РМЖ.
Цель – оценить влияние дефицита метаболитa витамина D – 25(OH)D3 в сыворотке крови на прогрессирование РМЖ.
МАТЕРИАЛ И МЕТОДЫ / MATERIAL AND METHODS
Дизайн исследования / Study design
Выполнено ретроспективное контролируемое исследование, в основу которого положен анализ наблюдений за больными РМЖ, получавшими лечение в ОБУЗ «Ивановский областной онкологический диспансер» с 2018 по 2020 гг. В исследование включены 67 женщин в возрасте от 29 до 48 лет с гистологически верифицированным РМЖ и дефицитом витамина D.
Критерии включения и исключения / Inclusion and exclusion criteria
Использовались следующие критерии включения:
- возраст старше 18 лет и моложе 50 лет;
- наличие злокачественного новообразования молочной железы, подтвержденное результатами клинического обследования, ультразвукового исследования (УЗИ), маммографии, гистологического заключения.
Критериями исключения являлись:
- наличие в анамнезе заболеваний, сопровождающихся дефицитом витамина D;
- психические расстройства;
- острые инфекционные заболевания;
- острые стадии хронических воспалительных процессов;
- период беременности и лактации.
Группы пациенток / Groups of patients
Самой молодой пациентке (n=1; 1,49%) было 29 лет, возраст большей части больных (n=66; 98,51%) составлял 46–48 лет. Пациентки были разделены на две группы. Основная группа (n=34) включала пациенток, которым выполнено специализированное противоопухолевое лечение РМЖ согласно клиническим рекомендациям [8]. Женщины этой группы принимали препараты витамина D (действующее вещество – холекальциферол, водный раствор) в дозе 4000 МЕ/сут в течение 6 мес. В группу сравнения (n=33) вошли пациентки с РМЖ, которые получали такое же комплексное лечение, но не принимали препараты витамина D.
Методы исследования / Study methods
Всем пациенткам проводили рентгеновскую маммографию в двух проекциях на аппарате цифровой маммографии Senographe (GE Healthcare, США), УЗИ молочных желез и регионарной зоны лимфатического оттока на аппарате экспертного класса Logiq 9 (GE Healthcare, США). Выполняли трепанобиопсию опухоли молочной железы с гистологическим, иммуногистохимическим исследованиями с определением рецепторного статуса, наличия онкогена – рецептора эпидермального фактора роста 2-го типа (англ. Human epidermal growth factor receptor 2, Her2/neu). Уровень промежуточного метаболита витамина D – 25(OH)D3 в периферической крови определяли с помощью хемилюминесцентного метода у всех пациенток трижды: в исходном состоянии (до лечения, 1-й визит), через 6 мес (2-й визит) и через 12 мес (3-й визит).
Этические аспекты / Ethical aspects
Все процедуры, выполненные в данном исследовании, соответствовали этическим стандартам Хельсинской декларации 1964 г. и ее последующим изменениям, а также сопоставимым нормам этики. Все пациентки до начала исследования подписали информированное добровольное согласие. Дизайн исследования рассмотрен и одобрен локальным этическим комитетом ФГБОУ ВО «Ивановская государственная медицинская академия» Минздрава России (протокол № 1 от 17 января 2018 г.).
Статистический анализ / Statistical analysis
Данные обрабатывали с использованием методов математической статистики: проводили расчет числовых характеристик случайных величин, проверку статистических гипотез на основе параметрических и непараметрических критериев.
Для сравнения прогнозируемой и наблюдаемой частот встречаемости исследуемых признаков использовали критерии χ2, Вилкоксона–Манна–Уитни и t-тест Стьюдента. Числовые показатели представлены в виде среднего арифметического и среднего квадратического отклонения (М±σ), рассчитанных с помощью программного обеспечения Statistica 10.0 (StatSoft Inc., США). Анализ предикторов (клинических и биохимических) прогрессирования РМЖ, в т.ч. концентрации 25(ОН)D3, выполняли с использованием ROC-анализа.
РЕЗУЛЬТАТЫ / RESULTS
Стадия I РМЖ определена у 20 (29,85%) больных, IIa – у 37 (55,22%), IIb – у 2 (2,98%), IIIа – у 1 (1,49%), IIIb – у 7 (10,46%), стадия IV не встречалась. Лечение носило преимущественно комплексный характер и включало (нео)адъювантную полихимиотерапию, радикальную мастэктомию, послеоперационную лучевую терапию, таргетную и гормонотерапию.
По гистологическому строению преобладал инфильтрирующий дольковый рак – 89,55%, протоковый рак отмечен в 8,95% случаев, «редкие» гистологические РМЖ – в 1,49%. У пациенток основной группы чаще встречались агрессивные молекулярные подтипы опухолей: Her2/neu-положительный РМЖ – у 11 (32,35%), трижды негативный (англ. Triple-negative, Trip.neg) – у 13 (38,23%).
В исследованной выборке прогрессия заболевания была выявлена в 4 (5,97%) случаях. При анализе 42 показателей состояния, собранных в ходе исследования, установлено, что пациентки существенно различались по 10 клиническим и биохимическим показателям (табл. 1).
Таблица 1. Показатели, отличающие пациенток с прогрессированием рака молочной железы (РМЖ) от больных со стабильным состоянием
Table 1. Parameters distinguishing progression vs. stable breast cancer (ВС) patients

Примечание. Показатели упорядочены по убыванию информативности, т.е. по возрастанию статистической значимости различий (р) между группами. Полужирным шрифтом выделены статистически значимые различия. S – светосумма за 30 с; Imax – значение максимальной интенсивности перекисного окисления липидов за все время измерения; Tg – тангенс угла убывания сигнала после достижения максимальной интенсивности, характеризующий скорость реакций обрыва свободнорадикальных процессов и являющийся показателем активности антиоксидантной системы со знаком (–). * 1-й визит; ** 2-й визит; *** 3-й визит.
Note. The parameters are sorted in descending order of informativeness, i.e., in order of increasing statistical significance of inter-group differences (p). Statistically significant differences are highlighted in bold. S – the light sum within 30 s; Imax – the magnitude of the maximum intensity of lipid peroxidation within the entire measurement time; Tg – tangent of the angle of signal decay after reaching the maximum intensity, which characterizes the rate of termination reactions of free radical processes being an indicator of (–) antioxidant system activity. * Visit 1; ** Visit 2; *** Visit 3.
Показатель уровня 25(ОН)D3 снижался на 3-м визите, что явилось наиболее сильным предиктором прогрессирования опухоли: уровень 25(ОН)D3 не более 18,9 нг/мл на 3-м визите выявлен у 100% пациенток с прогрессией РМЖ и только у 16% без прогрессии. Следует отметить, что содержание 25(OH)D3 в периферической крови перед началом прогрессирования заболевания снижалось вне зависимости от приема препаратов витамина D, результатов гистологического исследования опухоли и молекулярных подтипов РМЖ.
Выполнен ROC-анализ, по результатам которого было показано, что при концентрации 25(OH)D3 менее 18,9 нг/мл диагностируется прогрессирование заболевания. Специфичность и чувствительность данного предиктора составили 77,3% и 100% соответственно, площадь под кривой (англ. area under curve, AUC) – 0,914 (рис. 1).
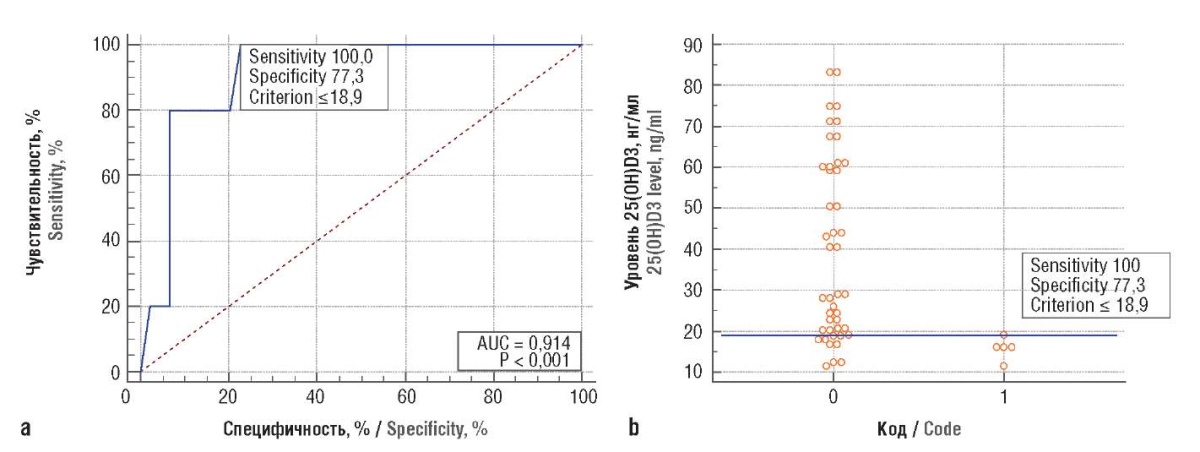
Рисунок 1. Результаты ROC-анализа содержания промежуточного метаболита витамина 25(ОН)D3 в крови больных раком молочной железы (a, b)
Figure 1. ROC-analysis data for serum 25(ОН)D3 intermediate metabolite level in breast cancer patients (a, b)
Вторым наиболее информативным предиктором стал показатель биолюминесценции – тангенс (Tg) угла убывания сигнала после достижения максимальной интенсивности (на 2-м визите), который отражает антиоксидантный статус пациенток: Tg свыше –30 ед. был определен на 2-м визите у всех больных с прогрессией РМЖ (100%) и ни у одной пациентки без прогрессии заболевания (0%).
ОБСУЖДЕНИЕ / DISCUSSION
Наиболее информативные показатели – уровни 25(ОН)D3 на 3-м визите и Tg на 2-м визите являются биохимическими параметрами, измерение которых инвазивно, т.к. требует отбора проб крови. Многие из менее информативных показателей (см. табл. 1) получены при физикальном обследовании пациенток и при анализе анамнеза жизни (неинвазивно).
Пациентки с прогрессированием опухоли отличались так называемым гиперэстрогеновым фенотипом, включающим наличие предменструального синдрома (ПМС), обильных и длительных менструаций, чистую кожу при отсутствии акне, а также локализацией опухоли слева (см. табл. 1). Гиперэстрогеновый профиль у них усугубляется при регулярном потреблении пива и алкоголя (был установлен тренд, р=0,0738). Эстрогены являются активаторами пролиферативных процессов, особенно в эстрогенозависимых тканях, в т.ч. в молочных железах и яичниках. Давно известно, что хронический прием алкоголя вызывает гиперэстрогенизм даже у мужчин [9].
У пациенток с прогрессированием опухоли был серый или голубой, но не карий цвет глаз. Хотя данное наблюдение являлось трендом (р=0,0734), оно имеет физическое обоснование. Известно, что цвет радужной оболочки глаз ассоциирован с наличием определенных нуклеотидных вариантов генов, кодирующих цитохромы Р450, таким образом, ассоциация между цветом глаз и риском прогрессирования опухолевых заболеваний имеет генетическую природу. В частности, у обследуемых с глазами голубого цвета наличие варианта цитохрома CYP2D6-EM соответствует повышенному риску развития опухолей [10].
Установление связи между цветом радужной оболочки глаза и риском прогрессии РМЖ является новым наблюдением, неизвестным в научной литературе по данному вопросу. Поэтому оно указывает на необходимость проведения более масштабных исследований. Наша работа ограничена тем, что число пациенток с прогрессией РМЖ и определенным цветом глаз было весьма мало, и даже не удалось показать статистически достоверные ассоциации между цветом глаз и прогрессией РМЖ.
Сочетания перечисленных физикальных и анамнестических признаков являются более важными и информативными предикторами, чем наличие каждого из признаков по отдельности. Так, сочетание 8 информативных физикальных/анамнестических признаков (отсутствие акне, высокий уровень стресса, предменструальный синдром, длительные менструации – 6 и более дней, болезненные и обильные менструации, локализация опухоли слева, голубой или серый цвет глаз) встречалось у всех пациенток с прогрессией (100%) и только у 3 из 67 больных без прогрессии (4%). Следовательно, наличие сочетания этих 8 признаков соответствует крайне высокому риску прогрессирования опухоли. Хотя по отдельности некоторые из признаков были ассоциированы с прогрессией РМЖ только как тренд (голубой или серый цвет глаз, р=0,0734), различия в частоте сочетания 8 указанных признаков были статистически достоверны (отношение шансов 20; 95% доверительный интервал 3,28–121,84; χ2= 4,53×10–5).
В то же время у пациенток с высоким риском прогрессирования злокачественной опухоли молочной железы, оцененным по физикальным/анамнестическим данным, измерение уровня 25(ОН)D на 3-м визите и показателя биолюминесценции Tg на 2-м визите позволяет зарегистрировать раннее начало прогрессирования заболевания.
Итак, по результатам нашего исследования предложен двухшаговый алгоритм скринингового обследования больных РМЖ.
На первом этапе, который проводится при первичном посещении врача-онколога или маммолога (1-й визит), устанавливается принадлежность пациентки к группе с повышенным риском прогрессирования РМЖ (в соответствии с наличием всех 8 информативных физикальных/анамнестических признаков). Если больная отнесена к данной группе, то на втором этапе каждые 6 мес у нее измеряется уровень 25(ОН)D3 и показатель биолюминесценции Tg (по данным анализа крови). Негативная динамика указанных показателей (25(ОН)D3 менее 18,9 нг/мл при 3-м визите и Tg свыше –30 ед. при 2-м визите) свидетельствует о начале прогрессирования опухоли. При этом снижение значений происходит даже на фоне приема препаратов витамина D3 в дозе 4000–10000 МЕ/сут.
Таким образом, были разработаны дополнительные критерии на основании концентраций 25(ОН)D3 , показателей биолюминесценции крови, анамнестических и физикальных данных (см. табл. 1), позволяющие прогнозировать прогрессирование РМЖ.
ЗАКЛЮЧЕНИЕ / CONCLUSION
Снижение уровня промежуточного метаболита витамина D – 25(OH)D3 в сыворотке крови является прогностическим признаком прогрессирования РМЖ независимо от молекулярного подтипа опухоли и потребления витамина D. На основании полученных данных были установлены признаки, сочетание которых позволяет делать прогноз о прогрессировании РМЖ: сниженное содержание 25(OH)D3, отсутствие акне, высокий уровень стресса, наличие ПМС, длительные (6 и более дней) и обильные менструации, локализация опухоли слева, голубой или серый цвет глаз. Так, при уровне промежуточного метаболита витамина D – 25(OH)D3 менее 18,9 нг/мл диагностируется прогрессирование заболевания. Выборки может быть недостаточно для получения корректных данных, и требуются более масштабные исследования для подтверждения изложенной гипотезы.
Таким образом, для выявления вторичных изменений (наличие отдаленных метастазов у больных РМЖ) и улучшения наблюдения за пациентками рекомендуется привлекать дополнительные методы диагностики и определять уровень промежуточного метаболита витамина D – 25(OH)D3 в периферической крови.
Список литературы
1. Mattiuzzi C., Lippi G. Current cancer epidemiology. J Epidemiol Glob Health. 2019; 9 (4): 217–22. https://doi.org/10.2991/jegh.k.191008.001.
2. Brown R.B. Vitamin D, cancer, and dysregulated phosphate metabolism. Endocrine. 2019; 65 (2); 238–43. https://doi.org/10.1007/s12020-019-01985-y.
3. Carlberg C., Muñoz A. An update on vitamin D signaling and cancer. Semin Cancer Biol. 2022; 79: 217–30. https://doi.org/10.1016/j.semcancer.2020.05.018.
4. Ercisli M.F., Kahrizi D., Aziziaram Z. Environmental factors affecting the risk of breast cancer and the modulating role of vitamin D on this malignancy. Cent Asian J Environ Sci Technol Innov. 2021; 2 (4): 175–83. https://doi.org/10.22034/CAJESTI.2021.04.04.
5. Милехина С.А., Трейбич М.А., Гринько Г.В. Роль витамина Д в развитии онкологических заболеваний. Международный журнал гуманитарных и естественных наук. 2022; 6-1: 82–5. https://doi.org/10.24412/2500-1000-2022-6-1-82-85.
6. Santos J.M., Khan Z.S., Munir M.T., et al. Vitamin D3 decreases glycolysis and invasiveness, and increases cellular stiffness in breast cancer cells. J Nutr Biochem. 2018; 53: 111–20. https://doi.org/10.1016/j.jnutbio.2017.10.013.
7. Voutsadakis I.A. Vitamin D baseline levels at diagnosis of breast cancer: a systematic review and meta-analysis. Hematol Oncol Stem Cell Ther. 2021; 14 (1): 16–26. https://doi.org/10.1016/j.hemonc.2020.08.005.
8. Клинические рекомендации. Рак молочной железы. 2021. URL: http://oncology.ru/specialist/treatment/references/actual/379.pdf (дата обращения 05.08.2021).
9. Kiełkiewicz D., Medraś M., Dolna M. Use of a dynamic test with HCG for evaluation of endocrine function in gonads of men with chronic alcohol abuse. Pol Merkur Lekarski. 2001; 10 (56): 85–8 (in Polish).
10. Torshin I.Yu. Sensing the change: from molecular genetics to personalized medicine. 1st ed. NY: Nova Science Publishers Inc.; 2012: 336 pр.
Об авторах
Д. Е. ФроловаРоссия
Фролова Дарья Евгеньевна – ассистент кафедры онкологии, акушерства и гинекологии
Шереметьевский пр-т, д. 8, Иваново 153012
Н. П. Лапочкина
Россия
Лапочкина Нина Павловна – д.м.н., профессор, заведующая кафедрой онкологии, акушерства и гинекологии
Шереметьевский пр-т, д. 8, Иваново 153012
О. А. Громова
Россия
Громова Ольга Алексеевна – д.м.н., профессор, ведущий научный сотрудник, научный руководитель Института фармакоинформатики
ул. Вавилова, д. 44, корп. 2, Москва 119333
WoS ResearcherID: J-4946-2017
Scopus Author ID: 7003589812
И. Ю. Торшин
Россия
Торшин Иван Юрьевич – к.ф-м.н., к.х.н., старший научный сотрудник Института фармакоинформатики
ул. Вавилова, д. 44, корп. 2, Москва 119333
WoS ResearcherID: C-7683-2018
Scopus Author ID: 7003300274
Рецензия
Для цитирования:
Фролова Д.Е., Лапочкина Н.П., Громова О.А., Торшин И.Ю. Концентрация метаболита витамина D – 25(OH)D3 как предиктор прогрессирования рака молочной железы. ФАРМАКОЭКОНОМИКА. Современная фармакоэкономика и фармакоэпидемиология. 2022;15(4):472-477. https://doi.org/10.17749/2070-4909/farmakoekonomika.2022.152
For citation:
Frolova D.Е., Lapochkina N.P., Gromova О.А., Torshin I.Yu. Concentration of vitamin D metabolite – 25(OH)D3 as a predictor of breast cancer progression. FARMAKOEKONOMIKA. Modern Pharmacoeconomics and Pharmacoepidemiology. 2022;15(4):472-477. (In Russ.) https://doi.org/10.17749/2070-4909/farmakoekonomika.2022.152

Контент доступен под лицензией Creative Commons Attribution-NonCommercial-ShareAlike 4.0 International License.






































