Перейти к:
Исследование методов государственного регулирования цен и издержек системы здравоохранения на лекарственные препараты в Великобритании
https://doi.org/10.17749/2070-4909/farmakoekonomika.2022.102
Аннотация
Цель: анализ государственного регулирования цен и издержек на закупку лекарственных препаратов (ЛП) в Великобритании, а также разработка предложений по совершенствованию процессов государственного регулирования предельных зарегистрированных цен производителей на препараты, включенные в перечень жизненно необходимых и важнейших ЛП, утвержденный в Российской Федерации.
Материал и методы. Анализ структуры государственного регулирования цен и издержек на закупку ЛП проведен на основании сведений, содержащихся в нормативных правовых документах Правительства Великобритании, служб здравоохранения и технического регулирования, а также информации, представленной в систематических обзорах и статьях.
Результаты. Ключевой особенностью регулирования в Великобритании является максимизация эффективности издержек здравоохранения на основе принципов цифровизации, долгосрочного планирования и оценки технологий здравоохранения при ценообразовании. Государственное регулирование издержек сконцентрировано на сегменте ЛП, находящихся под патентной защитой. Поставщики таких препаратов подпадают под действие Добровольной или Принудительной схемы доступа на рынок и обязаны осуществлять платежи в виде фиксированного процента продаж в пользу Департамента здравоохранения и социального обеспечения. Отдельные сегменты лекарств освобождены от платежей с целью стимулирования инновационного развития фармацевтической отрасли и ускорения доступа на рынок новых видов терапии. Как показывает практика, Добровольная схема выгоднее для большинства компаний. Регулирование в сегменте воспроизведенных ЛП осуществляется механизмами свободного рынка и антимонопольной службой.
Заключение. В результате анализа выявлены механизмы и ключевые особенности методов государственного регулирования цен и издержек системы здравоохранения на закупку ЛП, определены лучшие практики, перспективные для адаптации с целью совершенствования подходов государственного регулирования цен в Российской Федерации.
Ключевые слова
Для цитирования:
Лешкевич А.А., Юрочкин Д.С., Голант З.М., Наркевич И.А. Исследование методов государственного регулирования цен и издержек системы здравоохранения на лекарственные препараты в Великобритании. ФАРМАКОЭКОНОМИКА. Современная фармакоэкономика и фармакоэпидемиология. 2022;15(1):23-39. https://doi.org/10.17749/2070-4909/farmakoekonomika.2022.102
For citation:
Leshkevich A.A., Yurochkin D.S., Golant Z.M., Narkevich I.A. Study of methods for state regulation of prices and costs of the health care system for medicines in the United Kingdom. FARMAKOEKONOMIKA. Modern Pharmacoeconomics and Pharmacoepidemiology. 2022;15(1):23-39. (In Russ.) https://doi.org/10.17749/2070-4909/farmakoekonomika.2022.102
ВВЕДЕНИЕ / INTRODUCTION
Цена лекарственного препарата (ЛП), который находится под патентной защитой, является ключевым фактором, определяющим скорость возврата инвестиций в исследования (англ. research and development, R&D). В Великобритании (ВБ), странах Евросоюза, США, Китае, Японии на уровне государственного регулирования внедрены существенные меры поддержки и стимулирования разработки инновационной медицинской и фармацевтической продукции, которые кратно превышают ассигнования, направленные на развитие соответствующих отраслей в Российской Федерации (РФ). Актуальным остается вопрос ежегодно возрастающей и в перспективе критической финансовой нагрузки инновационных технологий на развивающиеся системы здравоохранения. Участники рынка (фармацевтические и медицинские компании) также вынуждены смещать фокус на разработку и внедрение в медицинскую практику оригинальных ЛП с учетом принципов доказательной и персонифицированной медицины, в т.ч. средств для терапии редких (орфанных) заболеваний.
Система государственного регулирования ценообразования на важнейшие ЛП в РФ предполагает достаточно жесткое ограничение цен производителей на основании реферирования со странами из перечня референтных стран и выбора минимальных цен. Несмотря на эффективность с точки зрения снижения издержек государственного бюджета, такой подход не включает достаточно широкий набор инструментов регулирования фармацевтического рынка, способствующих обеспечению эффективного баланса между экономией и долгосрочным инновационным развитием локальной фармацевтической промышленности. Среди таких инструментов можно выделить применение принципов оценки технологий здравоохранения (ОТЗ), сегментирование требований к ценообразованию в зависимости от наличия патентной защиты и области применения ЛП, внедрение схем разделения рисков в особых группах ЛП. Создание рациональной системы контроля затрат здравоохранения на лекарственную терапию предполагает поиск лучших практик ценообразования, обеспечивающих баланс издержек государства и «справедливой» прибыли производителей.
Таким образом, целесообразным является исследование подходов и инструментов государственного регулирования цен и издержек на закупку ЛП, включая определение перспективных практик, на примере одного из наиболее развитых фармацевтических рынков – Великобритании.
Цель – анализ государственного регулирования цен и издержек на закупку ЛП в ВБ, а также разработка предложений по совершенствованию процессов государственного регулирования предельных зарегистрированных цен производителей на препараты, включенные в перечень жизненно необходимых и важнейших ЛП, утвержденный в РФ.
МАТЕРИАЛ И МЕТОДЫ / MATHERIAL AND METHODS
Этапы исследования / Stages of the study
Исследование включало следующие этапы:
- поиск информации о порядке государственного регулирования издержек здравоохранения на ЛП;
- сбор и систематизация информации отраслевых нормативных актов, статей, обзоров;
- анализ собранной информации, выделение и сопоставление методов контроля издержек, ключевых особенностей регулирования патентованных и воспроизведенных ЛП, методик расчета ключевых показателей;
- формулирование выводов и рекомендаций.
Источники информации / Sources of information
Источниками информации о структуре здравоохранения и подходах к государственному регулированию цен являются ведомственные нормативные акты ВБ [1–5], а также аналитические базы данных [6][7].
Перечень нормативных правовых актов, используемых в исследовании, включает Постановление Правительства РФ от 31 октября 2020 г. № 1771 [8], Указ Президента РФ от 7 мая 2018 г. № 204 [9], Постановление Правительства РФ от 26 декабря 2017 г. № 1640 [10] и другие документы.
Представление результатов / Presentation of results
Результаты и выводы по итогам исследования представлены в виде графической и аналитической информации, а также рекомендаций, реализация которых, по мнению авторов, будет способствовать совершенствованию процессов обращения ЛП и повышению качества услуг, предоставляемых системой здравоохранения РФ.
РЕЗУЛЬТАТЫ / RESULTS
Комплексная система охраны здоровья граждан, сформированная в ВБ, позволяет государству эффективно выполнять социальную функцию в части лекарственного обеспечения населения необходимой терапией и оплачивать большую часть ЛП, выписываемых пациентам. Принятие решений о возмещении стоимости ЛП основывается на результатах ОТЗ, которая может корректироваться в соответствии с изменениями структуры заболеваемости и появлением новых средств терапии.
В ВБ выделяется три группы ЛП [1]:
- препараты рецептурного отпуска;
- препараты безрецептурного отпуска, реализуемые только в аптеках;
- препараты общего порядка реализации безрецептурного отпуска, которые потребитель может приобрести не только в аптеке, но и в обычных магазинах.
Возмещению могут подлежать все три группы ЛП, однако система здравоохранения концентрирует расходы прежде всего в рецептурном сегменте. В первичном звене здравоохранения (англ. primary care)1 возмещению подлежат практически все ЛП, за исключением препаратов, включенных в «черный список»2 (Drug Tariff3). Во вторичном звене обычно назначаются более специфичные, зачастую рецептурные возмещаемые ЛП. Оценка эффективности назначений вторичного звена (и, соответственно, затрат) возложена на медицинские организации и их клинико-фармакологические комиссии.
Сумма к возмещению отпущенного препарата устанавливается в соответствии с базовой ценой, указываемой в Drug Tariff, в исключительных случаях возмещение осуществляется без сформированной базовой цены по фактической отпускной цене. Служба здравоохранения пересматривает базовые цены в Drug Tariff ежемесячно в соответствии с рыночной конъюнктурой. Базовые цены ВБ нередко служат референтными для других стран, однако необходимо учитывать, что производители могут заключать индивидуальные и конфиденциальные соглашения о поставках с существенным снижением цены, которое не отражается в Drug Tariff, что снижает репрезентативность представленной в нем информации как референта.
К основным механизмам регулирования цен и издержек системы здравоохранения на закупку ЛП в ВБ относятся:
- базовые цены возмещения в Drug Tariff;
- право службы здравоохранения и правительства на ограничение и повышение базовых цен;
- Добровольная и Принудительная схемы регулирования затрат на патентованные ЛП4;
- рыночные механизмы саморегулирования в сегменте воспроизведенных ЛП.
Патентная защита позволяет производителям и поставщикам ЛП реализовывать продукцию по монопольно высоким ценам. Необходимость патентной защиты (и, соответственно, монополии) в фармацевтике обусловлена высокой стоимостью и рисками разработки и вывода на рынок оригинальных ЛП. Однако задачей службы здравоохранения при организации лекарственного обеспечения является формирование системы, при которой терапия была бы доступна максимально широкому кругу пациентов в необходимом количестве. Таким образом, задача выявления справедливого уровня расходов на ЛП является одной из ключевых для эффективного функционирования здравоохранения. В ВБ стоимость ЛП, находящихся под патентной защитой, контролируется с помощью двух схем:
- Добровольная схема регулирования цен и доступа на рынок патентованных препаратов (англ. The 2019 Voluntary Scheme for Branded Medicines Pricing and Access) – схема регулирования издержек системы здравоохранения на закупку патентованных препаратов, участие в которой для поставщиков ЛП является добровольным [2][3];
- Принудительная схема регулирования издержек на патентованные препараты 2018 г. (англ. The Branded Health Service Medicines (Costs) Regulations 2018), в которую автоматически включены производители и поставщики патентованных ЛП (в т.ч. участники Схемы ценового регулирования в фармации 2014 г. (англ. The Pharmaceutical Pricing Regulation Scheme, PPRS)), отказавшиеся от участия в Добровольной схеме [4][11][12].
Большая часть воспроизведенных препаратов (кроме биосимиляров) не подпадают под действие Добровольной и Принудительной схем. Таким образом, сумма возмещения затрат на такие препараты в виде базовой цены Drug Tariff устанавливается рынком. Мониторинг и выявление случаев «неразумного» завышения цен на дженерики является обязанностью антимонопольной службы. Актом об ограничении издержек на медицинские продукты государственной системы здравоохранения [5] установлена законодательная возможность правительства ограничить или снизить цену воспроизведенного препарата, если она признана «неразумной».
Добровольная схема / Voluntary Scheme
Добровольная схема – инструмент государственного регулирования издержек системы здравоохранения на закупку ЛП, сформированный в результате переговоров между участниками фармацевтического рынка: государственной службой здравоохранения и фармацевтической отраслью (поставщиками ЛП). Результатом этих переговоров является достаточно оригинальная система, которая фокусируется не на ограничении производителей, а на максимизации эффективности издержек здравоохранения. Необходимость равного диалога с промышленностью при формировании программ, ограничивающих издержки, обусловлена возможным отложенным эффектом снижения заинтересованности разработчиков ЛП во внедрении инновационных средств терапии вследствие излишнего ограничения доходности долгосрочных инвестиций в R&D и инфраструктуру для вывода на рынок новых действующих веществ (ДВ).
В указанной схеме введен лимит на рост общих издержек на закупку патентованных ЛП. Участники Добровольной схемы, годовые продажи которых в рамках схемы превышают 5 млн фунтов стерлингов (около 520 млн руб.), производят платежи исходя из разницы между допустимым и фактическим ростом расходов государства.
Добровольная схема вступила в силу 1 января 2019 г., придя на смену PPRS. Основными участниками процесса ее разработки и совершенствования являются Департамент здравоохранения и социального обеспечения (англ. Department of Health and Social care, DHSC), Национальная служба здравоохранения Великобритании (англ. United Kingdom National Health Service, NHS), Ассоциация фармацевтических производителей Британии (англ. Association of the British Pharmaceutical Industry, ABPI). Дополнительными участниками схемы являются поставщики лекарств, не входящие в ABPI, а также Национальный институт здравоохранения и передового опыта (англ. The National Institute for Health and Care Excellence, NICE).
Перечень продуктов, подпадающих под действие схемы5, включает:
- оригинальные ЛП под патентной защитой;
- брендированные дженерики;
- медицинские изделия для in vivо диагностики;
- препараты крови;
- жидкости для диализа;
- брендированные продукты, поставляемые по процедурам тендеров по государственным и муниципальным контрактам;
- биомедицинские препараты (в т.ч. биосимиляры).
Добровольная схема не распространяется:
- на препараты, приобретаемые за счет частных средств (т.е. действие схемы распространяется только на закупки в рамках государственных программ возмещения);
- на дентальные анестетики;
- на продажи по внебиржевым сделкам (англ. over the counter) (кроме продаж препаратов общего порядка реализации в систему здравоохранения, если они превышают 50 тыс. фунтов (около 5,250 млн руб.) в год).
Общие положения
Добровольная схема действует в течение 5 лет с 1 января 2019 г. до 31 декабря 2023 г. В рамках схемы поставщики ЛП осуществляют платежи в виде процента от выручки в пользу DHSC. Два раза в год основные участники процесса разработки организуют совещания, на которых осуществляется оценка и при необходимости ревизия эффективности существующего порядка применения Добровольной схемы.
Участником схемы может стать держатель регистрационного удостоверения (РУ) (англ. marketing authorization) препарата:
- если он локализован в ВБ (участником схемы должен быть либо сам держатель РУ, либо локальная организация из группы компаний держателя РУ);
- если он не локализован в ВБ, но в группе компаний владельца РУ есть локализованная организация (она должна участвовать в схеме от лица владельца РУ);
- если он не локализован в ВБ и нет локальных организаций в той же группе компаний (участником схемы должен стать первый поставщик ЛП схемы или первый получатель ЛП в ВБ).
Присоединение к Добровольной схеме может осуществляться компанией от своего лица либо посредством участия в ассоциации компаний – объединении нескольких организаций в группу с выделением лидирующей компании. Ассоциациям позволяется осуществлять консолидированные платежи по схеме, а также предоставлять консолидированную отчетность. Лидирующая компания несет ответственность за предоставляемую отчетность и объем платежей ассоциации.
Цели и задачи
Ключевыми задачами Добровольной схемы являются:
- поддержание инновационного развития здравоохранения и фармацевтической отрасли;
- рационализация потребления ЛП и приоритизация эффективных препаратов на основании методов клинико-экономической оценки;
- ускорение выхода на рынок инновационных и наиболее эффективных ЛП;
- повышение надежности планирования расходов системы здравоохранения и финансовой стабильности инвестиционных стратегий в здравоохранении.
В качестве методов достижения целей схемы указаны:
- совершенствование методик и моделей долгосрочного прогнозирования;
- дальнейшее увеличение вовлеченности системы здравоохранения и фармацевтической отрасли в стратегическое партнерство, а также как можно более раннее включение новых фармацевтических компаний в процесс взаимодействия с системой здравоохранения;
- совершенствование методов ОТЗ и ускорение процедуры оценки для новых активных ДВ;
- развитие коммерческих соглашений, разработка мер поддержки для наиболее эффективных технологий;
- повышение доступности информации о предстоящих тендерах и индивидуальных коммерческих соглашениях DHSC;
- инвестиции в информационную инфраструктуру.
Долгосрочное планирование
Одной из задач долгосрочного планирования является максимально раннее выявление и получение исчерпывающей информации о новых продуктах, включая клиническую, финансовую и прочую релевантную информацию, необходимую для стратегического финансового планирования и последующего выведения инновационных продуктов на рынок.
Для сбора такой информации используется онлайн-платформа PharmaScan, на которой производители указывают сведения о разрабатываемых продуктах, причем акцентируется необходимость как можно более раннего информирования о перспективных разработках. Эти данные передаются в DHSC для обеспечения процесса планирования.
Оценка технологий здравоохранения
NICE осуществляет оценку, результат которой является одним из ключевых факторов при принятии решения о включении продукта в систему возмещения и Добровольную схему. NICE оценивает:
- лекарственные препараты, в том числе все новые ДВ;
- медицинские изделия;
- диагностические процедуры;
- хирургические и терапевтические процедуры;
- прочие технологии.
Оценка выполняется на основании комплекса клинических и экономических данных, предоставленных компанией, свидетельств пациентов, медицинских работников и уполномоченных лиц. Одним из ключевых показателей клинико-экономической эффективности медицинской технологии является количество лет жизни с поправкой на качество (англ. quality-adjusted life year, QALY). Стандартным порогом эффективности затрат, который установлен NICE для утвердительного заключения об эффективности препарата является 20–30 тыс. фунтов за QALY6. В отдельных случаях этот порог может повышаться (например, в случае препаратов для лечения онкологических и орфанных заболеваний), когда DHSC дополнительно и на свое усмотрение может принять решение о закупке ЛП с превышением порога затрат, если установлена клиническая необходимость в оцениваемой терапии. Если участник Добровольной схемы не может обеспечить препараты по цене, которая признана эффективной для системы здравоохранения, допустимо заключение конфиденциального договора в рамках Схемы доступности для пациентов (англ. Patient Access Scheme) с разовой скидкой. Такие соглашения особенно важны для дорогостоящих ЛП.
Обеспечение доступности лекарственных препаратов
Основная задача Добровольной схемы – ограничить рост затрат системы здравоохранения на патентованные ЛП в соответствии с согласованным допустимым уровнем ежегодного увеличения бюджетных издержек, который составляет 2% в год7. Любое прогнозируемое и фактическое превышение согласованного уровня затрат означает необходимость осуществления выплат членами схемы в виде процента от очищенных продаж препарата (выручка без налога на добавленную стоимость, торговых скидок, возвратов, возмещений) в рамках Добровольной схемы (далее – процентный платеж).
Процентный платеж в текущем году рассчитывается из разницы прогнозируемого и допустимого роста объема продаж (затрат здравоохранения на закупку патентованных ЛП) на текущий год. С целью повышения стабильности и точности прогноза продаж при осуществлении расчетов учитываются продажи участников Принудительной схемы и параллельного импорта8. Методика расчета процентных платежей будет рассмотрена далее.
Часть продаж освобождена от процентных платежей:
- продажи продуктов схемы в рамках исключительных централизованных закупок;
- продажи новых ДВ в течение 36 мес после ввода в обращение;
- продажи малых предприятий (продажи, сумма которых в рамках схемы не превышает 5 млн фунтов (около 520 млн руб.) в год);
- часть продаж средних компаний (в случае, если сумма продаж компании в рамках схемы не превышает 25 млн фунтов (около 2,62 млрд руб.) в год, она имеет право вычесть 5 млн фунтов из учитываемых при расчете процентных платежей продаж);
- продажи препаратов нижнего ценового сегмента, базовая цена которых установлена ниже уровня в 2 фунта (около 200 руб.).
Рассчитанный процентный платеж является неизменным в текущем году9. В последнем квартале текущего года общие прогнозируемые продажи и процентный платеж на следующий год корректируются и очищаются на прогнозируемый размер исключений из платежей, а также на размер переплат или недоплат за прошлые годы.
Таким образом, ежегодно на следующий год уточняются:
- размер фактических продаж;
- темпы роста прогнозируемых продаж;
- совокупный размер переплат и недоплат по Добровольной схеме на основании фактических объемов продаж за прошлые годы относительно прогноза;
- сглаженное повышение или снижение процентных платежей следующих лет на основании данных о совокупных переплатах или недоплатах по схемам.
На рисунке 1 представлен первичный прогноз темпов роста общих прогнозируемых издержек системы здравоохранения на ЛП по Добровольной и Принудительной схемам, а также параллельному импорту, рассчитанный в 2019 г.
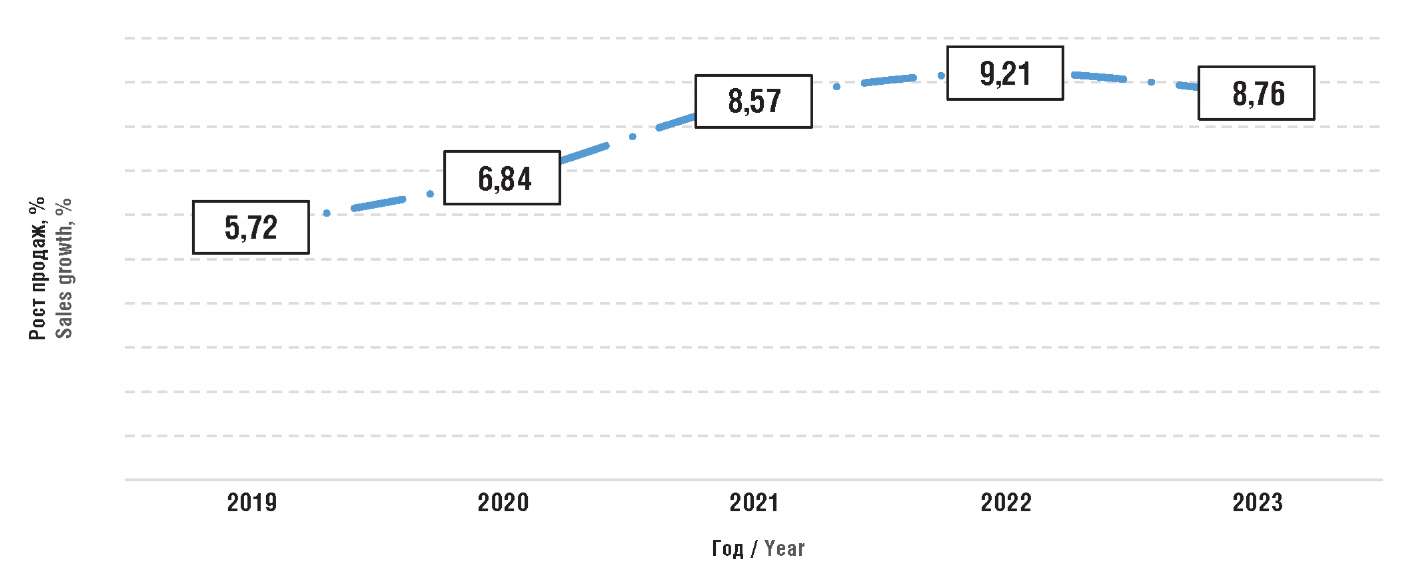
Рисунок 1. Первичный прогноз роста продаж
(издержек системы здравоохранения) в 2019–2023 гг. [3]
Figure 1. Primary sales growth (health system costs) forecast for 2019–2023 [3]
Процентные платежи перечисляются ежеквартально. Участники схемы обязаны предоставлять квартальные и годовые отчеты о продажах, а также организовывать их независимый аудит за свой счет. В предоставляемой отчетности продажи должны быть отражены очищенными от скидок, возвратов, возмещений, платежей по схеме и налога на добавленную стоимость. Участники с продажами продуктов схемы объемом менее 5 млн фунтов (около 520 млн руб.) в предыдущем календарном году имеют право не предоставлять квартальную отчетность. В случае если несколько компаний, входящих в одну группу, осуществляют реализацию одного и того же товара в рамках Добровольной схемы, головная организация должна предоставлять сводную отчетность о продажах своих подразделений.
Новые ДВ в течение 36 мес с момента выхода на рынок имеют относительную свободу ценообразования. Производители таких препаратов обязаны согласовывать базовую цену с DHSC, который исследует обоснованность предлагаемой цены с учетом результатов ОТЗ, проводимой NICE. Таким образом, максимальная цена ЛП с новым ДВ, которая теоретически может быть согласована DHSC, – это такая цена, которая будет обеспечивать минимальное клинико-экономическое преимущество относительно существующих технологий для системы здравоохранения. Если прогнозируемые ежегодные продажи препарата с новым ДВ в течение следующих 5 лет превышают 20 млн фунтов (около 2,1 млрд руб.), производитель обязан предоставить DHSC прогноз продаж. Если поставщик ЛП с новым ДВ по результатам собственных расчетов и на основании согласованных цен выясняет, что рентабельность реализации продукции будет превышать «разумный уровень», он должен сообщить об этом в DHSC и инициировать процедуру переговоров по достижению «разумного» уровня рентабельности.
Если препарат не содержит новое ДВ, при оценке приемлемости регистрируемой базовой цены DHSC принимает во внимание следующие факторы:
- клиническая востребованность (в ВБ и мире);
- цена терапевтически эквивалентных или сопоставимых продуктов;
- цена и операционные издержки в Евросоюзе и на других рынках;
- дата окончания патентной защиты;
- прогнозируемые натуральные и денежные продажи препарата в ближайшие 5 лет;
- релевантность информации, предоставляемой производителем о понесенных издержках: R&D, производство, издержки реализации;
- расчетный уровень цены, при которой достигается «разумный» уровень прибыли;
- прибыль, полученная производителем за последние 5 лет.
Повышение базовой цены производителя при государственных закупках допускается только по согласованию DHSC на основании данных о рентабельности производства и реализации продукции, а также экономического эффекта повышения цены для производителя.
В рамках Добровольной схемы основными участниками процесса разработки согласованы целевые, или «разумные», показатели рентабельности продаж и активов, а также уровни предельных издержек, учитываемых при их расчете (табл. 1).
Таблица 1. Показатели «разумной» рентабельности и издержек в рамках Добровольной схемы
Table 1. The “reasonable” profitability and cost indicators of the Voluntary Scheme
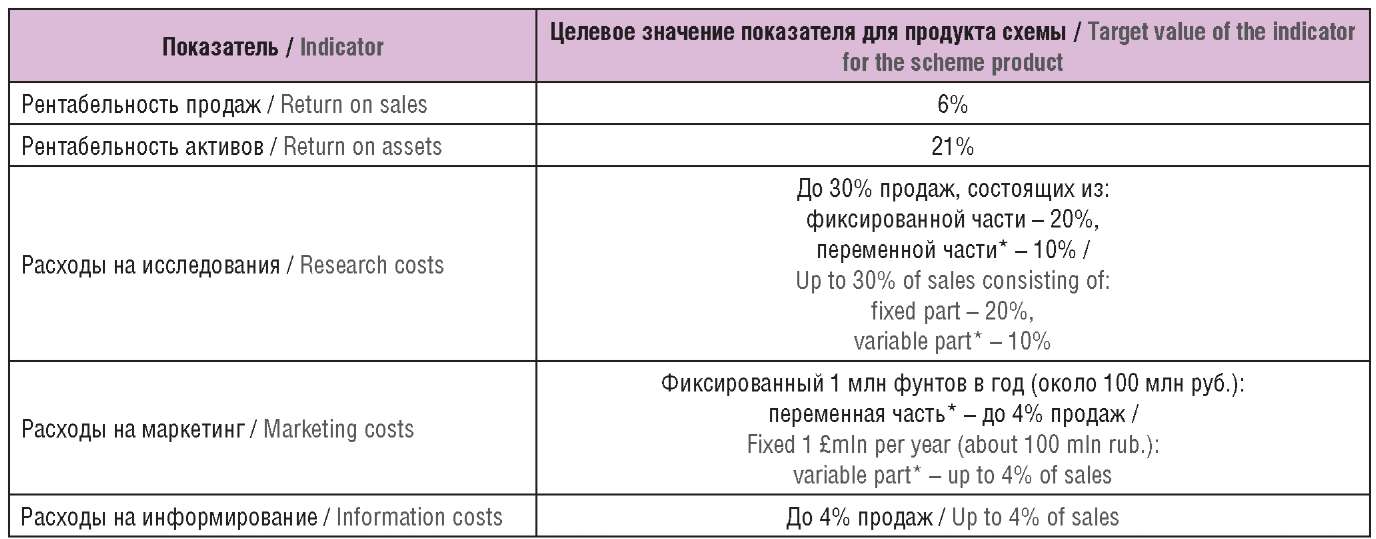
Примечание. * Переменная часть зависит от уровня инновационности
и состояния патентной защиты препарата. Для педиатрических препаратов
предусмотрена возможность учитывать больший объем затрат.
Note. * The variable part depends on the level of innovation
and the state of patent protection of the drug. For pediatric drugs,
there is an option to account for more costs.
При оценке рентабельности DHSC ожидает разумного и экономичного подхода к издержкам, а также их соответствия целевому назначению. Оцениваются тренды динамики издержек производителя, пропорциональность затрат на продукты внутри и вне Добровольной схемы, сопоставимость затрат внутри схожих групп компаний и пр. В случае выявления недобросовестного подхода к предоставлению информации об издержках DHSC имеет право ограничить их учитываемый объем.
Издержки на маркетинг и информирование принимаются к учету только в случае возможности подтвердить их целевое назначение. Затраты на маркетинг и информирование не должны включать затраты на пробники (за исключением пробников в рамках информирования специалистов здравоохранения), подарки, представительские расходы (кроме расходов на специализированных симпозиумах, конференциях). Постоянные издержки предоставляются за несколько лет. Включение нематериальных издержек для целей расчета рентабельности капитала в рамках Добровольной схемы недопустимо.
DHSC не одобрит повышение цены препарата, если фактическая и прогнозируемая прибыль (с учетом трансфертных цен) всех продуктов производителя, включенных в схему, на текущий и следующий финансовые годы обеспечивает показатели рентабельности продаж и активов выше 50% от целевых уровней, определенных соглашением. В случае если указанные показатели ниже 50%, DHSC согласует повышение цены до уровня 65% целевых показателей на следующие 5 лет в соответствии с прогнозируемыми объемами реализации продукции. Если производитель осуществляет реализацию продукции в государственном сегменте по цене выше согласованной DHSC, он обязан совершить возвратные платежи в размере разницы между закупками по базовой и фактической ценам.
Увеличение цены допускается 1 раз в год, однако существует ряд исключительных обстоятельств, которые являются основанием для подачи внеочередного заявления о повышении цены в DHSC:
- долгосрочные и системные изменения в цепи поставок, которые формируют необходимость изменения подхода и требований к оценке финансовой эффективности и необходимости повышения цены;
- ситуация, при которой ЛП не соответствует описанным критериям повышения цены, однако очевидно, что производство и реализация продукции экономически невыгодны и отмена закупки повлечет негативный эффект на здоровье пациентов.
Любое повышение цены патентованного препарата общего порядка реализации должно быть не выше 20% относительно цены сопоставимого ЛП или других форм того же препарата в пересчете на единицу лекарственной формы.
Участники схемы могут снизить базовую цену временно или постоянно. При временном снижении цены необходимо уведомить DHSC о размере и длительности снижения. Обратное повышение цены допустимо не выше уровня, который был до снижения. Снижение цены не освобождает от оплаты процентных платежей. Добровольной схемой не ограничивается размер скидок при поставке ЛП, а также такие скидки не оказывают влияния на базовую цену.
По требованию DHSC производитель обязан предоставить финансовый отчет, отражающий принципы формирования и соответствие фактических значений показателей прибыли и рентабельности «разумному» уровню. Пределом «разумного» уровня является прибыль, обеспечивающая показатели рентабельности не выше 150% от целевых показателей рентабельности продаж и активов (6% и 21%), т.е. 9,0% и 31,5%. В случае выявления в процессе аудита показателей выше «разумного» уровня инициируется процедура переговоров по условиям:
- платежей, возмещающих затраты бюджета на уровень превышения «разумной» прибыли;
- снижения цены до «разумного» уровня в соответствии с прогнозами реализации продукта схемы на следующие 5 лет;
- заморозки цены на определенный период с целью предотвращения ее повышения в дальнейшем.
Контроль трансфертного ценообразования
Одной из мер контроля «разумности» уровня рентабельности является сопоставление объема инвестированного капитала и фактического объема продаж в ВБ. Если объем продаж превышает задействованный капитал в 3,5 раза и более, для оценки «разумности» рентабельности в первую очередь учитывается рентабельность продаж, а не капитала, причем при оценке рентабельности продаж исследуется прибыль, полученная от трансфертных цен.
Участники схемы обязаны предоставлять полную информацию о трансфертном ценообразовании по запросу DHSC, в т.ч. разбивку затрат предыдущих участников цепи поставок. В случае если такая разбивка не предоставляется, DHSC при оценке учитывает следующее соотношение издержек: 59% – издержки производства, 21% – R&D, 20% – прибыль. Максимально допустимый учитываемый уровень прибыли составляет 25% от учитываемых издержек. Трансфертные издержки и прибыль учитываются при расчете целевых уровней рентабельности: трансфертная прибыль прибавляется к прибыли в рентабельности продаж. При оценке трансфертных цен учитывается динамика валютных курсов на дату проведения соответствующих операций, в случае значительных флуктуаций подход к оценке затрат и прибыли может быть изменен.
Ключевые прогнозные показатели
При расчете процентных платежей используется ряд ключевых концепций.
Общие измеренные продажи (англ. measured sales) – общий объем продаж патентованных препаратов NHS. Он включает прогнозируемые и фактические продажи в рамках Добровольной схемы, Принудительной схемы и параллельного импорта, сниженные на исключения из измеренных продаж. В расчет измеренных продаж не включаются продажи в рамках исключительных централизованных закупок, продажи малых компаний, а также препаратов ценой ниже 2 фунтов.
Учитываемые продажи (англ. eligible sales) – измеренные продажи участников схемы за вычетом исключений из учитываемых продаж (к таким исключениям относятся новые ДВ10, малые и средние компании, препараты нижнего ценового сегмента, исключительные централизованные закупки).
Допустимые продажи (англ. allowed sales) – объем продаж, рассчитанный на основании допустимого прироста относительно измеренных продаж прошлого года. Рост измеренных продаж должен быть ограничен допустимыми темпами роста (2%) за счет платежей, производимых производителями брендовых лекарств в DHSC.
Процентные платежи – доля очищенных продаж участников Добровольной схемы, выплачиваемая в пользу DHSC, рассчитываемая на основании соотношения допустимых и измеренных продаж производителей.
Прогноз фактического роста продаж формируется на основании прогноза роста:
- по Добровольной схеме;
- по Принудительной схеме;
- параллельного импорта.
Пример расчета прогнозных процентных платежей по Добровольной схеме
Сначала рассчитывается прогноз продаж:
Fд1 = Fд0 × (1 + Fд1,%),
где Fд1 – прогнозируемые измеренные продажи Добровольной схемы в следующем году (в денежном выражении); Fд0 – прогнозные измеренные продажи в текущем году (в денежном выражении)11; Fд1,% – прогнозируемый фактический прирост измеренных продаж Добровольной схемы в следующем году (%).
Аналогичный расчет выполняется по Принудительной схеме и параллельному импорту.
Прогнозируемые продажи по схемам суммируются с получением измеренных продаж следующего года:
Fизм1 = Fд1 + Fп1 + Fимп1,
где Fд1 – прогнозируемые продажи Добровольной схемы в следующем году (в денежном выражении); Fп1 – прогнозируемые продажи Принудительной схемы в следующем году (в денежном выражении); Fимп1 – прогнозируемые продажи параллельного импорта в следующем году (в денежном выражении).
Допустимые продажи в следующем году рассчитываются на основании согласованного допустимого ежегодного прироста продаж (издержек на закупку и возмещение ЛП) за вычетом общих процентных платежей:
ДП1 = (Fизм0 – Fплат0) × (1 + ДУР1,%),
где Fизм0 – прогнозируемые общие измеряемые продажи в текущем году (в денежном выражении); Fплат0 – размер платежей, осуществленных производителями в текущем году по Добровольной и Принудительной схемам (в денежном выражении); ДУР1,% – допустимый уровень роста расходов на следующий год (%)12.
Разница между допустимыми продажами и прогнозируемым фактическим измеренным объемом продаж формирует общий объем платежей по всем схемам в следующем году в денежном выражении:
ОП1 = Fизм1 – ДП1,
где Fизм1 – прогнозируемые общие измеренные продажи схемы в следующем году (в денежном выражении); ДП1 – допустимые продажи в следующем году (в денежном выражении).
Доля продаж Добровольной схемы в общем объеме следующего года (в процентах) определяется на основании прогнозируемых показателей продаж Добровольной схемы и общих измеренных продаж13:
ДС1,% = Fд1 / Fизм1,
где Fизм1 – прогнозируемые измеренные продажи в следующем году (в денежном выражении); Fд1 – прогнозируемые продажи Добровольной схемы в следующем году (в денежном выражении).
Объем процентных платежей по Добровольной схеме в следующем году рассчитывается как доля продаж Добровольной схемы в общем объеме платежей по всем схемам:
ДСП1 = ОП1 × ДС1,%,
где ОП1 – общий размер процентных платежей по всем схемам в следующем году; ДС1,% – доля продаж Добровольной схемы в общем объеме (%).
Объем учитываемых продаж по Добровольной схеме – прогнозируемые продажи по Добровольной схеме, сниженные на долю исключений из учитываемых продаж14:
Fуд1 = Fд1 × (1 – Fискл1,%),
где Fд1 – прогнозируемые продажи Добровольной схемы в следующем году (в денежном выражении); Fискл1,% – прогнозируемая доля продаж Добровольной схемы, не включаемая в объем учитываемых (%).
Процентный платеж по Добровольной схеме на следующий год является частным от объема процентных платежей по Добровольной схеме и объема учитываемых продаж Добровольной схемы. Из показателя в числителе не вычитались продажи новых ДВ (и среднего бизнеса), что увеличивает итоговый процент платежей, которые осуществляют участники схемы. Таким образом, издержки инноваций частично перенесены с бюджета на других участников рынка:
П1,% = ДСП1 / Fуд1,
где ДСП1 – объем процентных платежей по Добровольной схеме в следующем году; Fуд1 – объем учитываемых продаж по Добровольной схеме (в денежном выражении).
На следующих этапах осуществляется расчет для всего периода действия схемы.
В 2019 г. объем учитываемых продаж Добровольной схемы составил 8,781 млрд фунтов [14] – на 181 млн фунтов меньше, чем измеряемых. Эта разница является вкладом новых ДВ и средних компаний в измеряемые продажи. Соответственно, дополнительные процентные платежи, которые внесли поставщики ЛП в качестве «бремени за инновации», составили около 11 млн фунтов (рис. 2). Общие процентные платежи за этот же период составили около 834 млн фунтов.
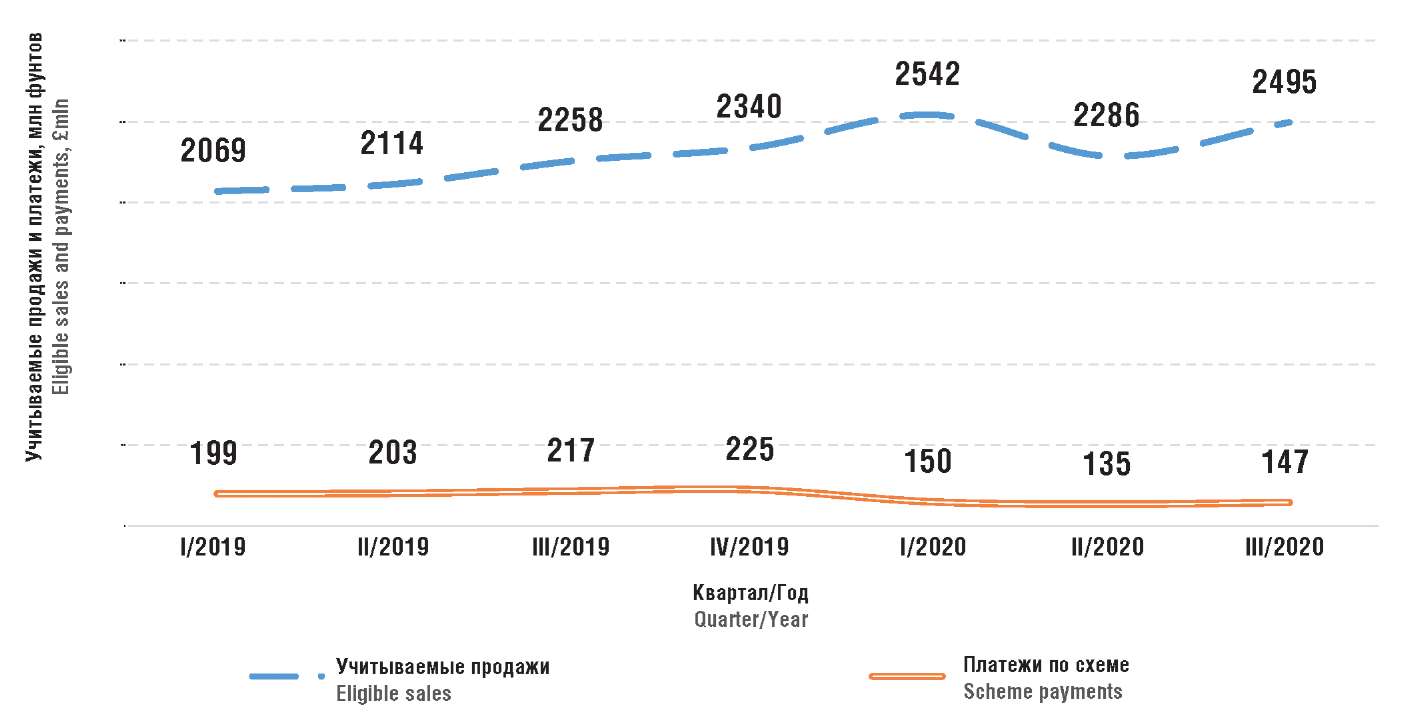
Рисунок 2. Объем учитываемых продаж и процентных платежей
по Добровольной схеме в 2019–2020 гг. [2]
Figure 2. Volume of eligible sales and interest payments
under the Voluntary Scheme in 2019–2020 [2]
Ключевые особенности
Рассмотрим ключевые особенности Добровольной схемы относительно реализованной в РФ системы реферирования цен.
Регулирование препаратов, находящихся под патентной защитой
Под действие схемы подпадают сегменты ЛП, оказывающих наибольшую нагрузку на бюджет. Наличие патентной защиты означает монопольное положение оригинатора и, как следствие, высокую стоимость терапии. ДВ, вышедшие из-под патентной защиты, подвергаются воздействию рыночных сил: если препарат представляет из себя перспективную терапию, он будет воспроизведен (и не раз), что в большинстве случаев формирует эффективный саморегулируемый конкурентный рынок. Безусловно, как и в любой другой сфере, возможны нарушения, возникновение картельных сговоров, однако контроль конкуренции является ответственностью антимонопольных служб, которые обладают достаточным инструментарием для поддержания эффективности рынка дженериков.
В России реализован подход, ограничивающий цены на все позиции перечня жизненно необходимых и важнейших лекарственных препаратов (ЖНВЛП), в т.ч. воспроизведенные, причем сформированный подход почти гарантированно вынуждает производителей постепенно снижать предельную зарегистрированную цену [15]. Именно воспроизведенные ЛП наиболее восприимчивы к такому регулированию вследствие того, что они выпускаются с уже сниженной нормой прибыли, а дальнейшее жесткое регулирование и снижение рентабельности является основанием для преждевременного ухода с рынка. Результатами такого подхода являются постепенное вымывание препаратов, отмена государственных регистраций производителями ЛП и, как следствие, снижение конкуренции с рисками дефектуры препаратов.
Частичным признанием существования таких рисков является постановление Правительства РФ о мониторинге дефектуры [8], согласно которому Росздравнадзор анализирует информацию об объемах ввода в оборот ЛП, которую ему сообщают производители, и в случае, если планируемый объем вводимых в оборот препаратов в течение следующего полугодия ниже определенного уровня, Минздрав России инициирует процедуру выяснения причин снижения поставок и возможного повышения цены. Однако маловероятно, что подобная мера будет эффективна вследствие достаточно сложной необходимой инфраструктуры для полноценного географического отслеживания возможных рисков образования дефектуры, необходимости учитывать запасы, динамику заболеваемости и пр. Отсутствие возможности принять информированное решение ведет к несправедливым повышениям цен, манипулированию объемами ввода ЛП в оборот и пр.
Информатизация как инструмент повышения эффективности долгосрочного планирования
В условиях постоянного повышения стоимости ЛП необходимо обеспечивать максимальную эффективность издержек. Одним из ключевых инструментов повышения эффективности затрат является информатизация здравоохранения и принятие стратегических решений на основании собираемой информации. В ВБ одним из инструментов долгосрочного планирования является платформа PharmaScan.
Создание и повсеместное внедрение Единой государственной информационной системы в сфере здравоохранения (ЕГИСЗ) в РФ является одной из программ национального проекта «Здравоохранение» [9][10][16]. Формирование подсистемы ЕГИСЗ в виде аналога PharmaScan может стать достаточно эффективным примером внедрения лучших мировых практик долгосрочного планирования. Такая подсистема должна основываться на анализе, оценке и прогнозировании показателей развития системы здравоохранения посредством построения многофакторных моделей на основе агрегации данных различных источников, формируемых с использованием первичных данных федеральных/региональных органов власти и подведомственных учреждений, данных открытого рынка в сочетании с макроэкономическими, социальными и демографическими показателями. Это может обеспечить повышение эффективности системы государственного планирования в части реализации профильных государственных программ и достижения национальных целей РФ.
Оценка технологий здравоохранения
Важнейшим элементом системы регулирования издержек является оценка их клинико-экономической эффективности путем проведения ОТЗ. Причем процедура ОТЗ осуществляется на входе процесса регистрации цены ЛП, т.е. сначала оцениваются показатель соотношения «затраты–эффективность» препарата, затем на основании этих данных осуществляется оценка приемлемости затрат на его возмещение.
В РФ полноценная процедура ОТЗ проводится в случае подачи заявки на включение препарата в перечень ЖНВЛП, а процедура формирования и оценки предельной зарегистрированной цены производителя на ЛП отделена от ОТЗ15 и формируется по большей части на основании экономических показателей. Система реферирования цен подразумевает, что если в стране, относительно которой реферируется цена, учитывается ОТЗ при ценообразовании, то косвенным образом она учитывается и в РФ. Однако, во-первых, на данный момент не до конца ясен перечень критериев, по которым выбираются референтные страны (в т.ч. было ли критерием наличие процедуры ОТЗ при формировании цены), а во-вторых, процедура ОТЗ является достаточно специфичной, прежде всего относительно структуры заболеваемости и нормирования издержек системы здравоохранения.
Таким образом, одним из элементов повышения эффективности системы ценообразования в РФ может стать внедрение процедуры ОТЗ при формировании предельных цен.
Недостатки
Можно также выделить и недостатки Добровольной схемы.
Необходимость платить прогнозный фиксированный процент от выручки
Производители обязаны раз в квартал осуществлять платежи по заранее определенному прогнозному проценту. Учитывая, что прогноз практически никогда не соответствует реальности в полной мере, естественным образом появляются переплаты или недоплаты, которые впоследствии возмещаются. Наличие возмещения переплат является справедливой мерой, однако в случае переплаты производитель несет издержки обесценивания денег к следующему году. Причем, несмотря на наличие средних по отрасли значений ставок дисконтирования, у каждой организации существуют индивидуальные риски и, соответственно, ставка, что формирует неравное положение компаний при переплатах или недоплатах. Отчасти это компенсируется преференциями для малых и средних предприятий, т.к. они наиболее чувствительны к данному фактору.
Дополнительные издержки ложатся на отрасль
Процентные платежи формируются на основании прогнозируемых переплат, основной вклад в которые вносят новые ДВ. Таким образом, старые участники схемы16 платят больше, чем должны были бы при абсолютно равномерном распределении платежей. Конечно, в дальнейшем новые участники станут старыми и сами будут нести издержки новых ДВ, если подход Добровольной схемы сохранится.
Принудительная схема / Statutory Scheme
Производители и поставщики патентованных ЛП (в т.ч. участники PPRS), отказавшиеся от участия в Добровольной схеме, автоматически включены в Принудительную схему [4][11][12].
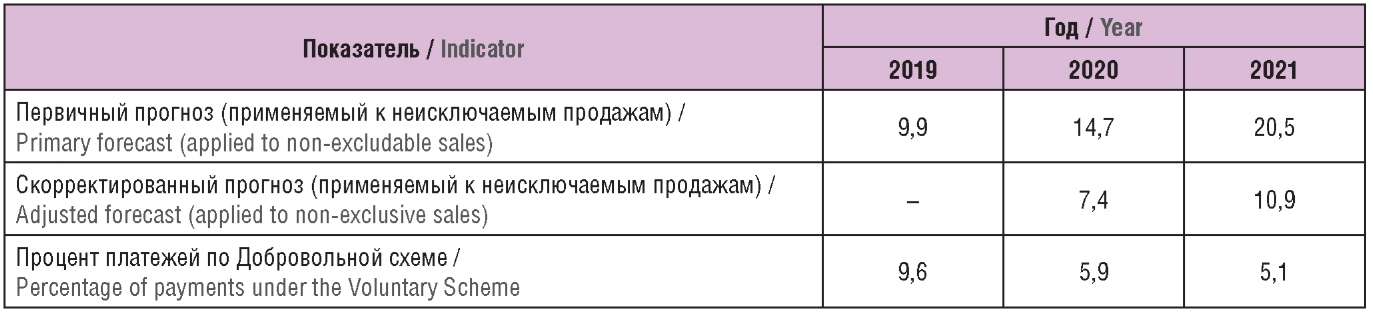
В сочетании с Добровольной схемой набор правил Принудительной схемы налагает ограничения на стоимость патентованных препаратов. Первичные условия Принудительной схемы предусматривали применение процентных платежей в размере 9,9% от очищенных продаж в 2019 г., 14,7% в 2020 г. и 20,5% в 2021 г. Платежи введены с целью контроля роста издержек системы здравоохранения в рамках Принудительной схемы до уровня 1,1% в год. Проценты ежегодно пересматриваются в зависимости от фактических и прогнозных продаж с целью сохранения их пропорционального соответствия приросту затрат государства. В случае просрочки внесения платежей поставщику начисляются пени в размере 2,5% годовых сверх базовой ставки Банка Англии простым начислением.
При расчете платежей не учитываются продажи, а также освобождены от платежей следующие группы препаратов:
- поставленные в рамках рамочных индивидуальных договоров и централизованных закупок;
- дешевле 2 фунтов;
- ЛП параллельного импорта;
- поставленные по Добровольной схеме;
- относящиеся к продажам малого бизнеса.
Контроль внесения платежей проводится DHSC. В случае если DHSC посчитает, что поставщик ЛП тем или иным способом уклоняется от оплаты процентных платежей, он имеет право выдать предписание на выплату штрафа в размере оцениваемого уклонения с обоснованием причин и размеров доплаты. DHSC также осуществляет контроль закупочных цен в рамках Принудительной схемы:
- если препарат был зарегистрирован ранее, цена не должна быть выше базовой цены Drug Tariff (если препарат не закупался длительное время или цена Drug Tariff является устаревшей, по согласованию с DHSC возможно повышение цены);
- если препарат не имеет базовой цены, DHSC устанавливает новую цену.
Предлагаемые вновь регистрируемые (и перерегистрируемые) максимальные цены препаратов оцениваются в соответствии со следующими критериями:
- текущая и прогнозируемая клиническая востребованность медицинской технологии системой здравоохранения;
- цена и операционные издержки терапевтически эквивалентных ЛП;
- референтные цены и операционные издержки регистрируемого ЛП в Евросоюзе и мире;
- является ли препарат новым ДВ;
- остаток срока патентной защиты;
- общая прибыль до вычета процентов и налогов поставщика по ЛП за прошлые периоды (при наличии);
- прогнозируемые продажи на ближайшие 5 лет или до конца срока действия патентной защиты (если срок меньше 5 лет);
- объем и обоснование прогнозируемых на ближайшие 5 лет издержек (издержки производства и реализации, издержки R&D, операционные и прочие издержки, рассчитанная на основании данных издержек «разумная» цена);
- уровень рентабельности при сохранении текущей цены и изменении цены на основании данных о «разумных» издержках (в случае повышения цены).
В случае клинической необходимости DHSC может установить временные правила ценообразования для обеспечения адекватной и рациональной лекарственной терапии, при этом указывается новая цена и период ее действия. При выявлении поставок по цене выше базовой поставщик обязан осуществить платеж в размере суммы превышения затрат относительно базовой цены. Поставщик имеет право подать заявку на снижение цены.
Участник Принудительной схемы обязан предоставлять годовой отчет о продажах, организовать и оплатить его независимый аудит, а также приложить подписанную уполномоченным лицом декларацию соответствия информации.
В текущем году поставщик ЛП осуществляет платежи в виде фиксированного процента очищенной выручки. В дальнейшем объем процентных платежей корректируется на основании доли Принудительной схемы в общих измеренных продажах по всем схемам и доли Принудительной схемы в общем объеме платежей по схемам.
Процедура расчета объема переплат или недоплат по Принудительной схеме
Первые шаги аналогичны расчетам по Добровольной схеме.
Рассчитываются общие измеренные продажи следующего года:
Fизм1 = Fд1 + Fп1 + Fимп1,
где Fд1 – прогнозируемые измеренные продажи Добровольной схемы в следующем году (в денежном выражении); Fп1 – прогнозируемые измеренные продажи Принудительной схемы в следующем году (в денежном выражении); Fимп1 – прогнозируемые измеренные продажи параллельного импорта в следующем году (в денежном выражении).
Допустимые продажи в следующем году вычисляются на основании согласованного прироста измеренных продаж текущего года за вычетом процентных платежей:
ДП1 = (Fизм0 – Fплат0) × (1 + ДУР1,%),
где Fизм0 – прогнозируемые измеренные продажи в текущем году (в денежном выражении); Fплат0 – размер платежей, осуществленных производителями в текущем году по Добровольной и Принудительной схемам (в денежном выражении); ДУР1,% – допустимый уровень роста расходов на следующий год (%).
Разница между допустимыми продажами и прогнозируемым измеренным объемом продаж формирует общий объем платежей по всем схемам в следующем году в денежном выражении:
ОП1 = Fизм1 – ДП1,
где Fизм1 – прогнозируемые общие измеренные продажи в следующем году (в денежном выражении); ДП1 – допустимые продажи в следующем году (в денежном выражении).
Объем переплат/недоплат в рамках Принудительной схемы рассчитывается как разница между платежами на основании прогнозируемого процента платежей и фактической доли схемы в структуре затрат системы здравоохранения:
Опер0 = (Fп0 × ПП0) – Fп0 / Fизм0 × ОП0,
где Fп0 – измеренные продажи текущего года в рамках Принудительной схемы; ПП0 – процент платежей от выручки текущего года в рамках Принудительной схемы17; Fизм0 – общие измеренные продажи по всем схемам текущего года; ОП0 – фактический объем процентных платежей текущего года.
Корректировка объема платежей осуществляется как снижение платежей следующего года на уровень переплат текущего:
ОП1(корр) = Fп1 / Fизм1 × ОП1 – Опер0,
где Fп1 – прогнозируемые измеренные продажи следующего года в рамках Принудительной схемы; Fизм1 – прогнозируемые общие измеренные продажи по всем схемам следующего года; Опер0 – переплаты/недоплаты в текущем году в Принудительной схеме; ОП1 – прогнозируемый объем процентных платежей в следующем году.
Сопоставление Добровольной и Принудительной схем / Comparison of Voluntary and Statutory Schemes
Ниже представлены сравнительные данные о совершенных платежах и объемах издержек системы здравоохранения в рамках схем [17–19].
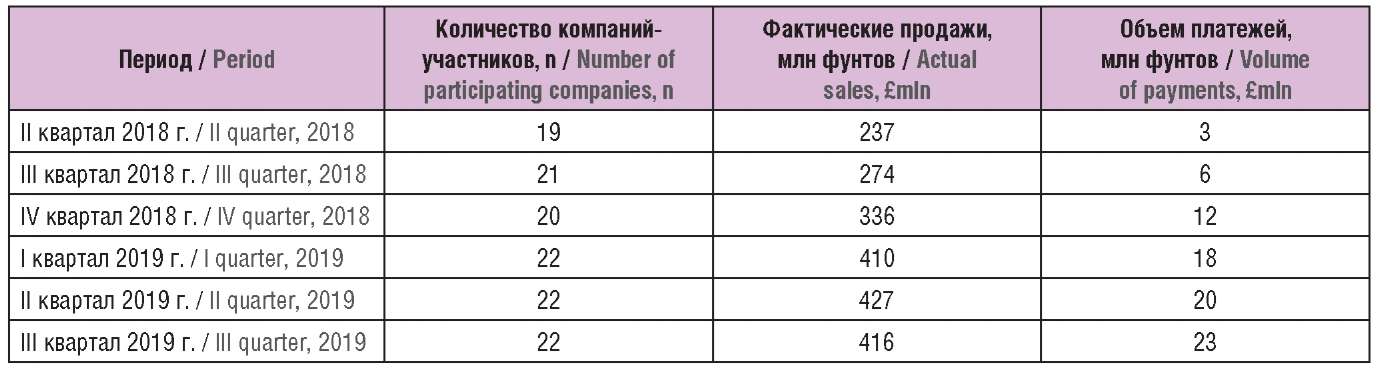
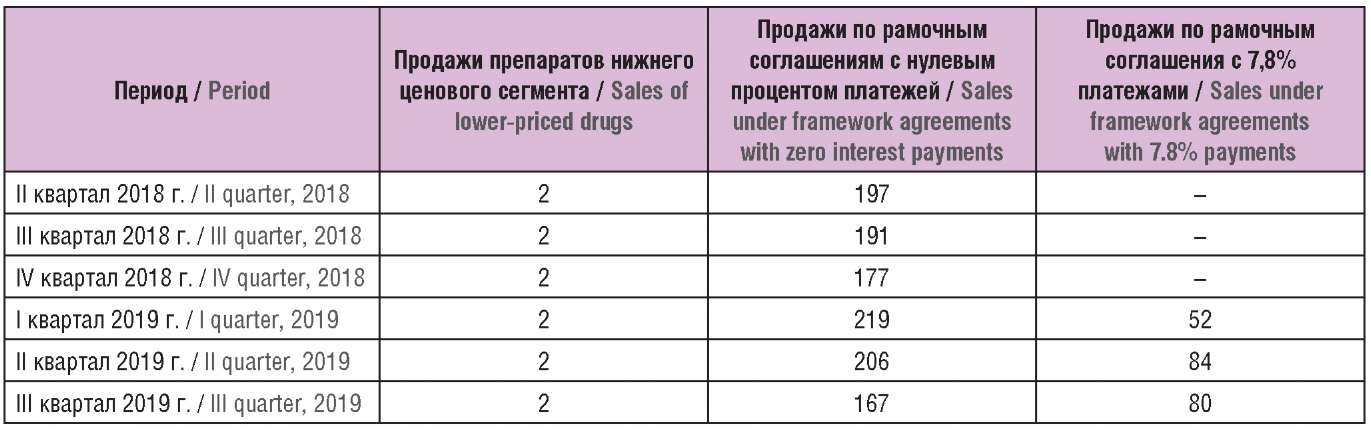
Таблица 2 содержит информацию о количестве компаний, вносящих платежи по Принудительной схеме в 2018–2019 гг., их объемах продаж, включая продажи компаний, заключивших рамочные соглашения с правительством и не вносящих платежи по схеме. Среднее количество участников Принудительной схемы составляет около 22 поставщиков.
Таблица 2. Фактические показатели реализации Принудительной схемы за 2018–2019 гг.
Table 2. Actual implementation of the Statutory Scheme for 2018–2019
В таблице 3 представлена информация о компаниях – участниках Принудительной схемы, не вносящих платежи, т.е. исключаемых из платежей продаж. Сопоставление общих и рамочных продаж показывает, что исключения составляют более половины общих продаж схемы, т.е. можно сделать вывод, что в рамках Принудительной схемы более выгодной стратегией является заключение индивидуальных рамочных соглашений на поставку с предоставлением разовых скидок с базовых цен.
Таблица 3. Продажи компаний, не вносящих платежи
или осуществляющих платежи со скидкой
в рамках Принудительной схемы, в 2018–2019 гг., млн фунтов
Table 3. Sales of companies not making payments or making payments
at a discount under the Statutory Scheme in 2018–2019, £mln
После внедрения Принудительной схемы в 2018 г. правительство выразило намерение сделать ее коммерческую привлекательность более сопоставимой с Добровольной, т.к. с точки зрения прямолинейного расчета процентные платежи в среднем ниже у Добровольной схемы. Стратегия выравнивания преследовала цель сделать обе схемы выгодными для максимально широкого круга поставщиков ЛП, причем для одного сегмента поставщиков более выгодной будет Принудительная схема, а для другого – Добровольная. Одним из способов достижения цели являлась корректировка процентных платежей. В Добровольной схеме на 2020 г. установлен процентный платеж в размере 5,9%. Это способствовало снижению платежа по Принудительной схеме до 7,4% в 2020 г. и до 10,9% в 2021 г. (изначально устанавливались 14,7% и 20,5% соответственно) (табл. 4).
Таблица 4. Характеристика изменений процента платежей по Принудительной схеме, %
Table 4. Characteristics of changes in the percentage of payments under the Statutory Scheme, %
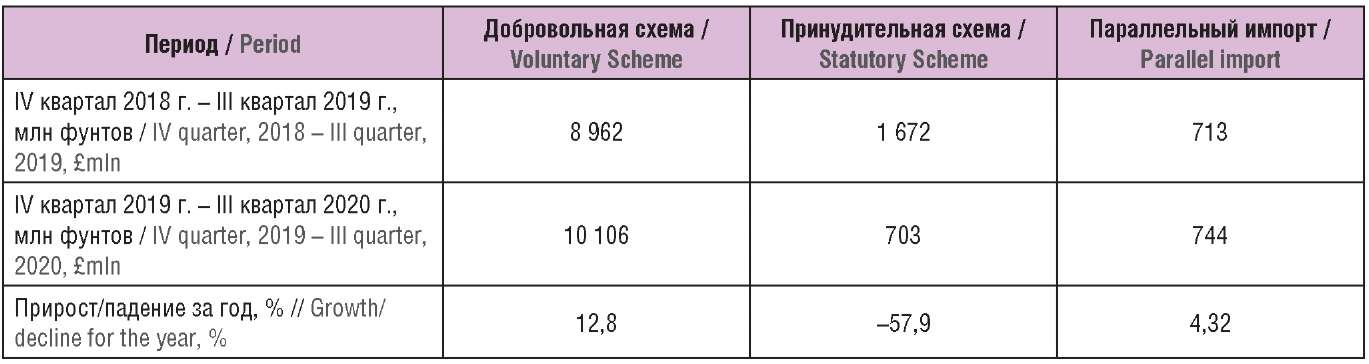
Принудительная схема является упрощенным и более ограниченным механизмом регулирования издержек государства на патентованные ЛП, согласно которому поставщик оплачивает фиксированный процент очищенной выручки с последующей корректировкой на размер переплат или недоплат, причем процент платежей выше, чем в Добровольной схеме, а процент прироста допустимых затрат ниже. Т.е. для среднего поставщика ЛП выгоднее присоединиться к Добровольной схеме. Этот вывод подтверждается соотношением и динамикой продаж по Добровольной и Принудительной схемам за период с IV квартала 2019 г. по III квартал 2020 г.: 10,106 млрд фунтов в Добровольной и 703 млн фунтов в Принудительной, причем наблюдается дальнейшее снижение неисключаемых продаж по Принудительной схеме.
Основным сегментом поставщиков ЛП, которых может заинтересовать Принудительная схема, являются те, которые подпадают под исключение продаж и заключают индивидуальные контракты на поставку. В Принудительной схеме есть схожие с Добровольной преференции для малых компаний и ЛП нижнего ценового сегмента, однако для поставщиков новых ДВ выгоднее Добровольная схема.
Сравнительные ключевые показатели и их прогнозируемые уровни, установленные при внедрении Добровольной схемы в 2019 г., представлены в таблице 5. Отметим неожиданно высокие прогнозируемые темпы роста продаж в рамках Принудительной схемы (учитывая более высокий процент платежей).
Таблица 5. Ключевые прогнозные показатели,
установленные при внедрении Добровольной схемы в 2019 г., %
Table 5. Key forecast indicators set in the implementation of the Voluntary Scheme in 2019, %
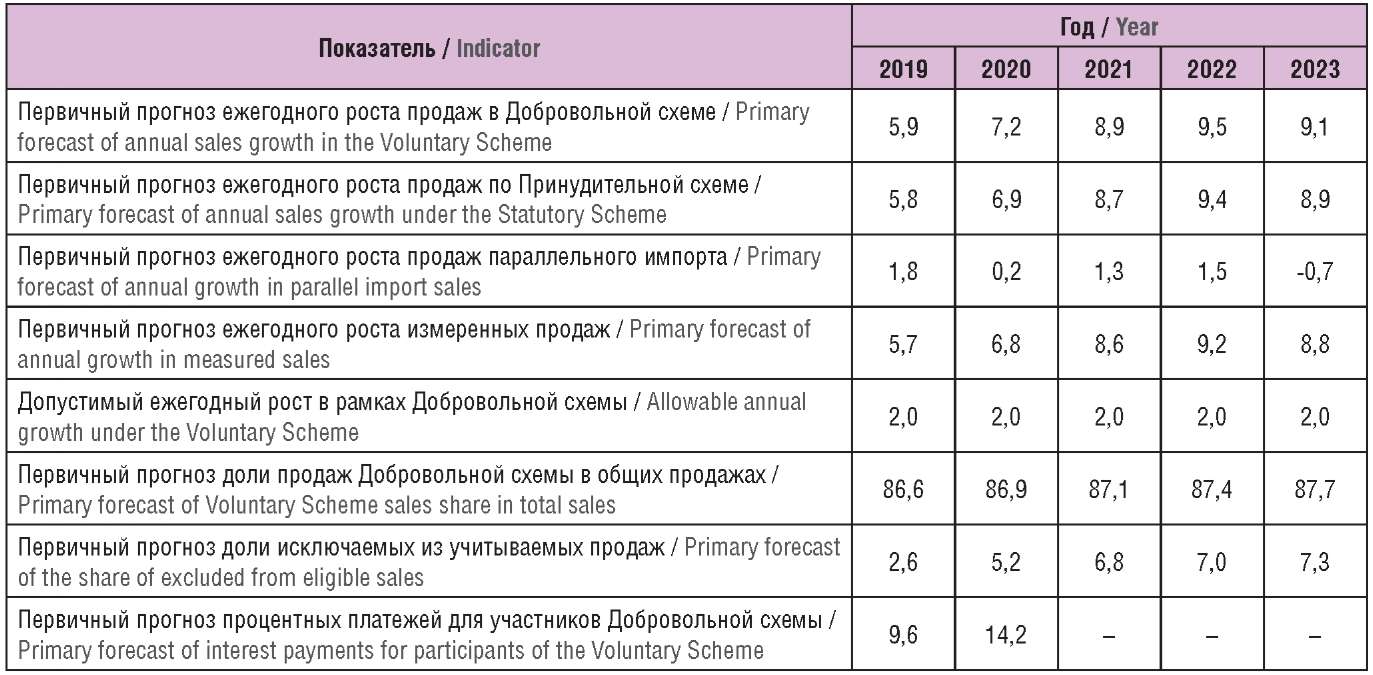
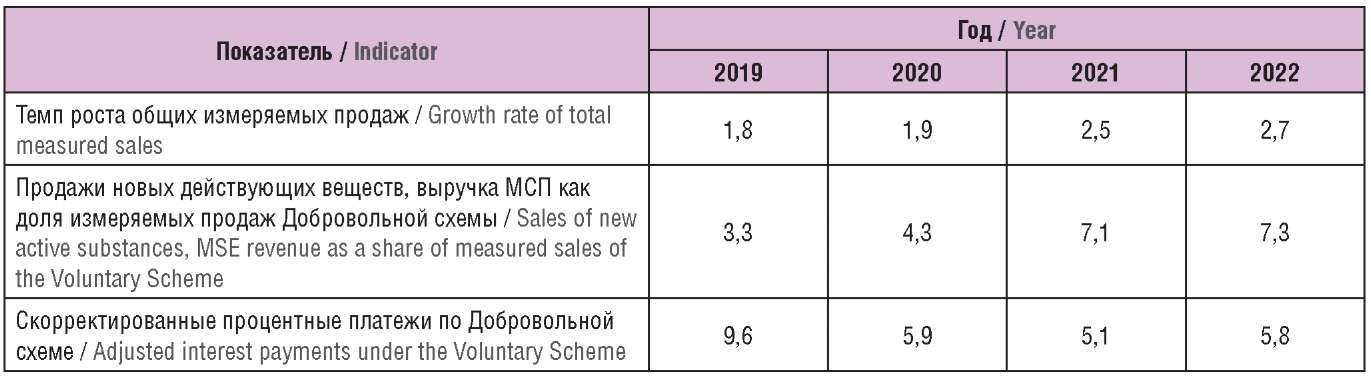
Таблица 6 отражает динамику фактических значений показателей, рассчитанных по данным 2020 г. Отметим, что в системе планирования ожидается заметное увеличение продаж новых ДВ. Учитывая наличие платформы для передачи информации о разрабатываемых препаратах PharmaScan, такими показателями DHSC демонстрирует определенную уверенность в получаемой информации о разрабатываемых технологиях.
Таблица 6. Прогнозные показатели, скорректированные в 2020 г., %
Table 6. Forecast indicators adjusted in 2020, %
Примечание. МСП – малые и средние предприятия.
Note. MSE – medium sized companies.
Как видно, при внедрении Добровольной схемы на 2020 г. был установлен процентный платеж в размере 14,2% с последующей корректировкой в сторону снижения до 5,9%. Процент на 2021 г. установлен на еще более низком уровне – 5,1%. Снижение отчасти объясняется более низким фактическим приростом общих измеряемых продаж патентованных ЛП в системе здравоохранения, чем ожидалось: первичный прогноз предусматривал 5,7% в 2019 г. и 6,8% в 2020 г., фактически прирост оказался 1,8% и 1,9% соответственно.
Объем фармацевтического рынка ВБ в 2018 г. в оптовых ценах составлял около 3,8 трлн руб., при этом затраты государства на продукты схем составили примерно 25% от всего фармацевтического рынка [6]. Фармацевтический рынок РФ в 2018 г. составил 1,6 трлн руб., из них 0,5 трлн руб. пришлось на государственный сектор [7]. В 2019–2020 гг. отчетливо заметна тенденция на снижение измеряемых продаж в рамках Принудительной схемы (табл. 7), что отчасти объясняется увеличением объемов исключаемых продаж в рамках централизованных государственных закупок, а также большей выгодой Добровольной схемы для среднестатистического поставщика ЛП.
Таблица 7. Динамика измеряемых продаж в 2018–2020 гг.
Table 7. Measured sales dynamics in 2018–2020
ОБСУЖДЕНИЕ / DISCUSSION
Ключевой особенностью системы государственного регулирования издержек здравоохранения на лекарственное обеспечение в ВБ является фокус на эффективность затрат, а не на ограничение участников рынка. Это выражается в пристальном внимании к сегменту ЛП, находящихся под патентной защитой, как наиболее затратному в структуре бюджета. Контроль издержек на воспроизведенные препараты предоставлен конкурентному рынку и регулированию антимонопольной службы.
Важнейшими инструментами достижения эффективности государственных затрат являются следующие.
- Заранее согласованная и общедоступная информация о динамике допустимого увеличения затрат здравоохранения в долгосрочной перспективе.
- Процентные платежи, осуществляемые поставщиками ЛП в рамках схем, в размере превышения допустимого уровня прироста затрат системы здравоохранения. Наличие необходимости осуществлять платежи по прогнозируемым ставкам практически гарантированно ведет к расхождениям с фактическими показателями. Образующаяся разница может быть выгодна одним участникам и невыгодна другим. Дополнительным аспектом неравенства является бремя от новых ДВ.
- Использование механизма ассоциаций и саморегулируемых организаций (СРО). Важность диалога при регулировании рынка очевидна, однако невозможно поддерживать общение со всеми организациями одновременно. Для представления интересов отрасли при разработке государственных программ в ВБ используется механизм СРО и ассоциаций, которые несут ответственность за правдивость и качество предоставляемой информации производителей, а также своевременность вносимых платежей в рамках схем. Деятельность СРО и эффективность саморегулирования в фармацевтической отрасли обоснованы большим объемом долгосрочных инвестиций, необходимых для реализации проектов, и высокой ценой ошибки в случае нарушений. В то же время с помощью диалога с СРО регулятор способен оперативно получить структурированный срез информации по интересующему вопросу, отражающий усредненное мнение участников о разрабатываемых ограничительных программах.
- Внедрение комплексных систем информатизации здравоохранения и взаимодействия с промышленностью для обеспечения эффективности долгосрочного планирования. Долгосрочное планирование лежит в основе Добровольной и Принудительной схем, т.е. Правительством ВБ признается ключевая роль стратегических решений и прогнозов в оптимизации здравоохранения. В основе формирования комплексных прогнозных моделей лежит большой объем первичной информации системы здравоохранения и промышленности. Подобный подход постепенно реализуется и в РФ в рамках национального проекта «Здравоохранение», однако необходимо увеличить наполнение и количество модулей ЕГИСЗ, обеспечив сбор информации планируемых к выводу ЛП в среднесрочной перспективе.
- Процедура ОТЗ как критерий принятия решений о цене возмещения. ОТЗ является важнейшим механизмом формирования эффективной структуры лекарственного возмещения. Сравнительная клинико-экономическая эффективность ЛП как показатель должна лежать в основе цены, которую готова заплатить система здравоохранения производителю за ЛП. Причем этот показатель является динамическим и должен периодически актуализироваться в зависимости от потребностей системы здравоохранения, структуры заболеваемости и регистрации новых ЛП (что возвращает к теме информатизации и автоматизации).
- Долгосрочные коммерческие соглашения на поставку ЛП с индивидуальными скидками. Практика долгосрочных соглашений на поставку постепенно внедряется и в РФ в форме «офсетных контактов», однако в рамках закупок ЛП, находящихся под патентной защитой, необходимо законодательно закрепить возможность проведения прямых переговоров с поставщиком. Внедрение этой процедуры обусловлено фактическим отсутствием рационального выбора поставщиков при закупке патентованных ЛП на аукционах. В рамках таких закупок поставить препарат может как производитель, так и дистрибьютор, однако, за редким исключением, производитель теоретически способен предложить более конкурентоспособную цену. Основным сдерживающим фактором в данном случае является принятая методика ценообразования [20][21], в соответствии с которой снижение цены на аукционе может стать основанием для снижения предельной зарегистрированной цены производителя навсегда. Соответственно, исключение такого фактора и законодательное закрепление процедуры прямых переговоров с индивидуальными скидками, которые не будут оказывать влияния на предельную цену и средневзвешенную цену контракта, позволят производителям более свободно предоставлять индивидуальные скидки на наиболее затратные ЛП в рамках централизованных закупок.
ЗАКЛЮЧЕНИЕ / CONCLUSION
Государственное регулирование издержек здравоохранения на лекарственное обеспечение в ВБ представляет собой достаточно оригинальную и комплексную систему, сформированную с учетом стратегической значимости инновационного развития фармацевтической отрасли.
Система ВБ не может быть полностью скопирована и перенесена на российское здравоохранение вследствие существенных страновых различий процессов, потребностей и инфраструктуры. Однако внедрение лучших универсальных практик контроля издержек позволит усовершенствовать систему государственного регулирования цен на важнейшие ЛП, обеспечить более эффективное расходование средств и расширить перечень социальных услуг, предоставляемых населению в рамках программ лекарственного обеспечения.
1. Включает наиболее общие процедуры и потребности пациентов, например обращение к врачу из-за симптомов острой респираторной вирусной инфекции, перелома, сыпи и пр. Также специалисты первичного звена ответственны за направление пациента в случае необходимости к узкоспециализированным медработникам, представляющим вторичное звено (англ. secondary care), например к кардиологу или эндокринологу.
2. Лекарства, медикаменты и другие вещества, которые нельзя заказывать по общему контракту на медицинские услуги (англ. Drugs, Medicines and Other Substances not to be ordered under a General Medical Services Contract).
3. Перечень воспроизведенных препаратов и их цен, которые подлежат возмещению системой здравоохранения Великобритании.
4. В данном случае понятие «патентованные препараты» применяется к так называемым брендированным препаратам (англ. branded medicines). Основная задача этих схем – регулирование издержек на лекарства, оказывающие наибольшую нагрузку на бюджет, большая часть которых включает именно препараты под патентной защитой. Более подробное описание групп лекарственных препаратов, регулируемых описываемыми схемами, приведено ниже.
5. Далее эти продукты будут обозначаться как «патентованные ЛП».
6. По оценкам группы специалистов, возглавляемой Йоркским университетом, в 2008 г. наиболее статистически достоверная стоимость QALY в Британии составила 12 936 фунтов стерлингов (около 1,35 млрд руб.). Таким образом, считается, что каждые 12 936 фунтов, перераспределенные из бюджета системы здравоохранения на другие цели, оцениваются как потеря 1 QALY. И наоборот, любые действия, обеспечивающие экономию затрат, будут считаться предоставлением 1 QALY на каждые 12 936 фунтов сэкономленных средств [13].
7. В рамках PPRS допустимый прирост был установлен на уровне 1,1% в год. Таким образом, в результате переговоров в процессе разработки схемы ABPI согласовала снижение общих издержек поставщиков препаратов благодаря увеличению допустимого прироста издержек.
8. Параллельный импорт – принцип исчерпания прав, при котором допускается ввоз на территорию страны оригинальных товаров, имеющих маркировку товарным знаком правообладателя, лицами, не получившими документированного согласия от правообладателя на ввоз.
9. В 2019 г. процентный платеж составил 9,6% на основании первичного прогноза.
10. Отметим, что продажи новых ДВ и средних компаний не исключаются из измеренных продаж. В дальнейшем будет показано, что такая мера перераспределяет нагрузку от новых ДВ с бюджета на участников схемы.
11. Т.к. прогнозирование и перерасчет осуществляются до конца текущего года, а именно в III квартале, часть продаж текущего года (IV квартал) формируется на основании прогнозных данных.
12. Составляет 2% в год по Добровольной схеме и 1,1% по Принудительной схеме.
13. Напомним, что из измеряемых продаж не вычитаются продажи новых ДВ.
14. Из учитываемых продаж исключаются новые ДВ.
15. Производители и сами проводят ОТЗ новых препаратов, однако методики и подходы к проведению несопоставимы.
16. «Старыми» их можно назвать условно, т.к. схема предназначена для патентованных препаратов.
17. В 2019 г. 9,9%.
Список литературы
1. The Human Medicines Regulations 2012. URL: https://www.legislation.gov.uk/uksi/2012/1916/introduction (дата обращения 05.05.2021).
2. The 2019 Voluntary Scheme for branded medicines pricing and access – chapters and glossary. URL: https://assets.publishing.service.gov.uk/government/uploads/system/uploads/attachment_data/file/761834/voluntary-scheme-for-branded-medicines-pricing-and-accesschapters-and-glossary.pdf (дата обращения 05.05.2021).
3. The 2019 Voluntary Scheme for branded medicines pricing and access – annexes. URL: https://assets.publishing.service.gov.uk/government/uploads/system/uploads/attachment_data/file/761835/voluntary-scheme-for-branded-medicines-pricing-and-accessannexes.pdf (дата обращения 05.05.2021).
4. The Branded Health Service Medicines (Costs) Regulations 2018. URL: https://www.legislation.gov.uk/uksi/2018/345/introduction/made (дата обращения 05.05.2021).
5. Health Service Medical Supplies (Costs) Act 2017. URL: https://www.legislation.gov.uk/ukpga/2017/23/contents/enacted (дата обращения 05.05.2021).
6. Pharmaceutical industry in the United Kingdom (UK) – Statistics & Facts. URL: https://www.statista.com/topics/5056/pharmaceuticalindustry-in-the-uk/#dossierSummary (дата обращения 05.05.2021).
7. Данные аналитической базы данных агентства DSM Group. URL: https://dsmviewer.ru/ (дата обращения 05.05.2021).
8. Постановление Правительства Российской Федерации от 31.10.2020 № 1771 «Об утверждении особенностей государственного регулирования предельных отпускных цен производителей на лекарственные препараты, включенные в перечень жизненно необходимых и важнейших лекарственных препаратов, и внесении изменений в отдельные акты Правительства Российской Федерации». URL: http://publication.pravo.gov.ru/Document/View/0001202011030002 (дата обращения 05.05.2021).
9. Указ Президента Российской Федерации от 07.05.2018 № 204 «О национальных целях и стратегических задачах развития Российской Федерации на период до 2024 года». URL: https://base.garant.ru/71937200/ (дата обращения 05.05.2021).
10. Постановление Правительства РФ от 26.12.2017 № 1640 «Об утверждении государственной программы Российской Федерации «Развитие здравоохранения» (с изменениями и дополнениями). URL: https://base.garant.ru/71848440/ (дата обращения 05.05.2021).
11. Proposed changes to the Statutory Scheme to control the costs of branded health service medicines. Consultation response. URL: https://assets.publishing.service.gov.uk/government/uploads/system/uploads/attachment_data/file/871345/consultation-responsestatutory-scheme-2020.pdf (дата обращения 05.05.2021).
12. Statutory Scheme to control costs of branded health service medicines. URL: https://assets.publishing.service.gov.uk/government/uploads/system/uploads/attachment_data/file/871361/final-impactassessment-statutory-scheme-2020.pdf (дата обращения 05.05.2021).
13. Methods for the estimation of the NICE cost effectiveness threshold. URL: https://www.york.ac.uk/media/che/documents/papers/researchpapers/CHERP81_methods_estimation_NICE_costeffectiveness_threshold_%28Nov2013%29.pdf (дата обращения 05.05.2021).
14. 2019 Voluntary Scheme sales reports: eligible sales and resulting total scheme payments. URL: https://www.gov.uk/government/publications/voluntary-scheme-aggregate-net-sales-and-paymentinformation-november-2020/aggregate-net-sales-and-paymentinformation-16-november-2020 (дата обращения 05.05.2021).
15. Лешкевич А.А., Юрочкин Д.С., Голант З.М., Наркевич И.А. Обзор методик расчета, процедуры регистрации и перерегистрации цен производителей лекарственных препаратов в странах Евразийского экономического союза. ФАРМАКОЭКОНОМИКА. Современная фармакоэкономика и фармакоэпидемиология. 2020; 13 (2): 193–204. https://doi.org/10.17749/2070-4909/farmakoekonomika.2020.039.
16. Национальный проект «Здравоохранение», Федеральный проект «Создание единого цифрового контура в здравоохранении на основе единой государственной информационной системы здравоохранения (ЕГИСЗ)». URL: https://legalacts.ru/doc/natsionalnyi-proekt-zdravookhranenie-federalnyi-proekt-sozdanieedinogo-tsifrovogo-kontura_4/ (дата обращения 05.05.2021).
17. Annual Review of the Branded Health Service Medicines (Costs) Regulations March 2020. URL: https://assets.publishing.service.gov.uk/government/uploads/system/uploads/attachment_data/file/871228/annual-review-of-the-branded-health-service-medicinescosts-regulations-2018.pdf (дата обращения 05.05.2021).
18. Aggregate net sales and payment information: 16 November 2020 (corrected). URL: https://www.gov.uk/government/publications/voluntary-scheme-aggregate-net-sales-and-payment-informationnovember-2020/aggregate-net-sales-and-payment-information-16-november-2020 (дата обращения 05.05.2021).
19. Voluntary Scheme for branded medicines: payment percentage for 2020. URL: https://www.gov.uk/government/publications/voluntaryscheme-for-branded-medicines-payment-percentage-for-2020 (дата обращения 05.05.2021).
20. Постановление Правительства Российской Федерации от 29.10.2010 № 865 «О государственном регулировании цен на лекарственные препараты, включенные в перечень жизненно необходимых и важнейших лекарственных препаратов» (с изменениями и дополнениями). URL: https://base.garant.ru/12179966/ (дата обращения 05.05.2021).
21. Постановление Правительства Российской Федерации от 15.09.2015 № 979 «О внесении изменений в постановление Правительства Российской Федерации от 29 октября 2010 г. N 865 и об утверждении методики расчета предельных отпускных цен производителей на лекарственные препараты, включенные в перечень жизненно необходимых и важнейших лекарственных препаратов» (с изменениями и дополнениями). URL: https://base.garant.ru/71192234/ (дата обращения 05.05.2021).
Об авторах
А. А. ЛешкевичРоссия
младший научный сотрудник лаборатории регуляторных отношений и надлежащих практик,
ул. Профессора Попова, д. 14, лит. А, Санкт-Петербург 197022
Д. С. Юрочкин
Россия
научный сотрудник лаборатории регуляторных отношений и надлежащих практик,
ул. Профессора Попова, д. 14, лит. А, Санкт-Петербург 197022
З. М. Голант
Россия
к.э.н., заведующий лабораторией регуляторных отношений и надлежащих практик,
ул. Профессора Попова, д. 14, лит. А, Санкт-Петербург 197022
И. А. Наркевич
Россия
д.фарм.н., профессор, ректор,
ул. Профессора Попова, д. 14, лит. А, Санкт-Петербург 197022
Рецензия
Для цитирования:
Лешкевич А.А., Юрочкин Д.С., Голант З.М., Наркевич И.А. Исследование методов государственного регулирования цен и издержек системы здравоохранения на лекарственные препараты в Великобритании. ФАРМАКОЭКОНОМИКА. Современная фармакоэкономика и фармакоэпидемиология. 2022;15(1):23-39. https://doi.org/10.17749/2070-4909/farmakoekonomika.2022.102
For citation:
Leshkevich A.A., Yurochkin D.S., Golant Z.M., Narkevich I.A. Study of methods for state regulation of prices and costs of the health care system for medicines in the United Kingdom. FARMAKOEKONOMIKA. Modern Pharmacoeconomics and Pharmacoepidemiology. 2022;15(1):23-39. (In Russ.) https://doi.org/10.17749/2070-4909/farmakoekonomika.2022.102

Контент доступен под лицензией Creative Commons Attribution-NonCommercial-ShareAlike 4.0 International License.






































