Перейти к:
Современные подходы к лечению вульвовагинальной атрофии у женщин с гинекологическим раком и раком молочных желез
https://doi.org/10.17749/2070-4909/farmakoekonomika.2025.314
Аннотация
Актуальность. Лечение вульвовагинальной атрофии (ВВА) у женщин с диагнозом гинекологического рака или рака молочных желез (РМЖ) является сложной задачей. Методы лечения ВВА как генитального проявления генитоуринарного синдрома менопаузы (ГСМ) обычно отражают подходы, используемые при естественной менопаузе, однако данные об эффективности и безопасности, характерные для этой группы пациенток, ограниченны из-за исключения их из клинических испытаний.
Цель: провести анализ литературных данных о новых подходах к терапии ВВА как проявления ГСМ у женщин с гинекологическим раком или РМЖ.
Материал и методы. Проведен поиск в базах данных PubMed/MEDLINE, Web of Science, eLibrary, Google Scholar, Scopus с использованием ключевых словосочетаний «вульвовагинальная атрофия», «вульварная атрофия после рака», «лечение вульварной атрофии у женщин с раком», «терапия низкими дозами эстрогенов», «лазерное лечение вульвовагинальной атрофии» на русском и английском языках. Также поиск выполняли по ключевым ссылкам из библиографий соответствующих исследований. В обзор включали оригинальные и обзорные статьи, содержащие указанные ключевые слова и опубликованные с 1996 г. по март 2025 г.
Результаты. У женщин с анамнезом гинекологического рака или РМЖ лечение ВВА должно быть индивидуализировано. Негормональные методы, а именно лубриканты при сексуальной активности и регулярное использование вагинальных увлажнителей длительного действия, обычно являются первой линией терапии. Фракционная лазерная терапия с применением CO2 представляет собой эффективный и безопасный метод для пациенток, переживших гинекологический рак, улучшая сексуальную функцию и качество жизни. Также в этой популяции использование гиалуроновой кислоты вместе с витаминами А и Е продемонстрировало положительный эффект, приводя к уменьшению сухости влагалища и диспареунии. Применение местной гормональной терапии может быть вариантом для пациенток, у которых нефармакологические и негормональные средства оказались неэффективны, после обсуждения рисков и преимуществ, а также консультации с онкологом.
Заключение. Не все доступные варианты лечения подходят для женщин с онкологическим анамнезом из-за опасности рецидива гормонозависимого рака, связанного с терапией эстрогенами. В данной популяции новые методы лечения, такие как лазерная терапия и вагинальные инъекции, показывают многообещающие результаты с минимальными побочными эффектами и гормононезависимыми механизмами.
Ключевые слова
Для цитирования:
Гридасова О.С., Солопова А.Г., Румянцева Е.И., Иванов А.Е., Уткин Д.О., Хизроева Д.Х. Современные подходы к лечению вульвовагинальной атрофии у женщин с гинекологическим раком и раком молочных желез. ФАРМАКОЭКОНОМИКА. Современная фармакоэкономика и фармакоэпидемиология. 2025;18(2):284–293. https://doi.org/10.17749/2070-4909/farmakoekonomika.2025.314
For citation:
Gridasova O.S., Solopova A.G., Rumyantseva E.I., Ivanov A.E., Utkin D.О., Khizroeva J.Kh. Current approaches to the treatment of vulvovaginal atrophy in women with gynecological and breast cancer. FARMAKOEKONOMIKA. Modern Pharmacoeconomics and Pharmacoepidemiology. 2025;18(2):284–293. (In Russ.) https://doi.org/10.17749/2070-4909/farmakoekonomika.2025.314
ВВЕДЕНИЕ / INTRODUCTION
В 2014 г. Североамериканское общество менопаузы (англ. North American Menopause Society, NAMS) и Международное общество по изучению женского сексуального здоровья (англ. International Society for the Study of Women's Sexual Health, ISSWSH) рекомендовали использовать термин «генитоуринарный синдром менопаузы» (ГСМ) для обозначения ряда генитальных и мочевых симптомов, которые могут возникать во время менопаузы и после нее [1].
Симптомы ГСМ встречаются часто и включают сухость влагалища, или вульвовагинальную атрофию (ВВА), дискомфорт и диспареунию, жжение и зуд, а также учащенное и неотложное мочеиспускание. Однако все они могут возникнуть и раньше из-за противораковой терапии или двусторонней овариэктомии [1][2]. Химиотерапия и антиэстрогенная адъювантная терапия, которая включает агонисты гонадотропин-рилизинг-гормона, тамоксифен и ингибиторы ароматазы (ИА), оказывает биологическое повреждение, предрасполагающее к атрофическим изменениям в урогенитальных тканях и усугубляющее гипоэстрогенное состояние [3]. Из-за более выраженной ятрогенной гипоэстрогении пациентки, принимающие ИА, испытывают более тяжелые симптомы ГСМ по сравнению с теми, кто принимает тамоксифен.
Лечение ВВА у женщин с диагнозом гинекологического рака или рака молочной железы (РМЖ) является сложной задачей.
Цель – провести анализ литературных данных о новых подходах к терапии ВВА как проявления ГСМ у женщин с онкогинекологическим раком или РМЖ.
МАТЕРИАЛ И МЕТОДЫ / MATERIAL AND METHODS
Стратегия поиска / Search strategy
Проведен поиск публикаций в базах данных PubMed/MEDLINE, Web of Science, eLibrary, Google Scholar, Scopus с использованием ключевых словосочетаний на русском и английском языках: ««вульвовагинальная атрофия», «вульварная атрофия после рака», «лечение вульварной атрофии у женщин с раком», «терапия низкими дозами эстрогенов», «лазерное лечение вульвовагинальной атрофии», “vulvovaginal atrophy following treatment for oncogynecologic pathologies”, “genitourinary syndrome of menopause in breast cancer survivors”, “low dose estrogen therapy”, “laser therapy of vulvovaginal atrophy”. Также поиск выполнен по ключевым ссылкам из библиографий соответствующих исследований. В обзор включали оригинальные исследования и обзорные статьи на английском и русском языках, содержащие вышеупомянутые ключевые слова и опубликованные с 1996 г. по март 2025 г.
Критерии отбора / Selection criteria
Оценку исследований проводили по критериям включения на основе названия и аннотации статьи, после чего анализировали текст статьи целиком. Исследования, полный текст которых был недоступен, исключались. Также не рассматривались публикации, посвященные менопаузальным изменениям, отличным от ГСМ.
По итогам первоначального поиска по ключевым словам найдено 3865 публикаций. В результате отбора в обзор включено 50 полнотекстовых статей (рис. 1).
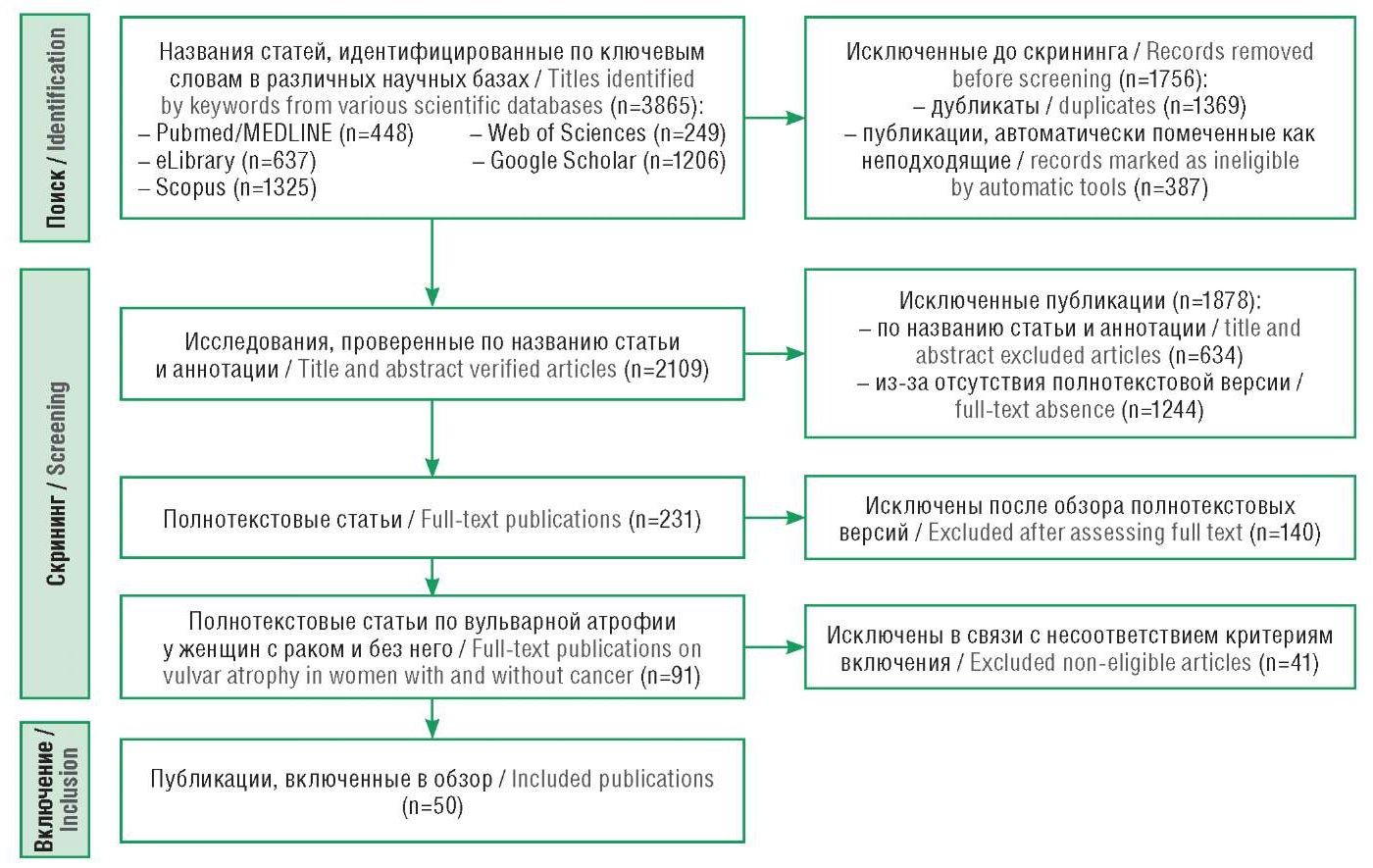
Рисунок 1. Схема отбора исследований для обзора
Figure 1. Flow chart of study selection for review
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ / RESULTS AND DISCUSSION
Методы лечения ВВА как генитального проявления ГСМ обычно отражают подходы, используемые при естественной менопаузе [1][4]. Однако не все доступные варианты лечения ГСМ подходят для женщин с онкологическим анамнезом из-за опасности рецидива гормонозависимого рака, связанного с терапией эстрогенами [5].
Методы лечения ВВА у женщин с опухолями половых органов / Treatment methods for VVA in women with genital tumors
В 2022 г. для выявления наиболее безопасных и эффективных методов лечения ВВА у женщин с опухолями женских половых органов был проведен систематический обзор литературы, в котором проанализированы пять различных методов лечения: вагинальные суппозитории, пероральные препараты, хирургические процедуры, терапия лазером CO2 и вагинальный расширитель [6].
Новые методы, такие как лазерная терапия, радиочастотные методы и вагинальные инъекции, показывают многообещающие результаты у женщин с минимальными побочными эффектами и гормононезависимыми механизмами, хотя данные об эффективности различаются [7][8].
Лучевая терапия в комплексном лечении рака шейки матки (РШМ), рака тела матки (РТМ) и вульвы может вызывать серьезные поздние вагинальные побочные эффекты [9]. К сожалению, существует мало доступных вмешательств, которые уменьшают симптомы атрофии влагалища, нормализуют pH и снижают ощущение сухости влагалища у женщин, прошедших брахитерапию или лучевую терапию по поводу злокачественных новообразований матки или шейки матки. В 2021 г. проведен анализ данных 376 пациенток с РТМ и РШМ, получавших гиалуроновую кислоту (ГК), витамин А, витамин Е, альфа-токоферола ацетат и диенестрол для лечения ВВА после облучения [10]. Применение ГК вместе с витаминами А и Е имело преимущество в таких конечных точках, как уменьшение диспареунии, воспаление слизистой оболочки влагалища, сухость влагалища, фиброз и клеточная атипия. Введение альфа-токоферола ацетата снизило воспаление слизистой оболочки влагалища и улучшило акантоз влагалища, тогда как диенестрол привел к уменьшению диспареунии и контактных кровянистых выделений [10].
Методы лечения ВВА у женщин с анамнезом РМЖ / Treatment methods for VVA in women with a history of breast cancer
Лечение РМЖ также увеличивает распространенность ВВА, поскольку хирургические, эндокринные и химиотерапевтические препараты, используемые при этом, могут вызывать или усугублять симптомы урогенитальной атрофии [11].
Для женщин с гормононезависимым раком терапия ВВА аналогична ведению в менопаузе. Для пациенток с гормонозависимым раком лечение ВВА обязательно под контролем онколога. Основные направления терапии ВВА у женщин, имеющих или перенесших РМЖ, включают изменение образа жизни, а также негормональные и гормональные методы [12][13]. Проводятся консультации с сексологом по увеличению сексуальной активности, которая улучшает кровоток и pH влагалища. Использование вагинальных расширителей позволяет предотвратить фиброзные изменения. Управление стрессом также важно для снижения стресса, связанного со страхом болезненного полового акта. Следует соблюдать правильную гигиену наружных половых органов.
Однако мер по изменению образа жизни самих по себе обычно недостаточно для значительного улучшения состояния женщин с ВВА, перенесших РМЖ. Негормональные вагинальные увлажнители и лубриканты рекомендуются в качестве терапии первой линии при симптомах ВВА у пациенток с РМЖ. Следует отказаться от парфюмированного мыла и туалетной бумаги, резиновых изделий, синтетических предметов одежды, включая нижнее белье, и некоторых смягчителей для стирки одежды [12]. Местная терапия эстрогенами, которая наиболее эффективна в лечении симптомов ГСМ, у женщин с РМЖ является спорным методом в связи с гипотетическим риском рецидива рака [13].
Менопаузальная гормональная терапия
В руководствах NAMS 2012 г. [14] и 2017 г. [1] назначение менопаузальной гормональной терапии (МГТ) считается противопоказанным при РМЖ, особенно после получения результатов исследования HABITS [15] и Стокгольмского исследования [16]. Исследование HABITS было преждевременно прекращено, поскольку риск рецидива РМЖ среди пациенток, получавших МГТ, был статистически значимо выше (относительный риск 3,3), чем среди тех, кто не получал никакого лечения. Кроме того, исследование тиболона (соединения, альтернативного обычной гормональной терапии), который демонстрирует эстрогенные, прогестагенные и андрогенные свойства, также было преждевременно остановлено из-за значительного увеличения рецидивов в группе РМЖ, принимавших тиболон, по сравнению с группой плацебо. Системная абсорбция может происходить при обычных дозах вагинальной терапии эстрогенами, особенно в случае атрофии влагалища. Применение сверхнизких доз вагинальных эстрогенов у здоровых женщин в постменопаузе показало хорошую эффективность и благоприятный профиль безопасности для молочных желез и эндометрия, при этом наблюдались незначительные уровни эстрадиола в плазме. Следует отметить, что для женщин с РМЖ, особенно тех, кто получает терапию ИА, крайне важна системная абсорбция вагинально вводимых эстрогенов.
Долгосрочная депривация эстрадиола вызывает «адаптивную гиперчувствительность». Длительное подавление эстрадиола приводит к повышению регуляции альфа-рецепторов эстрогенов и основных клеточных сигнальных путей, что вызывает гиперчувствительность раковых клеток к низким концентрациям эстрогенов [17]. В связи с этим у данной группы пациенток в качестве терапии первой линии Американская коллегия акушеров и гинекологов (англ. American College of Obstetricians and Gynecologists, ACOG) рекомендует местные негормональные лечебные средства, оставляя эстрогены пациенткам, не поддающимся лечению негормональными методами [18]. Решение об использовании вагинального эстрогена может быть принято по согласованию с онкологом. Кроме того, этому должен предшествовать процесс принятия информированного решения и согласия, в котором женщине предоставляются все данные для рассмотрения преимуществ и потенциальных рисков низких доз вагинального эстрогена.
В 2022 г. NAMS опубликовало заявление о своей позиции в отношении гормональной терапии, которое было одобрено более чем 20 ведущими международными организациями [19]. Гормональная терапия остается наиболее эффективным методом лечения вазомоторных симптомов и ГСМ. Также, как известно, она предотвращает потерю костной массы и риск развития переломов. Однако до сих пор мало рандомизированных контролируемых исследований о рисках длительной гормональной терапии у женщин старше 60 или 65 лет, хотя наблюдательные исследования указывают на редкий потенциальный риск РМЖ при увеличении продолжительности терапии. Использование низкодозированной вагинальной терапии эстрогенами в случаях, когда негормональная терапия ГСМ оказалась неэффективной, является безопасным методом, который значительно улучшает качество жизни [19].
Современные данные не демонстрируют повышенного риска рецидива рака среди женщин, в настоящее время проходящих лечение РМЖ или имеющих личный анамнез РМЖ, которые используют вагинальный эстроген для облегчения урогенитальных симптомов [20].
Исследования среди женщин с РМЖ, использующих низкие [21][22] и сверхнизкие [23] дозы вагинальных эстрогенов, показали, что такая терапия существенно облегчает симптомы ВВА без повышения уровня эстрогенов в крови. Применение вагинальных таблеток с низкой дозой 0,03 мг эстриола и Lactobacillus acidophilus у пациенток с РМЖ в постменопаузе во время лечения ИА, страдающих ВВА, приводит к небольшому и временному повышению уровня эстриола в сыворотке, но не эстрона или эстрадиола, поэтому может считаться безопасным и эффективным для лечения атрофического вагинита у женщин с РМЖ, принимающих ИА.
Ранее опубликованные данные показали эффективность и безопасность двух видов низкодозированных вагинальных эстрогенов (крем эстриол 0,25 мг или таблетки эстрадиола 12,5 мг) и негормонального вагинального увлажнителя на основе поликарбофила (2,5 г), вводимого дважды в неделю в течение 12 нед у постменопаузальных женщин с РМЖ и ВВА [21].
В оригинальном исследовании 2017 г. [24] проанализированы методы терапии, которые чаще всего назначаются онкогинекологами Италии. В большинстве случаев (71,1%) назначались негормональные методы лечения (смазки или увлажнители в той же пропорции). Вагинальная терапия эстрогенами была рекомендована 21% онкологов, а системная гормональная терапия рассматривается меньшинством клиницистов (4%) (рис. 2).
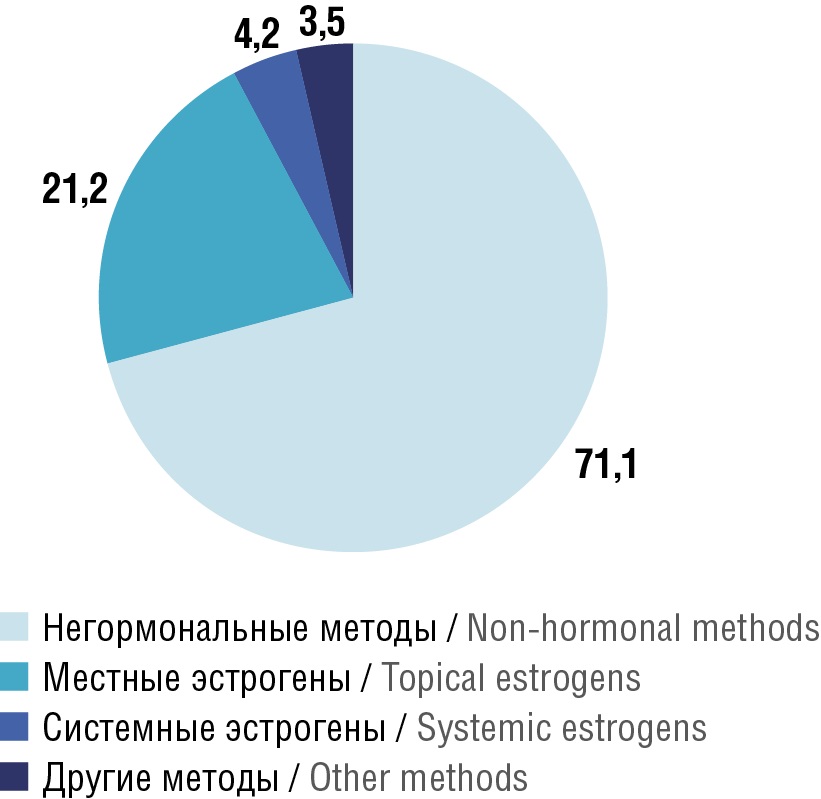
Рисунок 2. Методы, назначаемые для лечения вульвовагинальной атрофии у женщин с раком молочной железы в Италии: негормональные, местные или системные гормональные препараты и другие (в основном препараты альтернативной медицины) [24]
Figure 2. Methods prescribed for the treatment of vulvovaginal atrophy in women with breast cancer in Italy: non-hormonal, topical or systemic hormonal drugs, and others (mainly alternative medicine) [24]
Вагинальные расширители
Вагинальные расширители можно использовать для мягкого растяжения стенок влагалища, предотвращая сужение и улучшая гибкость тканей. Они выпускаются в различных размерах, и можно постепенно переходить от меньшего размера к большему.
Альтернативные методы
Оспемифен
Оспемифен – негормональный селективный агонист/антагонист эстрогена третьего поколения, аналогичный тамоксифену. Небольшой клинический опыт применения оспемифена показал, что он может быть кандидатом для назначения у женщин с ВВА и РМЖ в анамнезе после завершения (включая адъювантное) лечения рака [25, 26]. В исследовании он способствовал росту эпителия влагалища с минимальным воздействием на другие ткани, чувствительные к эстрогену, и был эффективен у женщин с ВВА, диспареунией и сухостью влагалища [25].
Оспемифен не увеличивает частоту возникновения рака или гиперплазии эндометрия, снижает метаболизм костной ткани у женщин в постменопаузе, а имеющиеся данные указывают на отсутствие проблем безопасности для тканей молочной железы [26]. Метаанализ выявил клинически незначимое утолщение эндометрия (до 1 мм) без новых случаев рака эндометрия или молочных желез после 12–52 нед лечения оспемифеном в дозе 60 мг [27].
Тестостерон
Известны немногочисленные данные о возможности использования вагинального тестостерона при РМЖ, хотя вульва и влагалище имеют андрогенные рецепторы. Тестостерон может вызывать пролиферацию вагинального эпителия, но его преобразование в эстрогены блокируется ингибированием ароматазы и, следовательно, может быть эффективным для профилактики ВВА без повышения уровня циркулирующего эстрогена и компрометации терапии ИА [28]. Четырехнедельный курс вагинального тестостерона приводил к улучшению состояния и снижению симптомов ВВА, связанной с терапией ИА, без повышения уровня эстрадиола или тестостерона [28].
Дегидроэпиандростерон
По данным NAMS, интравагинальный дегидроэпиандростерон (ДГЭА) может быть назначен женщинам с гормонозависимыми видами рака, когда негормональные методы лечения неэффективны [29]. Использование ДГЭА (6,5 мг прастерона) в течение 12 нед демонстрирует положительное влияние на pH и цитологические показатели влагалища без изменения уровней половых гормонов в крови [29][30][31].
Уровни сывороточного эстрадиола у пациенток, проходивших терапию ДГЭА, находились в пределах значений, наблюдаемых у здоровых женщин в постменопаузе. Он преобразуется в эстрогены внутриклеточно, без системного повышения эстрогена, и не влияет на клетки эндометрия. В эндометрии отсутствуют ферменты ароматазы, поэтому даже высокие дозы вагинального ДГЭА (в отличие от высоких доз вагинального эстрогена) не будут стимулировать эндометрий. Однако рекомендуется соблюдать осторожность при назначении его женщинам с анамнезом гормоночувствительного рака [31].
Оливковое масло, вагинальные упражнения и увлажняющий крем
Исследование OVERcome (оливковое масло, вагинальные упражнения и увлажняющий крем) продемонстрировало значительное улучшение качества жизни, сексуальной функции и диспареунии (p<0,001) через 12 нед терапии [32].
Пробиотики
Пробиотики играют важную роль в поддержании здоровья женской репродуктивной системы, облегчении течения гинекологических заболеваний и повышении местного иммунитета влагалища [33]. Они подавляют рост патогенов, вырабатывая различные антимикробные вещества, и конкурируют с патогенами за прилипание к вагинальному эпителию и за питательные вещества. Эксперименты in vitro с L. acidophilus продемонстрировали, что штамм способен вырабатывать значительные количества молочной кислоты и перекись водорода [34]. Также описаны дополнительные защитные механизмы, такие как выработка бактериоцинов и биосурфактантов, коагрегация и образование биопленки лактобацилл [33].
Сочетание вагинального введения сверхнизкой дозы 0,03 мг эстриола (Е3) и лиофилизированных жизнеспособных Lactobacillus acidophilus KS400 (0,03 мг-Е3/л) оказалось эффективным методом с двойным механизмом действия, поддерживающим не только пролиферацию и созревание вагинального эпителия, но и восстановление лактобациллярной микрофлоры у женщин с ВВА. Пробиотики продемонстрировали свою эффективность в качестве терапии для предотвращения будущей адгезии или колонизации патогенов у пациенток с РМЖ, испытывающих симптомы ВВА [35][36], и могут считаться безопасным и эффективным средством для терапии атрофического вагинита у женщин с РМЖ, принимающих нестероидные ИА [23].
Витамин D
Для изучения эффективности препаратов витамина D в изменении симптомов ВВА было проведено двойное слепое рандомизированное плацебо-контролируемое исследование, по результатам которого установлено, что пероральный прием витамина D потенциально улучшает показатели вагинального здоровья у женщин в постменопаузе с симптомами ВВА, однако существенных различий по сравнению с группой плацебо не выявлено [37].
В 2025 г. завершен систематический обзор и метаанализ [38], который включал 8 рандомизированных клинических исследований и оценивал эффективность витамина D как отдельно, так и в сочетании с другими методами лечения. Результаты продемонстрировали значительные позитивные изменения индекса созревания влагалища и сексуальной активности при применении местных форм витамина D, тогда как пероральный витамин D не показал существенных улучшений, за исключением вагинального pH.
Инъекционные методики
В качестве новых вариантов лечения ВВА предложены инъекционные процедуры в периуретральную область и стенки влагалища [39].
Самые распространенные методики включают применение следующих инъекционных материалов: аутологичная богатая тромбоцитами плазма (англ. platelet-rich plasma, PRP) + ГК, препараты на основе несшитой ГК и гидроксиапатита кальция (англ. not cross-linked hyaluronic acid plus calcium hydroxyapatite, NCLHA + CaHA), микрофрагментированная жировая ткань (англ. micro-fragmented adipose tissue, MFAT), гибридные кооперативные комплексы гиалуронана (англ. hyaluronan hybrid cooperative complexes, HCC), сшитая ГК, микрожировая и наножировая трансплантация + PRP и только PRP.
Тромбоциты хорошо известны своей способностью к свертыванию крови, но они также являются естественным источником аутологичных факторов роста (трансформирующий фактор роста бета, инсулиноподобный фактор роста, фактор роста эндотелия сосудов, эпидермальный фактор роста и тромбоцитарный фактор роста), которые играют важную роль в уменьшении воспаления, синтезе коллагена, стимуляции ангиогенеза и, как следствие, регенерации тканей.
Гидроксиапатит кальция – инъекционный дермальный наполнитель, содержащий однородные микросферы CaHA, взвешенные в водном носителе карбоксиметилцеллюлозного геля. Он считается долгосрочным, но непостоянным наполнителем и обладает высокой биосовместимостью с тканями человека, формируя под кожей матрицу, которая поддерживает синтез коллагена.
ГК – природный биополимер, который можно обнаружить в различных тканях, в большей концентрации в коже, глазах и суставных жидкостях. Уникальные свойства ГК, включая способность удерживать воду, делают ее бесценной в медицинских и косметических целях. В местах активного катаболизма тканей присутствует обильное количество низкомолекулярной ГК, где она способствует воспалению посредством воздействия на сигнализацию толл-подобных рецепторов [40]. Высокомолекулярная ГК присутствует в неповрежденных тканях и обладает противовоспалительным эффектом.
В литературе сообщается, что многие различные синтетические материалы, такие как кристаллы CaHA, наполнители ГК, PRP, эффективны в лечении сексуальных проблем и стрессового недержания мочи [41]. Однако на сегодняшний день данные о применении этих методов у женщин с онкологическим анамнезом весьма ограниченны.
Инъекции геля ГК также могут защитить мочевой пузырь и прямую кишку во время лучевой терапии. K. Iijima et al. показали, что инъекция 10 мл ГК в ректовагинальную или везиковагинальную перегородку значительно снизила воздействие радиации во время брахитерапии [42].
В исследовании 2023 г., проведенном S.S. Omar et al. [43], изучалась эффективность и переносимость инъекций PRP, отдельно или в сочетании с несшитой ГК по сравнению со стандартной терапией с применением местного геля ГК при лечении ВВА, вызванной или осложненной противоопухолевой терапией. Авторы сделали вывод, что оба препарата (PRP и PRP-ГК) имеют сопоставимую эффективность и могут стать новой альтернативной терапией для лечения ВВА у женщин в постменопаузе с онкологическим анамнезом [44].
Пересадка жировой ткани
Микрофрагментированная жировая ткань – относительно новая технология в области регенеративной медицины, которая начала набирать популярность в середине – конце 2000-х гг. Это форма обработанной аутологичной жировой ткани, которая была разбита на мелкие фрагменты или частицы различными методами, такими как механическая, ферментативная или ультразвуковая фрагментация. Использование собственного жира пациента (аутологичной ткани) исключает риск отторжения или неблагоприятной реакции, связанной с использованием инородных материалов. Микрофрагментированная жировая ткань содержит стволовые клетки, которые способны дифференцироваться в различные типы клеток (жировые, костные и хрящевые) и могут играть роль в регенерации и заживлении тканей. Кроме того, клетки, полученные из микрофрагментированной жировой ткани, обладают сильным противовоспалительным и регенеративным действием.
Методики микрожировой и наножировой трансплантации для вульвовагинального омоложения были представлены относительно недавно и направлены на увеличение васкуляризации, неоколлагенеза и регенерации тканей. Опыт применения аутологичной жировой трансплантации при лечении склероатрофического лихена вульвы продемонстрировал хорошие результаты [45]. Однако отсутствуют исследования по использованию данного метода у пациенток с гинекологическим раком или РМЖ.
Лазерная терапия
Вагинальная лазерная терапия стала многообещающей альтернативой для женщин с ВВА, которым не подходят другие виды лечения. В настоящее время при ГСМ используются два основных типа лазеров: фракционный микроаблационный CO2-лазер и неаблационный фототермический эрбиевый лазер YAG [46]. Как первый, так и второй вызывают морфологические изменения в тканях влагалища, улучшают кровоток и тонус мышц, способствуют сокращению коллагеновых волокон, восстанавливают эластичность влагалища и внеклеточный матрикс слизистых структур, при этом результаты аналогичны таковым в пременопаузальном периоде [6]. Лечение обычно включает три процедуры, проводимые с интервалами в 1 мес. Улучшение симптомов отмечалось по завершении протокола лечения, или через 4 нед после третьей лазерной процедуры [6].
Фракционный лазер CO2 вызывает локальное увеличение уровней различных цитокинов, в частности трансформирующего фактора роста А (стимулирующего матричные белки, такие как коллаген), основного фактора роста фибробластов (стимулирующего ангиогенную активность с миграцией и пролиферацией эндотелиальных клеток), эпидермального фактора роста (стимулирующего реэпителизацию), тромбоцитарного фактора роста (стимулирующего фибробласты для производства компонентов внеклеточного матрикса) и сосудистого эндотелиального фактора роста (регулирующего васкулогенез и ангиогенез, активирующего фибробласты для производства нового коллагена, других компонентов внеклеточного матрикса (протеогликанов, гликозаминогликанов и других молекул) и новых сосудов со специфическим воздействием на эпителиальную ткань) [47].
Er:YAG-лазер улучшает стрессовое недержания мочи, а также вагинальный пролапс и может быть предложен как безопасная и эффективная альтернатива заместительной гормональной терапии для лечения ВВА, а также как лечение первой линии для легкой и умеренной степени стрессового недержания мочи.
В 2015 г. N. Zerbinati et al. продемонстрировали микроскопические изменения слизистой оболочки влагалища после полного цикла лечения лазером CO2 [48]. Данные других авторов свидетельствуют о том, что как вагинальные Er:YAG, так и CO2 являются безопасными вариантами лечения ВВА у женщин с РМЖ [49].
Продолжается пилотное многоцентровое рандомизированное плацебо-контролируемое исследование пациенток с онкогинекологическими заболеваниями и ВВА, включающее 14 женщин с раком эндометрия (стадии I и II) [50]. Предварительные результаты подтверждают улучшение сексуальной жизни у таких пациенток. Более того, есть доказательства безопасности применения фракционнного лазера CO2 у женщин после гинекологического рака.
ЗАКЛЮЧЕНИЕ / CONCLUSION
Сухость влагалища, диспареуния, жжение, зуд и дискомфорт являются типичными клиническими проявлениями ВВА, которая усугубляется после радикального хирургического лечения, химиотерапии и антиэстрогенной адъювантной терапии у женщин с РМЖ и гинекологическим раком.
В настоящее время невозможно полностью определить безопасность приема вагинальных эстрогенов для лечения симптомов ВВА из-за малого размера выборки онкопациенток и дизайна доступных исследований. Большинство онкологов предпочитают негормональные методы лечения, такие как использование лубрикантов или увлажняющих средств, пробиотиков. В отдельных случаях (при гормононезависимом РМЖ или при гормонозависимых опухолях после завершения антигормональной адъювантной терапии) рассматривается возможность применения вагинальных эстрогенов. Лечение должно быть индивидуальным на основе соотношения риска и пользы для каждой женщины и клинической картины.
В качестве альтернативных вариантов можно рассматривать новые терапевтические подходы с использованием лазерной терапии, инъекционных методик, вагинальной формы ДГЭА сульфата, оспемифена.
Таким образом, в терапии ВВА у больных гинекологическим раком и РМЖ необходимо применять персонифицированный комплексный подход, сочетающий консультирование, информационную поддержку, использование медикаментозных и немедикаментозных средств, а также физиотерапевтических процедур, помощь профильных специалистов в контроле психологического состояния и сексуальной дисфункции.
Список литературы
1. The NAMS 2017 Hormone Therapy Position Statement Advisory Panel. The 2017 hormone therapy position statement of The North American Menopause Society. Menopause. 2017; 24 (7): 728–53. https://doi.org/10.1097/GME.0000000000000921.
2. Doust J., Huguenin A., Hickey M. Genitourinary syndrome of menopause: does everyone have it? Clin Obstet Gynecol. 2024; 67 (1): 4–12. https://doi.org/10.1097/GRF.0000000000000834.
3. Cucinella L., Tiranini L., Cassani C., et al. Genitourinary syndrome of menopause in breast cancer survivors: current perspectives on the role of laser therapy. Int J Womens Health. 2023; 15: 1261–82. https://doi.org/10.2147/IJWH.S414509.
4. Дмитриенко К.В., Яворская С.Д., Немцева Г.B. Вопросы диагностики и тактики ведения пациенток с вульвовагинальной атрофией с позиции международных клинических рекомендаций. Фундаментальная и клиническая медицина. 2022; 7 (4): 110–21. https://doi.org/10.23946/2500-0764-2022-7-4-110-121.
5. Angelou K., Grigoriadis T., Diakosavvas M., et al. The genitourinary syndrome of menopause: an overview of the recent data. Cureus. 2020; 12 (4): e7586. https://doi.org/10.7759/cureus.7586.
6. D'Oria O., Giannini A., Buzzaccarini G., et al. Fractional Co2 laser for vulvo-vaginal atrophy in gynecologic cancer patients: a valid therapeutic choice? A systematic review. Eur J Obstet Gynecol Reprod Biol. 2022; 277: 84–9. https://doi.org/10.1016/j.ejogrb.2022.08.012.
7. Доброхотова Ю.Э., Ильина И.Ю., Венедиктова М.Г. и др. Применение эрбиевого лазера в лечении генитоуринарного синдрома у пациенток после радикального лечения рака тела матки. Акушерство и гинекология. 2019; 6: 48–54. https://doi.org/10.18565/aig.2019.6.48-54.
8. Ампилогова Д.М., Солопова А.Г., Блинов Д.В. и др. Вульвовагинальная атрофия: проблемы лечения и реабилитации. Гинекология. 2022; 24 (4): 240–5. https://doi.org/10.26442/20795696.2022.4.201792.
9. Wierzbicka A., Mańkowska-Wierzbicka D., Cieślewicz S., et al. Interventions preventing vaginitis, vaginal atrophy after brachytherapy or radiotherapy due to malignant tumors of the female reproductive organs-a systematic review. Int J Environ Res Public Health. 2021; 18 (8): 3932. https://doi.org/10.3390/ijerph18083932.
10. Nappi R.E., Kotek M., Breštánský A., et al. Treatment of vulvovaginal atrophy with hyaluronate-based gel: a randomized controlled study. Minerva Obstet Gynecol. 2022; 74 (6): 480–8. https://doi.org/10.23736/S2724-606X.21.04841-7.
11. Lester J., Pahouja G., Andersen B., Lustberg M. Atrophic vaginitis in breast cancer survivors: a difficult survivorship issue. J Pers Med. 2015; 5 (2): 50–66. https://doi.org/10.3390/jpm5020050.
12. Loprinzi C.L., Abu-Ghazaleh S., Sloan J.A., et al. Phase III randomized double-blind study to evaluate the efficacy of a polycarbophil-based vaginal moisturizer in women with breast cancer. J Clin Oncol. 1997; 15: 969–73. https://doi.org/10.1200/JCO.1997.15.3.969.
13. Сметник А.А., Родионов В. В., Кометова В.В. Коррекция климактерических расстройств у больных раком молочной железы: актуальные методы и перспективы. Акушерство и гинекология. 2020; 1 (Прил.): 26–33. https://doi.org/10.18565/aig.2020.1suppl.26-33.
14. The North American Menopause Society. The 2012 Hormone therapy position statement of The North American Menopause Society. Menopause. 2012; 19 (3): 257–71. https://doi.org/10.1097/gme.0b013e31824b970a.
15. Holmberg L., Anderson H. HABITS (hormonal replacement therapy after breast cancer – is it safe?), a randomised comparison: trial stopped. Lancet. 2004; 363 (9407): 453–5. https://doi.org/10.1016/S0140-6736(04)15493-7.
16. von Schoultz E., Rutqvist L.E. Menopausal hormone therapy after breast cancer: the Stockholm randomized trial. J Natl Cancer Inst. 2005; 97 (7): 533–5. https://doi.org/10.1093/jnci/dji071.
17. Santen R.J., Song R.X., Masamura S., et al. Adaptation to estradiol deprivation causes up-regulation of growth factor pathways and hypersensitivity to estradiol in breast cancer cells. Adv Exp Med Biol. 2008; 630: 19–34. https://doi.org/10.1007/978-0-387-78818-0_2.
18. ACOG Committee Opinion No. 659: The use of vaginal estrogen in women with a history of estrogen-dependent breast cancer. Obstet Gynecol. 2016; 127 (3): e93–6. https://doi.org/10.1097/AOG.0000000000001351.
19. NAMS Position Statement. The 2023 nonhormone therapy position statement of The North American Menopause Society. Menopause. 2023; 30 (6): 573–90. https://doi.org/10.1097/GME.0000000000002200.
20. Faubion S.S., Larkin L.C., Stuenkel C.A., et al. Management of genitourinary syndrome of menopause in women with or at high risk for breast cancer: consensus recommendations from The North American Menopause Society and The International Society for the Study of Women's Sexual Health. Menopause. 2018; 25 (6): 596–608. https://doi.org/10.1097/GME.0000000000001121.
21. Biglia N., Peano E., Sgandurra P., et al. Low-dose vaginal estrogens or vaginal moisturizer in breast cancer survivors with urogenital atrophy: a preliminary study. Gynecol Endocrinol. 2010; 26 (6): 404–12. https://doi.org/10.3109/09513591003632258.
22. Pfeiler G., Glatz C., Königsberg R., et al. Vaginal estriol to overcome side-effects of aromatase inhibitors in breast cancer patients. Climacteric. 2011; 14 (3): 339–44. https://doi.org/10.3109/13697137.2010.529967.
23. Donders G., Neven P., Moegele M., et al. Ultra-low-dose estriol and Lactobacillus acidophilus vaginal tablets (Gynoflor®) for vaginal atrophy in postmenopausal breast cancer patients on aromatase inhibitors: pharmacokinetic, safety, and efficacy phase I clinical study. Breast Cancer Res Treat. 2014; 145 (2): 371–9. https://doi.org/10.1007/s10549-014-2930-x.
24. Biglia N., Bounous V.E., D'Alonzo M., et al. Vaginal atrophy in breast cancer survivors: attitude and approaches among oncologists. Clin Breast Cancer. 2017; 17 (8): 611–7. https://doi.org/10.1016/j.clbc.2017.05.008.
25. Pup L.D., Sánchez-Borrego R. Ospemifene efficacy and safety data in women with vulvovaginal atrophy. Gynecol Endocrinol. 2020; 36 (7): 569–77. https://doi.org/10.1080/09513590.2020.1757058.
26. Palacios S. Ospemifene for vulvar and vaginal atrophy: an overview. Drugs Context. 2020; 9: 2020-3-2. https://doi.org/10.7573/dic.2020-3-2.
27. Di Donato V., Schiavi M.C., Iacobelli V., et al. Ospemifene for the treatment of vulvar and vaginal atrophy: a meta-analysis of randomized trials. Part II: Evaluation of tolerability and safety. Maturitas. 2019; 121: 93–100. https://doi.org/10.1016/j.maturitas.2018.11.017.
28. Witherby S., Johnson J., Demers L., et al. Topical testosterone for breast cancer patients with vaginal atrophy related to aromatase inhibitors: a phase I/II study. Oncologist. 2011; 16: 424–31. https://doi.org/10.1634/theoncologist.2010-0435.
29. Faubion S.S., Kingsberg S.A., Clark A.L., et al. The 2020 genitourinary syndrome of menopause position statement of the North American Menopause Society. Menopause. 2020; 27 (9): 976–92. https://doi.org/10.1097/GME.0000000000001609.
30. Martel C., Labrie F., Archer D.F., et al. Serum steroid concentrations remain within normal postmenopausal values in women receiving daily 6.5 mg intravaginal prasterone for 12 weeks. J Steroid Biochem Mol Biol. 2016; 159: 142–53. https://doi.org/10.1016/j.jsbmb.2016.03.016.
31. Mension E., Alonso I., Cebrecos I., et al. Safety of prasterone in breast cancer survivors treated with aromatase inhibitors: the VIBRA pilot study. Climacteric. 2022; 25 (5): 476–82. https://doi.org/10.1080/13697137.2022.2050208.
32. Juraskova I., Jarvis S., Mok K., et al. The acceptability, feasibility, and efficacy (phase I/II study) of the OVERcome (Olive Oil, Oaginal Oxercise, and moisturizeR) intervention to improve dyspareunia and alleviate sexual problems in women with breast cancer. J Sex Med. 2013; 10 (10): 2549–58. https://doi.org/10.1111/jsm.12156.
33. Mueck A.O., Ruan X., Prasauskas V., et al. Treatment of vaginal atrophy with estriol and lactobacilli combination: a clinical review. Climacteric. 2018; 21 (2): 140–7. https://doi.org/10.1080/13697137.2017.1421923.
34. Barbés C., Boris S. Potential role of lactobacilli as prophylactic agents against genital pathogens. AIDS Patient Care STDS. 1999; 13 (12): 747–51. https://doi.org/10.1089/apc.1999.13.747.
35. Marschalek J., Farr A., Marschalek M.L., et al. Influence of orally administered probiotic lactobacillus strains on vaginal microbiota in women with breast cancer during chemotherapy: a randomized placebo-controlled double-blinded pilot study. Breast Care. 2017; 12 (5): 335–9. https://doi.org/10.1159/000478994.
36. Prasanchit P., Pongchaikul P., Lertsittichai P., et al. Vaginal microbiomes of breast cancer survivors treated with aromatase inhibitors with and without vulvovaginal symptoms. Sci Rep. 2024; 14 (1): 7417. https://doi.org/10.1038/s41598-024-58118-3.
37. Kamronrithisorn T., Manonai J., Vallibhakara S.A., et al. Effect of Vitamin D supplement on vulvovaginal atrophy of the menopause. Nutrients. 2020; 12 (9): 2876. https://doi.org/10.3390/nu12092876.
38. Youssef E., Badie M.S., Ismail D., et al. The effectiveness of vitamin D as an alternative to FDA-approved treatment and other therapies for managing vulvovaginal atrophy and sexual inactivity in postmenopausal women. A systematic review and meta-analysis. Int J Gynaecol Obstet. 2025; Feb 14. https://doi.org/10.1002/ijgo.70011.
39. Cuccu I., Golia D'Augè T., Firulli I., et al. Update on genitourinary syndrome of menopause: a scoping review of a tailored treatmentbased approach. Life. 2024; 14 (11): 1504. https://doi.org/10.3390/life14111504.
40. Ruppert S.M., Hawn T.R., Arrigoni A., et al. Tissue integrity signals communicated by high-molecular weight hyaluronan and the resolution of inflammation. Immunol Res. 2014; 58 (2-3): 186–92. https://doi.org/10.1007/s12026-014-8495-2.
41. Narutytė R., Žukienė G., Bartkevičienė D. Vulvovaginal atrophy following treatment for oncogynecologic pathologies: etiology, epidemiology, diagnosis, and treatment options. Medicina. 2024; 60 (10): 1584. https://doi.org/10.3390/medicina60101584.
42. Iijima K., Murakami N., Nakamura S., et al. Configuration analysis of the injection position and shape of the gel spacer in gynecologic brachytherapy. Brachytherapy. 2021; 20 (1): 95–103. https://doi.org/10.1016/j.brachy.2020.08.021.
43. Omar S.S., Elmulla K.F., AboKhadr N.A., et al. Comparable efficacy of submucosal platelet-rich plasma and combined platelet-rich plasma noncrosslinked hyaluronic acid injections in vulvovaginal atrophy: a cancer survivorship issue. J Womens Health. 2023; 32 (9): 1006–20. https://doi.org/10.1089/jwh.2023.0144.
44. Hersant B., SidAhmed-Mezi M., Belkacemi Y., et al. Efficacy of injecting platelet concentrate combined with hyaluronic acid for the treatment of vulvovaginal atrophy in postmenopausal women with history of breast cancer: a phase 2 pilot study. Menopause. 2018; 25 (10): 1124–30. https://doi.org/10.1097/GME.0000000000001122.
45. Boero V., Brambilla M., Di Loreto E., et al. Fat grafting in vulvar lichen sclerosus: long term follow-up. J Low Genit Tract Dis. 2023; 27 (4): 365–72. https://doi.org/10.1097/LGT.0000000000000766.
46. Flint R., Cardozo L., Grigoriadis T., et al. Rationale and design for fractional microablative CO2 laser versus photothermal non-ablative erbium: YAG laser for the management of genitourinary syndrome of menopause: a non-inferiority, single-blind randomized controlled trial. Climacteric. 2019; 22 (3): 307–11. https://doi.org/10.1080/13697137.2018.1559806.
47. Salvatore S., Leone Roberti Maggiore U., Athanasiou S., et al. Histological study on the effects of microablative fractional CO2 laser on atrophic vaginal tissue: an ex vivo study. Menopause. 2015; 22 (8): 845–9. https://doi.org/10.1097/GME.0000000000000401.
48. Zerbinati N., Serati M., Origoni M., et al. Microscopic and ultrastructural modifications of postmenopausal atrophic vaginal mucosa after fractional carbon dioxide laser treatment. Lasers Med Sci. 2015; 30 (1): 429–36. https://doi.org/10.1007/s10103-014-1677-2.
49. Salvatore S., Ruffolo A.F., Phillips C., et al. Vaginal laser therapy for GSM/VVA: where we stand now – a review by the EUGA Working Group on Laser. Climacteric. 2023; 26 (4): 336–52. https://doi.org/10.1080/13697137.2023.2225766.
50. Quick A.M., Dockter T., Le-Rademacher J., et al. Pilot study of fractional CO2 laser therapy for genitourinary syndrome of menopause in gynecologic cancer survivors. Maturitas. 2021; 144: 37–44. https://doi.org/10.1016/j.maturitas.2020.10.018
Об авторах
О. С. ГридасоваРоссия
Гридасова Ольга Сергеевна
пер. Яковоапостольский, д. 8А, Москва 105064
А. Г. Солопова
Россия
Солопова Антонина Григорьевна, д.м.н., проф.
WoS ResearcherID: Q-1385-2015. Scopus Author ID: 6505479504
ул. Трубецкая, д. 8/2, Москва 119048
Е. И. Румянцева
Россия
Румянцева Елена Ивановна, доцент
2-я Бауманская ул., д. 5, стр. 1, Москва 105005
А. Е. Иванов
Россия
Иванов Александр Евгеньевич, к.м.н.
Коломенский пр-д, д. 4, Москва 115446
Д. О. Уткин
Россия
Уткин Дмитрий Олегович, к.м.н.
WoS ResearcherID: HSF-1307-2023
Коломенский пр-д, д. 4, Москва 115446
Д. Х. Хизроева
Россия
Хизроева Джамиля Хизриевна, д.м.н., проф.
WoS ResearcherID: F-8384-2017. Scopus Author ID: 57194547147
ул. Трубецкая, д. 8/2, Москва 119048
Что уже известно об этой теме?
► Генитоуринарный синдром менопаузы (ГСМ) – термин, предложенный для обозначения ряда генитальных и мочевых симптомов, которые могут возникать во время и после менопаузы. Симптомы ГСМ могут появиться и раньше из-за противораковой терапии или двусторонней овариэктомии
► Симптомы ГСМ встречаются часто и включают сухость влагалища или вульвовагинальную атрофию (ВВА), дискомфорт и диспареунию, жжение и зуд, а также учащенное и неотложное мочеиспускание
► Лечение первой линии состоит из негормональных методов (лубрикантов/увлажнителей). «Золотым стандартом» считается вагинальная терапия эстрогенами в минимальной эффективной дозе, однако существует ряд опасений по поводу лечения эстрогенами, начиная от неудобства вагинального введения и заканчивая развитием новообразований
Что нового дает статья?
► Несмотря на то что гормональная терапия является «золотым стандартом» лечения ГСМ, в лечении ВВА она обычно неэффективна – отчасти из-за симптоматического действия, в результате которого процесс инволюции возобновляется, как только прекращается введение гормонов
► Селективные модуляторы эстрогеновых рецепторов, такие как лазофоксифен и оспемифен, а также введение в схему лечения лактобактерий, витаминов D и E продемонстрировали положительное влияние на вагинальную ткань у женщин с симптомами ВВА
► Появляются такие перспективные методы лечения, как вагинальный дегидроэпиандростендион, вагинальный тестостерон и тканевые селективные эстрогеновые комплексы. В качестве альтернативных вариантов можно использовать новые терапевтические подходы с использованием лазерной терапии и инъекционных процедур в периуретральную область и стенки влагалища
Как это может повлиять на клиническую практику в обозримом будущем?
► Применение инъекционных материалов (аутологичная богатая тромбоцитами плазма, гиалуроновая кислота (ГК), препараты на основе несшитой ГК и гидроксиапатита кальция, микрофрагментированная жировая ткань, гибридные кооперативные комплексы гиалуронана, сшитая ГК, микрожировая и наножировая трансплантация) является эффективным методом лечения ГСМ
► У женщин с онкологическим анамнезом новые методы лечения (лазерная терапия, вагинальные инъекции) показывают многообещающие результаты с минимальными побочными эффектами и гормононезависимыми механизмами. Лечение должно быть индивидуальным на основе соотношения риска и пользы для каждой пациентки
► В отдельных случаях (при гормононезависимом РМЖ или при гормонозависимых опухолях, после завершения антигормональной адъювантной терапии) можно рассмотреть возможность использования вагинальных эстрогенов, которые следует назначать локально, в минимальной дозе и на ограниченный период времени до улучшения симптомов
Рецензия
Для цитирования:
Гридасова О.С., Солопова А.Г., Румянцева Е.И., Иванов А.Е., Уткин Д.О., Хизроева Д.Х. Современные подходы к лечению вульвовагинальной атрофии у женщин с гинекологическим раком и раком молочных желез. ФАРМАКОЭКОНОМИКА. Современная фармакоэкономика и фармакоэпидемиология. 2025;18(2):284–293. https://doi.org/10.17749/2070-4909/farmakoekonomika.2025.314
For citation:
Gridasova O.S., Solopova A.G., Rumyantseva E.I., Ivanov A.E., Utkin D.О., Khizroeva J.Kh. Current approaches to the treatment of vulvovaginal atrophy in women with gynecological and breast cancer. FARMAKOEKONOMIKA. Modern Pharmacoeconomics and Pharmacoepidemiology. 2025;18(2):284–293. (In Russ.) https://doi.org/10.17749/2070-4909/farmakoekonomika.2025.314

Контент доступен под лицензией Creative Commons Attribution-NonCommercial-ShareAlike 4.0 International License.







































