Перейти к:
Клинико-диагностическое значение изолированного выявления антител класса IgA к деамидированным пептидам глиадина у пациентов с IgA-нефропатией
https://doi.org/10.17749/2070-4909/farmakoekonomika.2025.304
Аннотация
Актуальность. Иммуноглобулин A-нефропатия (IgA-H) представляет собой серьезную медицинскую проблему как одна из наиболее частых причин терминальной почечной недостаточности. Современные исследования все больше внимания уделяют роли лимфоидной ткани, ассоциированной со слизистыми оболочками (англ. mucosa-associated lymphoid tissue, MALT) кишечника в патогенезе IgA-H, особенно в контексте влияния пищевых антигенов, таких как глютен. У пациентов с IgA-Н часто обнаруживаются антитела (АТ) класса IgA к деамидированным пептидам глиадина (ДПГ). Изучение их изолированного носительства может помочь в разработке новых методов диагностики и лечения, направленных на коррекцию кишечного иммунитета и контроль высокоактивного течения и прогрессирования IgA-H.
Цель: установить клинико-диагностическую роль АТ IgA к ДПГ у пациентов с IgA-H для разработки дополнительных персонифицированных клинических подходов и оптимизации лечебных стратегий.
Материал и методы. В проспективном сравнительном когортном контролируемом исследовании приняли участие 105 пациентов с диагнозом IgA-H в возрасте от 18 до 64 лет. Использовались демографические, анамнестические и клинические показатели, сведения о лечении. Сыворотка крови больных исследована на антитела, специфичные для целиакии: АТ IgA к ДПГ, тканевой трасглутаминазе (ТТГ), эндомизию. В результате сформированы две группы пациентов в зависимости от наличия АТ IgA к ДПГ: в основную группу (n=20) вошли больные IgA-H с выявленными АТ, в контрольную (n=85) – серонегативные по целиакийным АТ. Один пациент был серопозитивен по АТ IgA к ДПГ и ТТГ одновременно.
Результаты. У пациентов основной группы активность IgA-Н, оцененная по выраженности утренней протеинурии (0,96 [0,70–1,60]г/л; р=0,005), суточной протеинурии (1,50 [0,70–2,50] г/сут; р=0,014), эритроцитурии (20,00 [15,00–25,00] в поле зрения; р=0,015), уровням систолического (147,65±12,06 мм рт. ст.; р=0,001) и диастолического (94,35±12,78 мм рт. ст.; р=0,006) артериального давления, оказалась выше, чем в группе контроля. Обнаружение АТ IgA к ДПГ ассоциировано с высокой концентрацией сывороточного IgA (4,35±1,06 г/л; р <0,001). Прямая корреляционная связь между АТ IgA к ДПГ и IgA (ρ=0,247; р=0,020) наиболее вероятно объясняется гиперреактивностью IgA-продуцирующих В-лимфоцитов слизистых кишечника в ответ на глютен. У больных основной группы риск снижения расчетной скорости клубочковой фильтрации на 50% или прогрессирования до терминальной почечной недостаточности в течение 5 лет после выполненной нефробиопсии статистически значимо выше, чем у пациентов группы контроля (15,05% [9,32– 20,91] против 7,99% [4,97–11,73]; р=0,015).
Заключение. Полученные результаты указывают на значимость АТ IgA к ДПГ как потенциального маркера риска прогрессирования IgA-H. Дальнейшее изучение влияния пищевых антигенов на иммунный ответ при IgA-Н открывает новые перспективы для разработки эффективных методов лечения.
Ключевые слова
Для цитирования:
Манцаева М.Е., Корабельников Д.И., Борисов А.Г. Клинико-диагностическое значение изолированного выявления антител класса IgA к деамидированным пептидам глиадина у пациентов с IgA-нефропатией. ФАРМАКОЭКОНОМИКА. Современная фармакоэкономика и фармакоэпидемиология. 2025;18(1):62-70. https://doi.org/10.17749/2070-4909/farmakoekonomika.2025.304
For citation:
Mantsaeva M.E., Korabelnikov D.I., Borisov A.G. Clinical and diagnostic significance of isolated detection of IgA antibodies to deamidated gliadin peptides in IgA nephropathy patients. FARMAKOEKONOMIKA. Modern Pharmacoeconomics and Pharmacoepidemiology. 2025;18(1):62-70. (In Russ.) https://doi.org/10.17749/2070-4909/farmakoekonomika.2025.304
ВВЕДЕНИЕ / INTRODUCTION
Иммуноглобулин A-нефропатия (IgA-H) – хроническая гломерулярная болезнь, связанная с воспалительным поражением почечных клубочков, опосредованным отложением иммунных комплексов, содержащих аберрантный секреторный иммуноглобулин А (англ. immunoglobulin A, IgA) и приводящая к развитию необратимых фибропластических изменений органа. IgA-H является одной из ведущих причин терминальной почечной недостаточности (ТПН), требующей проведения дорогостоящей заместительной почечной терапии: диализа и трансплантации почки [1][2]. Связь IgA-H с клинически очевидным или латентным воспалением кишечника указывает на наличие патогенетической энтероренальной оси, способствующей развитию гломерулярной болезни [3].
Исследовательский интерес в контексте этиопатогенеза IgA-H сосредоточен на изменениях иммунной системы лимфоидной ткани, ассоциированной со слизистыми оболочками (англ. mucosa-associated lymphoid tissue, MALT) кишечника, под воздействием пищевых антигенов, таких как глютен [4–6]. Помимо морфологически подтвержденной целиакии [7][8] у пациентов с IgA-Н отмечается высокая распространенность бессимптомного носительства антиглиадиновых антител в сыворотке крови [9][10]. Согласно другим литературным данным активность IgA-H снижается при исключении глютена из рациона [11][12].
Изучение клинико-диагностического значения изолированного носительства антител класса IgA к деамидированным пептидам глиадина (АТ IgA к ДПГ) у пациентов с IgA-H является актуальным направлением внутренней медицины. Полученные при исследовании результаты могут указать на необходимость и возможность разработки дополнительных диагностических и персонализированных терапевтических подходов, направленных на коррекцию активности MALT-системы кишечника и контроль высокоактивного течения IgA-H в российской популяции.
Цель – установить клинико-диагностическое значение АТ IgA к ДПГ у пациентов с IgA-H для разработки дополнительных персонифицированных клинических подходов и оптимизации лечебных стратегий.
МАТЕРИАЛ И МЕТОДЫ / MATERIAL AND METHODS
Проспективное сравнительное когортное контролируемое исследование выполнено на базе нефрологического отделения ФГБУ «Главный военный клинический госпиталь им. академика Н.Н. Бурденко» Минобороны России (ГВКГ им. академика Н.Н. Бурденко). Диагноз IgA-H был установлен на основании морфологического исследования столбиков почечной ткани с проведением световой микроскопии и иммунофлюоресцентного исследования. На момент включения пациентов в исследование регистрировали следующие показатели: пол, возраст, возраст дебюта болезни и на момент нефробиопсии, длительность заболевания от первых симптомов до морфологической верификации IgA-H. Анамнестические данные включали регистрацию клинически значимых хронических воспалительных заболеваний различной локализации (верхних и нижних дыхательных путей, желудочно-кишечного тракта и мочевыводящих путей), провоцирующих факторов дебюта или обострения болезни, ведущего синдрома в дебюте заболевания, эпизодов макрогематурии, текущей и ранее проводимой фармакотерапии.
Лабораторная диагностика / Laboratory diagnostics
Лабораторно оценены клинические показатели мочи (выраженность протеинурии (ПУ) и эритроцитурии (микроскопия осадка мочи), суточной протеинурии (СПУ)), стандартный биохимический анализ крови с расчетом скорости клубочковой фильтрации (СКФ) по формуле CKD-EPI (англ. Chronic Kidney Disease Epidemiology Collaboration), иммунологический анализ крови с определением IgA, IgM, IgG и компонентов системы комплемента С3- и С4-фракций.
Рутинные лабораторные исследования выполнены с использованием сертифицированного оборудования в лабораториях центра клинической лабораторной диагностики ГВКГ им. академика Н.Н. Бурденко. Антитела IgA к тканевой трансглютаминазе (АТ IgA к ТТГ) и АТ IgA к ДПГ определены в венозной крови иммуноферментным методом с применением набора реагентов Euroimmun и Orgentec (Германия). АТ IgA к эндомизию исследованы методом непрямой иммунофлюоресценции с применением набора реагентов Euroimmun (Германия) в лабораториях «Инвитро» (Россия).
Группы сравнения / Comparison groups
В исследовании приняли участие 105 пациентов с морфологически подтвержденной IgA-H в возрасте от 18 до 64 лет.
Cформированы две группы: в основную группу (n=20) вошли больные IgA-H с выявленными АТ IgA к ДПГ, в контрольную (n=85) – пациенты с IgA-H, серонегативные по АТ IgA к ДПГ, ТТГ и эндомизию.
Инструментальные методы / Instrumental methods
Всем пациентам выполнено ультразвуковое исследование почек на аппарате Siemens Acuson S2000 (Siemens, США) для оценки их размеров, исключения аномалий развития и нефролитиаза. Артериальное давление (АД) измерено стандартным методом с регистрацией систолического (сАД) и диастолического (дАД) показателей.
У 12 пациентов основной группы проведена фиброгастродуоденоскопия с использованием эндофиброскопа Fujinon ED-250XT5 (Fujinon, Япония) с биопсией из залуковичного отдела двенадцатиперстной кишки и последующим морфологическим исследованием слизистой оболочки тонкого кишечника (СОТК). На основании характерного типа повреждения СОТК устанавливали стадию по классификации Marsh–Oberhuber [13].
Расчет риска прогрессирования IgA-H / IgAN progression risk calculation
В калькуляторе расчета риска прогрессирования IgA-Н у взрослых (англ. International IgAN Prediction Tool at biopsy – Adults) [14][15] использовались переменные на момент проведения нефробиопсии: расчетная СКФ (рСКФ) (мл/мин/1,73 м²), сАД и дАД (мм рт. ст.), ПУ (г/сут), возраст (лет), этническая принадлежность, терапия ингибиторами ангиотензинпревращающего фермента (иАПФ) и блокаторами рецепторов ангиотензина II (БРА), иммуносупрессия, данные морфологии: мезангиальная пролиферация (M) 0–1, эндокапиллярная пролиферация (E) 0–1, сегментарный склероз (S) 0–1, интерстициальный фиброз / атрофия канальцев (T) 0–1–2.
Статистический анализ / Statistical analysis
Статистический анализ полученных данных проведен с использованием программы StatTech v. 4.8.0 (ООО «Статтех», Россия). Количественные показатели оценивали на предмет соответствия нормальному распределению с помощью критерия Колмогорова–Смирнова. Рассчитывали медиану (Me) с межквартильным размахом [ Q1–Q3], среднее со стандартным отклонением (M±SD) и 95% доверительным интервалом (ДИ). Для выявления межгрупповых различий применяли U-критерий Манна–Уитни, t-критерий Стьюдента. Категориальные данные описывали с указанием абсолютных значений и процентных долей. Направление и тесноту корреляционной связи между двумя количественными показателями определяли с помощью коэффициента ранговой корреляции Спирмена. Различия считали статистически значимыми при p<0,05.
РЕЗУЛЬТАТЫ / RESULTS
Клинико-анамнестические данные / Clinical and anamnestic data
В группах исследования было 92 (87,6%) пациента мужского пола и 13 (12,4%) женского. Средний возраст в общей группе составил 34,0 [ 29,0–42,0] года. Средний возраст мужчин – 34,0 [ 28,0–42,0] года, средний возраст женщин – 42,0 [ 33,5–45,0] года. Средний возраст дебюта IgA-H в общей группе – 30,3±8,03 года (мужчин – 29,95±8,13 года, женщин – 32,82±7,14 года). Средний возраст на момент нефробиопсии в общей группе – 33,0 [ 26,0–39,0] года (мужчин – 33,0 [ 26,0–38,8] года, женщин – 41,0 [ 32,5–44,0] года).
Из 105 участников исследования 47 (44,8%) больных находились в стационарном лечебном учреждении в связи с персистенцией клинических симптомов IgA-H, 58 (55,2%) – для морфологической верификации впервые выявленной IgA-H. Длительность заболевания от первых клинических симптомов до морфологической верификации IgA-H в общей группе составила 35,09±40,70 мес (у мужчин – 33,24±39,69 мес, у женщин – 48,18±47,28 мес). Все показатели с учетом гендерных характеристик представлены в таблице 1.
Таблица 1. Гендерные и возрастные характеристики больных с иммуноглобулин A-нефропатией (IgA-H)
Table 1. Gender and age characteristics of patients with immunoglobulin A nephropathy (IgAN)
|
Параметр / Parameter |
Мужчины / Males |
Женщины / Females |
Общая группа / Total group |
|
Число больных, n (%) / Number of patients, n (%) |
92 (87,6) |
13 (12,4) |
105 (100) |
|
Возраст, лет / Age, years |
34,0 [ 28,0–42,0] |
42,0 [ 33,5–45,0] |
34,0 [ 29,0–42,0] |
|
Возраст дебюта заболевания, лет / Age of disease onset, years |
29,95±8,13 |
32,82±7,14 |
30,30±8,03 |
|
Возраст на момент нефробиопсии, лет / Age at the time of renal biopsy, years |
33,0 [ 26,0–38,8] |
41,0 [ 32,5–44,0] |
33,0 [ 26,0–39,0] |
|
Длительность заболевания до проведения нефробиопсии, мес / Disease duration prior to renal biopsy, months |
33,24±39,69 |
48,18±47,28 |
35,09±40,70 |
|
Новые случаи IgA-Н, n (%) / New cases of IgAN, n (%) |
53 (91,4) |
5 (8,6) |
58 (55,2) |
Диагноз хронического гломерулонефрита (морфологически не верифицированного) в 42,9% случаев был установлен на основании результатов клинико-лабораторной и инструментальной диагностики в период прохождения углубленного медицинского обследования. Предположение о наличии хронического гломерулонефрита у врачей возникало в период госпитализаций по поводу респираторных инфекций, дебюта артериальной гипертензии и других заболеваний у 17,1%, 11,4% и 28,6% пациентов соответственно. Все указанные случаи потребовали дообследования в специализированном нефрологическом отделении стационарной медицинской организации. Нефропротективную терапию блокаторами ренин-ангиотензин-альдостероновой системы в терапевтических дозах согласно положениям действующих клинических рекомендаций [1][2] получали 94 (89,5%) пациента. Из них 80 (76,2%) больным терапия проводилась в течение более 3 мес, 25 (26,5%) пациентам лечение иАПФ/БРА инициировано в качестве монотерапии или в составе комбинированной гипотензивной терапии до морфологической верификации IgA-H в связи с дебютом артериальной гипертензии. После морфологической верификации IgА-H терапия глюкокортикостероидами была назначена 13 (12,4%) больным в связи с высоким риском прогрессирования.
На этапе клинического обследования у пациентов с IgA-H выделены неспецифические жалобы: дискомфорт в поясничной области (42,7%), головная боль при повышении АД (31,5%), отеки различной локализации (27,0%), изменение цвета мочи по типу «синфарингитной» гематурии (25,8%), общая слабость (18,0%). Среди провоцирующих факторов дебюта или обострения IgA-H выделены следующие: острая респираторно-вирусная инфекция (31,4%), острый тонзиллит (14,3%), вакцинация (3,8%), пневмония (4,8%), герпесвирусная инфекция (0,9%) (табл. 2).
Таблица 2. Структура провоцирующих факторов дебюта или обострения иммуноглобулин A-нефропатии
Table 2. Factors provoking the onset or exacerbation of immunoglobulin A nephropathy
|
Провоцирующий фактор / Provoking factor |
Число пациентов, n (%) / Number of patients, n (%) |
|
ОРВИ / ARVI |
33 (31,4) |
|
Острый тонзиллит / Acute tonsillitis |
15 (14,3) |
|
Вакцинация / Vaccination |
4 (3,8) |
|
Пневмония / Pneumonia |
5 (4,8) |
|
Герпесвирусная инфекция / Herpes virus infection |
1 (0,9) |
Примечание. ОРВИ – острая респираторно-вирусная инфекция.
Note. ARVI – acute respiratory viral infection.
Результаты анализа сопутствующей патологии (хронические воспалительные заболевания слизистых оболочек различной локализации) отражены в таблице 3.
Таблица 3. Структура сопутствующих хронических воспалительных заболеваний у пациентов с иммуноглобулин A-нефропатией
Table 3. Concomitant chronic inflammatory diseases in patients with immunoglobulin A nephropathy
|
Сопутствующие хронические воспалительные заболевания / Concomitant chronic inflammatory diseases |
Число пациентов, n (%) / Number of patients, n (%) |
|
Хронический тонзиллит / Chronic tonsillitis |
18 (17,1) |
|
Заболевания верхних дыхательных путей (гайморит, синусит, поллиноз) / Upper respiratory diseases (maxillary sinusitis, sinusitis, pollinosis) |
10 (9,5) |
|
Заболевания желудочно-кишечного тракта (гастрит, язвенная болезнь желудка/ДПК) // Gastrointestinal diseases (gastritis, gastric/duodenal ulcer) |
9 (8,6) |
|
Заболевания мочевыводящих путей (цистит, пиелонефрит, простатит) / Urinary tract diseases (cystitis, pyelonephritis, prostatitis) |
7 (6,7) |
|
Заболевания нижних дыхательных путей (бронхит, бронхиальная астма, ХОБЛ) / Lower respiratory diseases (bronchitis, bronchial asthma, COPD) |
4 (3,8) |
Примечание. ДПК – двенадцатиперстная кишка; ХОБЛ – хроническая обструктивная болезнь легких.
Note. COPD – chronic obstructive pulmonary disease.
Частота встречаемости бессимптомного варианта клинического течения IgA-H превалировала над классическим с повторными эпизодами макрогематурии: 71,9% и 28,1% соответственно. Дебют IgA-H наиболее часто (в 60,7% случаев) характеризовался нефритическим синдромом.
Данные серологического скрининга / Serological screening data
По результатам серологического скрининга, направленного на определение специфичных антител (АТ IgA к ДПГ, ТТГ и эндомизию) у пациентов с IgA-H, распространенность АТ IgA к ДПГ составила 19%, у 1 пациента отмечалась двойная серопозитивность – АТ IgA к ДПГ и ТТГ одновременно. Ни в одном случае не было отмечено повышения АТ IgA к эндомизию. Результаты cравнительного анализа лабораторных показателей в группах приведены в таблице 4.
Таблица 4. Лабораторная характеристика обследованных пациентов
Table 4. Laboratory characteristics of the examined patients
|
Параметр / Parameter |
Основная группа / Main group |
Контрольная группа / Control group |
р |
|
Стандартный биохимический анализ крови / Blood biochemistry test |
|||
|
Гемоглобин, г/л // Hemoglobin, g/l |
147,06±15,64 (139,02–155,1) |
145,1±14,83 (141,61–148,58) |
0,628 |
|
Общий белок, г/л // Total protein, g/l |
69,75±5,02 (67,17–72,34) |
68,56±6,39 (67,06–70,06) |
0,475 |
|
Альбумин, г/л // Albumin, g/l |
43,51±3,88 (41,51–45,50) |
42,99±3,82 (42,08–43,89) |
0,616 |
|
Холестерин, ммоль/л // Cholesterol, mmol/l |
4,62±0,86 (4,18–5,06) |
4,82±1,12 (4,56–5,09) |
0,490 |
|
Креатинин, мкмоль/л // Creatinine, μmol/l |
102 [ 87–132] |
97,50 [ 82,50–131,00] |
0,514 |
|
Мочевина, ммоль/л // Urea, mmol/l |
5,60 [ 5,20–7,30] |
5,60 [ 4,60–6,95] |
0,271 |
|
Мочевая кислота, мг/дл // Uric acid, mg/dl |
6,23±1,08 (5,67–6,79) |
6,18±1,49 (5,83–6,52) |
0,887 |
|
Калий, ммоль/л // Potassium, mmol/l |
4,25 [ 4,10–4,40] |
4,27 [ 4,09–4,50] |
0,874 |
|
СКФ, мл/мин/1,73 м² // GFR, ml/min/1.73 m² |
75,47±27,50 (61,33–89,61) |
79,93±24,57 (74,15–85,70) |
0,513 |
|
Иммунологические показатели крови / Immunological parameters |
|||
|
IgА, г/л // IgА, g/l |
4,35±1,06 (3,80–4,90) |
3,37±1,01 (3,13–3,61) |
<0,001* |
|
IgM, г/л // IgM, g/l |
1,04 [ 0,89–1,56] |
1,06 [ 0,60–1,55] |
0,666 |
|
IgG, г/л // IgG, g/l |
10,79±2,61 (9,40–12,19) |
10,62±3,02 (9,84–11,40) |
0,833 |
|
C3, г/л // C3, g/l |
1,20 [ 1,17–1,30] |
1,12 [ 1,03–1,27] |
0,138 |
|
C4, г/л // C4, g/l |
0,21 [ 0,19–0,30] |
0,26 [ 0,20–0,30] |
0,300 |
Примечание. СКФ – скорость клубочковой фильтрации; IgА (англ. immunoglobulin A) – иммуноглобулин А; IgM (англ. immunoglobulin M) – иммуноглобулин M; IgG (англ. immunoglobulin G) – иммуноглобулин G; С3, С4 – компоненты системы комплемента С3- и С4-фракций. * Выделено статистически значимое различие показателей (p<0,05).
Note. GFR – glomerular filtration rate; IgА – immunoglobulin A; IgM – immunoglobulin M; IgG – immunoglobulin G; C3, C4 – complement components C3 and C4. * Statistically significant difference between the parameters is highlighted (p<0.05).
Среди иммунологических маркеров отмечена статистически значимая разница (р<0,001) между концентрациями сывороточного IgA в основной и контрольной группах.
Корреляция между АТ IgA к ДПГ и IgA / Correlation between anti-DGP IgA and IgA
Корреляционный анализ взаимосвязи АТ IgA к ДПГ и сывороточного IgA показал, что корреляционная связь является статистически значимой, прямой, слабой тесноты по шкале Чеддока (ρ=0,247; р=0,020). Наблюдаемую зависимость можно описать уравнением парной линейной регрессии:
YАТ IgA к ДПГ = 4,663 × XIgA – 4,77.
При увеличении IgA на 1 г/л следует ожидать увеличения АТ IgA к ДПГ на 4,663 отн. ед/мл. Полученная модель объясняет 8,1% наблюдаемой дисперсии АТ IgA к ДПГ (рис. 1).
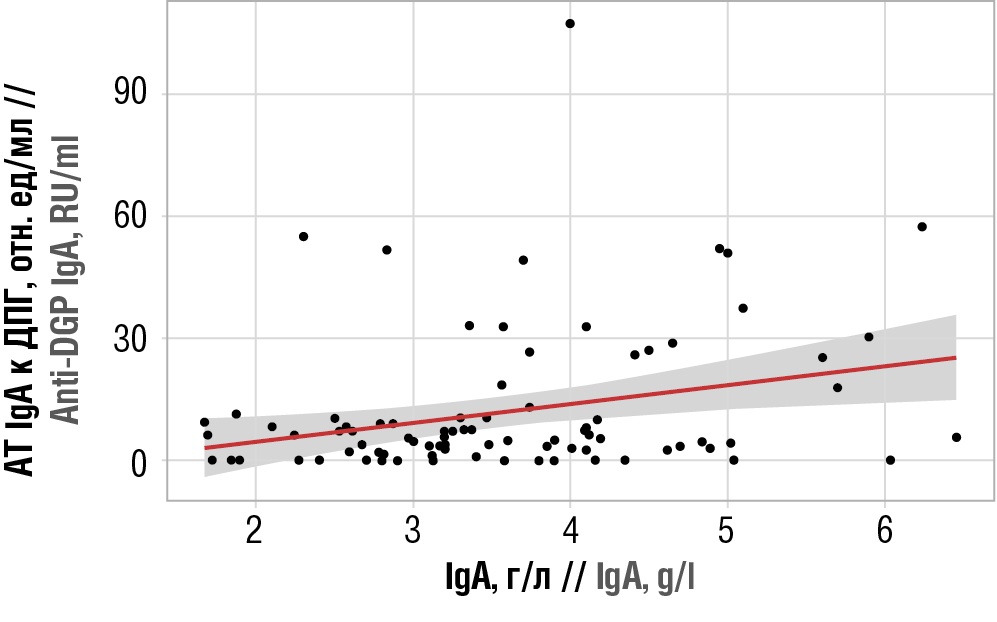
Рисунок 1. График регрессионной функции, характеризующий зависимость антител (АТ) иммуноглобулинов класса A (англ. immunoglobulin A, IgA) к деамидированным пептидам глиадина (ДПГ) от сывороточного IgA
Figure 1. Regression graph showing the dependence of immunoglobulin A (IgA) antibodies to deamidated gliadin peptides (anti-DGP IgA) on serum IgA
Оценка показателей мочи / Evaluation of urine parameters
Выявлены статистически значимые различия полученных результатов СПУ, ПУ и микрогематурии в основной и контрольной группах (табл. 5). У больных основной группы уровень ПУ был значительно выше, чем у пациентов контрольной группы, как в утренней, так и в суточной моче. В основной группе значение ПУ составило 0,96 [ 0,70–1,60] г/л, тогда как в контрольной группе этот показатель был ниже – 0,50 [ 0,30–0,92] г/л. Аналогичная тенденция наблюдалась и для СПУ: в основной группе ее уровень составил 1,50 [ 0,70–2,50] г/сут, а в группе контроля – 0,7 [ 0,45–1,15] г/сут. Выраженность микрогематурии была выше у пациентов основной группы по сравнению с контрольной группой: 20,00 [ 15,00–25,00] и 10,00 [ 7,00–20,00] в поле зрения соответственно.
Таблица 5. Данные сравнительного анализа показателей мочи
Table 5. Comparative analysis of urine parameters
|
Параметр / Parameter |
Основная группа / Main group |
Контрольная группа / Control group |
р |
|
Белок в моче, г/сут // Urine protein, g/day |
1,50 [ 0,70–2,50] |
0,70 [ 0,45–1,15] |
0,014* |
|
Белок в моче, г/л // Urine protein, g/l |
0,96 [ 0,70–1,60] |
0,50 [ 0,30–0,92] |
0,005* |
|
Эритроциты, в поле зрения / Red blood cells, per high power field |
20,00 [ 15,00–25,00] |
10,00 [ 7,00–20,00] |
0,015* |
Примечание. * Выделены статистически значимые различия показателей (p<0,05).
Note. * Statistically significant differences between the parameters are highlighted (p<0.05).
Исследование артериального давления / Blood pressure study
Уровни cАД и дАД были статистически значимо выше у пациентов основной группы по сравнению с контрольной: 147,65±12,06 (141,45–153,85) против 134,96±16,65 (131,05–138,87) мм рт. ст. и 94,35±12,78 (87,78–100,92) против 85,79±10,86 (83,24–88,34) мм рт. ст. соответственно (табл. 6).
Таблица 6. Сравнительная характеристика показателей артериального давления в группах, мм рт. ст.
Table 6. Comparative analysis of blood pressure readings in the groups, mm Hg
|
Параметр / Parameter |
Основная группа / Main group |
Контрольная группа / Control group |
р |
|
сАД / sBP |
147,65±12,06 (141,45–153,85) |
134,96±16,65 (131,05–138,87) |
0,001* |
|
дАД / dBP |
94,35±12,78 (87,78–100,92) |
85,79±10,86 (83,24–88,34) |
0,006* |
Примечание. сАД – систолическое артериальное давление; дАД – диастолическое артериальное давление. * Выделены статистически значимые различия показателей (p<0,05).
Note. sBP – systolic blood pressure; dBP – diastolic blood pressure. * Statistically significant differences between the parameters are highlighted (p<0.05).
Анализ риска прогрессирования IgA-H / IgAN progression risk аnalysis
На основании полученных данных проведен сравнительный анализ риска прогрессирования IgA-H в обеих группах (рис. 2). Риск снижения рСКФ на 50% или прогрессирования до ТПН в течение 5 лет после выполненной нефробиопсии у больных основной группы был статистически значимо выше, чем у пациентов контрольной группы: 15,05% [ 9,32–20,91] против 7,99% [ 4,97–11,73] (р=0,015).
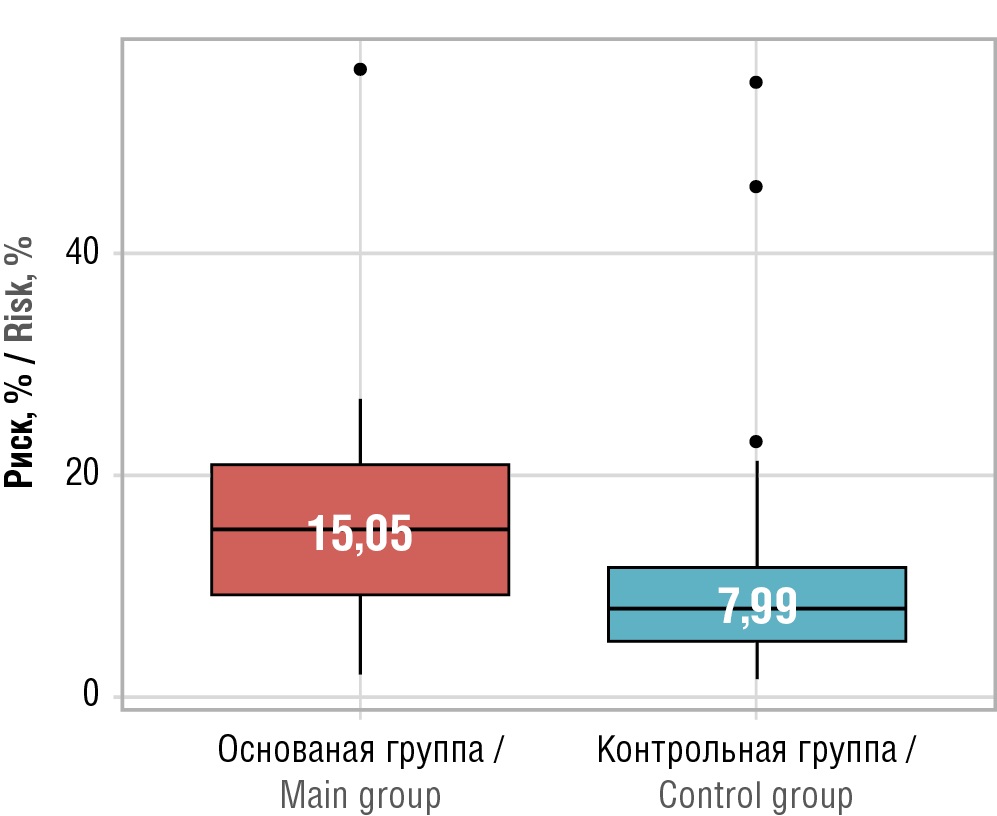
Рисунок 2. Сравнительная характеристика риска прогрессирования иммуноглобулин A-нефропатии в группах исследования
Figure 2. Comparative risk analysis of immunoglobulin A nephropathy progression in the study groups
Результаты фиброгастродуоденоскопии / Results of fibrogastroduodenoscopy
Нарушений архитектоники СОТК (уплощение или исчезновение циркулярных складок слизистой двенадцатиперстной кишки, появление поперечной исчерченности складок, ячеистого рисунка или микронодулярной структуры слизистой) обнаружено не было. Согласно гистологической классификации Marsh–Oberhuber морфологическая картина соответствовала показателю 0–1.
ОБСУЖДЕНИЕ / DISCUSSION
Несмотря на многочисленные успехи в изучении IgA-H, до сих пор не определен патогенетический механизм, полностью объясняющий развитие гломерулярной болезни. Так, обнаружение депозитов IgA в биоптатах почек свидетельствует об иммунокомплексной природе заболевания, однако существенное несоответствие между клинической картиной, концентрацией сывороточного IgA и степенью отложения IgA в мезангии повышает вероятность взаимодействия нескольких факторов восприимчивости организма, способных приводить к повреждению почечных клубочков [16].
Связь IgA-H с инфекционно-воспалительным процессом на слизистых стала основой для актуальной концепции патогенеза, согласно которой развитие гломерулярного заболевания непосредственно связано с активацией MALT-системы, в т.ч. кишечника [17][18]. В соответствии с этой концепцией плазматические клетки, находящиеся в СОТК, служат источником галактозодефицитного IgA1 (англ. galactose deficient IgA1, Gd-IgA1), который можно обнаружить в составе циркулирующих иммунных комплексов и в мезангиальных депозитах почечных клубочков [18][19]. R. Coppo et al. [20] впервые описали роль MALT-системы кишечника в патогенезе IgA-H. Авторы считают, что повреждение кишечного барьера и увеличение всасывания пищевых антигенов нарушают иммунологическую толерантность. Это, в свою очередь, приводит к усилению иммунного ответа, развитию субклинического воспаления в кишечнике и повышенному синтезу Gd-IgA1, который откладывается в мезангии почечных клубочков в составе иммунных комплексов [20]. Ранее S. Emansipator et al. изучили влияние пищевых антигенов на мышиной модели IgA-Н и установили, что отложение IgA в мезангии почечных клубочков может быть спровоцировано добавлением в рацион экзогенных антигенов, включая яичный альбумин, ферритин из селезенки лошади и бычий гамма-глобулин [4].
В контексте указанных теорий особое значение придается целиакии, где глютен, основной этиологический фактор болезни, оказывает свое патологическое воздействие на СОТК [21]. Так, исследования прошлых лет демонстрируют повышенную распространенность антиглиадиновых АТ в сыворотке крови у пациентов с IgA-H без клинических и морфологических проявлений целиакии, указывая на возможный вклад пищевых антигенов в патогенез IgA-H [9][10][22][23]. Согласно нашим данным распространенность носительства антиглиадиновых АТ среди пациентов с IgA-H составляет 19%. Установлено, что в преобладающем большинстве случаев серопозитивность определяется на основании АТ IgA к ДПГ (почти 100%). У пациентов с антиглиадиновыми АТ наблюдаются выраженные ПУ, эритроцитурия в сочетании с высокими значениями АД и концентрации сывороточного IgA. Наши данные согласуются с результатами ранее проведенных исследований, где авторы также подчеркнули высокую активность IgA-H по степени выраженности ПУ и уровню сАД [10].
Нами отмечено, что выявление АТ IgA к ДПГ ассоциировано с высокой концентрацией сывороточного IgA. В ходе исследования выявлена прямая корреляционная связь между уровнями IgA и АТ IgA к ДПГ (ρ=0,232; р=0,035). J. Laurent et al. наблюдали схожую корреляционную связь и объясняли это явление гиперреактивностью IgA-продуцирующих В-лимфоцитов СОТК в ответ на глютен [22]. Однако в своем исследовании авторы использовали АТ класса IgA к глиадину, чувствительность и специфичность которых варьируется в зависимости от производителя в широких пределах (65–100% и 71–97% соответственно), что делает их менее надежным методом диагностики [20]. В то же время АТ IgA к ДПГ демонстрируют более высокие показатели чувствительности (92%) и специфичности (90%) [24][25]. Кроме того, АТ IgA к глиадину могут быть обнаружены у здоровых лиц и пациентов с различными патологиями желудочно-кишечного тракта, такими как эзофагит, воспалительные заболевания кишечника, непереносимость лактозы и др. Это снижает их диагностическую ценность и подчеркивает важность использования более специфичных маркеров, таких как АТ IgA к ДПГ [25].
Мы предполагаем, что усиленный иммунный ответ на глютен может запускать гиперпродукцию Gd-IgA1, который либо инициирует IgA-H, либо отягощает уже имеющееся гломерулярное заболевание. Данное положение требует дальнейших исследований. Нами впервые установлено, что больные IgA-H c бессимптомным носительством АТ IgA к ДПГ имеют высокий риск прогрессирования в течение 5 лет (снижение рСКФ на 50% или прогрессирование до ТПН) после выполненной нефробиопсии.
Ограничения исследования/ Limitations of the study
Проведение исследования на базе одного центра и относительно небольшой размер выборки могут ограничивать воспроизводимость результатов в других условиях и возможности их экстраполяции на более крупные когорты. Для подтверждения прогностической ценности определения АТ IgA к ДПГ у пациентов c IgA-Н требуются дальнейшие проспективные исследования.
ЗАКЛЮЧЕНИЕ / CONCLUSION
Несмотря на достижения в изучении патогенеза IgA-Н, единый механизм, объясняющий возникновение заболевания, по-прежнему остается неясным. Выявленные связи между пищевыми антигенами, особенно глютена, и активностью IgA-H, подчеркивают необходимость проведения дополнительных исследований для более детального и точного понимания их влияния на развитие гломерулярной болезни. Наши данные указывают на значимость АТ IgA к ДПГ как потенциального маркера риска прогрессирования заболевания. Дальнейшая интеграция данных о пищевых антигенах и их влиянии на иммунный ответ в рамках IgA-H открывает перспективы в лечении, способствуя улучшению долгосрочного прогноза у больных IgA-H.
Список литературы
1. Гломерулярные болезни: иммуноглобулин А-нефропатия. Клинические рекомендации. 2024. URL: https://cr.minzdrav.gov.ru/preview-cr/894_1 (дата обращения 22.12.2024).
2. Бобкова И.Н., Буланов Н.М., Захарова Е.В. и др. Клинические практические рекомендации KDIGO 2021 по лечению гломерулярных болезней. Нефрология и диализ. 2022; 24 (4): 577–874. https://doi.org/10.28996/2618-9801-2022-4-577-874.
3. Coppo R. The gut-renal connection in IgA nephropathy. Semin Nephrol. 2018; 38 (5): 504–12. https://doi.org/10.1016/j.semnephrol.2018.05.020.
4. Emancipator S.N., Gallo G.R., Lamm M.E. Experimental IgA nephropathy induced by oral immunization. J Exp Med. 1983; 157 (2): 572–82. https://doi.org/10.1084/jem.157.2.572.
5. Coppo R. The intestine-renal connection in IgA nephropathy. Nephrol Dial Transplant. 2015; 30 (3): 360–6. https://doi.org/10.1093/ndt/gfu343.
6. Cheung C.K., Barratt J. Gluten and IgA nephropathy: you are what you eat? Kidney Int. 2015; 88 (2): 215–8. https://doi.org/10.1038/ki.2015.149.
7. Costa S., Currò G., Pellegrino S., et al. Case report on pathogenetic link between gluten and IgA nephropathy. BMC Gastroenterol. 2018; 18 (1): 64. https://doi.org/10.1186/s12876-018-0792-0.
8. Habura I., Fiedorowicz K., Woźniak A., et al. IgA nephropathy associated with coeliac disease. Cent Eur J Immunol. 2019; 44 (1): 106–8. https://doi.org/10.5114/ceji.2019.84021.
9. Nagy J., Scott H., Brandtzaeg P. Antibodies to dietary antigens in IgA nephropathy. Clin Nephrol. 1988; 29 (6): 275–9.
10. Ots M., Uibo O., Metsküla K., et al. IgA-antigliadin antibodies in patients with IgA nephropathy: the secondary phenomenon? Am J Nephrol. 1999; 19 (4): 453–8. https://doi.org/10.1159/000013497.
11. Papista C., Lechner S., Ben Mkaddem S., et al. Gluten exacerbates IgA nephropathy in humanized mice through gliadin-CD89 interaction. Kidney Int. 2015; 88 (2): 276–85. https://doi.org/10.1038/ki.2015.94.
12. Coppo R., Roccatello D., Amore A., et al. Effects of a gluten-free diet in primary IgA nephropathy. Clin Nephrol. 1990; 33 (2): 72–86.
13. Oberhuber G., Granditsch G., Vogelsang H. The histopathology of coeliac disease: time for a standardized report scheme for pathologists. Eur J Gastroenterol Hepatol. 1999; 11 (10): 1185–94. https://doi.org/10.1097/00042737-199910000-00019.
14. Barbour S.J., Coppo R., Zhang H., et al. Evaluating a new international risk-prediction tool in IgA nephropathy. JAMA Intern Med. 2019; 179 (7): 942–52. https://doi.org/10.1001/jamainternmed.2019.0600.
15. International IgAN Prediction Tool at Biopsy – Adults. Available at: https://qxmd.com/calculate/calculator_499/international-iganprediction-tooladults (дата обращения 22.12.2024).
16. Комиссаров К.С., Юркевич М.Ю., Зафранская М.М., Пилотович В.С. Современные представления о патогенезе иммуноглобулин А-нефропатии. Нефрология. 2014; 18 (2): 47–54.
17. Гуляев С.В., Стрижаков Л.А., Чеботарева Н.В., Моисеев С.В. Роль MALT-системы кишечника в патогенезе IgA-нефропатии. Терапевтический архив. 2021; 93 (6): 724–8. https://doi.org/10.26442/00403660.2021.06.200868.
18. Gesualdo L., Di Leo V., Coppo R. The mucosal immune system and IgA nephropathy. Semin Immunopathol. 2021; 43 (5): 657–68. https://doi.org/10.1007/s00281-021-00871-y.
19. Novak J., Julian B.A., Tomana M., Mestecky J. IgA glycosylation and IgA immune complexes in the pathogenesis of IgA nephropathy. Semin Nephrol. 2008; 28 (1): 78–87. https://doi.org/10.1016/j.semnephrol.2007.10.009.
20. Coppo R., Mazzucco G., Martina G., et al. Gluten-induced experimental IgA glomerulopathy. Lab Invest. 1989; 60 (4): 499–506.
21. Al-Toma A., Volta U., Auricchio R., et al. European Society for the Study of Coeliac Disease (ESsCD) guideline for coeliac disease and other gluten-related disorders. United European Gastroenterol J. 2019; 7 (5): 583–613. https://doi.org/10.1177/2050640619844125.
22. Laurent J., Branellec A., Heslan J.M., et al. An increase in circulating iga antibodies to gliadin in iga mesangial glomerulonephritis. Am J Nephrol. 1987; 7 (3): 178–83. https://doi.org/0.1159/000167460.
23. Pierucci A., Fofi C., Bartoli B., et al. Antiendomysial antibodies in Berger’s disease. Am J Kidney Dis. 2002; 39 (6): 1176–82. https://doi.org/10.1053/ajkd.2002.33387.
24. Ankelo M., Kleimola V., Simell S. Antibody responses to deamidated gliadin peptide show high specificity and parallel antibodies to tissue transglutaminase in developing coeliac disease. Clin Exp Immunol. 2007; 150 (2): 285–93. https://doi.org/10.1111/j.1365-2249.2007.03487.x.
25. Hill I.D., Dirks M.H., Liptak G.S., et al. Guideline for the diagnosis and treatment of celiac disease in children: recommendations of the North American Society for Pediatric Gastroenterology, Hepatology and Nutrition. J Pediatr Gastroenterol Nutr. 2005; 40 (1): 1–19. https://doi.org/10.1097/00005176-200501000-00001.
Об авторах
М. Е. МанцаеваРоссия
Манцаева Мария Евгеньевна
2-я Брестская ул., д. 5, Москва 123056;
ул. Намёткина, д. 16, корп. 4, Москва 117420;
ул. Народного ополчения, д. 35, Москва 123060
Д. И. Корабельников
Россия
Корабельников Даниил Иванович, к.м.н., доцент
Scopus Author ID: 7801382184
2-я Брестская ул., д. 5, Москва 123056
А. Г. Борисов
Россия
Борисов Алексей Геннадьевич, к.м.н., доцент
2-я Брестская ул., д. 5, Москва 123056;
ул. Баррикадная, д. 2/1, стр. 1, Москва 125993;
ул. Раменки, д. 29, Москва 119607
Что уже известно об этой теме?
► Иммуноглобулин A-нефропатия (IgA-H) – хроническая гломерулярная болезнь, одна из ведущих причин терминальной почечной недостаточности, что требует проведения дорогостоящей заместительной почечной терапии
► Одним из аспектов исследования IgA-H является изучение этиопатогенеза через призму энтероренальной оси с акцентом на участие MALT-системы кишечника под влиянием пищевых антигенов, таких как глютен
► У пациентов с IgА-Н часто наблюдается изолированное повышение уровней антиглиадиновых антител в сыворотке крови
Что нового дает статья?
► Полученные результаты указывают на возможность использования антител класса IgA к деамидированным пептидам как потенциального маркера риска прогрессирования IgA-H
Как это может повлиять на клиническую практику в обозримом будущем?
► Дальнейшее изучение влияния пищевых антигенов на иммунный ответ при IgA-Н может помочь в разработке дополнительных персонифицированных диагностических и терапевтических подходов, направленных на коррекцию MALT-системы кишечника и контроль высокоактивного течения IgA-H
Рецензия
Для цитирования:
Манцаева М.Е., Корабельников Д.И., Борисов А.Г. Клинико-диагностическое значение изолированного выявления антител класса IgA к деамидированным пептидам глиадина у пациентов с IgA-нефропатией. ФАРМАКОЭКОНОМИКА. Современная фармакоэкономика и фармакоэпидемиология. 2025;18(1):62-70. https://doi.org/10.17749/2070-4909/farmakoekonomika.2025.304
For citation:
Mantsaeva M.E., Korabelnikov D.I., Borisov A.G. Clinical and diagnostic significance of isolated detection of IgA antibodies to deamidated gliadin peptides in IgA nephropathy patients. FARMAKOEKONOMIKA. Modern Pharmacoeconomics and Pharmacoepidemiology. 2025;18(1):62-70. (In Russ.) https://doi.org/10.17749/2070-4909/farmakoekonomika.2025.304

Контент доступен под лицензией Creative Commons Attribution-NonCommercial-ShareAlike 4.0 International License.






































