Перейти к:
Хемоинформационное исследование спирамицина в сравнении с другими антибиотиками
https://doi.org/10.17749/2070-4909/farmakoekonomika.2025.296
Аннотация
Актуальность. Антибиотики различаются спектром воздействия на бактериальные патогены, в т.ч. их антибиотикорезистентные штаммы. Установление спектров действия антибиотиков и механизмов резистентности к ним является важной задачей для поиска эффективной и безопасной антибиотикотерапии.
Цель: хемоинформационное исследование спирамицина в сравнении с другими макролидами (джозамицином, азитромицином, кларитромицином) и респираторным фторхинолоном (моксифлоксацином).
Материал и методы. Оценка проведена посредством современных методов анализа (теорий анализа размеченных графов, метрического анализа данных, комбинаторной теории разрешимости, топологической теории анализа плохо формализованных задач), развиваемых в рамках алгебраического подхода к распознаванию.
Результаты. Хемомикробиомное и фармакоинформационное профилирование показало существенные отличия молекулы спирамицина от молекул сравнения с точки зрения эффективности, безопасности и механизмов действия. Отмечены характерные особенности действия спирамицина: ингибирование синтеза белка посредством воздействия на рибосому с возможными ингибированием бактериальной топоизомеразы, синтеза ДНК, снижением потенциала и дестабилизации мембран, в т.ч. через ионофорные механизмы. Анализ корреляций между хемогеномными профилями указал на выраженную схожесть эффектов трех из пяти исследованных молекул (джозамицина, азитромицина, кларитромицина) при существенном отличии действия спирамицина от свойств других исследованных макролидов. Механизмы резистентности к спирамицину потенциально включают гены из функциональных групп «сборка наружной мембраны грамотрицательных бактерий», «транспорт сорбитола», «трансмембранный транспортер L-лейцина» и др. Спирамицин характеризовался наилучшим профилем безопасности с точки зрения антимикронутриентных эффектов (увеличение риска выведения жизненно важных микронутриентов всего на 7%).
Заключение. Существенное отличие хемогеномных, хемомикробиомных и фармакоинформационных профилей спирамицина от остальных антибиотиков (в т.ч. других макролидов) позволяет предполагать низкую резистентность к спирамицину на уровне популяций.
Ключевые слова
Для цитирования:
Громова О.А., Торшин И.Ю. Хемоинформационное исследование спирамицина в сравнении с другими антибиотиками. ФАРМАКОЭКОНОМИКА. Современная фармакоэкономика и фармакоэпидемиология. 2025;18(1):80-94. https://doi.org/10.17749/2070-4909/farmakoekonomika.2025.296
For citation:
Gromovа O.A., Torshin I.Yu. Chemoinformatic study of spiramycin in comparison with other antibiotics. FARMAKOEKONOMIKA. Modern Pharmacoeconomics and Pharmacoepidemiology. 2025;18(1):80-94. (In Russ.) https://doi.org/10.17749/2070-4909/farmakoekonomika.2025.296
ВВЕДЕНИЕ / INTRODUCTION
Клиническая практика указывает на широкое распространение бактериальных штаммов с лекарственной устойчивостью. Например, не менее 40% штаммов патогена Streptococcus pneumoniae (вызывает внебольничные пневмонии, бактериемии, менингит, отиты, синуситы) в европейских популяциях характеризуются резистентностью к β-лактамам и макролидам [1]. В Китае и Японии резистентность S. pneumoniae к эритромицину распространена среди 94% штаммов [2], а в северном Китае более 99% штаммов S. pneumoniae резистентны одновременно к макролидам, линкозамидам и стрептограминам [3]. Среди россиян резистентность S. pneumoniae к эритромицину найдена для 24% штаммов, к кларитромицину – для 29%, к азитромицину – для 31% [4].
В условиях широкого распространения резистентности к антибиотикам среди бактериальных патогенов становится особенно важен поиск стратегий для эффективной и безопасной антибиотикотерапии. Одной из таких стратегий является использование антибиотиков, которые не так часто применялись в предыдущие десятилетия в той или иной популяции, поэтому резистентность к ним не имеет массового характера.
Cпирамицин – природный антибиотик из группы макролидов (с 16-членным макроциклическим лактонным кольцом). Как известно, макролиды имеют весьма высокий уровень безопасности и в целом хорошо переносятся пациентами различного возраста. Спектр антимикробной активности макролидов включает преимущественно грамположительные возбудители и ряд грамотрицательных бактерий [5]. Исходно спирамицин был обнаружен в продуктах жизнедеятельности Streptomyces ambofaciens и поэтому считается антибиотиком природного происхождения. Он по-прежнему характеризуется минимальным уровнем потребления в России [6].
Спирамицин проявляет бактериостатическое и бактерицидное действие, взаимодействуя с активным центром пептидилтрансферазы рибосом, формируя остановку синтеза белков бактериями, в т.ч. среди штаммов с устойчивостью к пенициллину. Бактерицидный/бактериостатический эффект спирамицина, как и других макролидов, дозозависим (дозы более 3 млн МЕ соответствуют преимущественно бактерицидному действию) [7]. Установлен весьма умеренный профиль побочных эффектов спирамицина – тошнота, диарея, повышение активности трансаминаз (редко), в то время как воздействие на показатели электрокардиограммы и свертывание крови практически не встречается.
Спирамицин продемонстрировал высокую активность против Staphylococcus aureus, коагулазоотрицательных стафилококков, β-гемолитических стрептококков, пневмококков, Haemophilus influenzae, ряда патогенов Neisseria, Bordetella, Corynebacterium, E. сoli, риккетсий, легионелл, хламидий, микоплазм, токсоплазм и др., а среди грамотрицательных микроорганизмов – против Klebsiella pneumoniae, Acinetobacter baumannii, Pseudomonas aeruginosa. В клинических исследованиях показана эффективность спирамицина для эрадикации H. рylori, при инфекциях дыхательных путей, инфекциях C. pneumoniae, C. trachomatis и токсоплазмозе беременных. Важно отметить, что при концентрации спирамицина в среде питания бактерий более 30 мкг/мл (что соответствует приему взрослым человеком порядка 150 мг спирамицина, т.е. около 600 тыс. МЕ) он тормозит формирование биопленок в 2 раза и более [6].
Для спирамицина характерны плейотропные эффекты, не связанные собственно с антибактериальным действием: противовирусный (против вируса гриппа H1N1, энтеровируса A71, коксакивируса A16), регенераторный (клетки печени, селезенки и головного мозга), противовоспалительный (снижение секреции макрофагами интерлейкинов ИЛ-6 и ИЛ-1β, индуцибельной синтазы оксида азота, ядерного фактора каппа В (англ. nuclear factor kappa B, NF-κB), митоген-активируемых протеинкиназ (англ. mitogen-activated protein kinase, MAPK), молекул адгезии на нейтрофилах и эндотелиоцитах), иммуномодулирующий, антипролиферативный [7].
Другие макролиды, в отличие от спирамицина, имеют более выраженные побочные эффекты, включающие не только негативное воздействие на желудочно-кишечный тракт (снижение аппетита, изжога, тошнота, рвота, метеоризм, диарея), но и аллергические реакции, а также последствия негативного влияния на ионные каналы, поддерживающие обмен минералов и электрический потенциал клетки.
Например, для джозамицина характерны аллергические реакции (крапивница), нарушения функции печени (повышение уровней аспартатаминотрансферазы, аланинаминотрансферазы, холестатический гепатит), псевдомембранозный энтероколит, гиповитаминозы и дисмикроэлементозы, снижение слуха, отеки.
Для азитромицина (15-членный макролид) наиболее частыми побочными эффектами являются диарея (5%), тошнота (3%), боли в животе (3%), нервозность, кожные реакции, холестаз, аномальные изменения в электрической активности сердца (удлинение интервала Q–T на фоне гипокалиемии и гипомагнеземии), наращивание избыточной массы тела.
Для кларитромицина (14-членный макролид) характерны побочные эффекты со стороны нервной системы (головная боль, головокружение, тревожность, страх, бессонница, редко – дезориентация, галлюцинации, спутанность сознания, шум в ушах, дисгевзия), дисфункция печени (повышение трансаминаз, холестатический гепатит), нарушения системы гемостаза (тромбоцитопения и кровотечения).
Считаем важным отметить, что в одном из последних руководств по инфекциям нижних дыхательных путей эксперты Европейского респираторного общества (англ. European Respiratory Society, ERS) рекомендуют добавление именно макролидов, а не респираторных фторхинолонов к β-лактамным антибиотикам для эмпирической терапии [8].
Антибиотики других групп могут проявлять еще более выраженные побочные эффекты. Необходимо помнить, что, несмотря на микробиологическую эффективность фторхинолонов, их применение ограничено второй линией терапии вследствие неблагоприятного профиля безопасности. В частности, моксифлоксацин (фторхинолон ІV поколения), имея широкий спектр антибактериальной активности, характеризуется при этом многочисленными побочными эффектами, обусловленными, прежде всего, негативным воздействием на минеральный обмен организма (нарушение активности белков-транспортеров ионов К⁺/Na⁺⁺/Ca²⁺, усиленное выведение ионов Mg²⁺). Побочные эффекты моксифлоксацина включают не только обычные диарею, головокружение и головную боль, но и обострение миастении и даже спонтанные разрывы сухожилий, повреждение нервов, тахикардию, повышение артериального давления, усиление сердцебиения, боль в груди, удлинение интервала Q–T. Многие из этих эффектов очевидным образом связаны с потерями магния [9]. Между ионами магния и определенными антибиотиками (прежде всего, аминогликозидами и фторхинолонами) существуют антагонистические взаимодействия: антибиотикотерапия вызывает выраженную гипомагнеземию, что обусловливает необходимость назначения препаратов магния [6].
Таким образом, спирамицин является перспективным антибиотиком для широкого применения в амбулаторной клинической практике, характеризующимся умеренным профилем побочных эффектов и хорошей эффективностью против широкого круга бактериальных внутриклеточных патогенов. Перед проведением обширных экспериментальных и клинических исследований представляется перспективным оценить антибиотические эффекты спирамицина в сравнении с другими антибиотиками.
Информационные технологии хемомикробиомного и фармакоинформационного анализа, разработанные в научной школе академика РАН Ю.И. Журавлёва, позволяют определять свойства различных молекул по сотням и даже тысячам показателей и сравнивать исследуемые молекулы между собой. Посредством хемомикробиомных скринингов препаратов, проводимых на основе современных информационных технологий анализа больших данных, можно оценивать эффекты веществ на различные типы бактерий-комменсалов в желудочно-кишечном тракте человека и на различные штаммы болезнетворных бактерий [10][11].
Цель – хемоинформационное исследование спирамицина в сравнении с другими макролидами (джозамицином, азитромицином, кларитромицином) и респираторным фторхинолоном (моксифлоксацином).
МАТЕРИАЛ И МЕТОДЫ / MATERIAL AND METHODS
Исследованные молекулы / The studied molecules
Проведено хемоинформационное исследование для оценки эффектов спирамицина, джозамицина, азитромицина, кларитромицина и моксифлоксацина. Химические структуры изученных молекул приведены на рисунке 1.
Рисунок 1. Химические формулы исследованных молекул
Figure 1. Chemical formulas of the studied molecules
Методы анализа / Methods for analysis
Хемомикробиомный анализ [10] основан на хемоинформационном подходе и теории анализа размеченных графов [12], теории метрического анализа данных, комбинаторной теории разрешимости [13], топологической теории анализа плохо формализованных задач [14] и новейших методов прогнозирования значений числовых переменных [15][16].
Для каждой из исследованных молекул были получены оценки значений площади под кривой роста для репрезентативной выборки микробиоты человека, включившей 152 болезнетворные бактерии, которые более подробно описаны в работах [10–12]. Для всех молекул, представленных на рисунке 1, выполнены:
– определение значений минимальных ингибирующих концентраций (англ. minimum inhibitory concentration, MIC) на основании информации в базах данных Human Microbiome Project [17], iHMP [18], PubChem [19];
– оценка свойств антибиотиков (по данным AntibioticDB [20]);
– хемогеномное [21] исследование (оценка механизмов действия и формирования резистентности);
– фармакоинформационное исследование (оценка антимикронутриентных свойств антибиотиков);
– хемомикробиомный анализ (оценки воздействия молекул на штаммы различных бактериальных патогенов);
– анализ механизмов действия антибиотиков (по алгоритмам, полученным по базе данных AntibioticsDB);
– хемогеномный анализ (воздействие исследованных молекул на библиотеку мутантов E. coli с целью формулировки механизмов действия и резистентности);
– анализ антивитаминных и антимикроэлементных свойств антибиотиков.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ / RESULTS AND DISCUSSION
Хемомикробиомный анализ / Chemomicrobiomic analysis
Хемомикробиомный анализ эффектов изученных антибиотиков на различные штаммы ряда представителей патогенной флоры (табл. 1) показал, что антибактериальное действие спирамицина не уступает антибиотикам сравнения. Среднее значение констант ингибирования MIC составило 9,8 мкг/мл, что сопоставимо с эффектами азитромицина (9,5 мкг/мл), кларитромицина (9,8 мкг/мл), джозамицина (11 мкг/мл) и существенно эффективнее по сравнению с фторхинолоном моксифлоксацином (45,4 мкг/мл). В ряде случаев спирамицин показал наилучшее антибактериальное действие – например, для Haemophilus influenza (2,7 мкг/мл; остальные молекулы: 2,9–21,4 мкг/мл) и для метициллинорезистентного штамма Staphylococcus aureus MRSA (3,7 мкг/мл; остальные молекулы: 4,1–19,4 мкг/мл).
Таблица 1. Значения констант минимальных ингибирующих концентраций (англ. minimum inhibitory concentration, MIC) патогенных и условно-патогенных бактерий, для которых были найдены достоверные различия между молекулами в результате проведения хемомикробиомного анализа, мкг/мл
Table 1. Values of minimum inhibitory concentration (MIC) constants of pathogenic and opportunistic bacteria for which reliable differences between molecules were found as a result of chemomicrobiomic analysis, μg/ml
|
Бактерия / Bacterium |
N* |
Описание / Description |
Спирамицин / Spiramycin |
Моксифлоксацин / Moxifloxacin |
Джозамицин / Josamycin |
Азитромицин / Azithromycin |
Кларитромицин / Clarithromycin |
|
Aspergillus flavus |
6 |
Наиболее частый возбудитель аспергиллеза, продуцент афлатоксинов / The most common causative agent of aspergillosis, aflatoxin producer |
20,2±3,1 |
263,3±11,4 |
22,2±3,3 |
30,2±3,8 |
31,4±3,9 |
|
Aspergillus fumigatus |
13 |
Вызывает аспергиллезы, иммунодефицитные состояния и новообразования (аспергилломы) / Causes aspergilloses, immunodeficiency and neoplasms (aspergillomas) |
8,0±2,0 |
228,1±10,6 |
10,6±2,3 |
13,6±2,6 |
12,8±2,5 |
|
Bacteroides fragilis |
4 |
Участвует в газообразовании, гнойно-воспалительные заболевания после травм / Participates in gas formation, purulent-inflammatory diseases after injuries |
9,7±2,2 |
4,8±1,5 |
13,9±2,6 |
4,9±1,6 |
12,9±2,5 |
|
Clostridium difficile |
3 |
Основная причина больничной диареи / The main cause of hospital diarrhea |
1,3±0,8 |
47,7±5,2 |
1,0±0,8 |
1,2±0,8 |
1,0±0,8 |
|
Cryptococcus neoformans |
11 |
Криптококкоз, дыхательная недостаточность, может поражать головной и спинной мозг / Cryptococcosis, respiratory failure, can affect the brain and spinal cord |
7,2±1,9 |
11,9±2,4 |
7,3±1,9 |
7,0±1,9 |
7,1±1,9 |
|
Fusobacterium necrophorum |
4 |
Возбудитель отита, синусита, постангинального сепсиса, гнойного тромбофлебита яремной вены / The causative agent of otitis, sinusitis, postanginal sepsis, purulent thrombophlebitis of the jugular vein |
0,5±0,5 |
0,9±0,7 |
0,4±0,5 |
0,4±0,5 |
0,4±0,5 |
|
Fusobacterium nucleatum |
3 |
Бактерии зубного налета, запускают воспалительные процессы, приводящие к образованию атеросклеротических бляшек и артриту / Plaque bacteria, trigger inflammatory processes that lead to the formation of atherosclerotic plaques and arthritis |
0,3±0,4 |
0,5±0,5 |
0,2±0,4 |
0,2±0,4 |
0,2±0,4 |
|
Haemophilus influenza |
2 |
Возбудитель гриппа / Influenza causative agent |
2,7±1,2 |
2,9±1,3 |
21,4±3,5 |
4,0±1,5 |
7,0±2,0 |
|
Klebsiella aerogenes |
3 |
При попадании в кровь вызывает септический шок / In case of contact with blood, causes septic shock |
16,5±3,0 |
12,9±2,7 |
20,9±3,4 |
12,4±2,6 |
11,8±2,6 |
|
Klebsiella oxytoca |
2 |
Больничная инфекция, резистентная к антибиотикам, колит и сепсис / Nosocomial infection resistant to antibiotics; colitis and sepsis |
7,1±2,0 |
0,2±0,4 |
8,1±2,1 |
7,1±2,0 |
8,1±2,1 |
|
Proteus mirabilis |
7 |
Инфекции мочевыводящих путей / Urinary tract infections |
27,5±3,7 |
19,8±3,1 |
13,0±2,5 |
11,4±2,4 |
9,0±2,1 |
|
Proteus vulgaris |
9 |
Инфекции мочевыводящих путей / Urinary tract infections |
23,1±3,4 |
17,5±2,9 |
27,9±3,7 |
33,0±4,0 |
27,1±3,6 |
|
Serratia marcescens |
7 |
Конъюнктивит, кератит, эндофтальмит, инфекции слезных протоков / Conjunctivitis, keratitis, endophthalmitis, tear duct infections |
9,6±2,2 |
5,6±1,7 |
3,4±1,3 |
3,0±1,2 |
3,3±1,3 |
|
Staphylococcus aureus MRSA |
2 |
Внутрибольничные инфекции, кожные инфекции (прыщи, целлюлит, карбункулы), пневмония, менингит, эндокардит / Nosocomial infections, skin infections (acne, cellulite, carbuncles), pneumonia, meningitis, endocarditis |
3,7±1,4 |
19,4±3,3 |
4,1±1,5 |
4,6±1,6 |
4,7±1,6 |
Примечание. * N – число штаммов, по которым проводилось усреднение.
Note. * N – number of strains for which averaging was performed.
Более детальный анализ показал, что антибактериальные эффекты спирамицина в существенной степени зависят от конкретных штаммов исследованных патогенов. Рассмотрим эти отличия на примерах профилей штамм-специфического действия рассматриваемых веществ против Klebsiella pneumoniae, Pseudomonas aeruginosa, Staphylococcus aureus, Streptococcus pneumoniae, Streptococcus pyogenes (рис. 2).
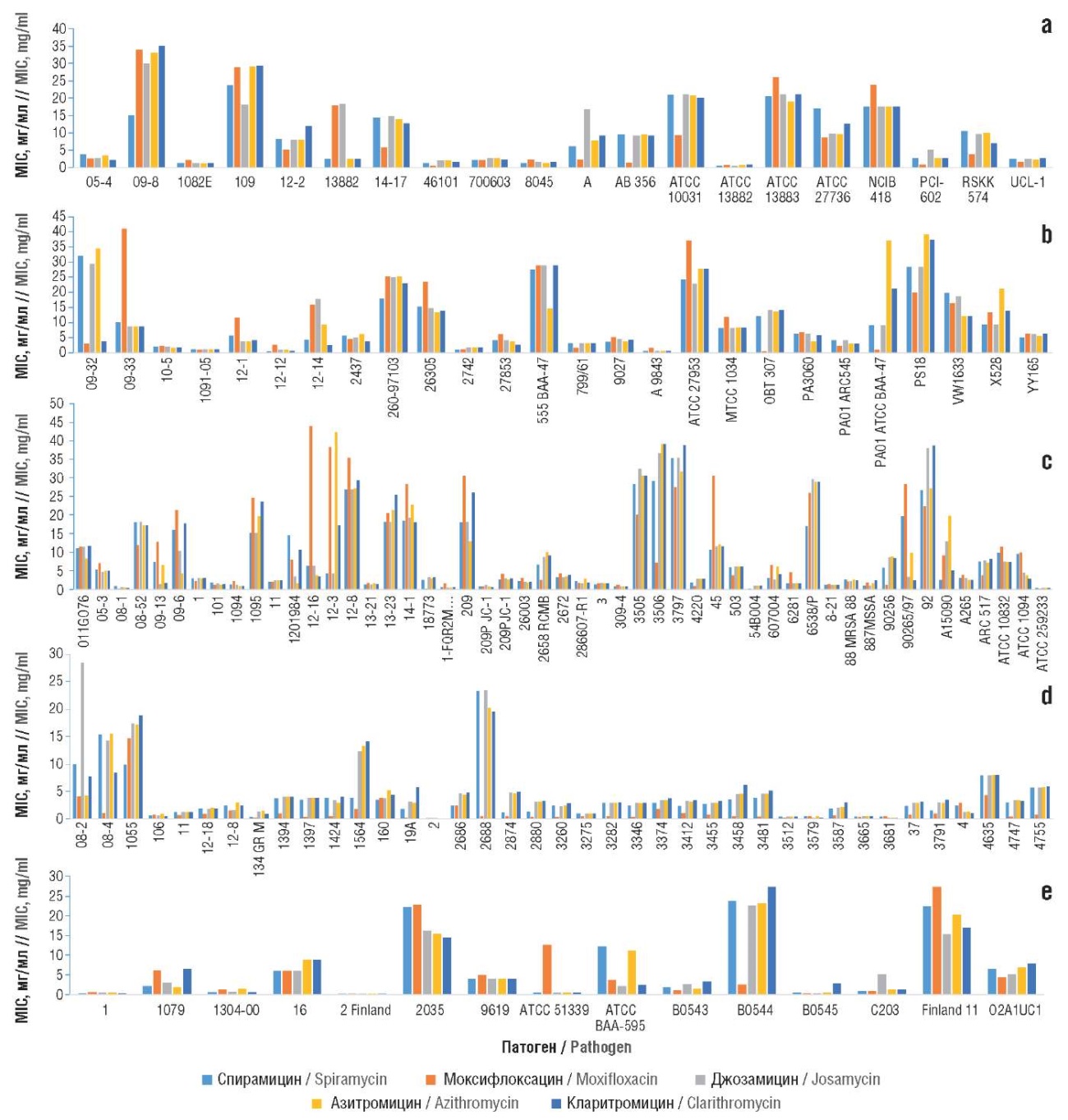
Рисунок 2. Профили штамм-специфических эффектов исследованных веществ (по результатам хемомикробиомного исследования) против патогенов:
a – Klebsiella pneumoniae; b – Pseudomonas aeruginosa; c – Staphylococcus aureus; d – Streptococcus pneumoniae; e – Streptococcus pyogenes.
MIC (англ. minimum inhibitory concentration) – минимальная ингибирующая концентрация
Figure 2. Profiles of strain-specific effects of the studied substances (based on the results of chemomicrobiomic study) against pathogens:
a – Klebsiella pneumoniae; b – Pseudomonas aeruginosa; c – Staphylococcus aureus; d – Streptococcus pneumoniae; e – Streptococcus pyogenes.
MIC – minimum inhibitory concentration
В случае Klebsiella pneumoniae (патоген, вызывающий внутрибольничные инфекции, включая пневмонию, сепсис, инфекции мочевыводящих путей, бактериемию, менингит, абсцессы в печени, особенно при иммунодефицитах) спирамицин был наиболее эффективен против штаммов «09-8» (15 мкг/мл; остальные молекулы: 30–35 мкг/мл) и «13882» (2,4 мкг/мл; остальные: 2,4–19 мкг/мл). Против всех остальных штаммов эффективность спирамицина была сопоставима с эффективностью других исследованных антибиотиков.
Для Staphylococcus aureus (внутрибольничные инфекции, кожные инфекции – прыщи, целлюлит, карбункулы, пневмония, менингит, эндокардит, бактериемия, сепсис) спирамицин более эффективно, чем остальные молекулы, ингибировал штаммы «1095» (15 мкг/мл; остальные: 15–25 мкг/мл), «45» (10 мкг/мл; остальные: 12–30 мкг/мл), «6538/P» (17 мкг/мл; остальные: 25–29 мкг/мл), «A15090» (2,5 мкг/мл; остальные: 5–12 мкг/мл).
Для патогена Streptococcus pneumoniae (возбудитель внебольничной пневмонии, менингита, среднего отита, синусита, эндокардита, септического артрита, перитонита) спирамицин был наиболее эффективен против штаммов «1055» (9,87 мкг/мл; остальные: 15–19 мкг/мл), «2686» (2,36 мкг/мл; остальные: 2,36–4,8 мкг/мл), «A 9585» (0,10 мкг/мл; остальные: 0,3–10,5 мкг/мл), «ATCC 13883» (1,61 мкг/мл; остальные: 2–23 мкг/мл).
Механизмы действия исследованных антибиотиков / Mechanisms of action of studied antibiotics
Результаты хемореактомного моделирования исследованных антибиотиков на основе базы данных AntibioticDB показали, что различия между молекулами связаны, в первую очередь, с механизмами действия на бактериальные патогены (рис. 3а).
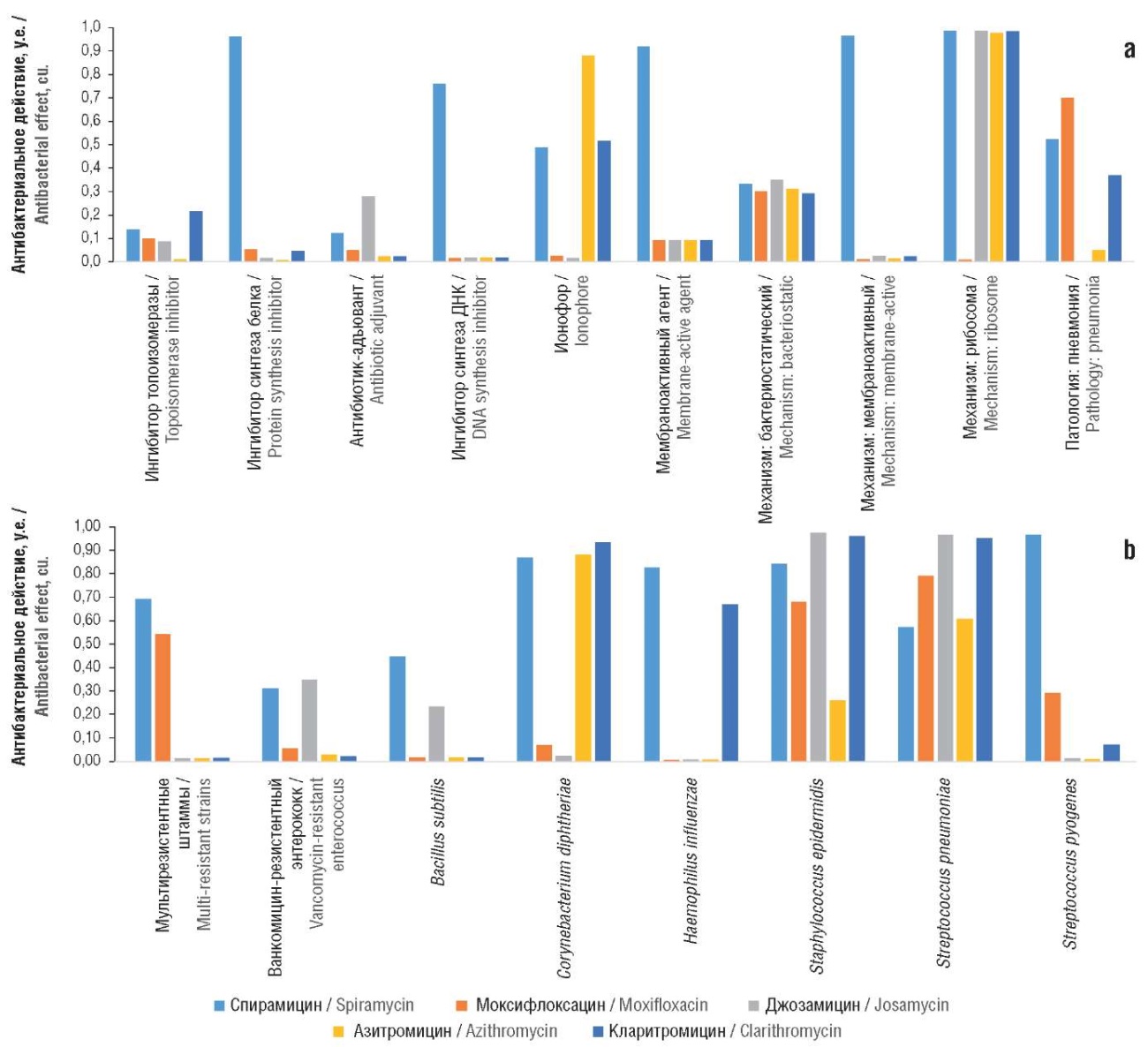
Рисунок 3. Результаты хемореактомного моделирования исследованных антибиотиков на основе базы данных AntibioticDB:
а – потенциальные механизмы действия; b – патогены.
ДНК – дезоксирибонуклеиновая кислота
Figure 3. Results of chemoreactomic modeling of the studied antibiotics based on the AntibioticDB database:
а – potential mechanisms of action; b – pathogens.
DNA – deoxyribonucleic acid
Характерными особенностями действия спирамицина были ингибирование синтеза белка посредством воздействия на рибосомы (субъединицы 50S) с возможными ингибированием бактериальной топоизомеразы, синтеза ДНК и антимембранной активностью, в т.ч. посредством ионофорных механизмов (т.е. через усиление транспорта ионов через клеточные мембраны патогена). Различий в бактериостатическом действии изученных молекул не обнаружено. Спирамицин может использоваться как антибиотик-адъювант при пневмониях, он потенциально эффективен против мультирезистентных штаммов, ванкомицинорезистентных энтерококков и ряда других бактериальных патогенов: Corynebacterium diphtheriae, Haemophilus influenzae, Staphylococcus epidermidis, Streptococcus pneumoniae, Streptococcus pyogenes (рис. 3b).
Генетическая природа антибиотикорезистентности бактерий / Genetic nature of bacterial antibiotic resistance
Приведенную выше характеристику антибиотиков с точки зрения патогенов и механизмов действия целесообразно дополнить данными о возможных механизмах формирования резистентности к каждому из них. Общеизвестно, что наличие антибиотикорезистентности у тех или иных штаммов патогенных бактерий обычно связывают с наличием отдельных генов устойчивости к антибиотикам (ГУА). Действительно, патогенные бактерии могут приобретать ряд ГУА посредством обмена плазмидами (кольцеобразными фрагментами негеномной ДНК), чему сопутствует выраженная резистентность к тетрациклинам (гены TET), сульфаниламидам (гены SUL), β-лактамам (гены BLA), макролидам (гены ERM), аминогликозидам (гены AAC), фторхинолонам (гены FCA, GYR), ванкомицину (гены VAN), а также мультилекарственная резистентность (гены MDR) [22]. Переносу ГУА способствует и перегрузка среды токсичными микроэлементами (так называемыми тяжелыми металлами) [23].
Однако помимо антибиотикорезистентности, приобретаемой посредством генов на плазмидах, существует еще и внутренняя, фенотипическая устойчивость бактерий к определенному антибиотику, обусловленная присущими данной бактерии структурными и/или функциональными свойствами. Такая устойчивость бактерий к лекарственным препаратам может быть врожденной, возникать вследствие мутаций или приобретаться через бактериальную рекомбинацию – перенос геномной (неплазмидной) ДНК из одних бактерий в другие. В частности, внутри биопленок существует огромное количество внеклеточной ДНК, которая может распространяться между бактериями в биопленке [24]. Молекулярные механизмы формирования такой резистентности существенно различаются.
Во-первых, внутриклеточная концентрация антибиотиков снижается из-за улучшенного оттока антибиотиков. Некоторые антибиотики могут быть эффективно устранены из бактериальной клетки посредством механизмов оттока ксенобиотиков (конечно, после того, как они проникли в клетки через пориновые белки в мембране). Другие антибиотики могут даже не проникать через пориновые белки определенных бактериальных штаммов. Экспрессия бактериальных систем лекарственного оттока обычно контролируется транскрипционными регуляторами, которые ингибируют или активируют транскрипцию. Например, сниженная экспрессия белков-поринов в Pseudomonas spp. и Acinetobacter spp. способствует поддержанию устойчивости этих бактерий к карбапенему и цефалоспоринам [25].
Во-вторых, антибиотики внутри бактерий могут инактивироваться посредством химических модификаций [26][27]. Ферментативно катализируемые реакции модификации антибиотиков (гидролиз, модификация β-лактамазами, ацетилтрансферазами, фосфотрансферазами, нуклеотидилтрансферазами и др.) являются основными механизмами антибиотикорезистентности.
В-третьих, большинство антибиотиков действуют, связываясь с целевым белком с высоким сродством и специфичностью, тем самым подавляя нормальную активность и функцию таргетного белка. Таргетные белки антибиотиков в бактериях могут модифицироваться в результате мутаций генома или же посттрансляционных модификаций целевого белка, сложным образом зависящих от состояния среды, окружающей бактериальную клетку. Важно отметить, что такие изменения в структуре целевого белка могут эффективно предотвращать связывание им антибиотиков, не влияя на внутриклеточную функцию этого таргетного белка [26].
В-четвертых, существуют малоизученные и недостаточно понимаемые механизмы антибиотикорезистентности. Например, известен механизм, посредством которого белки аденозинтрифосфатаз (АТФаз) типа «ABC» участвуют в резистентности к многочисленным клинически важным классам антибиотиков, поддерживая рибосомальную резистентность [28].
Хемогеномный анализ спирамицина и молекул сравнения на модели E. coli / Chemogenomic analysis of spiramycin and comparison molecules on E. coli model
Представленные выше результаты хемомикробиомного анализа указывают на различия в эффектах исследованных молекул антибиотиков на штаммы ряда бактериальных патогенов. Оценить различия в возможных механизмах молекулярного действия антибиотиков возможно с использованием хемогеномного анализа, в ходе которого оцениваются эффекты исследуемых молекул на мутантные штаммы бактерий (так называемые одногенные делеции). С целью определения механизмов резистентности рассматриваемых антибиотиков проведен хемогеномный анализ E. coli, в результате которого получены оценки воздействия исследованных молекул на библиотеку одногенных мутантов E. coli.
Хемогеномный анализ позволяет получить количественные оценки воздействия антибиотиков на мутантные формы бактерий (в т.ч. и те, которые проявляют резистентность или, наоборот, повышенную чувствительность к антибиотикам). Для этого вычисляются оценки эффектов исследуемых молекул на обширной библиотеке одногенных мутантов одной и той же бактерии. В настоящее время такая библиотека имеется только для грамотрицательной бактерии E. coli: в базе данных ACDB1 [29] представлены результаты измерения эффектов более 80 молекул на жизнеспособность 3950 одногенных мутантов E. coli (что соответствует ингибированию 3950 из 4531 известного гена бактерии), полученные в рамках обширного хемогеномного эксперимента [21].
Для заданной молекулы антибиотика и его концентрации хемогеномный анализ позволяет получить профиль воздействия молекулы на интенсивность роста мутантных бактерий из исследуемой библиотеки мутантов. Компонентами этого профиля (3950-мерный вектор в случае анализируемой библиотеки мутантов E. coli) являются числа от –10 до +10, количественно характеризующие интенсивность роста колонии бактерий в условных единицах: положительные числа указывают на повышение интенсивности роста, а отрицательные – на ингибирование роста соответствующих мутантов.
Анализ корреляций между этими хемогеномными профилями (табл. 2) продемонстрировал выраженную схожесть хемогеномных эффектов трех из пяти исследованных молекул. Так, значения попарных коэффициентов корреляции для джозамицина, азитромицина, кларитромицина лежали в диапазоне 0,49–0,64, что указывает на высокую схожесть хемогеномных эффектов этих трех молекул. В то же время хемогеномные эффекты спирамицина и моксифлоксацина существенно отличались (абсолютные значения коэффициентов корреляции составили <0,3).
Таблица 2. Корреляции между хемогеномными профилями исследованных антибиотиков
Table 2. Correlations between chemogenomic profiles of the studied antibiotics
|
Антибиотик / Antibiotic |
Спирамицин / Spiramycin |
Моксифлоксацин / Moxifloxacin |
Джозамицин / Josamycin |
Азитромицин / Azithromycin |
Кларитромицин / Clarithromycin |
|
Спирамицин / Spiramycin |
0,16 |
0,18 |
0,08 |
0,28 |
|
|
Моксифлоксацин / Moxifloxacin |
0,16 |
–0,19 |
–0,16 |
–0,09 |
|
|
Джозамицин / Josamycin |
0,18 |
–0,19 |
0,64 |
0,64 |
|
|
Азитромицин / Azithromycin |
0,08 |
–0,16 |
0,64 |
0,49 |
|
|
Кларитромицин / Clarithromycin |
0,28 |
–0,09 |
0,64 |
0,49 |
Примечание. Приведены значения коэффициентов корреляции со знаком корреляции. Полужирным шрифтом выделены высокие значения коэффициентов корреляции между хемогеномными профилями молекул.
Note. The values of the correlation coefficients with the correlation sign are given. High values of the correlation coefficients between the chemogenomic profiles of the molecules are highlighted in bold.
Анализ дозозависимых эффектов каждого из антибиотиков на каждый из 3950 мутантов проводился для «низкой», «средней» и «высокой» концентраций. Абсолютные значения этих концентраций отличаются для индивидуальных молекул: например, для амоксициллина они составляют 0,25, 0,5 и 1 мкг/мл, а для ампициллина – 1, 4 и 8 мкг/мл [21].
При оценке дозозависимости эффектов молекулы может быть найдена отрицательная дозозависимость (возрастание концентрации антибиотика сильнее снижает рост бактерий-мутантов) или положительная (неотрицательная) дозозависимость (возрастание концентрации антибиотика не ингибирует рост бактерий-мутантов). Отрицательная дозозависимость соответствует повышению чувствительности бактерии к антибиотику при делеции гена и указывает на механизмы резистентности к антибиотику. Положительная дозозависимость указывает на то, что при делеции того или иного гена эффект антибиотика существенно ослабляется, что означает участие данного гена в реализации молекулярных эффектов этого антибиотика.
Отрицательная дозозависимость для спирамицина (соответствующая механизмам резистентности) наблюдалась для мутантов E. coli, полученных при делециях отдельных генов из функциональных групп «сборка наружной мембраны грамотрицательных бактерий», «комплекс белков Bam» (фолдинг и вставка β-бочкообразных белков-поринов во внешнюю мембрану грамотрицательных бактерий), «транспорт сорбитола», «активность трансмембранного транспортера L-лейцина», «активность цитохрома bo3 убихинолоксидазы» и др. (рис. 4а). Иначе говоря, активность генов в этих группах противодействует антибиотическому действию спирамицина. Штаммы, в которых эти гены менее активны, будут более восприимчивы к воздействию спирамицина.
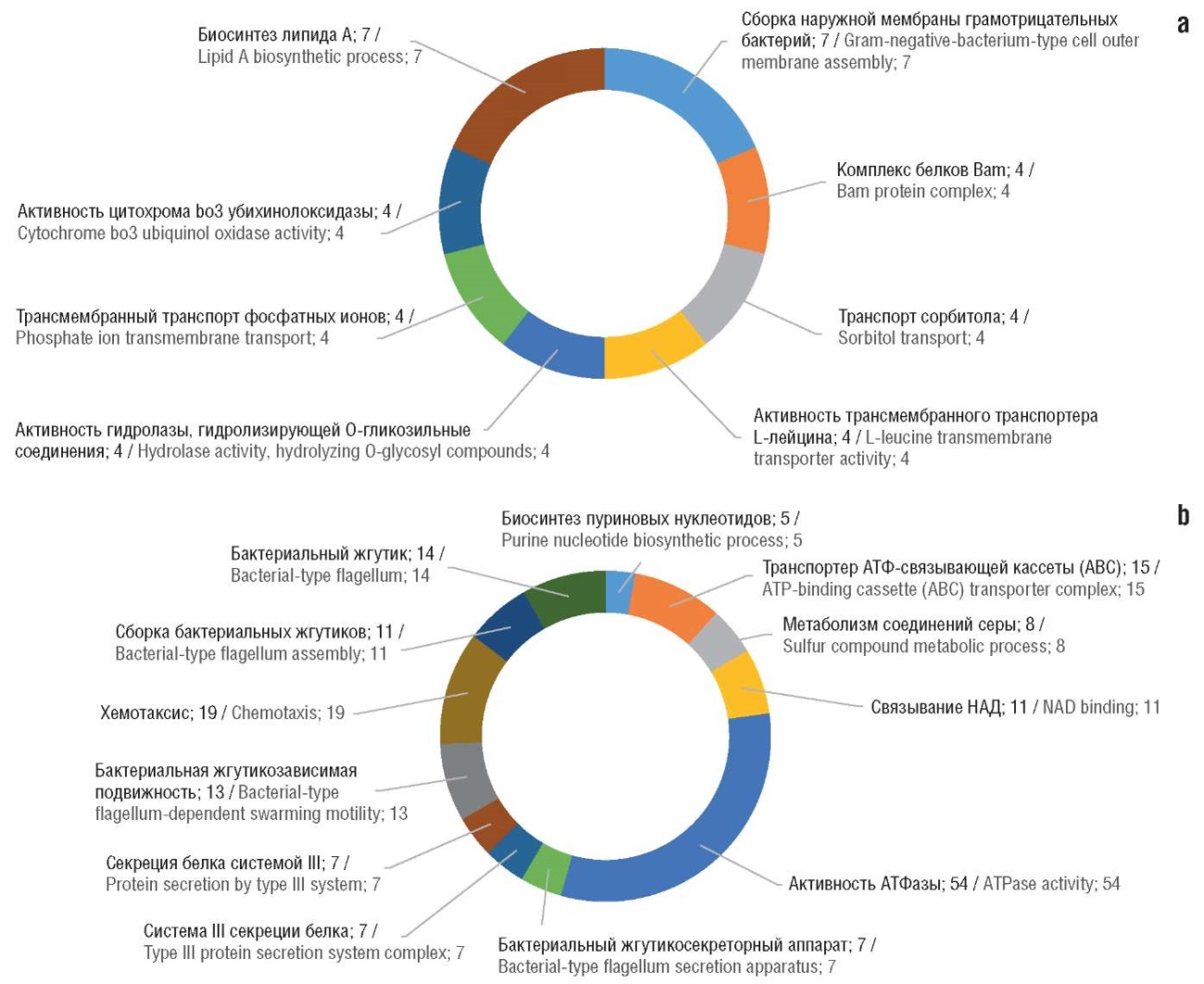
Рисунок 4. Результаты хемогеномного анализа E. coli для спирамицина. Приведены числа генов бактерии в каждой из категорий GO (Gene Ontology), описывающей функции генов:
a – отрицательная дозозависимость (механизмы резистентности); b – положительная дозозависимость (механизмы действия).
АТФ – аденозинтрифосфат; НАД – никотинамидадениндинуклеотид
Figure 4. Results of chemogenomic analysis of E. coli for spiramycin. The numbers of bacterial genes in each of the GO (Gene Ontology) categories describing gene functions are given:
a – negative dose dependence (resistance mechanisms); b – positive dose dependence (mechanisms of action).
ATP – adenosine triphosphate; NAD – nicotinamide adenine dinucleotide
Положительная дозозависимость для спирамицина наблюдалась у одногенных мутантов E. coli, полученных при делециях генов из следующих функциональных групп: «биосинтез пуриновых нуклеотидов», «комплекс транспортера АТФ-связывающей кассеты ABC», «метаболизм соединений серы», «активность АТФазы», «бактериальный жгутикосекреторный аппарат», «система III секреции белка», «сборка бактериальных жгутиков» и др. Другими словами, гены из этих функциональных групп участвуют в механизмах реализации антибиотических (как бактериостатических, так и бактерицидных) эффектов спирамицина (рис. 4b). Штаммы, в которых активность этих генов снижена, будут менее восприимчивы к спирамицину.
В случае моксифлоксацина очевидны существенные отличия в списках генов с отрицательной и положительной дозозависимостью. Одногенные мутанты E. coli, показавшие отрицательную дозозависимость для моксифлоксацина, отражают возможные механизмы врожденной резистентности к этому антибиотику. Эти гены относятся к функциональным группам «активность ДНК-хеликазы», «транспорт органического фосфоната», «окисление формиата», «протеин-фосфоцистеин фосфотрансфераза», «катаболизм глюкозы» и др. Отрицательная дозозависимость по отношению к моксифлоксацину одногенных мутантов E. coli, сформированных делециями генов из вышеперечисленных функциональных групп, указывает на то, что бактериальные штаммы, в которых эти гены менее активны, будут более восприимчивы к воздействию моксифлоксацина.
Одногенные мутанты E. coli с положительной дозозависимостью, характеризующие дополнительные механизмы антибиотического действия моксифлоксацина, были получены при делециях генов, вовлеченных в биосинтез пуриновых нуклеотидов, секрецию жгутиков бактериального типа, метаболизм серных соединений, биосинтез жирных кислот, метаболизм глутамина, путресцина, инозинфосфата (рис. 5). Положительная дозозависимость одногенных мутантов на основе генов из вышеперечисленных функциональных групп указывает на то, что штаммы, в которых активность этих генов снижена, будут менее восприимчивы к моксифлоксацину.
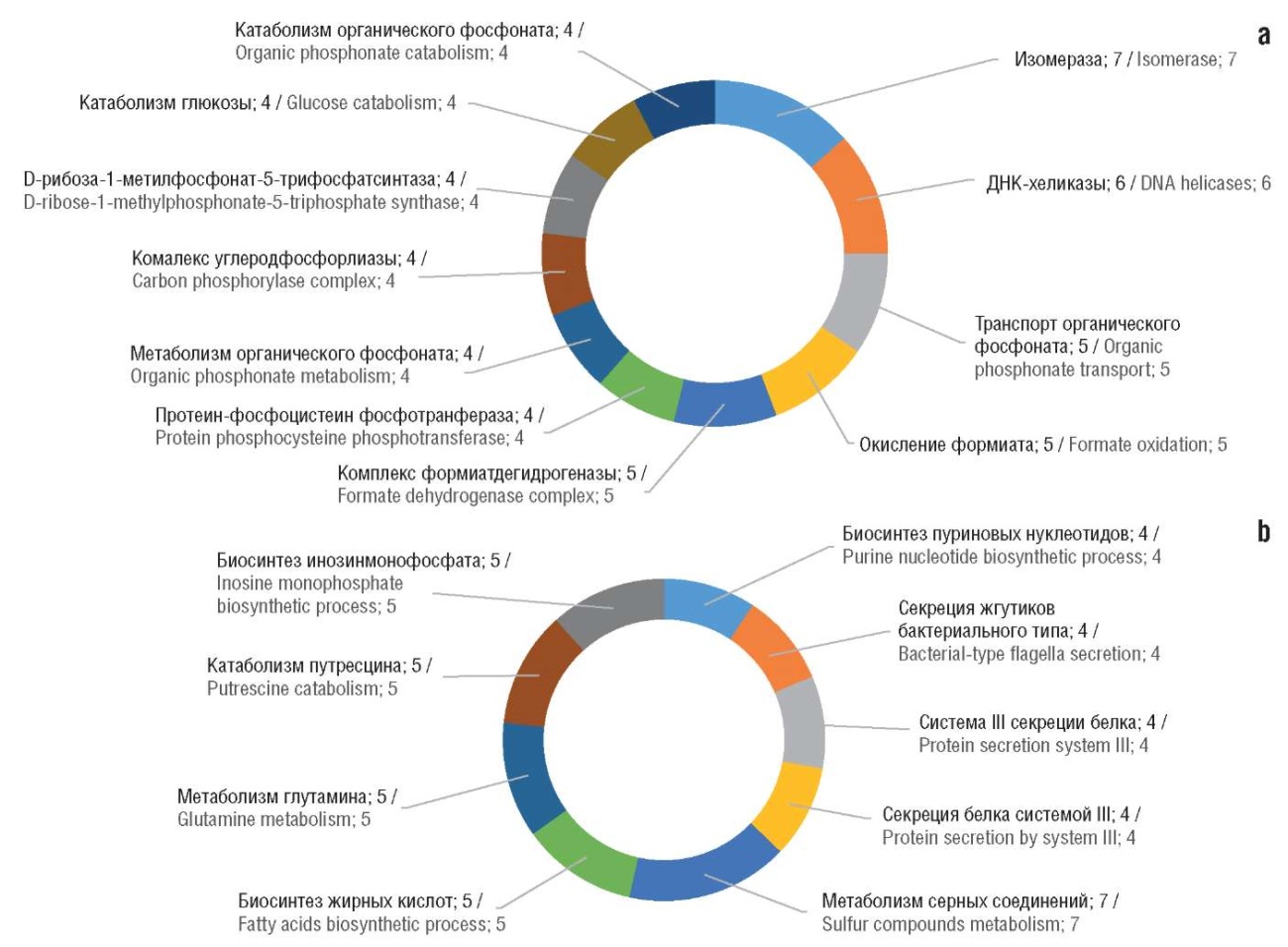
Рисунок 5. Результаты хемогеномного анализа E. coli для моксифлоксацина. Приведены числа генов бактерии в каждой из категорий GO (Gene Ontology), описывающей функции генов:
а – отрицательная дозозависимость (механизмы резистентности); b – положительная дозозависимость (механизмы действия).
ДНК – дезоксирибонуклеиновая кислота
Figure 5. Results of E. coli chemogenomic analysis for moxifloxacin. The numbers of bacterial genes in each of the GO (Gene Ontology) categories describing gene functions are given:
а – negative dose dependence (resistance mechanisms); b – positive dose dependence (mechanisms of action).
DNA – deoxyribonucleic acid
Для кларитромицина (как и джозамицина, азитромицина, принимая во внимание схожесть их хемогеномных профилей – см. табл. 2) отрицательная дозозависимость (наличие которой отражает механизмы антибиотикорезистентности) установлена для одногенных мутантов E. coli, полученных в результате делеций генов из функциональных групп «вставка белка в мембрану», «активность изомеразы протеина дисульфида», «транспорт бактериоцина», «комплекс белка Bam», «транспорт кобаламина», «биосинтез жирных кислот», «метаболизм глутамина». Иначе говоря, отрицательная дозозависимость генов этих групп указывает на то, что бактериальные штаммы, в которых данные гены менее активны, будут более восприимчивы к воздействию кларитромицина.
Положительная дозозависимость одногенных мутантов E. coli (которая отражает механизмы действия кларитромицина) связана с генами, белки которых участвуют в функционировании протонотранспортирующей АТФ-синтазы, импорте железа в клетку, секреции жгутиков бактерий, биосинтезе убихинона и транскрипции РНК-полимеразы. Иначе говоря, положительная дозозависимость с практической точки зрения указывает штаммы, которые будут менее восприимчивы к кларитромицину вследствие сниженной активности генов из этих функциональных групп (рис. 6).
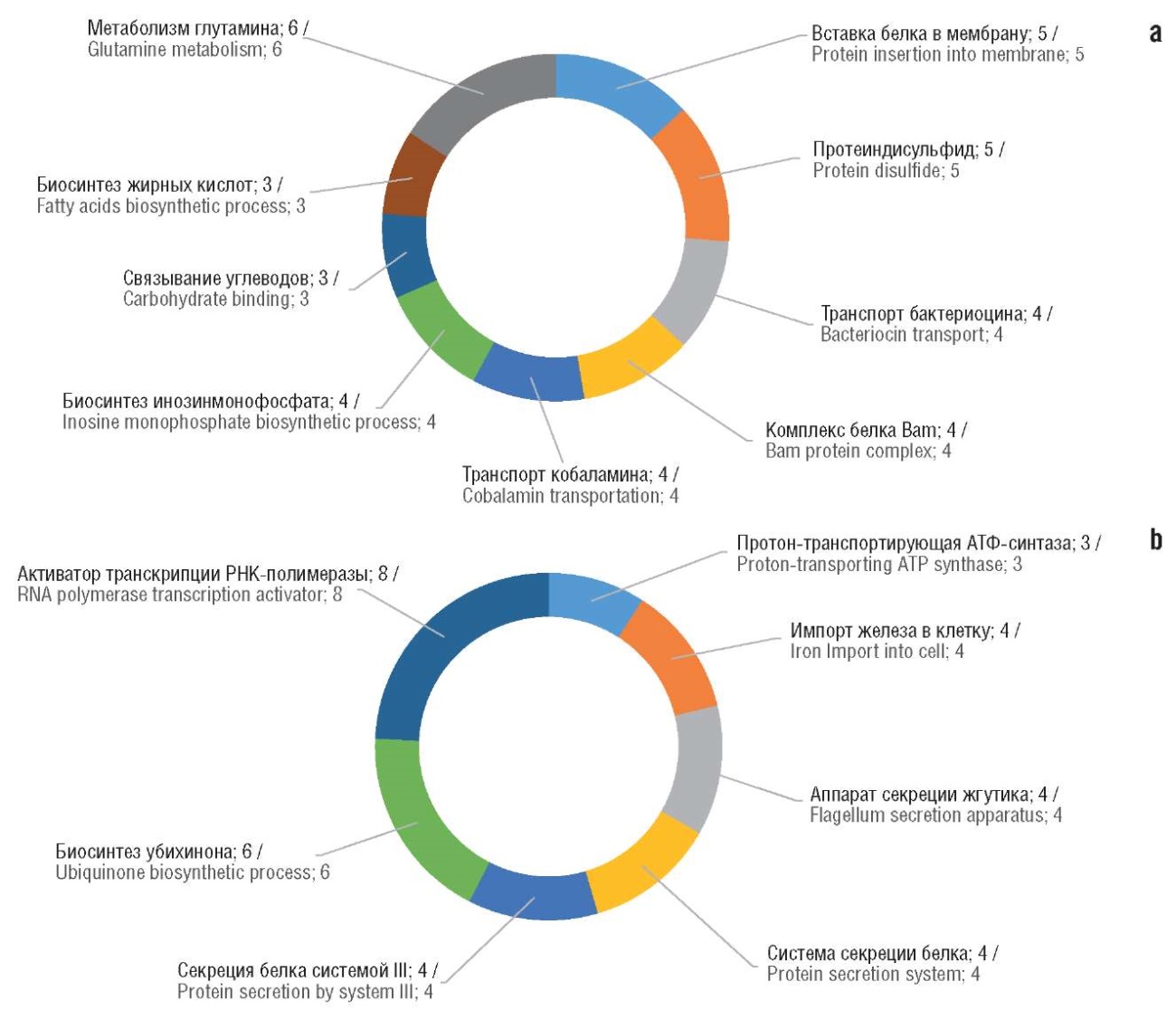
Рисунок 6. Результаты хемогеномного анализа E. coli для кларитромицина. Приведены числа генов бактерии в каждой из категорий GO (Gene Ontology), описывающей функции генов:
а – отрицательная дозозависимость (механизмы резистентности); b – положительная дозозависимость (механизмы действия).
АТФ – аденозинтрифосфат; РНК – рибонуклеиновая кислота
Figure 6. Results of E. coli chemogenomic analysis for clarithromycin. The numbers of bacterial genes in each of the GO (Gene Ontology) categories describing gene functions are given:
а – negative dose dependence (resistance mechanisms); b – positive dose dependence (mechanisms of action).
ATP – adenosine triphosphate; RNA – ribonucleic acid
Воздействие антибиотиков на обмен микронутриентов / The effect of antibiotics on micronutrient metabolism
Различные фармацевтические препараты, в особенности антибиотики, зачастую проявляют побочное действие через отрицательное влияние на обмен витаминов и микроэлементов, стимулируя усиленные потери эссенциальных микронутриентов организмом. Практически все микронутриенты в той или иной форме участвуют в поддержке антибактериального и противовирусного иммунитета, проявляют выраженные противовоспалительные и антиоксидантные свойства [30]. Поэтому анализ свойств лекарств с точки зрения профилей антимикронутриентного воздействия имеет большое значение для оценки безопасности исследуемых соединений. Проведенный анализ указал на существенные различия изученных молекул антибиотиков по данному параметру.
Наиболее выраженным антимикронутриентным действием характеризовались моксифлоксацин и кларитромицин, которые могут стимулировать выведение витаминов группы В (В1, В2, В6), витаминов С, D и K (рис. 7а), лития, магния, цинка, железа, калия (рис. 7b). В то же время спирамицин продемонстрировал наилучший профиль безопасности с этой точки зрения: суммарный балл антивитаминного действия составил всего 0,90±0,08, антиминеральных эффектов – 0,66±0,07 (рис. 7с). Суммарный балл для спирамицина по витаминам и микроэлементам составил 1,56, что соответствует в среднем увеличению риска выведения того или иного микронутриента всего на 7%. Очевидно, что для других антибиотиков суммарные баллы антимикронутриентного действия существенно выше (от 3,6 для джозамицина до 7,3 для моксифлоксацина).
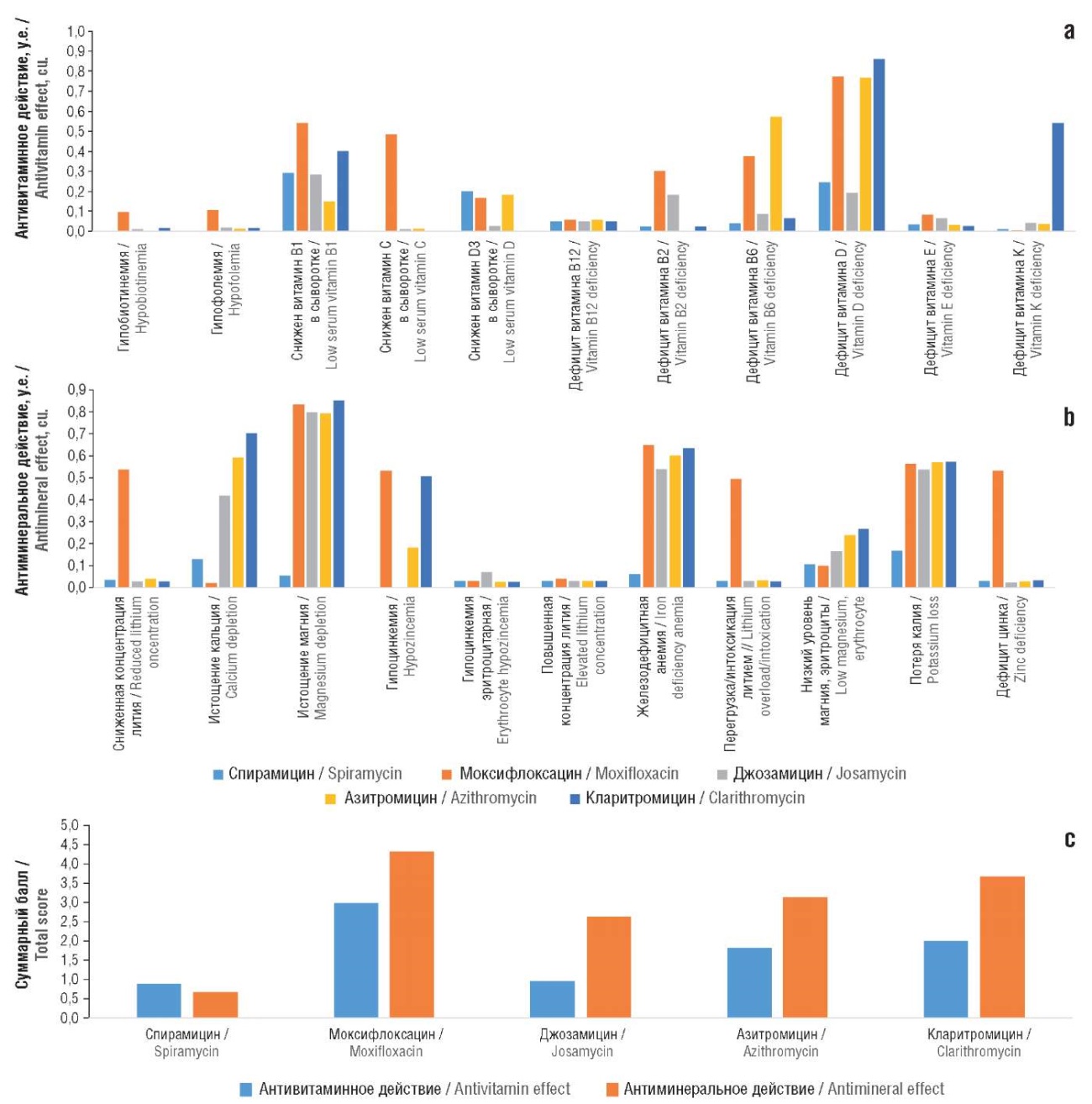
Рисунок 7. Фармакоинформационные оценки антивитаминных и антиминеральных свойств исследованных молекул антибиотиков:
a – антивитаминное действие; b – антиминеральное действие; c – суммарные баллы
Figure 7. Pharmacoinformatiс assessments of antivitamin and antimineral properties of the studied antibiotic molecules:
a – antivitamin action; b – antimineral action; c – total scores
Таким образом, спирамицин характеризуется наиболее благоприятным профилем воздействия на гомеостаз микронутриентов. Важно отметить, что минимальный отрицательный эффект спирамицина на обмен магния полностью соответствует тому, что препараты на его основе практически не влияют на длительность интервала Q–T на электрокардиограмме.
Спирамицин в составе препарата Дорамитцин ВМ / Spiramycin in Doramitcin WM composition
В России зарегистрировано несколько препаратов спирамицина, в т.ч. Дорамитцин ВМ (World Medicine, Турция) (код анатомо-терапевтическо-химической классификации J01FA02), который послужил предметом хемоинформационного исследования.
Спирамицин применяется для лечения инфекций верхних и нижних дыхательных путей, острых риносинуситов, отитов, тонзиллофарингитов, негонококкового уретрита, бактериального простатита, хламидиоза, токсоплазмоза, инфекций кожи и мягких тканей (пиодермия, рожа, фурункулы, импетиго), стоматита, периодонтита, гингивита, а также является препаратом выбора при аллергии к β-лактамам.
В 2024 г. Межрегиональная ассоциация по клинической микробиологии и антимикробной химиотерапии протестировала in vitro активность фармацевтической субстанции спирамицина, из которой производится Дорамитцин ВМ. Исследование было проведено на библиотеке из 350 штаммов S. pneumoniae и S. pyogenes от пациентов с внебольничными инфекциями дыхательных путей из 16 городов России. В целом 70,5% штаммов S. pneumoniae и 94,7% штаммов S. pyogenes были чувствительны к спирамицину. При этом 25–36% штаммов S. pneumoniae и 69,6–97,3% изолятов S. pyogenes, устойчивых к 14- и 15-членным макролидам (эритромицину, кларитромицину, азитромицину), сохраняли чувствительность к спирамицину2.
In vitro анализ 350 клинических изолятов от пациентов с внебольничными инфекциями дыхательных путей (200 – S. рneumoniae, 150 – S. рyogenes) оценил активность макролидных антибиотиков. Резистентными к 14- и 15-членным макролидам эритромицину, кларитромицину, азитромицину были 41,5%, 42% и 40,5% изолятов S. pneumoniae. Как чувствительные к спирамицину оценены 70,5% изолятов S. pneumoniae. Среди исследованных изолятов S. pyogenes резистентными к 14- и 15-членным макролидам эритромицину, кларитромицину, азитромицину были 19,3%, 22% и 26,7%, а как чувствительные к спирамицину могут быть расценены 94,7%. Таким образом, 16-членный макролид спирамицин может сохранять in vitro активность в отношении существенной доли изолятов S. pneumoniae и S. pyogenes [31].
В проспективном исследовании с участием 50 пациентов 28–59 лет с инфекциями нижних дыхательных путей (20 (40%) с пневмонией, 10 (20%) с хронической обструктивной болезнью легких в стадии обострения, 9 (18%) с хроническим бронхитом в стадии обострения, 11 (22%) с острым бронхитом) оценены эффекты применения спирамицина в дозе 3 млн МЕ 3 раза в сутки в течение 10 сут на фоне базовой терапии (бронходилататоры короткого действия, мукоактивные средства). Использование спирамицина привело к клиническому, лабораторному и рентгенологическому улучшению у всех больных независимо от нозологии. В результате терапии у всех пациентов отмечена нормализация температуры тела, уменьшилось число больных с кашлем, гнойным характером мокроты, одышкой. Среди объективных показателей констатировали исчезновение хрипов в легких, снижение уровня С-реактивного белка и достижение нормальных показателей лейкоцитов периферической крови. У пациентов с пневмонией удалось достигнуть уменьшения/редукции инфильтративно-очаговых изменений в легких. Нежелательных явлений не зарегистрировано [32].
Результаты проспективного когортного исследования 246 новорожденных с риском врожденного токсоплазмоза, проведенного в Бразилии с октября 2003 г. по октябрь 2011 г., показали эффективность лечения матерей спирамицином. Благоприятный профиль безопасности позволяет назначать препарат беременным с I триместра. При применении спирамицина во время беременности в I триместре отмечено уменьшение риска передачи токсоплазмоза плоду с 25% до 8%, а при использовании антибиотика во II триместре – снижение риска с 65% до 44% [33]. В целом по данным многолетних наблюдений при применении препарата Дорамитцин ВМ в преконцепции и во время беременности не отмечено тератогенных или фетотоксических нежелательных эффектов3.
ЗАКЛЮЧЕНИЕ / CONCLUSION
Хемоинформационное исследование спирамицина, природного антибиотика из группы 16-членных макролидов, проводилось в сравнении с моксифлоксацином, джозамицином, азитромицином и кларитромицином. Анализ подтвердил, что основное действие спирамицина и других макролидов осуществляется посредством ингибирования рибосомального синтеза белка. Отличительными особенностями дополнительных механизмов действия спирамицина являются возможное ингибирование бактериальной топоизомеразы, синтеза ДНК и дестабилизации мембран, в т.ч. через ионофорные механизмы.
Хемогеномный анализ эффектов спирамицина на библиотеке мутантов E. coli позволил детализировать потенциальные механизмы антибактериального действия спирамицина. К этим механизмам осуществления бактериостатического и бактерицидного (в зависимости от дозы) эффектов спирамицина относятся ингибирование биосинтеза пуриновых нуклеотидов, активности транспортных белков (комплекс транспортера АТФ-связывающей кассеты ABC), угнетение энергетического метаболизма (снижение активности АТФазы и метаболизма серосодержащих соединений), а также торможение процессов сборки бактериальных жгутиков. Потенциальные механизмы резистентности к спирамицину включают активности белков из функциональных групп «сборка наружной мембраны грамотрицательных бактерий», «транспорт сорбитола», «трансмембранный транспортер L-лейцина».
Анализ корреляций между хемогеномными профилями указал на выраженную схожесть эффектов трех из пяти исследованных молекул (джозамицина, азитромицина, кларитромицина) при существенном отличии действия спирамицина от свойств других изученных макролидов.
Спирамицин характеризовался наилучшим профилем безопасности среди исследованных антибиотиков с точки зрения антимикронутриентных эффектов. Принимая во внимание весьма умеренные антивитаминные и антиминеральные показатели (в частности, минимальное воздействие на обмен магния), у спирамицина очевидным образом отсутствуют такие серьезные побочные эффекты, обычно ассоциируемые с влиянием макролидов и фторхинолонов на К⁺/Ca⁺⁺ и Na⁺-каналы, поддерживающие электрический потенциал клеток, как артериальная гипотония, удлинение интервала Q–T по данным электрокардиографии (ассоциировано с гипомагнеземией), развитие пароксизмальной желудочковой тахикардии (связана с гипокалиемией, гипомагнеземией), гепатотоксичности (характерна для азитромицина, кларитромицина, эритромицина), прокинетических болей при приеме препарата и диареи (характерна для эритромицина).
Существенное отличие хемогеномных, хемомикробиомных и фармакоинформационных профилей спирамицина от остальных антибиотиков (в т.ч. других макролидов) в сочетании с плейотропными эффектами данной молекулы (противовирусный, противоопухолевый, снижение избыточной массы тела) позволяет предполагать низкую популяционную резистентность к данному препарату.
1. www.acdb.plus.
2. https://pharmvestnik.ru/content/news/Izuchena-in-vitro-aktivnost-makrolidov-v-otnoshenii-S-pneumoniae-i-S-pyogenes.html.
3. https://grls.pharm-portal.ru/grls/a189cae4-cdfe-4d68-9840-29e29e65ef91#summary.
Список литературы
1. Zahari N.I.N., Engku Abd Rahman E.N.S., Irekeola A.A., et al. a review of the resistance mechanisms for β-lactams, macrolides and fluoroquinolones among streptococcus pneumoniae. Medicina. 2023; 59 (11): 1927. https://doi.org/10.3390/medicina59111927.
2. Gergova R., Boyanov V., Muhtarova A., Alexandrova A. A review of the impact of streptococcal infections and antimicrobial resistance on human health. Antibiotics. 2024; 13 (4): 360. https://doi.org/10.3390/antibiotics13040360.
3. Zhou X., Liu J., Zhang Z., et al. Characterization of Streptococcus pneumoniae macrolide resistance and its mechanism in northeast china over a 20-year period. Microbiol Spectr. 2022; 10 (5): e0054622. https://doi.org/10.1128/spectrum.00546-22.
4. Иванчик Н.В., Чагарян А.Н., Сухорукова М.В. и др. Антибиотикорезистентность клинических штаммов Streptococcus pneumoniae в России: результаты многоцентрового эпидемиологического исследования «ПеГАС 2014–2017». Клиническая микробиология и антимикробная химиотерапия. 2019; 21 (3): 230–7. https://doi.org/10.36488/cmac.2019.3.230-237.
5. Vázquez-Laslop N., Mankin A.S. How macrolide antibiotics work. Trends Biochem Sci. 2018; 43 (9): 668–84. https://doi.org/10.1016/j.tibs.2018.06.011.
6. Бутранова О.И., Зырянов С.К., Абрамова А.А. Спирамицин: прошлое и будущее антибиотика с плейотропными эффектами в терапии внебольничных инфекций. Фармация и фармакология. 2024; 12 (2): 150–71. https://doi.org/10.19163/2307-9266-2024-12-2-150-171.
7. Fuursted K., Knudsen J.D., Petersen M.B., et al. Comparative study of bactericidal activities, postantibiotic effects, and effects of bacterial virulence of penicillin G and six macrolides against Streptococcus pneumoniae. Antimicrob Agents Chemother. 1997; 41 (4): 781–4. https://doi.org/10.1128/AAC.41.4.781
8. Martin-Loeches I., Torres A., Nagavci B., et al. ERS/ESICM/ESCMID/ALAT guidelines for the management of severe community-acquired pneumonia. Intensive Care Med. 2023; 49 (6): 615–32. https://doi.org/10.1007/s00134-023-07033-8
9. Громова О.А., Торшин И.Ю. Магний и «болезни цивилизации». М.: ГЭОТАР-Медиа; 2018: 800 с.
10. Торшин И.Ю., Громова О.А., Захарова И.Н., Максимов В.А. Хемомикробиомный анализ Лактитола. Экспериментальная и клиническая гастроэнтерология. 2019; 164 (4): 111–21 https://doi.org/10.31146/1682-8658-ecg-164-4-111-121.
11. Громова О.А., Торшин И.Ю., Наумов А.В., Максимов В.А. Хемомикробиомный анализ глюкозамина сульфата, пребиотиков и нестероидных противовоспалительных препаратов. ФАРМАКОЭКОНОМИКА. Современная фармакоэкономика и фармакоэпидемиология. 2020; 13 (3): 270–82. https://doi.org/10.17749/2070-4909/farmakoekonomika.2020.049.
12. Торшин И.Ю. О применении топологического подхода к анализу плохо формализуемых задач для построения алгоритмов виртуального скрининга квантово-механических свойств органических молекул I: основы проблемно ориентированной теории. Информатика и ее применения. 2022; 16 (1): 39–45. https://doi.org/10.14357/19922264220106.
13. Рудаков К.В., Торшин И.Ю. Вопросы разрешимости задачи распознавания вторичной структуры белка. Информатика и ее применения. 2010; 4 (2): 25–35.
14. Torshin I.Yu. On solvability, regularity, and locality of the problem of genome annotation. Pattern Recognit Image Anal. 2010; 20: 386–95. https://doi.org/10.1134/S1054661810030156
15. Торшин И.Ю. О задачах оптимизации, возникающих при применении топологического анализа данных к поиску алгоритмов прогнозирования с фиксированными корректорами. Информатика и ее применения. 2023; 17 (2): 2–10. https://doi.org/10.14357/19922264230201.
16. Торшин И.Ю. О формировании множеств прецедентов на основе таблиц разнородных признаковых описаний методами топологической теории анализа данных. Информатика и еe применения. 2023; 17 (3): 2–7. https://doi.org/10.14357/19922264230301.
17. Human Microbiome Project Consortium. A framework for human microbiome research. Nature. 2012; 486 (7402): 215–21. https://doi.org/10.1038/nature11209.
18. The Integrative Human Microbiome Project: dynamic analysis of microbiome-host omics profiles during periods of human health and disease. Cell Host Microbe. 2014; 16 (3): 276–89. https://doi.org/10.1016/j.chom.2014.08.014.
19. Kim S., Chen J., Cheng T., et al. PubChem 2019 update: improved access to chemical data. Nucleic Acids Res. 2019; 47 (D1): D1102–9. https://doi.org/10.1093/nar/gky1033.
20. Farrell L.J., Lo R., Wanford J.J., et al. Revitalizing the drug pipeline: AntibioticDB, an open access database to aid antibacterial research and development. J Antimicrob Chemother. 2018; 73 (9): 2284–97. https://doi.org/10.1093/jac/dky208.
21. Nichols R.J., Sen S., Choo Y.J., et al. Phenotypic landscape of a bacterial cell. Cell. 2011; 144 (1): 143–56. https://doi.org/10.1016/j.cell.2010.11.052.
22. He Y., Yuan Q., Mathieu J., et al. Antibiotic resistance genes from livestock waste: occurrence, dissemination, and treatment. npj Clean Water. 2020; 3: 4. https://doi.org/10.1038/s41545-020-0051-0
23. Zhu Y.G., Johnson T.A., Su J.Q., et al. Diverse and abundant antibiotic resistance genes in Chinese swine farms. Proc Natl Acad Sci USA. 2013; 110 (9): 3435–40. https://doi.org/10.1073/pnas.1222743110.
24. Jian Z., Zeng L., Xu T., et al. Antibiotic resistance genes in bacteria: occurrence, spread, and control. J Basic Microbiol. 2021; 61: 1049–70. https://doi.org/10.1002/jobm.202100201.
25. Fernández L., Hancock R.E. Adaptive and mutational resistance: role of porins and efflux pumps in drug resistance. Clin Microbiol Rev. 2012; 25 (4): 661–81. https://doi.org/10.1128/CMR.00043-12.
26. Nikaido H. Multidrug resistance in bacteria. Annu Rev Biochem. 2009; 78: 119–46. https://doi.org/10.1146/annurev.biochem.78.082907.
27. Wright G.D. Molecular mechanisms of antibiotic resistance. Chem Commun. 2011; 47 (14): 4055–61. https://doi.org/10.1039/c0cc05111j.
28. Sharkey L.K., Edwards T.A., O'Neill A.J. ABC-F proteins mediate antibiotic resistance through ribosomal protection. mBio. 2016; 7 (2): e01975 https://doi.org/10.1128/mBio.01975-15.
29. Lv J., Liu G., Dong W., et al. ACDB: An Antibiotic Combination DataBase. Front Pharmacol. 2022; 13: 869983. https://doi.org/0.3389/fphar.2022.869983.
30. Громова О.А., Торшин И.Ю. Микронутриенты и репродуктивное здоровье. 2-е изд. М.: ГЭОТАР-Медиа; 2022: 832 c.
31. Козлов Р.С., Иванчик Н.В., Микотина А.В., Дехнич А.В. In vitro активность макролидных антибиотиков в отношении Streptococcus pneumoniae и Streptococcus pyogenes в Российской Федерации: «Status praesens». Клиническая микробиология и антимикробная терапия. 2024; 26 (3): 318–26. https://doi.org/10.36488/cmac.2024.3.318-326.
32. Байгозина Е.А., Подгурская Е.П., Сенина О.А. и др. Возможности применения и клиническая эффективность спирамицина в эмпирической терапии инфекции нижних дыхательных путей в современных условиях. Русский медицинский журнал. 2024; 1: 47–51.
33. Avelino M.M., Amaral W.N., Rodrigues I.M., et al. Congenital toxoplasmosis and prenatal care state programs. BMC Infect Dis. 2014; 14: 33. https://doi.org/10.1186/1471-2334-14-33.
Об авторах
О. А. ГромоваРоссия
Громова Ольга Алексеевна, д.м.н., проф.
WoS ResearcherID: J-4946-2017
Scopus Author ID: 7003589812
ул. Вавилова, д. 44, корп. 2, Москва 119333
И. Ю. Торшин
Россия
Торшин Иван Юрьевич, к.ф-м.н., к.х.н.
WoS ResearcherID: C-7683-2018
Scopus Author ID: 7003300274
ул. Вавилова, д. 44, корп. 2, Москва 119333
Что уже известно об этой теме?
► Cпирамицин – природный антибиотик из группы макролидов (с 16-членным макроциклическим лактонным кольцом). Макролиды имеют весьма высокий уровень безопасности и в целом хорошо переносятся пациентами различного возраста
► По сравнению с другими макролидами спирамицин обладает менее выраженными побочными эффектами, включающими не только негативное воздействие на желудочно-кишечный тракт, но и аллергические реакции, а также последствия негативного влияния на ионные каналы, поддерживающие обмен минералов и электрический потенциал клетки
Что нового дает статья?
► Хемомикробиомное и фармакоинформационное профилирование спирамицина указало на существенные отличия данной молекулы от молекул сравнения с точки зрения механизмов действия, эффективности и безопасности
► Хемомикробиомный анализ эффектов изученных антибиотиков в среднем по изученной выборке штаммов ряда представителей патогенной флоры показал, что антибактериальное действие спирамицина не уступает антибиотикам сравнения (а для некоторых штаммов – превосходит)
Как это может повлиять на клиническую практику в обозримом будущем?
► Существенное отличие хемогеномных, хемомикробиомных и фармакоинформационных профилей спирамицина от остальных антибиотиков (в т.ч. других макролидов) позволяет предполагать низкую резистентность к спирамицину на уровне популяции
Рецензия
Для цитирования:
Громова О.А., Торшин И.Ю. Хемоинформационное исследование спирамицина в сравнении с другими антибиотиками. ФАРМАКОЭКОНОМИКА. Современная фармакоэкономика и фармакоэпидемиология. 2025;18(1):80-94. https://doi.org/10.17749/2070-4909/farmakoekonomika.2025.296
For citation:
Gromovа O.A., Torshin I.Yu. Chemoinformatic study of spiramycin in comparison with other antibiotics. FARMAKOEKONOMIKA. Modern Pharmacoeconomics and Pharmacoepidemiology. 2025;18(1):80-94. (In Russ.) https://doi.org/10.17749/2070-4909/farmakoekonomika.2025.296

Контент доступен под лицензией Creative Commons Attribution-NonCommercial-ShareAlike 4.0 International License.






































