Перейти к:
Дифференциальный хемопротеомный анализ молекулы-кандидата RRS-1 и молекул нескольких нестероидных противовоспалительных препаратов
https://doi.org/10.17749/2070-4909/farmakoekonomika.2024.265
Аннотация
Актуальность. Для планирования эффективной и безопасной фармакотерапии воспаления и боли важно оценивать механизмы и спектр действия нестероидных противовоспалительных препаратов (НПВП), включая воздействие на протеом человека.
Цель: выявить и оценить наиболее существенные отличия молекулы-кандидата RRS-1 (N-{(Z)-2-(1-метил-1H-индол-3-ил)-1-[(пропиламино)карбонил]винил}бензамида) от других НПВП посредством дифференциального хемореактомного анализа.
Материал и методы. Хемопротеомное моделирование фармакологических эффектов молекулы RRS-1 и ряда известных НПВП (диклофенак, нимесулид, кеторолак) на протеом человека проводилось на основе алгоритмов числового прогнозирования над пространством разнородных признаковых описаний, развиваемых в топологическом подходе к распознаванию научной школы Ю.И. Журавлёва и К.В. Рудакова.
Результаты. Достоверные отличия в эффектах исследованных молекул были найдены для 1232 белков протеома человека. Выявлены особенности оценок взаимодействий исследованных молекул с 47 таргетными белками, которые наибольшим образом отличают эффекты молекулы RRS-1 от всех остальных. Соединение RRS-1 может активировать аденозиновые и дофаминовые рецепторы, каннабиноидный рецептор 2 и ГАМКА-рецептор в большей степени, чем другие молекулы (активация этих рецепторов соответствует противовоспалительному, антиноцицептивному и нейропротекторному эффектам). RRS-1 может предпочтительно ингибировать ряд провоспалительных белков, рецептор брадикинина 1, метаботропный глутаматный рецептор 5, матриксные металлопротеиназы 8, 9, 12 и фактор свертывания крови X. Дополнительно показано преимущественное ингибирование молекулой RRS-1 ряда киназ, таргетируемых в противоопухолевой и противовоспалительной терапии. RRS-1 меньше, чем другие исследованные молекулы, взаимодействовал с рецепторами витамина D3, гормона щитовидной железы, ацетилхолина, каннабиноидов и опиоидов, орексина, различных метаболических ферментов, что важно с точки зрения безопасности применения препартов на основе данной молекулы. Вещество RRS-1 отличалось умеренным профилем антивитаминного действия: суммарный балл потери витаминов и минералов (7,4±3,7) был существенно меньше, чем в случае диклофенака (11,7±4,5), и фактически был на одном уровне с нимесулидом (6,9±3,7) и кеторолаком (6,7±3,6).
Заключение. Хемореактомное и хемопротеомное профилирование молекулы-кандидата RRS-1 позволило получить доэкспериментальные оценки эффективности и безопасности через моделирование взаимодействий с протеомом человека
Ключевые слова
Для цитирования:
Галенко-Ярошевский П.А., Торшин И.Ю., Громов А.Н., Громова О.А., Суздалев К.Ф., Мурашко Р.А., Зеленская А.В., Задорожний А.В., Глечян Т.Р., Симавонян Г.В., Мухаммад Э.И. Дифференциальный хемопротеомный анализ молекулы-кандидата RRS-1 и молекул нескольких нестероидных противовоспалительных препаратов. ФАРМАКОЭКОНОМИКА. Современная фармакоэкономика и фармакоэпидемиология. 2024;17(3):324-336. https://doi.org/10.17749/2070-4909/farmakoekonomika.2024.265
For citation:
Galenko-Yaroshevsky P.A., Torshin I.Yu., Gromov A.N., Gromova O.A., Suzdalev K.F., Murashko R.A., Zelenskaya A.V., Zadorozhniy A.V., Glechyan T.R., Simavonyan G.V., Muhammad E.I. Differential chemoproteomic analysis of RRS-1 candidate molecule and molecules of several nonsteroidal anti-inflammatory drugs. FARMAKOEKONOMIKA. Modern Pharmacoeconomics and Pharmacoepidemiology. 2024;17(3):324-336. (In Russ.) https://doi.org/10.17749/2070-4909/farmakoekonomika.2024.265
ВВЕДЕНИЕ / INTRODUCTION
Нестероидные противовоспалительные препараты (НПВП), модулируя ноцицепцию и подавляя избыточные болевые реакции посредством регуляции активности каскада арахидоновой кислоты, используются для преодоления болевых синдромов различного генеза [1].
Для поиска и анализа молекул с требуемым мультитаргетным действием in silico необходимы методы прогнозирования свойств молекул исходя из их химической структуры. Фармакологические/биологические свойства молекул могут быть оценены посредством конгломерата методов хемоинформационного анализа, развиваемых в научной школе академиков РАН Ю.И. Журавлёва и К.В. Рудакова под общей рубрикой «хемореактомный анализ» [2]. Результатом его применения является комплексная, разносторонняя оценка фармакологических эффектов действующих начал лекарств (фармакоинформационные спектры, или профили молекул-кандидатов или препаратов) [3–5].
Цель – выявить и оценить наиболее существенные отличия молекулы-кандидата RRS-1 (N-{(Z)-2-(1-метил-1H-индол-3-ил)-1-[(пропиламино)карбонил]винил}бензамида) от других НПВП посредством дифференциального хемореактомного анализа.
МАТЕРИАЛ И МЕТОДЫ / MATERIAL AND METHODS
Исследованные молекулы / The studied molecules
Мимикрия молекул тех или иных действующих начал в контексте метаболом обусловливает желательные и побочные эффекты лекарственных препаратов [6]. Информационная технология хемоинформационного анализа, включающая сопоставление структуры молекулы-запроса с другими известными молекулами посредством топологической теории распознавания [7–9], позволяет оценить количественно и качественно схожесть молекулы с метаболитами и взаимодействия с протеомом. Молекулы, структуры которых были исследованы в настоящей работе, показаны на рисунке 1.
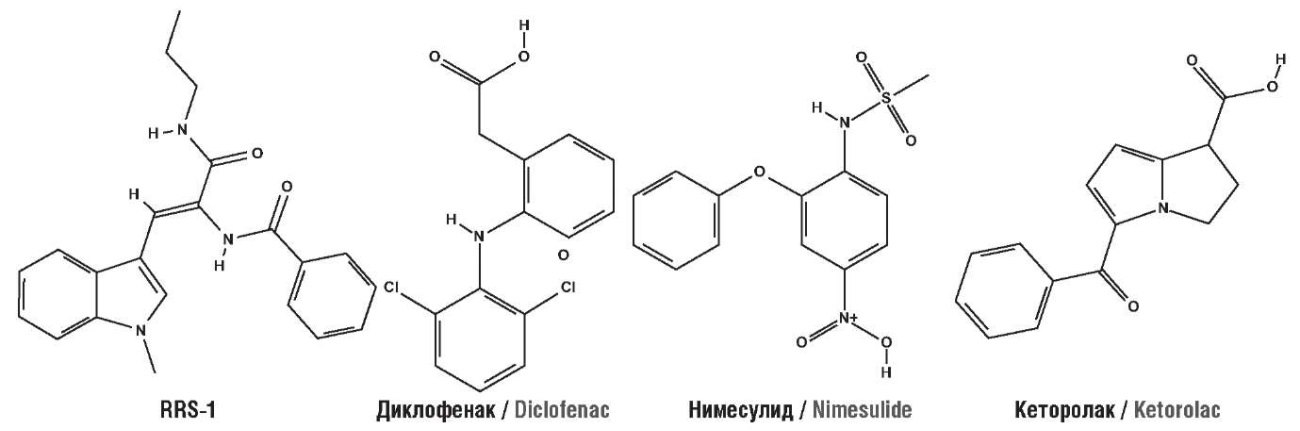
Рисунок 1. Химические формулы исследованных молекул
Figure 1. Chemical formulas of the studied molecules
Этапы хемореактомного анализа / Stages of chemoreactomic analysis
Как и в других наших работах по хемореактомике [1][3][4][8], анализ включал три стадии:
– формирование базы данных для обучения алгоритмов на основе ключевых слов (“nociception”, “dopamine”, “histamine”) и поисков в базе данных PubChem;
– нахождение в базе данных, сформированной на первой стадии, молекул, наиболее близких по структуре к молекулам-запросам (см. рис. 1) посредством расчета химического расстояния (dχ) по теории хемографов [7][8];
– вычисление констант полумаксимального ингибирования (англ. half-maximal inhibitory concentration, IC50) и полумаксимальной эффективной концентрации (англ. half-maximal effective concentration, EC50) белков протеома методами числового прогнозирования [10].
В рамках настоящей серии вычислительных экспериментов на один таргетный белок протеома приходилось в среднем 14 экспериментов.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ / RESULTS AND DISCUSSION
Результаты хемопротеомного профилирования четырех молекул со свойствами НПВП (RRS-1, диклофенак, нимесулид, кеторолак) на протеоме человека позволили оценить эффекты НПВП на дофаминовые, опиоидные, каннабиноидные, ацетилхолиновые, брадикининовые рецепторы и др.
Общий анализ профилей взаимодействия соединений с протеомом человека / General analysis of interaction profiles of compounds with human proteome
В рамках хемопротеомного профилирования изучаемых молекул проведен анализ взаимодействий молекул с белками протеома человека. Достоверные отличия в эффектах исследованных молекул были найдены для 1232 белков. Проценты белков протеома со схожим воздействием существенно отличались между молекулами (табл. 1).
Таблица 1. Белки протеома человека (на выборке из 1232 белков) со схожим воздействием каждой пары молекул, %
Table 1. Human proteome proteins (based on a sample of 1232 proteins) with similar effects of each pair of molecules, %
|
Молекула / Molecule |
RRS-1 |
Диклофенак / Diclofenac |
Нимесулид / Nimesulide |
Кеторолак / Ketorolac |
|
RRS-1 |
100 |
59 |
51 |
39 |
|
Диклофенак / Diclofenac |
59 |
100 |
43 |
64 |
|
Нимесулид / Nimesulide |
51 |
43 |
100 |
58 |
|
Кеторолак / Ketorolac |
39 |
64 |
58 |
100 |
На метрической диаграмме (рис. 2) каждому соединению соответствует одна точка, которая, в свою очередь, отражает расстояния 1232-мерного вектора, содержащего взаимодействия соединения с выборкой белков протеома, от всех остальных векторов (точек). Видно, что взаимодействия соединения RRS-1 с выборкой белков протеома существенно отличаются от взаимодействий всех остальных молекул НПВП. При этом RRS-1 расположен правее вдоль обобщенной координаты свойств диклофенака, что соответствует более выраженному противовоспалительному действию молекулы RRS-1.
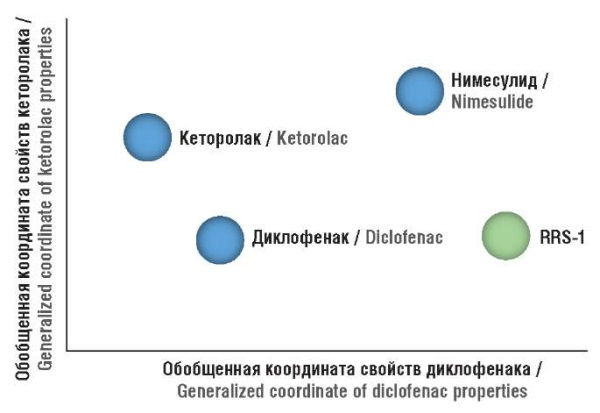
Рисунок 2. Метрическая диаграмма схожести профилей воздействия исследованных соединений на протеом человека. Диаграмма получена посредством проецирования 1232-мерных векторов для каждого соединения на плоскость. Чем больше расстояние между точками, тем больше различия в протеомных профилях соответствующих соединений. Значения координат не имеют физического числового выражения, диаграмма предназначена только для визуальной иллюстрации расстояния между соответствующими значениями
Figure 2. Metric diagram of similarity in the profiles of studied compound effects on human proteome. The diagram was obtained by projecting 1232-dimensional vectors onto a plane for each compound. The greater the distance between the points, the greater the differences in proteomic profiles of the corresponding compounds. The coordinate values do not have a physical numerical expression, the diagram is intended only to visually illustrate the distance between the corresponding values
Дифференциальный хемореактомный анализ / Differential chemoreactomic analysis
Из данных таблицы 1 следует, что профиль взаимодействия соединения RRS-1 с протеомом человека более схож с профилями диклофенака (59%) и нимесулида (51%), чем с профилем кеторолака (39%). Дифференциальный анализ результатов хемореактомного моделирования направлен на выявление биологических активностей (таргетных белков протеома человека), которые наиболее выраженно отличают молекулы друг от друга. В соответствии с целями настоящего исследования наиболее важным является нахождение отличий именно молекулы-кандидата RRS-1.
Результаты хемопротеомного моделирования позволили выявить такие различия в оценках взаимодействия исследованных молекул с рецепторами (рис. 3). Полученные оценки целесообразно разделить на три группы: оценки активации белков протеома, оценки ингибирования белков протеома и оценки минимальности вмешательства в активность белков протеома (прежде всего со стороны соединения RRS-1). Если первые две группы относятся к оценке эффективности исследованных молекул как потенциальных терапевтических средств, то третья имеет прямое отношение к безопасности (иными словами, лекарства не должны изменять активность белков, не имеющих отношения к патофизиологии соответствующего заболевания).
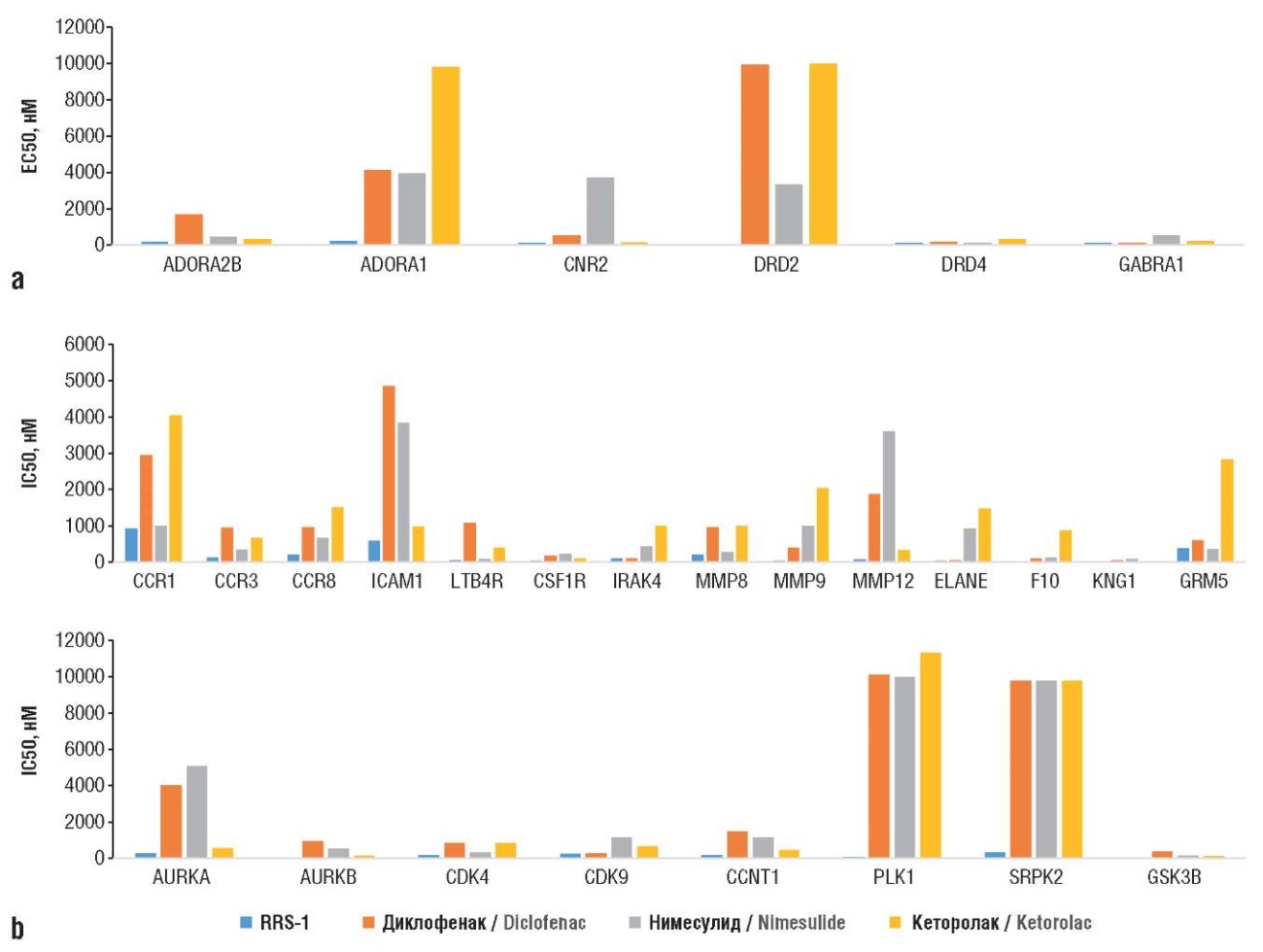
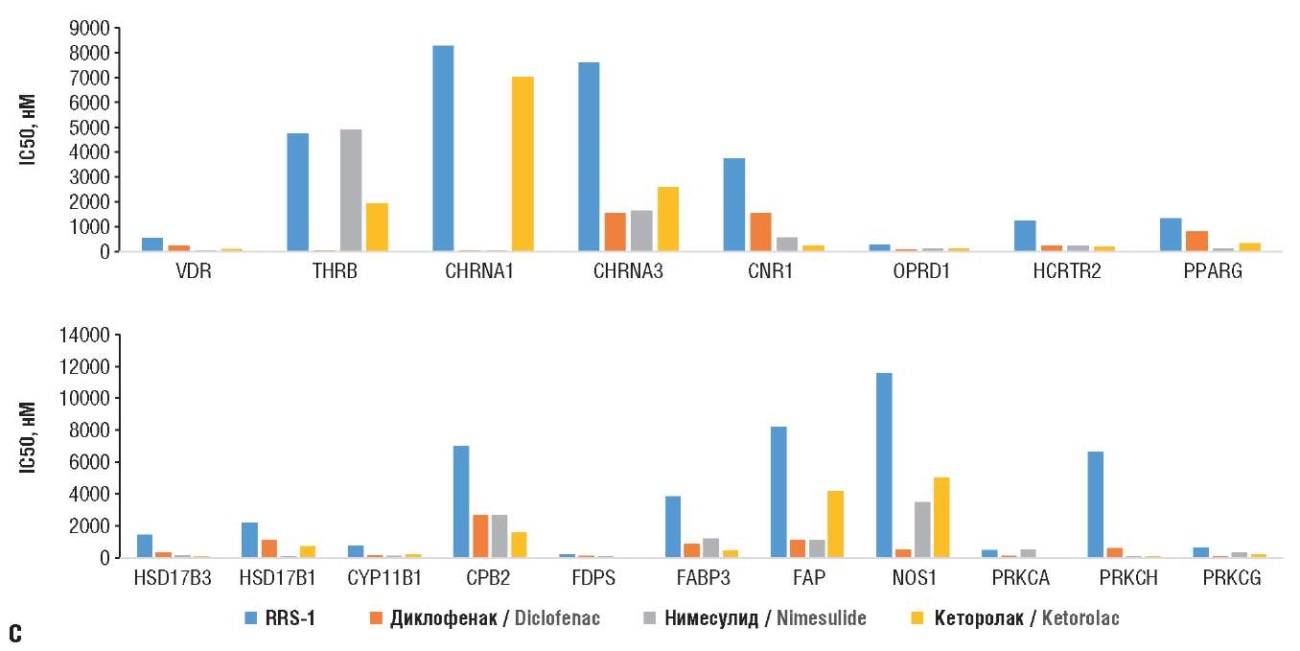
Рисунок 3. Хемопротеомные оценки различий (дифференциальный анализ) в протеомных профилях исследованных соединений:
а – активация белков протеома человека;
b – ингибирование белков протеома.
ADORA2В (англ. аdenosine 2В receptor) – рецептор аденозина 2В; ADORA1 (англ. аdenosine A1 receptor) – рецептор аденозина А1; CNR2 (англ. cannabinoid receptor 2) – каннабиноидный рецептор 2; DRD2 (англ. dopamine receptor D2) – рецептор дофамина D2; DRD4 (англ. dopamine receptor D4) – рецептор дофамина D4; GABRA1 (англ. GABA type A1 receptor subunit) – субъединица альфа-1 рецептора ГАМК; CCR1 (англ. C-C chemokine receptor type 1) – C-C-рецептор хемокина 1; CCR2 (англ. C-C chemokine receptor type 2) – C-C-рецептор хемокина 2; CCR8 (англ. C-C chemokine receptor type 8) – C-C-рецептор хемокина 8; ICAM1 (англ. intercellular adhesion molecule 1) – молекула межклеточной адгезии 1; LTB4R (англ. leukotriene B4 receptor) – рецептор лейкотриена В4; CSF1R (англ. colony stimulating factor 1 receptor) – рецептор колониестимулирующего фактора 1; IRAK4 (англ. interleukin-1 receptor-associated kinase 4) – киназа 4, ассоциированная с рецептором интерлейкина-1; MMP8 (англ. matrix metalloproteinase-8) – матриксная металлопротеиназа-8; MMP9 (англ. matrix metalloproteinase-9) – матриксная металлопротеиназа-9; MMP12 (англ. matrix metalloproteinase-12) – матриксная металлопротеиназа-12; ELANE (англ. neutrophil elastase) – эластазa нейтрофилов; F10 (англ. recombinant coagulation factor X) – рекомбинантный фактор свертывания крови X; KNG1 (англ. kininogen 1) – кининоген 1; GRM5 (англ. glutamate metabotropic receptor 5) – глутаматный метаботропный рецептор 5; AURKA (англ. aurora kinase A) – аврора киназа А; AURKB (англ. aurora kinase B) – аврора киназа B; CDK4 (англ. cyclin dependent kinase 4) – циклинзависимая киназа 4; CDK9 (англ. cyclin dependent kinase 9) – циклинзависимая киназа 9; CCNT1 (англ. cyclin T1) – циклин T1; PLK1 (англ. polo-like kinase 1) – поло-подобная киназа 1; SRPK2 (англ. serine/threonine protein-specific kinase 2) – cерин/треониновая протеинкиназа 2 SR; GSK3B (англ. glycogen synthase kinase-3 beta) – киназа гликогенсинтазы-3 бета
с – минимальное вмешательство соединения RRS-1 в белки протеома.
VDR (англ. vitamin D receptor) – рецептор витамина D; THRB (англ. thyroid hormone receptor beta) – бета-рецептор гормонов щитовидной железы; CHRNA1 (англ. cholinergic receptor nicotinic alpha 1 subunit) – aльфа-1-субъединица никотинового холинергического рецептора; CHRNA3 (англ. cholinergic receptor nicotinic alpha 3 subunit) – aльфа-3-субъединица никотинового холинергического рецептора; CNR1 (англ. cannabinoid receptor 1) – каннабиноидный рецептор 1; OPRD1 (англ. opioid receptor delta 1) –опиоидный рецептор дельта 1; HCRTR2 (англ. hypocretin receptor type 2) – рецептор гипокретина 2; PPARG (англ. peroxisome proliferator-activated receptor gamma) – гамма-рецептор, активируемый пролифератором пероксисом; HSD17B3 (англ. hydroxysteroid 17-beta dehydrogenase 3) – гидроксистероид 17-бета-дегидрогеназа 3; HSD17B1 (англ. hydroxysteroid 17-beta dehydrogenase 1) – гидроксистероид 17-бета-дегидрогеназа 1; CYP11B1 (англ. cytochrome P450 11B1) – цитохром P450 11B1; CPB2 (англ. carboxypeptidase B2) – карбоксипептидаза В2; FDPS (англ. farnesyl diphosphate synthase) – фарнезилдифосфатсинтаза; FABP3 (англ. fatty acid binding protein 3) – белок, связывающий жирные кислоты 3; FAP (англ. fatty acid photodecarboxylase) – фотодекарбоксилаза жирных кислот; NOS1 (англ. nitric oxide synthase 1) – cинтаза оксида азота 1; PRKCA (англ. protein kinase C-alpha) – протеинкиназа С-aльфа; PRKCH (англ. protein kinase C-eta) – протеинкиназа С-эта;
PRKCG (англ. protein kinase C-gamma) – протеинкиназа С-гамма
Figure 3. Chemoproteomic assessments of differences (differential analysis) in proteomic profiles of the studied compounds:
а – activation of human proteome proteins;
b – inhibition of proteome proteins.
ADORA2В – аdenosine 2В receptor; ADORA1 – аdenosine A1 receptor; CNR2 – cannabinoid receptor 2; DRD2 – dopamine receptor D2; DRD4 – dopamine receptor D4; GABRA1 – GABA type A1 receptor subunit; CCR1 – C-C chemokine receptor type 1; CCR2 – C-C chemokine receptor type 2; CCR8 – C-C chemokine receptor type 8; ICAM1 – intercellular adhesion molecule 1; LTB4R – leukotriene B4 receptor; CSF1R – colony stimulating factor 1 receptor; IRAK4 – interleukin-1 receptor-associated kinase 4; MMP8 – matrix metalloproteinase-8; MMP9 – matrix metalloproteinase-9; MMP12 – matrix metalloproteinase-12; ELANE – neutrophil elastase; F10 – recombinant coagulation factor X; KNG1 – kininogen 1; GRM5 – glutamate metabotropic receptor 5; AURKA – aurora kinase A; AURKB – aurora kinase B; CDK4 – cyclin dependent kinase 4; CDK9 – cyclin dependent kinase 9; CCNT1 – cyclin T1; PLK1 – polo-like kinase 1; SRPK2 – serine/threonine protein-specific kinase 2; GSK3B – glycogen synthase kinase-3 beta
с – minimal interference of RRS-1 compound in proteome proteins.
VDR – vitamin D receptor; THRB – thyroid hormone receptor beta; CHRNA1 – cholinergic receptor nicotinic alpha 1 subunit; CHRNA3 – cholinergic receptor nicotinic alpha 3 subunit; CNR1 – cannabinoid receptor 1; OPRD1 – opioid receptor delta 1; HCRTR2 – hypocretin receptor type 2; PPARG – peroxisome proliferator-activated receptor gamma; HSD17B3 – hydroxysteroid 17-beta dehydrogenase 3; HSD17B1 – hydroxysteroid 17-beta dehydrogenase 1; CYP11B1 – cytochrome P450 11B1; CPB2 – carboxypeptidase B2; FDPS – farnesyl diphosphate synthase; FABP3 – fatty acid binding protein 3; FAP – fatty acid photodecarboxylase; NOS1 – nitric oxide synthase 1; PRKCA – protein kinase C-alpha; PRKCH – protein kinase C-eta; PRKCG – protein kinase C-gamma
Активация белков протеома
Хемореактомный анализ молекул-запросов (см. рис. 1) указал на участие активации аденозиновых, каннабиоидных, дофаминовых рецепторов протеома в противодействии молекулы RRS-1 патофизиологии боли и воспаления. Аденозин характеризуется противовоспалительным и нейропротекторным эффектами. Реализация биологических эффектов аденозина осуществляется посредством аденозиновых рецепторов A1, A2a, A2b и A3, контролирующих состояние сосудов в сердечно-сосудистой и цереброваскулярной системах. Активация A1-рецепторов снижает частоту сердечных сокращений, а активация A2-рецепторов улучшает кровоток и снижает артериальное давление. Сокращение активности аденозина приводит к увеличенной глутаматной нейротрансмиссии. Вещества с анальгетическим действием на мышиной модели хронической нейропатической боли индуцируют антиноцицепцию посредством активации аденозиновых рецепторов типа A2A [11].
Интересно отметить, что у крыс с артритом, вызванным адъювантом Фрейнда, мануальная акупунктура облегчает воспалительную боль именно посредством активации аденозиновых рецепторов [12]. Для аденозинового рецептора типа А2 значение константы активации ЕС50 составило 178 нМ для RRS-1, а для остальных молекул показатели были существенно выше (325–1697 нМ). Для аденозинового рецептора А1 значение ЕС50 составило 183 нМ, для остальных молекул – на порядок выше (3953–9820 нМ).
Каннабиноидный рецептор-2 активируется эндоканнабиноидом 2-арахидоноилглицерином, модулирующим ноцицепцию [13] и тормозящим нейродегенерацию [14]. Молекулы RRS-1 (ЕС50 124 нМ) и кеторолак (ЕС50 156 нМ) могут активировать СВ2 (другие молекулы-запросы: 513–3695 нМ).
Дофаминовый рецептор D2 опосредует анальгетический эффект, вызываемый нисходящим дофаминергическим путем, в модели нейропатической боли при поражении тройничного нерва у мышей. Специфическое возбуждение дофаминергических нейронов в ядре А11 ослабляло нейропатическую боль тройничного нерва за счет активации рецепторов D2 в каудальном ядре тройничного нерва спинного мозга [15]. Из исследованных молекул только для RRS-1 была получена значимая оценка активации D2-рецепторов (ЕС50 49 нМ; остальные молекулы: 3323–9989 нМ). Молекулы RRS-1 и диклофенак могут активировать рецептор гамма-аминомасляной кислоты А (ГАМКА) (ЕС50 86 и 93 нМ; другие молекулы: 192 и 530 нМ), реализующий эффекты основного тормозного нейромедиатора центральной нервной системы.
Ингибирование белков протеома
RRS-1 может ингибировать рецепторы хемокинов типа С-С (CCR1), лейкотриена LTB4, глутамата и другие белки, так или иначе участвующие в воспалении. Дополнительно RRS-1 – потенциальный антагонист киназ, используемых как таргетные белки противоопухолевой фармакотерапии.
Рецепторы хемокинов типа CCR, активируемые хемокинами типа MCP-3/4/RANTES/MIP-1 способствуют воспалению [16]. RRS-1 ингибирует CCR1 (IC50 932 нМ; диклофенак: 2947 нМ; кеторолак: 4044 нМ), CCR3 (IC50 121 нМ; другие молекулы: 345–949 нМ) и CCR8 (IC50 215 нМ; другие молекулы: 674–1508 нМ).
Молекула межклеточной адгезии интегрин альфа-L/бета-2 (ICAM1) – лиганд белка адгезии лейкоцитов интегрин альфа-L/бета-2. Во время трансэндотелиальной миграции лейкоцитов активность ICAM1 способствует этому посредством белок-белковых комплексов ARHGEF26/SGEF/RHOG [17], также приводя к инвазии вирусов внутрь клеток организма-хозяина [18]. RRS-1 ингибировал белок ICAM1 (IC50 578 нМ; другие молекулы: 983–4851 нМ). Ингибируя CSF-1R (IC50 29 нМ; другие молекулы: 99–223 нМ), RRS-1 может способствовать снижению пролиферации макрофагов и моноцитов [19] и тормозить нейродегенерацию [20].
RRS-1 и диклофенак (IC50 100 нМ; другие молекулы: 432 и 992 нМ) ингибировали киназу IRAK4, участвующую в реализации эффектов толл-рецепторов и рецептора интерлейкина-1 [21] посредством транскрипционного ядерного фактора каппа В (англ. nuclear factor kappa B, NF-κB) [21].
RRS-1 может ингибировать матриксные металлопротеиназы (англ. matrix metalloproteinase, MMP), деградирующие коллагено-эластиновую компоненту соединительной ткани сосудов, облегчая инвазию лейкоцитов: MMP8 (IC50 203 нМ; нимесулид: 270 нМ; другие: 950–1000 нМ). Коллагеназа (MMP9), необходимая для протеолиза внеклеточного матрикса, способствует инвазии лейкоцитов (RRS-1: IC50 39 нМ; остальные: 401–2037 нМ). MMP12 также преимущественно ингибируется RRS-1 (IC50 75 нМ; другие: 328–3602 нМ). RRS-1 может ингибировать лейкоцитарную эластазу (IC50 38 нМ), участвующую в патофизиологии воспалительных заболеваний, в т.ч. эмфиземы [22]. Важным аспектом действия RRS-1 может являться ингибирование рецептора LTB4 (IC50 49 нМ; нимесулид: 85 нМ; другие: 1081 и 402 нМ).
Дополнительно были получены оценки возможных эффектов RRS-1 на фактор свертывания крови и на метаботропный глутаматный рецептор 5. Фактор коагуляции крови Х – витамин К-зависимый гликопротеиновый фермент, превращающий протромбин в тромбин (IC50 26 нМ; остальные: 108–867 нМ). Гиперактивность метаботропного рецептора глутамата 5 – фактор патофизиологии ишемии головного мозга, воспаления, ноцицепции [23]. RRS-1 и нисмесулид (IC50 360–380 нМ) ингибировали метаботропный рецептор более, чем диклофенак (IC50 608 нМ) и кеторолак (IC50 2824 нМ).
По данным моделирования белок-лигандных комплексов методологией докинга молекулы RRS-1 может связываться с метаботропным глутаматным рецептором с энергией связывания, в 2 раза большей, чем ранее исследованная молекула SV-1010. Хемореактомное моделирование константы IC50 для метаботропного рецептора глутамата 5 подтвердило, что значение IC50 для RRS-1 существенно ниже (378 нМ), чем для SV-1010 (2320 нМ). Данное различие в значениях констант приблизительно соответствует двукратной разнице в изменении свободной энергии связывания Гиббса.
Рецептор брадикинина 1 связывает брадикинин и другие кининогены, способствуя высвобождению других медиаторов воспаления. Антагонисты рецепторов брадикинина рассматриваются как перспективные средства для лечения острых эпизодов отека и воспаления. RRS-1 и кеторолак ингибировали этот рецептор в большей степени (IC50 24 нМ), чем две другие молекулы (IC50 52–85 нМ).
Ингибирование киназ
Аврора киназа А (AURKА) участвует в регуляции клеточного цикла, требуется для активации циклинзависимой киназы CDK1 [24] и является регуляторным компонентом путей p53/TP53, имеющих решающее значение для онкогенной трансформации клеток. Ингибиторы AURKА – перспективные противоопухолевые лекарства [25]. Из исследованных молекул наилучшим ингибитором AURKA было соединение RRS-1 (IC50 275 нМ; остальные: 548–5084 нМ).
Аврора киназа B (AURKB) играет роль в развитии клеточного цикла, сверхэкспрессия связана с инвазией опухолевых клеток, метастазированием и устойчивостью к лекарствам. Ингибиторы AURKB – также перспективные противоопухолевые средства [26]. Вещество RRS-1 наилучшим образом ингибировало AURKB (IC50 34 нМ; другие молекулы: 150–923 нМ).
Ингибиторы CDK4 исследуются как противоопухолевые препараты [27]. RRS-1 отличался наименьшей константой ингибирования среди изученных молекул (IC50 164 нМ; остальные молекулы: 320–805 нМ). Циклинзависимая киназа CDK9, опосредующая внутриклеточную передачу сигналов от рецепторов фактора некроза опухоли альфа или интерлейкина-6 через каскады NF-κB/STAT3 [28], также ингибируется веществом RRS-1 и диклофенаком (IC50 221 и 264 нМ) в большей степени, чем нимесулид (IC50 1127 нМ) и кеторолак (IC50 664 нМ). Ингибирование CDK9 способствовало уменьшению потери костной массы пародонта и воспалительной реакции, вызванной бактериями P. gingivalis и приводящей к пародонтиту [29]. Для регуляторной субъединицы CDK9 (реализация эффектов CDK9, транскрипция вирусных генов [30]) значение IC50 для RRS-1 составило 178 нМ, для остальных молекул – 458–1492 нМ.
Серин/треонин-протеинкиназа PLK1 во время М-фазы цикла деления клетки участвует в регуляции созревания центросом, сборке веретена, удалении когезинов из плеч хромосом, инактивации комплекса/циклосомы, способствует активации CDK1 путем фосфорилирования положительного регулятора CDC25C и ингибирования отрицательных регуляторов WEE1 и PKMYT1/MYT1 [31]. RRS-1 ингибировал PLK1-киназу существенно больше (IC50 65 нМ), чем остальные молекулы (отличие на два порядка: 9994–11339 нМ). Провоспалительные серин/треонин-протеинкиназа SRPK2 [32] (RRS-1: IC50 322 нМ; другие молекулы: 9770–9900 нМ) и киназа GSK-3β [33] (RRS-1: IC50 44 нМ; другие молекулы: 85–376 нМ) также ингибировались RRS-1.
Минимальность вмешательства в активность белков протеома
Как было отмечено выше, минимизация вмешательства молекул-кандидатов в активность очевидно нетаргетных белков соответствует минимизации побочных эффектов исследуемых молекул. С этой точки зрения чем слабее взаимодействия молекулы RRS-1 с различными гормональными рецепторами (кальциферола, тиреоидных гормонов, ацетилхолина, орексина и др.), тем выше безопасность лекарства.
Рецептор витамина D3 (VDR) реализует эффекты кальцитриола (активной формы витамина) посредством прямого воздействия на транскрипцию тысяч генов. Ингибирование VDR нежелательно, т.к. приводит к функциональному дефициту витамина [34]. RRS-1 оказывал наименьшее влияние на активность VDR (521 нМ; остальные молекулы: 53–220 нМ).
Бета-рецептор гормона щитовидной железы действует как репрессор или активатор транскрипции генов. Рецептор характеризуется высоким сродством к гормонам щитовидной железы, включая трийодтиронин и тироксин [35]. RRS-1 практически не влиял на активность этого рецептора (4757 нМ).
Вмешательство со стороны противовоспалительных средств в ацетилхолиновую нейротрансмиссию (особенно ингибирование, в т.ч. рецептора α/β/δ/γ AChR1 [36]) крайне нежелательно. RRS-1 практически не влиял на активность рецептора AChR1 (8265 нМ), а также рецептора CHRNA3 (7616 нМ; остальные молекулы: 1543–2590 нМ).
Каннабиноидный рецептор CNR1, связанный с G-белком, необходим для эндогенных каннабиноидов анандамида и 2-арахидоноилглицерина [37]. Он опосредует многие эффекты, вызванные каннабиноидами, влияя среди прочего на прием пищи, моторику желудочно-кишечного тракта, потерю памяти, каталепсию, подвижность, тревогу, хроническую боль, усиливая дыхание при низких дозах и угнетая при высоких [37]. Воздействие обезболивающих средств на CNR1 никак не может быть ингибирующим. По результатам хемореактомного анализа RRS-1 практически не влиял на активность (3739 нМ; другие молекулы: 219–537 нМ). Хемореактомный анализ показал минимальность воздействия RRS-1 на ноцицептивный опиоидный рецептор дельта [38] (286 нМ; остальные молекулы: 64–130 нМ) и рецепторов орексинов [39], влияющих на цикл сна-бодрствования и уровни гистамина в центральной нервной системе (1232 нМ; остальные молекулы: 199–220 нМ).
Рецептор активаторов пролиферации пероксисом гамма (PPARG) связывает пролифераторы пероксисом (особые жирные кислоты или гиполипидемические препараты), модулируя затем транскрипцию своих генов-мишеней, в пероксисомальном бета-окислении жирных кислот и воспалении через каскад NF-κB [40]. Среди исследованных молекул RRS-1 в наименьшей степени влиял на PPARG (1329 нМ; нимесулид: 136 нМ).
Также для исследованных молекул были получены оценки взаимодействий с различными метаболическими ферментами. Например, 17β-гидроксистероиддегидрогеназа-3 необходима для восстановления андростендиона до тестостерона с использованием кофермента никотинамидадениндинуклеотидфосфат (витамин РР) [41]. RRS-1 слабо вмешивался в активность данного фермента (1437 нМ; другие молекулы: 95–280 нМ).
Эстрадиол-17β-дегидрогеназа-1 способствует снижению уровня эстрогенов и андрогенов с использованием кофермента никотинамидадениндифосфат (витамин РР). RRS-1 наименьшим образом влиял на активность фермента (2177 нМ; другие молекулы: 49–1000 нМ).
Цитохром P450 11B1 (CYP11B1) проявляет стероидную 11β-гидроксилазную активность, осуществляя 18/19-гидроксилирование стероидов и ароматизацию андростендиона в эстрон. Вмешательство в активность этого фермента очевидным образом приведет к нарушению баланса андрогенов и эстрогенов. RRS-1 влиял на активность CYP11B1 гораздо слабее (747 нМ; другие молекулы: 127–218 нМ). RRS-1 также не влиял на активность карбоксипептидазы CPB2 (деактивирует кинины [42] (6985 нМ; другие молекулы: 1600–2700 нМ) и фарнезилдифосфатсинтазы – ключевого фермента биосинтеза изопреноидов (160 нМ; остальные молекулы: 20–100 нМ). RRS-1 слабо влияет на белок связывания жирных кислот FABP3 (3807 нМ; другие молекулы: 450–1190 нМ) и белок активации фибробластов [43] (8193 нМ; другие молекулы: 1133–4100 нМ).
Нейрональная синтаза оксида азота (NO) вырабатывает NO в мозге и является молекулой-мессенджером, выполняющей разнообразные функции. В мозге и периферической нервной системе NO проявляет многие свойства нейромедиатора, также опосредует посттрансляционную модификацию (S-нитрозилирование цистеина). Активность нейрональной NO-синтазы практически не затрагивалась RRS-1 (11 577 нМ), в отличие, например, от диклофенака (493 нМ).
Важно, что молекула-кандидат RRS-1 слабо взаимодействует с рядом протеинкиназ – центральных сигнальных белков любой клетки, участвующих в регуляции пролиферации, апоптоза, дифференцировки, миграции и адгезии клеток [44]. Протеинкиназа С-альфа: RRS-1 и нимесулид (480–500 нМ) в меньшей степени воздействовали на активность киназы, чем две другие молекулы (40 и 124 нМ). Протеинкиназа C-эта [45]: RRS-1 практически не влиял (6667 нМ; другие молекулы: 88–574 нМ). Протеинкиназа С-гамма модулирует активность опиоидных рецепторов мю-типа, участвуя в сигнальном пути, который приводит к фосфорилированию и деградации опиоидных рецепторов, и может также способствовать хроническим изменениям опиоидной ноцицепции [46]. Нарушение активности такого важного сигнального белка приведет к дисбалансу регуляции ноцицепции. RRS-1 вмешивался наименьшим образом (612 нМ), в отличие, например, от диклофенака (86 нМ).
Хемореактомное моделирование экспериментальных эффектов НПВП in vivo / Chemoreactomic modeling of NSAID experimental effects in vivo
Описанное выше модулирование активности таргетных белков протеома человека соответствует снижению интенсивности ноцицептивных сигналов, а слабое вмешательство НПВП в адренергическую и другие нейротрансмиттерные системы соответствует снижению центральных побочных эффектов. Хемореактомное моделирование (табл. 2) подтвердило эффекты молекул на протеоме человека (вообще говоря, in vitro) с точки зрения экспериментальных исследований изученных молекул у мышей (in vivo).
Таблица 2. Результаты хемореактомного моделирования противоболевых эффектов in vivo у мышей для разных моделей боли
Table 2. Results of chemoreactome modeling of analgesic effects in vivo in mice for different pain models
|
Эксперимент / Experiment |
Константа / Constant |
Единицы / Units |
RRS-1 |
Диклофенак / Diclofenac |
Нимесулид / Nimesulide |
Кеторолак / Ketorolac |
|
Антиноцицептивная активность соединения, вводимого подкожно, на корчи, вызванные уксусной кислотой / Antinociceptive activity of a compound administered subcutaneously on acetic acid-induced writhing |
ED50 |
мг/кг // mg/kg |
0,160 |
1,020 |
0,898 |
0,155 |
|
Анальгетическая активность с помощью анализа «щипка хвоста» / Analgesic activity according to tail pinch test |
ED50 |
мг/кг // mg/kg |
5,976 |
7,870 |
5,057 |
7,733 |
|
Антиноцицептивная активность с помощью теста на судороги брюшной полости, вызванные ацетилхолином, с последующим подкожным введением вещества / Antinociceptive activity according to the acetylcholine-induced abdominal cramp test followed by subcutaneous administration of the substance |
ED50 |
мг/кг // mg/kg |
0,221 |
0,278 |
0,257 |
0,576 |
|
Антиноцицептивная активность с использованием теста отдергивания хвоста при подкожном введении / Antinociceptive activity according to the tail flick test upon subcutaneous administration |
ED50 |
мг/кг // mg/kg |
2,389 |
2,200 |
8,627 |
8,670 |
|
Анальгетическая активность (подкожно) через 30 мин при использовании тепловой модели боли / Analgesic activity (subcutaneously) after 30 min according to the thermal pain model |
ED50 |
мг/кг // mg/kg |
0,402 |
0,482 |
0,532 |
0,601 |
|
Анальгетическая активность (подкожно) на корчах с фенилхиноном / Analgesic activity (subcutaneously) on writhing with phenylquinone |
ED50 |
мг/кг // mg/kg |
7,019 |
15,720 |
7,022 |
14,990 |
|
Антиноцицептивная активность как ингибирование сужения брюшной полости, индуцированного уксусной кислотой (доза 40 мг/кг перорально за 30 ми), начиная с 5 мин после инъекции уксусной кислоты по сравнению с контролем // Antinociceptive activity assessed by inhibition of abdominal contraction induced by acetic acid (40 mg/kg orally for 30 min) ranging from 5 min after acetic acid injection relative to control |
– |
% |
47,860 |
32,070 |
38,920 |
23,060 |
Примечание. ED50 (англ. half-maximal effective dose) – полумаксимальная эффективная доза.
Note. ED50 – half-maximal effective dose.
Хемореактомное моделирование результатов экспериментальных исследований изученных молекул у мышей показало, что в тесте антиноцицептивной активности на корчах, вызванных уксусной кислотой, значение ED50 было наименьшим для RRS-1 (0,159 мг/кг) и кеторолака (0,16 мг/кг), чем у других молекул (0,9–1,0 мг/кг). Схожие результаты получены для RRS-1 для антиноцицептивной активности с помощью теста на судороги брюшной полости, вызванные ацетилхолином (ED50 0,22 мг/кг; другие молекулы: 0,26–0,57 мг/кг), на тепловой модели боли (ED50 0,40 мг/кг; другие молекулы: 0,48–0,60 мг/кг) и в модели с уксусной кислотой (ED50 48%; другие молекулы: 23,38%).
Антивитаминная и антиминеральная активность / Antivitamin and antimineral activity
Еще одним аспектом безопасности молекул-кандидатов является их влияние на обмен витаминов и минералов – ключевых регуляторов метаболизма клеток и тканей. Патофизиология самых различных заболеваний включает ятрогенные эффекты ряда лекарств, в т.ч. стимулирование ими интенсивных потерь витаминов и микроэлементов (минералов). Фармакоинформационные профили исследуемых соединений указали на существенные различия в их антивитаминном действии (рис. 4).
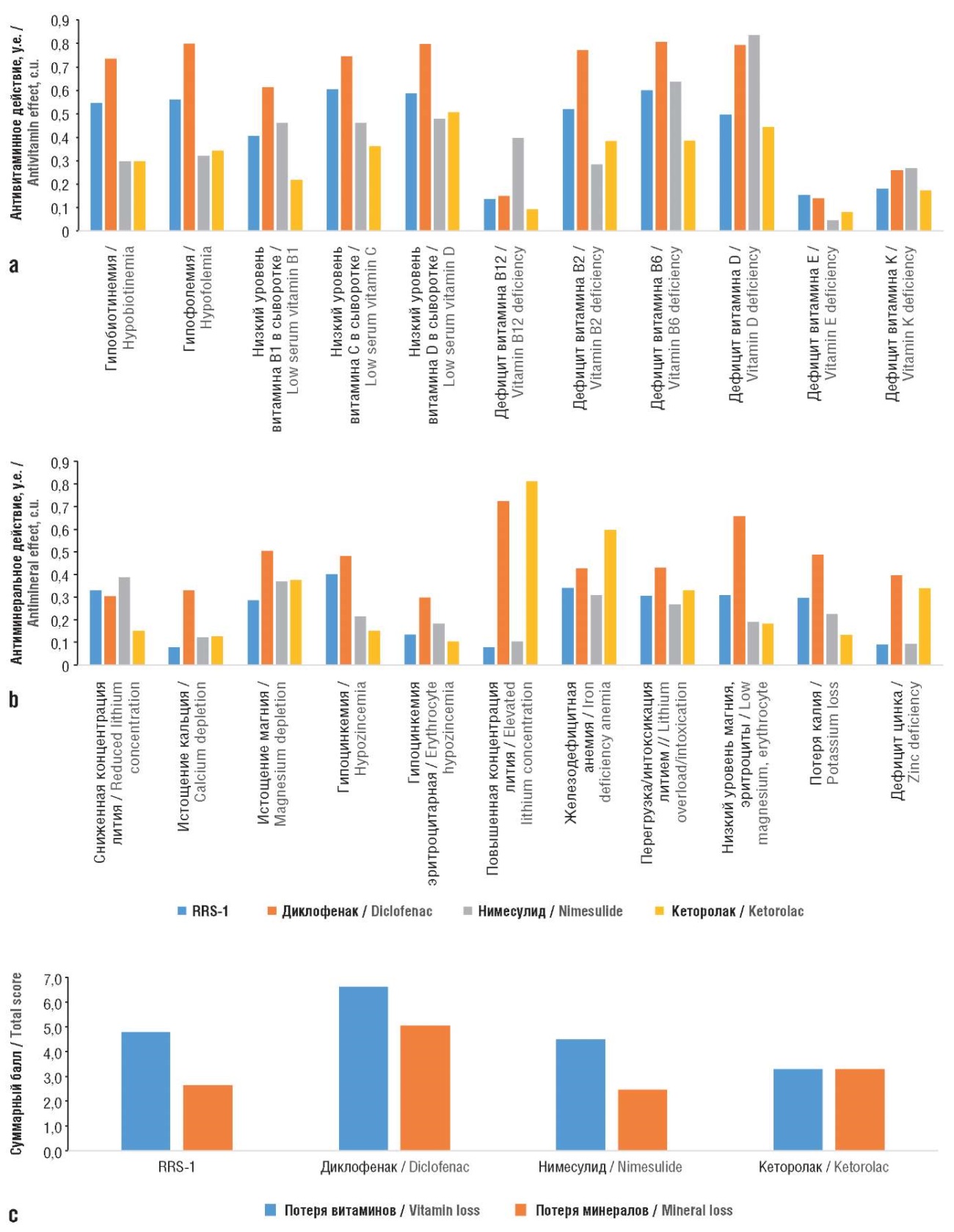
Рисунок 4. Оценки антивитаминных и антиминеральных свойств исследованных молекул:
а – антивитаминное действие; b – антиминеральное действие, c – суммарные баллы
Figure 4. Evaluation of antivitamin and antimineral properties of the studied molecules:
a – antivitamin effect; b – antimineral effect, c – total scores
Наиболее выраженным антимикронутриентным действием характеризовался диклофенак, который может стимулировать выведение цинка, калия, магния, витаминов группы В (биотина, В1, В2, В6, фолатов), витаминов С и D. Вещество RRS-1 отличалось умеренным профилем антивитаминного действия: суммарный балл потери витаминов и минералов (7,4±3,7) был существенно меньше, чем в случае диклофенака (11,7±4,5) и фактически был на одном уровне с нимесулидом (6,9±3,7) и кеторолаком (6,7±3,6).
Суммарный балл RRS-1 по всем витаминам и минералам составил 7,4, что соответствует в среднем увеличению риска выведения того или иного микронутриента приблизительно на 35%. В наименьшей степени RRS-1 может стимулировать потери Ca2+, Zn2+ из эритроцитов, витаминов B12, Е, К. Он может умеренно усиливать потери Li+, Fe2+, Zn2+ из цельной крови, витаминов D3, B6, С из сыворотки. Соответственно, дополнение терапии RRS-1 перечисленными микронутриентами в физиологических дозах снизит риск их потерь практически до нуля.
ЗАКЛЮЧЕНИЕ / CONCLUSION
Хемопротеомное моделирование фармакологических эффектов перспективной молекулы RRS-1 в сравнении с известными НПВП (диклофенак, нимесулид, кеторолак) на протеоме человека показало достоверные отличия в эффектах взаимодействий с 1232 белками протеома. Результаты позволили выявить 47 таргетных белков, которые наиболее выраженно отличают эффекты молекулы RRS-1 от всех остальных. RRS-1 способен:
– активировать рецепторы аденозина, дофамина, каннабиноидов, ГАМК, внося вклад в противовоспалительный, антиноцицептивный, нейропротекторный эффекты;
– ингибировать провоспалительные таргетные белки (CCR1, CCR3, CCR8, рецепторы LTB4, колониестимулирующий фактор макрофагов);
– ингибировать ряд киназ – таргетов противоопухолевой и противовоспалительной терапии (AURKA, AURKB, CDK4, CDK9, PLK1, SRPK2, GSK3B).
Вещество RRS-1 отличается умеренным профилем антивитаминного действия и не вмешивается в активность исследованных гормональных рецепторов (кальциферола, тиреоидных гормонов и др.).
Таким образом, хемопротеомное и хемореактомное профилирование молекулы-кандидата RRS-1 указывает на дополнительные молекулярно-фармакологические свойства, в меньшей степени выраженные у молекул сравнения. Эти свойства могут способствовать усилению противоболевых эффектов соединения у определенных групп пациентов.
Список литературы
1. Громова О.А., Торшин И.Ю., Путилина М.В. и др. Хемореактомный анализ центральных механизмов нестероидных противовоспалительных препаратов. Журнал неврологии и психиатрии им. С.С. Корсакова. 2020; 120 (1): 70–7. https://doi.org/10.17116/jnevro202012001170.
2. Торшин И.Ю., Громова О.А. Экспертный анализ данных в молекулярной фармакологии. М.: МЦНМО; 2012: 747 с.
3. Торшин И.Ю., Громова О.А., Федотова Л.Э., Громов А.Н. Сравнительный хемореактомный анализ декскетопрофена, кетопрофена и диклофенака. Неврология, нейропсихиатрия, психосоматика. 2018; 10 (1): 47–54. http://doi.org/10.14412/2074-2711-2018-1-47-54.
4. Торшин И.Ю., Громова О.А., Стаховская Л.В., Семёнов В.А. Хемореактомный анализ молекул толперизона, тизанидина и баклофена: холинолитические, спазмолитические и анальгетические механизмы действия. Неврология, нейропсихиатрия, психосоматика. 2018; 10 (4): 72–80. http://doi.org/10.14412/2074-2711-2018-4-72-80.
5. Торшин И.Ю. О задачах оптимизации, возникающих при применении топологического анализа данных к поиску алгоритмов прогнозирования с фиксированными корректорами. Информатика и еe применения. 2023; 17 (2): 2–10. http://doi.org/10.14357/19922264230201.
6. Trshin I.Yu. Sensing the change: from molecular genetics to personalized medicine. NY: Nova Science Pub Inc; 2012: 366 pp.
7. Torshin I.Y., Rudakov K.V. On the application of the combinatorial theory of solvability to the analysis of chemographs. Part 1: Fundamentals of modern chemical bonding theory and the concept of the chemograph. Pattern Recognit Image Anal. 2014; 24 (1): 11–23. http://doi.org/10.1134/s1054661814010209.
8. Torshin I.Y., Rudakov K.V. On the application of the combinatorial theory of solvability to the analysis of chemographs. Part 2: Local completeness of invariants of chemographs in view of the combinatorial theory of solvability. Pattern Recognit Image Anal. 2014; 24 (2): 196–208. https://doi.org/10.1134/S1054661814020151.
9. Torshin I.Y. The study of the solvability of the genome annotation problem on sets of elementary motifs. Pattern Recognit Image Anal. 2011; 21 (4): 652–62. https://doi.org/10.1134/S1054661811040171.
10. Torshin I.Yu., Rudakov K.V. On the procedures of generation of numerical features over partitions of sets of objects in the problem of predicting numerical target variables. Pattern Recognit Image Anal. 2019; 29 (4): 654–67. https://doi.org/10.1134/S1054661819040175.
11. Schwarz A.M., Keresztes A., Bui T., et al. Terpenes from Cannabis sativa induce antinociception in a mouse model of chronic neuropathic pain via activation of adenosine A2A receptors. Pain. 2024; May 2. https://doi.org/10.1097/j.pain.0000000000003265.
12. Xu J.P., Ouyang Q.W., Shao M.J., et al. Manual acupuncture ameliorates inflammatory pain by upregulating adenosine A(3) receptor in complete Freund's adjuvant-induced arthritis rats. Int Immunopharmacol. 2024; 133: 112095. https://doi.org/10.1016/j.intimp.2024.112095.
13. Kishimoto S., Gokoh M., Oka S., et al. 2-arachidonoylglycerol induces the migration of HL-60 cells differentiated into macrophage-like cells and human peripheral blood monocytes through the cannabinoid CB2 receptor-dependent mechanism. J Biol Chem. 2003; 278 (27): 24469–75. https://doi.org/10.1074/jbc.M301359200.
14. Feng W., Song Z.H. Effects of D3.49A, R3.50A, and A6.34E mutations on ligand binding and activation of the cannabinoid-2 (CB2) receptor. Biochem Pharmacol. 2003; 65 (7): 1077–85. https://doi.org/10.1016/s0006-2952(03)00005-4.
15. Liu S., Tang Y., Shu H., et al. Dopamine receptor D2, but not D1, mediates descending dopaminergic pathway-produced analgesic effect in a trigeminal neuropathic pain mouse model. Pain. 2019; 160 (2): 334–44. https://doi.org/10.1097/j.pain.0000000000001414.
16. Garlisi C.G., Xiao H., Tian F., et al. The assignment of chemokine-chemokine receptor pairs: TARC and MIP-1 beta are not ligands for human CC-chemokine receptor 8. Eur J Immunol. 1999; 29 (10): 3210–5. https://doi.org/10.1002/(SICI)1521-4141(199910)29:10<3210::AID-IMMU3210>3.0.CO;2-W.
17. Hayashi T., Takahashi T., Motoya S., et al. MUC1 mucin core protein binds to the domain 1 of ICAM-1. Digestion. 2001; 63 (Suppl. 1): 87–92. https://doi.org/10.1159/000051917.
18. Xiao C., Bator C.M., Bowman V.D., et al. Interaction of coxsackievirus A21 with its cellular receptor, ICAM-1. J Virol. 2001; 75 (5): 2444–51. https://doi.org/10.1128/JVI.75.5.2444-2451.2001.
19. Wei S., Nandi S., Chitu V., et al. Functional overlap but differential expression of CSF-1 and IL-34 in their CSF-1 receptor-mediated regulation of myeloid cells. J Leukoc Biol. 2010; 88 (3): 495–505. https://doi.org/10.1189/jlb.1209822.
20. Han J., Chitu V., Stanley E.R., et al. Inhibition of colony stimulating factor-1 receptor (CSF-1R) as a potential therapeutic strategy for neurodegenerative diseases: opportunities and challenges. Cell Mol Life Sci. 2022; 79 (4): 219. https://doi.org/10.1007/s00018-022-04225-1.
21. Hoarau C., Gérard B., Lescanne E., et al. TLR9 activation induces normal neutrophil responses in a child with IRAK-4 deficiency: involvement of the direct PI3K pathway. J Immunol. 2007; 179 (7): 4754–65. https://doi.org/10.4049/jimmunol.179.7.4754.
22. Tralau T., Meyer-Hoffert U., Schröder J.M., Wiedow O. Human leukocyte elastase and cathepsin G are specific inhibitors of C5a-dependent neutrophil enzyme release and chemotaxis. Exp Dermatol. 2004; 13 (5): 316–25. https://doi.org/10.1111/j.0906-6705.2004.00145.x.
23. Minakami R., Katsuki F., Yamamoto T., et al. Molecular cloning and the functional expression of two isoforms of human metabotropic glutamate receptor subtype 5. Biochem Biophys Res Commun. 1994; 199 (3): 1136–43. https://doi.org/10.1006/bbrc.1994.1349.
24. Marumoto T., Hirota T., Morisaki T., et al. Roles of aurora-A kinase in mitotic entry and G2 checkpoint in mammalian cells. Genes Cells. 2002; 7 (11): 1173–82. https://doi.org/10.1046/j.1365-2443.2002.00592.x.
25. Walter A.O., Seghezzi W., Korver W., et al. The mitotic serine/threonine kinase Aurora2/AIK is regulated by phosphorylation and degradation. Oncogene. 2000; 19 (42): 4906–16. https://doi.org/10.1038/sj.onc.1203847.
26. Borah N.A., Reddy M.M. Aurora kinase B inhibition: a potential therapeutic strategy for cancer. Molecules. 2021; 26 (7): 1981. https://doi.org/10.3390/molecules26071981.
27. Matsuura I., Denissova N.G., Wang G., et al. Cyclin-dependent kinases regulate the antiproliferative function of Smads. Nature. 2004; 430 (6996): 226–31. https://doi.org/10.1038/nature02650.
28. Simone C., Stiegler P., Bagella L., et al. Activation of MyoD-dependent transcription by cdk9/cyclin T2. Oncogene. 2002; 21 (26): 4137–48. https://doi.org/10.1038/sj.onc.1205493.
29. Li J., Shi J., Pan Y., et al. Transcription modulation by CDK9 regulates inflammatory genes and RIPK3-MLKL-mediated necroptosis in periodontitis progression. Sci Rep. 2019; 9 (1): 17369. https://doi.org/10.1038/s41598-019-53910-y.
30. Kwak Y.T., Ivanov D., Guo J., et al. Role of the human and murine cyclin T proteins in regulating HIV-1 tat-activation. J Mol Biol. 1999; 288 (1): 57–69. https://doi.org/10.1006/jmbi.1999.2664.
31. Oshimori N., Ohsugi M., Yamamoto T. The Plk1 target Kizuna stabilizes mitotic centrosomes to ensure spindle bipolarity. Nat Cell Biol. 2006; 8 (10): 1095–101. https://doi.org/10.1038/ncb1474.
32. Daub H., Blencke S., Habenberger P., et al. Identification of SRPK1 and SRPK2 as the major cellular protein kinases phosphorylating hepatitis B virus core protein. J Virol. 2002; 76 (16): 8124–37. https://doi.org/10.1128/jvi.76.16.8124-8137.2002.
33. Frame S., Cohen P., Biondi R.M. A common phosphate binding site explains the unique substrate specificity of GSK3 and its inactivation by phosphorylation. Mol Cell. 2001; 7 (6): 1321–7. https://doi.org/10.1016/s1097-2765(01)00253-2.
34. Hourai S., Fujishima T., Kittaka A., et al. Probing a water channel near the A-ring of receptor-bound 1 alpha,25-dihydroxyvitamin D3 with selected 2 alpha-substituted analogues. J Med Chem. 2006; 49 (17): 5199–205. https://doi.org/10.1021/jm0604070.
35. Borngraeber S., Budny M.J., Chiellini G., et al. Ligand selectivity by seeking hydrophobicity in thyroid hormone receptor. Proc Natl Acad Sci USA. 2003; 100 (26): 15358–63. https://doi.org/10.1073/pnas.2136689100.
36. Shen X.M., Okuno T., Milone M., et al. Mutations causing slow-channel myasthenia reveal that a valine ring in the channel pore of muscle AChR is optimized for stabilizing channel gating. Hum Mutat. 2016; 37 (10): 1051–9. https://doi.org/10.1002/humu.23043.
37. Hua T., Vemuri K., Pu M., et al. Crystal structure of the human cannabinoid receptor CB(1). Cell. 2016; 167 (3): 750–62.e14. https://doi.org/10.1016/j.cell.2016.10.004.
38. Leskelä T.T., Lackman J.J., Vierimaa M.M., et al. Cys-27 variant of human δ-opioid receptor modulates maturation and cell surface delivery of Phe-27 variant via heteromerization. J Biol Chem. 2012; 287 (7): 5008–20. https://doi.org/10.1074/jbc.M111.305656.
39. Yin J., Babaoglu K., Brautigam C.A., et al. Structure and ligand-binding mechanism of the human OX1 and OX2 orexin receptors. Nat Struct Mol Biol. 2016; 23 (4): 293–9. https://doi.org/10.1038/nsmb.3183.
40. Park S.H., Choi H.J., Yang H., et al. Endoplasmic reticulum stress-activated C/EBP homologous protein enhances nuclear factor-kappaB signals via repression of peroxisome proliferator-activated receptor gamma. J Biol Chem. 2010; 285 (46): 35330–9. https://doi.org/10.1074/jbc.M110.136259.
41. Engeli R.T., Rhouma B.B., Sager C.P., et al. Biochemical analyses and molecular modeling explain the functional loss of 17β-hydro-xysteroid dehydrogenase 3 mutant G133R in three Tunisian patients with 46, XY Disorders of Sex Development. J Steroid Biochem Mol Biol. 2016; 155 (Pt A): 147–54. https://doi.org/10.1016/j.jsbmb.2015.10.023.
42. Mao S.S., Cooper C.M., Wood T., et al. Characterization of plasmin-mediated activation of plasma procarboxypeptidase B. Modulation by glycosaminoglycans. J Biol Chem. 1999; 274 (49): 35046–52. https://doi.org/10.1074/jbc.274.49.35046.
43. Ghersi G., Zhao Q., Salamone M., et al. The protease complex consisting of dipeptidyl peptidase IV and seprase plays a role in the migration and invasion of human endothelial cells in collagenous matrices. Cancer Res. 2006; 66 (9): 4652–61. https://doi.org/10.1158/0008-5472.CAN-05-1245.
44. Dobrikov M., Dobrikova E., Shveygert M., Gromeier M. Phosphorylation of eukaryotic translation initiation factor 4G1 (eIF4G1) by protein kinase C{alpha} regulates eIF4G1 binding to Mnk1. Mol Cell Biol. 2011; 31 (14): 2947–59. https://doi.org/10.1128/MCB.05589-11.
45. Lau E., Kluger H., Varsano T., et al. PKCε promotes oncogenic functions of ATF2 in the nucleus while blocking its apoptotic function at mitochondria. Cell. 2012; 148 (3): 543–55. https://doi.org/10.1016/j.cell.2012.01.016.
46. Yoshida K., Liu H., Miki Y. Protein kinase C delta regulates Ser46 phosphorylation of p53 tumor suppressor in the apoptotic response to DNA damage. J Biol Chem. 2006; 281 (9): 5734–40. https://doi.org/10.1074/jbc.M512074200.
Об авторах
П. А. Галенко-ЯрошевскийРоссия
Галенко-Ярошевский Павел Александрович, д.м.н., проф., чл.-кор. РАН
ул. Митрофана Седина, д. 4, Краснодар 350063
И. Ю. Торшин
Россия
Торшин Иван Юрьевич, к.ф-м.н., к.х.н.
ул. Вавилова, д. 44, корп. 2, Москва 119333
WoS ResearcherID: C-7683-2018. Scopus Author ID: 7003300274
А. Н. Громов
Россия
Громов Андрей Николаевич
ул. Вавилова, д. 44, корп. 2, Москва 119333
WoS ResearcherID: C-7476-2018. Scopus Author ID: 7102053964
О. А. Громова
Россия
ромова Ольга Алексеевна, д.м.н., проф.
ул. Вавилова, д. 44, корп. 2, Москва 119333
WoS ResearcherID: J-4946-2017. Scopus Author ID: 700358981
К. Ф. Суздалев
Россия
Суздалев Константин Филиппович, к.х.н., доцент
ул. Зорге, д. 7, Ростов-на-Дону 344090
Scopus Author ID: 6505813444
Р. А. Мурашко
Россия
Мурашко Роман Алексеевич, д.м.н., доцент
ул. Митрофана Седина, д. 4, Краснодар 350063
А. В. Зеленская
Россия
Зеленская Анаит Владимировна, к.м.н., доцент
ул. Митрофана Седина, д. 4, Краснодар 350063
А. В. Задорожний
Россия
Задорожний Андрей Владимирович, к.м.н., доцент
пер. Нахичеванский, д. 29, Ростов-на-Дону 344022
Т. Р. Глечян
Россия
Глечян Тереза Робертовна
ул. Митрофана Седина, д. 4, Краснодар 350063
Г. В. Симавонян
Россия
Симавонян Глеб Владимирович
ул. Митрофана Седина, д. 4, Краснодар 350063
Э.М. И. Мухаммад
Россия
Мухаммад Эсан Мохаммад Исхак
ул. Митрофана Седина, д. 4, Краснодар 350063
Что уже известно об этой теме?
► Для эффективной фармакотерапии воспаления и боли используются нестероидные противовоспалительные препараты (НПВП)
► Длительная терапия и/или неадекватное применение НПВП могут привести к повреждениям желудочно-кишечного тракта
► Осуществляется поиск новых НПВП с уникальными профилями взаимодействия с белками протеома, в т.ч. с улучшенной безопасностью
Что нового дает статья?
► Посредством конгломерата методов хемоинформационного анализа молекул смоделированы оценки фармакологических эффектов перспективного НПВП RRS-1
► Показано, что RRS-1 может активировать аденозиновые и дофаминовые рецепторы, каннабиноидный рецептор 2 и ГАМКА-рецептор в большей степени, чем другие молекулы, что соответствует противовоспалительному, антиноцицептивному и нейропротекторному эффектам
► Вещество RRS-1 отличалось умеренным профилем антивитаминного и антиминерального действия, что соответствует умеренному риску побочных эффектов вследствие ятрогенных нарушений микронутриентного баланса
Как это может повлиять на клиническую практику в обозримом будущем?
► Дополнение RRS-1 рядом микронутриентов в физиологических дозах позволит снизить риск потерь этих микронутриентов до нуля
► Хемопротеомное профилирование молекулы-кандидата RRS-1 указало на комплекс потенциальных фармакологических свойств, которые могут способствовать усилению противоболевых эффектов соединения у определенных групп пациентов
Рецензия
Для цитирования:
Галенко-Ярошевский П.А., Торшин И.Ю., Громов А.Н., Громова О.А., Суздалев К.Ф., Мурашко Р.А., Зеленская А.В., Задорожний А.В., Глечян Т.Р., Симавонян Г.В., Мухаммад Э.И. Дифференциальный хемопротеомный анализ молекулы-кандидата RRS-1 и молекул нескольких нестероидных противовоспалительных препаратов. ФАРМАКОЭКОНОМИКА. Современная фармакоэкономика и фармакоэпидемиология. 2024;17(3):324-336. https://doi.org/10.17749/2070-4909/farmakoekonomika.2024.265
For citation:
Galenko-Yaroshevsky P.A., Torshin I.Yu., Gromov A.N., Gromova O.A., Suzdalev K.F., Murashko R.A., Zelenskaya A.V., Zadorozhniy A.V., Glechyan T.R., Simavonyan G.V., Muhammad E.I. Differential chemoproteomic analysis of RRS-1 candidate molecule and molecules of several nonsteroidal anti-inflammatory drugs. FARMAKOEKONOMIKA. Modern Pharmacoeconomics and Pharmacoepidemiology. 2024;17(3):324-336. (In Russ.) https://doi.org/10.17749/2070-4909/farmakoekonomika.2024.265

Контент доступен под лицензией Creative Commons Attribution-NonCommercial-ShareAlike 4.0 International License.






































