Перейти к:
Анализ практики использования метотрексата у пациентов с ревматоидным и псориатическим артритом
https://doi.org/10.17749/2070-4909/farmakoekonomika.2024.273
Аннотация
Актуальность. Фармакоэпидемиологические исследования играют ключевую роль в оптимизации фармакотерапии различных заболеваний. В частности, значительный прогресс в лечении ревматоидного артрита (РА) и псориатического артрита (ПсА) требует углубленного анализа потребления базисных противовоспалительных препаратов. Современная концепция терапии данных заболеваний основывается на достижении и поддержании длительной ремиссии, в связи с чем метотрексат (МТ) является препаратом первой линии и характеризуется высокой эффективностью, безопасностью и выгодными фармакоэкономическими показателями.
Цель: изучить особенности использования МТ в реальной клинической практике у пациентов с РА и ПсА на амбулаторном этапе оказания медицинской помощи.
Материал и методы. Исследование состояло из двух частей: ретроспективный поперечный анализ динамики потребления МТ в 2018, 2020 и 2023 гг. с помощью методологии ATC/DDD (англ. Anatomical Therapeutic Chemical classification, ATC; defined daily dose, DDD) и лонгитудинальное неинтервенционное фармакоэпидемиологическое исследование, выполненное в 2023 г. с использованием медицинской информационной системы «БАРС. Здравоохранение».
Результаты. ATC/DDD-анализ показал значительное увеличение потребления МТ среди пациентов с РА и ПсА: с 302 428,6 до 319 114,3 установленных суточных доз на 1000 пациентов в год для РА и с 28 157,1 до 310 771,6 установленных суточных доз на 1000 пациентов в год для ПсА в 2018 и 2023 гг. соответственно. Наиболее часто назначаемая доза МТ составляла 15 мг/нед. Основной терапевтической комбинацией у 55,8% больных была «МТ + нестероидные противовоспалительные препараты», у 32,7% пациентов к данной комбинации добавлялись глюкокортикостероиды (ГКС). Исследование выявило высокую частоту назначения ингибиторов протонной помпы, ГКС и колекальциферола, что акцентирует внимание на активности рассматриваемых заболеваний, возможных осложнениях и необходимости профилактики клинически значимых лекарственных взаимодействий.
Заключение. Проведенное исследование подтвердило, что МТ остается основным препаратом для лечения РА и ПсА. ATC/DDD-анализ продемонстрировал значимое увеличение потребления МТ за последние годы, что связано с его терапевтической эффективностью и доступностью применения. Высокая частота сопутствующих назначений подчеркивает сложность лечения РА и ПсА и необходимость междисциплинарного подхода для обеспечения безопасности и эффективности терапии.
Ключевые слова
Для цитирования:
Докторова С.А., Грабовецкая Ю.Ю., Зуев А.В., Аксенова-Сорохтей Ю.Н., Рафальский В.В. Анализ практики использования метотрексата у пациентов с ревматоидным и псориатическим артритом. ФАРМАКОЭКОНОМИКА. Современная фармакоэкономика и фармакоэпидемиология. 2025;18(1):33-41. https://doi.org/10.17749/2070-4909/farmakoekonomika.2024.273
For citation:
Doktorova S.A., Grabovetskaya Yu.Yu., Zuev A.V., Aksenova-Sorokhtei J.N., Rafalskiy V.V. Analysis of methotrexate use practice in patients with rheumatoid and psoriatic arthritis. FARMAKOEKONOMIKA. Modern Pharmacoeconomics and Pharmacoepidemiology. 2025;18(1):33-41. (In Russ.) https://doi.org/10.17749/2070-4909/farmakoekonomika.2024.273
ВВЕДЕНИЕ / INTRODUCTION
Исследования использования лекарственных средств (ЛС) являются одним из важных направлений для оптимизации фармакотерапии различных заболеваний [1]. Существенный прогресс в лечении ревматоидного артрита (РА) и псориатического артрита (ПсА) приводит к необходимости анализа потребления и назначений базисных противовоспалительных препаратов (БПВП) в популяции [2][3].
Метотрексат (МТ) является препаратом первой линии у пациентов с РА и ПсА ввиду его высокой эффективности, безопасности и выгодных фармакоэкономических характеристик [4][5]. В настоящее время накоплено значительное число исследований, которые подтверждают важную позицию МТ в современной фармакотерапии. В частности, установлена высокая частота использования МТ у пациентов с РА и ПсА как в режиме монотерапии, так и в комбинации с другими БПВП, глюкокортикостероидами (ГКС) и нестероидными противовоспалительными препаратами (НПВП) [6–8].
В связи с этим не теряют актуальности фармакоэпидемиологические аналитические и описательные исследования потребления МТ, позволяющие установить закономерности и разработать предложения по оптимизации применения данного препарата [1]. Для изучения особенностей использования ЛС в реальной клинической практике могут применяться как качественные, так и количественные подходы. Одним из инструментов фармакоэпидемиологической оценки является ATC/DDD-анализ (англ. Anatomical Therapeutic Chemical classification, ATC; defined daily dose, DDD), позволяющий объективно сравнить количественное потребление ЛС в различных регионах и странах в определенные временные интервалы [9]. Методология DDD, в свою очередь, дает возможность измерять и сравнивать потребление ЛС независимо от дозы и формы выпуска путем нормализации данных до установленной суточной дозы. В клинической практике эта система используется в фармакоэпидемиологических исследованиях для мониторинга тенденций в назначении ЛС, оценки рациональности фармакотерапии, а также формирования национальных и международных рекомендаций [10].
Цель – изучить особенности использования МТ в реальной клинической практике у пациентов с РА и ПсА на амбулаторном этапе оказания медицинской помощи.
МАТЕРИАЛ И МЕТОДЫ / MATERIAL AND METHODS
Исследование проводили на базе ГБУЗ КО «Областная клиническая больница» и ГБУЗ КО «Центральная городская клиническая больница» (г. Калининград, Калининградская обл., Россия). На каждого пациента, включенного в исследование, заполняли индивидуальную регистрационную карту с внесением демографических данных (возраст, пол), кода заболевания по Международной классификации болезней 10-го пересмотра (МКБ-10), проводимой терапии, зарегистрированных нежелательных реакций (НР), случаев коррекции фармакотерапии, клинически значимых лекарственных взаимодействий (ЛВ).
Источники данных / Data sources
Для поиска релевантных данных использовалась медицинская информационная система «БАРС. Здравоохранение» (АО «БАРС Груп», Россия)1 в составе регионального сегмента Единой государственной информационной системы в сфере здравоохранения (ЕГИСЗ) Калининградской обл. (КО). Классификацию используемых ЛС и определение DDD проводили с помощью ATC/DDD Index 2023 Всемирной организации здравоохранения (ВОЗ) [11].
Этапы исследования / Study stages
Исследование состояло из двух частей, которые были основаны на сплошном анализе данных пациентов с РА и ПсА, получающих МТ в режиме монотерапии в качестве терапии БПВП, а также комбинации МТ + ГКС, МТ + НПВП и МТ + ГКС + НПВП.
Первая часть представляла собой ретроспективное исследование поперечного среза, спланированное для выявления динамики потребления МТ в регионе. Анализ проводили во временные периоды с 1 января 2018 г. по 31 декабря 2018 г., с 1 января 2020 г. по 31 декабря 2020 г. и с 1 января 2023 г. по 31 декабря 2023 г., которые были выбраны с целью сравнительного ATC/DDD-анализа назначений и потребления МТ в популяции.
Вторая часть – лонгитудинальное неинтервенционное фармакоэпидемиологическое исследование, включающее период с 1 января 2023 г. по 31 декабря 2023 г.
Критерии включения и невключения / Inclusion and non-inclusion criteria
Критериями включения в исследование являлись:
– возраст пациентов 18 лет и старше;
– подписание информированного согласия на обработку персональных данных;
– установленный диагноз «ревматоидный артрит» согласно критериям ACR 1997 г. и/или ACR/EULAR2 2010 г. (коды по МКБ-10: M05.3, М05.8, М05.9, М06.0, М06.8, М06.9) или установленный диагноз «псориатический артрит» в соответствии с критериями CASPAR (англ. ClASsification criteria for Psoriatic Arthritis) 2006 г. (коды по МКБ-10: М07.2, М07.3, L40.5);
– применение МТ в качестве БПВП.
В анализ не включали пациентов, получающих другие БПВП, а именно синтетические (лефлуномид, гидроксихлорохин, азатиоприн, сульфасалазин), биологические и таргетные синтетические БПВП и их комбинации, на момент исследования.
ATC/DDD-анализ // ATC/DDD analysis
Для расчета общего потребления МТ по ATC/DDD-системе использовали следующие формулы:
Q = (∑i=1n Di×ti) / 7,
NDDD = Q / DDD,
где Q – количество потребленного МТ; n – число пациентов; Di – недельная доза у 1 пациента; ti – длительность назначения МТ у 1 пациента (сут); NDDD – число установленных суточных доз; DDD = 2,5 мг.
Для расчета относительного потребления МТ на 1000 пациентов в год и 1000 населения в год в КО применяли формулы:
NDDD (1000 пациентов/год) = NDDD × 1000 / NКО,
NDDD (1000 населения/год) = NDDD × 1000 / РКО,
где NКО – общее число больных с исследуемым заболеванием в КО; РКО – численность взрослого населения в КО.
Статистический анализ / Statistical analysis
Полученные данные обрабатывали с помощью компьютерных программ Microsoft Excel (Microsoft, США), Statistica 13.3 (StatSoft Inc., США). Для анализа количественных признаков применяли методы описательной статистики, в частности для оценки центральной тенденции рассчитывали среднее арифметическое значение, медиану и моду. Для оценки разброса значений относительно среднего арифметического использовали стандартную ошибку среднего значения, минимальное и максимальное значения.
РЕЗУЛЬТАТЫ / RESULTS
Характеристика пациентов / Patient characteristics
В ходе выполнения первой части исследования были изучены данные пациентов с РА и ПсА, получающих МТ в качестве БПВП. Их количество в 2018, 2020 и 2023 гг. составило 592, 474, 787 и 142, 156, 260 соответственно. Из них в исследование включены 184, 134 и 364 пациента с РА и 76, 104, 167 пациентов с ПсА, соответствующих критериям включения/невключения, для указанных интервалов времени. Дубликаты документов и повторяющиеся записи исключали из анализа (табл. 1). Средний возраст пациентов с РА составил 60,3±22,2 года (18–86 лет, медиана 63 года), с ПсА – 52,1±13,1 года (19–79 лет, медиана 53 года) в анализируемых временных периодах.
Таблица 1. Количество и демографические характеристики пациентов, включенных в исследование
Table 1. Number and demographic characteristics of patients included in the study
|
Параметр / Parameter |
Год / Year |
||
|
2018 |
2020 |
2023 |
|
|
Ревматоидный артрит / Rheumatoid arthritis |
|||
|
Общее число пациентов, обратившихся за медицинской помощью, n / Total number of patients attending for medical care, n |
592 |
474 |
787 |
|
Число пациентов, включенных в исследование, n / Number of patients included in the study, n |
184 |
134 |
364 |
|
Пол, n (%) / Gender, n (%) |
|||
|
мужской / male |
30 (16,3) |
27 (20,1) |
53 (14,6) |
|
женский / female |
154 (83,7) |
107 (79,9) |
311 (85,4) |
|
Средний возраст, лет / Mean age, years |
59,4±28,7 |
59,5±26,8 |
62,1±11,3 |
|
Псориатический артрит / Psoriatic arthritis |
|||
|
Общее число пациентов, обратившихся за медицинской помощью, n / Total number of patients attending for medical care, n |
142 |
156 |
260 |
|
Число пациентов, включенных в исследование, n / Number of patients included in the study, n |
76 |
104 |
167 |
|
Пол, n (%) / Gender, n (%) |
|||
|
мужской / male |
32 (42,1) |
41 (39,4) |
54 (32,3) |
|
женский / female |
44 (57,9) |
63 (60,6) |
113 (67,7) |
|
Средний возраст, лет / Mean age, years |
52,2±12,3 |
51±13,3 |
53,2±13,6 |
Динамика потребления МТ / MTX consumption dynamics
Согласно ATC/DDD Index ВОЗ стандартная дневная доза (DDD) для МТ (L04AX03) составляет 2,5 мг для парентерального и перорального применения и не менялась в течение периода наблюдения. Данные для изучения потребления и использования ЛС по методологии ATC/DDD могут быть представлены в виде подсчета NDDD на 1000 пациентов в год, NDDD на 1000 населения в год, NDDD на 100 койко-дней и NDDD на 1 жителя в год [12]. Население КО, по данным Росстата, в 2018 г. составило 1 002 187 человек, в 2020 г. – 1 018 624 человека, в 2023 г. – 1 032 343 человека, около 80% – взрослое население [13]. Таким образом, получены следующие значения NDDD на 1000 населения в год:
– для РА: 2018 г. – 356,7; 2020 г. – 697,4; 2023 г. – 2137,9;
– для ПсА: 2018 г. – 64,7; 2020 г. – 150,3; 2023 г. – 444,2.
Для расчета значений NDDD, отнесенных к количеству пациентов с соответствующими заболеваниями, использовали эпидемиологические данные по заболеваемости РА и ПсА в КО. Заболеваемость РА распределилась следующим образом: в 2018 г. – 1,18 случая на 1000 взрослого населения; в 2020 г. – 2,2 случая; в 2023 г. – 6,7 случая. Использование показателей заболеваемости по РА позволило рассчитать количество NDDD МТ на 1000 пациентов в год: 2018 г. – 302 428,6; 2020 г. – 317 028,6; 2023 г. – 319 114,3 (рис. 1).
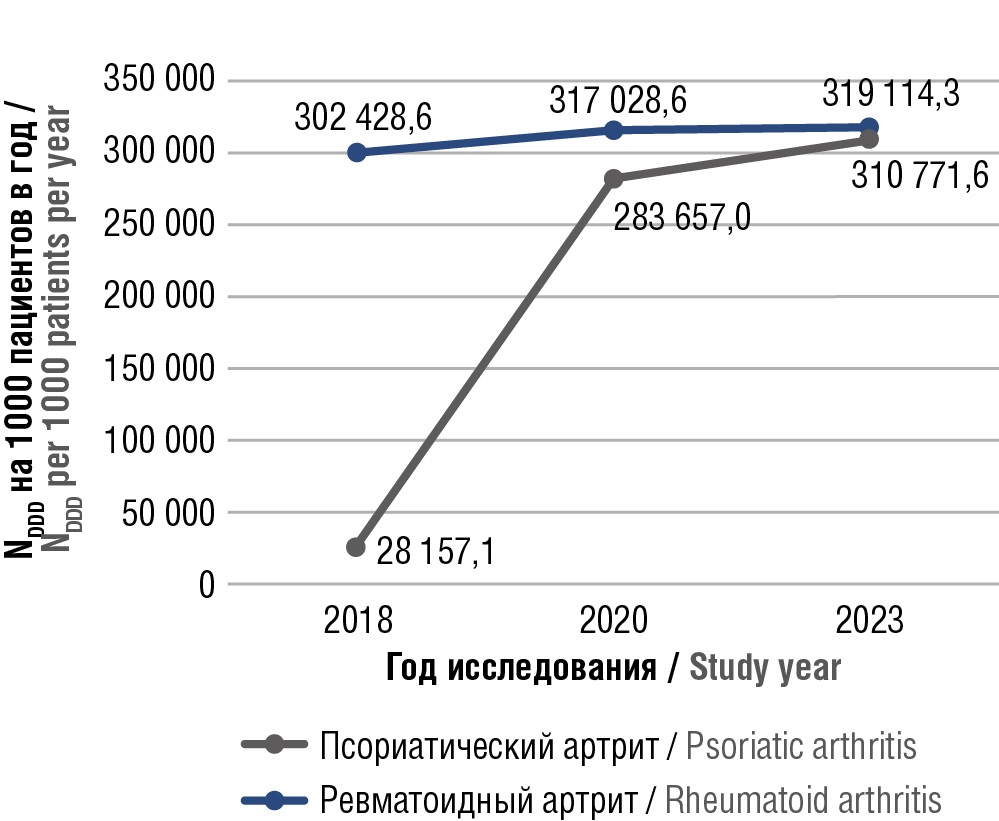
Рисунок 1. Динамика потребления метотрексата у пациентов с ревматоидным и псориатическим артритом в 2018, 2020 и 2023 гг. в Калининградской обл.
NDDD – число установленных суточных доз
Figure 1. Dynamics of methotrexate consumption by patients with rheumatoid and psoriatic arthritis in 2018, 2020 and 2023 in Kaliningrad Region
NDDD – number of defined daily doses
Согласно данным по заболеваемости ПсА, в КО отмечалась тенденция к росту показателя в периоды наблюдения: в 2018 г. – 0,23 случая на 1000 взрослого населения; в 2020 г. – 0,53 случая, в 2023 г. – 1,43 случая. Учитывая это, ATC/DDD-анализ показал увеличение количественного потребления МТ среди пациентов с ПсА: 2018 г. – 28 157,1; 2020 г. – 283 657,0; 2023 г. – 310 771,6 на 1000 пациентов в год (см. рис. 1).
Терапия БПВП / DMARD therapy
Пациенты с РА
В ходе второй части исследования проводили анализ всех случаев назначения, отмены, изменения дозы МТ у пациентов с РА в 2023 г. (n=364), также фиксировали и анализировали сопутствующую терапию. Наиболее часто (в 43,4% случаев) назначалась доза МТ 15 мг/нед, средняя доза составляла 15,3±4,4 мг/нед. Максимальную дозу 25 мг/нед получали 8% пациентов из исследуемой выборки. На рисунке 2а представлено распределение назначаемых доз МТ. Монотерапию МТ получали 5,2% пациентов, в комбинации с ГКС – 6,3%, в комбинации с НПВП – 55,8%, в комбинации с ГКС и НПВП – 32,7%.
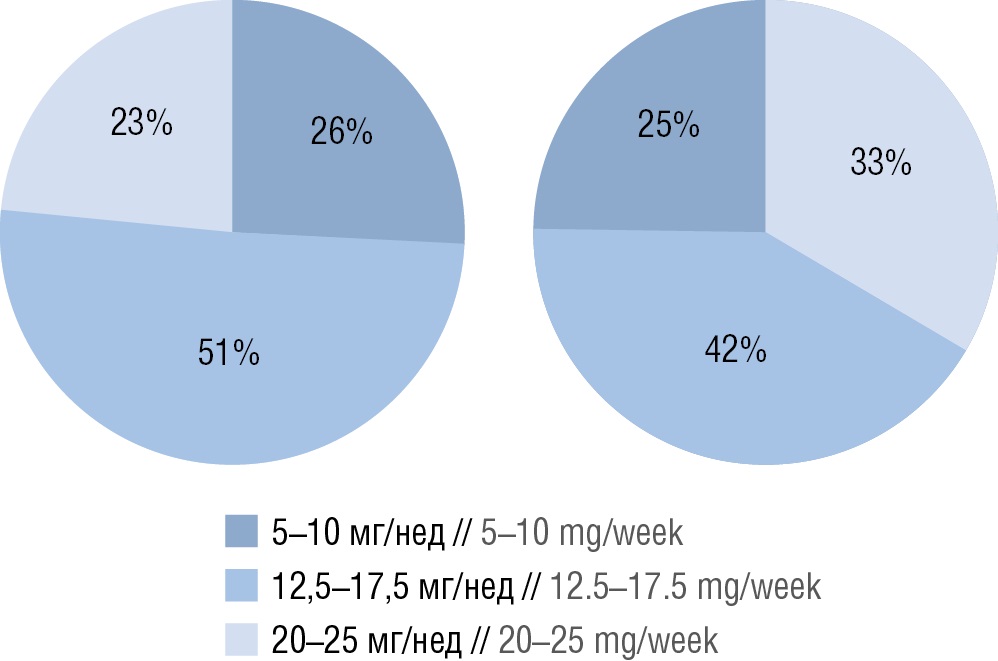
Рисунок 2. Структура распределения назначенных доз метотрексата в 2023 г.:
а – пациентам с ревматоидным артритом (n=364); b – пациентам с псориатическим артритом (n=167)
Figure 2. Distribution pattern of prescribed methotrexate doses in 2023;
а – patients with rheumatoid arthritis (n=364); b – patients with psoriatic arthritis (n=167)
Нами отслеживались все случаи изменения терапии БПВП у пациентов с РА, в которых в первую очередь отмечалось назначение или отмена МТ. Установлено, что у 43,7% больных в течение 1 года терапия БПВП не изменялась, у 25,8% произошло изменение дозы МТ (снижение в 80,9% случаев, повышение в 19,1% случаев), у 19,2% выполнен переход с терапии МТ на лечение другими БПВП, изменение пути применения МТ произошло у 1,5% больных, 9,8% пациентам рекомендован другой путь введения и проведена коррекция дозы МТ. Изменение терапии БПВП в связи с отменой или назначением МТ распределилось следующим образом: в 42,9% случаев – отмена других синтетических БПВП и назначение МТ, в 57,1% – отмена МТ и назначение другого БПВП. Главным образом смена терапии БПВП происходила в связи с низкой эффективностью или непереносимостью данного вида лечения.
При анализе сопутствующей фармакотерапии установлено, что наиболее часто используемыми группами ЛС были следующие: НПВП (85,7%), средства для лечения кислотозависимых заболеваний (81,3%), колекальциферол (48,4%) и ГКС (43,7%). Среди ЛС, применяющихся для лечения кислотозависимых заболеваний, чаще назначался омепразол (68,1%). Большинству пациентов НПВП были рекомендованы на выбор: любой селективный или неселективный НПВП (n=173) с обязательным применением ингибитора протонной помпы (ИПП) при выборе неселективного ингибитора циклооксигеназы (ЦОГ); для 63 пациентов предпочтение отдавалось селективным НПВП (преимущественно ингибиторам ЦОГ-2). Наиболее часто назначали нимесулид (23%), мелоксикам (21%), целекоксиб (19%), напроксен (18%) в категории «любой НПВП». Менее 5% назначений включали эторикоксиб, ацеклофенак, диклофенак, кетопрофен, ибупрофен, этодолак, декскетопрофен и лорноксикам в той же категории. Также у 9 пациентов проводилась комбинированная противовоспалительная и анальгетическая терапия: любой НПВП и парацетамол/трамадол (n=6), любой НПВП и амитриптилин/дулоксетин (n=2), а также любой НПВП и габапентин (n=1).
В качестве профилактики и лечения остеопороза были рекомендованы и назначены препараты группы бисфосфонатов и колекальциферол. В 48,4% случаев назначался колекальциферол в режиме монотерапии на курсовой прием, у 11% пациентов среди назначений были комбинации бисфосфонатов и колекальциферола. Среди других ЛС были отмечены рекомендации по лечению сердечно-сосудистых (n=17; 4,7%) и метаболических (n=16; 4,4%) заболеваний, подагры (n=3; 0,8%), болезней щитовидной железы (n=3; 0,8%). Данные по сопутствующей терапии у пациентов с РА обобщены и представлены в таблице 2.
Таблица 2. Назначения сопутствующих препаратов одновременно с метотрексатом у пациентов с ревматоидным артритом (n=364)
Table 2. Administration of concomitant medications concurrently with methotrexate in patients with rheumatoid arthritis (n=364)
|
Фармакотерапевтическая группа / Pharmacotherapeutic group |
Название препарата / Drug name |
Код АТХ / ATC code |
Число пациентов, n (%) / Number of patients, n (%) |
|
Средства для лечения кислотозависимых заболеваний / Medicines for acid-dependent diseases |
Омепразол / Omeprazole |
А02ВС01 |
248 (68,1) |
|
Пантопразол / Pantoprazole |
A02BC02 |
26 (7,1) |
|
|
Любые ИПП* / Any PPIs* |
н/п // n/a |
20 (5,5) |
|
|
Средства для лечения функциональных нарушений ЖКТ, аминокислоты и их производные / Medicines for functional GI tarct disorders, amino acids and their derivatives |
Адеметионин / Ademetionine |
A16AA02 |
6 (1,7) |
|
Глюкокортикостероиды / Glucocorticoids |
Преднизолон / Prednisolone |
H02AB06 |
107 (28,8) |
|
Метилпреднизолон / Methylprednisolone |
H02AB04 |
44 (12,1) |
|
|
Нестероидные противовоспалительные препараты / Nonsteroidal anti-inflammatory drugs |
Нимесулид / Nimesulide |
M01AX17 |
24 (6,6) |
|
Мелоксикам / Meloxicam |
M01AC06 |
11 (3,0) |
|
|
Напроксен / Naproxen |
M01AE02 |
23 (6,3) |
|
|
Эторикоксиб / Etoricoxib |
M01AH05 |
12 (3,3) |
|
|
Любые НПВП** / Any NSAIDs** |
н/п // n/a |
173 (47,5) |
|
|
Любые селективные (ЦОГ-2) НПВП*** / Any selective (COX-2) NSAIDs*** |
н/п // n/a |
63 (17,3) |
|
|
Анальгетики / Analgesics |
Трамадол / Tramadol |
N02AX02 |
7 (1,9) |
|
Парацетамол / Paracetamol |
N02BE01 |
||
|
Ацетилсалициловая кислота / Acetylsalicylic acid |
N02BА01 |
||
|
Средства, влияющие на структуру и минерализацию костей / ингибиторы костной резорбции // Medicines influencing bone structure and mineralization / inhibitors of bone resorption |
Любые бисфосфонаты**** + колекальциферол / Any bisphosphonates **** + cholecalciferol |
н/п // n/a |
40 (11,0) |
|
Колекальциферол / Cholecalciferol |
A11CC05 |
176 (48,4) |
|
|
Минеральные добавки, витамины группы В, препараты железа, периферические вазодилататоры / Mineral supplements, B vitamins, iron preparations, peripheral vasodilators |
Калия аспарагинат + магния аспарагинат / Potassium aspartate + magnesium aspartate |
A12CX |
17 (4,7) |
|
Бенфотиамин + пиридоксин / Benfotiamine + pyridoxine |
A11DB |
||
|
Железа сульфат + аскорбиновая кислота / Iron sulfate + ascorbic acid |
B03AA07 |
||
|
Железа глюконат + марганца глюконат + меди глюконат / Iron gluconate + manganese gluconate + copper gluconate |
B03AE10 |
||
|
Миорелаксанты / Muscle relaxants |
Толперизон / Tolperisone |
M03BX04 |
4 (1,1) |
|
Тизанидин / Tizanidine |
M03BX02 |
12 (3,3) |
|
|
Антидепрессанты / Antidepressants |
Амитриптилин / Amitriptyline |
N06AА09 |
8 (2,2) |
|
Дулоксетин / Duloxetine |
N06AX21 |
4 (1,1) |
|
|
Гиполипидемические средства / Hypolipidemic agents |
Аторвастатин / Atorvastatin |
C10AA05 |
12 (3) |
|
Стимулятор репарации тканей / Tissue repair stimulator |
Глюкозамин + хондроитина сульфат / Glucosamine + сhondroitin sulfate |
M09AX |
7 (1,9) |
|
Комбинированная противовоспалительная и анальгетическая терапия / Combined anti-inflammatory and analgesic therapy |
Любой НПВП** + антидепрессант / Any NSAID** + antidepressant |
н/п // n/a |
6 (1,6) |
|
Любой НПВП** + анальгетик / Any NSAID** + analgesic |
н/п // n/a |
2 (0,5) |
|
|
Любой НПВП** + ПЭП / Any NSAID** + AED |
н/п // n/a |
1 (0,3) |
|
|
Другие лекарственные средства / Other medicinal products |
– |
– |
60 (16,5) |
Примечание. АТХ – анатомо-терапевтическо-химическая классификация; ЖКТ – желудочно-кишечный тракт; ИПП – ингибиторы протонной помпы; НПВП – нестероидные противовоспалительные препараты; ЦОГ-2 – циклооксигеназа-2; ПЭП – противоэпилептический препарат; н/п – неприменимо. * ИПП на выбор (омепразол, рабепразол, эзомепразол, пантопразол). ** НПВП на выбор (любые селективные или неселективные). *** Селективные НПВП (преимущественно целекоксиб, нимесулид, эторикоксиб, мелоксикам, лорноксикам). **** Бисфосфонаты и другие средства, влияющие на структуру и минерализацию костей, на выбор (алендроновая кислота, ибандроновая кислота, золендроновая кислота, деносумаб).
Note. ATC – анатомо-терапевтическо-химическая классификация; GI – gastrointestinal; PPIs – proton pump inhibitors; NSAIDs – non-steroidal anti-inflammatory drugs; COX-2 – cyclooxygenase-2; AED – antiepileptic drug; n/a – not applicable. * PPIs of choice (omeprazole, rabeprazole, esomeprazole, pantoprazole). ** NSAIDs of choice (any selective or non-selective). *** Selective NSAIDs (mainly celecoxib, nimesulide, etoricoxib, meloxicam, lornoxicam). **** Bisphosphonates and other agents affecting bone structure and mineralization of choice (alendronic acid, ibandronic acid, zoledronic acid, denosumab).
Потенциальные ЛВ выявлены у 93% включенных пациентов, однако указания на развитие НР вследствие ЛВ не были отражены в медицинской документации. Наибольший процент возможных ЛВ приходился на комбинации МТ + НПВП + ИПП (n=277; 82,2%), а также МТ + НПВП (n=41; 12,2%) (рис. 3).
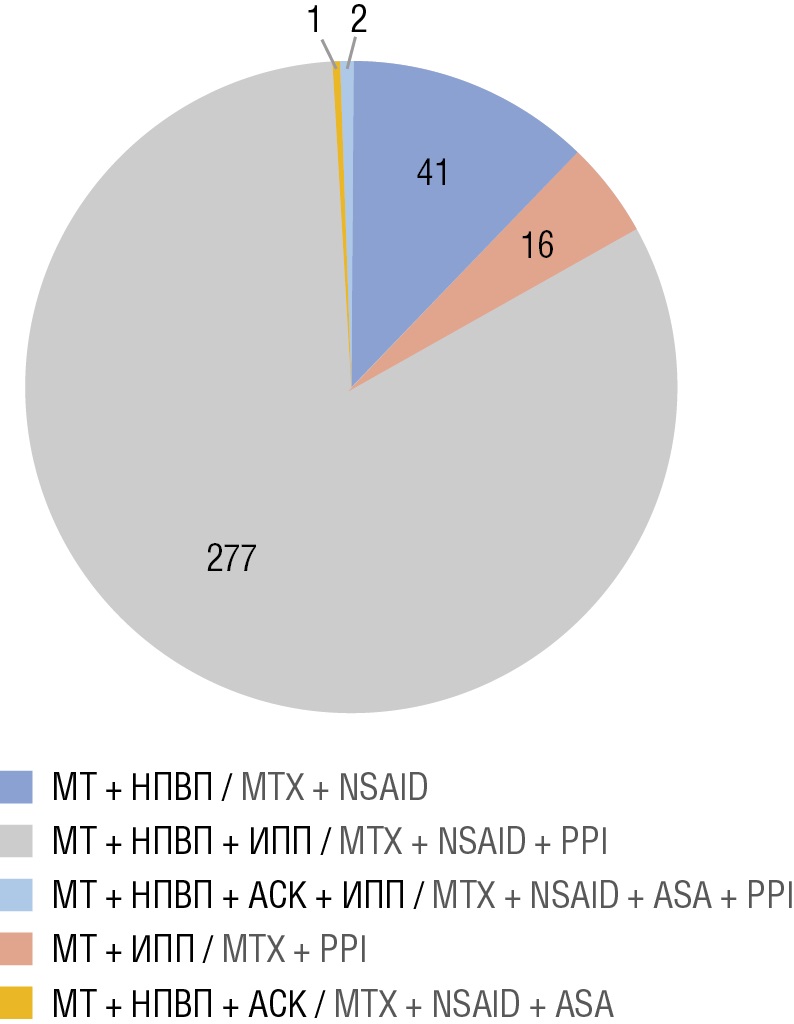
Рисунок 3. Структура потенциальных лекарственных взаимодействий метотрексата (МТ) с нестероидными противовоспалительными препаратами (НПВП), ингибиторами протонной помпы (ИПП), ацетилсалициловой кислотой (АСК) у пациентов с ревматоидным артритом (всего 337 взаимодействий)
Figure 3. Structure of potential drug interactions of methotrexate (MTX) with nonsteroidal anti-inflammatory drugs (NSAID), proton pump inhibitors (PPI), acetylsalicylic acid (ASA) in patients with RA (a total of 337 interactions)
Пациенты с ПсА
Исследование терапии БПВП у пациентов с ПсА показало, что МТ назначался 167 (59,6%) больным из общей выборки (n=260) в 2023 г. Структура назначений других БПВП распределилась следующим образом: 27,4% пациентам терапия не назначалась ввиду отсутствия необходимых обследований для постановки диагноза и выбора БПВП (23%), наличия противопоказаний (злокачественное новообразование, прегравидарная подготовка) (6%) и достаточного контроля заболевания на монотерапии НПВП (71%). У 29 (25,7%) больных зарегистрирована непереносимость и/или неэффективность МТ и других БПВП в анамнезе. Другой синтетический БПВП (сульфасалазин, лефлуномид, циклоспорин, гидроксихлорохин) использовался у 35 (31%) пациентов в качестве стартовой терапии при постановке диагноза. Также применялись генно-инженерные биологические препараты (устекинумаб (2), рисанкизумаб (1), секукинумаб (2), адалимумаб (1), этанерцепт (1)) у 7 (6,2%) пациентов, таргетный БПВП (упадацитиниб) – у 2 (1,8%). В 5,3% случаев в представленных выписках информация о назначенной терапии не была отображена.
Комбинированную терапию МТ + ГКС получали 2,4% больных, МТ + НПВП – 91%, МТ + ГКС + НПВП – 2,4%, монотерапию МТ – 4,2% пациентов с ПсА. Комбинация МТ с другими БПВП в представленной выборке не рекомендовалась.
Установлено, что наиболее часто (у 36,5% пациентов) назначалась доза МТ 15 мг/нед, средняя доза составляла 14,9±4,62 мг/нед. Максимальную дозу 25 мг/нед получали 7,2% пациентов из исследуемой выборки. На рисунке 2b представлено структурное распределение назначенных доз МТ в интервалах от 5 до 25 мг/нед пациентам с ПсА.
ОБСУЖДЕНИЕ / DISCUSSION
ATC/DDD-анализ является распространенной методологией фармакоэпидемиологических исследований и предусматривает проведение количественной оценки потребления ЛС в разных регионах и в различные временные интервалы [1][9][12][14]. На сегодняшний день опубликовано ограниченное количество исследований, описывающих потребление БПВП с использованием ATC/DDD-подхода у больных ревматологического профиля. Проведенный нами анализ показал значительное увеличение применения МТ среди пациентов как с РА, так и с ПсА в период с 2018 по 2023 гг. в КО.
Динамика роста NDDD свидетельствует об увеличении использования МТ на амбулаторном этапе, что может быть обусловлено высокой эффективностью препарата, его относительно хорошей переносимостью и доступностью, а также ростом общего числа пациентов с зарегистрированными РА и ПсА. Несмотря на явную тенденцию увеличения абсолютного числа NDDD при РА, отмечается небольшое повышение относительного числа NDDD на 1000 пациентов, что свидетельствует о росте в большей степени числа больных с установленным диагнозом РА, чем количества назначений МТ. Картина потребления МТ среди пациентов с ПсА демонстрирует более значительный рост как абсолютных, так и относительных показателей NDDD. Это позволяет сделать вывод об увеличении числа назначений МТ пациентам на фоне более медленного прироста заболеваемости ПсА в период с 2018 по 2023 гг.
Сходная тенденция к росту потребления МТ отмечается и в других исследованиях. Так, в работе X.M. Jin et al. определено, что применение МТ при РА увеличилось с 67,2 на 1000 пациентов в день в 2005 г. до 86,5 на 1000 пациентов в день в 2006 г. [8]. Наряду с МТ также выросло потребление других традиционных БПВП, таких как гидроксихлорохин, сульфасалазин и лефлуномид [8]. По данным K. Almutairi et al., использование БПВП при РА увеличилось с 1,45 до 3,19 на 1000 населения в день за 1995–2014 гг. [15]. MT – один из наиболее часто используемых БПВП у пациентов с РА в Корее (57,9%) и Канаде (62%), что подтверждают проведенные ранее исследования [16][17]. В Германии продемонстрирован рост назначений данного препарата на 37% в период с 2004 по 2011 гг., а в 2011 г. МТ был самым назначаемым ЛС для пациентов с РА (4,76%), тогда как азатиоприн (1,72%) и сульфасалазин (1,20%) занимали следующие позиции [7]. Согласно данным исследования, проведенного в период с 2004 по 2015 гг. в США, на долю МТ приходилось 80,6% назначений в качестве стартовой терапии больным ПсА [18]. В работе L.A. Anghel et al. изучены паттерны назначений БПВП среди пациентов с различными аутоиммунными заболеваниями, среди которых также рассматривались РА и ПсА: исследование показало значительные колебания числа назначений МТ, которое снизилось с 31,12% в 2011 г. до 14,92% в 2012 г., а затем вновь возросло до 30,79% к 2014 г. [3].
Комбинированная терапия, включающая МТ, НПВП, ГКС и другие БПВП (синтетические, таргетные синтетические и биологические), является одной из самых часто назначаемых вследствие терапевтической эффективности и хорошей переносимости у пациентов с высокой активностью РА [19][20]. По результатам нашего исследования, в 2023 г. наиболее распространенной схемой лечения РА оказалась комбинация МТ + НПВП (55,8%), что согласуется с данными о необходимости комплексного подхода к терапии воспалительных артритов [21]. При ПсА такую комбинацию получали 91% больных. Это подчеркивает сходство в терапевтических подходах к лечению РА и ПсА, при котором НПВП играют важную роль в купировании симптомов болезней и контроле воспалительного процесса [22][23]. В то же время комбинация МТ + ГКС при РА и ПсА назначалась 6,3% и 2,4% пациентам соответственно. Монотерапия МТ была наименее популярна (5,2% при РА, 4,2% при ПсА), что указывает на необходимость дополнительной терапии для улучшения клинического исхода. Анализ, проведенный в Австралии, продемонстрировал, что из 1059 пациентов с РА 17% получали комбинацию МТ + ГКС, в частности пероральный преднизолон [24].
Важно отметить, что большинство пациентов (43,4% с РА, 36,5% с ПсА) в нашем исследовании получали дозу МТ 15 мг/нед, что сопровождалось необходимостью продолжения приема НПВП и ГКС и увеличивало риски, связанные с полипрагмазией. Таким образом, отмечена важность назначения МТ в дозах до 25 мг/нед для достижения целей лечения и снижения ряда осложнений, ассоциированных с комбинированной терапией.
Пациентам с РА и ПсА часто назначают сопутствующую терапию, включающую НПВП, препараты для лечения кислотозависимых заболеваний, ГКС и витамин D. В нашей работе 93% больных получали комбинации МТ, НПВП и ИПП, что согласуется с целями противовоспалительной терапии и профилактики НПВП-ассоциированных гастро- и энтеропатий при назначении неселективных НПВП [25]. Однако это увеличивает риски возникновения ЛВ, а применение любых НПВП на выбор (в частности, напроксена, диклофенака, кетопрофена) может приводить к нарушению выведения МТ путем почечного клиренса [26–28]. Клинически значимые ЛВ также могут возникать при терапии комбинациями МТ + ИПП (омепразол, пантопразол), анальгетиками (ацетилсалициловая кислота) и противоэпилептическими препаратами (габапентин) [29]. Высокий уровень сопутствующих назначений подчеркивает сложность и коморбидность данных состояний, а также необходимость оценки и предупреждения потенциальных ЛВ.
ЗАКЛЮЧЕНИЕ / CONCLUSION
Проведенный анализ практики назначений МТ при РА и ПсА показал высокую частоту применения данного препарата. С 2018 по 2023 гг. потребление МТ при РА возросло с 302 428,6 до 319 114,3 NDDD на 1000 пациентов в год. В то же время данные для ПсА подтвердили рост потребления с 28 157,1 до 310 771,6 NDDD на 1000 пациентов в 2018 и 2023 гг. соответственно. Эта разница в динамике применения МТ между РА и ПсА может свидетельствовать об активном использовании МТ в терапии ПсА, где наблюдается более стремительный рост как абсолютных, так и относительных показателей на фоне постепенно нарастающей заболеваемости ПсА в КО.
Кроме того, исследование продемонстрировало, что потенциальные ЛВ возникают у 93% пациентов с РА, получающих терапию МТ. Клинически значимыми являются комбинации МТ с НПВП и ИПП: МТ + НПВП + ИПП (82,2%), МТ + НПВП (12,2%). Необходимость в сопутствующей терапии и возникновение ЛВ подчеркивают важность внимательной оценки применения других ЛС с целью обеспечения безопасности и эффективности лечения.
Следует отметить, что методология ATC/DDD является эффективным инструментом для количественной оценки потребления ЛС в различных странах и регионах, а также для анализа изменений во временной перспективе. Полученные данные могут служить основой для дальнейших исследований и разработки рекомендаций по оптимизации лечения пациентов с РА и ПсА.
1. https://bars.group/directions/medicinskaya-informacionnaya-sistema/.
2. ACR (англ. American College of Rheumatology) – Американская коллегия ревматологов; EULAR (англ. European Alliance of Associations for Rheumatology) – Европейский альянс ревматологических ассоциаций.
Список литературы
1. Рачина С.А., Козлов Р.С., Белькова Ю.А. Фармакоэпидемиология: от теоретических основ к практическому применению. ФАРМАКОЭКОНОМИКА. Современная фармакоэкономика и фармакоэпидемиология. 2014; 7 (1): 33–9.
2. Bilgin E., Duran E., Bolek E.C., et al. AB0742 conventional synthetic DMARDs in psoriatic arthritis – changing practice in biologic era: real-life results from HURBIO-PsA registry. Ann Rheum Dis. 2020; 79 (Suppl. 1): 1667.1. http://doi.org/10.1136/annrheumdis-2020-eular.4735.
3. Anghel L.A. Utilization patterns of disease-modifying antirheumatic drugs (DMARDs) in patients with autoimmune rheumatic diseases. Farmacia. 2019; 67 (1): 184–92. http://doi.org/10.31925/farmacia.2019.1.25.
4. Чичасова Н.В., Лила А.М. Метотрексат в лечении ревматоидного артрита и псориатического артрита. Лечащий врач. 2020; 7: 42–51. https://doi.org/10.26295/OS.2020.12.42.002.
5. Насонов Е.Л., Амирджанова В.Н., Олюнин Ю.А. и др. Применение метотрексата при ревматоидном артрите. Рекомендации Общероссийской общественной организации «Ассоциация ревматологов России». Научно-практическая ревматология. 2023; 61 (4): 435–49. https://doi.org/10.47360/1995-4484-2023-435-449.
6. Ng B., Chu A., Khan M.M. A retrospective cohort study: 10-year trend of disease-modifying antirheumatic drugs and biological agents use in patients with rheumatoid arthritis at Veteran Affairs Medical Centers. BMJ Open. 2013; 3 (4): e002468. http://doi.org/10.1136/bmjopen-2012-002468.
7. Fassmer A.M., Garbe E., Schmedt N. Frequency and trends of diseasemodifying antirheumatic drug (DMARD) use in Germany. Pharmacol Res Perspect. 2016; 4 (5): e00254. http://doi.org/10.1002/prp2.254.
8. Jin X.M., Lee J., Choi N.K., et al. Utilization patterns of diseasemodifying antirheumatic drugs in elderly rheumatoid arthritis patients. J Korean Med Sci. 2014; 29 (2): 210–6. https://doi.org/10.3346/jkms.2014.29.2.210.
9. Зиганшина Л.Е., Магсумова Д.Р., Кучаева А.В. и др. ATC/DDD-классификационная система в фармакоэпидемиологических исследованиях. Качественная клиническая практика. 2004; 1: 28–33.
10. Elseviers M., Wettermark B., Almarsdóttir A.B., et al. Drug utilization research: methods and applications. Wiley-Blackwell; 2016: 536 pp.
11. ATC/DDD Index. Norwegian Institute of Public Health WHO Collaborating Centre for Drug Statistics Methodology. Available at: https://atcddd.fhi.no/atc_ddd_index/?code=L04AX03&showdescription=yes (accessed 16.07.2024).
12. Guidelines for ATC classification and DDD assignment. Norwegian Institute of Public Health WHO Collaborating Centre for Drug Statistics Methodology. Available at: https://atcddd.fhi.no/atc_ddd_index_and_guidelines/guidelines/ (accessed 16.07.2024).
13. Территориальный орган Федеральной службы государственной статистики по Калининградской области. Население. URL: https://39.rosstat.gov.ru/population (дата обращения 16.07.2024).
14. Hollingworth S., Kairuz T. Measuring medicine use: applying ATC/ DDD methodology to real-world data. Pharmacy. 2021; 9 (1): 60. https://doi.org/10.3390/pharmacy9010060.
15. Almutairi K., Nossent J., Preen D., et al. POS0632 The longitudinal associations of methotrexate and biologic use on hospital admission for rheumatoid arthritis patients in Western Australia population (1995– 2014). Ann Rheum Dis. 2021; 80 (Suppl. 1): 554. https://doi.org/10.1136/annrheumdis-2021-eular.3230.
16. Won S., Cho S.K., Kim D., et al. Update on the prevalence and incidence of rheumatoid arthritis in Korea and an analysis of medical care and drug utilization. Rheumatol Int. 2018; 38 (4): 649–56. https://doi.org/10.1007/s00296-017-3925-9.
17. Khraishi M., Ivanovic J., Zhang Y., et al. Real-world utilization of methotrexate or prednisone co-therapy with etanercept among Canadian patients with rheumatoid arthritis: a retrospective cohort study. Curr Med Res Opin. 2019; 35 (11): 2025–33. https://doi.org/10.1080/03007995.2019.1636543.
18. Lee M.P., Lii J., Jin Y., et al. Patterns of systemic treatment for psoriatic arthritis in the US: 2004–2015. Arthritis Care Res. 2018; 70 (5): 791–6. https://doi.org/10.1002/acr.23337.
19. Fraenkel L., Bathon J.M., England B.R., et al. 2021 American College of Rheumatology guideline for the treatment of rheumatoid arthritis. Arthritis Rheumatol. 2021; 73 (7): 1108–23. https://doi.org/10.1002/art.41752.
20. Tarp S., Jorgensen T.S., Furst D.E., et al. Added value of combining methotrexate with a biological agent compared to biological monotherapy in rheumatoid arthritis patients: a systematic review and meta-analysis of randomised trials. Semin Arthritis Rheum. 2019; 48 (6): 958–66. https://doi.org/10.1016/j.semarthrit.2018.10.002.
21. Smolen J.S., Landewé R.B.M., Bijlsma J.W.J., et al. EULAR recommendations for the management of rheumatoid arthritis with synthetic and biological disease-modifying antirheumatic drugs: 2019 update. Ann Rheum Dis. 2020; 79 (6): 685–99. https://doi.org/10.1136/annrheumdis-2019-216655.
22. Gottlieb A., Merola J.F. Psoriatic arthritis for dermatologists. J Dermatolog Treat. 2020; 31 (7): 662–79. http://dx.doi.org/10.1080/09546634.2019.1605142.
23. Coates L.C., Kavanaugh A., Mease P.J., et al. Group for research and assessment of psoriasis and psoriatic arthritis 2015 treatment recommendations for psoriatic arthritis. Arthritis Rheumatol. 2016; 68 (5): 1060–71. https://doi.org/10.1002/art.39573.
24. Montag K., Gingold M., Boers A., Littlejohn G. Disease-modifying antirheumatic drug usage, prescribing patterns and disease activity in rheumatoid arthritis patients in community-based practice. Intern Med J. 2011; 41 (6): 450–5. https://doi.org/10.1111/j.1445-5994.2010.02240.x.
25. Каратеев А.Е., Ермакова Ю.А., Березюк А.Н., Соловьева Е.С. Метотрексат и ингибиторы протонной помпы: имеется ли негативное фармакологическое взаимодействие? Научно-практическая ревматология. 2013; 51 (6): 662–5.
26. Iwaki M., Shimada H., Irino Y., et al. Inhibition of methotrexate uptake via organic anion transporters OAT1 and OAT3 by glucuronides of nonsteroidal anti-inflammatory drugs. Biol Pharm Bull. 2017; 40 (6): 926–31. http://doi.org/10.1248/bpb.b16-00970.
27. Tracy T., Krohn K., Jones D., et al. The effects of a salicylate, ibuprofen, and naproxen on the disposition of methotrexate in patients with rheumatoid arthritis. Eur J Clin Pharmacol. 1992; 42 (2): 121–5. https://doi.org/10.1007/bf00278469.
28. Bagatini F., Blatt C.R., Maliska G., et al. Potential drug interactions in patients with rheumatoid arthritis. Rev Bras Reumatol. 2011; 51 (1): 29–39. http://doi.org/10.1590/S0482-50042011000100003.
29. Инструкция по медицинскому применению лекарственного препарата Метотрексат-РОНЦ®. Государственный реестр лекарственных средств. URL: https://grls.rosminzdrav.ru/Grls_View_v2.aspx?routingGuid=0f1ca4f4-7407-4900-85de-e873e382f622 (дата обращения 16.07.2024).
Об авторах
С. А. ДоктороваРоссия
Докторова Светлана Алексеевна
WoS ResearcherID: JCP-1160-2023
Scopus Author ID: 57918372500
ул. А. Невского, д. 14, Калининград 236041
Ю. Ю. Грабовецкая
Россия
Грабовецкая Юлия Юрьевна
Scopus Author ID: 57222427083
ул. Клиническая, д. 74, Калининград 236016
А. В. Зуев
Россия
Зуев Андрей Викторович, д.м.н., проф.
ул. А. Невского, д. 14, Калининград 236041
Ю. Н. Аксенова-Сорохтей
Россия
Аксенова-Сорохтей Юлия Николаевна, к.ю.н., доцент
WoS ResearcherID: V-2867-2017
Scopus Author ID: 36150403000
ул. А. Невского, д. 14, Калининград 236041
В. В. Рафальский
Россия
Рафальский Владимир Витальевич, д.м.н., проф.
WoS ResearcherID: G-3172-2013
Scopus Author ID: 15023010400
ул. А. Невского, д. 14, Калининград 236041
Что уже известно об этой теме?
► Метотрексат (МТ) является препаратом первой линии для лечения ревматоидного артрита (РА) и псориатического артрита (ПсА) благодаря высокой эффективности и благоприятному профилю безопасности
► Фармакоэпидемиологические исследования демонстрируют тенденции потребления лекарственных средств и паттерны назначения среди пациентов с ревматологическими заболеваниями
Что нового дает статья?
► С помощью ATC/DDD-анализа показано значительное увеличение потребления МТ у пациентов с РА и ПсА в Калининградской обл. в период с 2018 по 2023 гг.
► Основная терапевтическая комбинация у 55,8% пациентов – «МТ + нестероидные противовоспалительные препараты», что подчеркивает необходимость комплексного подхода в лечении
► Отмечена необходимость назначения МТ в терапевтических дозах, достигающих 25 мг/нед, для более эффективного контроля заболеваний и минимизации дополнительных рисков, связанных с комбинированной терапией
Как это может повлиять на клиническую практику в обозримом будущем?
► Результаты исследования могут помочь в разработке практических рекомендаций для более эффективного использования МТ в клинической практике
► Понимание паттернов назначения препаратов поможет в оптимизации фармакотерапии с высоким уровнем коморбидности
Рецензия
Для цитирования:
Докторова С.А., Грабовецкая Ю.Ю., Зуев А.В., Аксенова-Сорохтей Ю.Н., Рафальский В.В. Анализ практики использования метотрексата у пациентов с ревматоидным и псориатическим артритом. ФАРМАКОЭКОНОМИКА. Современная фармакоэкономика и фармакоэпидемиология. 2025;18(1):33-41. https://doi.org/10.17749/2070-4909/farmakoekonomika.2024.273
For citation:
Doktorova S.A., Grabovetskaya Yu.Yu., Zuev A.V., Aksenova-Sorokhtei J.N., Rafalskiy V.V. Analysis of methotrexate use practice in patients with rheumatoid and psoriatic arthritis. FARMAKOEKONOMIKA. Modern Pharmacoeconomics and Pharmacoepidemiology. 2025;18(1):33-41. (In Russ.) https://doi.org/10.17749/2070-4909/farmakoekonomika.2024.273

Контент доступен под лицензией Creative Commons Attribution-NonCommercial-ShareAlike 4.0 International License.






































