Перейти к:
Хемореактомное исследование эффектов препарата Актитропил (фонтурацетам): молекулярные механизмы влияния на метаболизм жировой ткани
https://doi.org/10.17749/2070-4909/farmakoekonomika.2024.260
Аннотация
Цель: провести хемореактомный, фармакоинформационный и хемонейроцитологический анализ свойств рацетамов (пирацетам, анирацетам, прамирацетам, леветирацетам, фонтурацетам).
Материал и методы. Хемореактомный, фармакоинформационный и хемонейроцитологический методы анализа свойств молекул основаны на хемореактомной методологии – новейшем направлении приложения систем машинного обучения в области постгеномной фармакологии. Оценка фармакологических возможностей молекул в рамках хемореактомной методологии проводится посредством сравнения химической структуры молекул рацетамов со структурами молекул, для которых молекулярно-фармакологические свойства изучены с использованием алгоритмов обучения искусственного интеллекта на основе информации типа big data, представленной в базах данных PubChem, HMDB, STRING, PharmGKB. На основании всего комплекса различий между молекулами во взаимодействиях с белками-рецепторами для каждой вычисляли балл «противодействия ожирению» как порядковый номер этой молекулы при упорядочении по убыванию значений соответствующих хемореактомных констант IC50, EC50.
Результаты. Липолитический эффект прогнозируется именно для фонтурацетама в результате активации этой молекулой β3-адреноцепторов, рецепторов аденозина, глюкагоноподобного пептида, сфингозинфосфата и пролифераторов пероксисом, а также специфического ингибирования каннабиноидных, опиоидных, гистаминовых, глутаматных, ноцицептиновых, орексиновых рецепторов и рецепторов нейропептида Y. Вследствие действия этих механизмов фонтурацетам будет способствовать нормализации аппетита и улучшению метаболизма жировой ткани. Значения суммарного балла липолитического эффекта, полученные по всем установленным взаимодействиям с рецепторами, составили 4,3±0,9 для фонтурацетама, 3,0±1,4 для прамирацетама и 2,5±1,5 для всех остальных молекул.
Заключение. Результаты анализа позволяют утверждать, что липолитические эффекты фонтурацетама (Актитропил – АО «Фармстандарт», Россия) будут проявляться гораздо сильнее, чем для других рацетамов (пирацетама, анирацетама, прамирацетама, леветирацетама). Хемореактомный анализ фонтурацетама указал на новые молекулярные механизмы фармакологического действия молекулы, обеспечивающие снижение избыточного аппетита и нормализацию массы тела. Фонтурацетам является единственным ноотропным препаратом, показанным для терапии ожирения.
Ключевые слова
Для цитирования:
Громова О.А., Торшин И.Ю. Хемореактомное исследование эффектов препарата Актитропил (фонтурацетам): молекулярные механизмы влияния на метаболизм жировой ткани. ФАРМАКОЭКОНОМИКА. Современная фармакоэкономика и фармакоэпидемиология. 2024;17(2):172-181. https://doi.org/10.17749/2070-4909/farmakoekonomika.2024.260
For citation:
Gromova O.A., Torshin I.Yu. Chemoreactomic study of fonturacetam effects: molecular mechanisms of influence on adipose tissue metabolism. FARMAKOEKONOMIKA. Modern Pharmacoeconomics and Pharmacoepidemiology. 2024;17(2):172-181. (In Russ.) https://doi.org/10.17749/2070-4909/farmakoekonomika.2024.260
ВВЕДЕНИЕ / INTRODUCTION
Фонтурацетам (Актитропил – АО «Фармстандарт», Россия) является ноотропным препаратом рацетамового ряда [1], дополнительно проявляющим антиастеническое, адаптогенное, противовоспалительное и нейромодуляторное действие [2]. Фонтурацетам эффективен при ишемии головного мозга, нейродегенеративной патологии, эпилепсии, астении, психических расстройствах (в т.ч. при алкогольной интоксикации и зависимости) [3].
Интересным свойством фонтурацетама является его терапевтический эффект в отношении ожирения, заключающийся в снижении прибавки массы тела и гипергликемии на диете с высоким содержанием углеводов и жиров [4], особенно на фоне микронутриентных дефицитов [5]. Метаболический синдром – доказанный фактор риска не только цереброваскулярных заболеваний [6], но и нейродегенеративной патологии (в т.ч. болезни Альцгеймера) [7]. Изменения количества и размеров адипоцитов при ожирении влияют на состояние окружающих структур, сопровождаясь изменениями секреции адипокинов, гибелью адипоцитов, локальной гипоксией. В результате возрастают неконтролируемые воспалительные реакции, приводящие к системному процессу и появлению резистентности к инсулину [8]. В связи с этим положительное влияние фонтурацетама на углеводный и жировой обмен наряду с противовоспалительными эффектами может существенно повысить эффективность лечения пациентов с метаболическим синдромом и коморбидной неврологической патологией.
Однако молекулярные механизмы влияния фонтурацетама на метаболизм жировой ткани в настоящий момент остаются не вполне изученными. Делаются предположения, что препарат может улучшать чувствительность к лептину [4] (возможно, посредством усиления дофаминергической нейротрансмиссии), снижая чувство голода и процесс отложения жира [9]. При этом следует учитывать, что активация дофаминовых рецепторов D2 может предрасполагать к ожирению [10], а антагонисты (не агонисты) D2-рецепторов дофамина снижают гликемию при ожирении [11].
Для выявления потенциальных механизмов фармакологических эффектов фонтурацетама перспективным представляется подход в соответствии с постгеномной парадигмой [12]. В рамках постгеномного подхода молекула любого лекарственного средства мимикрирует под определенные метаболиты (вследствие наличия сходств в химической структуре) и, связываясь с теми или иными белками протеома, производит соответствующие данному лекарству эффекты (как терапевтические, так и нежелательные). Хемореактомный анализ – информационная технология постгеномных исследований, позволяющая, в частности, оценивать профиль взаимодействий молекулы с заданной структурой с белками протеома (профиль сродства) [13][14].
В настоящей работе хемореактомный анализ [15] применен для оценки эффектов фонтурацетама на углеводный и жировой метаболизм в сравнении с другими рацетамами. Анализ проводили с использованием новейших технологий машинного обучения (ошибочно называемого «искусственным интеллектом»), разрабатываемых в научной школе академика РАН Ю.И. Журавлева и члена корреспондента РАН К.В. Рудакова [16].
Цель – провести хемореактомный, фармакоинформационный и хемонейроцитологический анализ свойств рацетамов (пирацетама, анирацетама, прамирацетама, леветирацетама, фонтурацетама).
МАТЕРИАЛ И МЕТОДЫ / MATERIAL AND METHODS
Методы анализа / Methods of analysis
Хемореактомный, фармакоинформационный и хемонейроцитологический методы анализа свойств молекул основаны на хемореактомной методологии – новейшем направлении приложения систем машинного обучения в области постгеномной фармакологии [14]. Анализ фармакологических возможностей молекул в рамках хемореактомной методологии проводится посредством сравнения химической структуры исследуемой молекулы со структурами миллионов других молекул, для которых молекулярно-фармакологические свойства уже были изучены в экспериментальных и клинических исследованиях. Обучение алгоритмов искусственного интеллекта проводится на основе информации типа big data, представленной в базах данных PubChem, HMDB, STRING, PharmGKB [17], и осуществляется с многоуровневым контролем качества обучения согласно дизайну «скользящий контроль» по комбинаторной теории разрешимости в рамках топологического подхода к анализу данных [15][16].
Исследуемые молекулы / Studied molecules
Структуры молекул, исследованных в настоящей работе, приведены на рисунке 1.
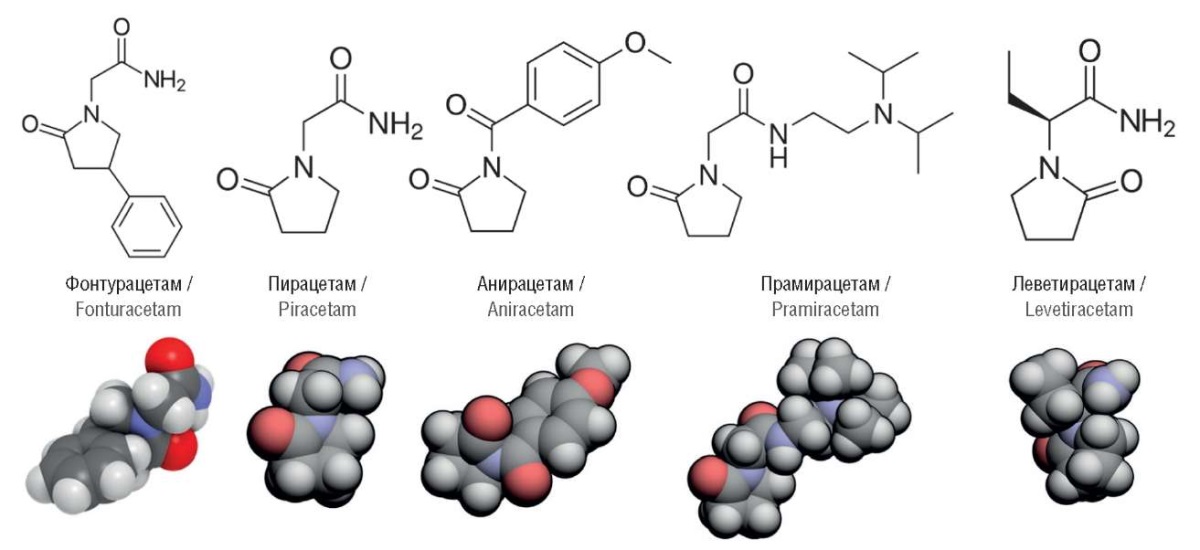
Рисунок 1. Химические структуры фонтурацетама и других исследованных молекул
Figure 1. Chemical structures of fonturacetam and other studied molecules
Дифференциальный хемореактомный анализ заключается в нахождении фармакологических активностей, которые позволяют максимально отличать каждую из исследованных молекул от всех остальных. Активности оценивали через вычисление значений констант полуингибирования (англ. half-maximal inhibitory concentration, IC50) или полуактивации (англ. half-maximal effective concentration, ЕС50) белков-рецепторов. Более низкие значения констант IC50/ЕС50 соответствуют большему сродству молекулы к рецептору. После получения списка таких «дифференцирующих» активностей методом функциональных взаимосвязей [12] выбирали активности, связанные с патофизиологией ожирения.
Вычисления активностей молекул (фонтурацетама, пирацетама, анирацетама, прамирацетама, леветирацетама) проводили с использованием инфраструктуры Центра коллективного пользования «Информатика» ФИЦ «Информатика и управление» РАН, включающей гибридные высокопроизводительные вычислительные комплексы архитектуры Intel на основе серверных платформ Fusion Server G5500 (2.1 GHz, 24 Core) и Server XH620 (2.1 GHz, 16 Core) (обе – Huawei, Китай) по сертифицированным методикам, разработанным в отделе интеллектуальных систем ФИЦ «Информатика и управление» РАН.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ / RESULTS AND DISCUSSION
В результате проведения хемореактомного анализа фонтурацетама и молекул сравнения были получены оценки различных эффектов рацетамов: хемонейроцитологических, протеомных, рецепторных, фармакоинформационных. Анализ полученных данных позволил сформулировать молекулярные механизмы воздействия фонтурацетама на патофизиологию ожирения.
Хемонейроцитологический анализ / Chemoneurocytological analysis
На основе хемонейроцитологического анализа выявлено, что в концентрациях 0,1–1 ммоль/л исследованные молекулы характеризуются прямым нейропротекторным эффектом при оценке выживаемости нейронов в культуре в условиях среднетяжелого глутаматного стресса (100 мкмоль/л глутамата, выживаемость 50% клеток) (рис. 2).
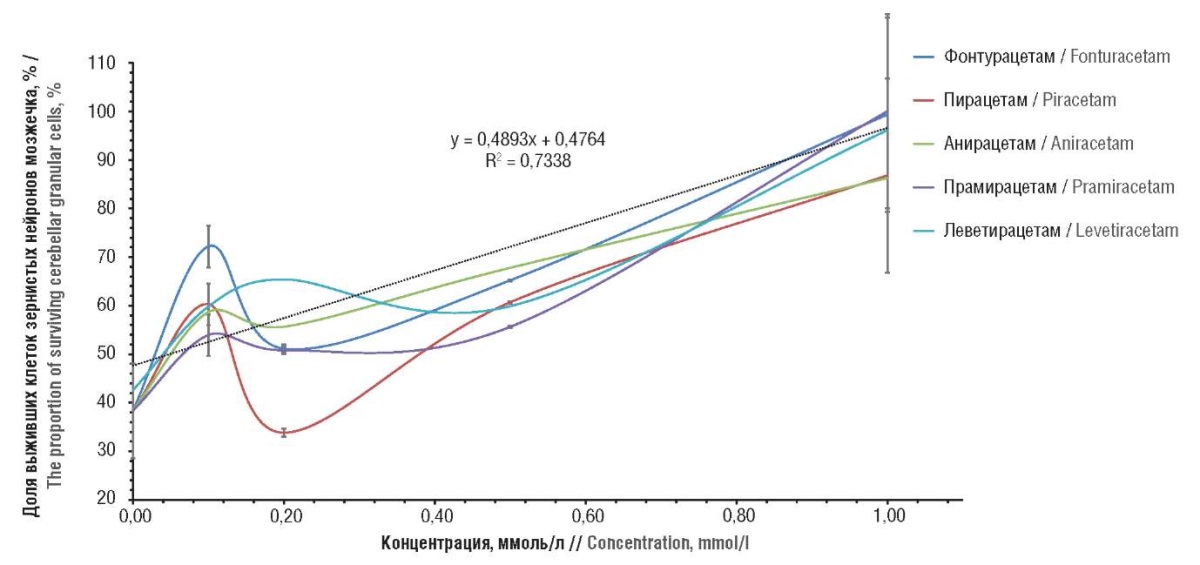
Рисунок 2. Результаты хемонейроцитологического анализа
фонтурацетама и молекул сравнения.
Штрих-пунктиром обозначена линейная аппроксимация возрастания выживаемости нейронов
(при усреднении по всем веществам)
Figure 2. Results of chemoneurocytological analysis of fonturacetam and compared molecules.
The dash-dotted line indicates the linear approximation of the increase in neuronal survival
(averaged over all substances)
Характерной особенностью фонтурацетама являлся выраженный пик выживаемости нейронов при концентрации веществ 0,1 ммоль/л: резкое повышение почти до 72%. Этому же эффекту соответствует и наивысшее прогнозируемое значение наклона кривой «концентрация – выживание» (фонтурацетам: 0,26 у.е., остальные молекулы: 0,13–0,19 у.е.). При этом, в отличие, например, от пирацетама, не происходило существенного снижения нейропротекции при возрастании концентрации фонтурацетама. Таким образом, фонтурацетам может проявлять нейропротекторные свойства при малых концентрациях (0,1 ммоль/л, что соответствует приему ~170 мг фонтурацетама взрослым человеком).
Протеомные эффекты рацетамов / Proteomic effects of racetams
Хемопротеомное профилирование позволило оценить взаимодействия исследованных молекул более чем с 1500 белками протеома человека. Доли белков протеома со схожим воздействием существенно различались между молекулами (табл. 1).
Таблица 1. Доли белков протеома человека (на выборке из 1500 белков)
со схожим воздействием каждой пары молекул, %
Table 1. Proportions of human proteome proteins (on a sample of 1500 proteins)
with similar effects of each pair of molecules, %
|
Молекула / Molecule |
Фонтурацетам / Fonturacetam |
Пирацетам / Piracetam |
Анирацетам / Aniracetam |
Прамирацетам / Pramiracetam |
Леветирацетам / Levetiracetam |
|
Фонтурацетам / Fonturacetam |
100 |
97 |
80 |
90 |
36 |
|
Пирацетам / Piracetam |
97 |
100 |
88 |
95 |
36 |
|
Анирацетам / Aniracetam |
80 |
88 |
100 |
94 |
33 |
|
Прамирацетам / Pramiracetam |
90 |
95 |
94 |
100 |
35 |
|
Леветирацетам / Levetiracetam |
36 |
36 |
33 |
35 |
100 |
На метрической диаграмме (рис. 3) каждому соединению соответствует одна точка, которой, в свою очередь, соответствует 1500-мерный вектор, отражающий взаимодействия соединения с выборкой белков протеома. Чем больше расстояние между точками, тем больше различия в протеомных профилях соответствующих соединений. Видно, что профили взаимодействия фонтурацетама, пирацетама, анирацетама и прамирацетама с белками протеома более похожи, чем профиль леветирацетама. Дифференциальный анализ (см. далее) позволил выявить спектр функциональных различий между исследованными рацетамами с точки зрения воздействия на патофизиологию ожирения.
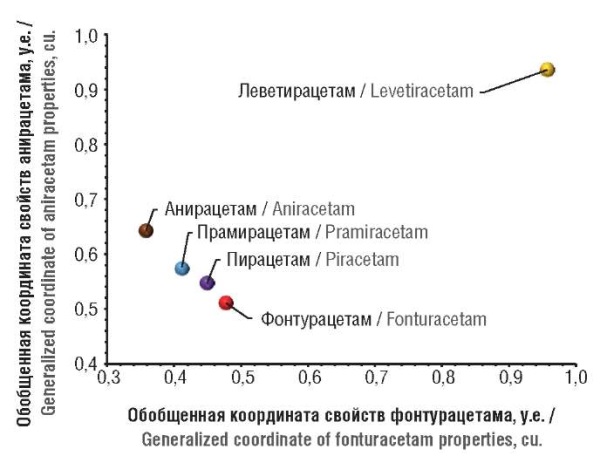
Рисунок 3. Метрическая диаграмма схожести
профилей протеомного воздействия исследованных соединений
Figure 3. Metric diagram of similarity of proteomic effect profiles of the studied compounds
Воздействие рацетамов на рецепторы, модуляция активности которых важна для терапии/профилактики ожирения // The effect of racetams on receptors, which activity modulation is important for obesity treatment/prevention
В результате проведения дифференциального хемореактомного анализа получен список фармакологических активностей, которые позволяют максимально отличать каждую из исследованных молекул от всех остальных. Затем были выбраны активности, связанные с патофизиологией ожирения (рис. 4).
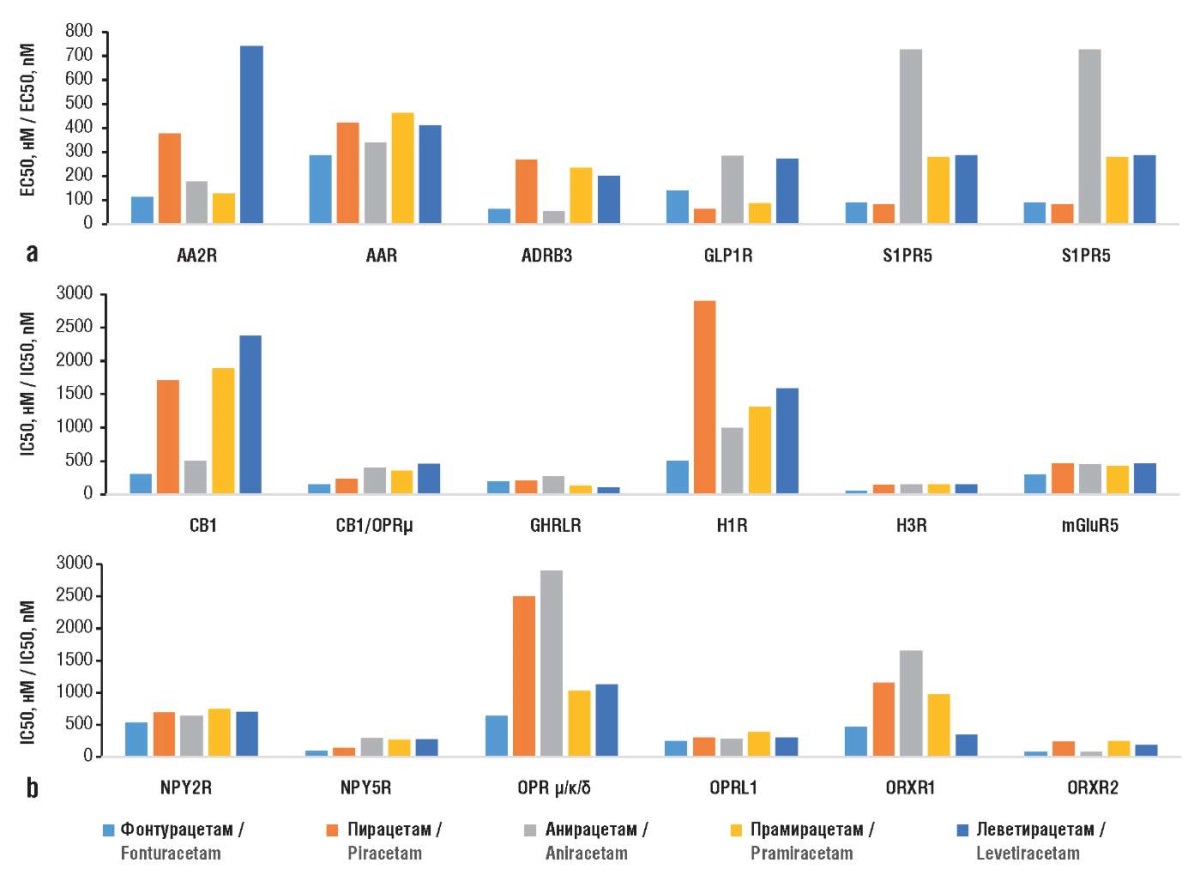
Рисунок 4. Основные результаты дифференциального хемореактомного анализа
фонтурацетама и молекул сравнения:
а – константы активации (англ. half-maximal effective concentration, ЕС50)
таргетных белков протеома;
b – константы ингибирования (англ. half-maximal inhibitory concentration, IC50) белков.
AA2R (англ. adenosine A2A receptor) – аденозиновый рецептор А2А;
AAR (англ. A adenosine receptor) – аденозиновый рецептор любого типа;
ADRB3 (англ. adrenergic receptor beta-3) – адренергический рецептор бета-3;
GLP1R (англ. glucagon-like peptide 1 receptor) – рецептор глюкагоноподобного пептида 1;
S1PR5 (англ. sphingosine-1-phosphate receptor 5) – сфингозин-1-фосфатный рецептор 5;
CB1 (англ. cannabinoid receptor 1) – каннабиноидный рецептор 1;
OPRμ (англ. opioid peptide receptor mu-type) – опиоидный рецептор мю-типа;
GHRLR (англ. ghrelin receptor) – рецептор грелина;
H1R (англ. histamine H1 receptor) – гистаминовый рецептор H1;
H3R (англ. histamine H3 receptor) – гистаминовый рецептор H3;
mGluR5 (англ. metabotropic glutamate receptor 5) – метаботропный глутаматный рецептор 5;
NPY2R (англ. neuropeptide Y receptor Y2) – рецептор-2 нейропептида Y;
NPY5R (англ. neuropeptide Y receptor Y5) – рецептор-5 нейропептида Y;
OPR μ/κ/δ (англ. opioid peptide receptor mu/kappa/delta types) –
опиоидные рецепторы мю-, каппа-, дельта-типов;
OPRL1 (англ. opioid related nociceptin receptor 1) – рецептор ноцицептина;
ORXR1 (англ. orexin-1 receptor) – рецептор орексина 1-го типа;
ORXR2 (англ. orexin-2 receptor) – рецептор орексина 2-го типа
Figure 4. Main results of differential chemoreactome analysis
of fonturacetam and reference molecules:
a – half-maximal effective concentration (ЕС50);
b – half-maximal inhibitory concentration (IC50).
AA2R – adenosine A2A receptor; AAR – A adenosine receptor;
ADRB3 – adrenergic receptor beta-3; GLP1R – glucagon-like peptide-1 receptor;
S1PR5 – sphingosine-1-phosphate receptor 5; CB1 – cannabinoid receptor 1;
OPRμ – opioid peptide receptor mu-type; GHRLR – ghrelin receptor;
H1R – histamine H1 receptor; H3R – histamine H3 receptor;
mGluR5 – metabotropic glutamate receptor 5; NPY2R – neuropeptide Y receptor Y2;
NPY5R – neuropeptide Y receptor Y5;
OPR μ/κ/δ – opioid peptide receptor mu/kappa/delta types;
OPRL1 – opioid related nociceptin receptor 1; ORXR1 – orexin-1 receptor;
ORXR2 – orexin-2 receptor
Выполнена оценка констант ЕС50 для рецепторов аденозина, адреналина, глюкагоноподобного пептида 1 (англ. glucagon-like peptide 1, GLP1), сфингозин-1-фосфата, пролифераторов пероксисом, а также констант IC50 для рецепторов каннабиноидов, опиоидов, грелина, гистамина, глутамата, нейропептида Y (англ. neuropeptide Y, NPY), ноцицептина и орексина.
Фармакоинформационные эффекты / Pharmacoinformatic effects
Ингибирование нейропептида Y
В эксперименте передача сигналов NPY в латеральном гипоталамусе модулирует выбор животными тех или иных компонентов диеты. Хемореактомный анализ показал, что исследованные молекулы могут ингибировать рецепторы NPY, участвующего в регуляции потребления пищи. Значение константы IC50 было ниже у фонтурацетама для рецепторов NPY2R (530 нМ; остальные молекулы: 636–744 нМ) и NPY5R (97 нМ; остальные молекулы: 140–287 нМ). Антагонисты рецепторов NPY тестируются в качестве препаратов против ожирения [18]. Периферическое введение антагониста NPY-рецептора предотвращает ожирение, вызванное «западной диетой» у мышей [19]. Таким образом, ингибирование фонтурацетамом рецепторов NPY может способствовать профилактике ожирения.
Ингибирование рецепторов грелина
Грелин, пептидный гормон из 28 аминокислот, иногда называют «гормоном голода». Рецептор грелина, который также известен как рецептор, стимулирующий секрецию гормона роста (англ. growth hormone secretagogue receptor, GHSR), экспрессируется в различных ядрах гипоталамуса и проявляет орексигенное действие совместно с белком AgRP и нейропептидом NPY. Активация GHSR увеличивает потребление пищи [20]. Хемореактомный анализ продемонстрировал, что фонтурацетам, пирацетам, прамирацетам проявляют практически одинаковую активность по ингибированию GHSR (IC50 73–83 нМ), тогда как ингибирующие эффекты анирацетама и леветирацетама были гораздо слабее (IC50 392 и 443 нМ соответственно). Ингибирование GHSR предотвращает ожирение, связанное со старением [21], – таким образом, ингибирование GHSR фонтурацетамом противодействует ожирению.
Ингибирование рецепторов орексинов
Нейропептиды орексины1 синтезируются нейронами латерального отдела гипоталамуса, активируют одноименные рецепторы ORXR1, ORXR2, влияя на цикл «сон – бодрствование», аппетит и базальный уровень метаболизма. По данным хемореактомного анализа, фонтурацетам (IC50 469 нМ) и леветирацетам (IC50 340 нМ) ингибируют ORXR1 (остальные молекулы: 972–1646 нМ). Фонтурацетам (IC50 79 нМ) и прамирацетам (IC50 80 нМ) могут ингибировать рецептор ORXR2 (остальные молекулы: 185–243 нМ). Ингибирование ORXR1 в миндалевидном теле снижало потребление пищи у крыс с моделью ожирения [22] – таким образом, ингибирование ORXR1/2 фонтурацетамом может снижать избыточное потребление пищи.
Ингибирование опиоидных рецепторов
Опиоидная система участвует в гедонистической регуляции потребления пищи. Антагонисты опиатов можно использовать при лечении компульсивного переедания [23]. Хемореактомный анализ указал на умеренные антиопиоидные эффекты фонтурацетама по отношению к опиоидным рецепторам μ-, κ-, δ-типов (IC50 642 нМ; остальные молекулы: 1030–9438 нМ). Блокада κ-опиоидных рецепторов уменьшает ожирение, вызванное дефицитом эстрогена. Метаанализ доклинических исследований подтвердил анорексигенные эффекты опиоидных антагонистов [24].
Ингибирование каннабиноидных рецепторов
Каннабиноидный рецептор 1 (англ. cannabinoid receptor 1, СВ1), который также является μ-опиоидным рецептором, активируется каннабиноидами и эндогенными опиоидами (β-эндорфин, эндоморфин). СВ1 влияет на прием пищи, моторику желудочно-кишечного тракта, стимулирует высвобождение орексигенного β-эндорфина [25]. По результатам хемореактомного анализа, фонтурацетам может ингибировать СВ1 (IC50 146 нМ; остальные молекулы: 233–458 нМ). Блокада CB1 снижала массу тела, массу внутрибрюшинной жировой ткани, уровень триглицеридов и инсулина в крови на модели гипометаболического и гипоталамического ожирения у крыс [25], а также тормозила провоспалительные реакции макрофагов, активацию инфламмосомы NLRP3 и секрецию интерлейкина 1β [26].
Активация рецептора глюкагоноподобного пептида 1
Коагонист рецептора глюкагона GLP1 влияет на потерю веса у взрослых с избыточной массой тела [27]. Метаанализ 15 исследований подтвердил, что агонисты рецептора GLP1 снижают массу тела и нормализуют кардиометаболические параметры у лиц с ожирением (снижение артериального давления, уровня триглицеридов, липопротеинов очень низкой плотности, липопротеинов низкой плотности, повышение уровней липопротеинов высокой плотности) [28]. Хемореактомный анализ показал, что рецептор GLP1 может активироваться исследованными молекулами: значения константы ЕС50 лежали в диапазоне 62–283 нМ, для фонтурацетама – в середине этого диапазона (139 нМ).
Активация γ-рецептора пролифераторов пероксисом
Гамма-рецептор пролифераторов пероксисом гамма (англ. peroxisome proliferator-activated receptor gamma, PPAR-γ) регулирует выработку грелина, аппетит и потребление пищи. Повышенная экспрессия/активность PPAR-γ снижает потребление пищи на жирной диете [29]. По данным хемореактомного анализа, фонтурацетам активирует PPAR-γ (ЕС50 584 нМ; леветирацетам: 296 нМ; остальные молекулы: 1777–2992 нМ). Несмотря на достаточно слабый эффект (значения констант в диапазоне сотен наномоль на литр), активация PPAR-γ будет приводить к усилению антигрелиновых эффектов фонтурацетама, способствуя дальнейшему снижению аппетита.
Активация адренорецепторов β3
Активация β-адренергических рецепторов предотвращает ожирение и дисфункцию жировой ткани, способствует потере избыточной жировой ткани [30]. Хемореактомные оценки позволяют предполагать, что фонтурацетам (ЕС50 64 нМ) и анирацетам (ЕС50 54 нМ) – агонисты β3-адренергических рецепторов (значения ЕС50 остальных молекул лежали в диапазоне 202–267 нМ). При этом фонтурацетам может также являться достаточно селективным агонистом β3-рецепторов: значения ЕС50 для остальных типов адренорецепторов (α1/2, β2) превышали 600 нМ. Селективные агонисты β3-адренергических рецепторов исследуются как потенциальные препараты для лечения ожирения. Например, зеаксантин уменьшает ожирение, активируя β3-адренергический рецептор и стимулируя термогенез жира у мышей [31].
Ингибирование глутаматных рецепторов
Концентрации глутамата в крови положительно коррелируют с показателями центрального накопления жира (окружность талии, площадь висцеральной жировой ткани и др.), распространенностью сахарного диабета 2-го типа, сердечно-сосудистых заболеваний и неалкогольной жировой болезни печени [32]. Хемореактомный анализ продемонстрировал, что фонтурацетам может ингибировать метаботропный глутаматный рецептор 5 (англ. metabotropic glutamate receptor 5, mGluR5) (IC50 35 нМ; остальные молекулы: 100–110 нМ). При этом фонтурацетам, по всей видимости, является специфическим ингибитором mGluR5: значения IC50 для других типов глутаматных рецепторов (метаботропных или ионотропных) превышали 2000 нМ. Аллостерические модуляторы метаботропных глутамат-рецепторов mGluR1 и mGluR5 являются перспективными молекулами – кандидатами для лечения ожирения и расстройств, связанных с перееданием [33]. Ингибирование глутаматных рецепторов может также являться механизмом реализации антиастенических эффектов фонтурацетама [3].
Ингибирование ноцицептинового рецептора
Эндогенный нейропептид ноцицептин, взаимодействуя с одноименным (ноцицептиновым) опиоидным рецептором, модулирует восприятие боли и двигательную активность, стимулирует стресс, тревогу и ожирение. По результатам хемореактомного анализа, фонтурацетам, пирацетам, прамирацетам могут ингибировать рецептор ноцицептина (IC50 15–22 нМ) в большей степени, чем анирацетам (IC50 64 нМ) или леветирацетам (IC50 76 нМ). Антагонизм ноцицептиновых рецепторов противодействует формированию ожирения и депрессивных состояний [34].
Модуляция активности гистаминовых рецепторов
Гистаминергическая система играет ключевую роль в энергетическом гомеостазе: посредством активации H1-рецептора она увеличивает высвобождение в гипоталамусе гистамина, что снижает потребление пищи и массу тела. Хемореактомный анализ показал возможность того, что фонтурацетам – ингибитор гистаминового рецептора H3R (IC50 55 нМ; остальные молекулы: 142–150 нМ). Соединения, которые усиливают высвобождение гистамина (такие как селективные антагонисты H3R), исследуются как средства для лечения ожирения [35].
Активация аденозиновых рецепторов
Рецепторы аденозина экспрессируются в скелетных мышцах и жировой ткани. Передача сигналов по каскадам аденозиновых рецепторов тормозит возрастную саркопению и противодействует ожирению. По данным хемореактомного анализа, фонтурацетам может активировать аденозиновые рецепторы типа А2А более эффективно (ЕС50 111 нМ), чем все остальные молекулы (ЕС50 137–740 нМ). Лиганды – активаторы рецепторов A2A продемонстрировали эффекты против ожирения в исследованиях на мышах, находящихся на диете с высоким содержанием жиров [36].
Активация сфингозинфосфатных рецепторов
Сфингозин-1-фосфат – биоактивный лизофосфолипид, регулирующий метаболизм липидов. В результате хемореактомного анализа выявлено, что рецептор сфингозин-1-фосфата может активироваться фонтурацетамом и пирацетамом (EC50 83–92 нМ; остальные молекулы: 280–726 нМ). В эксперименте аналог сфингозин-1-фосфата FTY720 подавлял ожирение, вызванное насыщенными жирными кислотами [37].
Молекулярные механизмы воздействия фонтурацетама на снижение массы тела / Molecular mechanisms of fonturacetam effect on body weight loss
Дифференциальный хемореактомный анализ фонтурацетама, пирацетама, анирацетама, прамирацетама и леветирацетама позволил установить молекулярные механизмы воздействия фонтурацетама (Актитропил) на снижение массы тела (рис. 5):
- активация рецепторов адреналина β3, аденозина А2А, GLP1, сфингозин-1-фосфата, PPAR-γ;
- ингибирование рецепторов СВ1, опиоидов μ-, κ-, δ-типов, гистамина Н3, глутамата mGluR5, ноцицептина, орексина OPRX 1/2, грелина GHSR, а также NPY.
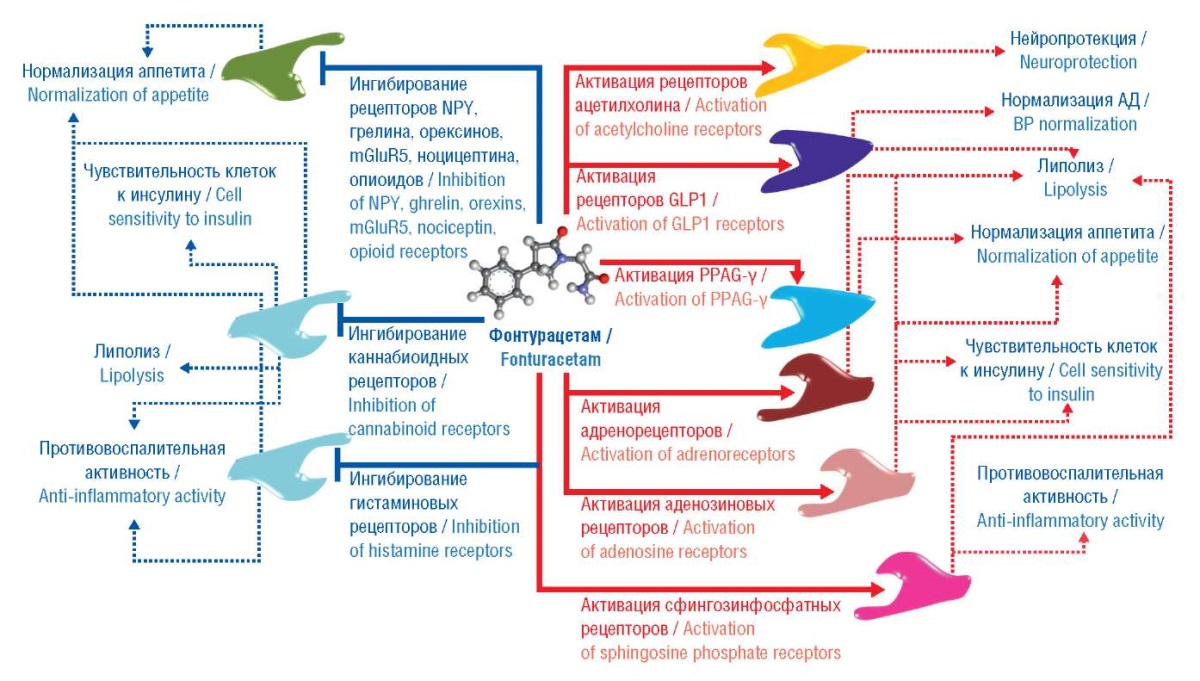
Рисунок 5. Молекулярные механизмы воздействия фонтурацетама
на ожирение и метаболический синдром
NPY (англ. neuropeptide Y) – нейропептид Y;
mGluR5 (англ. metabotropic glutamate receptor 5, mGluR5) –
метаботропный глутаматный рецептор 5;
GLP1 (англ. glucagon-like peptide 1) – глюкагоноподобный пептид 1;
PPAG-γ (англ. peroxisome proliferator-activated receptor gamma) –
гамма-рецептор пролифераторов пероксисом гамма;
АД – артериальное давление
Figure 5. Molecular mechanisms of fonturacetam effect on obesity and metabolic syndrome
NPY – neuropeptide Y; mGluR5 – metabotropic glutamate receptor 5, mGluR5;
GLP1 – glucagon-like peptide 1; PPAG-γ – peroxisome proliferator-activated receptor gamma;
BP – blood pressure
ЗАКЛЮЧЕНИЕ / CONCLUSION
Метаболический синдром и ожирение сопровождают процесс старения, усугубляя тяжесть цереброваскулярной и сердечно-сосудистой патологии, заболеваний печени и др. Хемореактомное исследование фонтурацетама (Актитропил) указало на возможные механизмы влияния данного ноотропного препарата на обмен жиров и углеводов, тем самым объясняя эффективность терапии ожирения и метаболического синдрома в соответствии с показаниями, приведенными в инструкции по медицинскому применению препарата.
1. Слово «орексин» происходит от греческого ορεξις, для которого допустим перевод «аппетит».
Список литературы
1. Бадалян О.Л., Савенков А.А., Авакян Г.Н., Юцкова Е.В. Возможности применения ноотропных препаратов в комплексном лечении эпилепсии. Эпилепсия и пароксизмальные состояния. 2013; 5 (2): 24–30.
2. Ковалев Г.И., Ахапкина В.И., Абаимов Д.А., Фирстова Ю.Ю. Фенотропил как рецепторный модулятор синаптической нейропередачи. Нервные болезни. 2007; 4: 22–26.
3. Громова О.А., Торшин И.Ю., Лазебник Л.Б. Фонтурацетам: молекулярные механизмы эффектов действия при ожирении. Медицинский совет. 2024; 6: 124–31. https://doi.org/10.21518/ms2024-204.
4. Zvejniece L., Svalbe B., Vavers E., et al. S-phenylpiracetam, a selective DAT inhibitor, reduces body weight gain without influencing locomotor activity. Pharmacol Biochem Behav. 2017; 160: 21–9. https://doi.org/10.1016/j.pbb.2017.07.009.
5. Громова О.А., Торшин И.Ю. Микронутриенты и репродуктивное здоровье. Руководство. 2-е изд. М.: ГЭОТАР-Медиа; 2022: 832 c.
6. Zhang F., Liu L., Zhang C., et al. Association of metabolic syndrome and its components with risk of stroke recurrence and mortality: a meta-analysis. Neurology. 2021; 97 (7): e695–705. https://doi.org/10.1212/WNL.0000000000012415.
7. Atti A.R., Valente S., Iodice A., et al. Metabolic syndrome, mild cognitive impairment, and dementia: a meta-analysis of longitudinal studies. Am J Geriatr Psychiatry. 2019; 27 (6): 625–37. https://doi.org/10.1016/j.jagp.2019.01.214.
8. Choe S.S., Huh J.Y., Hwang I.J., et al. Adipose tissue remodeling: its role in energy metabolism and metabolic disorders. Front Endocrinol. 2016; 7: 30. https://doi.org/10.3389/fendo.2016.00030.
9. Beeler J.A., Faust R.P., Turkson S., Ye H. Low dopamine D2 receptor increases vulnerability to obesity via reduced physical activity, not increased appetitive motivation. Biol Psychiatry. 2016; 79 (11): 887–97. https://doi.org/10.1016/j.biopsych.2015.07.009.
10. Labouesse M.A., Sartori A.M., Weinmann O., et al. Striatal dopamine 2 receptor upregulation during development predisposes to diet-induced obesity by reducing energy output in mice. Proc Natl Acad Sci USA. 2018; 115 (41): 10493–8. https://doi.org/10.1073/pnas.1800171115.
11. Tabatabaei Dakhili S.A., Greenwell A.A., Yang K., et al. The antipsychotic dopamine 2 receptor antagonist diphenylbutylpiperidines improve glycemia in experimental obesity by inhibiting succinyl-CoA:3- ketoacid CoA transferase. Diabetes. 2023; 72 (1): 126–34. https://doi.org/10.2337/db22-0221.
12. Torshin I.Yu. Sensing the change: from molecular genetics to personalized medicine (Bioinformatics in the Post-genomic Era). 1st ed. Nova Science Pub Inc; 2012: 366 pp.
13. Торшин И.Ю., Громова О.А., Федотова Л.Э. и др. Хемореактомный анализ молекул цитруллина и малата. Неврология, нейропсихиатрия, психосоматика. 2017; 9 (2): 30–5. http://doi.org/10.14412/2074-2711-2017-2-30-35.
14. Torshin I.Yu. Physiology and medicine (Bioinformatics in the Postgenomic Era). Nova Science Pub Inc; 2007: 302 pp
15. Рудаков К.В., Торшин И.Ю. Об отборе информативных значений признаков на базе критериев разрешимости в задаче распознавания вторичной структуры белка. Доклады Академии наук. 2011; 441 (1): 24–8.
16. Torshin I.Y. On solvability, regularity, and locality of the problem of genome annotation. Pattern Recognit Image Anal. 2010; 20 (3): 386– 95. https://doi.org/10.1134/S1054661810030156.
17. Bolton E., Wang Y., Thiessen P.A., Bryant S.H. PubChem: Integrated platform of small molecules and biological activities. Chapter 12. Ann Rep Comput Chem. 2008; 4: 217–41. https://doi.org/10.1016/S1574-1400(08)00012-1.
18. Marcos P., Coveñas R. Regulation of homeostasis by neuropeptide Y: food intake. Curr Med Chem. 2022; 29 (23): 4026–49. https://doi.org/10.2174/0929867328666211213114711.
19. Ailanen L., Vähätalo L.H., Salomäki-Myftari H., et al. Peripherally administered Y(2)-receptor antagonist BIIE0246 prevents diet-induced obesity in mice with excess neuropeptide Y, but enhances obesity in control mice. Front Pharmacol. 2018; 9: 319. https://doi.org/10.3389/fphar.2018.00319.
20. Wald H.S., Ghidewon M.Y., Hayes M.R., Grill H.J. Hindbrain ghrelin and liver-expressed antimicrobial peptide 2, ligands for growth hormone secretagogue receptor, bidirectionally control food intake. Am J Physiol Regul Integr Comp Physiol. 2023; 324 (4): R547–55. https://doi.org/10.1152/ajpregu.00232.2022.
21. Guillory B., Chen J.A., Patel S., et al. Deletion of ghrelin prevents aging-associated obesity and muscle dysfunction without affecting longevity. Aging Cell. 2017; 16 (4): 859–69. https://doi.org/10.1111/acel.12618.
22. Wang M., Sun X., Guo F., et al. Activation of orexin-1 receptors in the amygdala enhances feeding in the diet-induced obesity rats: blockade with μ-opioid antagonist. Biochem Biophys Res Commun. 2018; 503 (4): 3186–91. https://doi.org/10.1016/j.bbrc.2018.08.120.
23. Díaz-Rúa A., Chivite M., Comesaña S., et al. The opioid system in rainbow trout telencephalon is probably involved in the hedonic regulation of food intake. Front Physiol. 2022; 13: 800218. https://doi.org/10.3389/fphys.2022.800218.
24. Sandoval-Caballero C., Luarte L., Jiménez Y., et al. Meta-analysis of pre-clinical studies on the effects of opioid receptor ligands on food intake, motivation, and choice. Neurosci Biobehav Rev. 2023; 152: 105288. https://doi.org/10.1016/j.neubiorev.2023.105288.
25. Chen W., Chen Z., Xue N., et al. Effects of CB1 receptor blockade on glutamate induced hypometabolic and hypothalamic obesity in rats. Naunyn Schmiedebergs Arch Pharmacol. 2013; 386 (8): 721–32. https://doi.org/10.1007/s00210-013-0875-y.
26. Jourdan T., Godlewski G., Cinar R., et al. Activation of the Nlrp3 inflammasome in infiltrating macrophages by endocannabinoids mediates beta cell loss in type 2 diabetes. Nat Med. 2013; 19 (9): 1132– 40. https://doi.org/10.1038/nm.3265.
27. Friedrichsen M.H., Endahl L., Kreiner F.F., et al. Results from three phase 1 trials of NNC9204-1177, a glucagon/GLP-1 receptor co-agonist: effects on weight loss and safety in adults with overweight or obesity. Mol Metab. 2023; 78: 101801. https://doi.org/10.1016/j.molmet.2023.101801.
28. Haq Ansari H.U.H., Qazi S.U., Sajid F., et al. Efficacy and safety of glucagon-like-peptide-1 receptor agonists on body weight and cardiometabolic parameters in individuals with obesity and without diabetes: a systematic review and meta-analysis. Endocr Pract. 2024; 30 (2): 160–71. https://doi.org/10.1016/j.eprac.2023.11.007.
29. Li Q., Yu Q., Lin L., et al. Hypothalamic peroxisome proliferatoractivated receptor gamma regulates ghrelin production and food intake. Neuropeptides. 2018; 69: 39–45. https://doi.org/10.1016/j.npep.2018.04.002.
30. Hong J., Shi Y., Chen J., et al. Konjac glucomannan attenuate highfat diet-fed obesity through enhancing β-adrenergic-mediated thermogenesis in inguinal white adipose tissue in mice. Glycoconj J. 2023; 40 (5): 575–86. https://doi.org/10.1007/s10719-023-10131-w.
31. Xie J., Liu M., Liu H., et al. Zeaxanthin ameliorates obesity by activating the β3-adrenergic receptor to stimulate inguinal fat thermogenesis and modulating the gut microbiota. Food Funct. 2021; 12 (24): 12734–50. https://doi.org/10.1039/d1fo02863d.
32. Chaouche L., Marcotte F., Maltais-Payette I., Tchernof A. Glutamate and obesity – what is the link? Curr Opin Clin Nutr Metab Care. 2024; 27 (1): 70–6. https://doi.org/10.1097/MCO.0000000000000991.
33. Yohn S.E., Galbraith J., Calipari E.S., Conn P.J. Shared behavioral and neurocircuitry disruptions in drug addiction, obesity, and binge eating disorder: focus on group I mGluRs in the mesolimbic dopamine pathway. ACS Chem Neurosci. 2019; 10 (5): 2125–43. https://doi.org/10.1021/acschemneuro.8b00601.
34. Witkin J.M., Statnick M.A., Rorick-Kehn L.M., et al. The biology of nociceptin/orphanin FQ (N/OFQ) related to obesity, stress, anxiety, mood, and drug dependence. Pharmacol Ther. 2014; 141 (3): 283–99. https://doi.org/10.1016/j.pharmthera.2013.10.011.
35. Mika K., Szafarz M., Zadrożna M., et al. KSK-74: dual histamine H(3) and sigma-2 receptor ligand with anti-obesity potential. Int J Mol Sci. 2022; 23 (13): 7011. https://doi.org/10.3390/ijms23137011.
36. Kim K., Im H., Son Y., et al. Anti-obesity effects of the dual-active adenosine A(2A)/A(3) receptor-ligand LJ-4378. Int J Obes. 2022; 46 (12): 2128–36. https://doi.org/10.1038/s41366-022-01224-x.
37. Rivas D.A., Rice N.P., Ezzyat Y., et al. Sphingosine-1-phosphate analog FTY720 reverses obesity but not age-induced anabolic resistance to muscle contraction. Am J Physiol Cell Physiol. 2019; 317 (3): C502–12. https://doi.org/10.1152/ajpcell.00455.2018.
Об авторах
О. А. ГромоваРоссия
Громова Ольга Алексеевна – д.м.н., профессор, ведущий научный сотрудник
WoS ResearcherID: J-4946-2017
Scopus Author ID: 7003589812
ул. Вавилова, д. 44, корп. 2, Москва 119333
И. Ю. Торшин
Россия
Торшин Иван Юрьевич – к.ф-м.н., к.х.н., ведущий научный сотрудник
WoS ResearcherID: C-7683-2018
Scopus Author ID: 7003300274
ул. Вавилова, д. 44, корп. 2, Москва 119333
Что уже известно об этой теме?
- Метаболический синдром и ожирение сопровождают процесс старения, усугубляя тяжесть цереброваскулярной и сердечно-сосудистой патологии, заболеваний печени
- Фонтурацетам эффективен при ишемии головного мозга, нейродегенеративной патологии, эпилепсии, астении, психических расстройствах (в т.ч. при алкогольной интоксикации и зависимости)
- Интересным свойством фонтурацетама является его терапевтический эффект в отношении ожирения, однако механизмы этого фармакологического эффекта неизвестны
Что нового дает статья?
- Хемореактомный, фармакоинформационный и хемонейроцитологический методы анализа позволяют утверждать, что липолитические эффекты фонтурацетама будут проявляться гораздо сильнее, чем у других рацетамов
- Липолитическое действие фонтурацетама потенциально связано с активацией β3-адреноцепторов, рецепторов аденозина, глюкагоноподобного пептида, сфингозинфосфата и пролифераторов пероксисом
- Липолитический эффект фонтурацетама может реализовываться посредством ингибирования каннабиноидных, опиоидных, гистаминовых, глутаматных, ноцицептиновых, орексиновых рецепторов
Как это может повлиять на клиническую практику в обозримом будущем?
- Хемореактомное исследование фонтурацетама (Актитропил) указало на возможные механизмы влияния данного ноотропного препарата на обмен жиров и углеводов, тем самым объясняя эффективность терапии ожирения и метаболического синдрома
Рецензия
Для цитирования:
Громова О.А., Торшин И.Ю. Хемореактомное исследование эффектов препарата Актитропил (фонтурацетам): молекулярные механизмы влияния на метаболизм жировой ткани. ФАРМАКОЭКОНОМИКА. Современная фармакоэкономика и фармакоэпидемиология. 2024;17(2):172-181. https://doi.org/10.17749/2070-4909/farmakoekonomika.2024.260
For citation:
Gromova O.A., Torshin I.Yu. Chemoreactomic study of fonturacetam effects: molecular mechanisms of influence on adipose tissue metabolism. FARMAKOEKONOMIKA. Modern Pharmacoeconomics and Pharmacoepidemiology. 2024;17(2):172-181. (In Russ.) https://doi.org/10.17749/2070-4909/farmakoekonomika.2024.260

Контент доступен под лицензией Creative Commons Attribution-NonCommercial-ShareAlike 4.0 International License.






































