Перейти к:
Лигнан 7-гидроксиматаирезинол в контексте постгеномной фармакологии
https://doi.org/10.17749/2070-4909/farmakoekonomika.2024.240
Аннотация
Цель: определение молекулярных механизмов действия 7-гидроксиматаирезинола (7(ОН)МР) – основного лигнана экстрактов ели, характеризующегося онкопротективными и противовоспалительными свойствами.
Материал и методы. Анализ 7(ОН)МР проведен на основе хемоинформационного подхода, использующего комбинаторную теорию разрешимости и топологическую теорию распознавания. Постгеномный подход позволяет оценивать действие лекарств на транскрипцию генома (транскриптом) и на протеом в целом.
Результаты. 7(ОН)МР имеет противовоспалительные (ингибирование 5-липоксигеназы, матриксной металлопротеиназы 2, митоген-активируемой киназы 14, рецептора лейкотриена В4, рецептора простагландина) и онкопротективные (антиоксидантный эффект за счет ингибирования гемоксигеназы-2, ингибирование циклин-зависимых киназ 3 и 4, фактора роста эпидермиса, белка mTOR) фармакологические эффекты.
Заключение. Снижая экспрессию пролиферативных генов и генов, вовлеченных в хроническое воспаление, молекула 7(ОН)МР тормозит пролиферацию опухолевых клеток. Фармакоинформационное моделирование показало, что противоспалительные эффекты 7(ОН)МР могут способствовать увеличению продолжительности жизни модельных животных.
Ключевые слова
Для цитирования:
Рубашкина А.Н., Торшин И.Ю., Громова О.А., Галустян А.Н. Лигнан 7-гидроксиматаирезинол в контексте постгеномной фармакологии. ФАРМАКОЭКОНОМИКА. Современная фармакоэкономика и фармакоэпидемиология. 2024;17(2):191-199. https://doi.org/10.17749/2070-4909/farmakoekonomika.2024.240
For citation:
Rubashkina А.N., Torshin I.Yu., Gromova O.A., Galustyan A.N. Lignan 7-hydroxymatairesinol in the context of post-genomic pharmacology. FARMAKOEKONOMIKA. Modern Pharmacoeconomics and Pharmacoepidemiology. 2024;17(2):191-199. (In Russ.) https://doi.org/10.17749/2070-4909/farmakoekonomika.2024.240
ВВЕДЕНИЕ / INTRODUCTION
7-гидроксиматаирезинол (7(ОН)МР), как и некоторые другие лигнаны ели (сезаминол, пинорезинол и др.), проявляет противовоспалительные и другие полезные терапевтические эффекты [1–3]. Важными особенностями 7(ОН)МР являются его низкая хроническая токсичность (полулетальная доза в диапазоне от 600 до 2000 мг/кг/сут) и отсутствие тератогенного и аллергического эффектов [4][5]. Результаты исследований (экспериментальных и клинических) указали на перспективность 7(ОН)МР как противовоспалительного и онкопротективного средства [6]. Однако молекулярные механизмы осуществления этих и других возможных фармакологических эффектов 7(ОН)МР не вполне изучены.
Исследование механизмов молекулярного действия лекарств и молекул-кандидатов – крайне трудоемкий процесс, требующий многолетней напряженной экспериментальной и аналитической работы по конкретному веществу. Постгеномный метод в фармакологии предлагает универсальный подход к характеризации свойств и механизмов молекулярного действия потенциальных лекарств. Важными его компонентами являются изучение эффектов действия лекарств на протеом (совокупность всех белков организма) и транскриптом (совокупность всех РНК организма, образующихся в результате транскрипции генов).
Цель – определение молекулярных механизмов действия 7(ОН)МР – основного лигнана экстрактов ели, обладающего онкопротективными и противовоспалительными свойствами.
МАТЕРИАЛ И МЕТОДЫ / MATERIAL AND METHODS
Хемореактомное моделирование воздействия 7(ОН)МР на протеом выполняли в сравнении с контрольными молекулами (молекулы сравнения – 17-эстрадиол, β-ситостерол, эпигаллокатехин-3-галлат) и путем хемотранскриптомного анализа (оценка воздействия на экспрессию генов) в линии опухолевых клеток.
Хемореактомный анализ / Chemoreactomic analysis
Анализ 7(ОН)МР проведен на основе хемоинформационного подхода (сопоставление химической структуры молекулы-запроса с неизвестными фармакологическими свойствами со структурами молекул в базе данных, для которых свойства были изучены). Хемореактомный анализ основан на новейших технологиях машинного обучения: комбинаторной теории разрешимости и топологической теории распознавания [7–10].
Объектами исследования являются хемографы – особая разновидность графа (математического объекта, совокупности множества вершин и множества ребер) [11]. На основании фундаментальных теоретических результатов (теорема о полноте инварианта и критериях разрешимости/регулярности и комбинаторное тестирование локальной полноты) определяется метрическое расстояние dχ (Х1,Х2) между хемографами Х1 и Х2, которое используется для решения задачи поиска молекул, структурно схожих с 7(ОН)МР. На основании списка схожих молекул осуществляется прогноз фармакологической активности.
Хемотранскриптомный анализ / Chemotranscriptomic analysis
Результаты транскриптомных экспериментов в базе данных Gene Expression Omnibus (GEO)1 представлены в виде таблицы, в столбцах которой указаны гены, а в строках – соответствующие воздействия на клетку (например, те или иные молекулы). При задании типа клеток (например, фибробласты), концентрации и времени воздействия каждый столбец такой таблицы соответствует химической реакции «Генi → мРНКi», в результате которой осуществляется синтез i-й молекулы мРНКi, соответствующей i-му гену (Генi). Расстояние dχ является настраиваемой метрикой, т.к. содержит произвольно настраиваемые параметры – веса ωk. По этим данным настраиваются расстояния dχ (Х1,Х2) между хемографами, на основании которых затем и оцениваются изменения экспрессии каждого i-го гена.
Более детальное описание методологии хемотранскриптомного анализа представлено в работе [12]. Оценка групп генов, вовлеченных в согласованные изменения экспрессии, устанавливались методом функционального связывания [13–15]. Использованы новые математические подходы для определения интервалов информативных значений численных параметров, нахождения метрических сгущений в пространстве параметров биомедицинского исследования [16] и построения метрических карт [17].
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ / RESULTS AND DISCUSSION
Хемореактомный анализ / Chemoreactomic analysis
Хемореактомный анализ молекулы 7(ОН)МР нами был проведен ранее [11]. Хемореактомные оценки ее свойств сравнили с оценками для 17-эстрадиола, фитоэстрогена, β-ситостерола и эпигаллокатехин-3-галлата, что позволило сформулировать молекулярные механизмы противовоспалительных (ингибирование 5-липоксигеназы, матриксной металлопротеиназы 2 (англ. matrix metalloproteinase 2, ММР2), митоген-активируемой протеинкиназы 14 (англ. mitogen-activated protein kinase 14, МАРК14), рецептора лейкотриена В4, рецептора простагландина), онкопротективных (антиоксидантный эффект за счет ингибирования гемоксигеназы-2, ингибирование циклин-зависимых киназ (англ. cyclin-dependent kinase, CDK) 3 и 4, рецептора фактора роста эпидермиса (англ. epidermal growth factor receptor, EGFR), белка mTOR), вазодилаторных (ингибирование адренорецепторов и ренина), а также антибактериальных и противовирусных свойств молекулы 7(ОН)МР [11]. Рассмотрим противовоспалительные и онкопротективные эффекты.
Противовоспалительные свойства
Результаты хемореактомного моделирования подтвердили противовоспалительные эффекты 7(ОН)МР, обусловленные ингибированием окисления арахидоновой кислоты 5-липоксигеназой, ММР2 и МАРК14 (рис. 1). Значение константы концентрации полумаксимального ингибирования (англ. half-maximal inhibitory concentration, IC50) 5-липоксигеназы было в несколько раз ниже для 7(ОН)МР (IC50 213±169 нМ), чем для молекул сравнения (IC50 608–887 нМ). Ингибирование синтеза провоспалительных простагландинов в каскаде арахидоновой кислоты неизбежно сопровождается снижением отека в каррагинановой модели (7(ОН)МР – на 56%, в контроле – на 6,4–37%).
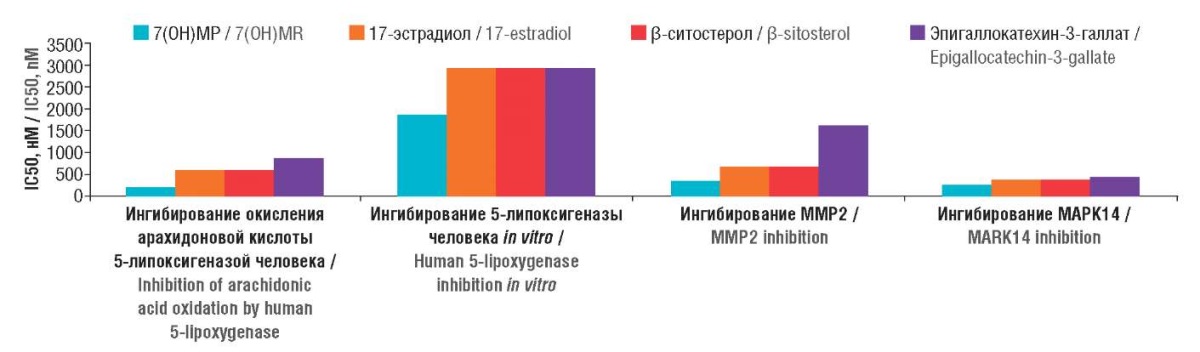
Рисунок 1. Результаты хемореактомного моделирования противовоспалительных эффектов
7-гидроксиматаирезинола (7(ОН)МР) и молекул сравнения.
IC50 (англ. half-maximal inhibitory concentration) –
концентрация полумаксимального ингибирования;
ММР2 (англ. matrix metalloproteinase 2) – матриксная металлопротеиназа 2;
МАРК14 (англ. mitogen-activated protein kinase 14) –
митоген-активируемая протеинкиназа 14
Figure 1. Results of chemoreactome modeling of the anti-inflammatory effects
of 7-hydroxymateiresinol (7(OH)MR) and comparison molecules.
IC50 – half-maximal inhibitory concentration; ММР2 – matrix metalloproteinase 2;
МАРК14 – mitogen-activated protein kinase 14
Для 7(ОН)МР характерно ингибирование MAPK14 (IC50 261±292 нМ, контрольные молекулы: 376–425 нМ). Известно, что МАРК 11, 12, 13 и 14 участвуют в передаче сигнала от провоспалительных цитокинов, так что ингибиторы этих киназ – противовоспалительные средства [11].
Фармакопротеомное моделирование (т.е. хемореактомные оценки взаимодействий молекул с белками протеома) показало, что 7(ОН)МР может связываться с рецептором лейкотриена В4 (противовоспалительное действие), рецептором простагландина (противовоспалительное и вазодилаторное действие), прооксидантным ферментом гемоксигеназой-2. Высокие значения вероятности ингибирования получены для CDK3 и MAP3K2 (онкопротективное действие) (рис. 2а) [11]. На рисунке 2b приведены примеры сравнительных оценок различных фармакологических активностей 7(ОН)МР, связанных с ингибированием указанных белков.
Противовоспалительные эффекты 7(ОН)МР могут способствовать увеличению продолжительности жизни модельных животных. На рисунке 2с представлены хемореактомные оценки эффектов воздействия молекул на продолжительность жизни червей C. еlegans, мух дрозофил и мышей. Очевидно, что среди исследованных молекул именно 7(ОН)МР (в меньшей степени эпигаллокатехин-3-галлат) способствовал увеличению максимальной продолжительности жизни у C. еlegans и дрозофил. Только 7(ОН)МР существенно увеличивал медианную продолжительность жизни у мышей (+8%).
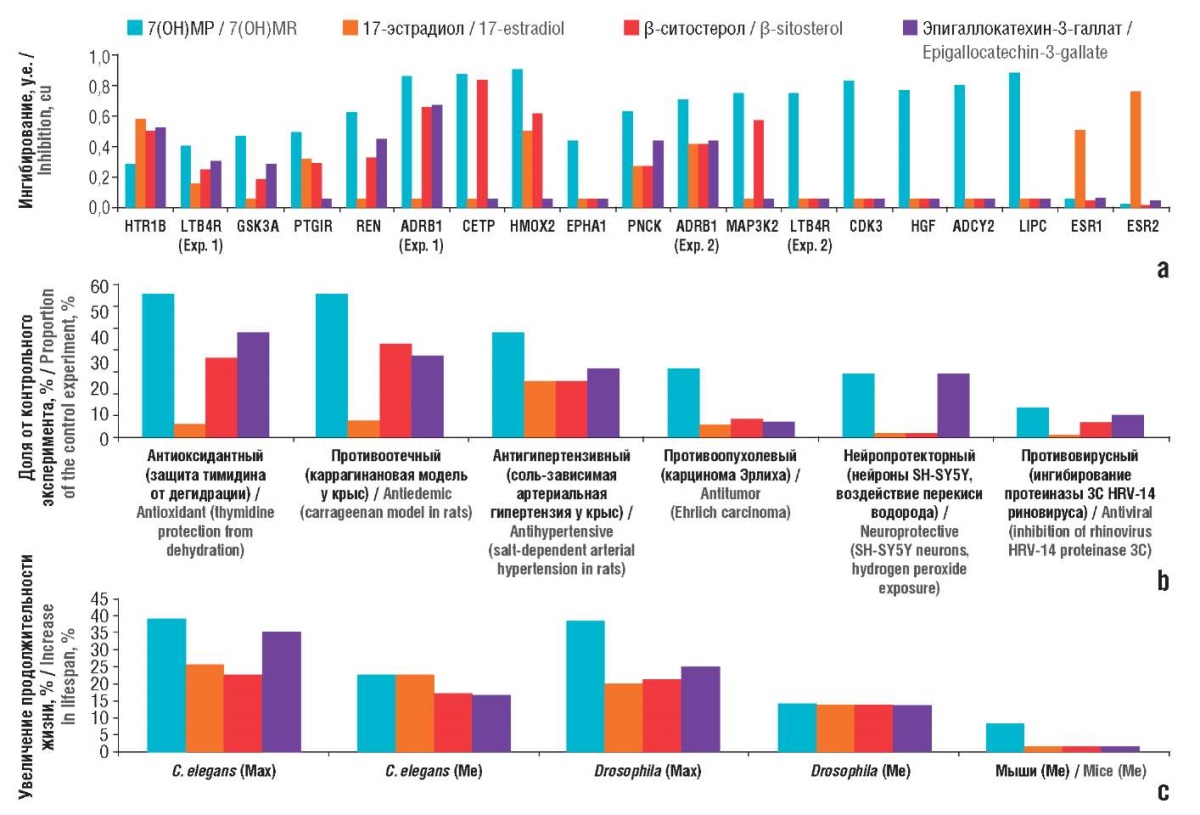
Рисунок 2. Фармакопротеомное моделирование 7-гидроксиматаирезинола (7(ОН)МР)
(оценки вероятности связывания различных белков протеома):
a – вероятности связывания отдельных белков;
b – фармакологические эффекты 7(ОН)МР и других молекул
(указаны значения эффекта в процентах от контрольного эксперимента);
с – воздействие на продолжительность жизни.
HTR1B (англ. 5-hydroxytryptamine receptor 1B) – 5-гидрокситриптаминовый рецептор 1В;
LTB4R (англ. leukotriene B4 receptor) – рецептор лейкотриена B4;
GSK3A (англ. glycogen synthase kinase 3A) – киназа гликогенсинтазы-3A;
PTGIR (англ. prostaglandin I2 receptor) – рецептор простагландина I2;
REN (англ. renin) – ренин;
ADRB1 (англ. В1 adrenergic receptor) – адренергический рецептор В1;
CETP (англ. сholesteryl ester transfer protein) – белок – транспортер холестериновых эфиров;
HMOX2 (англ. heme oxygenase 2) – гемоксигеназа-2;
EPHA1 (англ. ephrin type A receptor 1) – эфриновый рецептор-1 типа А;
PNCK (англ. сalcium/calmodulin-dependent protein kinase) –
кальций-кальмодулин-зависимая протеинкиназа;
MAP3K2 (англ. mitogen activated protein kinase kinase kinase 2) –
митоген-активированная протеинкиназа-киназа-киназа 2;
CDK3 (англ. сyclin-dependent kinase 3) – циклин-зависимая киназа 3;
HGF (англ. hepatocyte growth factor) – фактор роста гепатоцитов;
ADCY2 (англ. adenylate cyclase 2) – аденилатциклаза-2;
LIPC (англ. lipoprotein lipase C) – липопротеин липаза С;
ESR1, ESR2 (англ. estrogen receptors 1, 2) – рецепторы эстрогенов 1-го и 2-го типов;
Exp. 1, 2 (англ. experiments 1, 2) – эксперименты 1, 2;
HSV (лат. herpes simplex virus) – простой вирус герпеса;
Max (англ. maximum) – максимальное значение;
Ме (англ. median) – медианное значение
Figure 2. Pharmacoproteomic modeling of 7-hydroxymateiresinol (7(OH)MR)
(estimates of binding probabilities of different proteome proteins):
a – binding probabilities of individual proteins;
b – pharmacological effects of 7(OH)MR and other molecules
(effect values are presented as percentage of the control experiment);
c – effects on lifespan.
HTR1B – 5-hydroxytryptamine receptor 1B; LTB4R – leukotriene B4 receptor;
GSK3A – glycogen synthase kinase 3A; PTGIR – prostaglandin I2 receptor;
REN – renin; ADRB1 – В1 adrenergic receptor; CETP – сholesteryl ester transfer protein;
HMOX2 – heme oxygenase 2; EPHA1 – ephrin type A receptor 1;
PNCK – сalcium/calmodulin-dependent protein kinase;
MAP3K2 – mitogen activated protein kinase kinase kinase 2;
CDK3 – сyclin-dependent kinase 3; HGF – hepatocyte growth factor;
ADCY2 – adenylate cyclase 2; LIPC – lipoprotein lipase C;
ESR1, ESR2 – estrogen receptors 1, 2; Exp. 1, 2 – experiments 1, 2;
HSV – herpes simplex virus; Max – maximum; Ме – median
Таким образом, хемореактомное моделирование указало на противовоспалительную активность 7(ОН)МР, осуществляемую по различным молекулярным механизмам. Экспериментальные исследования подтверждают этот результат. В моноцитах 7(ОН)МР дозозависимо ингибировал синтез/секрецию фактора некроза опухоли альфа (ФНО-α), а в гранулоцитах – снижал уровни активных форм кислорода и провоспалительного интерлейкина-8 [18]. 7(ОН)МР приводил к снижению ФНО-α-индуцированной адгезии моноцитов к эндотелиоцитам сосудов, снижению активации ядерного фактора каппа В (англ. nuclear factor kappa B, NF-κB) [19]. Также 7(ОН)МР дозозависимо тормозил ФНО-α-индуцированное фосфорилирование внеклеточной сигнально-регулируемой киназы ERK1/2 (или MAPK1/2) и Akt, что важно для замедления роста опухолевых клеток [2], повышал экспрессию ферментов антиоксидантной защиты [20].
Онкопротективные эффекты
Хемореактомное моделирование подтвердило наличие у молекул 7(ОН)МР прямых онкопротективных эффектов и позволило установить наиболее вероятные молекулярные механизмы их осуществления (рис. 3). Показаны более выраженный проапоптотический эффект в клетках НСТ116 (колоректальный рак) (7(ОН)МР: полумаксимальная эффективная концентрация (англ. half-maximal effective concentration, EC50) 59 нМ; контроль: EC50 972–1735 нМ), K562 (лейкемия миелоидная) (7(ОН)МР: увеличение апоптоза на 44%; контроль: 13–36%), антиангиогенная активность (7(ОН)МР: 65%; контроль: 5–6%) и торможение роста опухолей у мышей с солидной карциномой Эрлиха (СКЭ) (7(ОН)МР: на 27±15%; контроль: 5–7%) [11].
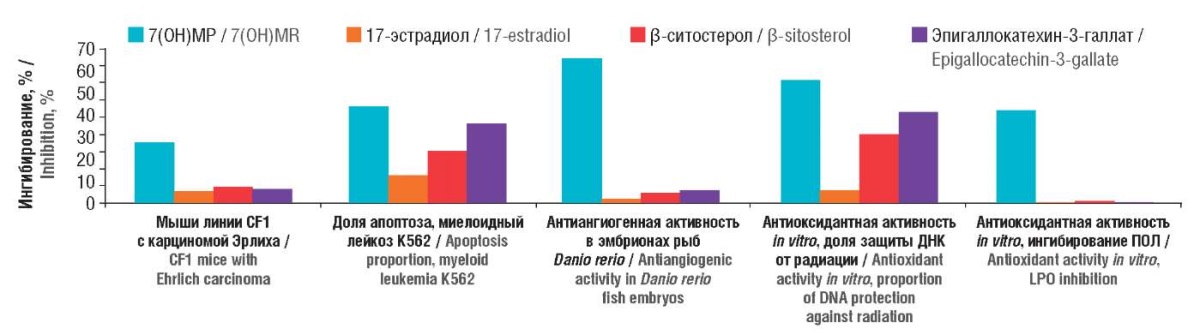
Рисунок 3. Результаты хемореактомного моделирования онкопротективных эффектов
7-гидроксиматаирезинола (7(ОН)МР).
ДНК – дезоксирибонуклеиновая кислота; ПОЛ – перекисное окисление липидов
Figure 3. Results of chemoreactome modeling
of 7-hydroxymateiresinol (7(OH)MR) oncoprotective effects.
DNA – deoxyribonucleic acid; LPO – lipid peroxidation
Хемореактомный анализ показал, что 7(ОН)МР может ингибировать CDK4 (Ki 1427 нМ; остальные: Ki>3000 нМ), EGFR (IC50 244 нМ; остальные: IC50 255–477 нМ), белка mTOR (IC50 632 нМ; остальные: IC50>2000 нМ) [11]. Ингибиторы CDK4 используются в терапии опухолей [21]. Ингибиторы EGFR применяются в лечении рака легких и прямой кишки [22]. Ингибиторы mTOR – группа онкопротективных средств, также проявляющих антигиперинсулинемические, противовоспалительные и геропротекторные свойства [23]. Таким образом, хемореактомный анализ демонстрирует выраженные онкопротективные эффекты 7(ОН)МР.
Хемотранскриптомный анализ и долговременные механизмы осуществления онкопротективных эффектов 7(ОН)МР / Chemotranscriptomic analysis and long-term mechanisms of 7(OH)MR oncoprotective effects
Хемореактомный анализ указал на возможные онкопротективные эффекты 7(ОН)МР, связанные с ингибированием белков протеома. Установление действия онкопротективных средств на транскриптом (т.е. совокупность мРНК всех генов, экспрессируемых в заданном типе клеток) – важная процедура постгеномной фармакологии, необходимая для комплексной оценки желательных и нежелательных эффектов лекарств. Значимой особенностью действия молекул – кандидатов на транскриптом является долговременность формируемых таким образом эффектов.
В результате проведения хемотранскриптомного анализа 7(ОН)МР влияние на экспрессию генов в клетках опухоли молочной железы (линия MCF7) было найдено для 27% изученных генов (3468 из 12700). Лигнан 7(ОН)МР снижал экспрессию пролиферативных генов (n=401), синтез и деградацию белка (n=266), энергетический метаболизм опухолевых клеток (n=91) и хроническое воспаление (n=148), повышая экспрессию генов онкопротективного иммунитета (n=100). Примеры функциональных групп генов, транскрипция которых достоверно изменялась, приведены на рисунке 4.
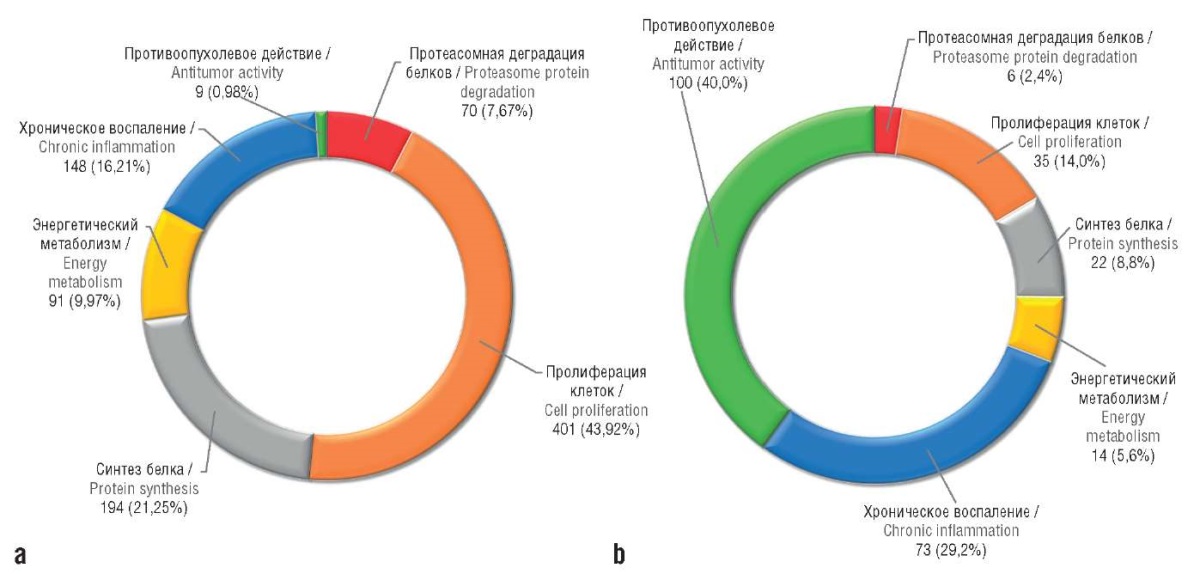
Рисунок 4. Частота встречаемости функциональных групп генов
со сниженной (а) и повышенной (b) транскрипцией
при воздействии 7-гидроксиматаирезинола на онкоклетки линии MCF7
(по результатам хемотранскриптомного анализа).
Указаны абсолютные значения количества генов
в каждой функциональной группе и доли от общего количества (%)
Figure 4. Frequency rates of functional groups of genes
with decreased (a) and increased (b) transcription
under the exposure of 7-hydroxymatairesinol on MCF7 cancer cells
(based on chemotranscriptome analysis).
The absolute values of the number of genes in each functional group
and the proportions of total number (%) are indicated
Установленные изменения транскрипции важны для следующих функций:
- уменьшение интенсивности внутриклеточного гомеостаза белков (что косвенно снижает синтез аденозинтрифосфата (АТФ));
- прямое снижение обеспеченности опухолевых клеток АТФ (сокращение транскрипции генов, функционирующих в митохондриях);
- ингибирование генов, непосредственно вовлеченных в пролиферацию (поддержание теломер, ремонт и репликация ДНК, деление клеток);
- ингибирование каскада NF-κB посредством предотвращения деградации белка Iκ-B, ингибирующего NF-κB;
- повышение транкрипции онкопротективных генов.
К белкам, кодируемым онкопротективными генами, относятся, в частности, интерферон-гамма (стимулирует апоптоз опухолевых клеток), ферменты биосинтеза тиреоидных гормонов (ингибируют рост онкоклеток линии MCF7) [24], рецепторные системы онкопротективных витаминов A, D и C (стимулируют апоптоз опухолевых клеток MCF7 [25]) и др.
В эксперименте онкопротективный эффект 7(ОН)МР наблюдался в дозе 5 мг/кг/сут [26]. Показано, что 7(ОН)МР и его метаболит энтеролактон уменьшают рост и метастазирование опухолей печени [27], предстательной железы [28], матки [29] и аденоматозной полипозной кишечной неоплазии [30]. Прием 30 мг/кг/сут 7(ОН)МР ингибировал рост опухолей молочных желез у крыс. Лигнан 7(ОН)МР уменьшал образование полипов и предотвращал накопление β-катенина в ядре (патофизиологическая метка образования полипов) [2][30].
Нами проведено экспериментальное исследование, показавшее, что 7(ОН)МР в дозах 60 и 120 мг/сут тормозит рост СКЭ даже при провокации эстрадиолом. Онкопротективный эффект 7(ОН)МР был сильнее выражен при использовании более высокой дозы (120 мг/сут): на 21-е сутки объем опухолевого узла снижался в среднем на 620 мм³ по сравнению с контролем (р=0,00036). Анализ динамики опухолевого узла продемонстрировал, что применение 7(ОН)МР замедляет скорость роста опухолей. Прием 120 мг/сут 7(ОН)МР достоверно тормозил интенсивность роста опухолевого узла на фоне применения эстрогенов [11]. Различия были статистически достоверны на 10-е, 13-е, 17-е и 21-е сутки [31].
В частности, в рамках анализа выживаемости мышей при приеме 7(ОН)МР у единичных особей отмечалось существенное повышение продолжительности жизни (рис. 5). В 2 случаях из 14 животные, получавшие 7(ОН)МР в дозе 120 мг/сут на фоне приема эстрадиола, выживали в течение 3 мес после начала эксперимента. В контроле все животные погибли через 90 сут от начала эксперимента. Данный результат интересно сопоставить с результатами хемореактомного анализа, показавшего выраженное влияние 7(ОН)МР на увеличение продолжительности жизни модельных животных (см. рис. 2с). Таким образом, препарат 7(ОН)МР в дозах 60 и 120 мг/кг/сут оказывает достоверное онкопротективное воздействие при СКЭ [31].
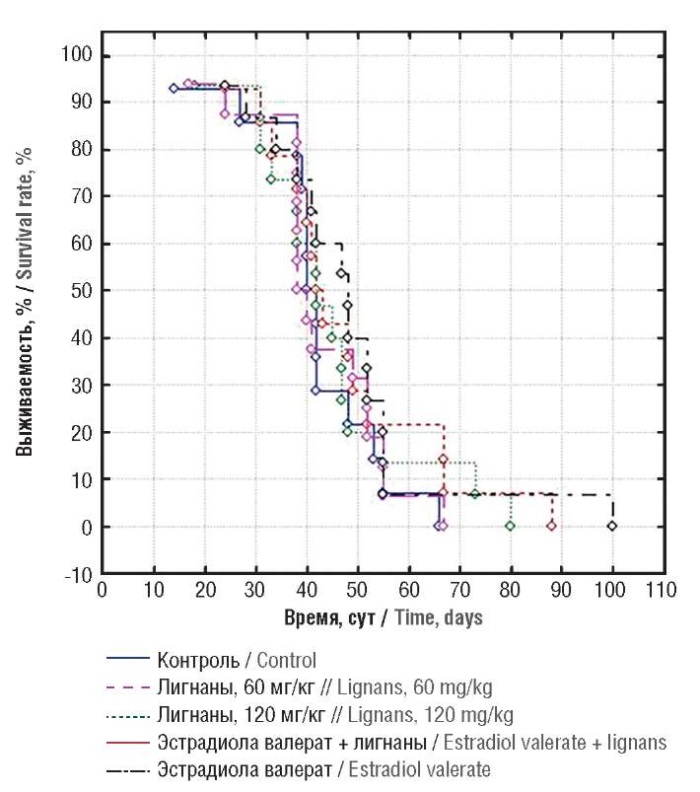
Рисунок 5. Диаграммы Каплана–Мейера выживаемости мышей-опухоленосителей
в экспериментальных группах
Figure 5. Kaplan–Meier diagrams of the survival rate of tumor-bearing mice
in the experimental groups
Результаты хемотранскриптомного моделирования 7(ОН)МР (клетки линии MCF7, рак молочной железы), подтвержденные результатами хемореактомного анализа молекулы и экспериментальными данными [31], также согласуются с результатами клинического исследования 7(ОН)МР у пациенток в предраковом состоянии – с фиброзно-кистозной мастопатией (ФКМ) [32]. Прием 7(ОН)МР в дозе 60 мг/сут (длительность курса 1 мес) приводил к нормализации метаболизма эстрогенов и улучшению клинической симптоматики ФКМ. Анализ метрических диаграмм, указавший на существование кластера высококоррелирующих между собой параметров при применении 7(ОН)МР, позволяет утверждать, что 7(ОН)МР способствует улучшению координации метаболизма различных эстрогенов [32].
ЗАКЛЮЧЕНИЕ / CONCLUSION
Онкопротективные и противовоспалительные свойства 7(ОН)МР, специфического лигнана ели обыкновенной, обусловливают целесообразность его использования в клинической практике онкологов и гинекологов.
По данным хемоинформационного анализа 7(ОН)МР, схожие с ним молекулы характеризуются онкопротективным, антибактериальным, противовирусным, гепатопротекторным, противовоспалительным, вазодилатирующим, гиполипидемическим, антитромботическим, антиоксидантным, противодиабетическим и нейропротекторным эффектами. Хемотранскриптомный анализ 7(ОН)МР в опухолевых клетках рака молочной железы (MCF7) продемонстрировал снижение транкрипции генов пролиферации, синтеза и протеасомной деградации белков, энергетического метаболизма и воспаления при повышении экспрессии онкопротективных генов. Экспериментальные исследования 7(ОН)МР показали достоверное снижение объема опухолевого узла даже при провокации эстрадиолом. Лигнан 7(ОН)МР, влияя на профиль микроэлементов, способствует снижению опухолевых рисков, связанных с гиперэстрогенией при мастопатии.
Таким образом, 7(ОН)МР является перспективной молекулой – кандидатом для лечения ФКМ и профилактики рака молочной железы, особенно в климактерическом периоде.
1. https://www.ncbi.nlm.nih.gov/geo/.
Список литературы
1. Gerstenmeyer E., Reimer S., Berghofer E., et al. Effect of thermal heating on some lignans in flax seeds, sesame seeds and rye. Food Chem. 2013; 138 (2-3): 1847–55. https://doi.org/10.1016/j.foodchem.2012.11.117.
2. Громова О.А., Торшин И.Ю., Рубашкина А.Н. и др. Систематический анализ фундаментальных и клинических исследований лигнана 7-гидроксиматаирезинола. Эффективная фармакотерапия. 2019; 15 (13): 34–41.
3. Udani J.K., Brown D.J., Tan M.O., Hardy M. Pharmacokinetics and bioavailability of plant lignan 7-hydroxymatairesinol and effects on serum enterolactone and clinical symptoms in postmenopausal women: a single-blinded, parallel, dose-comparison study. J Am Coll Nutr. 2013; 32 (6): 428–35. https://doi.org/10.1080/07315724.2013.849578.
4. Lina B., Korte H., Nyman L., Unkila M. A thirteen week dietary toxicity study with 7-hydroxymatairesinol potassium acetate (HMRlignan) in rats. Regul Toxicol Pharmacol. 2005; 41 (1): 28–38. https://doi.org/10.1016/j.yrtph.2004.09.001.
5. Wolterbeek A.P., Roberts A., Korte H., et al. Prenatal developmental toxicity study with 7-hydroxymatairesinol potassium acetate (HMRlignan) in rats. Regul Toxicol Pharmacol. 2004; 40 (1): 1–8. https://doi.org/10.1016/j.yrtph.2004.04.001.
6. Saarinen N.M., Wärri A., Mäkelä S.I., et al. Hydroxymatairesinol, a novel enterolactone precursor with antitumor properties from coniferous tree (Picea abies). Nutr Cancer. 2000; 36 (2): 207–16. https://doi.org/10.1207/S15327914NC3602_10.
7. Журавлёв Ю.И., Рудаков К.В., Торшин И.Ю. Алгебраические критерии локальной разрешимости и регулярности как инструмент исследования морфологии аминокислотных последовательностей. Труды МФТИ. 2011; 3 (4): 45–54.
8. Torshin I.Yu., Rudakov K.V. On the application of the combinatorial theory of solvability to the analysis of chemographs. Part 1: Fundamentals of modern chemical bonding theory and the concept of the chemograph. Pattern Recognit Image Anal. 2014; 24 (1): 11–23. https://doi.org/10.1134/S1054661814010209.
9. Torshin I.Yu. On solvability, regularity, and locality of the problem of genome annotation. Pattern Recognit Image Anal. 2010; 20 (3): 386–95. https://doi.org/10.1134/S1054661810030156.
10. Торшин И.Ю., Громова О.А. Экспертный анализ данных в молекулярной фармакологии. М.: МЦНМО; 2012: 687 с.
11. Торшин И.Ю., Рубашкина А.Н., Лапочкина Н.П., Громова О.А. Хемореактомный анализ 7-гидроксиматаирезинола, 17-эстрадиола, фитоэстрогена, β-ситостерола и эпигаллокатехин-3-галлата. Акушерство, гинекология и репродукция. 2020; 14 (3): 347–60. https://doi.org/10.17749/2313-7347/ob.gyn.rep.2020.152.
12. Торшин И.Ю., Громова О.А., Фролова Д.Е. и др. Дозозависимый хемотранскриптомный анализ дифференциального действия витамина D на экспрессию генов в клетках-предшественниках нейронов NPC и в опухолевых клетках MCF7 человека. Фармакокинетика и фармакодинамика. 2018; 2: 35–51. https://doi.org/110.24411/2587-7836-2018-10013.
13. Torshin I.Yu. Sensing the change: from molecular genetics to personalized medicine. 1st ed. Nova Science Publishers; 2009: 366 pp.
14. Торшин И. Ю., Рубашкина А. Н., Громова О. А. Хемотранскриптомный анализ молекулы 7-гидроксиматаирезинола на опухолевые клетки молочной железы человека линии MCF7. Акушерство, гинекология и репродукция. 2023; 17 (5): 584–96. https://doi.org/10.17749/2313-7347/ob.gyn.rep.2023.409.
15. Громова О.А., Фролова Д.Е., Торшин И.Ю., Филимонова М.В., Сорокина М.А., Рейер И.А., Лиманова O.А., Федотова Л.Э., Майорова Л.А. Противоопухолевые эффекты витамина В12 in vitro, in vivo, in silico. ФАРМАКОЭКОНОМИКА. Современная фармакоэкономика и фармакоэпидемиология. 2024: [принятая рукопись]. https://doi.org/10.17749/2070-4909/farmakoekonomika.2024.231.
16. Torshin I.Yu., Rudakov K.V. On metric spaces arising during formalization of problems of recognition and classification. Part 2: Density properties. Pattern Recognit Image Anal. 2016; 26 (3): 483–96. https://doi.org/10.1134/S1054661816030202.
17. Torshin I.Yu., Rudakov K.V. Combinatorial analysis of the solvability properties of the problems of recognition and completeness of algorithmic models. Part 2: Metric approach within the framework of the theory of classification of feature values. Pattern Recognit Image Anal. 2017; 27 (2): 184–99. https://doi.org/10.1134/S1054661817020110.
18. Cosentino M., Marino F., Maio R.C., et al. Immunomodulatory activity of the lignan 7-hydroxymatairesinol potassium acetate (HMR/lignan) extracted from the heartwood of Norway spruce (Picea abies). Int Immunopharmacol. 2010; 10 (3): 339–43. https://doi.org/10.1016/j.intimp.2009.12.005.
19. Spilioti E., Holmbom B., Papavassiliou A.G., Moutsatsou P. Lignans 7-hydroxymatairesinol and 7-hydroxymatairesinol 2 exhibit anti-inflammatory activity in human aortic endothelial cells. Mol Nutr Food Res. 2014; 58 (4): 749–59. https://doi.org/10.1002/mnfr.201300318.
20. Yang D., Xiao C.X., Su Z.H., et al. (-)-7(S)-hydroxymatairesinol protects against tumor necrosis factor-alpha-mediated inflammation response in endothelial cells by blocking the MAPK/NF- κB and activating Nrf2/HO-1. Phytomedicine. 2017; 32: 15–23. https://doi.org/10.1016/j.phymed.2017.04.005.
21. Samson K. LEE011 CDK inhibitor showing early promise in drug-resistant cancers. Oncol Times. 2014; 36 (3): 39–40. https://doi.org/10.1097/01.COT.0000444043.33304.c1.
22. Liang W., Wu X., Fang W., et al. Network meta-analysis of erlotinib, gefitinib, afatinib and icotinib in patients with advanced non-small-cell lung cancer harboring EGFR mutations. PLoS One. 2014; 9 (2): e85245. https://doi.org/10.1371/journal.pone.0085245.
23. Lamming D.W., Ye L., Sabatini D.M, Baur J.A. Rapalogs and mTOR inhibitors as anti-aging therapeutics. J Clin Invest. 2013; 123 (3): 980–9. https://doi.org/10.1172/JCI64099.
24. Rogowski M., Gollahon L., Chellini G., Assadi-Porter F.M. Uptake of 3-iodothyronamine hormone analogs inhibits the growth and viability of cancer cells. FEBS Open Bio. 2017; 7 (4): 587–601. https://doi.org/10.1002/2211-5463.12205.
25. Aouad P., Saikali M., Abdel-Samad R., et al. Antitumor activities of the synthetic retinoid ST1926 in two-dimensional and three-dimensional human breast cancer models. Anticancer Drugs. 2017; 28 (7): 757–70. https://doi.org/10.1097/CAD.0000000000000511.
26. Saarinen N.M., Huovinen R., Wärri A., et al. Uptake and metabolism of hydroxymatairesinol in relation to its anticarcinogenicity in DMBA-induced rat mammary carcinoma model. Nutr Cancer. 2001; 41 (1-2): 82–90. https://doi.org/10.1080/01635581.2001.9680616.
27. Miura D., Saarinen N.M., Miura Y., et al. Hydroxymatairesinol and its mammalian metabolite enterolactone reduce the growth and metastasis of subcutaneous AH109A hepatomas in rats. Nutr Cancer. 2007; 58 (1): 49–59. https://doi.org/10.1080/01635580701308133.
28. Bylund A., Saarinen N., Zhang J.X., et al. Anticancer effects of a plant lignan 7-hydroxymatairesinol on a prostate cancer model in vivo. Exp Biol Med. 2005; 230 (3): 217–23. https://doi.org/10.1177/153537020523000308.
29. Katsuda S., Yoshida M., Saarinen N., et al. Chemopreventive effects of hydroxymatairesinol on uterine carcinogenesis in Donryu rats. Exp Biol Med. 2004; 229 (5): 417–24. https://doi.org/10.1177/153537020422900510.
30. Oikarinen S.I., Pajari A., Mutanen M. Chemopreventive activity of crude hydroxsymatairesinol (HMR) extract in Apc(Min) mice. Cancer Lett. 2000; 161 (2): 253–8. https://doi.org/10.1016/s0304-3835(00)00662-5.
31. Громова О.А., Рубашкина А.Н., Филимонова М.В. и др. Адъювантная терапия лигнаном 7-гидроксиматаирезинолом как метод повышения онкологической безопасности приема эстрогенов. Эффективная фармакотерапия. 2018; 14 (13): 14–9.
32. Рубашкина А.Н., Лапочкина Н.П., Торшин И.Ю., Громова О.А. Роль 7-гидроксиматоирезинола в модуляции метаболизма эстрогенов и терапии мастопатии. Гинекология. 2020; 22 (4): 43–8.
Об авторах
А. Н. РубашкинаРоссия
Рубашкина Анна Николаевна – аспирант кафедры онкологии, акушерства и гинекологии
Шереметевский пр-т, д. 8, Иваново 153012
И. Ю. Торшин
Россия
Торшин Иван Юрьевич – к.ф-м.н., к.х.н., старший научный сотрудник
WoS ResearcherID: C-7683-2018
Scopus Author ID: 7003300274
ул. Вавилова, д. 44, корп. 2, Москва 119333
О. А. Громова
Россия
Громова Ольга Алексеевна – д.м.н., профессор, ведущий научный сотрудник
WoS ResearcherID: J-4946-2017
Scopus Author ID: 7003589812
ул. Вавилова, д. 44, корп. 2, Москва 119333
А. Н. Галустян
Россия
Галустян Анна Николаевна – к.м.н., доцент, заведующая кафедрой фармакологии с курсом клинической фармакологии и фармакоэкономики
ул. Литовская, д. 2, Санкт-Петербург 194100
Что уже известно об этой теме?
- 7-гидроксиматаирезинол (7(ОН)МР) – основной лигнан экстрактов ели, который обладает онкопротективными и противовоспалительными свойствами
- Важной особенностью 7(ОН)МР является высокая безопасность его применения
- 7(ОН)МР не дает тератогенных и аллергических эффектов
Что нового дает статья?
- Показано, что противовоспалительный механизм молекулярного действия 7(OH)МР включает ингибирование 5-липоксигеназы, матриксной металлопротеиназы 2, митоген-активируемой киназы 14, рецептора лейкотриена В4, рецептора простагландина
- Онкопротективный механизм молекулярного действия 7(OH)МР основан на ингибировании гемоксигеназы-2, циклин-зависимых киназ 3 и 4, фактора роста эпидермиса, белка mTOR
- По данным экспериментального исследования, 7(ОН)МР в дозах 60 и 120 мг/сут тормозит рост солидной карциномы Эрлиха даже при провокации эстрадиолом
Как это может повлиять на клиническую практику в обозримом будущем?
- Онкопротективные и противовоспалительные свойства 7(ОН)МР указывают на перспективность его использования в клинической практике онкологов и гинекологов
Рецензия
Для цитирования:
Рубашкина А.Н., Торшин И.Ю., Громова О.А., Галустян А.Н. Лигнан 7-гидроксиматаирезинол в контексте постгеномной фармакологии. ФАРМАКОЭКОНОМИКА. Современная фармакоэкономика и фармакоэпидемиология. 2024;17(2):191-199. https://doi.org/10.17749/2070-4909/farmakoekonomika.2024.240
For citation:
Rubashkina А.N., Torshin I.Yu., Gromova O.A., Galustyan A.N. Lignan 7-hydroxymatairesinol in the context of post-genomic pharmacology. FARMAKOEKONOMIKA. Modern Pharmacoeconomics and Pharmacoepidemiology. 2024;17(2):191-199. (In Russ.) https://doi.org/10.17749/2070-4909/farmakoekonomika.2024.240

Контент доступен под лицензией Creative Commons Attribution-NonCommercial-ShareAlike 4.0 International License.






































