Перейти к:
Оценка клинико-экономических последствий применения даратумумаба в комбинации с леналидомидом в 1-й и 2-й линиях терапии пациентов с множественной миеломой
https://doi.org/10.17749/2070-4909/farmakoekonomika.2024.237
Аннотация
Цель: оценка клинико-экономических последствий добавления лекарственного препарата (ЛП) даратумумаб (Dara) к программе лечения «леналидомид + дексаметазон» (Rd) в ранних линиях терапии пациентов с множественной миеломой (ММ), не являющихся кандидатами на проведение высокодозной химиотерапии (ВДХТ) с последующей аутологичной трансплантацией гемопоэтических стволовых клеток (аутоТГСК).
Материал и методы. Разработана модель разделенной выживаемости. Вводные данные и их дальнейшая компьютерная обработка (оцифровка и аппроксимация) для моделирования исходов в долгосрочной перспективе определены по результатам систематического поиска и анализа рандомизированных контролируемых исследований для следующих таргетных ЛП, включенных в программы лечения пациентов с ММ: 1-я линия – Dara+Rd; 2-я линия – триплеты «карфилзомиб + леналидомид» (K+Rd) или «иксазомиб + леналидомид» (Ixa+Rd); 3-я линия – помалидомид (Pom+dex) и Rd+(Dara+Rd)+(Pom+dex) в сравнении с Rd+(K/Ixa+Rd)+(Pom+dex/Dara). В модели учитывали только прямые медицинские затраты на лекарственную терапию таргетными ЛП. В качестве критерия клинико-экономической эффективности оценивали стоимость дополнительной единицы эффективности – 1 сохраненного года жизни. Показатель разницы в затратах между текущей и ожидаемой практикой использовали для анализа влияния на бюджет.
Результаты. В сравнении с использованием Rd в 1-й линии применение комбинации Dara+Rd позволяет увеличить продолжительность жизни на 1,04 года (+16,05%) и на 0,95 года (+14,57%) в расчете на 1 пациента, а в целевой популяции (n=955) – на 995,48 и 903,40 года для программ лечения (Dara+Rd)+(K+Rd)+(Pom+dex) и (Dara+Rd)+(Ixa+Rd)+(Pom+dex) соответственно. Инкрементальный показатель «затраты–эффективность» (англ. incremental cost-effectiveness ratio, ICER) на 1 год сохраненной жизни в 1-й линии терапии составил 8,95 млн руб. при использовании Dara+Rd и 8,41 млн руб. для программ (Dara+Rd)+(K+Rd)+(Pom+dex) и (Dara+Rd)+(Ixa+Rd)+(Pom+dex), что ниже медианного значения ICER 13,64 млн руб. за 1 сохраненный год жизни для противоопухолевых ЛП, применяющихся для лечения злокачественных новообразований лимфатической и кроветворной тканей (референтный ICER). При использовании триплета Dara+Rd во 2-й линии терапии после Rd число сохраненных лет жизни в целевой популяции за счет большей эффективности выше на 291,50 года по сравнению с применением K+Rd и на 203,93 года по сравнению с Ixa+Rd. ICER на 1 сохраненный год жизни для Dara+Rd также ниже референтного значения ICER: 9,25 млн руб. против 13,64 млн руб. По результатам анализа влияния на бюджет применение Dara в ранних линиях терапии ММ не приводит к увеличению расходов на лекарственное обеспечение в целевой популяции.
Заключение. Полученные результаты позволяют сделать вывод об экономической целесообразности добавления Dara к 1-й и 2-й линиям терапии в программах лечения леналидомидом пациентов с ММ, не являющихся кандидатами на ВДХТ с аутоТГСК.
Ключевые слова
Для цитирования:
Ивахненко О.И., Ряженов В.В., Фалалеева Н.А. Оценка клинико-экономических последствий применения даратумумаба в комбинации с леналидомидом в 1-й и 2-й линиях терапии пациентов с множественной миеломой. ФАРМАКОЭКОНОМИКА. Современная фармакоэкономика и фармакоэпидемиология. 2024;17(1):5-21. https://doi.org/10.17749/2070-4909/farmakoekonomika.2024.237
For citation:
Ivakhnenko О.I., Ryazhenov V.V., Falaleeva N.A. Clinical and economic implications of using daratumubab with lenalidomide in the 1st and 2nd lines of therapy for multiple myeloma patients. FARMAKOEKONOMIKA. Modern Pharmacoeconomics and Pharmacoepidemiology. 2024;17(1):5-21. (In Russ.) https://doi.org/10.17749/2070-4909/farmakoekonomika.2024.237
ВВЕДЕНИЕ / INTRODUCTION
Внедрение новых методов лечения в реальную клиническую практику существенно улучшило показатели выживаемости пациентов с множественной миеломой (ММ). По данным популяционного исследования, проводившегося с 1970 г., к 2015 г. летальность в первые 3 мес после постановки диагноза ММ сократилась с 19% до 4,3% (p<0,001), летальность в течение 1 года – с 36% до 12,6% (p<0,001), а 5-летняя относительная выживаемость увеличилась с 27% до 56% [1].
Несмотря на достигнутые успехи, ММ по-прежнему остается неизлечимым заболеванием. В 2020 г. на ее долю приходилось 14% от всех случаев опухолей системы крови, зарегистрированных в мире [2]. Исследователи отмечают тенденцию к росту эпидемиологического бремени ММ. Стандартизованный по возрасту показатель первичной заболеваемости ММ с 1990 г. увеличился с 1,72 до 1,92 на 100 тыс. населения к 2019 г. Число смертельных исходов по причине ММ выросло в 1,19 раза за этот же период [2][3]. В Российской Федерации (РФ) в среднем ежегодно регистрируется до 4 тыс. новых случаев ММ, летальность в течение 1-го года с момента постановки диагноза составляет 20,7%, 5-летняя общая выживаемость (ОВ), по данным эпидемиологических исследований, достигает лишь 49% [4][5].
Изменение терапевтического ландшафта привело к значительному прогрессу в лечении ММ. При этом совершенствование ведения пациентов с ММ осуществляется не только за счет внедрения в практику новых лекарственных препаратов (ЛП), но и за счет расширения показаний к применению для уже обращающихся на рынке ЛП. Достижение длительных ремиссий на ранних этапах лечения обеспечивает наилучшие результаты по выживаемости в долгосрочной перспективе. В качестве одного из потенциальных направлений развития терапевтической стратегии эксперты рассматривают применение наиболее эффективных комбинаций в ранних линиях терапии ММ [6]. Для оптимизации результатов лечения в клиническую практику внедряется использование прогностических биомаркеров для оценки показателей выживаемости без прогрессирования (ВБП) и ОВ у конкретного пациента с ММ. Выявление хромосомных нарушений позволяет стратифицировать популяцию пациентов с ММ по группам риска и выделить больных с наименьшей прогностической выживаемостью с целью назначения наиболее эффективных схем лечения [7].
В РФ лекарственное обеспечение (ЛО) пациентов с ММ осуществляется в основном за счет средств федерального бюджета (программа обеспечения ЛП пациентов с высокозатратными нозологиями (ВЗН)) по перечню дорогостоящих лекарственных препаратов (перечень 14 ВЗН). Первым из моноклональных антител в перечень 14 ВЗН был включен препарат даратумумаб. В соответствии с критериями назначения в рамках программы ВЗН даратумумаб используется пока только в монотерапии для лечения рецидивирующей и (или) рефрактерной ММ. В то же время по результатам клинических исследований была показана его высокая эффективность и безопасность в составе триплетов в 1-й и 2-й линиях терапии ММ [8] и расширены показания к применению. В руководстве американской Национальной всеобщей онкологической сети (англ. National Comprehensive Cancer Network, NCCN) рекомендовано использование даратумумаба в комбинации с ингибиторами протеасом или леналидомидом в ранних линиях терапии [9]. В проекте российских клинических рекомендаций (КР) по диагностике и лечению ММ 2023 г. эксперты также рекомендуют применять даратумумаб в добавление к программе лечения бортезомибом или леналидомидом в 1-й и 2-й линиях терапии [10].
Цель – оценка клинико-экономических последствий добавления даратумумаба к программе лечения «леналидомид + дексаметазон» в ранних линиях терапии пациентов с ММ, не являющихся кандидатами на проведение высокодозной химиотерапии (ВДХТ) с последующей аутологичной трансплантацией гемопоэтических стволовых клеток (аутоТГСК).
МАТЕРИАЛ И МЕТОДЫ / MATERIAL AND METHODS
Для достижения цели исследования были решены следующие задачи:
– при разработке дизайна исследования рассмотрены подходы к проведению оценки экономических последствий применения таргетной терапии для лечения злокачественных новообразований (ЗНО) в долгосрочной перспективе;
– изучены эпидемиологические характеристики ММ в РФ и тактика оказания медицинской помощи пациентам с ММ для определения характеристик и численности целевой популяции, выбора альтернативных схем лечения для моделирования исходов заболевания в долгосрочной перспективе;
– проведен систематический поиск результатов рандомизированных клинических исследований (РКИ) для определения вводных данных и выполнена их дальнейшая компьютерная обработка (оцифровка и аппроксимация) для моделирования исходов в долгосрочной перспективе;
– разработана математическая модель для проведения клинико-экономического исследования (КЭИ) и анализа влияния на бюджет (АВБ) применения даратумумаба в комбинации с леналидомидом в ранних линиях терапии.
Гипотеза и нормативная база исследования / Hypothesis and regulatory framework of the study
Разработка дизайна исследования основывалась на гипотезе о том, что расширение показаний к добавлению даратумумаба к программе лечения леналидомидом в 1-й и 2-й линиях терапии у пациентов с ММ экономически целесообразно по сравнению с альтернативными вариантами лечения.
Нормативную базу исследования составило законодательство РФ, регулирующее оказание медицинской помощи [10–12], нормы технического регулирования оценки медицинских технологий и проведения КЭИ и АВБ, закрепленные в документах национальной системы стандартизации1.
Дизайн математической модели и сценарии лечения / Mathematical model design and treatment scenarios
Для клинико-экономического обоснования внедрения новых подходов к лечению пациентов с ММ широко применяются различные методы исследований: ретроспективные когортные исследования [13], моделирование эффективности терапии ММ с использованием машинного обучения [14], методы клинико-экономической оценки [15], математическое моделирование [16–19]. В особенности актуально проведение оценки экономических последствий применения различных режимов терапии у пациентов, относящихся к группам высокого риска [20].
Накопление данных об эффективности инновационных ЛП и возможность синтеза данных об их клинический эффективности в долгосрочной перспективе позволяют выполнять оценку экономических последствий с учетом эффективности терапии практически за весь период дожития пациентов. Для имитационного моделирования в долгосрочной перспективе и сравнения эффективности различных схем терапии широко используется валидный и эффективный метод восстановления индивидуальных данных пациентов с последующим математическим моделированием исходов в долгосрочной перспективе [21]. В связи с этим для проведения анализа экономических последствий применения даратумумаба не только в режиме монотерапии в 3-й линии лечения ММ, но и в сочетании с леналидомидом в ранних линиях терапии был использован метод математического моделирования.
Оказание медицинской помощи, включая ЛО, в РФ регламентируется положениями Федерального закона «Об основах охраны здоровья граждан в Российской Федерации» от 21 ноября 2011 г. № 323-ФЗ (ст. 37, гл. 5): медицинская помощь осуществляется «в соответствии с порядками оказания медицинской помощи, на основе клинических рекомендаций и на основе стандартов медицинской помощи, утверждаемых уполномоченным органом исполнительной власти» [10]. Выбор препаратов для формирования схем лечения осуществляли поэтапно:
– вначале были изучены современные подходы к диагностике и лечению ММ;
– далее были проанализированы сведения из инструкции по
медицинскому применению (ИМП), размещенной в Государственном реестре лекарственных средств;
– затем был проведен анализ действующего перечня дорогостоящих ЛП и предложений по включению ЛП в перечень 14 ВЗН на 2023 г.
В качестве источников информации использовали действующие ИМП для ЛП, применяющихся для лечения ММ, КР по диагностике и лечению МM, обзорные статьи по подходам к диагностике и лечению пациентов с ММ, действующие перечни ЛП для медицинского применения, решения комиссии Министерства здравоохранения РФ по формированию перечней лекарственных препаратов для медицинского применения и минимального ассортимента лекарственных препаратов, необходимых для оказания медицинской помощи (далее – Комиссия). Для проведения таргетной терапии в перечень 14 ВЗН на данный момент включено 4 ЛП – леналидомид, даратумумаб, иксазомиб, помалидомид. Препарат карфилзомиб был рекомендован к включению в перечень на 2023 г.
Препараты элотузумаб и изатуксимаб на сегодняшний день не входят в перечень 14 ВЗН, поэтому далее не рассматривались в качестве альтернативных ЛП в составе комбинированной терапии пациентов целевой популяции [22]. Препарат карфилзомиб был рекомендован Комиссией для включения в перечень 14 ВЗН на 2023 г. [23]. Однако Правительство РФ не утвердило пересмотр данного перечня. Несмотря на то что перечень 14 ВЗН не пересматривался Правительством РФ, карфилзомиб также включен в настоящее исследование как кандидатный препарат для ЛО пациентов с ММ за счет средств федерального бюджета. Это целесообразно с точки зрения оценки влияния на бюджет и определения его клинико-
экономической эффективности в случае закупок карфилзомиба после внесения изменений в перечень 14 ВЗН. Таким образом, для формирования альтернативных программ лечения ММ и моделирования исходов были выбраны следующие сценарии лечения.
Сценарий 1 «Применение даратумумаба только в режиме монотерапии»: в 1-й линии терапии применяется комбинация «леналидомид + дексаметазон», во 2-й линии – триплеты «карфилзомиб + леналидомид + дексаметазон» или «иксазомиб + леналидомид + дексаметазон», в 3-й линии – «помалидомид + дексаметазон» или даратумумаб в монотерапии.
Сценарий 2 «Добавление даратумумаба к 1-й и 2-й линиям терапии в программах лечения леналидомидом»:
– в 1-й линии применяется комбинация «леналидомид + дексаметазон», во 2-й линии – триплеты «карфилзомиб + леналидомид + дексаметазон», или «иксазомиб + леналидомид + дексаметазон», или «даратумумаб + леналидомид + дексметазон», в 3-й линии – «помалидомид + дексаметазон» или даратумумаб в монотерапии;
– в 1-й линии используется комбинация «даратумумаб + леналидомид + дексаметазон», во 2-й линии – триплеты «карфилзомиб + леналидомид + дексаметазон» или «иксазомиб + леналидомид + дексаметазон», в 3-й линии – «помалидомид + дексаметазон».
Для проведения КЭИ и АВБ была разработана модель разделенной выживаемости (англ. partitioned survival model) [24, 25], в которой на основании восстановленных при помощи бесплатной утилиты Engauge Digitizer [26] индивидуальных данных пациентов (англ. individual patient data, IPD) по показателям ВБП и ОВ смоделированы исходы заболевания для каждой программы лечения, включенной в анализ, в зависимости от выбора стартовой терапии в 1-й линии и в случае прогрессирования заболевания во 2-й и 3-й линиях.
Продолжительность жизни пациентов с ММ и ответ на терапию зависят от ряда прогностических факторов [27], влияющих на выбор схемы лечения в зависимости от группы риска, определенной в момент постановки диагноза. Гетерогенность заболевания обусловливает вариабельность показателей ОВ в широких пределах: от нескольких месяцев до 20 лет [28]. Средние показатели ОВ при ММ составляют 7–10 лет [29]. Выбранный временной горизонт моделирования составил 10 лет (период дожития пациентов с ММ) с шагом в 1 мес для возможности выбора оценки клинико-экономических последствий за любой временной период в течение 10 лет. Длительность 1 мес была принята за 30,44 сут в соответствии с Федеральным законом от 3 июня 2011 г. № 107-ФЗ «Об исчислении времени». В качестве целевой популяции в модели рассматривались пациенты с диагнозом ММ, установленным впервые в жизни, из группы высокого риска, не являющиеся кандидатами на ВДХТ с аутоТГСК.
Таким образом, концепция модели заключалась в оценке экономических последствий добавления даратумумаба к 1-й и 2-й линиям терапии в программах лечения леналидомидом по сравнению с использованием препарата только в режиме монотерапии с учетом программ лечения с 1-й по 3-ю линии терапии, включенных в исследование.
В модели было выделено три взаимоисключающих состояния, отражающих статус здоровья пациента в каждый момент времени на протяжении временного горизонта исследования [18]. Предполагалось, что пациент находится в одном из следующих взаимоисключающих состояний:
– стабильное состояние (без прогрессии);
– прогрессия заболевания;
– смерть (абсорбирующее состояние).
Состояния пациента, включенные в модель разделенной выживаемости, представлены на рисунке 1.
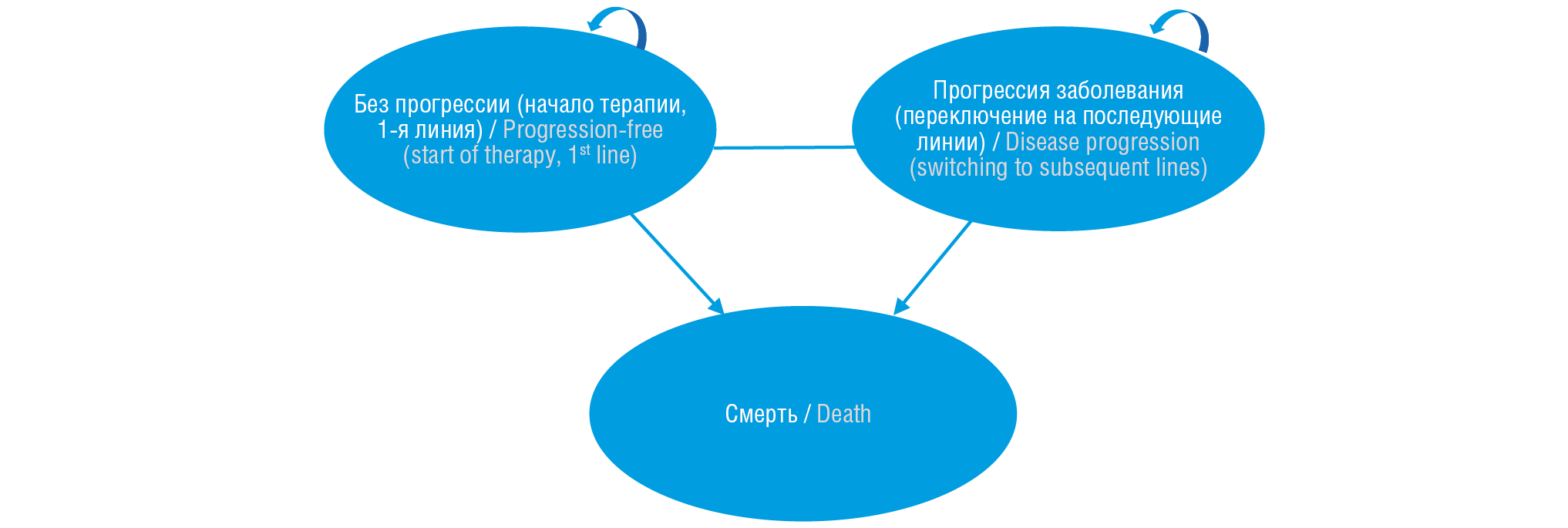
Рисунок 1. Состояния пациента в модели
Figure 1. Patient status in the model
В первом цикле модели пациент находится в «стабильном состоянии» – без прогрессии, назначается схема 1-й линии терапии в соответствии со Сценарием 1 или Сценарием 2. По истечении первого цикла моделирования пациент либо остается в «стабильном состоянии» на 1-й линии терапии, либо переходит в состояние «прогрессии заболевания», что означает назначение схемы лечения из 2-й линии терапии в соответствии с выбранным сценарием. По истечении первого цикла моделирования пациент также может перейти в терминальное состояние («смерть»). С прогрессией заболевания в предыдущем цикле в дальнейшем он может оставаться в этом состоянии до переключения со 2-й на 3-ю линию терапии или перехода в абсорбирующее состояние. В случае смерти пациента лекарственная терапия с использованием вариантов сравнения прекращается.
Методика получения исходных данных для построения математической модели / Methodology of obtaining initial data for mathematical model building
Показатели ВБП и ОВ для соответствующих программ лечения, выбранных на этапе разработки дизайна модели, были извлечены из РКИ, найденных по результатам систематического поиска и обзора. Процедуру систематического поиска для оценки сравнительной клинической эффективности медицинских технологий проводили в соответствии с Кокрейновскими рекомендациями [30] и рекомендациями Европейской сети оценки технологий здравоохранения (англ. European Network for Health Technology Assessment, EUnetHTA) [31]. В качестве источников информации при проведении систематического поиска использованы следующие базы данных:
– библиографическая база данных PubMed/MEDLINE2;
– международный реестр клинических исследований Национальных институтов здоровья США (англ. National Institutes of Health, NIH)3;
– Кокрейновская библиотека4.
При проведении поиска в базе данных PubMed/MEDLINE применяли следующие ключевые слова и логические операторы: multiple myeloma, AND, therapy. В международном реестре NIH осуществляли расширенный поиск с использованием следующих фильтров: сondition or disease – multiple myeloma; status – completed; phase – phase 3; age group – adult. Для Кокрейновской библиотеки использовали следующую стратегию поиска: MeSH descriptor: [Multiple Myeloma] explode all trees and with qualifier(s): [therapy – TH].
В качестве фильтров при проведении систематического поиска учитывали ограничения по языку научных публикаций (английский язык). Временной горизонт поиска не ограничивали: первоначальный поиск результатов исследований был проведен в ходе разработки дизайна и концепции модели, дополнительный – на этапе валидации модели с целью проверки на наличие новых данных. При отборе исследований для извлечения кривых выживаемости учитывались следующие критерии: дизайн РКИ, наличие графиков кривых выживаемости Каплана–Мейера с данными по ВБП и ОВ, описания демографических характеристик пациентов, позволяющие провести оценку сопоставимости групп между исследованиями. При наличии результатов с показателями ВБП и ОВ за более длительный период наблюдения учитывали актуальные сведения по эффективности для медицинских технологий, включенных в исследование. Перечень и характеристики РКИ, из которых были извлечены кривые выживаемости для восстановления индивидуальных данных пациентов, приведены в Приложении 1 [32–37].
Для восстановления индивидуальных данных пациентов кривые выживаемости были извлечены из опубликованных результатов соответствующих РКИ для ЛП, входящих в схемы лечения, оцифрованы [38] и аппроксимированы с использованием программного пакета R 4.3.0. Экстраполяцию кривых ВБП и ОВ, извлеченных из отобранных в результате систематического поиска и обзора РКИ, проводили на основании шести видов распределений: Вейбулла, Гомперца, экспоненциального, логнормального, лог-логистического и обобщенного гамма-распределения [39]. При выборе аппроксимированной кривой выживаемости были учтены полученные значения критериев Акаике (англ. Akaike information criterion, AIC) и байесовского информационного критерия (англ. Bayesian information criterion, BIC), а также визуальная оценка с фактическими кривыми ВБП и ОВ.
Вероятность прогрессии в период t при использовании одного из сценариев терапии i (pi,tp ) определяли исходя из ВБП при использовании соответствующего варианта лечения:
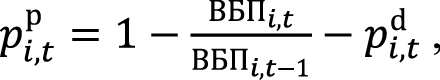
где ВБПi,t – оценка выживаемости без прогрессирования в период t при использовании варианта лечения i; ВБПi,t–1 – оценка выживаемости без прогрессирования в период t–1 при использовании варианта лечения i; pi,td – вероятность смерти пациента в период t при использовании одного из сценариев терапии.
Вероятность смерти пациента в период t при использовании одного из сценариев терапии i (pi,td) определяли исходя из ОВ при использовании соответствующего варианта лечения:
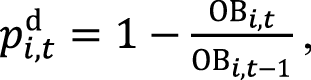
где pi,td – вероятность смерти пациента в период t при использовании одного из сценариев терапии; ОВi,t – ОВ в период t при использовании варианта лечения i; ОВi,t–1 – ОВ в период t–1 при использовании варианта лечения i.
Вероятность остаться в стабильном состоянии в период t при использовании одного из сценариев терапии i (pi,ts) рассчитывали по формуле:
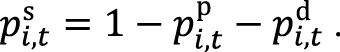
Смоделированные данные по эффективности программ лечения для каждого сценария терапии, включенного в анализ, далее использовали для расчета затрат и проведения клинико-экономической оценки и АВБ.
Методика учета затрат и клинико-экономической оценки / Methodology of cost accounting and clinical and economic assessment
В настоящем исследовании учитывались только прямые медицинские затраты на таргетные препараты для проведения медикаментозного лечения в целевой популяции. Предполагалось, что ЛО пациентов осуществляется за счет средств федерального бюджета в рамках реализации программы 14 ВЗН в течение всего периода моделирования.
Для расчета затрат использовали сведения о способе применения и режиме дозирования ЛП из ИМП. Учитывали цену закупок ЛП за счет средств федерального бюджета по программе 14 ВЗН за 2022 г. При расчете затрат в долгосрочной перспективе применяли дисконтирование (приведение будущих денежных потоков к текущему моменту) с учетом ставки дисконтирования 5%. Расчет затрат на лекарственную терапию для рассматриваемых вмешательств проводили на основании сведений о способах применения и режимах дозирования, указанных в ИМП препаратов. В качестве источника информации о ценах использовали данные компании Headway по мониторингу государственных централизованных закупок для ЛО пациентов по перечню 14 ВЗН за 2022 г. Для леналидомида, иксазомиба и помалидомида расчет выполняли с учетом всех форм выпуска и дозировок в пересчете на 1 стандартизованную упаковку. Для даратумумаба и карфилзомиба проводили расчет затрат на отдельные флаконы. Затраты на дексаметазон в общих расходах на терапию не учитывали, поскольку он используется во всех схемах лечения и расходы на него не оказывают значительного влияния на разницу в затратах. Ключевые параметры для расчета прямых медицинских затрат приведены в таблице 1.
Таблица 1. Цены на препараты, использованные при учете затрат на лекарственную терапию
Table 1. Drug prices used in accounting for drug therapy costs
|
МНН / INN |
Форма выпуска / Release form |
Цена за 1 ед., руб. / |
|
Леналидомид / Lenalidomide |
Капсулы 25 мг № 21 / Capsules 25 mg N21 |
111 099,42* |
|
Даратумумаб / Daratumumab |
Концентрат для приготовления инфузий 20 мг/мл 20 мл // |
71 214,93 |
|
Концентрат для приготовления инфузий 20 мг/мл 5 мл // |
16 876,04 |
|
|
Иксазомиб / Ixazomib |
Капсулы 4 мг № 3 / Capsules 4 mg N3 |
212 914,85* |
|
Карфилзомиб / Carfilzomib |
Лиофилизат для приготовления раствора для инфузий 60 мг / |
73 173,05 |
|
Помалидомид / Pomalidomide |
Капсулы 4 мг № 21 / Capsules 4 mg N21 |
297 760,22* |
Примечание. МНН – международное непатентованное наименование. * В пересчете на 1 стандартизованную упаковку.
Note. INN – international nonproprietary name. * In terms of 1 standardized package.
КЭИ было проведено в расчете на 1 пациента. В качестве критерия клинико-экономической эффективности учитывали стоимость 1 сохраненного года жизни. Расчет показателей «затраты–эффективность» (англ. cost-effectiveness ratio, CER) и объема дополнительных затрат на 1 единицу эффективности (англ. incremental cost-effectiveness ratio, ICER) был проведен по общепринятой методике [40]. Для оценки полученных результатов был выполнен анализ чувствительности при снижении цены стандартизованной упаковки препарата леналидомид на 20% от базового значения.
Методика проведения анализа влияния на бюджет / Methodology of budget impact analysis
Основной целью исследований с использованием АВБ является прогнозирование экономических последствий исходя из изменения частоты применения ЛП, использующихся при оказании медицинской помощи в целевой популяции пациентов [41].
Эпидемиология ММ на сегодняшний момент изучена мало: широкомасштабные эпидемиологические исследования в РФ не проводились. В связи с этим при определении характеристик и численности целевой популяции для выполнения АВБ был использован комплексный подход: систематический поиск и обзор литературных данных в сочетании с моделированием ключевых параметров на основании данных федерального статистического наблюдения, результатов эпидемиологических исследований, мнения экспертов. Из-за ограниченности эпидемиологических данных АВБ был проведен для статической модели целевой популяции: за основу для моделирования затрат и исходов взяли численность пациентов с ММ в утвержденной заявке для централизованной закупки ЛП по перечню 14 ВЗН для ЛО пациентов по программе ВЗН в 2022 г.
Доля пациентов с диагнозом ММ, установленным впервые в жизни, в структуре общей заболеваемости была рассчитана на основании сведений о показателе первичной заболеваемости ММ в 2021 г. из статистического бюллетеня Московского научно-исследовательского онкологического института им. П.А. Герцена [4] и информации о распространенности ММ в РФ в 2021 г., представленной в Ежегодном бюллетене экспертного совета по редким заболеваниям за 2022 г. [44]. По результатам опроса экспертов, доля больных, относящихся к группе высокого риска, среди пациентов с ММ с впервые в жизни установленным диагнозом составила 51%, что коррелирует с зарубежными данными [42]. По итогам мониторинга государственных закупок за счет средств федерального бюджета, в 40% случаев из числа пациентов группы высокого риска был назначен леналидомид. На рисунке 2 приведена модель популяционной воронки, а в таблице 2 – значения ключевых параметров, использованные для расчета численности целевой популяции.

Рисунок 2. Модель популяционной воронки: алгоритм расчета. ММ – множественная миелома; ЛО – лекарственное обеспечение; ВЗН – высокозатратные нозологии
Figure 2. Population funnel model: calculation algorithm. MM – multiple myeloma; DP – drug provision; HCN – high-cost nosologies
Таблица 2. Ключевые параметры для расчета численности целевой популяции
Table 2. Key parameters for calculating the target population size
|
Параметр / Parameter |
Значение / Value |
Источник / Reference |
|
Численность пациентов с ММ в утвержденной заявке для централизованной закупки ЛП по перечню 14 ВЗН для ЛО пациентов по программе ВЗН на 2023 г., чел. / Number of MM patients in the approved request for centralized procurement of drugs according to the list of 14 HCN for DP of patients under the HCN program for 2023, persons |
12 360 |
По данным экспертов / Expert data |
|
Взято на учет больных с впервые в жизни установленным диагнозом ММ и иммунопролиферативных новообразований в 2021 г. в РФ, чел. / Registered patients with first-time diagnosed MM and immunoproliferative neoplasms in 2021 in the RF, persons |
3831 |
[4] |
|
Распространенность ММ в РФ в 2021 г., чел. / |
10 113 |
[42] |
|
Доля пациентов с впервые в жизни установленным диагнозом ММ среди контингента пациентов с ММ, % / Proportion of patients with primarily diagnosed MM among MM patients, % |
38 |
Рассчитано на основании данных о распространенности и первичной заболеваемости на 2021 г. / Calculated based on prevalence and primary incidence data for 2021 |
|
из них доля пациентов с ММ высокого риска / |
51 |
По данным экспертов / Expert data |
|
из них доля пациентов, получающих леналидомид / |
40 |
Результаты мониторинга государственных закупок за счет средств федерального бюджета / Results of monitoring of public procurement at the expense of the federal budget funds |
Примечание. ММ – множественная миелома; ЛП – лекарственный препарат; ВЗН – высокозатратная нозология; ЛО – лекарственное обеспечение; РФ – Российская Федерация.
Note. MM – multiple myeloma; HCN – high-cost nosologies; DP – drug provision; RF – Russian Federation.
В рамках АВБ сравнивали расходы на лечение с учетом эффективности и частоты назначения сформированных сценариев терапии в целевой популяции в условиях текущей и ожидаемой практики. Рассмотрены следующие варианты лечения ММ в целевой популяции пациентов.
Текущая практика. 100% пациентов получают леналидомид в 1-й линии терапии. При прогрессировании ММ во 2-й линии может быть назначена комбинация «карфилзомиб + леналидомид» или «иксазомиб + леналидомид». При переключении на 3-ю линию назначается даратумумаб в монотерапии или помалидомид. Частота назначения ЛП в схемах определена на основании данных о государственных закупках за 2022 г. в пересчете на пациентов.
Ожидаемая практика. Комбинация «даратумумаб + леналидомид» назначается в 1-й линии терапии наряду с использованием леналидомида. Также «даратумумаб + леналидомид» применяется во 2-й линии в качестве дополнительной альтернативы к использованию комбинаций «карфилзомиб + леналидомид» и «иксазомиб + леналидомид». В 3-й линии назначается даратумумаб в монотерапии или помалидомид. Частота назначения схем лечения в ожидаемой практике – допущение исследования, основанное на следующих предпосылках.
По данным госзакупок, в текущей практике даратумумаб назначается в 78% случаев. Предполагалось, что за счет расширения критериев применения частота его назначения в условиях ожидае-
мой практики фактически перераспределится между 1-й, 2-й и 3-й линиями терапии. При этом в 1-й линии даратумумаб как предпочтительная опция в соответствии с рекомендуемой практикой лечения [9] будет назначаться с большей частотой, чем во 2-й и 3-й линиях. Во 2-й линии триплеты даратумумаба и карфилзомиба применяются в качестве дополнительной альтернативы к иксазомибу для пациентов, которые в 1-й линии получали только леналидомид. В 3-й линии даратумумаб назначается только тем пациентам, которые не получали его в 1-й и 2-й линиях.
В таблице 3 представлена частота назначения ЛП в условиях текущей и ожидаемой практики лечения.
Таблица 3. Частота назначения лекарственных препаратов в условиях текущей и ожидаемой практики
Table 3. Rate of drug prescription in current and expected practice settings
|
Лекарственный препарат / Drug |
Частота назначения / Rate of prescription |
|
|
Текущая практика / |
Ожидаемая практика / Expected practice |
|
|
1-я линия терапии / 1st line therapy |
||
|
Леналидомид / Lenalidomide |
1,00 |
0,61 |
|
Даратумумаб + леналидомид / Daratumumab + lenalidomide |
– |
0,39 |
|
2-я линия терапии / 2nd line therapy |
||
|
Карфилзомиб + леналидомид / Carfilzomib + lenalidomide |
0,47 |
0,20 |
|
Иксазомиб + леналидомид / Ixazomib + lenalidomide |
0,53 |
0,60 |
|
Даратумумаб + леналидомид / Daratumumab + lenalidomide |
– |
0,20 |
|
3-я линия терапии / 3rd line therapy |
||
|
Даратумумаб в монотерапии / Daratumumab in monotherapy |
0,78 |
0,20 |
|
Помалидомид / Pomalidomide |
0,22 |
0,80 |
Для оценки влияния на бюджет была рассчитана разница в затратах между текущей и ожидаемой практикой лечения в целевой популяции. Устойчивость полученных результатов к изменению ключевых параметров оценивалась в анализе чувствительности при одновременном увеличении частоты назначения комбинаций «даратумумаб + леналидомид» и «даратумумаб + дексаметазон» в 1-й линии терапии на 25%, увеличении численности целевой популяции на 10% и снижении цены стандартизованной упаковки леналидомида на 20% от базовых значений.
РЕЗУЛЬТАТЫ / RESULTS
Клинико-экономическая оценка / Clinical and economic assessment
Моделирование исходов и оценка экономических последствий были проведены в целевой популяция пациентов с впервые в жизни установленным диагнозом ММ и факторами, влияющими на неблагоприятный исход заболевания: больные, относящиеся к группе высокого риска, которым не показано проведение ВДХТ с ауто-
ТГCК. Согласно нашим оценкам численность целевой популяции пациентов, получающих ЛО по перечню 14 ВЗН, может достигать 955 человек.
По результатам прогнозирования, добавление даратумумаба к программе леналидомида в 1-й и 2-й линиях терапии позволило достичь лучших результатов в выживаемости за счет большего числа сохраненных лет жизни. На рисунке 3 приведено среднее число прожитых лет жизни в расчете на 1 пациента для программ лечения пациентов целевой популяции в зависимости от линии терапии, в которой был назначен препарат даратумумаб.
Применение даратумумаба в сочетании с леналидомидом в ранних схемах лечения позволяет увеличить показатели ОВ в целевой популяции:
– в расчете на 1 пациента при добавлении даратумумаба к леналидомиду в 1-й линии терапии ОВ для программы лечения (Dara+Rd)+(K+Rd)+(Pom+dex) выше на 1,04 года (+16,05%) в сравнении с программой Rd+(K+Rd)+Dara и на 0,95 года (+14,57%) для (Dara+Rd)+(Ixa+Rd)+(Pom+dex) в сравнении с программой Rd+(Ixa+Rd)+Dara, где даратумумаб применяется в 3-й линии терапии;
– в расчете на 1 пациента при добавлении даратумумаба к леналидомиду во 2-й линии терапии ОВ для программы лечения Rd+(Dara+Rd)+(Pom+dex) на 0,31 года (+5,30%) больше в сравнении с программой Rd+(K+Rd)+Dara и на 0,20 года (+3,71%) в сравнении с программой Rd+(Ixa+Rd)+Dara, где даратумумаб применяется в 3-й линии терапии;
– суммарно применение препарата даратумумаб в сочетании с леналидомидом в 1-й и 2-й линиях в программах лечения ММ увеличивает показатели ОВ на 21,35% по сравнению с программой Rd+(K+Rd)+Dara и на 17,76% по сравнению с программой Rd+(Ixa+Rd)+Dara, где даратумумаб применяется в 3-й линии терапии.
В расчете на 1 пациента расходы на проведение терапии за 10-летний период при использовании альтернативных программ лечения составили 10,01 млн руб. для программы Rd+(K+Rd)+Dara, 7,32 млн руб. – для Rd+(Ixa+Rd)+Dara, 11,26 млн руб. – для Rd+(Dara+Rd)+(Pom+dex), а для программ (Dara+Rd)+(K+Rd)+(Pom+dex) и (Dara+Rd)+(Ixa+Rd)+(Pom+dex) – 24,33 и 23,23 млн руб. соответственно. Поскольку при большей эффективности программы лечения с применением даратумумаба в ранних линиях терапии требуют бо́льших затрат, для оценки клинико-экономической эффективности был рассчитан ICER на 1 сохраненный год жизни (табл. 4).
ICER на 1 сохраненный год жизни при использовании даратумумаба в ранних линиях терапии варьирует от 8,4 до 9,24 млн руб. Данный показатель ниже медианного значения ICER за 1 год сохраненной жизни 13,64 млн руб. для противоопухолевых препаратов, использующихся для лечения ЗНО лимфатической и кроветворной тканей [44]. По данным анализа чувствительности, снижение цены на стандартизованную упаковку леналидомида и увеличение частоты назначения даратумумаба в условиях ожидаемой практики не повлияли на полученные в базовом сценарии результаты.
В модели текущей практики в 1-й линии терапии пациенты начинали лечение с леналидомида в сочетании с дексаметазоном. После двух и последующего рецидивов к программе на основе леналидомида добавляли иксазомиб или карфилзомиб, далее при ММ, отягощенной двойной рефрактерностью, использовали даратумумаб в монотерапии или помалидомид с дексаметазоном. В ожидаемой практике лечения у части пациентов (39%) даратумумаб добавляли к программе лечения на основе леналидомида в 1-й и 2-й линиях терапии и использовали в 3-й линии у пациентов, не получавших препарат на ранних линиях лечения. В остальных случаях в 1-й линии терапии назначали леналидомид, в случае прогрессии пациент переводился на триплеты, содержащие карфилзомиб, иксазомиб или даратумумаб, в 3-й линии назначали помалидомид.
На рисунке 4 приведена динамика показателей выживаемости в зависимости от выбранной программы лечения.
К концу 1-го года терапии 95% пациентов, получающих комбинацию «даратумумаб + леналидомид» в 1-й линии терапии, продолжат получать лечение по схеме Dara+Rd, при этом за счет сокращения частоты введения даратумумаба на 2-й год лечения сократятся затраты на комбинацию Dara+Rd. Среди пациентов, получающих только леналидомид в 1-й линии терапии, продолжат лечение чуть больше 89%, остальные переключатся на 2-ю линию с применением триплетов, что приведет к увеличению расходов на лечение. Данная тенденция сохраняется на протяжении всего временного горизонта исследования: пациенты, получавшие комбинацию Dara+Rd в 1-й линии, переключались на последующие линии терапии с меньшей частотой (рис. 5).
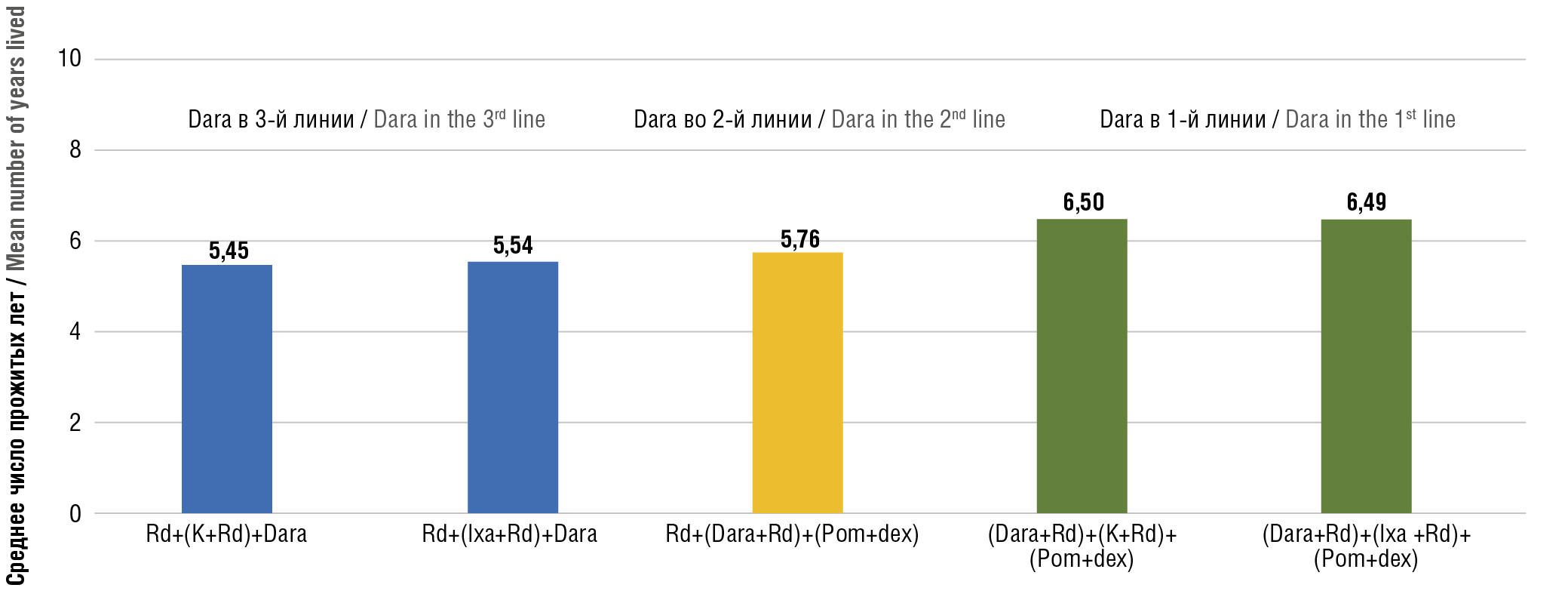
Рисунок 3. Среднее число прожитых лет жизни в расчете на 1 пациента для программ лечения пациентов целевой популяции в зависимости от линии терапии, в которой был назначен препарат даратумумаб.
Rd – леналидомид + дексаметазон; K – карфилзомиб; Dara – даратумумаб; Pom+dex – помалидомид; Ixa – иксазомиб
Figure 3. Mean number of years lived per patient for treatment programs in the target population according to the line of therapy in which daratumumab was prescribed.
Rd – lenalidomide + dexamethasone; K – carfilzomib; Dara – daratumumab; Pom+dex – pomalidomide; Ixa – ixazomib
Таблица 4. Клинико-экономический профиль препарата даратумумаб при использовании в 1-й, 2-й или 3-й линии терапии пациентов целевой популяции
Table 4. Clinical and economic profile of daratumumab when used in 1st, 2nd or 3rd line therapy for patients in the target population
|
Параметр / Parameter |
Программа лечения (включение даратумумаба) / Treatment program (inclusion of daratumumab) |
||||
|
В 3-ю линию / In 3rd line |
В 1-ю линию / In 1st line |
Во 2-ю линию / |
|||
|
Rd+(Ixa+Rd)+ |
Rd+(K+Rd+)+ |
Rd+(Dara+Rd)+ |
(Dara+Rd)+(K+Rd)+ |
(Dara+Rd)+(Ixa+Rd)+ |
|
|
Прямые медицинские затраты на программу лечения с 1-й по 3-ю линии / Direct medical costs of treatment program |
|||||
|
Затраты в расчете на 1 пациента за весь период моделирования, руб. / Costs per 1 patient for the entire modeling period, rub. |
7 318 203,00 |
10 011 027,04 |
11 266 920,96 |
24 337 297,91 |
23 226 008,23 |
|
Эффективность программы лечения с 1-й по 3-ю линии терапии / Effectiveness of treatment program from 1st to 3rd line |
|||||
|
Число прожитых лет / Number of years lived |
5,54 |
5,45 |
5,76 |
6,50 |
6,49 |
|
Число потерянных лет жизни / Number of life years lost |
4,46 |
4,55 |
4,24 |
3,50 |
3,51 |
|
Число сохраненных лет жизни / Number of life years gained |
1,09 |
0,91 |
1,52 |
2,99 |
2,98 |
|
Клинико-экономическая оценка программы лечения с 1-й по 3-ю линии терапии / Clinical and economic assessment of treatment program from 1st to 3rd line |
|||||
|
CER, руб. / CER, rub. |
6 715 220,86 |
11 044 690,82 |
7 427 692,05 |
8 136 349,04 |
7 789 441,56 |
|
Ранжирование СER / |
1 |
5 |
2 |
4 |
3 |
|
Разница в эффективности по критерию «число сохраненных лет жизни», лет / Difference in effectiveness by “number of life years gained” criterion, years |
Референтная терапия / Reference therapy |
– |
0,43 |
1,90 |
1,89 |
|
ICER на 1 сохраненный год жизни, руб. / ICER per 1 of life year gained, rub. |
– |
– |
9 245 696,68 |
8 950 878,11 |
8 408 214,31 |
|
Коэффициент относительной ценности, руб. [43] / Relative value coefficient, rub. [43] |
– |
– |
– |
12 799 751,59 |
12 276 316,69 |
Примечание. CER (англ. cost-effectiveness ratio) – показатель «затраты–эффективность»; ICER (англ. incremental cost-effectiveness ratio) – инкрементный показатель «затраты–эффективность»; Rd – леналидомид + дексаметазон; K – карфилзомиб; Dara – даратумумаб; Ixa – иксазомиб; Pom+dex – помалидомид.
Note. CER – cost-effectiveness ratio; ICER – incremental cost-effectiveness ratio; Rd – lenalidomide + dexamethasone; K – carfilzomib; Dara – daratumumab; Ixa – ixazomib; Pom+dex – pomalidomide.
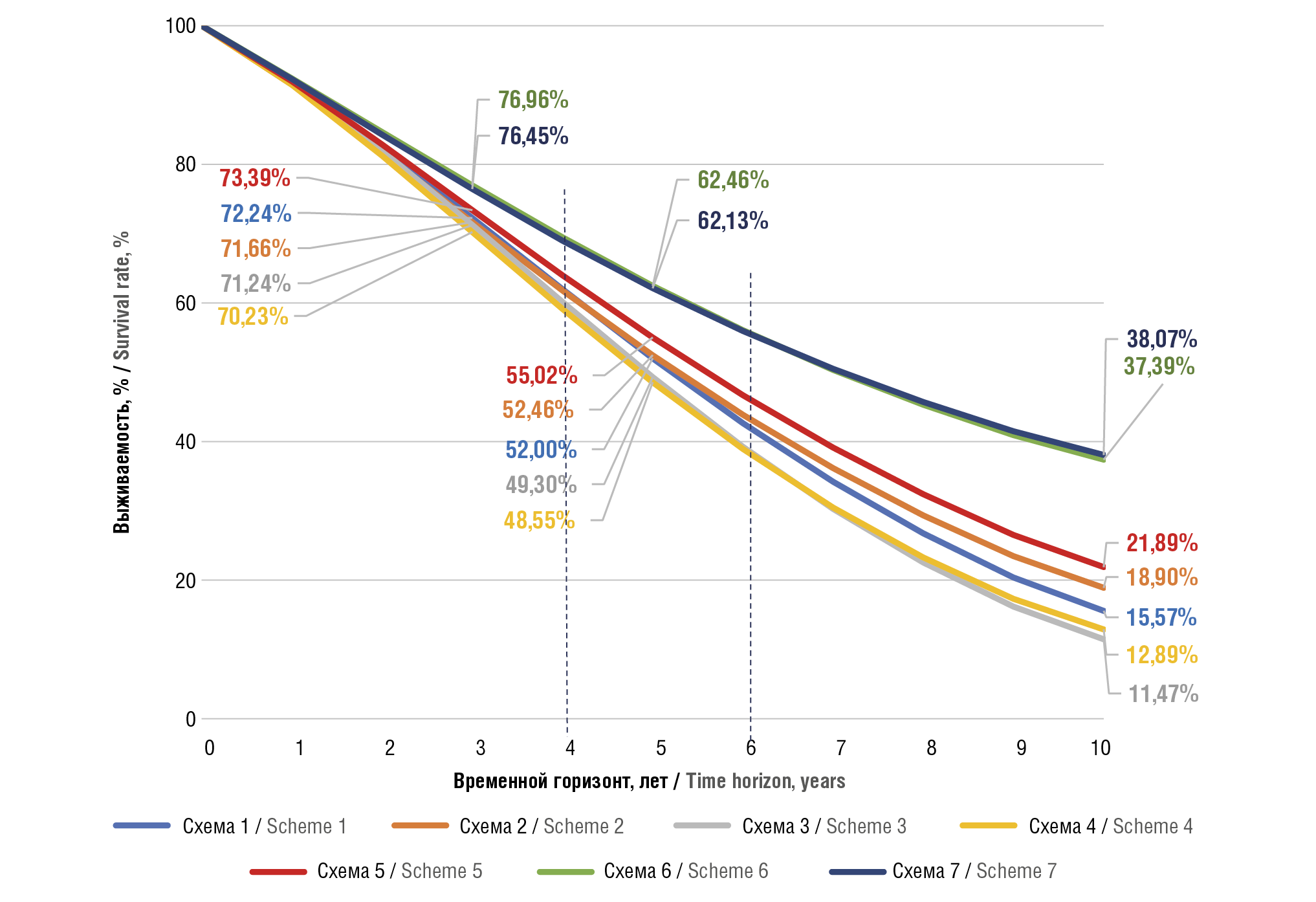
Рисунок 4. Динамика показателей выживаемости в зависимости от выбранной программы лечения в течение всего периода моделирования.
Схема 1: Rd+(K+Rd)+Dara; Схема 2: Rd+(Ixa+Rd)+Dara; Схема 3: Rd+(K+Rd)+Dara; Схема 4: Rd+(Ixa+Rd)+(Pom+dex); Схема 5: Rd+(Dara+Rd)+(Pom+dex);
Схема 6: (Dara+Rd)+(K+Rd)+(Pom+dex); Схема 7: (Dara+Rd)+(Ixa+Rd)+(Pom+dex).
Rd – леналидомид + дексаметазон; K – карфилзомиб; Dara – даратумумаб; Ixa – иксазомиб; Pom+dex – помалидомид
Figure 4. Dynamics of survival rates depending on the selected treatment program throughout the simulation period.
Scheme 1: Rd+(K+Rd)+Dara; Scheme 2: Rd+(Ixa+Rd)+Dara; Scheme 3: Rd+(K+Rd)+Dara; Scheme 4: Rd+(Ixa+Rd)+(Pom+dex); Scheme 5: Rd+(Dara+Rd)+(Pom+dex);
Scheme 6: (Dara+Rd)+(K+Rd)+(Pom+dex); Scheme 7: (Dara+Rd)+(Ixa+Rd)+(Pom+dex).
Rd – lenalidomide + dexamethasone; K – carfilzomib; Dara – daratumumab; Ixa – ixazomib; Pom+dex – pomalidomide
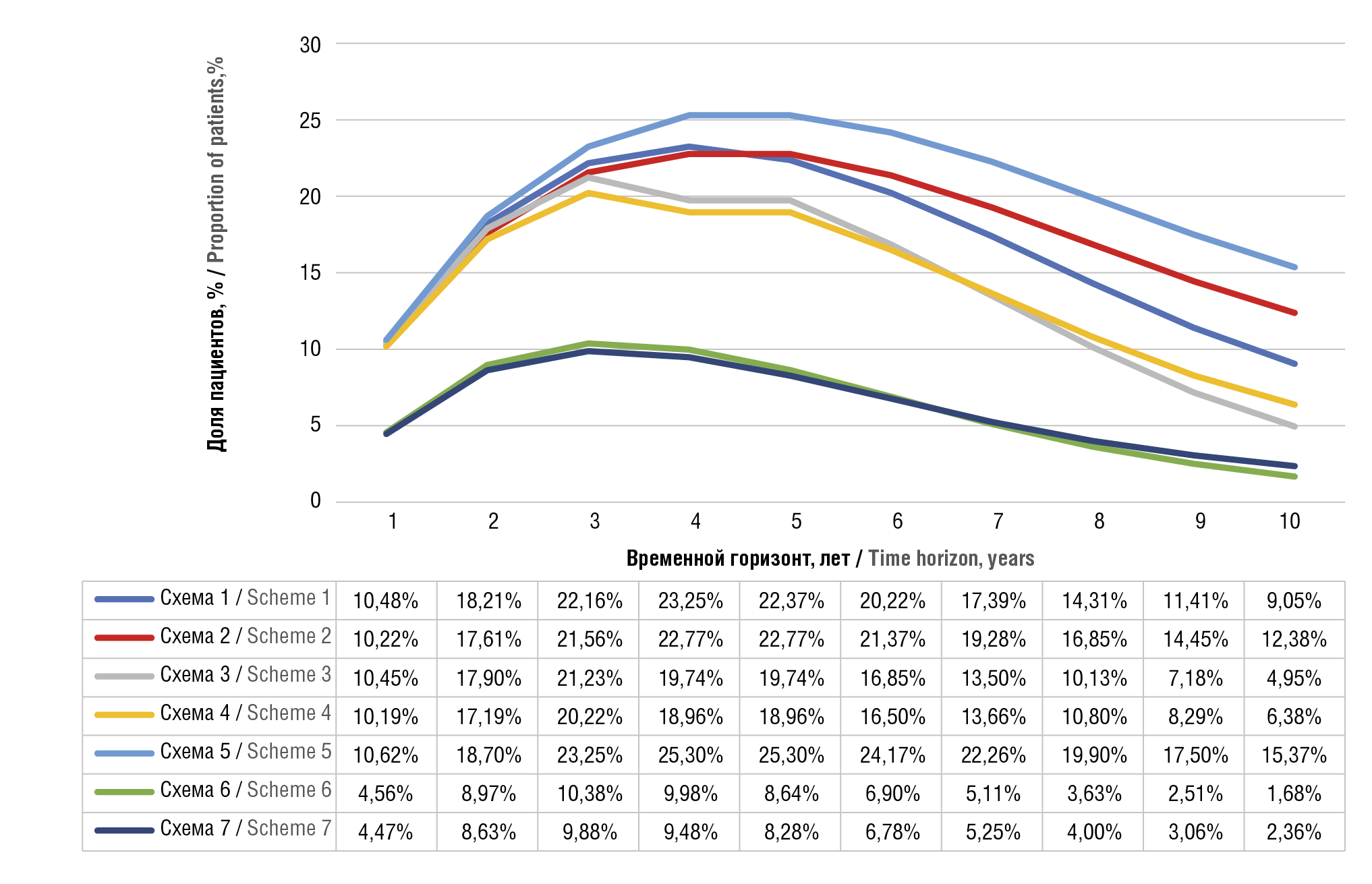
Рисунок 5. Доля пациентов, переключившихся на последующие линии терапии, в зависимости от программы лечения в течение всего периода моделирования.
Схема 1: Rd+(K+Rd)+Dara; Схема 2: Rd+(Ixa+Rd)+Dara; Схема 3: Rd+(K+Rd)+Dara; Схема 4: Rd+(Ixa+Rd)+(Pom+dex); Схема 5: Rd+(Dara+Rd)+(Pom+dex);
Схема 6: (Dara+Rd)+(K+Rd)+(Pom+dex); Схема 7: (Dara+Rd)+(Ixa+Rd)+(Pom+dex).
Rd – леналидомид + дексаметазон; K – карфилзомиб; Dara – даратумумаб; Ixa – иксазомиб; Pom+dex – помалидомид
Figure 5. Proportion of patients who switched to subsequent lines of therapy, depending on the treatment program throughout the modeling period.
Scheme 1: Rd+(K+Rd)+Dara; Scheme 2: Rd+(Ixa+Rd)+Dara; Scheme 3: Rd+(K+Rd)+Dara; Scheme 4: Rd+(Ixa+Rd)+(Pom+dex); Scheme 5: Rd+(Dara+Rd)+(Pom+dex);
Scheme 6: (Dara+Rd)+(K+Rd)+(Pom+dex); Scheme 7: (Dara+Rd)+(Ixa+Rd)+(Pom+dex).
Rd – lenalidomide + dexamethasone; K – carfilzomib; Dara – daratumumab; Ixa – ixazomib; Pom+dex – pomalidomide
Анализ влияния на бюджет / Budget impact analysis
Результаты анализа влияния на бюджет в зависимости от выбранного варианта терапии, частоты назначения ЛП в альтернативных схемах лечения и их эффективности в условиях текущей и ожидаемой практики за весь период моделирования приведены в таблице 5.
Как показывают результаты исследования, применение программ лечения с включением даратумумаба в ранних линиях терапии не приводит к увеличению расходов на ЛО в целевой популяции. Разница в затратах варьирует от 0,016 млрд руб. (1,16%) в год до 0,676 млрд руб. (10,37%) за 10 лет в пользу применения программ лечения с добавлением даратумумаба в ранних линиях лечения ММ. Экономическая эффективность программ лечения с добавлением даратумумаба к леналидомиду в ранних линиях терапии достигается за счет большей эффективности и меньшего числа пациентов с прогрессированием по сравнению с использованием только леналидомида. Максимальный эффект в разнице в затратах достигается на 5-й год моделирования за счет большей выживаемости пациентов в 1-й линии при добавлении даратумумаба к программе лечения леналидомидом в ранних линиях терапии как в базовом сценарии, так и при проведении анализа чувствительности. Динамика суммарных расходов на терапию в целевой популяции в течение временного горизонта моделирования с учетом различных вариантов лечения представлена на рисунке 6.
Таблица 5. Результаты анализа влияния на бюджет в рамках временного горизонта моделирования 10 лет
Table 5. Results of budget impact analysis within the modeling time horizon of 10 years
|
Программа лечения с 1-й по 3-ю линии терапии / Treatment program from 1st to 3rd line therapy |
Число пациентов, n / Number of patients, n |
Затраты на программу в расчете на 1 пациента, руб. / Program costs per 1 patient, rub. |
Суммарные затраты на программу |
|
Текущая практика / Current practice |
|||
|
Rd+(K+Rd)+Dara |
350 |
7 472 080,27 |
2 616 464 050,68 |
|
Rd+(Ixa+Rd)+Dara |
395 |
6 376 696,93 |
2 517 949 591,95 |
|
Rd+(K+Rd)+(Pom+dex) |
99 |
7 247 379,79 |
715 784 586,48 |
|
Rd+(Ixa+Rd)+(Pom+dex) |
111 |
6 049 379,06 |
673 736 586,25 |
|
Всего в условиях текущей практики / Total in сurrent practice |
955 |
– |
6 523 934 815,36 |
|
Ожидаемая практика / Expected practice |
|||
|
При использовании даратумумаба в 3-й линии в режиме монотерапии / When daratumumab is used in 3rd line monotherapy |
|||
|
Rd+(K+Rd)+Dara |
58 |
4 172 539,49 |
243 071 288,26 |
|
Rd+(Ixa+Rd)+Dara |
175 |
4 367 834,00 |
763 344 508,75 |
|
Rd+(K+Rd)+(Pom+dex) |
58 |
3 121 355,98 |
181 834 592,83 |
|
Rd+(Ixa+Rd)+(Pom+dex) |
175 |
3 372 386,56 |
589 375 137,72 |
|
Rd+(Dara+Rd)+(Pom+dex) |
117 |
4 380 426,12 |
510 363 447,74 |
|
Всего / Total |
583 |
– |
2 287 988 975,29 |
|
При использовании даратумумаба в ранних линиях терапии / When daratumumab is used in early lines of therapy |
|||
|
(Dara+Rd)+(K+Rd)+(Pom+dex) |
112 |
9 510 897,38 |
1 062 700 118,23 |
|
(Dara+Rd)+(Ixa+Rd)+(Pom+dex) |
261 |
9 575 577,65 |
2 496 496 726,59 |
|
Всего / Total |
372 |
– |
3 559 196 844,82 |
|
Всего в условиях ожидаемой практики / Total in expected practice |
955 |
– |
5 847 185 820,11 |
|
Разница в затратах между текущей и ожидаемой практикой / Difference in costs between current and expected practices |
– |
– |
–676 748 995,25 (–10,37%) |
Примечание. Rd – леналидомид + дексаметазон; K – карфилзомиб; Dara – даратумумаб; Ixa – иксазомиб; Pom+dex – помалидомид
Note. Rd – lenalidomide + dexamethasone; K – carfilzomib; Dara – daratumumab; Ixa – ixazomib; Pom+dex – pomalidomide
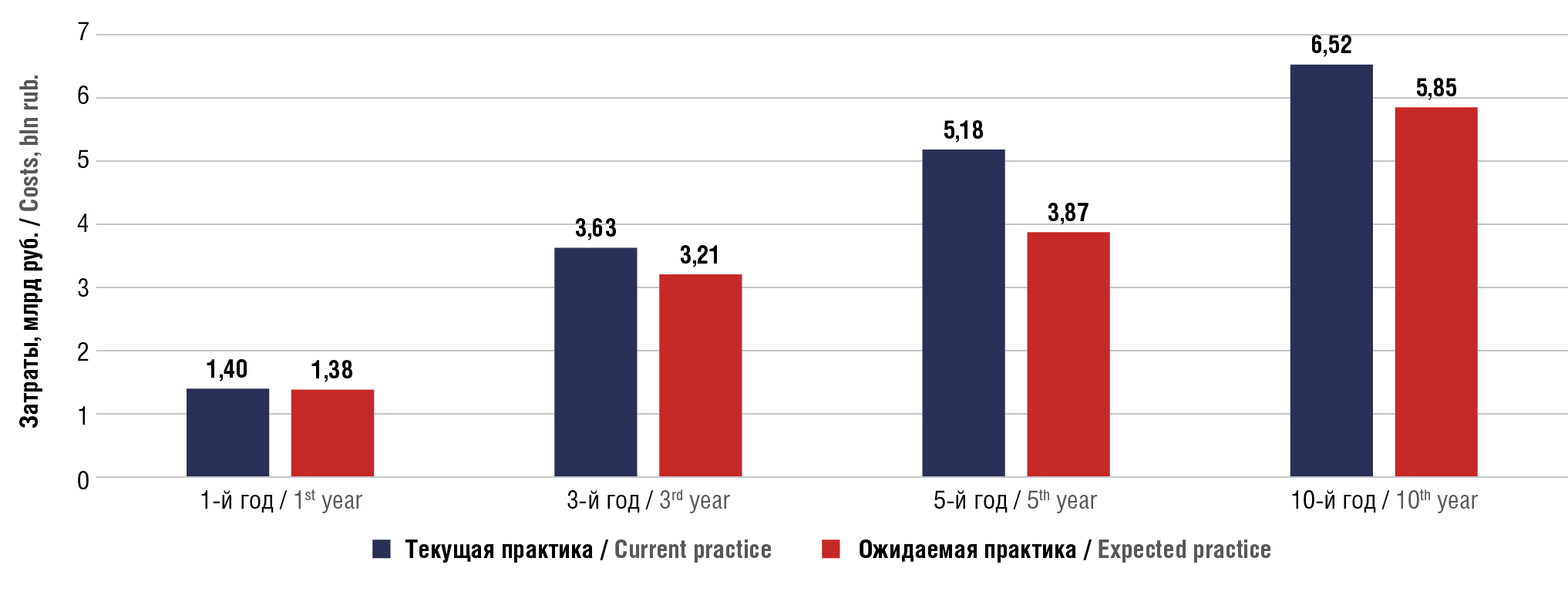
Рисунок 6. Динамика суммарных затрат на терапию с учетом различных вариантов лечения в течение всего временного горизонта моделирования
Figure 6. Dynamics of total costs of therapy taking into account different treatment options during the entire time horizon of modeling
По результатам анализа чувствительности, проведенного при увеличении частоты назначения даратумумаба в 1-й линии терапии и снижении цены леналидомида, разница в затратах между текущей и ожидаемой практикой лечения в 1-й год нивелировалась к 5-му году и составила 0,38 млрд руб. (8,71%) в пользу ожидаемой практики. Рост затрат к 10-му году моделирования в условиях ожидаемой практики не превысил 10% (8,41%) при сохранении базового значения цены на даратумумаб.
ОБСУЖДЕНИЕ / DISCUSSION
В течение последних десятилетий значительное увеличение показателя ОВ при ММ было достигнуто за счет внедрения в клиническую практику новых подходов к лечению: ВДХТ с аутоТГСК, режимов противоопухолевой терапии с использованием ингибитора протеасом бортезомиба и иммуномодулятора леналидомида. Появление новых таргетных препаратов (ингибиторов протеасом следующего поколения, иммуномодуляторов, анти-CD38 моноклональных антител) также значимо улучшило показатели выживаемости пациентов. Однако, несмотря на успехи в лечении, ММ продолжает относиться к категории фатальных ЗНО, 5-летняя ОВ пациентов с ММ в РФ не превышает 49% [5]. Это свидетельствует о том, что даже при наличии существующих возможностей терапии ММ по-прежнему остается неудовлетворенная потребность в улучшении показателей выживаемости пациентов с ММ.
В соответствии с КР основными целями лечения пациентов с ММ являются: максимальное подавление роста опухоли, увеличение продолжительности и улучшение качества жизни пациентов [22]. Лечение пациентов с ММ требует персонализированного назначения различных схем терапии с учетом прогностических факторов. К основным факторам, оказывающим влияние на прогнозирование исходов лечения ММ, специалисты относят: возраст пациента в момент начала лечения, оценку общего состояния онкологического больного по версии Восточной объединенной группы онкологов (англ. Eastern Cooperative Oncology Group, ECOG), молекулярно-генетические характеристики опухоли, возможность проведения ВДХТ с аутоТГСК, число предшествующих линий терапии, режим терапии [14][45]. Пул накопленных данных об эффективности и безопасности препаратов по результатам РКИ, объединенных данных РКИ и данных реальной клинической практики позволяет пересматривать критерии назначения ЛП за счет расширения показаний к их применению. Для планирования бюджета и оптимизации расходов на ЛО необходимо оценивать клинико-экономические преимущества программ лечения за счет внедрения новых опций на ранних этапах терапии для ЛП, уже применяющихся в рутинной клинической практике.
По результатам РКИ зарубежными регуляторами даратумумаб был одобрен к применению у пациентов в сочетании с леналидомидом или бортезомибом в 1-й и 2-й линиях терапии [46]. В 2021 г. в РФ были также внесены данные изменения в ИМП препарата даратумумаб. Расширение показаний к применению даратумумаба позволяет не только рассматривать препарат как опцию лечения в ≥3 линиях терапии, но и включить его в схемы лечения на более ранних этапах в качестве альтернативной опции для комбинации «леналидомид + дексаметазон» в 1-й линии терапии и для триплетов в случае рецидивов заболевания в усло-
виях ожидаемой практики. Таким образом, за счет появления новых данных об эффективности и безопасности применения может быть изменено позиционирование препарата: расширены критерии его назначения в клинической практике, в т.ч. в рамках программы ЛО по перечню 14 ВЗН.
В настоящем исследовании проведена оценка экономических последствий применения даратумумаба при добавлении к программе леналидомида в 1-й и 2-й линиях терапии ММ. Показана клинико-экономическая эффективность использования даратумумаба не только в качестве монотерапии у пациентов с двойной рефрактерностью, но и на ранних этапах лечения. Добавление даратумумаба к программе лечения леналидомидом в 1-й линии терапии позволяет увеличить продолжительность жизни в расчете на 1 пациента на 16,05% и 14,57% для схем (Dara+Rd)+(K+Rd)+(Pom+dex) и (Dara+Rd)+(Ixa+Rd)+(Pom+dex) соответственно по сравнению с текущей практикой применения даратумумаба в 3-й линии в схемах лечения, содержащих леналидомид. При этом за счет большей эффективности даратумумаба в сочетании с леналидомидом в 1-й линии терапии число сохраненных лет жизни в расчете на целевую популяцию (n=955) увеличится на 995,48 и 903,40 года. При добавлении даратумумаба к программе лечения леналидомидом через 5 лет после старта терапии доля выживших пациентов составила 62%, при использовании только леналидомида с дексаметазоном – 52%. Полученные нами результаты коррелируют с данными исследования R. Fonseca et al., где доля выживших пациентов при использовании даратумумаба с леналидомидом в 1-й линии составила 69%, только леналидомида – 55% [44]. Незначительная разница в долевой структуре исходов связана с различиями в выбранных схемах терапии во 2-й и последующих линиях, поскольку существует разница между международными подходами к лечению ММ и российской клинической практикой.
По сравнению с референтной терапией Rd+(Ixa+Rd)+Dara показатель CER при использовании даратумумаба в 1-й и 2-й линиях выше. В то же время применение даратумумаба в 1-й и 2-й линиях терапии является доминирующей стратегией по сравнению со схемой Rd+(K+Rd)+Dara. ICER на 1 год сохраненной жизни при использовании даратумумаба в 1-й линии терапии составил 8,95 млн руб. для схемы (Dara+Rd)+(K+Rd)+(Pom+dex) и 8,41 млн руб. для схемы (Dara+Rd)+(Ixa+Rd)+(Pom+dex), что ниже медианного значения ICER 13,64 млн руб. за 1 год сохраненной жизни для противоопухолевых препаратов, использующихся для лечения ЗНО лимфатической и кроветворной тканей (референтный ICER) [47]. За счет большей эффективности триплета «даратумумаб + леналидомид + дексаметазон» во 2-й линии терапии число сохраненных лет жизни в целевой популяции больше на 291,50 года по сравнению с триплетом «карфилзомиб + леналидомид + дексаметазон» и на 203,93 – по сравнению с триплетом «иксазомиб + леналидомид + дексаметазон». ICER на 1 сохраненный год жизни для триплета «даратумумаб + леналидомид + дексаметазон» также ниже референтного значения ICER – 9,25 млн руб. против 13,64 млн руб. По данным экспертов, в перечни ЛП для медицинского применения включались препараты и с более высоким показателем ICER на 1 сохраненный год жизни. Максимальный уровень показателя ICER для противоопухолевых ЛП, включенных в перечень жизненно необходимых и важнейших лекарственных препаратов, составил 15,3 млн руб. [48]. Полученные нами значения ICER на 1 сохраненный год жизни в случае применения даратумумаба в 1-й и 2-й линиях терапии ниже в сравнении как с максимальным, так и с медианным значениями. Следует отметить, что рассчитанный нами коэффициент относительной ценности применения даратумумаба в 1-й линии терапии также ниже референтных значений ICER на 1 сохраненный год жизни.
В случае применения таргетных препаратов на ранних линиях терапии расходы на ЛО возрастают за счет длительности лечения в отсутствие прогрессирования, в то же время благодаря улучшению исходов разница в затратах в долгосрочной перспективе не только нивелируется, но и приводит к экономии бюджета. По результатам АВБ, включение препарата даратумумаб в программу лечения в ранних линиях терапии ММ не приводит к увеличению расходов на ЛО в целевой популяции.
ЗАКЛЮЧЕНИЕ / CONCLUSION
В отсутствие прямых РКИ использование математического моделирования позволило показать клинико-экономические преимущества добавления даратумумаба к леналидомиду в ранних линиях терапии благодаря увеличению ОВ пациентов в целевой популяции. С учетом тенденции к росту численности показателей заболеваемости ММ расширение критериев назначения даратумумаба для ЛО пациентов за счет ассигнований федерального бюджета может рассматриваться не только в качестве совершенствования подходов к ведению пациентов, но и как экономически целесообразный инструмент для оптимизации использования финансовых ресурсов.
С методологической точки зрения полученные для даратумумаба данные обосновывают целесообразность рассмотрения результатов КЭИ и АВБ при расширении показаний к применению препарата, в т.ч. при ЛО в рамках перечня 14 ВЗН, в долгосрочной перспективе – 5 лет и более. Данный подход позволит оценивать клинико-экономическую эффективность не только стартовых схем терапии, но и программ лечения в течение всего периода дожития пациентов с онкопатологией. Результаты подобной оценки клинико-экономического потенциала для уже использующихся в рутинной практике ЛП могут стать основой для определения частоты их применения и прогнозирования ожидаемых затрат, в т.ч. в рамках программы 14 ВЗН.
На основании полученных результатов можно сделать вывод о клинико-экономической целесообразности добавления даратумумаба к программе лечения леналидомидом в 1-й и 2-й линиях у пациентов с ММ, не являющихся кандидатами на ВДХТ с ауто-
ТГCК и относящихся к группе высокого риска.
ДОПОЛНИТЕЛЬНАЯ ИНФОРМАЦИЯ / ADDITIONAL INFORMATION
Приложение к данной статье размещено онлайн на интернет-сайте журнала «ФАРМАКОЭКОНОМИКА. Современная фармакоэкономика и фармакоэпидемиология»: https://www.pharmacoeconomics.ru/.
1. ГОСТ Р 57525-2017 «Клинико-экономические исследования. Общие требования»; ГОСТ Р 56044-2014 «Оценка медицинских технологий. Общие положения».
2. http://www.ncbi.nlm.nih.gov/pubmed/.
3. https://clinicaltrials.gov/.
4. https://www.cochranelibrary.com/.
Список литературы
1. Rodríguez-Lobato L.G., Pereira A., Fernández de Larrea C., et al. Real-world data on survival improvement in patients with multiple myeloma treated at a single institution over a 45-year period. Br J Haematol. 2022; 196 (3): 649–59. https://doi.org/10.1111/bjh.17888.
2. Huang J., Chan S.C., Lok V., et al. The epidemiological landscape of multiple myeloma: a global cancer registry estimate of disease burden, risk factors, and temporal trends. Lancet Haematol. 2022; 9 (9): e670– 7. https://doi.org/10.1016/S2352-3026(22)00165-X.
3. Zhou L., Yu Q., Wei G., et al. Measuring the global, regional, and national burden of multiple myeloma from 1990 to 2019. BMC Cancer. 2021; 21 (1): 606. https://doi.org/10.1186/s12885-021-08280-y.
4. Каприн А.Д., Старинский В.В., Шахзадова А.О. (ред.) Злокачественные новообразования в России в 2021 году (заболеваемость и смертность). М.: МНИОИ им. П.А. Герцена – филиал ФГБУ «НМИЦ радиологии» Минздрава России; 2022: 252 с.
5. Соловьев М.В., Менделеева Л.П., Алексеева А.Н. и др. Эффективность терапии множественной миеломы в Pоссии (результаты многоцентрового проспективного исследования). Гематология и трансфузиология. 2020; 65 (1): 103–4.
6. Ахмедов М.И., Зейналова П.А. Обзор экспертного совета «Множественная миелома». Онкогематология. 2023; 18 (2): 10–6. https://doi.org/10.17650/1818-8346-2023-18-2-10-16.
7. Скворцова Н.В., Ковынев И.Б., Логинова А.Б. и др. Прогностическое значение модифицированного индекса коморбидности множественной миеломы в условиях реальной клинической практики. Онкогематология. 2020; 15 (3): 51–62. https://doi.org/10.17650/18188346-2020-15-3-51-62.
8. Offidani M., Corvatta L., Morè S., et al. Daratumumab for the management of newly diagnosed and relapsed/refractory multiple myeloma: current and emerging treatments. Front Oncol. 2021; 10: 624661. https://doi.org/10.3389/fonc.2020.624661.
9. National Comprehensive Cancer Network®. Multiple myeloma. https://www.nccn.org/professionals/physician_gls/pdf/myeloma.pdf.
10. Проект клинических рекомендаций. Множественная миелома. URL: https://oncology-association.ru/wp-content/uploads/2022/04/mnozhestvennaya-mieloma.pdf (дата обращения 01.02.2024).
11. Федеральный закон от 21.11.2011 № 323-ФЗ «Об основах охраны здоровья граждан в Российской Федерации». URL: https://base.garant.ru/12191967/ (дата обращения 01.02.2024).
12. Постановление Правительства РФ от 28.08.2014 № 871 «Об утверждении Правил формирования перечней лекарственных препаратов для медицинского применения и минимального ассортимента лекарственных препаратов, необходимых для оказания медицинской помощи». URL: https://base.garant.ru/70728348/ (дата обращения 01.02.2024).
13. Птушкин В.В., Кунст М.А., Митина Т.А. Множественная миелома: ответ на лечение и выживаемость пациентов по данным промежуточного анализа российского наблюдательного ретроспективно-проспективного многоцентрового когортного исследования (MULTISPECT). Терапевтический архив. 2022; 94 (7): 827–35. https://doi.org/10.26442/00403660.2022.07.201718.
14. Птушкин В.В., Мюллер М. Анализ эффективности лечения множественной миеломы на базе клинического опыта европейских стран. Терапевтический архив. 2021; 93 (4): 404–14. https://doi.org/100.26442/00403660.2021.04.200682.
15. Лучинин Е.А., Журавлёва М.В., Шелехова Т.В. и др. Применение метода «затраты–эффективность» в совершенствовании фармакотерапии множественной миеломы. Качественная клиническая практика. 2023; 1: 15–25. https://doi.org/10.37489/2588-0519-20231-15-25.
16. Suresh K., Severn C., Ghosh D. Survival prediction models: an introduction to discrete-time modeling. BMC Med Res Methodol. 2022; 22 (1): 207. https://doi.org/10.1186/s12874-022-01679-6.
17. Толкушин А.Г., Зырянов С.К., Погудина Н.Л., Давыдовская М.В. Методика проведения клинико-экономических исследований лекарственных препаратов для лечения злокачественных новообразований с применением моделирования. ФАРМАКОЭКОНОМИКА. Современная фармакоэкономика и фармакоэпидемиология. 2018; 11 (4): 48–60. https://doi.org/10.17749/2070-4909.2018.11.4.048-060.
18. Smare C., Lakhdari K., Doan J., et al. Evaluating partitioned survival and Markov decision-analytic modeling approaches for use in costeffectiveness analysis: estimating and comparing survival outcomes. Pharmacoeconomics. 2020; 38 (1): 97–108. https://doi.org/10.1007/s40273-019-00845-x.
19. Ряженов В.В., Орлов С.В., Ивахненко О.И. Влияние препарата дурвалумаб на достижение целевого показателя «снижение смертности населения от новообразований» при распространенном мелкоклеточном раке легкого. Современная онкология. 2022; 24 (1): 30–40. https://doi.org/10.26442/18151434.2022.1.201498.
20. Заболотнева Ю.А., Гуревич К.Г., Заборовский А.В., Тарарина Л.А. Фармакоэкономические аспекты лечения множественной миеломы. Фармация. 2021; 70 (4): 11–9. https://doi.org/10.29296/254192182021-04-02.
21. Messori A., Damuzzo V., Rivano M., et al. Application of the IPDfromKM-Shiny method to compare the efficacy of novel treatments aimed at the same disease condition: a report of 14 analyses. Cancers. 2023; 15 (6): 1633. https://doi.org/10.3390/cancers15061633.
22. Клинические рекомендации. Множественная миелома. 2020. URL: https://cr.minzdrav.gov.ru/schema/144_1 (дата обращения 01.02.2024).
23. Протокол заседания комиссии Министерства здравоохранения Российской Федерации по формированию перечней лекарственных препаратов для медицинского применения и минимального ассортимента лекарственных препаратов, необходимых для оказания медицинской помощи от 9 февраля 2022 г. URL: https://static-0.minzdrav.gov.ru/system/attachments/attaches/000/059/327/original/протокол_09.02.2022.pdf?1644589022 (дата обращения 01.02.2024).
24. Kim H., Goodall S., Liew D. Health technology assessment challenges in oncology: 20 years of value in health. Value Health. 2019; 22 (5): 593–600. https://doi.org/10.1016/j.jval.2019.01.001.
25. Ягудина Р.И., Бабий В.В. Моделирование выживаемости в фармакоэкономических исследованиях: модель Маркова и модель разделенной выживаемости. Фармакоэкономика: теория и практика. 2017; 5 (2): 13–7.
26. Engauge Digitizer. URL: https://markummitchell.github.io/engaugedigitizer/ (дата обращения 01.02.2024).
27. Yucel E., Malcolm B., Diakite I., et al. Correlation and prognostic value of surrogate endpoints and overall survival in multiple myeloma: a systematic literature review. URL: https://www.ispor.org/docs/defaultsource/euro2021/yucel-ispor-eu-slr-surrogate-endpoint-and-os-in-mmfinal-pdf.pdf?sfvrsn=9bd876ec_0 (дата обращения 01.02.2024).
28. Лучинин А.С., Загоскина Т.П. Результаты применения статистического моделирования в прогнозировании общей выживаемости больных множественной миеломой. Клиническая онкогематология. Фундаментальные исследования и клиническая практика. 2011; 4 (4): 320–4.
29. Заболотнева Ю.А., Гуревич К.Г. Подходы к выбору первой линии терапии множественной миеломы с фармакоэкономической точки зрения. Кардиоваскулярная терапия и профилактика. 2021; 20 (1S): 33.
30. Cochrane handbook for systematic reviews of interventions. Cochrane Training. URL: https://training.cochrane.org/handbook/current (дата обращения 01.02.2024).
31. EUnetHTA methodological guidelines. Process of information retrieval for systematic reviews and health technology assessments on clinical effectiveness. URL: https://www.eunethta.eu/wp-content/uploads/2020/01/EUnetHTA_Guideline_Information_Retrieval_v2-0.pdf (дата обращения 01.02.2024).
32. Facon T., Kumar S.K., Plesner T., et al. Daratumumab, lenalidomide, and dexamethasone versus lenalidomide and dexamethasone alone in newly diagnosed multiple myeloma (MAIA): overall survival results from a randomised, open-label, phase 3 trial. Lancet Oncol. 2021; 22 (11): 1582–96. https://doi.org/10.1016/S1470-2045(21)00466-6.
33. Stewart A.K., Rajkumar S.V., Dimopoulos M.A., et al. Carfilzomib, lenalidomide, and dexamethasone for relapsed multiple myeloma. N Engl J Med. 2015; 372 (2): 142–52. https://doi.org/10.1056/NEJMoa1411321.
34. Moreau P., Masszi T., Grzasko N., et al. Oral ixazomib, lenalidomide, and dexamethasone for multiple myeloma. N Engl J Med. 2016; 374 (17): 1621–34. https://doi.org/10.1056/NEJMoa1516282.
35. Dimopoulos M.A., Oriol A., Nahi H., et al. Overall survival with daratumumab, lenalidomide, and dexamethasone in previously treated multiple myeloma (POLLUX): a randomized, open-label, phase III trial. J Clin Oncol. 2023; 41 (8): 1590–9. https://doi.org/10.1200/JCO.22.00940.
36. Usmani S.Z., Weiss B.M., Plesner T., et al. Clinical efficacy of daratumumab monotherapy in patients with heavily pretreated relapsed or refractory multiple myeloma. Blood. 2016; 128 (1): 37–44. https://doi.org/10.1182/blood-2016-03-705210.
37. Richardson P.G., Perrot A., San-Miguel J., et al. Isatuximab plus pomalidomide and low-dose dexamethasone versus pomalidomide and low-dose dexamethasone in patients with relapsed and refractory multiple myeloma (ICARIA-MM): follow-up analysis of a randomised, phase 3 study. Lancet Oncol. 2022; 23 (3): 416–27. https://doi.org/10.1016/S1470-2045(22)00019-5.
38. Guyot P., Ades A., Ouwens M.J., et al. Enhanced secondary analysis of survival data: reconstructing the data from published Kaplan–Meier survival curves. BMC Med Res Methodol. 2012; 12: 9. https://doi.org/10.1186/1471-2288-12-9.
39. Liu N., Zhou Y., Lee J.J. IPDfromKM: reconstruct individual patient data from published Kaplan–Meier survival curves. BMC Med Res Methodol. 2021; 21 (1): 111. https://doi.org/10.1186/s12874-02101308-8.
40. Авксентьева М.В., Воробьев П.А., Герасимов В.Б. и др. Экономическая оценка эффективности лекарственной терапии (фармакоэкономический анализ). М.: ООО «Медико-технологическое предприятие «Ньюдиамед»; 2000: 80 с.
41. Омельяновский В.В., Авксентьева М.В., Сура М.В. и др. Методические рекомендации по оценке влияния на бюджет в рамках реализации программы государственных гарантий бесплатного оказания гражданам медицинской помощи. М.: ФГБУ «ЦЭККМП»; 2018: 40 с.
42. Ежегодный бюллетень экспертного совета по редким (орфанным) заболеваниям. Комитет Государственной думы по охране здоровья. URL: http://komitet2-2.km.duma.gov.ru/Ekspertnye-Sovety/RAbota/Orfany/item/19232971/ (дата обращения 01.02.2024).
43. Серпик В.Г., Ягудина, Р.И., Куликов А.Ю. Фармакоэкономика инноваций или инновации в фармакоэкономике: анализ «относительной ценности» вместо анализа «затраты–эффективность»? Фармакоэкономика: теория и практика. 2019; 7 (2): 5–8. https://doi.org/10.30809/phe.2.2019.1.
44. Fonseca R., Facon T., Hashim M., et al. Impact of treatment sequencing on overall survival in patients with transplant-ineligible newly diagnosed myeloma. Oncologist. 2023; 28 (5): e263–69. https://doi.org/10.1093/oncolo/oyad053.
45. Аксенова А.Ю., Жук А.С., Степченкова Е.И., Грицаев С.В. Стратификация больных множественной миеломой: современное состояние вопроса и дальнейшие перспективы. Клиническая онкогематология. 2022; 15 (3): 259–70. https://doi.org/10.21320/2500-21392022-15-3-259-270.
46. Atrash S., Thompson-Leduc P., Tai M.H., et al. Treatment patterns and effectiveness of patients with multiple myeloma initiating Daratumumab across different lines of therapy: a real-world chart review study. BMC Cancer. 2021; 21 (1): 1207. https://doi.org/10.1186/s12885-021-08881-7.
47. Тепцова Т.С., Перова К.А., Мусина Н.З. и др. Определение инкрементальных показателей «затраты/эффективность» противо- опухолевых препаратов. Фармация. 2021; 70 (1): 40–5. https://doi.org/10.29296/25419218-2021-01-07.
48. Авксентьева М.В. Порог готовности платить и финансовая нагрузка на систему здравоохранения при назначении TD-M1 в постнеоадъювантной терапии. Доклад на Большой конференции RUSSCO «Рак молочной железы» (28–30 января 2021 г.). URL: https://rosoncoweb.ru/events/2021/01/28-30/archive/ (дата обращения 01.02.2024).
Об авторах
О. И. ИвахненкоРоссия
Ивахненко Оксана Игоревна – магистр права, ассистент кафедры регуляторных отношений в области обращения лекарственных препаратов и медицинских изделий.
Ул. Трубецкая, д. 8, стр. 2, Москва 119048
В. В. Ряженов
Россия
Ряженов Василий Вячеславович – д.фарм.н., заведующий кафедрой регуляторных отношений в области обращения лекарственных препаратов и медицинских изделий.
Москва
Ул. Трубецкая, д. 8, стр. 2, Москва 119048
Н. А. Фалалеева
Россия
Фалалеева Наталья Александровна – д.м.н., заведующая отделом лекарственной терапии злокачественных новообразований.
Ул. Королева, д. 4, Обнинск 249036
Дополнительные файлы

|
1. Приложение 1. Перечень и характеристики исследований, из которых извлекались кривые выживаемости для имитации индивидуальных данных пациентов | |
| Тема | ||
| Тип | Исследовательские инструменты | |
Скачать
(728KB)
|
Метаданные ▾ | |
Рецензия
Для цитирования:
Ивахненко О.И., Ряженов В.В., Фалалеева Н.А. Оценка клинико-экономических последствий применения даратумумаба в комбинации с леналидомидом в 1-й и 2-й линиях терапии пациентов с множественной миеломой. ФАРМАКОЭКОНОМИКА. Современная фармакоэкономика и фармакоэпидемиология. 2024;17(1):5-21. https://doi.org/10.17749/2070-4909/farmakoekonomika.2024.237
For citation:
Ivakhnenko О.I., Ryazhenov V.V., Falaleeva N.A. Clinical and economic implications of using daratumubab with lenalidomide in the 1st and 2nd lines of therapy for multiple myeloma patients. FARMAKOEKONOMIKA. Modern Pharmacoeconomics and Pharmacoepidemiology. 2024;17(1):5-21. (In Russ.) https://doi.org/10.17749/2070-4909/farmakoekonomika.2024.237

Контент доступен под лицензией Creative Commons Attribution-NonCommercial-ShareAlike 4.0 International License.






































