Перейти к:
Об онкопротективных эффектах хондропротекторов: глюкозамина, хондроитина сульфата и неденатурированного коллагена II типа
https://doi.org/10.17749/2070-4909/farmakoekonomika.2023.182
Аннотация
Цель: систематизация фундаментальных, клинических и эпидемиологических данных об онкопротективном действии хондропротекторов хондроитина сульфата (ХС), глюкозамина (в т.ч. глюкозамина сульфата, ГС) и неденатурированного коллагена II типа (НК-II).
Материал и методы. Проведен систематический компьютерный анализ 6176 публикаций по взаимосвязи ХС/ГС/НК-II и опухолевых заболеваний, найденных по запросу «(glucosamine OR chondroitin OR ((“Collagen Type II” OR “type II collagen”) AND pharmacology)) AND (Cancer OR cancers OR tumor OR tumors OR tumour*) NOT tumor necrosis» в базах данных PubMed и Embase. Были взяты все статьи любого формата с 1900 г. по настоящее время, для которых имелись полные абстракты. Использован топологический подход к анализу данных.
Результаты. Крупномасштабные клинико-эпидемиологические исследования и метаанализы показали, что регулярное употребление ХС/ГС снижает риск развития рака толстой кишки и рака легких, а также смертности от опухолевых заболеваний. Механизмы онкопротективного действия ХС/ГС осуществляются путем ингибирования провоспалительного каскада фактора некроза опухоли альфа, рецептора CD44 и ядерного фактора каппа B, а также инициации апоптоза опухолевых клеток. Модулируя рецептор CD44 и специфическое O-гликозилирование внутриклеточных белков, ГС ингибирует провоспалительные эффекты каскада арахидоновой кислоты, интерлейкинов ИЛ-6, ИЛ-8, пролиферативного пути PI3K/Akt, циклинзависимых киназ. Проведены первые постгеномные исследования онкопротективных эффектов ХС/ГС, включая исследования микробиома. Дополнительно ХС способствует ингибированию эффектов фактора роста эндотелия сосудов и матриксных металлопротеиназ, участвующих в метастазировании и инвазии опухолей. Потенциально онкопротективные эффекты ХС/ГС могут усиливаться противовоспалительным действием НК-II: добавление в комплексе ХС/ГС вещества НК-II позволяет снижать аутоиммунную ветвь патогенеза не только при первичном, но и при вторичном ОА, ревматоидном артрите.
Заключение. Хондропротекторы ХС и глюкозамин (в т.ч. ГС) проявляют онкопротективные эффекты. Применение ХС и ГС совместно со стандартизированными фармацевтическими формами НК-II может усиливать их противовоспалительное и иммуномодулирующее действие.
Для цитирования:
Торшин И.Ю., Чучалин А.Г., Громова О.А. Об онкопротективных эффектах хондропротекторов: глюкозамина, хондроитина сульфата и неденатурированного коллагена II типа. ФАРМАКОЭКОНОМИКА. Современная фармакоэкономика и фармакоэпидемиология. 2023;16(4):681-699. https://doi.org/10.17749/2070-4909/farmakoekonomika.2023.182
For citation:
Torshin I.Yu., Chuchalin A.G., Gromova O.A. Oncoprotective effects of chondroprotectors: glucosamine, chondroitin sulfate and undenatured type II collagen. FARMAKOEKONOMIKA. Modern Pharmacoeconomics and Pharmacoepidemiology. 2023;16(4):681-699. (In Russ.) https://doi.org/10.17749/2070-4909/farmakoekonomika.2023.182
ВВЕДЕНИЕ / INTRODUCTION
Эндогенные протеогликаны на основе молекул хондроитина сульфата (ХС) представляют собой макромолекулы, необходимые для развития клеток, лечения заболеваний человека и злокачественных новообразований. В частности, хондроитинсульфатные протеогликаны (англ. сhondroitin sulfate proteoglycan, CSPG) накапливаются в строме опухоли. Управляя множественными проонкогенными сигнальными путями опухолевых клеткок (каскады рецепторной тирозинкиназы (англ. receptor tyrosine kinase, RTK), митоген-активируемых протеинкиназ (англ. mitogen-activated protein kinase, MAPK), интегринов, киназы фокальной адгезии (англ. focal adhesion kinase, FAK), внеклеточных киназ (англ. еxtracellular signal-regulated kinases, ERK1/2)) и способствуя критическим взаимодействиям в микроокружении опухоли, CSPG играют ключевую роль в росте и инвазии опухолей [1].
В частности, ХС-протеогликан CSPG4 – трансмембранный белок I типа, связанный с ростом и прогрессированием опухолей. Взаимодействуя с компонентами внеклеточного матрикса, внеклеточными лигандами, рецепторами факторов роста, внутриклеточными ферментами, CSPG4 регулирует миграцию клеток и передачу пролиферативных сигналов. Абнормально повышенная экспрессия CSPG4 опухолевыми клетками, периваскулярными клетками и клетками-предшественниками в глиомах указывает на роль этого ХС-протеогликана в формировании, прогрессировании и неоангиогенезе опухолей. Поэтому CSPG4 является перспективной терапевтической мишенью при лечении опухолевых заболеваний [1].
Регуляция эффектов эндогенных ХС-протеогликанов возможна посредством использования экзогенных ХС и глюкозамина сульфата (ГС), проявляющих широкий круг противовоспалительных и онкопротективных эффектов. Напомним, что ХС/ГС повсеместно используются в терапии остеоартрита и называются хондропротекторами (т.е. препаратами для профилактики и лечения дегенеративно-дистрофических заболеваний суставов и позвоночника), симптоматическими лекарственными средствами замедленного действия (СЛСЗД) (англ. symptomatic slow acting drug for osteoаrthritis, SYSADOA), болезнь-модифицирующими препаратами против остеоартрита (англ. disease-modifying osteoarthritis drug, DMOAD) и т.п. [2].
С точки зрения молекулярной фармакологии высокоочищенные фармацевтические формы ХС/ГС, взаимодействуя с рецепторами CD44, толл-подобными рецепторами 4 (англ. toll-like receptor 4, TLR4) и молекулами клеточной адгезии 1 (англ. inter-cellular adhesion molecule 1, ICAM1) на поверхности различных клеток, ингибируют провоспалительный транскрипционный ядерный фактор каппа В (англ. nuclear factor kappa В, NF-κВ) и цитокиновый сигнальный путь JAK/STAT1. Поэтому ХС/ГС демонстрируют выраженное противовоспалительное и анальгетическое действие [3].
Онкопротективное действие ХС/ГС обусловлено, в частности, тем, что они способствуют снижению хронического воспаления, в т.ч. опосредованного фактором некроза опухолей альфа (ФНО-α). Первые работы по онкопротективным эффектам глюкозамина были проведены более 70 лет назад [4–6].
Хемореактомный анализ молекулы ГС показал, что онкопротективные эффекты ГС также могут быть основаны на регуляции воспаления через простагландины/лейкотриены, ФНО-α и другие цитокины, матриксные металлопротеиназы [7]. Выявлено прямое воздействие на снижение транскрипции генов, вовлеченных в провоспалительный сигнальный каскад NF-κB, внутриклеточную передачу сигнала от рецепторов цитокинов, процессы пролиферации клеток [8].
Результаты фундаментальных исследований, указывающие на перспективность применения фармацевтически стандартизированных форм ХС/ГС в профилактике/терапии опухолевых заболеваний, подтверждаются доказательными исследованиями. Например, в крупномасштабном когортном исследовании ГС снижал риск колоректального рака на 20% (отношение шансов (ОШ) 0,80; 95% доверительный интервал (ДИ) 0,67–0,95) [9]. Метаанализ применения ГС и ХС в профилактике рака включил результаты 13 исследований (n = 1 690 918, 55 045 случаев рака). Прием ХС и/или ГС ассоциирован с более низким риском колоректального рака (ОШ 0,91; 95% ДИ 0,87–0,94) и рака легких (ОШ 0,84; 95% ДИ 0,79–0,89) [10].
Стандартизированные экстракты неденатурированного коллагена II типа (НК-II) являются основой современных хондропротекторных препаратов. Действие НК-II связано с модуляцией механизмов врожденного и приобретенного иммунитета, снижением активности провоспалительных цитокинов и простагландинов. Поэтому онкопротективные эффекты ХС и ГС могут усиливаться противовоспалительным действием НК-II [11].
МАТЕРИАЛ И МЕТОДЫ / MATERIAL AND METHODS
Стратегия поиска / Search strategy
Проведен систематический анализ онкопротективных эффектов ХС/ГС и НК-II. Массив публикаций по данному вопросу достаточно обширен: например, только по запросу «(glucosamine OR chondroitin OR (("Collagen Type II" OR "type II collagen") AND pharmacology)) AND (Cancer OR cancers OR tumor OR tumors OR tumour*) NOT tumor necrosis» в базах данных биомедицинских публикаций PubMed и Embase найдено 6176 источников (в т.ч. по ГС – 3168). Были взяты все статьи любого формата с 1900 г. по настоящее время, для которых имелись полные абстракты.
Топологический анализ / Topological analysis
Для анализа данной выборки были применены методы топологического анализа данных [12–14]. Множества прецедентов включают описания объектов (текстов научной публикации), состоящие из признакового описания (слов и словосочетаний текста) и информации о принадлежности этого объекта к тому или иному классу (например, класс К1 – «публикации по теме», класс К2 – «контрольная выборка» и т.д.). Затем исследуется разрешимость поставленной задачи классификации текстов (т.е. непротиворечивость множеств прецедентов при заданном признаковом описании). Для эффективного установления выполнимости условия (1) вводится некоторый функционал информативности каждого признака относительно классов К1/К2 [12]. Вычисление условия разрешимости на множестве прецедентов и лежит в основе использованного метода классификации текстов. В результате вычисления отбираются наиболее информативные признаки, гарантирующие разрешимость задачи классификации, затем проводится анализ метрической диаграммы, на которой отображены эти признаки.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ / RESULTS AND DISCUSSION
Результаты систематического анализа / Results of systematic analysis
Систематический компьютерный анализ включил сравнение 6176 публикаций по взаимосвязи ХС/ГС/НК-II и опухолевых заболеваний с публикациями в контрольной выборке (6170 статей, случайно выбранных из 5 388 383 найденных по запросу «(Cancer OR cancers OR tumor OR tumors OR tumour OR tumours) NOT glucosamine NOT chondroitin» в базе данных PubMed).
В ходе систематического анализа литературы выявлено 29 наиболее информативных терминов, позволяющих отличать статьи по онкопротективному действию ХС/ГС/НК-II от контроля, и проведен их экспертный анализ [15]. Список этих терминов указывает на участие ХС/ГС/НК-II в образовании протеогликановых и коллагеновых компонентов внеклеточного матрикса соединительной ткани, в процессах адгезии клеток, формировании и метастазировании новообразований. С молекулярно-фармакологической точки зрения экзогенные ХС/ГС приводят к апоптозу линий опухолевых клеток посредством активации рецептора CD44 и ингибирования NF-κB, эффектов ФНО-α, циклинзависимых киназ (англ. сyclin-dependent kinase, CDK), регулирования экспрессии генов и гликозилирования внутриклеточных белков. ХС подавляет рост рака толстой кишки человека HCT-116 как in vitro, так и in vivo, ингибируя пролиферацию и индуцируя апоптоз. Индукция апоптоза происходит за счет активации митохондриального пути, связанного с семейством Bcl-2 [16]. С клинической точки зрения нарушения обмена ХС/ГС и НК-II ассоциированы с многочисленными опухолевыми патологиями (рис. 1).
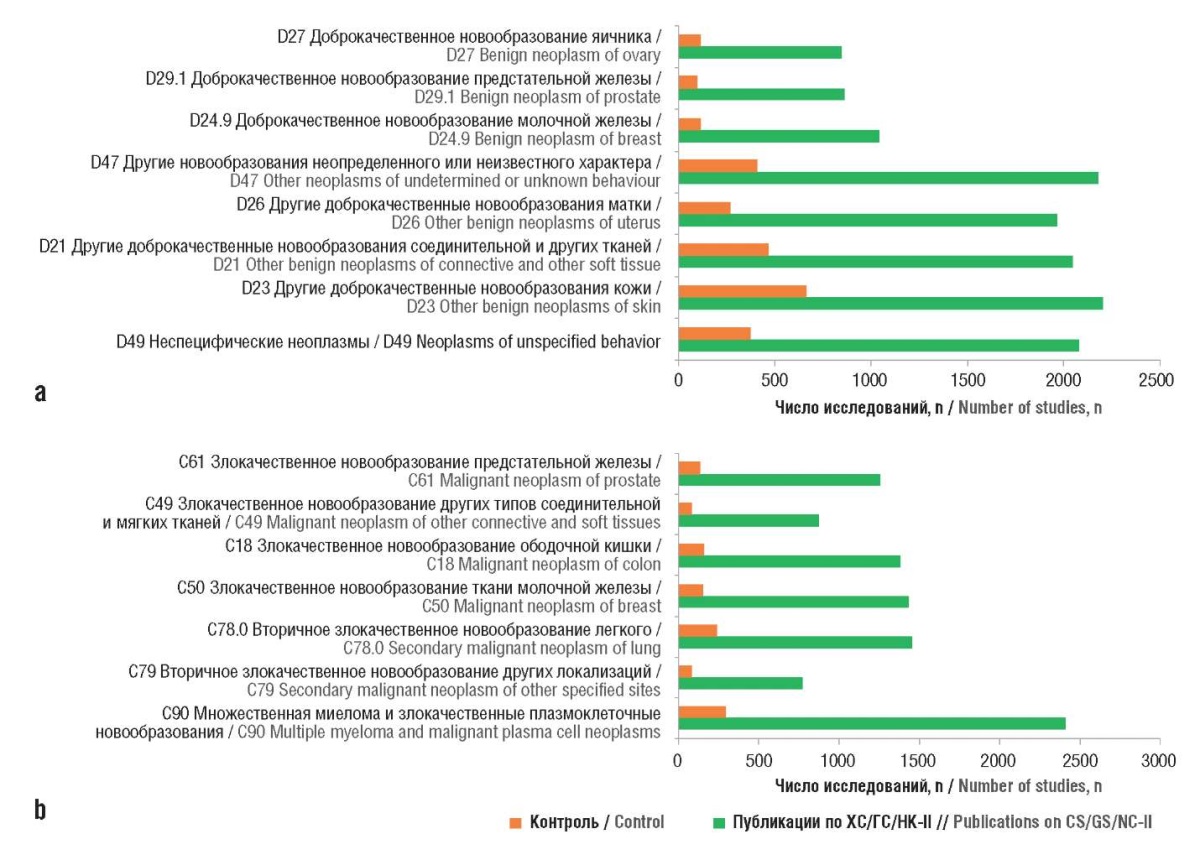
Рисунок 1. Исследования по доброкачественным (а)
и злокачественным (b) опухолевым патологиям,
достоверно ассоциированным с нарушениями обмена
хондроитина сульфата (ХС), глюкозамина сульфата (ГС)
и неденатурированного коллагена II типа (НК-II)
Figure 1. Studies on benign (a) and malignant (b) tumor pathologies
significantly associated with abnormalities in chondroitin sulfate (CS),
glucosamine sulfate (GS), and undenatured type II collagen (UC-II) metabolism
Ниже представлены результаты фундаментальных и клинических исследований механизмов онкопротективного действия ХС/ГС при пероральном использовании, постгеномных эффектов ХС/ГС на опухолевые ткани (в т.ч. воздействие на микробиоту желудочно-кишечного тракта (ЖКТ)), клинико-эпидемиологических исследований эффектов ХС/ГС на заболеваемость раком и смертность. Рассмотрены перспективы исследований онкопротективных эффектов экстрактов НК-II.
Таргетное накопление ХС/ГС в опухолевой ткани // Targeted accumulation of СS/GS in tumor tissue
Экспериментальные и клинические исследования показали, что упомянутые выше онкопротективные эффекты молекул экзогенных ХС/ГС (апоптоз, ингибирование NF-κB, CDK, гликозилирования белков и др.) сопровождаются таргетным накоплением ГС и ХС в тканях опухолей. Вследствие этого уникального свойства молекулы ХС/ГС исследуются как вспомогательные вещества при таргетной доставке лекарств и при проведении диагностики с помощью магнитно-резонансной томографии (МРТ).
В частности, наночастицы ХС с инкапсулированным в них метотрексатом вследствие специфических взаимодействий с рецептором CD44 существенно увеличивали растворимость и эффективность доставки химиопрепарата к опухоли [17]. Исследование in vitro показало, что наночастицы на основе ХС могут одновременно доставлять кверцетин (хемосенсибилизатор), хлорин Е6 (фотосенсибилизатор) и паклитаксел (химиотерапевтическое средство) в рамках химиофотодинамической терапии, улучшающей противоопухолевую эффективность паклитаксела по отношению к клеткам MCF-7/ADR [18].
Свойство ГС дозозависимо накапливаться в опухолях наряду с крайне низкой токсичностью может быть использовано для улучшения визуализации опухолей при проведении МРТ. Это было продемонстрировано в эксперименте на мышах с моделью опухоли молочной железы (рис. 2) [19].
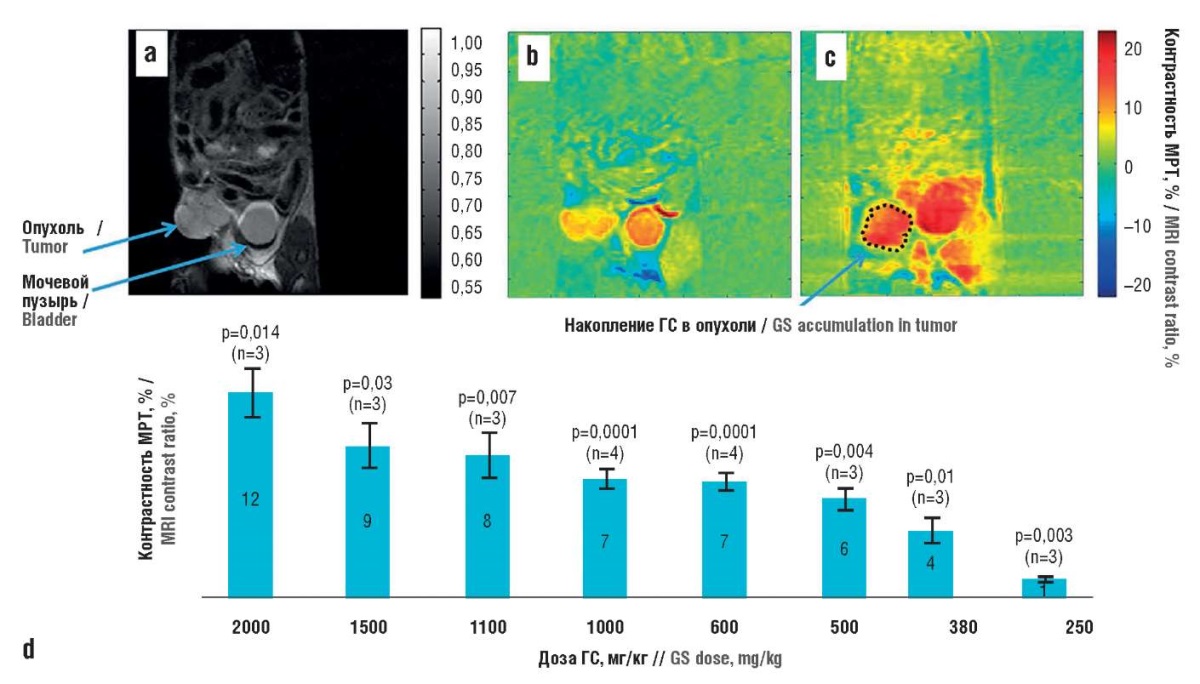
Рисунок 2. Результаты магнитно-резонансной томографии (МРТ)
мышей с опухолями молочной железы (модель 4T1) (по данным [19]):
a – изображение мыши с опухолью молочной железы
до введения глюкозамина сульфата (ГС);
b – МРТ-изображение перед приемом ГС;
с – МРТ-изображение через 48 мин после приема ГС в дозе 1,1 г/кг;
d – на гистограмме показана средняя контрастность МРТ
через 1 ч после приема ГС per os
Figure 2. Magnetic resonance imaging (MRI) results
for mice with mammary tumors (model 4T1) (after [19]):
a – image of mouse with mammary tumor
before glucosamine sulfate (GS) administration;
b – MRI image before GS administration;
c – MRI image 48 min after GS administration at a dose of 1.1 g/kg;
d – histogram shows mean MRI contrast 1 h after GS administration per os
Показана перспективность клинического использования глюкозамина для улучшения качества МРТ. В частности, у пациенток с недавно диагностированными опухолями (n=12) была осуществлена визуализация опухолей молочной железы посредством МРТ с химическим переносом глюкозамина (англ. chemical exchange saturation transfer, CEST). Процедура CEST-МРТ выявила более высокую интенсивность сигнала в ткани опухоли по сравнению с окружающей тканью молочной железы (8,12±4,09%; p=0,0022), причем с постепенным увеличением за счет поглощения глюкозамина (на 3,41±0,79%; p=0,02). Последнее соответствует уточнению локализации опухоли [20].
Молекулярные механизмы онкопротективного действия ГС / Molecular mechanisms of GS oncoprotective action
В цитологических экспериментах низкомолекулярный ХС тормозил рост клеток рака толстой кишки [21] и опухоли мочевого пузыря [22]. Прием олигомеров ГС и N-ацетил-D-глюкозамина per os тормозил рост опухоли на модели колоректального рака у мышей [23]. Низкомолекулярный ХС из хряща осетровых рыб при приеме per os таргетно накапливается в опухолях и существенно снижает рост ксенотрансплантата колоректальной аденокарциномы (клетки линии HT-29), ингибируя пролиферацию клеток, индуцируя апоптоз и не оказывая отрицательного воздействия на нормальные ткани [24].
ГС ингибирует экспрессию циклооксигеназы 2 (ЦОГ-2) и провоспалительного ИЛ-8 в клетках линии MCF-7 рака молочной железы человека. Активация экспрессии генов ЦОГ-2 и ИЛ-8, вызываемая протеинкиназой С, ослабляется ГС через рецептор CD44 и сигнальный путь NF-κB (рис. 3) [25]. Аналогичные результаты были получены для цитокинов ИЛ-1β и ИЛ-8 на клетках опухолей предстательной железы (линии DU-145, PC-3 рака) [26].
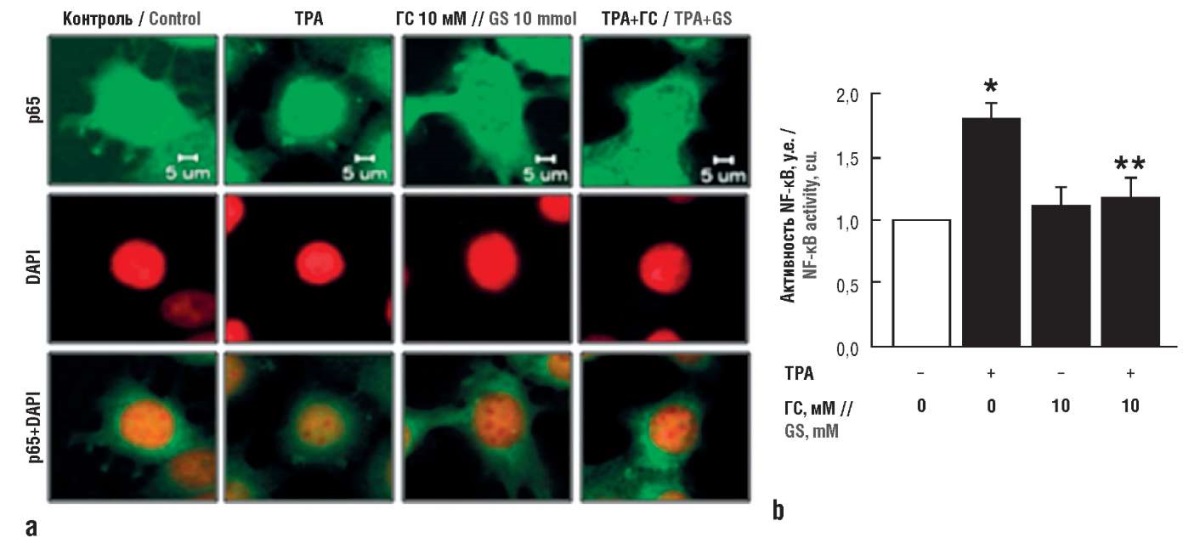
Рисунок 3. Глюкозамина сульфат (ГС) ингибирует сигнальный каскад
ядерного фактора каппа В (англ. nuclear factor kappa В, NF-κВ),
участвующий в экспрессии генов циклооксигеназы 2 и интерлейкина-8
при посредстве каскада протеинкиназы С в опухолевых клетках
линии MCF-7 (рак молочной железы).
Клетки предварительно обрабатывали 10 мМ ГС в течение 30 мин
с последующей обработкой 20 нг/мл активатора
протеинкиназы С – 12-O-тетрадеканоилфорбол-13-ацетата
(англ. 2-O-tetradecanoylphorbol 13-acetate, TPA) (по данным [25]):
a – активация субъединицы p65 NF-κB через 12 ч визуализирована
с помощью иммунофлуоресцентной микроскопии (масштаб 5 мкм);
b – количественная оценка активности NF-κB
при использовании ГС по данным иммунофлуоресцентной микроскопии.
DAPI (англ. 4′,6-diamidino-2-phenylindole) –
краситель 4',6-диамидино-2-фенилиндол.
* р<0,05 по сравнению с контрольной группой;
** р<0,05 по сравнению с группой, получавшей только TPA
Figure 3. Glucosamine sulfate (GS) inhibits nuclear factor
kappa B (NF-κB) signaling cascade involved in cyclooxygenase 2
and interleukin-8 gene expression mediated by protein kinase C cascade
in MCF-7 (breast cancer) tumor cell line.
Cells were pretreated with 10 mM GS for 30 min followed
by treatment with 20 ng/ml of the protein kinase C activator
12-O-tetradecanoylphorbol 13-acetate (TPA) (after [25]):
a – activation of p65 NF-κB subunit after 12 h visualized
by immunofluorescence microscopy (scale 5 μm);
b – quantification of NF-κB activity using GS
by immunofluorescence microscopy.
DAPI – 4′,6-diamidino-2-phenylindole.
* p<0.05 compared to the control group;
** p<0.05 compared to the group receiving TPA alone
Онкопротективная активность ГС осуществляется при воздействии на N-гликозилирование – посттрансляционную модификацию белков, определяющую время их жизни в клетке и круг биологических ролей. В цитологическом исследовании клеток карциномы предстательной железы человека (линия DU145) показано, что рецептор ИЛ-6 подвергается N-гликозилированию, а ГС тормозит N-гликозилирование рецепторов, тем самым снижая популяцию опухолевых клеток [27]. Инактивируя белок STAT3 через N-гликозилирование, ГС тормозит рост опухолевых клеток молочной железы [28]. На клетках рака легких в культуре (линия A549) онкопротективное действие ГС реализовалось посредством модификации O-гликозилирования белков протеома, что приводило к ингибированию активности сигнальных путей FoxO/PI3K/Akt и FoxO/MAPK [29].
Дополнительно ГС ингибирует метаболизм тимидина (непосредственно воздействуя на тимидинкиназу [30]), индуцирует экспрессию белка-супрессора опухолей (ингибитор сериновой протеазы Maspin) [31], стимулирует гибель опухолевых клеток посредством ингибирования протеасом (через O-гликозилирование белков [32]), инактивирует рецептор андрогенов в опухолевых клетках [33], тормозит пролиферацию посредством ингибирования сигнального белка p70S6K и усиливает эффекты специфического ингибитора белка – мишени рапамицина у млекопитающих (англ. mammalian target of rapamycin, mTOR) [34], стимулирует апоптоз клеток опухолей легкого (посредством фактора TRAIL2 и активации белка DR-5, что активирует проапоптотическую каспазу-8 через O-гликозилирование белков [35]).
ГС и ХС могут непосредственно воздействовать на цикл клеточного деления в фазе G0/G1. Антипролиферативное действие ГС в опухолевых клетках связано с остановкой цикла клеточного деления в фазе G0/G1. ГС дозозависимо ингибировал пролиферацию опухолевых клеток линий 786-O и Caki-1 рака почки и стимулировал апоптоз опухолевых клеток (рис. 4). Экспрессия регуляторных белков Cyclin D1, CDK4 и CDK6, которые способствуют фазовому переходу G1/S во время пролиферации, была значительно подавлена на фоне повышения уровней ингибиторов клеточного цикла p21 и p53 [36].
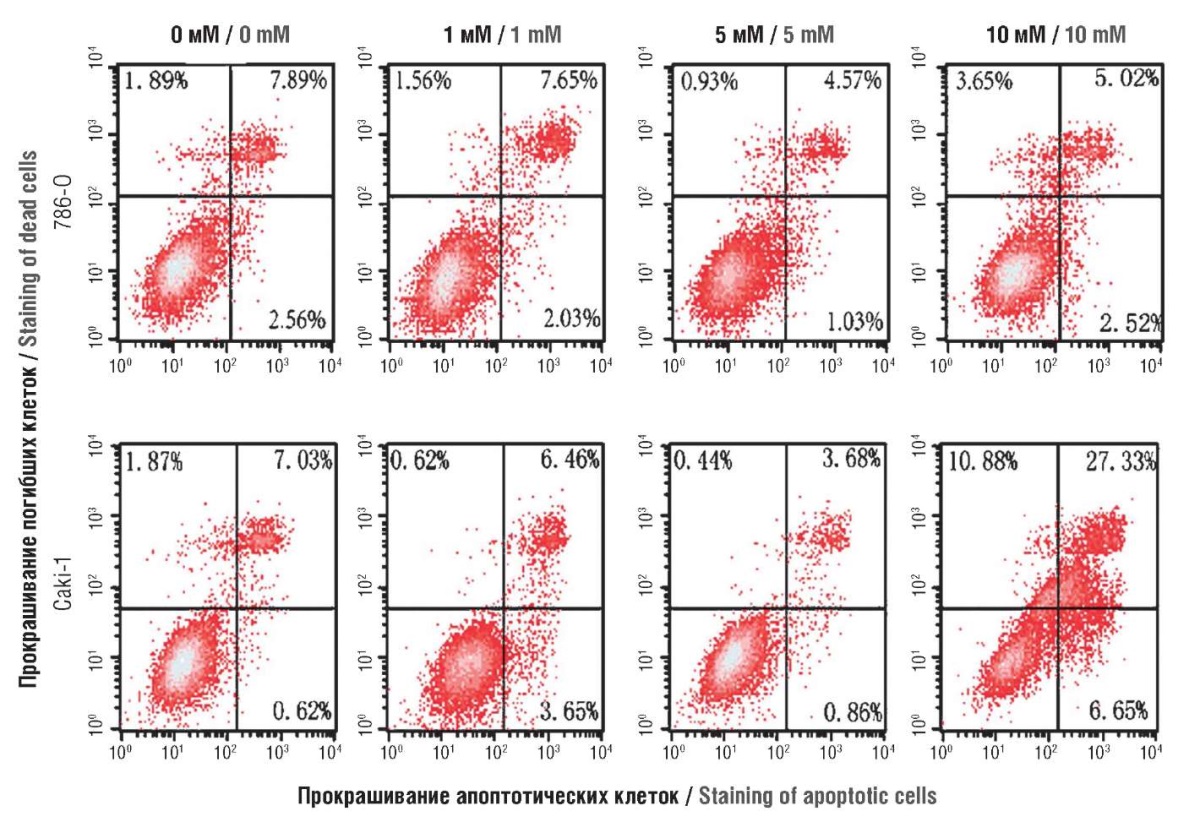
Рисунок 4. Влияние глюкозамина на апоптоз
опухолевых клеток линий 786-O и Caki-1
при разных концентрациях глюкозамина сульфата.
Проведено прокрашивание апоптотических клеток
красителем аннексин-V-FITC, а погибших клеток –
красителем пропидиум йодид (англ. propidium iodide, PI).
Апоптотическими считались клетки,
окрашенные на аннексин V, но не на PI
(адаптировано из [36])
Figure 4. Effect of glucosamine on apoptosis
of tumor cells of 786-O and Caki-1 lines
at different concentrations of glucosamine sulfate.
Apoptotic cells were stained with annexin-V-FITC dye
and dead cells were stained with propidium iodide (PI) dye.
Cells stained with annexin V but not with PI
were considered apoptotic (adapted from [36])
Показано влияние ХС на ингибирование CDK при колоректальном раке. Уровни экспрессии генов CDK1, CDK4 и CDK6 изменяются на разных стадиях заболевания и рассматриваются как независимые факторы риска заболевания. Эксперименты на линии опухолевых клеток HCT-116 подтвердили, что ХС ингибирует уровни экспрессии генов и белков CDK4 и других CDK, увеличивая соотношение апоптотических клеток HCT-116 (через регуляцию сигнальных путей MAPK) (рис. 5) [37].
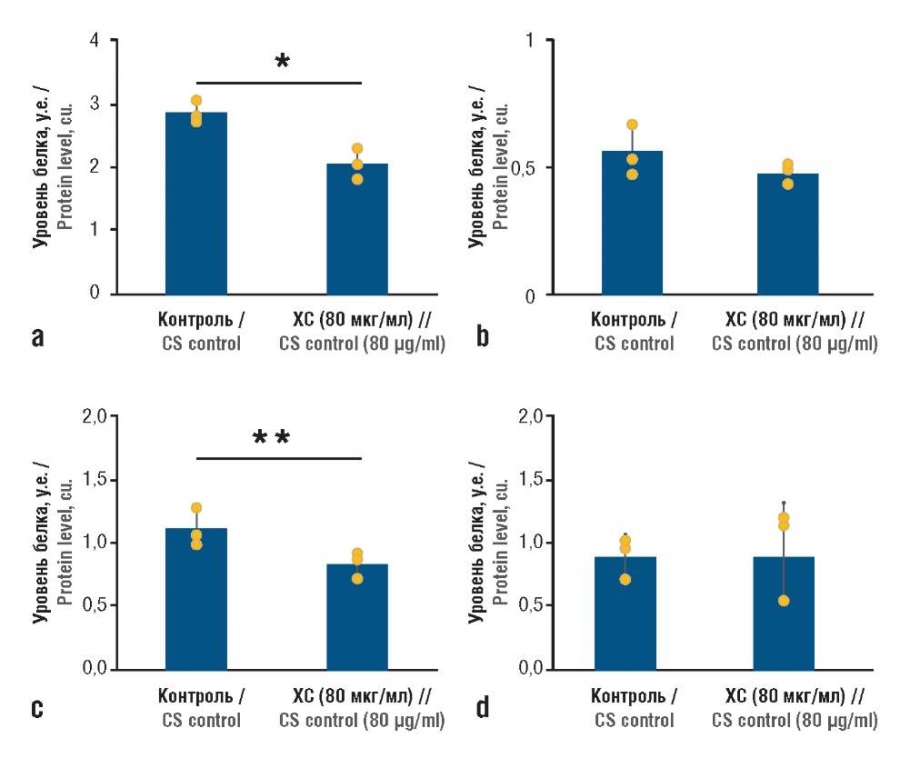
Рисунок 5. Циклинзависимые киназы
(англ. cyclin-dependent kinases, CDK)
регулируются хондроитина сульфатом (ХС)
в клетках колоректального рака линии HCT-116 в культуре.
Уровни белков: a – CDK1; b – CDK2; c – CDK4; d – CDK6
(по данным [37]).
* р<0,05 по сравнению с плацебо;
** р<0,1 по сравнению с плацебо
(оценивали с помощью t-критерия Стьюдента)
Figure 5. Cyclin-dependent kinases (CDK)
are regulated by chondroitin sulfate (CS)
in colorectal cancer cell line HCT-116 in culture.
Protein levels: a – CDK1; b – CDK2; c – CDK4; d – CDK6 (after [37]).
* p<0.05 compared to placebo; **
p<0.1 compared to placebo (evaluated by Student’s t-criterion)
Кроме воздействия на CDK ХС/ГС тормозят цикл деления опухолевых клеток и по другим смежным механизмам:
- активация экспрессии гена, кодирующего ингибитор циклинзависимой киназы N1 (CDKN1);
- увеличение апоптоза (посредством активации каспазы-3);
- аутофагия опухолевых клеток посредством стимуляции стресса в эндоплазматическом ретикулуме (индукция экспрессии генов BiP, IRE1, фосфо-eIF2А)3[38];
- подавление экспрессии фактора роста эндотелия сосудов (англ. vascular endothelial growth factor, VEGF);
- увеличение экспрессии тканевого ингибитора металлопротеиназы-1 (англ. tissue inhibitor of metalloproteinase 1, TIMP-1), подавляющего матриксные металлопротеиназы.
Эти эффекты ХС/ГС сопровождаются значительным ингибированием сигнального пути NF-κB [39].
Формирование четкой границы опухолевых узлов (инкапсуляция) – большая проблема противоопухолевой терапии, особенно в случае опухолевых заболеваний мозга и метастазирования. Процесс инкапсуляции опухолей неразрывно связан с состоянием микроокружения опухоли, прежде всего с синтезом ХС-протеогликанов и других компонентов соединительной ткани [40]. Состояние микроокружения опухоли определяет, будут ли процессы биосинтеза соединительной ткани приводить к метастазированию или ХС будет способствовать ингибированию инвазии опухоли. Известно, что повышенная экспрессия ХС-протеогликанов в моделях опухолей мозга вызывает астроглиотическую инкапсуляцию опухоли [41]. И наоборот, механическое повреждение стенки капсулы из ХС-протеогликанов создает условия для роста и метастазирования опухолей [40].
Следует отметить, что онкопротективные эффекты ХС зависят от характера сульфатирования молекул хондроитина. Это обусловлено тем, что расположение отрицательно заряженных сульфатных групп в пространственной структуре ХС существенно влияет на прикрепление и инвазию опухолевых клеток. Отметим, что при метастазировании эндогенные ХС-стромы характеризуются уменьшением отношения количеств дерматансульфата и ХС на фоне нарушений процессов сульфатирования ХС [42]. Систематический фармакологический анализ эффектов 16 паттернов сульфатирования ХС на клетках опухоли молочной железы (линия клеток MDA-MB-231) показал достоверное усиление апоптоза при обработке ди- и трисульфатированными дисахаридами ХС. В частности, хондроитина-4,6-сульфат снижал подвижность опухолевых клеток и ингибировал проонкогенный каскад Wnt/катенин [43].
Онкопротективные эффекты ХС/ГС: постгеномные исследования // Оncoprotective effects of СS/GS: postgenomic studies
Дозозависимый хемокиномный анализ эффектов ГС на активность 297 ферментов киназ (кином человека) показал, что ГС может ингибировать активность 31 киназы человека со значениями констант ингибирования (EC50) в субмикромолярном диапазоне. Подавление активности киназ MAP3K3, PDPK1, IKBKE4 соответствует ингибированию NF-κB. Ингибируя активность CDK4, CDK6 и др., ГС тормозит гиперпролиферативные процессы, а ингибирование киназ CHEK1, Src и PRKCD5 стимулирует апоптоз опухолевых клеток. Ингибирование данной выборки киназ способствует снижению избыточного ангиогенеза, препятствует развитию метастазирования и резистентности к химиотерапии [44].
Транскриптомный и протеомный анализ ХС на клетках колоректального рака (линия НТ-29) в сравнении с нормальными эпителиальными клетками толстой кишки (линия NCM460) выявил несколько белков – мишеней онкопротективного действия. ХС не оказывал существенного влияния на профиль экспрессии генов и белков в нормальных клетках NCM460. ХС ингибировал рост опухолевых клеток линии HT-29 и избирательно регулировал экспрессию 188 генов, участвующих в репликации ДНК, клеточном цикле и апоптозе опухолевых клеток. Параллельно ХС приводил к снижению уровней провоспалительных цитокинов (рис. 6) [45].
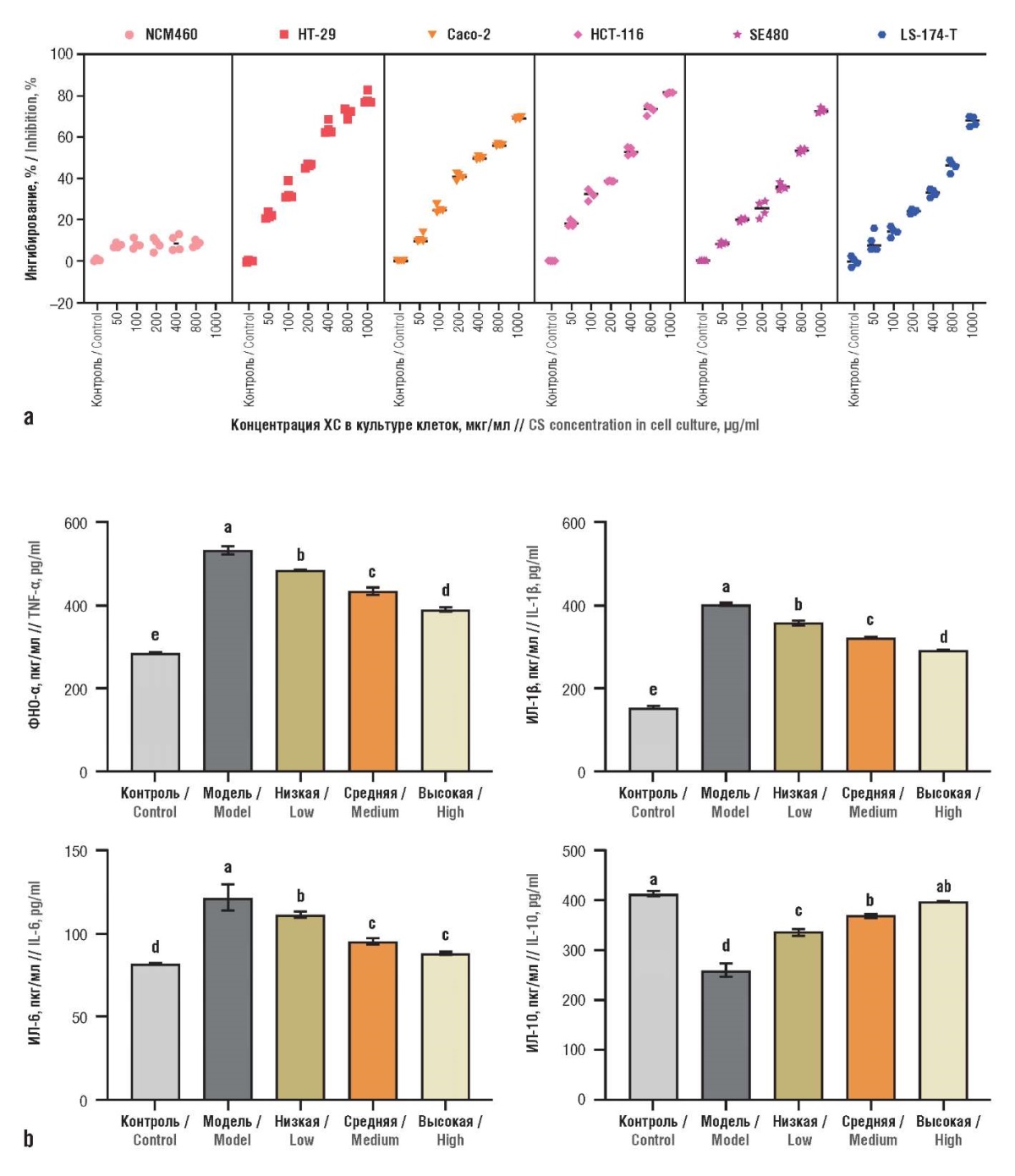
Рисунок 6. Влияние хондроитина сульфата (ХС)
на пролиферацию клеток рака толстой кишки
и нормального эпителия кишечника (по данным [45]):
a – клетки рака толстой кишки
(линии HT-29, Caco-2, HCT-116, SE480, LS-174-T)
и клетки нормального кишечного эпителия NCM460
обрабатывали различными концентрациями
(50, 100, 200, 400, 800 и 1000 мкг/мл) ХС в течение 24 ч,
жизнеспособность клеток измеряли с помощью набора
для подсчета клеток 8 (англ. Cell Counting Kit-8, CCK8),
результаты выражали в виде степени ингибирования
по сравнению с необработанными клетками;
b – уровни провоспалительных цитокинов
дозозависимо снижались под влиянием ХС.
ФНО-α – фактор некроза опухоли альфа;
ИЛ – интерлейкин.
Низкая доза – 200 мг/кг/сут,
средняя доза – 400 мг/кг/сут,
высокая доза – 800 мг/кг/сут.
Буквы над столбцами на рис. b указывают
на статистически достоверные различия (p<0,05)
по сравнению с любой другой группой
Figure 6. Effect of chondroitin sulfate (CS) on proliferation
of colon cancer cells and normal intestinal epithelium (after [45]):
a – colorectal cancer cells (HT-29, Caco-2, HCT-116, SE480, LS-174-T cell lines)
and NCM460 normal intestinal epithelial cells were treated
with different concentrations (50, 100, 200, 400, 800, and 1000 μg/ml)
of CS for 24 h, cell viability was measured using Cell Counting Kit-8 (CCK8),
the results were expressed as the degree
of inhibition compared to untreated cells;
b – pro-inflammatory cytokine levels
were dose-dependently decreased by CS.
TNF-α – tumor necrosis factor alpha;
IL – interleukin.
Low dose was 200 mg/kg/day,
medium dose was 400 mg/kg/day,
and high dose was 800 mg/kg/day.
Letters above the bars in Figure b indicate
statistically significant differences (p<0.05)
compared to any other group
Транскриптомный и протеомный анализ ХС позволил сформулировать механизм реализации онкопротективных эффектов ХС при воздействии на культуру клеток колоректального рака (линия HT-29) (рис. 7). ХС снижает пролиферацию опухолевых клеток путем ингибирования рецепторного белка HSPG26 на клеточной мембране, активации экспрессии генов/белков в сигнальных путях PI3K-Akt, усиления экспрессии генов, связанных с апоптозом (Bad) и блокирующих клеточный цикл (P21, CDK2, CCNE1 и MCM2) [45].
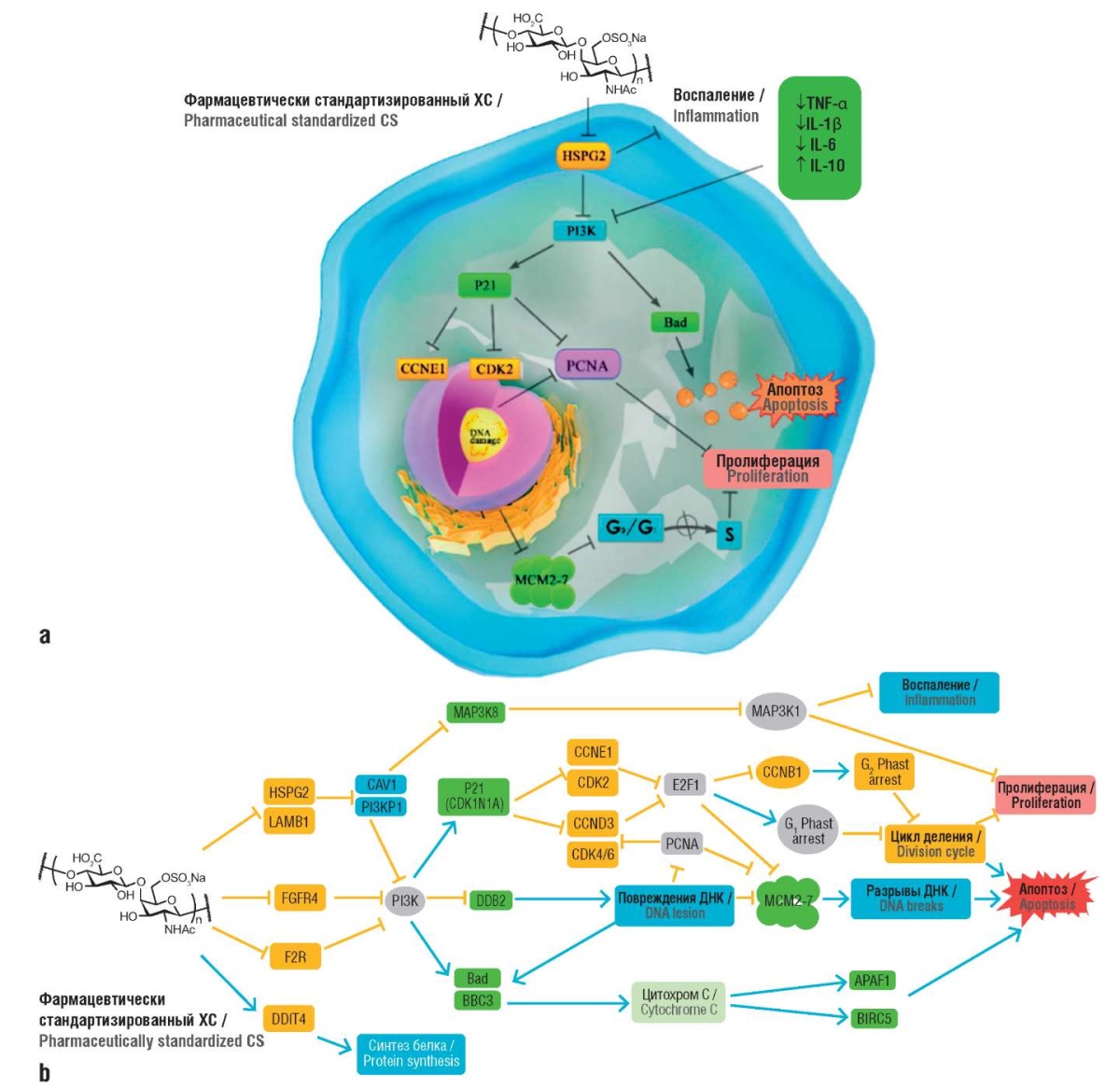
Рисунок 7. Сравнительный анализ двух наборов данных
(транскриптомный анализ опухолевых клеток HT-29
и нормофизиологических клеток эпителия кишечника NCM460)
позволил сформулировать регуляторную сеть генов,
описывающую онкопротективные эффекты
хондроитина сульфата (ХС) на клеточной модели
колоректального рака (адаптировано из [45]):
a – общая схема;
b – детализация механизма.
TNF-α (англ. tumor necrosis factor alpha) –
фактор некроза опухоли альфа;
IL (англ. interleukin) – интерлейкин;
ДНК – дезоксирибонуклеиновая кислота
Figure 7. Comparative analysis of two datasets
(transcriptome analysis of HT-29 tumor cells
and normophysiological NCM460 intestinal epithelial cells)
allowed to formulate a regulatory network of genes
describing the оncoprotective effects of chondroitin sulfate (CS)
in a cellular model of colorectal cancer (adapted from [45]):
a – general scheme;
b – detail of the mechanism.
TNF-α – tumor necrosis factor alpha;
IL – interleukin;
DNA – deoxyribonucleic acid
Онкопротективные эффекты ХС/ГС через нормализацию микробиоты ЖКТ // Оncoprotective effects of СS/GS through gastrointestinal microbiota normalization
ХС может не только эффективно останавливать рост колоректальных опухолевых клеток, пересаженных модельным животным, но и значительно изменять микробиом кишечника. Прием стандартизированного экстракта ХС хряща восстанавливал баланс кишечной микробиоты у мышей с моделью колоректального рака. Например, изменение уровней Lactobacillales, Gastranaerophilales, Ruminiclostridium 5 и Ruminiclostridium 6 привело к увеличению некоторых метаболитов (например, Phe, Tyr и Gly). ХС значительно снижал количество Phe, Pro, Ala, Tyr и Leu, присутствующих в фекалиях. Таким образом, ХС может ингибировать рост колоректального рака, модулируя микробиом кишечника и изменяя выработку определенных аминокислот (рис. 8, 9) [46].
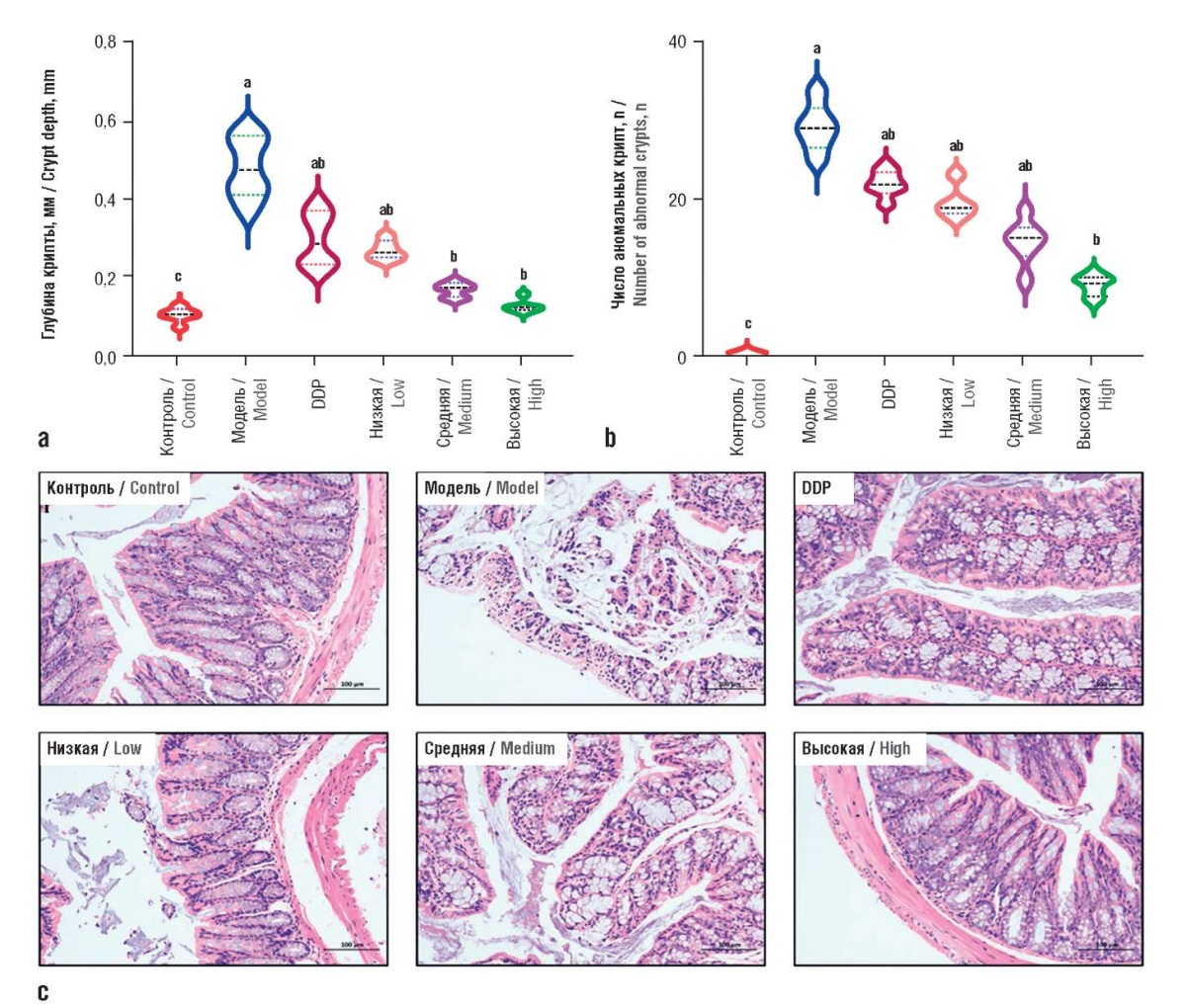
Рисунок 8. Эффекты воздействия внутрижелудочного введения
хондроитина сульфата (ХС) на модель опухоли
(аллотрансплантат клеток линии HT-29 у мышей)
(адаптировано из [46]):
a – влияние ХС на глубину крипт эпителия толстой кишки;
b – влияние ХС на количество аномальных очагов крипт;
c – типичные диаграммы окрашенных гематоксилином/эозином клеток
в колоректальных эпителиальных тканях с ХС (×100).
DDP – цисплатин.
Низкая доза – 200 мг/кг/сут,
средняя доза – 400 мг/кг/сут,
высокая доза – 800 мг/кг/сут.
Буквы на рис. a, b указывают
на статистически достоверные различия (p<0,05)
по сравнению с любой другой группой
Figure 8. Effects of intragastric administration of chondroitin sulfate (CS)
on a tumor model (HT-29 cell line allograft in mice) (adapted from [46]):
a – effect of CS on crypt depth of colorectal epithelium;
b – effect of CS on the number of abnormal crypt foci;
c – typical diagrams of hematoxylin/eosin-stained cells
in colorectal epithelial tissues with CS (×100).
DDP – cisplatin.
Low dose – 200 mg/kg/day,
medium dose – 400 mg/kg/day,
high dose – 800 mg/kg/day.
Letters in Figures a, b indicate statistically significant differences (p<0.05)
compared to any other group
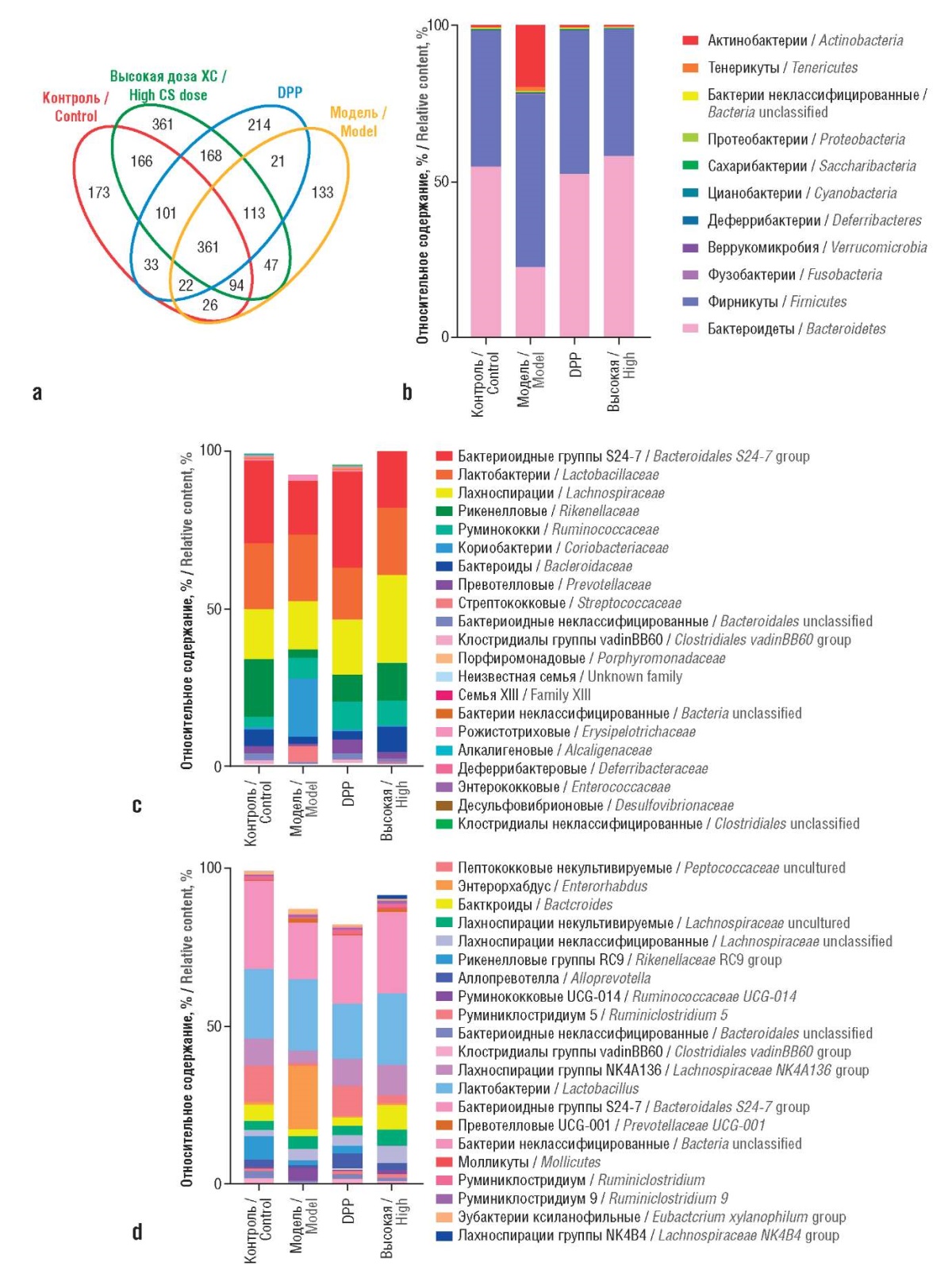
Рисунок 9. Анализ микробиома
при изучении влияния хондроитина сульфата (ХС)
на модель рака толстой кишки (адаптировано из [46]):
a – диаграмма Венна, иллюстрирующая степень перекрытия
операционных таксономических единиц;
b – cостав микробиоты на уровне типа;
c – на уровне семейства;
d – на уровне рода.
DDP – цисплатин.
Высокая доза – 800 мг/кг/сут
Figure 9. Microbiome analysis of chondroitin sulfate (CS)
research on a model of colorectal cancer (adapted from [46]):
a – Venn diagram illustrating the degree of overlap
of operational taxonomic units;
b – microbiota composition at the type level;
c – at the family level;
d – at the genus level.
DDP – cisplatin.
The high dose – 800 mg/kg/day
ХС как пребиотик также проявлял прямое онкопротективное действие в отношении клеток рака толстой кишки человека: обработанные ХС клетки HT-29 демонстрировали фрагментацию ядер с последующим апоптозом (рис. 10) [21].
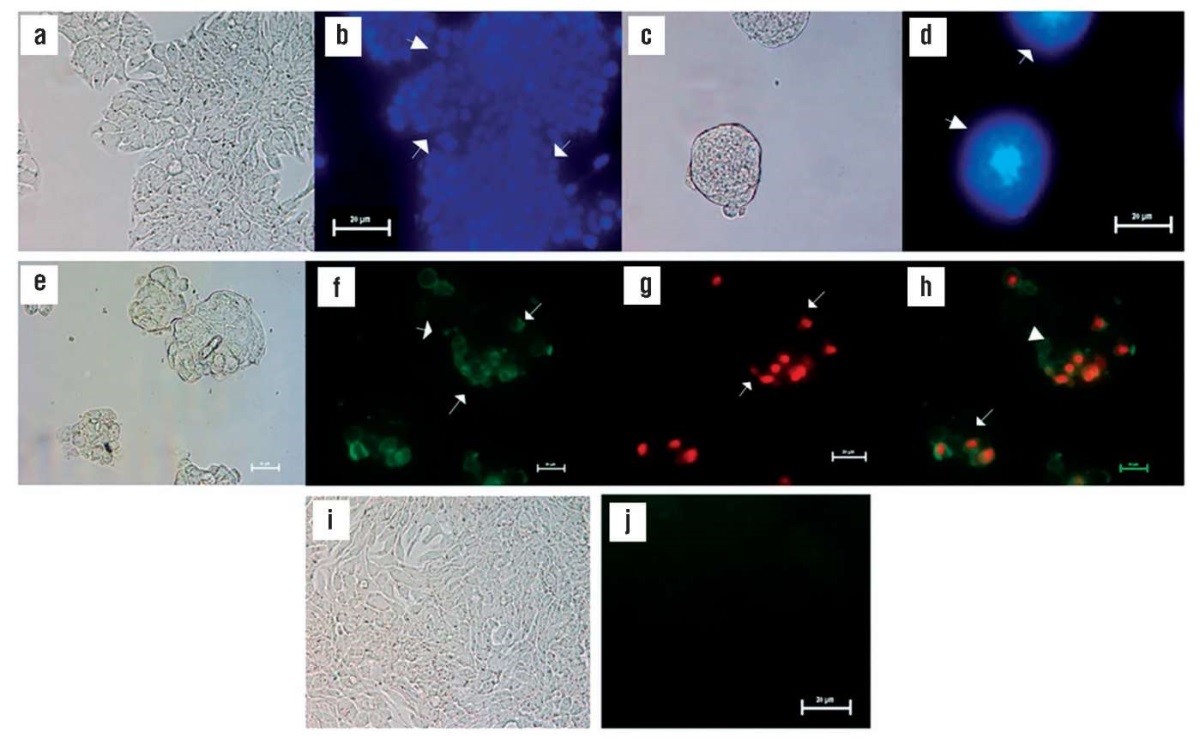
Рисунок 10. Анализ эффектов хондроитина сульфата (ХС)
на клетки HT-29 в культуре.
Окрашивание ядер красителем 4',6-диамидино-2-фенилиндол
(англ. 4′,6-diamidino-2-phenylindole, DAPI) с разрешением ×40
(по данным [21]):
a – контрольные необработанные клетки;
b – контрольные необработанные клетки,
демонстрирующие слабую флуоресценцию
и меньшую проницаемость для DAPI;
c – обработанные 0,5 мг/мл ХС клетки под микроскопом
со светлым полем, показывающим разрушенную мембрану;
d – обработанные клетки, демонстрирующие
высокую проницаемость с помощью DAPI и ядерной конденсации,
анализ апоптоза/некроза клеток HT-29
с помощью окрашивания аннексином-V-FITC
и пропидиум йодидом с разрешением ×40;
e, f, g, h – обработанные 0,5 мг/мл ХС клетки HT-29;
i, j – необработанные клетки HT-29
Figure 10. Analysis of the effects of chondroitin sulfate (CS)
on HT-29 cells in culture.
Nuclei staining with 4’,6-diamidino-2-phenylindole (DAPI)
dye at ×40 resolution (after [21]):
a – control untreated cells;
b – control untreated cells showing weak fluorescence
and lower permeability to DAPI;
c – 0.5 mg/ml CS-treated cells under a light field microscope
showing disrupted membrane;
d – treated cells showing high permeability by DAPI
and nuclear condensation, apoptosis/necrosis analysis of HT-29 cells
by annexin-V-FITC and propidium iodide staining at ×40 resolution;
e, f, g, h – 0.5 mg/ml CS-treated HT-29 cells;
i, j – untreated HT-29 cells
В результате проведения хемомикробиомного анализа молекулы ГС были оценены профили воздействия ГС, пребиотиков (лактозы, фруктозы) и ряда нестероидных противовоспалительных препаратов на микробиом человека (38 бактерий-комменсалов) и на выборку 120 болезнетворных бактерий. В среднем по выборке нормомикробиоты профиль действия ГС на микробиом был практически идентичен профилю действия лактозы (площадь под кривой (англ. area under curve, AUC) 0,23±0,18). Анализ минимальных ингибирующих концентраций (англ. minimum inhibitory concentrations, MIC) показал, что ГС в меньшей степени поддерживал рост патогенной флоры (MIC 16±1,5 мкг/мл), чем диклофенак (MIC 35±1,4 мкг/мл) и ацетилсалициловая кислота (MIC 23±2,2 мкг/мл). Ингибирование болезнетворных бактерий микробиома молекулой ГС способствует снижению воспаления в эпителии ЖКТ и, соответственно, снижению опухолевых рисков [47].
Клинические исследования эффектов ХС/ГС по отношению к различным типам опухолей // Clinical studies of СS/GS effects in relation to various types of tumors
Проводившееся в течение 10 лет эпидемиологическое исследование по оценке опухолевых рисков (англ. Cancer Prevention Study II Nutrition Cohort, n = 113 067, 1440 случаев) продемонстрировало, что потребление ГС на регулярной основе уменьшает риск рака толстого кишечника на 17% (отношение рисков (ОР) 0,83; 95% ДИ 0,71–0,97) [48].
Крупномасштабное наблюдательное исследование (n = 439 393, средний возраст 56 лет, 53% женщин) с последующим наблюдением в течение 11 лет позволило выявить 1971 случай рака легкого (0,45%). Использование глюкозамина было достоверно связано со снижением риска рака легких на 16% (ОШ 0,84; 95% ДИ 0,75–0,92; р<0,001) и смертности от рака легких на 12% (ОШ 0,88; 95% ДИ 0,81–0,96; р=0,002). Более сильная связь между использованием глюкозамина и снижением риска рака легких наблюдалась при семейном анамнезе рака легких [49].
Исследование когорты медперсонала (англ. Nurses' Health Study, n = 65 000) в течение 8 лет позволило установить 672 случая рака толстого кишечника. Регулярное потребление ГС ассоциировано со снижением риска заболевания на 21% (ОР 0,79; 95% ДИ 0,63–1,00), а регулярно употребление ХС – со снижением риска на 23% (ОР 0,77; 95% ДИ 0,59–1,01) [50].
Крупномасштабное проспективное когортное исследование (n = 453 645) показало связь между употреблением ГС и более низкой смертностью от различных видов рака. Участники в возрасте 38–73 лет, у которых не был диагностирован рак при вхождении в исследование, наблюдались с 2010 по 2021 гг. Из всех участников 88 224 человек (19,4%) сообщили о регулярном употреблении глюкозамина при вхождении в исследование. За 12-летний период наблюдения зарегистрировано 9366 смертей от рака. Установлен достоверный эффект глюкозамина на снижение смертности на 5% для всех видов рака (ОШ 0,95; 95% ДИ 0,90–1,00; р<0,05), особенно для рака почки (на 32%; ОШ 0,68; 95% ДИ 0,49–0,95; p<0,05), рака легкого (на 16%; ОШ 0,84; 95% ДИ 0,74–0,95; p<0,05) и колоректального рака (на 24%; ОШ 0,76; 95% ДИ 0,59–0,98; p<0,05). Анализ подгрупп показал, что употребление ГС коррелировало с более низкой общей смертностью от рака, особенно среди участников старше 60 лет, мужчин, курильщиков, без высокого уровня холестерина и без ожирения (рис. 11) [51].
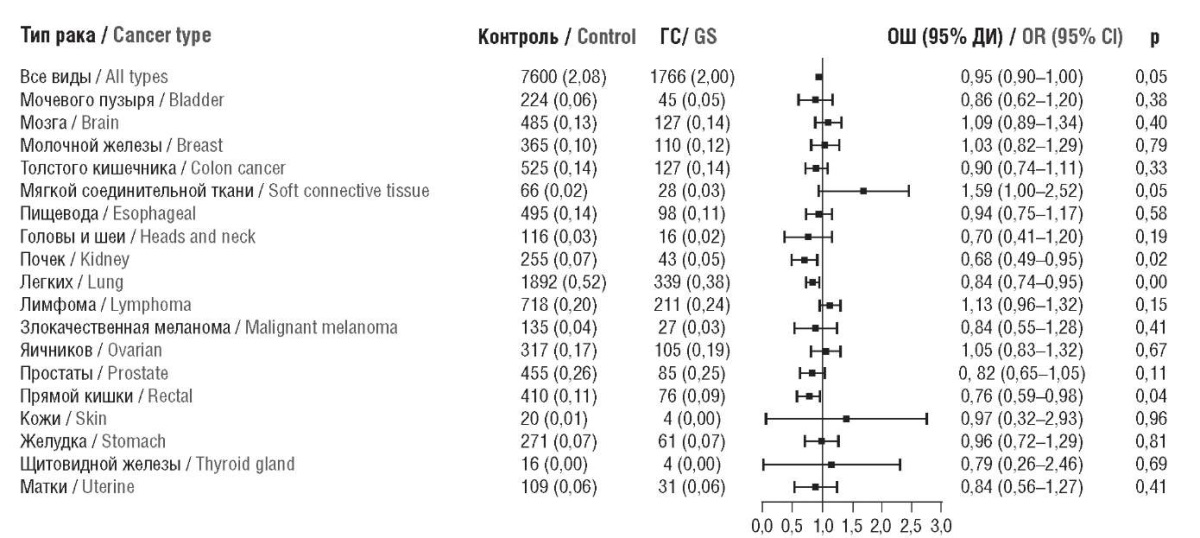
Рисунок 11. Результаты серии метаанализов эффектов
регулярного приема глюкозамина сульфата (ГС)
и смертности от различных видов рака.
Уточненная модель с поправками на возраст, пол,
этническую принадлежность, доход семьи, ожирение,
физическую активность, курение в настоящее время,
потребление алкоголя, прием витаминно-минеральных комплексов,
потребление фруктов, овощей, мяса, употребление аспирина,
нестероидных противовоспалительных препаратов
и хондроитина сульфата (по данным [51]).
ОШ – отношение шансов;
ДИ – доверительный интервал
Figure 11. Results of a series of meta-analyses of the effects
of regular glucosamine sulfate (GS) intake
and mortality from various cancers.
Refined model with adjustments for age, gender, ethnicity,
family income, obesity, physical activity, current smoking,
alcohol consumption, intake of vitamin and mineral complexes,
consumption of fruits, vegetables, meat, use of aspirin,
nonsteroidal anti-inflammatory drugs
and chondroitin sulfate (after [51]).
OR – odds ratio;
CI – confidence interval
О возможных онкопротективных эффектах экстрактов неденатурированного коллагена II типа / Possible оncoprotective effects of undenatured type II collagen extracts
Эпитопы нативного коллагена в структуре НК-II способствуют уменьшению аутоиммунных реакций. Взаимодействуя с дискоидиновыми рецепторами, НК-II ускоряет реконструкцию соединительной ткани хряща и тормозит провоспалительные эффекты эндогенных коллагенов. Экспериментальные и клинические исследования подтверждают эффективность стандартизированных субстанций НК-II для ускорения регенерации хряща и снижения боли при остеоартрите или при субклинической дисфункции суставов [11]. НК-II отличается крайне низкой токсичностью (LD50 порядка 5000 мг/кг при приеме per os) и полным отсутствием мутагенности в тестах на бактериях S. typhimurium и на клетках лимфомы мышей (линия L5178Y) [52].
Более того, имеющиеся данные позволяют высказать предположение, что НК-II может проявлять онкопротективные свойства. Одним из основных молекулярно-физиологических механизмов действия НК-II является модуляция процессов воспаления (в т.ч. активности провоспалительных хемокинов CCL2/7, регулировки дифференцировки Т-клеток, тучных клеток, дегрануляции эозинофилов и адгезии лейкоцитов). НК-II также способствует снижению активности провоспалительных простагландинов и лейкотриенов [11].
Кроме того, НК-II может специфически связываться с рецепторами дискоидиновых доменов (англ. discoidin domain receptor) DDR1 и DDR2, что приводит к устойчивой активации этих рецепторов, регулирующих адгезию, рост, миграцию и деление клеток. DDR1 опосредует индуцированную эндогенным коллагеном воспалительную активацию микроглии, увеличивая экспрессию ЦОГ-2, матриксной металлопротеиназы-9, рецептора ФНО-α и NF-κB. Нарушения регуляции DDR в организме человека ассоциированы с нарушениями онкопротективного иммунитета [53].
Описанные выше процессы так или иначе вовлечены в патофизиологию опухолевых заболеваний. Торможение этих процессов посредством приема НК-II per os соответствует снижению онкориска. В частности, прием НК-II per os снижает уровни провоспалительных цитокинов ИЛ-1β, ИЛ-6, ФНО-α, С-реактивного белка в сыворотке крови [54]. Очевидно, что комбинирование НК-II с такими онкопротекторами, как ХС и ГС, может способствовать усилению их онкопротективных свойств.
ЗАКЛЮЧЕНИЕ / CONCLUSION
Повышение эффективности профилактики и безопасности лечения опухолевых заболеваний неразрывно связано с использованием достижений клинической нутрициологии. Нутрицевтики, проявляющие онкопротективные эффекты, относятся ко многим группам веществ: витамины, полифенолы, биофлавоноиды, микроэлементы и др. Как показано в настоящей статье, ХС и ГС проявляют отчетливое онкопротективное действие при разных видах опухолей. Чаще всего препараты на основе фармацевтически стандартизированных ХС и ГС назначаются при заболеваниях суставов и принимаются пациентами длительно (в течение многих лет).
Долговременная нутрицевтическая поддержка посредством ХС/ГС способствует снижению воспалительных процессов в опухоли, активации противоопухолевого иммунитета, апоптозу и аутофагии опухолевых клеток, инкапсулированию опухолей и ослаблению процесса метастазирования. Крупномасштабные клинико-эпидемиологические исследования и метаанализы показали, что регулярное употребление ХС/ГС снижает риск развития рака толстой кишки и рака легких, а также смертности от всех видов рака (особенно от рака почки, рака легкого и рака толстой кишки). Применение ХС и ГС совместно со стандартизированными фармацевтическими формами НК-II может усиливать их противовоспалительный и иммуномодулирующий эффекты, что может способствовать улучшению онкопротективных свойств этих веществ.
1. JAK (англ. janus kinase) – янус-киназа; STAT (англ. signal transducer and activator of transcription) – преобразователь сигнала и активатор транскрипции.
2. TRAIL (англ. tumor necrosis factor related apoptosis inducing ligand) – лиганд, индуцирующий апоптоз, связанный с фактором некроза опухоли.
3. BiP (англ. binding immunoglobulin protein) – связывающий белок иммуноглобулин; IRE1 (англ. inositol-requiring enzyme 1) – фермент, требующий инозитола 1; eIF2А (англ. eukaryotic translation initiation factor 2A) – эукариотический фактор инициации трансляции.
4. PDPK1 (англ. 3-phosphoinositide dependent protein kinase 1) – 3-фосфоинозитидзависимая протеинкиназа 1; IKBKE (англ. inhibitor of nuclear factor kappa B kinase subunit epsilon) – ингибитор субъединицы ядерного фактора каппа В киназы эпсилон.
5. CHEK1 (англ. checkpoint kinase 1) – киназа 1 контрольной точки клеточного цикла; PRKCD (англ. protein kinase С delta) – протеинкиназа С дельта.
6. HSPG2 (англ. heparan sulfate proteoglycan 2) – гепарансульфат протеогликан 2.
Список литературы
1. Mellai M., Casalone C., Corona C., et al. Chondroitin sulphate proteoglycans in the tumour microenvironment. Adv Exp Med Biol. 2020; 1272: 73–92. https://doi.org/10.1007/978-3-030-48457-6_5.
2. Торшин И.Ю., Лила А.М., Загородний Н.В. и др. Разработка верифицированной шкалы риска остеоартрита на основе кросс-секционного исследования клинико-анамнестических параметров и фармакологического анамнеза пациентов. ФАРМАКОЭКОНОМИКА. Современная фармакоэкономика и фармакоэпидемиология. 2023; 16 (1): 70–9. https://doi.org/10.17749/2070-4909/farmakoekonomika.2023.158.
3. Громова О.А., Торшин И.Ю., Лила А.М., Громов А.Н. Молекулярные механизмы глюкозамина сульфата при лечении дегенеративно-дистрофических заболеваний суставов и позвоночника: результаты протеомного анализа. Неврология, нейропсихиатрия, психосоматика. 2018; 10 (2): 38–44. https://doi.org/10.14412/2074-2711-2018-2-38-44.
4. Quastel J., Cantero A. Inhibition of tumour growth by D-glucosamine. Nature. 1953; 171 (4345): 252–4. https://doi.org/10.1038/171252a0.
5. Sorkin E., Fjelde A. The effect of D-glucosamine and related products on human cancer cells in tissue culture. G Ital Chemioter. 1956; 3 (3–4): 355–61.
6. Luhrs W. A contribution to the question glucosamine on the growth retardation of tumours. Acta Unio Int Contra Cancrum. 1957; 13 (3): 480–1.
7. Громова О.А., Торшин И.Ю., Лила А.М. и др. Дифференциальный хемореактомный анализ глюкозамина сульфата и нестероидных противовоспалительных препаратов: перспективные синергичные комбинации. Современная ревматология. 2018; 12 (2): 36–43. https://doi.org/10.14412/1996-7012-2018-2-36-43.
8. Торшин И.Ю., Громова О.А., Лила А.М. и др. Результаты постгеномного анализа молекулы глюкозамина сульфата указывают на перспективы лечения коморбидных заболеваний. Современная ревматология. 2018; 12 (4): 129–36. https://doi.org/10.14412/1996-7012-2018-4-129-136.
9. Kantor E.D., O'Connell K., Liang P.S., et al. Glucosamine use and risk of colorectal cancer: results from UK biobank. Cancer Epidemiol Biomarkers Prev. 2022; 31 (3): 647–53. https://doi.org/10.1158/1055-9965.EPI-21-1171.
10. Liu B., Yang W., Zhang K. Role of glucosamine and chondroitin in the prevention of cancer: a meta-analysis. Nutr Cancer. 2023; 75 (3): 785–94. https://doi.org/10.1080/01635581.2023.2173258.
11. Громова О.А., Торшин И.Ю., Лила А.М., Шавловская О.А. О перспективах использования неденатурированного коллагена II типа в терапии остеоартрита и других заболеваний суставов. Современная ревматология. 2022; 16 (4): 111–6. https://doi.org/10.14412/1996-7012-2022-4-111-116.
12. Torshin I.Yu., Rudakov K.V. Combinatorial analysis of the solvability properties of the problems of recognition and completeness of algorithmic models. Part 2: Metric approach within the framework of the theory of classification of feature values. Pattern Recognit Imag Anal. 2017; 27 (2): 184–99. https://doi.org/10.1134/S1054661817020110.
13. Рудаков К.В., Торшин И.Ю. Об отборе информативных значений признаков на базе критериев разрешимости в задаче распознавания вторичной структуры белка. Доклады Академии наук. 2011; 441 (1): 24–8.
14. Torshin I.Y., Rudakov K.V. Combinatorial analysis of the solvability properties of the problems of recognition and completeness of algorithmic models. Part 1: Factorization approach. Pattern Recog Image Anal. 2017; 27 (1): 16–28. https://doi.org/10.1134/S1054661817010151.
15. Торшин И.Ю., Громова О.А. 25 мгновений молекулярной фармакологии. О развитии клинико-фармакологического мышления. Иваново: А-Гриф; 2012: 684 с.
16. Wu R., Shang N., Gui M., et al. Sturgeon (acipenser)-derived chondroitin sulfate suppresses human colon cancer HCT-116 both in vitro and in vivo by inhibiting proliferation and inducing apoptosis. Nutrients. 2020; 12 (4): 1130. https://doi.org/10.3390/nu12041130.
17. Wang J., Zhao W., Chen H., et al. Anti-tumor study of chondroitin sulfate-methotrexate nanogels. Nanoscale Res Lett. 2017; 12 (1): 572. https://doi.org/10.1186/s11671-017-2324-1.
18. Shi X., Yang X., Liu M., et al. Chondroitin sulfate-based nanoparticles for enhanced chemo-photodynamic therapy overcoming multidrug resistance and lung metastasis of breast cancer. Carbohydr Polym. 2021; 254: 117459. https://doi.org/10.1016/j.carbpol.2020.117459.
19. Rivlin M., Navon G. Glucosamine and N-acetyl glucosamine as new CEST MRI agents for molecular imaging of tumors. Sci Rep. 2016; 6: 32648. https://doi.org/10.1038/srep32648.
20. Rivlin M., Anaby D., Nissan N., et al. Breast cancer imaging with glucosamine CEST (chemical exchange saturation transfer) MRI: first human experience. Eur Radiol. 2022; 32 (11): 7365–73. https://doi.org/10.1007/s00330-022-08772-w.
21. Rani A., Baruah R., Goyal A. Prebiotic chondroitin sulfate disaccharide isolated from chicken keel bone exhibiting anticancer potential against human colon cancer cells. Nutr Cancer. 2019; 71 (5): 825–39. https://doi.org/10.1080/01635581.2018.1521446.
22. Ferro M., Giuberti G., Zappavigna S., et al. Chondroitin sulphate enhances the antitumor activity of gemcitabine and mitomycin-C in bladder cancer cells with different mechanisms. Oncol Rep. 2012; 27 (2): 409–15. https://doi.org/10.3892/or.2011.1526.
23. Masuda S., Azuma K., Kurozumi S., et al. Anti-tumor properties of orally administered glucosamine and N-acetyl-D-glucosamine oligomers in a mouse model. Carbohydr Polym. 2014; 111: 783–7. https://doi.org/10.1016/j.carbpol.2014.04.102.
24. Wu R., Li P., Wang Y., et al. Structural analysis and anti-cancer activity of low-molecular-weight chondroitin sulfate from hybrid sturgeon cartilage. Carbohydr Polym. 2022; 275: 118700. https://doi.org/10.1016/j.carbpol.2021.118700.
25. Chou W.Y., Chuang K.H., Sun D., et al. Inhibition of PKC-induced COX-2 and IL-8 expression in human breast cancer cells by glucosamine. J Cell Physiol. 2015; 230 (9): 2240–51. https://doi.org/10.1002/jcp.24955.
26. Tsai C.Y., Lee T.S., Kou Y.R., Wu Y.L. Glucosamine inhibits IL-1betamediated IL-8 production in prostate cancer cells by MAPK attenuation. J Cell Biochem. 2009; 108 (2): 489–98. https://doi.org/10.1002/jcb.22278.
27. Chesnokov V., Gong B., Sun C., Itakura K. Anti-cancer activity of glucosamine through inhibition of N-linked glycosylation. Cancer Cell Int. 2014; 14: 45. https://doi.org/10.1186/1475-2867-14-45.
28. Hosea R., Hardiany N.S., Ohneda O., Wanandi S.I. Glucosamine decreases the stemness of human ALDH(+) breast cancer stem cells by inactivating STAT3. Oncol Lett. 2018; 16 (4): 4737–44. https://doi.org/10.3892/ol.2018.9222.
29. Yu Z., Ju Y., Liu H. Antilung cancer effect of glucosamine by suppressing the phosphorylation of FOXO. Mol Med Rep. 2017; 16 (3): 3395–400. https://doi.org/10.3892/mmr.2017.6976.
30. Friedman S.J., Kimball T., Trotter C.D., Skehan P.J. The inhibition of thymidine kinase in glial tumor cells by an amino sugar, D-glucosamine. Cancer Res. 1977; 37 (4): 1068–74.
31. Cocchiola R., Lopreiato M., Guazzo R., et al. The induction of Maspin expression by a glucosamine-derivative has an antiproliferative activity in prostate cancer cell lines. Chem Biol Interact. 2019; 300: 63–72. https://doi.org/10.1016/j.cbi.2019.01.014.
32. Liu B.Q., Meng X., Li C., et al. Glucosamine induces cell death via proteasome inhibition in human ALVA41 prostate cancer cell. Exp Mol Med. 2011; 43 (9): 487–93. https://doi.org/10.3858/emm.2011.43.9.055.
33. Guo J., Hu J., Cao R., et al. Androgen receptor is inactivated and degraded in bladder cancer cells by phenyl glucosamine via miR-449a restoration. Med Sci Monit. 2018; 24: 2294–301. https://doi.org/10.12659/MSM.906836.
34. Oh H.J., Lee J.S., Song D.K., et al. D-glucosamine inhibits proliferation of human cancer cells through inhibition of p70S6K. Biochem Biophys Res Commun. 2007; 360 (4): 840–5. https://doi.org/10.1016/j.bbrc.2007.06.137.
35. Liang Y., Xu W., Liu S., et al. N-acetyl-glucosamine sensitizes nonsmall cell lung cancer cells to TRAIL-induced apoptosis by activating death receptor 5. Cell Physiol Biochem. 2018; 45 (5): 2054–70. https://doi.org/10.1159/000488042.
36. Wang L.S., Chen S.J., Zhang J.F., et al. Anti-proliferative potential of glucosamine in renal cancer cells via inducing cell cycle arrest at G0/G1 phase. BMC Urol. 2017; 17 (1): 38. https://doi.org/10.1186/s12894-017-0221-7.
37. Zhou Y., Li X., Morita Y., et al. Identification of the effects of chondroitin sulfate on inhibiting CDKs in colorectal cancer based on bioinformatic analysis and experimental validation. Front Oncol. 2021; 11: 705939. https://doi.org/10.3389/fonc.2021.705939.
38. Hwang M.S., Baek W.K. Glucosamine induces autophagic cell death through the stimulation of ER stress in human glioma cancer cells. Biochem Biophys Res Commun. 2010; 399 (1): 111–6. https://doi.org/10.1016/j.bbrc.2010.07.050.
39. Liu X., Liu Y., Hao J., et al. In vivo anti-cancer mechanism of lowmolecular-weight fucosylated chondroitin sulfate (LFCS) from sea cucumber Cucumaria frondosa. Molecules. 2016; 21 (5): 625. https://doi.org/10.3390/molecules21050625.
40. Prinz R.D., Willis C.M., Viloria-Petit A., Kluppel M. Elimination of breast tumor-associated chondroitin sulfate promotes metastasis. Genet Mol Res. 2011; 10 (4): 3901–13. https://doi.org/10.4238/2011.December.8.9.
41. Silver D.J., Siebzehnrubl F.A., Schildts M.J., et al. Chondroitin sulfate proteoglycans potently inhibit invasion and serve as a central organizer of the brain tumor microenvironment. J Neurosci. 2013; 33 (39): 15603–17. https://doi.org/10.1523/JNEUROSCI.3004-12.2013.
42. Pudelko A., Wisowski G., Olczyk K., Kozma E.M. The dual role of the glycosaminoglycan chondroitin-6-sulfate in the development, progression and metastasis of cancer. FEBS J. 2019; 286 (10): 1815–37. https://doi.org/10.1111/febs.14748.
43. Willis C.M., Kluppel M. Chondroitin sulfate-E is a negative regulator of a pro-tumorigenic Wnt/beta-catenin-Collagen 1 axis in breast cancer cells. PLoS One. 2014; 9 (8): e103966. https://doi.org/10.1371/journal.pone.0103966.
44. Торшин И.Ю., Громова О.А., Лила А.М. и др. Таргетное действие глюкозамина сульфата при сочетании остеоартрита и опухолевой патологии. Русский медицинский журнал. 2019; 6: 23–30.
45. Wu R., Shen Q., Li G., et al. The regulatory network of sturgeon chondroitin sulfate on colorectal cancer inhibition by transcriptomic and proteomic analysis. Int J Mol Sci. 2021; 22 (17): 9395. https://doi.org/10.3390/ijms22179395.
46. Wu R., Shen Q., Li P., Shang N. Sturgeon chondroitin sulfate restores the balance of gut microbiota in colorectal cancer bearing mice. Int J Mol Sci. 2022; 23 (7): 3723. https://doi.org/10.3390/ijms23073723.
47. Громова О.А., Торшин И.Ю., Наумов А.В., Максимов В.А. Хемомикробиомный анализ глюкозамина сульфата, пребиотиков и нестероидных противовоспалительных препаратов. ФАРМАКОЭКОНОМИКА. Современная фармакоэкономика и фармакоэпидемиология. 2020; 13 (3): 270–82. https://doi.org/10.17749/2070-4909/farmakoekonomika.2020.049.
48. Kantor E.D., Newton C.C., Giovannucci E.L., et al. Glucosamine use and risk of colorectal cancer: results from the Cancer Prevention Study II Nutrition Cohort. Cancer Causes Control. 2018; 29 (3): 389–97. https://doi.org/10.1007/s10552-018-1003-6.
49. Li G., Zhang X., Liu Y., et al. Relationship between glucosamine use and the risk of lung cancer: data from a nationwide prospective cohort study. Eur Respir J. 2022; 59 (3): 2101399. https://doi.org/10.1183/13993003.01399-2021.
50. Kantor E.D., Zhang X., Wu K., et al. Use of glucosamine and chondroitin supplements in relation to risk of colorectal cancer: results from the Nurses' Health Study and Health Professionals follow-up study. Int J Cancer. 2016; 139 (9): 1949–57. https://doi.org/10.1002/ijc.30250.
51. Zhou J., Wu Z., Lin Z., et al. Association between glucosamine use and cancer mortality: a large prospective cohort study. Front Nutr. 2022; 9: 947818. https://doi.org/10.3389/fnut.2022.947818.
52. Yoshinari O., Marone P.A., Moriyama H., et al. Safety and toxicological evaluation of a novel, water-soluble undenatured type II collagen. Toxicol Mech Methods. 2013; 23 (7): 491–9. https://doi.org/10.3109/15376516.2013.781255.
53. Seo M.C., Kim S., Kim S.H., et al. Discoidin domain receptor 1 mediates collagen-induced inflammatory activation of microglia in culture. J Neurosci Res. 2008; 86 (5): 1087–95. https://doi.org/10.1002/jnr.21552.
54. Sahin K., Kucuk O., Orhan C., et al. Niacinamide and undenatured type II collagen modulates the inflammatory response in rats with monoiodoacetate-induced osteoarthritis. Sci Rep. 2021; 11 (1): 14724. https://doi.org/10.1038/s41598-021-94142-3
Об авторах
И. Ю. ТоршинРоссия
Торшин Иван Юрьевич – к.ф-м.н., к.х.н., ведущий научный сотрудник
WoS ResearcherID: C-7683-2018; Scopus Author ID: 7003300274
ул. Вавилова, д. 44, корп. 2, Москва 119333, Россия
А. Г. Чучалин
Россия
Чучалин Александр Григорьевич – д.м.н., профессор, академик РАН, заведующий кафедрой госпитальной терапии педиатрического факультета
ул. Островитянова, д. 1, Москва 117997, Россия
О. А. Громова
Россия
Громова Ольга Алексеевна – д.м.н., профессор, ведущий научный сотрудник
WoS ResearcherID: J-4946-2017; Scopus Author ID: 7003589812
ул. Вавилова, д. 44, корп. 2, Москва 119333, Россия
Рецензия
Для цитирования:
Торшин И.Ю., Чучалин А.Г., Громова О.А. Об онкопротективных эффектах хондропротекторов: глюкозамина, хондроитина сульфата и неденатурированного коллагена II типа. ФАРМАКОЭКОНОМИКА. Современная фармакоэкономика и фармакоэпидемиология. 2023;16(4):681-699. https://doi.org/10.17749/2070-4909/farmakoekonomika.2023.182
For citation:
Torshin I.Yu., Chuchalin A.G., Gromova O.A. Oncoprotective effects of chondroprotectors: glucosamine, chondroitin sulfate and undenatured type II collagen. FARMAKOEKONOMIKA. Modern Pharmacoeconomics and Pharmacoepidemiology. 2023;16(4):681-699. (In Russ.) https://doi.org/10.17749/2070-4909/farmakoekonomika.2023.182

Контент доступен под лицензией Creative Commons Attribution-NonCommercial-ShareAlike 4.0 International License.






































