Перейти к:
Роль ферритина в оценке заболеваний печени
https://doi.org/10.17749/2070-4909/farmakoekonomika.2023.200
Аннотация
Актуальность. Ферритин является важным интегральным и диагностическим маркером заболеваний печени. У 1/3 пациентов с неалкогольной жировой болезнью печени (НАЖБП) выявлены проявления гиперферритинемии. Повышение уровня ферритина свидетельствует о тяжести течения и влияет на прогноз заболевания.
Цель: определение частоты и характера проявлений гиперферритинемии у больных НАЖБП и оценка эффективности ее коррекции гидролизатом плаценты человека.
Материал и методы. Обследованы 158 больных НАЖБП возрасте от 20 до 63 лет (92 мужчины и 66 женщин). Достоверных различий по возрасту между мужчинами и женщинами не выявлено. Группа контроля составила 20 практически здоровых лиц. Проведен анализ молекулярных механизмов действия пептидных компонентов гидролизата плаценты человека (препарат Лаеннек®) на патофизиологические процессы нарушения содержания ферритина в сыворотке крови, показатели обмена железа, проявления воспаления.
Результаты. В составе препарата Лаеннек® идентифицированы 19 пептидов, потенциально важных для регулировки гомеостаза железа. Регулируя уровни гепцидина (основного гормона гомеостаза железа), снижая синтез ферритина, а также проявляя противовоспалительные и иммуномодулирующие эффекты, эти пептиды способствуют устранению нарушений обмена железа. Показана эффективность применения препарата у больных НАЖБП с гиперферритинемией в виде монотерапии.
Заключение. Установлено, что Лаеннек® является одним из препаратов, способствующих уменьшению проявлений гиперферритинемии, нарушений обмена железа, системного воспалительного процесса при НАЖБП.
Ключевые слова
Для цитирования:
Радченко В.Г., Гриневич В.Б., Иванюк Е.С., Лазебник Л.Б. Роль ферритина в оценке заболеваний печени. ФАРМАКОЭКОНОМИКА. Современная фармакоэкономика и фармакоэпидемиология. 2023;16(3):432-446. https://doi.org/10.17749/2070-4909/farmakoekonomika.2023.200
For citation:
Radchenko V.G., Grinevich V.B., Ivanyuk E.S., Lazebnik L.B. The role of ferritin in liver disease assessment. FARMAKOEKONOMIKA. Modern Pharmacoeconomics and Pharmacoepidemiology. 2023;16(3):432-446. (In Russ.) https://doi.org/10.17749/2070-4909/farmakoekonomika.2023.200
ВВЕДЕНИЕ / INTRODUCTION
Ферритин – сложный белковый комплекс, выполняющий у человека роль основного внутриклеточного депо железа и состоящий из белка апоферритина и атома трехвалентного железа в составе фосфатного гидроксида. Его биологическая функция заключается в депонировании железа, токсичного для организма, в растворимой, нетоксичной и физиологически доступной форме. Ферритин синтезируется клетками печени, селезенки, костного мозга, сердечной мышцы, легких, почек, щитовидной железы, плаценты, тонкого кишечника, поджелудочной железы, а также лейкоцитами [1]. Агрегированный ферритин превращается в токсичную форму железа – гемосидерин [2].
Молекула ферритина состоит из двух компонентов: белковой «раковины» (апоферритина) и кристаллической «сердцевины» в виде коллоидного гидроксида железа. Белковая оболочка ферритина (апоферритин) состоит из 24 субъединиц двух видов: Н (англ. heavy) и L (англ. light). Разнообразие количественных сочетаний Н- и L-субъединиц создает большую гетерогенность изоферритинов. Вследствие этого каждый орган имеет свою композицию Н- и L-субъединиц, т.е. «свой изоферритин» [3].
Помимо железа синтез ферритина регулируется цитокинами на различных уровнях (транскрипции, посттранскрипции и трансляции), окислительным стрессом, гормонами1. Ферритин – косвенный маркер общего запаса железа в организме, его низкий уровень считается одним из первых лабораторных признаков дефицита этого микроэлемента [1][4][5]. При ряде заболеваний увеличение содержания ферритина в плазме крови считается фактором неблагоприятного прогноза.
Наряду с С-реактивным белком (СРБ) ферритин является острофазовым белком [6]. Его концентрация повышается в ответ на воспалительную реакцию. Однако все больше современных исследовательских работ показывают, что ферритин не просто отражает реакцию острой фазы, а играет решающую роль в воспалении, оказывая иммуносупрессивное действие. Обнаружены и другие физиологические функции ферритина, не связанные непосредственно с обменом железа. Оказалось, что его Н-изоформы могут играть роль супрессоров в пролиферации клеток крови. Они ингибируют Т-розеткообразование, миграцию лимфоцитов, бласттрансформацию лимфоцитов, стимулированную фитогемагглютинином и конканавалином А. Предполагают, что все вышеперечисленные эффекты реализуются через поверхностные клеточные рецепторы лимфоцитов, направленные к ферритину [7]. Ферритин обладает антиоксидантными свойствами. Он ингибирует цитолиз р-клеток, обусловленный кислородными радикалами, выполняя физиологическую защитную роль. В последние годы много работ посвящено исследованию сывороточного ферритина (СФ) при многих заболеваниях [8].
Гиперферритинемия – это повышение концентрации ферритина в сыворотке крови более 250 мкг/л у мужчин и более 120 мкг/л у женщин. Ее причинами могут выступать перегрузка железом, воспалительные процессы инфекционного и неинфекционного происхождения, злокачественные новообразования и т.д. Чрезмерный синтез и/или клеточная секреция ферритина возникают под влиянием различных стимулов (цитокины, оксидативный стресс, гипоксия, онкогены и факторы роста) [4][9–11]. Печень принимает участие во всех метаболических процессах, в т.ч. и в обмене ферритина. Причину возрастания уровня СФ при патологии печени (рак, гепатит, цирроз) связывают с процессом его освобождения из гепатоцитов при их деструкции. С другой стороны, синтез ферритина стимулируется рядом других факторов. Являясь острофазовым белком, он подвержен воздействию провоспалительных цитокинов, которые способны усиливать его продукцию при воспалительных реакциях.
В настоящее время в качестве одного из кандидатов на роль фактора патогенеза неалкогольной жировой болезни печени (НАЖБП) рассматривается перегрузка железом [12][13]. В 1997 г. Y. Deugnier et al. определили разновидность перегрузки железом при НАЖБП, характеризующейся гиперферритинемией, нормальной или слегка повышенной степенью насыщения трансферрина железом и повышением содержания железа в печеночной ткани, как синдром дисметаболической перегрузки железом (англ. dysmetabolic iron overload syndrome, DIOS) [14]. В то же время роль ферритина в развитии и прогрессировании заболеваний печени во многом неизвестна. В литературе имеется недостаточно данных об эффективной терапии по коррекции уровня ферритина. Одним из препаратов, снижающих концентрацию СФ, является гидролизат плаценты человека (ГПЧ) [15], однако его эффективность у больных НАЖБП не изучена в полной мере.
Цель – определение частоты и характера проявлений гиперферритинемии у больных НАЖБП и оценка эффективности ее коррекции ГПЧ.
МАТЕРИАЛ И МЕТОДЫ / MATERIAL AND METHODS
Обследованы 158 больных НАЖБП в возрасте от 20 до 63 лет (92 мужчины и 66 женщин). Достоверных различий по возрасту между мужчинами и женщинами не выявлено. Группа контроля составила 20 практически здоровых лиц.
Диагноз заболевания верифицирован после сбора анамнеза, физикального осмотра, исключения маркеров вирусного гепатита В, С, D, злоупотребления алкоголем, донорства, аутоиммунных и онкологических заболеваний. До начала и в конце лечения оценивали показатели эффективности и параметры безопасности препарата.
Исследуемые препараты / Studied drugs
Перспективным направлением лечения указанных патологий является применение полипептидного препарата Лаеннек® (Japan Bio Products, Япония) (АТХ2 A05BA Препараты для лечения заболеваний печени), который проявляет комплекс гепатопротекторных, противовирусных, противовоспалительных и регенераторных свойств. Лаеннек® представляет собой препарат на основе ГПЧ. Экспериментальные и клинические исследования демонстрируют перспективность использования ГПЧ для восстановления паренхимы и детоксикационной активности печени [15][16].
В качестве препарата сравнения выступали эссенциальные фосфолипиды – препарат Эссенциале® форте Н (Sanofi, Франция), который является гепатопротектором. Входящие в его состав фосфолипиды – основные элементы в структуре клеточной оболочки и митохондрий. Препарат регулирует липидный и углеводный обмен, улучшает функциональное состояние печени и ее дезинтоксикационную функцию, способствует сохранению и восстановлению структуры гепатоцитов, тормозит формирование соединительной ткани в печени.
Лабораторные и инструментальные исследования / Laboratory and instrumental studies
На первом этапе всем пациентам проведены общеклинические, клинико-биохимические и инструментальные обследования, полнота и характер которых регламентировались необходимостью получения научно-аналитической информации.
Лабораторные исследования включали: клинический анализ крови, анализ общей железосвязывающей способности (ОЖСС), коэффициента насыщения трансферрина железом (КНТ), определение уровней аспартатаминотрансферазы (АСТ), аланинаминотрансферазы (АЛТ), щелочной фосфатазы (ЩФ), гамма-глютамилтранспептидазы (ГГТП), общего билирубина, ферритина, сывороточного железа, общего белка, глюкозы, индекса оценки модели гомеостаза при резистентности к инсулину (англ. Homeostasis Model Assessment of Insulin Resistance, HOMA-IR), гликированного гемоглобина, фибриногена, СРБ, общего холестерина, липопротеинов высокой плотности (ЛПВП), липопротеинов низкой плотности (ЛПНП), липопротеинов очень низкой плотности (ЛПОНП), скорости оседания эритроцитов (СОЭ), коэффициента атерогенности (КА), триглицеридов (ТГ), мочевой кислоты, цитокинов – интерлейкинов ИЛ-1β, ИЛ-6, фактора некроза опухоли альфа (ФНО-α).
Также всем пациентам выполнены ультразвуковое исследование органов брюшной полости, эластометрия, допплерография, тест ФиброМакс и морфологическое исследование печени.
Группы пациентов / Patient groups
На втором этапе согласно уровню СФ (референтный показатель контрольной группы 33,34±2,59 нг/мл) больные были разделены на две группы: 54 (34,1%) пациента с повышенным содержанием ферритина и 104 (65,9%) с нормальным уровнем СФ. В дальнейшем исследуемые с гиперферритинемией распределены на подгруппы пациентов с нарушением обмена железа (n=29; 53,7%) и тех, у которых повышение уровня ферритина протекало изолированно на фоне нормальных показателей обмена железа (n=25; 46,3%).
Для оценки эффективности препарата Лаеннек® в лечении больных НАЖБП с гиперферритинемией выделено 40 пациентов (основная группа) в возрасте от 18 до 60 лет (средний возраст 45,5±11,3 года, 18 женщин и 22 мужчины), из которых у 7 верифицирован стеатоз, у 29 – стеатогенетит, у 4 – цирроз печени. По данным теста ФиброМакс у 4 исследуемых отсутствовали проявления фиброза, у 4 определялся фиброз I степени, у 17 – фиброз II степени, у 7 – фиброз III степени, у 4 – фиброз IV степени. Масса тела больных варьировалась от 63 до 93 кг (в среднем 76,7±1,52 кг). В лечении пациентов с НАЖБП и гиперферритинемией в качестве монотерапии использовали Лаеннек® по 4,0 мл внутривенно капельно через день в течение 1 мес. В дальнейшем в течение 3 мес проводили поддерживающую терапию по 2 мл внутримышечно 1 раз в неделю [17].
В группу сравнения включены 14 пациентов с НАЖБП и гиперферритинемией, по характеру течения заболевания аналогичных больным основной группы, из которых у 3 верифицирован стеатоз, у 9 – стеатогепатит, у 2 – цирроз печени. По данным теста ФиброМакс у 1 исследуемого проявления фиброза не определялись, у 1 отмечен фиброз I степени, у 2 – фиброз II степени, у 2 – фиброз III степени и у 3 – фиброз IV степени. Пациенты этой группы получали Эссенциале® форте Н по 2 капсулы 3 раза в день во время еды в течение 4 мес.
Этические аспекты / Ethical aspects
Исследование соответствует принципам Хельсинкской декларации Всемирной медицинской ассоциации (Форталеза, Бразилия, 2013 г.). Все пациенты дали письменное согласие на участие в исследовании.
Статистический анализ / Statistical analysis
Статистическую обработку данных выполняли с помощью непараметрических методов исследования с использованием расчета рангового коэффициента корреляции Спирмена (r). Достоверность различий показателей между группами оценивали с помощью непараметрического критерия U Вилкоксона–Манна–Уитни. Рассчитывали среднее значение (М), стандартную ошибку репрезентативности среднего значения (m). Сравнение номинальных признаков осуществляли с применением критерия χ2. Различия между изучаемыми группами считали достоверными при p<0,05.
РЕЗУЛЬТАТЫ / RESULTS
Клинико-лабораторная характеристика / Clinical and laboratory characteristics
Клинико-лабораторная характеристика 158 больных НАЖБП показала, что уровень ферритина был увеличен у 54 (34%) исследуемых. Среди пациентов было 30 мужчин и 24 женщин. У 18 (18,51%) верифицирован стеатоз, у 38 (70,37%) – стеатогепатит, у 6 (11,1%) – цирроз печени. Средний уровень ферритина у исследуемых находился в пределах 366,81±24,56 нг/мл (р<0,05): 420,21±39,00 нг/мл (р<0,05) у мужчин и 300,29±35,76 нг/мл (р<0,05) у женщин. Частота гиперферритинемии нарастала при увеличении длительности заболевания, степени ожирения и тяжести инсулинорезистентности. Предикторами развития гиперферритинемии явились тяжесть течения метаболического синдрома, возраст старше 45 лет, индекс массы тела (ИМТ) более 30 кг/м2, артериальная гипертензия, нарушения сердечного ритма.
Основными клиническими проявлениями у пациентов с повышенным уровнем ферритина были тяжесть в правом подреберье в 37 (70,0%) наблюдениях, вздутие живота – в 39 (72,2%), непереносимость жирной пищи – в 30 (55,5%), астенический синдром – в 42 (77,7%). Избыточная масса тела за счет отложения жира по висцеральному типу определялась у 33 (61,1%) человек, гепатомегалия – у 48 (88,8%), спленомегалия – у 29 (53,7%), геморрагический синдром – у 21 (38,8%), артериальная гипертензия – у 33 (61,1%), нарушение сердечного ритма в виде фибрилляции предсердий, нарушения проводимости – у 33 (61,1%), меланодермия – у 15 (27,7%). ИМТ составлял 34,160±1,045 кг/м2 (р<0,05), уровень жировой массы тела по импедансометрии – 30,20±1,27 (р<0,05).
Лабораторные показатели / Laboratory indicators
При анализе лабораторных показателей (табл. 1) имело место достоверное (р<0,05) повышение уровня гемоглобина, среднего объема эритроцитов (англ. mean corpuscular volume, МСV), сывороточного железа, ОЖСС, КНТ, а также снижение среднего содержания гемоглобина в эритроците (англ. mean corpuscular hemoglobin, МСН) и средней концентрации гемоглобина в эритроците (англ. mean corpuscular hemoglobin concentration, МСНС).
Активность процесса оценивали по биохимическим показателям (табл. 2) и морфологическим данным. У пациентов с гиперферритинемией выявлено значимое (р<0,05) повышение активности АЛТ, АСТ, ЩФ, ГГТП, что достоверно отличалось от исследуемых с нормальными показателями уровня ферритина.
Результаты оценки липидограммы свидетельствовали о достоверном (р<0,05) повышении КА, ТГ, снижении ЛПВП. Наличие дислипидемии сыворотки крови усугубляло течение НАЖБП, увеличивало уровень содержания ферритина.
У больных наблюдалось повышение уровня мочевой кислоты, протекающее, как правило, без клинических проявлений. При этом не выявлены изменения со стороны почек, нарушения диеты. Уровень мочевой кислоты у мужчин с гиперферритинемией составил 460,5±23,5 ммоль/л (р<0,05), у женщин – 420,74±20,56 ммоль/л (р<0,05).
Установлено, что дислипидемия и гиперурикемия способствуют развитию хронического системного воспаления [18]. У пациентов с гиперферритинемией наблюдалось достоверное (р<0,05) повышение маркеров воспаления – СРБ, СОЭ, фибриногена, ИЛ-1β, ИЛ-6, ФНО-α. Повышение маркеров воспаления, как правило, зависело от уровня СФ (р<0,01). Известно, что при НАЖБП печень способна выступать в качестве органа – мишени системного воспаления и быть источником патогенных медиаторов. Печень может усиливать инсулинорезистентность, вызывать атерогенную дислипидемию и выброс множества провоспалительных цитокинов, вазоактивных и тромбогенных молекул, играющих важную роль в нарушении содержания ферритина [19].
В развитии гиперферритинемии существенное место занимают показатели углеводного обмена (уровни в сыворотке крови глюкозы, гликированного гемоглобина и индекс HOMA-IR). У пациентов было повышено содержание глюкозы (6,500±1,343 ммоль/л; р<0,01), гликированного гемоглобина (5,84±2,31%; р<0,01), наблюдалось увеличение индекса HOMA-IR (7,87±1,78; р<0,01), что достоверно отличалось от группы лиц с нормальными показателями ферритина. Установлена положительная корреляция между активностью фермента АСТ и индексом HОМА-IR (р<0,05).
У исследуемых выявлены изменения, характерные для окислительного стресса. Наблюдалось снижение активности ферментного и субстратного звена антиоксидантной системы (АОС), нарушения в окислительно-восстановительном гомеостазе, тиол-дисульфидной системе. Об этом свидетельствовали низкие величины общего (р<0,01), низкомолекулярного (р<0,01), белкового (р<0,01) тиол-дисульфидного коэффициента (ТДК). Анализ состояния ферментного звена АОС сыворотки крови продемонстрировал угнетение активности супероксиддисмутазы (СОД) (р<0,01), каталазы (КАТ) (р<0,01). Нарушения протекали на фоне увеличения уровня малонового диальдегида (МДА) (р<0,01). При анализе лабораторных показателей у больных с гиперферритинемией установлена зависимость между показателями системного воспаления, активности процесса и степенью инсулинорезистентности.
При верификации стадии фиброза с использованием шкалы оценки степени фиброза при НАЖБП гиперферритинемия на стадиях F0–F2 у пациентов с НАЖБП выявлена в 62,91% случаев, а на стадиях F3–F4 – в 79,37%, т.е. развитие печеночного фиброза протекает параллельно с увеличением уровня ферритина.
У больных НАЖБП с нормальными показателями СФ клинические и лабораторные проявления изменялись в меньше мере. Так, ИМТ (31,80±1,020 кг/м2), уровень жировой массы тела по импедансометрии (27,20±1,30) достоверно отличались от основной группы (р<0,05). Различались также характер и частота клинических проявлений. Повышенная утомляемость наблюдалась у 20 (28%) пациентов, снижение работоспособности – у 13 (20%).
Достоверно (р<0,05) от исследуемых с гиперферритинемией отличались и данные лабораторных показателей (см. табл. 2): индекс НОМА-IR, активность ферментов АЛТ, АСТ, ЩФ, показатели липидограммы – ЛПВП, ТГ, КА, уровень мочевой кислоты. Установлены значимые (р<0,05) различия в показателях системного воспаления – СРБ, СОЭ, ИЛ-1β, ИЛ-6, ФНО-α, фибриногена.
Таким образом, проведенный анализ показал, что гиперферритинемия у больных НАЖБП по клиническим проявлениям и лабораторным показателям утяжеляет течение заболевания.
Известно, что уровень ферритина в сыворотке крови более 300 мкг/л для мужчин и 200 мкг/л для женщин расценивается как гиперферритинемия, которая может быть обусловлена перегрузкой организма железом, а также свидетельствовать о признаках воспаления или опухоли [15]. Нами предпринята попытка установить причину гиперферритинемии у исследуемых с НАЖБП. При анализе причинного фактора выялено, что у 29 (53,7%) пациентов (16 мужчин и 13 женщин) увеличение уровня ферритина сочеталось с лабораторными признаками перегрузки железом. Средний возраст больных составил 42,3±12,2 года. Первые признаки заболевания в этой группе, как правило, появлялись в молодом возрасте, при этом часто выявлялись изменения сердечного ритма (15 (51,7%) пациентов), эндокринные нарушения (20 (68,9%)), меланодермия (14 (44,8%)).
Нарушения обмена железа проявлялись в виде гиперферритинемии, увеличения ОЖСС, КНТ. Так, средний уровень железа в сыворотке составил 41,75±12,5 мкмоль/л с большим разбросом значений (17,4–87,45 мкмоль/л) (рис. 1, 2), ферритина – 385,81±34,56 нг/мл (167,9–704,8 нг/мл), КНТ – 69,59±4,5% (49,5–1035%); ОЖСС – 58,74±12,1% (49,3–64,6%). Отмечено достоверное (р<0,05) повышение индекса НОМА-IR, глюкозы, активности ферментов АЛТ, АСТ, показателей липидограммы – ЛПВП, ТГ, КА, уровня мочевой кислоты.
При оценке корреляционных связей выявлена прямая высокодостоверная связь с сывороточным содержанием ферритина и железа (р<0,01), уровнями ферритина и глюкозы (р<0,05), КНТ железом и глюкозой (р<0,05). Следовательно, высокий уровень ферритина у лиц в данной группе может быть обусловлен перегрузкой железом, что согласуется с литературными данными [12, 20].
Нами выделена группа из 25 пациентов (14 мужчин и 11 женщин), у которых имело место изолированное повышение СФ без признаков нарушения гомеостаза железа (изолированная гиперферритинемия) с проявлениями системного воспаления (средний возраст 49,2±12,7 года). Уровень ферритина составил 345,32±41,13 нг/мл (р<0,05), наблюдалось недостоверное увеличение концентрации железа (28,60±5,12 мкмоль/л; р>0,05) с большим разбросом микроэлемента (10,40–57,45 мкмоль/л), минимальное повышение КНТ (56,08±5,19%; р>0,05). У больных значимо (р<0,05) чаще определялись признаки метаболического синдрома: выявлены избыточная масса тела (ожирение по висцеральному типу), гепатомегалия, проявления инсулинорезистентности, артериальная гипертензия, повышение активности ГГТП (96,140±8,282 Ед/л), уровня ТГ (2,310±0,150 ммоль/л), снижение уровня ЛПВП (0,900±0,019 ммоль/л), повышение уровня глюкозы (5,91±0,83 ммоль/л). Выявлены максимально высокие (р<0,05) показатели системного воспаления (см. рис. 2): СРБ (11,90±1,34 мг/л), СОЭ (15,04±1,96 мм/ч), ИЛ-1β (9,57±2,85 пг/мл), ИЛ-6 (8,80±0,85 пг/мл), ФНО-α (9,21±0,75 пг/мл). Установлена достоверная (р<0,05) коррреляционная связь между уровнем ферритина и СРБ, ферритина и СОЭ, ферритина и ФНО-α. Таким образом, увеличение ферритина у данных пациентов может быть обусловлено системной воспатительной реакцией. Ферритин, являясь острофазовым белком, подвержен воздействию провоспалительных цитокинов, которые способны усиливать его синтез при воспалительных состояниях.
Гистологическое исследование / Histological study
При гистологическом исследовании печени у 18 пациентов проявления гемосидероза наблюдались в 10 (55,5%) случаях, нарушения обмена железа – в 7, у 3 больных преобладало системное воспаление. Гемосидероз проявлялся накоплением железа в гепатоцитах и клетках Купфера, преимущественно в перисинусоидальном пространстве. У больных с нарушением уровня железа накопление микроэлемента наблюдалось в большей степени в гепатоцитах, в отличие от пациентов с системным воспалением, у которых преобладало его накопление в клетках ретикулоэндотелиальной системы.
Генотипирование / Genotyping
Для установления роли генетических механизмов в развитии гиперферритинемии проведено генотипирование по мутациям C282Y и H63D в гене HFE у 20 больных НАЖБП с лабораторными симптомами гиперферритинемии. Мутантные гены были обнаружены у 7 (35%) исследуемых (6 – с избыточным содержанием железа, 1 – с признаками системного воспаления). Среди выявленных вариантов полиморфизма гена HFE у 1 (5%) пациента наблюдалась гетерозигота по C282Y-мутации, у 5 (25%) – по H63D/N-мутации, у 1 (5%) – по H63D-мутации. Полученные результаты свидетельствуют о значимом вкладе выявленных генетических поломок у лиц с проявлениями избытка железа, что согласуется с данными литературы [9].
Терапия гидролизатом плаценты человека / Human placenta hydrolysate therapy
В клинической практике недостаточно разработаны терапевтические подходы по коррекции уровня ферритина. В настоящее время в литературе появились экспериментальные данные об использовании препарата ГПЧ Лаеннек® в лечении гиперферритинемии [21].
Нами проведена оценка эффективности препарата Лаеннек® по коррекции уровня ферритина у 40 больных НАЖБП с гиперферритинемией (основная группа). Исследование выявило положительное воздействие ГПЧ на ряд клинических и лабораторных проявлений заболевания. Так, после курса лечения у всех пациентов полностью купировались тяжесть в правом подреберье, вздутие живота, проявления геморрагического синдрома. Непереносимость жирной пищи наблюдалась у 10 (25%) больных, проявления астенического синдрома – у 5 (12,5%), гепатомегалия – у 23 (57,5%), спленомегалия – у 10 (25%). У 8 (13,5%) исследуемых уменьшились проявления меланодермии. Масса тела пациентов существенно не менялась.
Препарат оказывал существенное влияние на показатели обмена железа (рис. 3). После завершения курса терапии наблюдалась нормализация (р<0,05) уровней гемоглобина, сывороточного железа, СФ, ОЖСС, КНТ, МСV, МСН и МСНС. Установлена корреляционная зависимость между снижением содержания ферритина и железа в сыворотке крови (р<0,05). Уменьшение концентрации железа наблюдалось параллельно со значениями СФ. Следовательно, препарат способствует нормализации показателей гомеостаза железа. Указанный эффект оказался более значимым у исследуемых с гиперферритинемией, обусловленной нарушением обмена железа. В то же время в группе сравнения при использовании Эссенциале® форте Н показатели обмена железа практически не менялись, отмечено только снижение содержания гемоглобина (р<0,05).
Изменения в липидном спектре и нарушения углеводного обмена являются одним из звеньев патогенетического механизма НАЖБП. Использование ГПЧ Лаеннек® способствовало нормализации показателей липидного спектра крови за счет уменьшения концентрации общего холестерина (р<0,05), ТГ (р<0,01), холестерина ЛПОНП (р<0,01), холестерина ЛПНП (р<0,05), увеличения концентрации холестерина ЛПВП (р<0,01) на фоне снижения КА (р<0,01).
Наблюдалось достоверное снижение индекса HOMA IR (р<0,05), уровня глюкозы (6,300±0,237 ммоль/л; р<0,05), в то время как у пациентов группы сравнения на фоне приема эссенциальных фосфолипидов показатели гликемического профиля и индекса HOMA-IR существенно не отличались от исходного состояния (р>0,05).
Компоненты ГПЧ способствовали уменьшению активности ферментов: АСТ (р<0,01), АЛТ (р<0,01), ЩФ (р<0,05) и ГГТП (р<0,05). Концентрация прямого билирубина снизилась до 2,540±0,057 мкмоль/л (р<0,05), непрямого – до 7,330±0,356 мкмоль/л (р<0,05). Отмечено значимое (р<0,05) увеличение количества общего белка, альбуминов, протромбинового индекса, а также нормализация гамма-глобулинов.
Терапия больных основной группы приводила к достоверному (р<0,01) снижению уровня маркеров системного воспаления (рис. 4): СОЭ (10,100±0,502 мм/ч), СРБ (1,790±0,316 мг/л), фибриногена (2,510±0,691 мг/л), ИЛ-1β (1,150±0,583 пг/мл) и ФНО-α (1,090±0,684 пг/мл). Установлена зависимость между уровнем СРБ и степенью инсулинорезистентности (р<0,01). Таким образом, препарат Лаеннек® в виде монотерапии обладает противовоспалительным эффектом. У пациентов группы сравнения на фоне лечения достоверных различий в показателях маркеров воспаления не выявлено.
У исследуемых основной группы прием препарата ГПЧ привел к снижению мощности ферментативного звена АОС, сдвигу окислительно-восстановительного потенциала в тиол-дисульфидной системе в сторону окисления, повышению пероксидации белков, сокращению перекисного окисления липидов, о чем свидетельствует достоверное (р<0,01) повышение общего, низкомолекулярного, белкового ТДК, СОД, КАТ и снижение МДА (рис. 5). Установленные изменения свидетельствуют о том, что одним из лечебных механизмов патогенетического действия ГПЧ у больных НАЖБП с повышенным уровнем ферритина являются стимуляция ферментов тиол-дисульфидной системы, СОД, КАТ и уменьшение продукции МДА. Существенной динамики указанных показателей в группе сравнения не выявлено.
При ультразвуковом исследовании органов брюшной полости установлено, что у пациентов основной групы в 8 (20%) случаях терапия способствовала уменьшению размеров печени. При этом в печени наблюдалось снижение выраженности жировой и воспалительной инфильтрации, что дало возможность выявить неоднородность паренхимы. При допплерографии существенной динамики портального и селезеночного кровотока не установлено.
По данным теста ФиброМакс на фоне терапии ГПЧ выявлена положительная динамика степени регрессии фиброза печени. При контрольных исследованиях у 8 пациентов проявления фиброза не определялись, у 9 выявлен фиброз I степени, у 15 – фиброз II степени, у 5 – фиброз III степени, у 3 – фиброз IV степени. В группе сравнения динамики степени фиброза печени не зарегистрировано.
Таким образом, установлена эффективность препарата Лаеннек® у больных НАЖБП с проявлениями гиперферритинемии в виде нормализации показателей обмена железа, в частности уровня ферритина, системного воспаления.
Таблица 1. Лабораторные показатели обмена железа у пациентов с неалкогольной жировой болезнью печени (НАЖБП) в зависимости от уровня ферритина
Table 1. Laboratory indicators of iron metabolism in patients with nonalcoholic fatty liver disease (NAFLD) depending on ferritin level
|
Показатель / Indicator |
Здоровые лица / Healthy individuals (n=20) |
Пациенты с НАЖБП / NAFLD hatients |
|
|
С гиперферритинемией / With hyperferritinemia (n=54) |
Без гиперферритинемии / Without hyperferritinemia (n=104) |
||
|
Гемоглобин, г/л // Hemoglobin, g/l |
123,4±3,05 |
150,2±3,81* |
128,6±2,25** |
|
Эритроциты, ×1012/л // Erythrocytes, ×1012/l |
4,24±0,35 |
4,75±0,26 |
4, 65±0,30 |
|
МСН, пг / МСН, pg |
31,72±0,76 |
27,4±0,80* |
31,44±0,67 |
|
МСV, фл / МСV, fl |
81,4±1,01 |
85,5±1,55* |
83,7±1,89* |
|
МСНС, % / МСНС, % |
35,5±0,44 |
32,0±0,55* |
35,7±0,31* |
|
Железо в сыворотке, мкмоль/л // Serum iron, μmol/l |
24, 52±7,06 |
35,7±11,53* |
26,95±8,41 |
|
ОЖСС, мкмоль/л // TIBC, µmol/l |
45,71±2,54 |
55,35±3,14* |
48,7±3,31 |
|
КНТ, % / TSC, % |
53,6±3,00 |
64, 5±3, 66* |
55.3±4,51 |
Примечание. МСН (англ. mean corpuscular hemoglobin) – среднее содержание гемоглобина в эритроците; MCV (англ. mean corpuscular volume) – средний объем эритроцитов; МСНС (англ. mean corpuscular hemoglobin concentration) – средняя концентрация гемоглобина в эритроците; ОЖСС – общая железосвязывающая способность; КНТ – коэффициент насыщения трансферрина железом.* Различия достоверны (р<0,05) между данной группой и группой здоровых лиц. ** Различия достоверны (р<0,05) между данной группой и группой пациентов с НАЖБП и гиперферритинемией.
Note. MSH – mean corpuscular hemoglobin; MCV – mean corpuscular volume; МСНС – mean corpuscular hemoglobin concentration; TIBC – total iron-binding capacity; TSC – transferrin saturation coefficient. * Differences are significant (p<0.05) between this group and the group of healthy individuals. ** Differences are significant (p<0.05) between this group and the group of NAFLD patients with hyperferritinemia.
Таблица 2. Лабораторные показатели крови у пациентов с неалкогольной жировой болезнью печени (НАЖБП) в зависимости от уровня ферритина
Table 2. Laboratory blood parameters in patients with nonalcoholic fatty liver disease (NAFLD) depending on ferritin level
|
Показатель / Indicator |
Здоровые лица / Healthy individuals (n=20) |
Пациенты с НАЖБП / NAFLD hatients |
|
|
С гиперферритинемией / With hyperferritinemia (n=54) |
Без гиперферритинемии / Without hyperferritinemia (n=104) |
||
|
АЛТ, Ед/л // ALT, U/l |
18,20±0,92 |
41,93±4,29* |
25,780±1,931** |
|
АСТ, Ед/л // AST, U/l |
14,40±0,98 |
32,800±5,241* |
17,290±2,234** |
|
ЩФ, Ед/л // ALP, U/l |
41,320±0,462 |
149,32±14,20* |
97,16±8,37** |
|
ГГТП, Ед/л // GGTP, U/l |
52,120±0,680 |
82,220±9,178* |
80,530±7,471* |
|
Билирубин общий, мкмоль/л // Total bilirubin, μmol/l |
12,360±0,128 |
15,150±0,590* |
11,430±0,456* |
|
Глюкоза, ммоль/л // Glucose, mmol/l |
4,210±0,573 |
6,500±0,343* |
5,500±0,874* |
|
Индекс HOMA-IR / HOMA-IR index |
2,500±0,347 |
7,87±1,78* |
4,07±0,98** |
|
Инсулин, мкЕд/мл // Insulin, μU/ml |
5,631±0,284 |
16,541±3,780* |
18,324±2,541* |
|
Гликированный гемоглобин, % / Glycated hemoglobin, % |
3,81±0,23 |
5,84±0,81* |
4,84±0,78 |
|
Креатинин, мкмоль/л // Creatinine, μmol/l |
70,781±0,540 |
75,427± 8,420 |
73,532±7,654 |
|
Мочевая кислота, моль/л // Uric acid, mol/l |
|||
|
у мужчин / men |
220,38±3,30 |
469,5±23,5* |
378,50±9,23** |
|
у женщин / women |
154,31±3,74 |
411,74±20,56* |
342,74±6,41** |
|
Белок, г/л // Protein, g/l |
78,850±1,101 |
70,51±4,41 |
70,82±5,24 |
|
Общий холестерин, ммоль/л // Total cholesterol, mmol/l |
3,680±0,782 |
5,990±1,324 |
5,840±1,163 |
|
ЛПНП, ммоль/л // LDL, mmol/l |
1,31±0,32 |
3,74±0,98* |
3,64±0,96* |
|
ЛПОНП, ммоль/л // VLDL, mmol/l |
0,580±0,068 |
1,680±0,492* |
1,02±0,14* |
|
ЛПВП, ммоль/л // HDL, mmol/l |
1,240±0,081 |
0,950±0,021* |
1,15±0,01** |
|
Триглицериды, ммоль/л // Triglycerides, mmol/l |
0,940±0,037 |
2,250±0,163* |
1,780±0,041** |
|
КА / AR |
2,05±0,34 |
4,680±0,173* |
4,040±0,222** |
|
СОЭ, мм/ч // ESR, mm/h |
3,00±1,00 |
7,910±1,824* |
8,32±0,25** |
|
СРБ, мг/л // CRP, mg/L |
0,500±0,002 |
8,20±1,02* |
3,800±0,502** |
|
ИЛ-1β, пг/мл // IL-1β, pg/ml |
2,18±0,72 |
9,34±2,74* |
4,200±1,324** |
|
ИЛ-6, пг/мл // IL-6, pg/ml |
2,98±0,31 |
8,10±0,76* |
5,90±0,74** |
|
ФНО-α, пг/мл // TNF-α, pg/ml |
3,51±0,13 |
9,10±0,78* |
6,51±0,84** |
|
Фибриноген, мг/л // Fibrinogen, mg/l |
2,350±0,541 |
6,300±1,323* |
4,250±0,245** |
Примечание. АЛТ – аланинаминотрансфераза; АСТ – аспартатаминотрансфераза; ЩФ – щелочная фосфатаза; ГГТП – гамма-глютамилтранспептидаза; HOMA-IR (англ. Homeostasis Model Assessment of Insulin Resistance) – оценка модели гомеостаза при резистентности к инсулину; ЛПНП – липопротеины низкой плотности; ЛПОНП – липопротеины очень низкой плотности; ЛПВП – липопротеины высокой плотности; КА – коэффициент атерогенности; СОЭ – скорость оседания эритроцитов; СРБ – С-реактивный белок; ИЛ – интерлейкин; ФНО-α – фактор некроза опухоли альфа. * Различия достоверны (р<0,05) между данной группой и группой здоровых лиц. ** Различия достоверны (р<0,05) между данной группой и группой пациентов с НАЖБП и гиперферритинемией.
Note. ALT – alanine aminotransferase; AST – aspartate aminotransferase; ALP – alkaline phosphatase; GGTP – gamma-glutamyl transpeptidase; HOMA-IR – Homeostasis Model Assessment of Insulin Resistance; LDL – low-density lipoproteins; VLDL – very low-density lipoproteins; HDL – high-density lipoproteins; AR – atherogenicity ratio; ESR – erythrocyte sedimentation rate; CRP – C-reactive protein; IL – interleukin; TNF-α – tumor necrosis factor alfa. * Differences are significant (p<0.05) between this group and the group of healthy individuals. ** Differences are significant (p<0.05) between this group and the group of patients with NAFLD and hyperferritinemia.
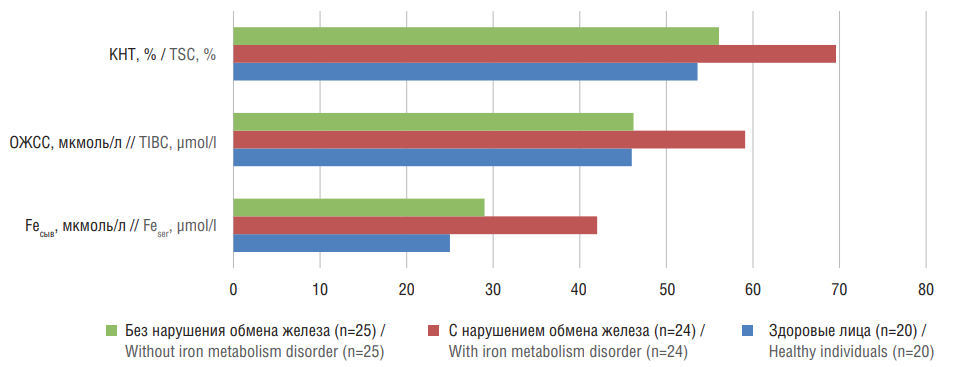
Рисунок 1. Лабораторные показатели нарушений обмена железа у пациентов с неалкогольной жировой болезнью печени и гиперферритинемией.
КНТ – коэффициент насыщения трансферрина железом; ОЖСС – общая железосвязывающая способность; Feсыв – уровень железа в сыворотке
Figure 1. Laboratory indicators of iron metabolism disorders in patients with nonalcoholic fatty liver disease and hyperferritinemia.
TSC – transferrin saturation coefficient; TIBC – total iron-binding capacity; Feser – serum iron level
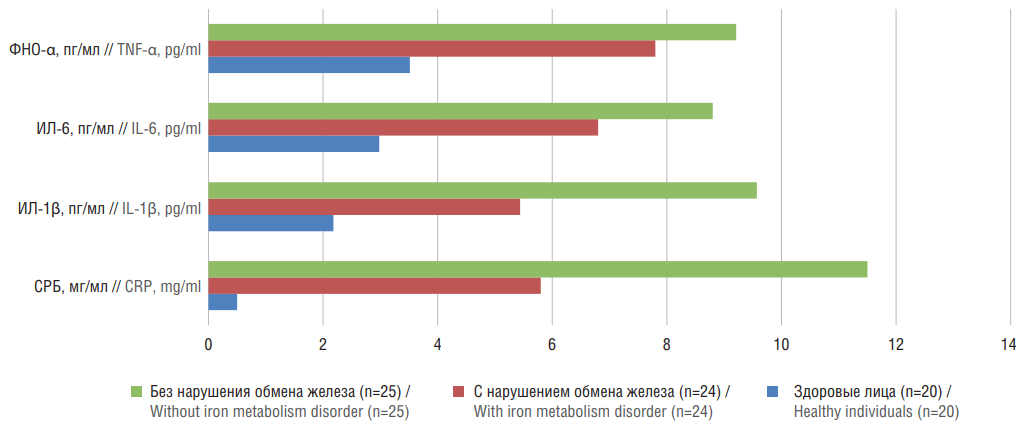
Рисунок 2. Лабораторные показатели системного воспаления у пациентов с неалкогольной жировой болезнью печени и гиперферритинемией.
ФНО-α – фактор некроза опухоли альфа; ИЛ – интерлейкин; СРБ – С-реактивный белок
Figure 2. Laboratory indicators of systemic inflammation in patients with nonalcoholic fatty liver disease and hyperferritinemia.
TNF-α – tumor necrosis factor alfa; IL – interleukin; CRP – C-reactive protein

Рисунок 3. Динамика показателей обмена железа у пациентов с неалкогольной жировой болезнью печени на фоне проведения терапии.
КНТ – коэффициент насыщения трансферрина железом; ОЖСС – общая железосвязывающая способность; Feсыв – уровень железа в сыворотке; МСНС (англ. mean corpuscular hemoglobin concentration) – средняя концентрация гемоглобина в эритроците; MCV (англ. mean corpuscular volume) – средний объем эритроцитов; МСН (англ. mean corpuscular hemoglobin) – среднее содержание гемоглобина в эритроците
Figure 3. Dynamics of iron metabolism indicators in patients with nonalcoholic fatty liver disease due to the therapy.
TSC – transferrin saturation coefficient; TIBC – total iron-binding capacity; Feser – serum iron level; МСНС – mean corpuscular hemoglobin concentration; MCV – mean corpuscular volume; МСН – mean corpuscular hemoglobin
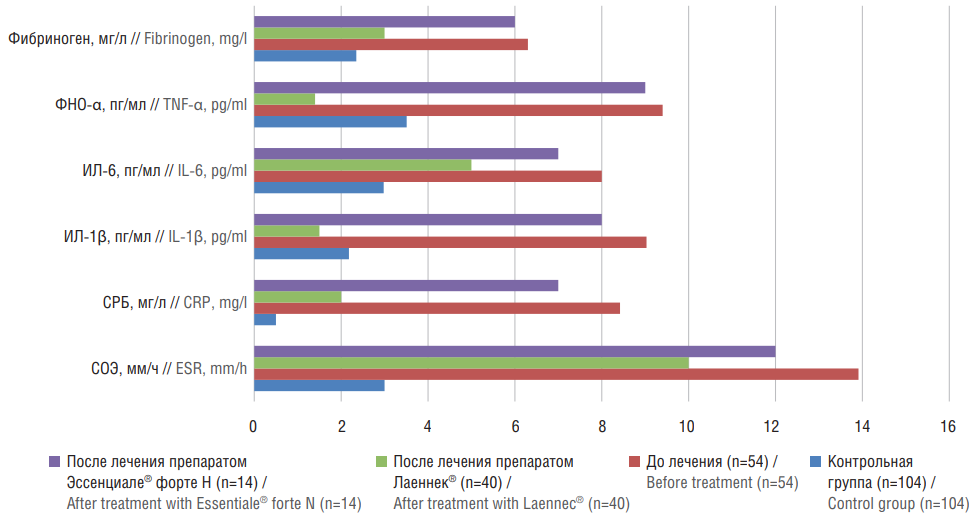
Рисунок 4. Динамика показателей системного воспаления у пациентов с неалкогольной жировой болезнью печени на фоне проведения терапии.
ФНО-α – фактор некроза опухоли альфа; ИЛ – интерлейкин; СРБ – С-реактивный белок; СОЭ – скорость оседания эритроцитов
Figure 4. Dynamics of systemic inflammation indicators in patients with nonalcoholic fatty liver disease du to the therapy.
TNF-α – tumor necrosis factor alfa; IL – interleukin; CRP – C-reactive protein; ESR – erythrocyte sedimentation rate
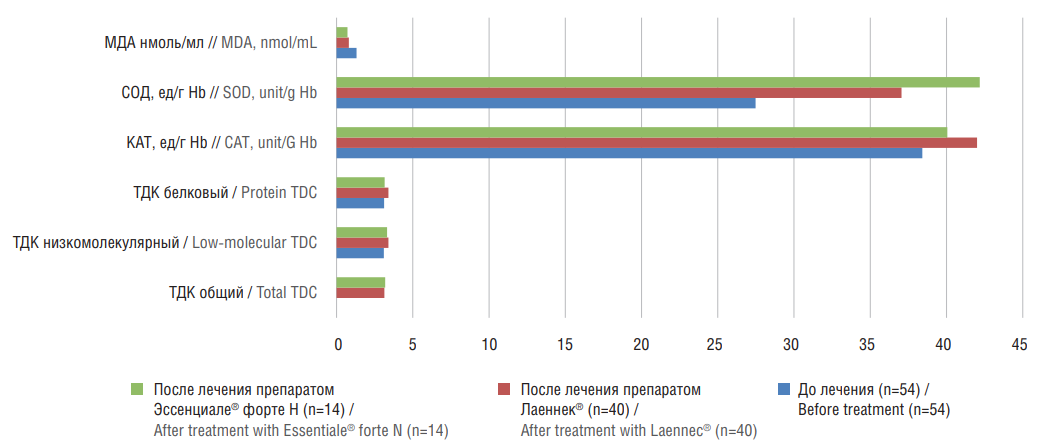
Рисунок 5. Динамика показателей активности антиоксидантной системы у пациентов с неалкогольной жировой болезнью печени на фоне проведения терапии.
МДА – малоновый диальдегид; СОД – супероксиддисмутаза; КАТ – каталаза; ТДК – тиол-дисульфидный коэффициент
Figure 5. Dynamics of antioxidant system activity indicators in patients with nonalcoholic fatty liver disease due to the therapy.
MDA – malonic dialdehyde; SOD – superoxide dismutase; CAT – catalase; TDC – thiol-disulfide ratio
ОБСУЖДЕНИЕ / DISCUSSION
Известно, что высокий уровень СФ – это предиктор тяжести течения патологического процесса. Ферритин является маркером общего запаса железа, участвует в иммунных процессах, обладает как провоспалительной, так и иммуносупрессивной активностью. Гиперферритинемия – неспецифический признак при ряде иммуновоспалительных, инфекционных заболеваний, а также при избытке запасов железа в организме.
Для изучения значимости ферритина в развитии НАЖБП в нашей работе обследовано 158 больных, из которых у 54 (34%) выявлена гиперферритинемия. Установлено, что повышенный уровень ферритина существенно утяжеляет течение и прогноз заболевания. У пациентов с повышенным уровнем ферритина достоверно чаще наблюдались: увеличение массы тела, нарушение обмена железа, признаки системного воспаления, проявления инсулинорезистентности, липотоксичности. В то же время указанные проявления или их сочетания отмечались не у каждого больного. В качестве интегрального показателя течения заболевания нами определен уровень ферритина. В дальнейшем в анализируемой группе пациентов проведены исследования по выявлению причинного фактора гиперферритинемии. Обнаружено, что из 54 больных с гиперферритинемией у 29 (53,7%) имели место нарушения обмена железа. При этом у 25 (46,3%) пациентов наблюдались проявления системного воспаления. Анализ показал, что течение заболевания у лиц анализируемых групп имеет свои особенности. Так, у исследуемых с избыточным содержанием железа увеличивались показатели ОЖСС, КНТ.
Известно, что в качестве одного из кандидатов на роль фактора патогенеза НАЖБП рассматривается перегрузка железом [9][22]. Железо, обладая выраженными окислительно-восстановительными свойствами, принимает активное участие в транспорте кислорода гемоглобином, синтезе ДНК, активности оксидоредукции митохондриальных энзимов. Однако биологические преимущества этого микроэлемента сочетаются с серьезными отрицательными свойствами – генерацией свободных радикалов, усилением оксидантного стресса. Поскольку печень является основным органом, депонирующим железо, проблемы, связанные с токсическим действием металла, в первую очередь, возникают именно в ее структурах. При этом основными механизмами повреждающего действия микроэлемента являются: стимуляция перикисного окисления липидов за счет свободнорадикальных реакций, усиление образования коллагена, прямое взаимодействие железа на ДНК клеток, приводящее к прямому повреждению гепатоцитов, клеток Купфера с последующим запуском в них механизмов ферроптоза или некроза [23][24].
Кроме того, доказано, что избыток железа может индуцировать повреждение печеночной ткани и нарушение толерантности к глюкозе или развитие сахарного диабета. Железо как прооксидант влияет на проявление многочисленных системных заболеваний, включая сахарный диабет и атеросклероз [23–25]. Инсулин является важным фактором повышения уровня СФ. Он может оказывать влияние на метаболизм железа, стимулируя синтез ферритина и облегчая поглощение металла клеткой через транслокацию рецепторов трансферрина. В свою очередь, железо влияет на метаболизм глюкозы – являясь мощным прооксидантом, усиливает окислительный стресс клетки и вызывает торможение интернализации инсулина, приводя в конечном итоге к инсулинорезистентности и гиперинсулинемии [26][27]. При синдроме перегрузки железом повышение уровня ферритина может быть обусловлено усиленным высвобождением тканевого ферритина из поврежденных гепатоцитов. Также установлено, что 2/3 пациентов с НАЖБП являются гетерозиготами по одной из мутаций в гене HFE [25][28].
В нашем исследовании у 25 больных НАЖБП гиперферритинемия была связана с проявлениями системного воспаления. У таких пациентов повышенное содержание ферритина может быть обусловлено системным воспалением [29]. Общие механизмы повышения уровня СФ на фоне воспаления описаны довольно подробно. Ферритин, являясь острофазовым белком при воспалительных реакциях, подвержен воздействию провоспалительных цитокинов, способных усиливать его синтез. В то же время провоспалительные цитокины также могут запускать механизмы, способные снижать уровень внеклеточного железа. По данным F. Tacke et al. (2016 г.), дисбаланс в метаболизме железа возникает наряду с воспалительным процессом, о чем свидетельствуют снижение содержания железа и повышение уровня ферритина, растворимых рецепторов трансферрина, гепсидина и ИЛ-6 в плазме [30]. В настоящее время установлено, что от провоспалительных стимулов зависит экспрессия H-ферритина, который захватывает железо быстрее, чем более стабильный L-ферритин (ферритин-депо) [31]. По той же причине именно H-ферритин обеспечивает защиту клеток от свободных радикалов [21]. Клетка способна регулировать количество содержащегося в ней H-ферритина путем его секреции в плазму, избавляясь от излишков, ведущих к избыточному захвату железа. Таким образом, при воспалении в плазме увеличивается содержание именно H-ферритина, в то время как в норме ферритин плазмы богат L-субъединицами [32]. Возможно, это и является одной из причин повышения СФ во время ответа на системный воспалительный процесс.
В основе развития гиперферритинемии при системном воспалении важное место отводится инсулинорезистентности, гипергликемии и висцеральному ожирению. При инсулинорезистентности и гиперинсулинемии происходит повышенная транслокация трансферриновых рецепторов на мембранах гепатоцитов, энтероцитов, приводящая к увеличению поступления железа в клетку и стимулированию синтеза ферритина [33]. При ожирении абдоминальная жировая ткань, обладающая собственной гормональной активностью, выделяет провоспалительные цитокины (ФНО-α, ИЛ-6, ИЛ-8, ИЛ-10), что приводит к насыщению тканей макрофагами, которые активно накапливают железо, индуцируя окислительный стресс и воспалительную реакцию3 [19][34][35]. Известно, что ферритин в большей степени секретируется из клеток ретикулоэндотелиальной системы, чем из гепатоцитов, поэтому на формирование гиперферритинемии может влиять не только повышенная концентрация железа в печени, но и распределение его в клеточных компартментах у лиц с НАЖБП [34].
Полученные данные указывают на то, что у больных НАЖБП в развитии гиперферритинемии ведущую роль играют процессы нарушения обмена железа и системного воспаления, способствующие прогрессированию патологического процесса, а уровень ферритина является интегральным показателем течения и прогноза заболевания.
Наличие увеличенного количества ферритина требует применения диагностического алгоритма, в частности определения параметров обмена железа (сыворотки, трансферрина, ОЖСС, КНТ) и показателей, характеризующих системное воспаление (СРБ, ИЛ-1β, ИЛ-6, ФНО-α, СОЭ) [36].
Одним из перспективных направлений в коррекции уровня ферритина является использование полипептидного препарата ГПЧ Лаеннек® [37]. В эксперименте установлено, что применение ГПЧ снижает уровень СФ, нормализует процессы обмена железа, системного воспаления [21][22]. По данным О.А. Громовой и др. (2020 г.) [21], в препарате Лаеннек® идентифицированы три группы пептидов, важных для регулировки гомеостаза железа и уровней ферритина: 1) хелаторы ионов железа; 2) гормоноподобные пептиды; 3) пептиды – ингибиторы специфических таргетных белков. В ГПЧ идентифицировано не менее семи пептидных фрагментов, которые могут являться специфичными хелаторами ионов железа. Специфичность пептидов обусловлена тем, что они непосредственно являются компонентами железосвязывающих сайтов соответствующих белков протеома человека. Хелаторами железа являются пептиды VTLDGGL [38], PAGAPQV, VCTNLG и ALHAQY.
Для понимания механизма действия ГПЧ важно то, что он содержит следовые количества железа (12±3 мкг/кг) [39], что соответствует 0,3 нмоль в 1 мл препарата. Следовательно, пептиды-хелаторы не нагружены ионами железа и при введении в организм могут выполнять свои хелатирующие функции.
В составе ГПЧ выделено несколько гормоноподобных пептидных фрагментов, которые участвуют в регуляции гомеостаза железа. Они соответствуют различным фрагментам последовательности гемоглобина. Так, пептид WYPWTE соответствует пептиду WYPWTQ 34-40 бета-субъединицы гемоглобина, а пептид WYPWT – фрагменту WYPWT 34-39 того же белка. Пептидный фрагмент гемоглобина 33-42 называется «М-геморфин-7», а пептидный фрагмент 33-39 – «спинорфин». Геморфины и спинорфины – эндогенные опиоидные пептиды, которые оказывают антиноцицептивное действие, а также проявляют противовоспалительные, антипролиферативные и иммуномодулирующие эффекты [40]. Геморфины и спинорфины вовлечены в регуляцию гомеостаза железа. При участии рецептора CD163+ макрофаги перерабатывают гемовое железо, параллельно синтезируя LW-геморфин-7 [41].
В ГПЧ также идентифицированы пептиды-ингибиторы и пептиды-активаторы специфических таргетных белков, важных для регуляции обмена микроэлементов. Модулирование их активности способствует повышению уровней гепцидина (основного гормона гомеостаза железа) и снижению синтеза ферритина [42]. Пептиды VYPFGE, VAALNS и SLEHEP, ингибируя трансформацию мембранной формы гемоювелина в растворимую форму, повышает уровнь гепцидина. При высоком содержании гепцидина в крови в кишечнике ослабляются процессы всасывания железа, а его концентрация в сыворотке крови падает вследствие контролируемого захвата микроэлемента макрофагами и гепатоцитами. Наоборот, аномально низкие уровни гепцидина способствуют повышенному всасыванию железа в кишечнике и резкому увеличению оттока железа (в виде ферритина) из внутриклеточного депо посредством повышения активности белка ферропортина [43].
Снижение уровней ферритина осуществляется также посредством ингибирования пептидами белкового комплекса убиквитинлигазы SKP1-CUL1-RBX1-FBXL5, регулирующего распад железорегуляторных белков Р1 и Р2. Р-белки связываются с так называемыми железо-чувствительными элементами РНК (англ. iron-responsive element, IRE) в мРНК ферритина и рецептора трансферрина. Связывание IRP-белков с элементами IRE в мРНК ферритина приводит к подавлению синтеза ферритина. Поэтому ингибирование белков SKP1 и CUL1 пептидом NLTVLSLP тормозит протеолиз белка IRP2 и, соответственно, ингибирует синтез новых молекул ферритина.
Нормализации гомеостаза железа способствуют пептиды, усиливающие сигналы от рецепторов ретиноидов (витамина А). Установлено, что дефицит витамина А повышает дефицит железа за счет усиления экспрессии белка IRP2, нарушающего экспрессию генов ферритина и рецептора трансферрина [44]. Следовательно, идентифицированные пептиды препарата Лаеннек® способствуют комплексной регуляции гомеостаза железа, включая снижение избыточного синтеза ферритина [45].
В настоящее время доказано, что у больных НАЖБП препарат Лаеннек® оказывает противовоспалительное, антиоксидантное действие, способствует нормализации функции печени [46]. ГПЧ содержит ряд пептидов легкой фракции (до 1200 Да), обладающих противовоспалительным эффектом. Так, пептид LAGSGPAG проявляет противовоспалительное действие за счет снижения активности транскрипционного ядерного фактора каппа-В (англ. nuclear factor kappa B, NF-κB). Подобным механизмом также обладают пептид VGPLGPLGPAG (ингибирует тирозинкиназы CSK и TNK2) и спиралеобразный пептид DLGLPGAPGAP (ингибирует сигнальный белок MAPKAPK2). Особого внимания заслуживает пептид QLLGLLG, являющийся потенциальным ингибитором киназы гликогенсинтазы 3β. Выделенный в составе препарата пептид ITGNGRTT, взаимодействуя с NF-κB, регулирует процессы воспаления, а также связывает убиквитинлигазы, необходимые для контролируемой деградации внутриклеточных белков на протеасоме. Поскольку транскрипционная регуляция системного воспаления выполняет значимую роль в формировании НАЖБП, важное место в понимании молекулярных механизмов процесса отводится оценке роли транскрипционных ядерных факторов, в частности NF-κB, который отвечает на большую часть внешних и внутренних стимулов, активирующих или подавляющих транскрипцию генов, участвующих в воспалительной реакции. По нашим данным, блокада NF-κB пептидами ГПЧ может способствовать снижению СОЭ, СРБ, фибриногена, ИЛ-1β и ФНО-α [47].
Известно, что печень является основным источником циркулирующего в крови инсулиноподобного фактора роста 1-го типа (ИФР-1). Его уровень существенно снижен при хронических заболеваниях печени. При системном воспалении, нарушении обмена железа, гиперферритинемии защитный эффект препарата Лаеннек® по отношению к клеткам печени связан с наличием в его составе биологически активных пептидных фрагментов ИФР-1 [15][48–50]. Пептид регулирует экспрессию рецепторов трансферрина, осуществляющего перенос ионов железа между поверхностью клетки и эндосомами внутри клетки [48]. Препарат Лаеннек®, в состав которого входит ИФР-1, способствует нормализации функционального состояния печени по динамике уровня альбумина, общего билирубина, активности АЛТ, АСТ, ГГТП, ЩФ. Повышение экспрессии ИФР-1 в активированных звездчатых клетках печени содействует снижению выраженности фиброза. По данным теста ФиброМакс у исследуемых основной группы на фоне терапии ГПЧ наблюдалась положительная динамика степени регрессии фиброза печени. Помимо гепатопротекции ИФР-1 приводит к уменьшению проявлений инсулинорезистентности [22], нормализации индекса HOMA-IR [46]. Важно, что в составе препарата Лаеннек® содержится дегидроэпиандростерон, повышающий секрецию ИФР-1 [50].
Таким образом, выявленные патогенетические особенности заболевания, а также универсальность действия органопротектора свидетельствуют о целесообразности дифференцированного подхода к использованию препарата Лаеннек® в лечении НАЖБП. В частности, у больных с проявлениями синдрома перегрузки железом после окончания основного курса монотерапии (4,0 мл внутривенно капельно через день в течение 1 мес) поддерживающая терапия (2 мл внутримышечно 1 раз в неделю) должна проводиться длительно – в течение 1–2 лет. В то же время у лиц с преобладанием системного воспаления поддерживающую терапию целесообразно использовать в течение 4–6 мес.
ЗАКЛЮЧЕНИЕ / CONCLUSION
Полученные данные свидетельствуют о том, что в течении и прогрессировании НАЖБП значительное место отводится белковому комплексу ферритину – важному интегральному и диагностическому маркеру заболевания. По результатам исследования выявлено повышение уровня ферритина у 34% пациентов. Наличие гиперферритинемии свидетельствует о тяжести и характере течения заболевания, особенностях его патогенетического развития. Высокий уровень ферритина в сочетании с лабораторными признаками нарушения обмена железа и воспаления дают воможность выявить патогенетические особенности НАЖБП и внести соответствующие коррективы в лечение.
Широкий диапазон лечебного воздействия ГПЧ Лаеннек®, включая нормализацию уровня ферритина, показателей обмена железа, а также противовоспалительный эффект, обусловлен уникальностью пептидного состава препарата, содержанием минеральных веществ, витаминов, других ингредиентов, что позволяет дифференцированно использовать его для патогенетической терапии и в качестве универсального органопротектора в лечении НАЖБП.
1. Богуш Л.С. Вторичная перегрузка железом: сопоставление клинических, морфологических и генетических характеристик. Автореф. дис. … канд. мед. наук. Минск; 2009.
2. АТХ – анатомо-терапевтическо-химическая классификация.
3. Козулина Е.А. Клинико-патогенетические особенности хронической сердечной недостаточности у женщин с абдоминальным ожирением в постменопаузальном периоде. Дис. … канд. мед. наук. Екатеринбург; 2015.
Список литературы
1. Harrison P.M., Arosio P. The ferritins: molecular properties, iron storage function and cellular regulation. Biochim Biophys Acta. 1996; 1275 (3): 161–203. https://doi.org/10.1016/0005-2728(96)00022-9.
2. MacKenzie E.L., Iwasaki K., Tsuji Y. Intracellular iron transport and storage: from molecular mechanisms to health implications. Antioxid Redox Signal. 2008; 10 (6): 997–1030. https://doi.org/10.1089/ars.2007.1893. PMC 2932529.
3. Harrison P.M., Ford G.C., Rice D.W., et al. Production and characterization of recombinant heteropolymers of human ferritin H and L chains. Biochem Soc Transact. 1987; 15: 744–8.
4. Beaton M.D., Adams P.C. Treatment of hyperferritinemia. Ann Hepatol. 2012; 11 (3): 294–300.
5. Knovich M.A., Storey J.A., Coffman L.G., et al. Ferritin for the clinician. Blood Rev. 2009; 23 (3): 95–104. https://doi.org/10.1016/j.blre.2008.08.001.
6. Khosravi M.J., Chan M.A., Bellem A.C., Diamandis Е.Р. A sensitive time-resolved immunofluorometric assay of ferritin in serum with monoclonal antibodies. Clin Chim Acta. 1988; 175 (3): 267–75. https://doi.org/10.1016/0009-8981(88)90102-7.
7. Matzner Y., Konijn A.M., Schlomai Z., Ben-Bassat H. Differential effect of isolated placental isoferritins on in vitro T-lymphocyte function. Brit J Haematol. 1985; 59 (3): 443–8. https://doi.org/10.1111/j.1365-2141.1985.tb07331.x.
8. Diamandis E.P. Immunoassays with time-resolved fluorescence spectroscopy: principles and applications. Clin Biochem. 1988; 21 (3): 139–50. https://doi.org/10.1016/0009-9120(88)90001-x.
9. Chang T.Y., Liu K.L., Chang C.S., et al. Ferric citrate supplementation reduces red-blood-cell aggregation and improves CD163+ macrophagemediated hemoglobin metabolism in a rat model of high-fat-dietinduced obesity. Mol Nutr Food Res. 2018; 62 (2). https://doi.org/10.1002/mnfr.201700442.
10. Sandnes M., Ulvik R.J., Vorland M., Reikvam H. Hyperferritinemia – a clinical overview. J Clin Med. 2021; 10 (9): 2008. https://doi.org/10.3390/jcm10092008.
11. Torti F.M., Torti S.V. Regulation of ferritin genes and protein. Blood. 2002; 99 (10): 3505–16. https://doi.org/10.1182/blood.v99.10.35054.
12. George D.K., Goldwurm S., MacDonald G.A., et al. Increased hepatic iron concentration in nonalcoholic steatohepatitis is associated with increased fibrosis. Gastroenterology. 1998; 114 (2): 311–8. https://doi.org/10.1016/s0016-5085(98)70482-2.
13. Piperno A. Classification and diagnosis of iron overload. Haematologica. 1998; 83 (5): 447–55.
14. Deugnier Y., Turlin B., le Quilleuc D., et al. A reappraisal of hepatic siderosis in patients with end-stage cirrhosis: practical implications for the diagnosis of hemochromatosis. Am J Surg Pathol. 1997; 21 (6): 669–75. https://doi.org/10.1097/00000478-199706000-00007.
15. Громова О.А., Торшин И.Ю., Шаповалова Ю.О. и др. COVID-19 и железодефицитная анемия: взаимосвязи патогенеза и терапии. Акушерство, гинекология и репродукция. 2020; 14 (5): 644–55. https://doi.org/10.17749/2313-7347/ob.gyn.rep.2020.179.
16. Громова О.А., Торшин И.Ю., Минушкин О.Н. и др. Об эффективности и молекулярных механизмах действия препарата «Лаеннек» в лечении патологических состояний печени, связанных с отложением железа в печени. Дело жизни. 2015; 1: 44–51.
17. Минушкин О.Н. Максимов В.А., Пальцев А.И. и др. Рекомендации по применению гидролизата человеческой плаценты при заболеваниях печени. Экспериментальная и клиническая гастроэнтерология. 2016; 12: 75–7.
18. Радченко В.Г., Селиверстов П.В., Иванова В.Ф., Ситкин С.И. Алгоритм лечения неалкогольной жировой болезни печени и роль митохондриальной дисфункции в ее развитии. Фарматека. 2017; 6: 12–9.
19. Маянский А.Н., Маянский Д.Н. Очерки о нейтрофиле и макрофаге. 2-е изд. Новосибирск: Наука; 1989: 340 с.
20. Щербинина С.П., Романова Е.А., Левина А.А. и др. Диагностическое значение комплексного исследования показателей метаболизма железа в клинической практике. Гематология и трансфузиология. 2005; 50 (5): 23–8.
21. Громова О.А., Торшин И.Ю., Максимов В.А. и др. Пептиды в составе препарата Лаеннек, способствующие устранению гиперферритинемии и перегрузки железом. ФАРМАКОЭКОНОМИКА. Современная фармакоэкономика и фармакоэпидемиология. 2020; 13 (4): 413–25. https://doi.org/10.17749/2070-4909/farmakoekonomika.2020.070.
22. Радченко В.Г., Лазебник Л.Б., Гриневич В.Б., Радченко Д.В. Препарат плаценты Лаеннек как универсальный регулятор. М.: Тинкомаркетинг; 2022: 260 с.
23. Токарев Ю.Н., Сеттарова Д.А., Сметанина Н.С. и др. Болезни перегрузки железом (гемохроматозы): руководство для врачей. М.: Медпрактика-М; 2004: 328 с.
24. Ramm G.A., Ruddell R.G. Iron homeostasis, hepatocellular injury, and fibrogenesis in hemochromatosis; the role of inflammation in a noninflammatory liver disease. Semin Liver Dis. 2010; 30 (3): 271–87. https://doi.org/10.1055/s-0030-1255356.
25. Смирнов О.А., Радченко В.Г., Кальм Е.И. Клинико-морфологические особенности хронического гепатита при гемосидерозе печени. Российский медицинский журнал. 2003; 1: 20–2.
26. Houstis N., Rosen E.D., Lander E.S. Reactive oxygen species have a causal role in multiple forms of insulin resistance. Nature. 2006; 440 (7086): 944–8. https://doi.org/10.1038/nature04634.
27. Sumida Y., Kanemasa K., Fukumoto K., et al. Effect of iron reduction by phlebotomy in Japanese patients with non-alcoholic steatohepatitis: a pilot study. Hepatol Res. 2006; 36 (4): 315–21. https://doi.org/10.1016/j.hepres.2006.08.003.
28. Bottomley S. Secondary iron overload disorders. Sem Hematol. 1998; 35 (1): 77–86.
29. Tilg H., Hotamisligil G.S. Nonalcoholic fatty liver disease: cytokineadipokine interplay and regulation of insulin resistance. Gastroenterology. 2006; 131 (3): 934–45. https://doi.org/10.1053/j.gastro.2006.05.054.
30. Tacke F., Nuraldeen R., Koch A., et al. Iron parameters determine the prognosis of critically ill patients. Crit Care Med. 2016; 44 (6): 1049–58. https://doi.org/10.1097/CCM.0000000000001607.
31. Ruscitti P., Di Benedetto P., Berardicurti O., et al. Pro-inflammatory properties of H-ferritin on human macrophages, ex vivo and in vitro observations. Sci Rep. 2020; 10 (1): 12232. https://doi.org/10.1038/s41598-020-69031-w.
32. Veas F. (Ed.) Acute phase proteins – regulation and functions of acute phase proteins. InTech; 2011: 380 pp. https://doi.org/10.5772/756.
33. Moirand R., Mortaji A.M., Loréal O., et al. A new syndrome of liver iron overload with normal transferrin saturation. Lancet. 1997; 349 (9045): 95–7. https://doi.org/10.1016/S0140-6736(96)06034-5.
34. Cohen L.A., Gutierrez L., Weiss A., et al. Serum ferritin is derived primarily from macrophages through a nonclassical secretory pathway. Blood. 2010; 116 (9): 1574–84. https://doi.org/10.1182/blood-2009-11-253815.
35. Orino K., Lehman L., Tsuji Y., et al. Ferritin and the response to oxidative stress. Biochem J. 2001; 357 (Pt. 1): 241–7. https://doi.org/10.1042/0264-6021:3570241.
36. Wood J. Guidelines for quantifying iron overload. Hematology Am Soc Hematol Educ Program. 2014; 2014 (1): 210–5. https://doi.org/10.1182/asheducation-2014.1.210.
37. Торшин И.Ю., Громова О.А. Мировой опыт использования гидролизатов плаценты человека в терапии. Экспериментальная и клиническая гастроэнтерология. 2019; 1 (10): 79–89. https://doi.org/10.31146/1682-8658-ecg-170-10-79-89.
38. Faber H.R., Bland T., Day C.L., et al. Altered domain closure and iron binding in transferrins: the crystal structure of the Asp60Ser mutant of the amino-terminal half-molecule of human lactoferrin. J Mol Biol. 1996; 256 (2): 352–63. https://doi.org/10.1006/jmbi.1996.0091.
39. Громова О.А., Торшин И.Ю., Волков А.Ю. и др. Препарат «Лаеннек»: элементный состав и фармакологическое действие. Пластическая хирургия и косметология. 2011; 2: 327–33.
40. Chen L.Y., Chang S.D., Sreenivasan G.M. Dysmetabolic hyperferritinemia is assiciated with normal transferrin saturation, mild hepatic iron overload, and elevated hepsidin. Ann Hematol. 2011; 90 (2): 139– 43. https://doi.org/10.1007/s00277-010-1050-x.
41. Zhao Q., Garreau I., Sannier F., Piot J.M. Opioid peptides derived from hemoglobin: hemorphins. Biopolymers. 1997; 43 (2): 75–98. https://doi.org/10.1002/(SICI)1097-0282(1997)43:2<75::AIDBIP2>3.0.CO;2-X.
42. Громова О.А., Торшин И.Ю., Гришина Т.Р., Томилова И.К. Значение использования препаратов железа и его молекулярных синергистов для профилактики и лечения железодефицитной анемии у беременных. Российский вестник акушера-гинеколога. 2015; 15 (4): 85–94. https://doi.org/10.17116/rosakush201515485-94.
43. Colucci S., Pagani A., Pettinato M., et al. The immunophilin FKBP12 inhibits hepcidin expression by binding the BMP type I receptor ALK2 in hepatocytes. Blood. 2017; 130 (19): 2111–20. https://doi.org/10.1182/blood-2017-04-780692.
44. Jiang S., Wang C.X., Lan L., Zhao D. Vitamin A deficiency aggravates iron deficiency by upregulating the expression of iron regulatory protein-2. Nutrition. 2012; 28 (3): 281–7. https://doi.org/10.1016Zj.nut.2011.08.015.
45. Лазебник Л.Б., Радченко В.Г., Селиверстов П.В. и др. Современное представление о фиброзе печени и подходах к его лечению у больных неалкогольным стеатогепатитом. Экспериментальная и клиническая гастроэнтерология. 2017; 12: 98–109.
46. Chen Z., Xu W., Ma W., et al.Clinical laboratory evaluation of COVID-19. Clin Chim Acta. 2021; 519: 172–82. https://doi.org/10.1016/j.cca.2021.04.022.
47. Dufrusine B., Di Francesco A., Oddi S., et al. Iron-dependent trafficking of 5-lipoxygenase and impact on human macrophage activation. Front Immunol. 2019; 10: 1347. https://doi.org/10.3389/fimmu.2019.0134.
48. Davis R.J., Faucher M., Racaniello L.K., et al. Insulin-like growth factor I and epidermal growth factor regulate the expression of transferrin receptors at the cell surface by distinct mechanisms. J Biol Chem. 1987; 262 (27): 13126–34. https://doi.org/10.1016/S00219258(18)45177-0.
49. Vera M., Sobrevals L., Zaratiegui M., et al. Liver transduction with a simian virus 40 vector encoding insulin-like growth factor I reduces hepatic damage and the development of liver cirrhosis. Gene Ther. 2007; 14 (3): 203–10. https://doi.org/10.1038/sj.gt.3302858.
50. Villareal D.T., Holloszy J.O., Kohrt W.M. Effects of DHEA replacement on bone mineral density and body composition in elderly women and men. Clin Endocrinol (Oxf). 2000; 53 (5): 561–8. https://doi.org/10.1046/j.1365-2265.2000.01131.x.
Об авторах
В. Г. РадченкоРоссия
д.м.н., профессор 2-й кафедры (терапии усовершенствования врачей) ФГБВОУ ВО «Военно-медицинская академия им. С.М. Кирова» Минобороны России
ул. Академика Лебедева, д. 6, Санкт-Петербург 194044
В. Б. Гриневич
Россия
д.м.н., профессор, заведующий 2-й кафедрой (терапии усовершенствования врачей) ФГБВОУ ВО «Военно-медицинская академия им. С.М. Кирова» Минобороны России
ул. Делегатская, д. 20, стр.1, Москва 127473
Е. С. Иванюк
Россия
к.м.н., доцент 2-й кафедры (терапии усовершенствования врачей) ФГБВОУ ВО «Военно-медицинская академия им. С.М. Кирова» Минобороны России
ул. Делегатская, д. 20, стр.1, Москва 127473
Л. Б. Лазебник
Россия
д.м.н., профессор кафедры поликлинической терапии ФГБОУ ВО «Московский государственный медико-стоматологический университет им. А.И. Евдокимова» Минздрава России
ул. Делегатская, д. 20, стр.1, Москва 127473
Рецензия
Для цитирования:
Радченко В.Г., Гриневич В.Б., Иванюк Е.С., Лазебник Л.Б. Роль ферритина в оценке заболеваний печени. ФАРМАКОЭКОНОМИКА. Современная фармакоэкономика и фармакоэпидемиология. 2023;16(3):432-446. https://doi.org/10.17749/2070-4909/farmakoekonomika.2023.200
For citation:
Radchenko V.G., Grinevich V.B., Ivanyuk E.S., Lazebnik L.B. The role of ferritin in liver disease assessment. FARMAKOEKONOMIKA. Modern Pharmacoeconomics and Pharmacoepidemiology. 2023;16(3):432-446. (In Russ.) https://doi.org/10.17749/2070-4909/farmakoekonomika.2023.200

Контент доступен под лицензией Creative Commons Attribution-NonCommercial-ShareAlike 4.0 International License.






































