Перейти к:
Болезнь-модифицирующие остеоартрит препараты (DMOADs) – новые тенденции в терапии пациентов с остеоартритом
https://doi.org/10.17749/2070-4909/farmakoekonomika.2023.207
Аннотация
В обзоре рассматриваются фармакологические средства, которые могут претендовать на статус потенциальных болезнь модифицирующих остеоартрит препаратов (англ. disease-modifying osteoarthritis drugs, DMOADs). DMOADs препятствуют прогрессированию и дальнейшему структурному повреждению сустава (структурно-модифицирующий эффект), приводя к уменьшению выраженности симптомов (симптом-модифицирующий эффект), таких как боль, и улучшению функции сустава. Обсуждаются подходы к выбору потенциальных DMOADs: 1) предпочтительная мишень (кость, хрящ, синовия); 2) механизм действия препарата / антицитокиновая терапия (ингибиторы матриксной металлопротеиназы, ингибиторы провоспалительных интерлейкинов и др.). Описаны основные системы доставки препаратов, претендующих на статус DMOADs, и возможный вклад иммунологических механизмов в патогенез остеоартрита. Большой интерес представляют методы оценки эффективности DMOADs-терапии (цитология, микроскопирование, радиологические методы исследования, биохимические маркеры крови и синовии). На основании проведенного анализа результатов исследований в качестве потенциальных DMOADs можно рассмотреть такие субстанции, как хондроитина сульфат, глюкозамина сульфат, неденатурированный коллаген II типа, витамин D. Каждая из них обладает симптом-модифицирующим и структурно-модифицирующим действием.
Ключевые слова
Для цитирования:
Шавловская О.А., Громова О.А., Кочиш А.Ю., Юхновская Ю.Д., Романов И.Д., Бокова И.А. Болезнь-модифицирующие остеоартрит препараты (DMOADs) – новые тенденции в терапии пациентов с остеоартритом. ФАРМАКОЭКОНОМИКА. Современная фармакоэкономика и фармакоэпидемиология. 2023;16(3):482-499. https://doi.org/10.17749/2070-4909/farmakoekonomika.2023.207
For citation:
Shavlovskaya O.A., Gromova О.А., Kochish A.Yu., Yukhnovskaya Yu.D., Romanov I.D., Bokova I.A. Disease-modifying osteoarthritis drugs (DMOADs): new trends in osteoarthritis therapy. FARMAKOEKONOMIKA. Modern Pharmacoeconomics and Pharmacoepidemiology. 2023;16(3):482-499. (In Russ.) https://doi.org/10.17749/2070-4909/farmakoekonomika.2023.207
ВВЕДЕНИЕ / INTRODUCTION
Болезнь-модифицирующие остеоартрит (ОА) препараты (disease-modifying osteoarthritis drugs, DMOADs) представляют собой фармакологические средства, которые препятствуют прогрессированию и дальнейшему структурному повреждению сустава (структурно-модифицирующий эффект), приводя к уменьшению выраженности симптомов (симптом-модифицирующий эффект), таких как боль, и улучшению функции сустава [1, 2]. DMOAD – это препарат, который изменяет патофизиологию, лежащую в основе ОА, и потенциально подавляет структурные повреждения, предотвращая или уменьшая долгосрочную нетрудоспособность благодаря облегчению симптомов [3].
Направление по изучению DMOAD-терапии и DMOAD-эффектов сейчас является крайне актуальным и перспективным. Работы по поиску и оценке эффективности DMOADs ведутся с 1990-х гг. Очень многие лекарственные препараты (ЛП) претендуют на звание DMOADs. Но, несмотря на десятилетия исследовательских усилий и многочисленные клинические испытания, нацеленные на поиск эффективных ЛП, модифицирующих заболевание при ОА, пока не сформировалось единого мнения о препарате, который мог бы получить статус «эффективного DMOAD» [4]. Сейчас все чаще в качестве потенциальных DMOADs рассматриваются молекулы хондроитина сульфата (ХС), глюкозамина сульфата (ГС), неденатурированного коллагена II типа (НК-II).
Традиционно лечение ОА сводилось к облегчению симптомов, но для многих специалистов в этой области актуальна разработка ЛП, которые помогут справиться не только с симптомами заболевания, но и со структурными изменениями [3]. В настоящее время нет единого представления о том, по каким критериям ЛП должны быть включены в группу DMOADs [5]. Продолжается активный поиск и разработка лекарственных субстанций, которые бы отвечали всем требованиям, предъявляемым к DMOADs [6].
Одно из таких требований – это ингибирование активности провоспалительных маркеров: интерлейкин 1β (ИЛ-1β), ИЛ-6, ИЛ-8, ядерный фактор транскрипции каппа В (англ. nuclear factor kappa-light-chain-enhancer of activated B cells, NF-κВ), фактор некроза опухоли альфа (англ. tumor necrosis factor alfa, TNF-α), матриксная металлопротеиназа 1 (ММП-1), ММП-13. Еще одним немаловажным свойством, которым должны обладать потенциальные DMOADs, является их иммуномодулирующая способность, т.е. активация противовоспалительных маркеров – ИЛ-4, ИЛ-10, трансформирующий фактор роста бета (англ. transforming growth factor beta, TGF-β). Стимуляция противовоспалительных и подавление каскада провоспалительных маркеров осуществляются посредством инициации иммунных механизмов:
– трансформация наивных лимфоцитов Т-клеток в регуляторные Т-клетки (англ. regulatory T cells, Treg), что способствует подавлению гиперпродукции провоспалительных цитокинов;
– подавление активации макрофагов М1 (отвечающих за продукцию провоспалительных цитокинов) и стимуляция выработки макрофагов М2 (способствующих активации противовоспалительных цитокинов).
И самое главное, DMOADs должны проявлять структурно-модифицирующий эффект – подавлять процессы дегенерации хряща, препятствовать прогрессированию уже имеющихся изменений в хряще, способствовать формированию «новой хрящевой ткани», что отчетливо визуализируется при использовании радиологических методов исследования: рентгенографии, компьютерной томографии (КТ), магнитно-резонансной томографии (МРТ), ультразвукового исследования (УЗИ). Кроме того, структурномодифицирующий эффект оценивается по морфологическим изменениям в хрящевой ткани (гистология) с использованием таких методов, как артроскопия, электронное микроскопирование. Соответственно, структурно-модифицирующий эффект и подавление маркеров воспаления ведет к улучшению состояния пациента (уменьшение боли, улучшение функции) и повышению качества жизни.
На 2019 г. ни один DMOAD не был одобрен регулирующими органами, такими как Управление по контролю за продуктами питания и лекарствами США (англ. USA Food and Drug Administration, FDA) и Европейское агентство по лекарственным средствам (англ. European Medicines Agency, EMA) [1]. В настоящей статье предпринята попытка представить и обсудить те активные действующие вещества/молекулы (в составе ЛП), которые могут рассматриваться в качестве потенциальных DMOADs, основываясь на данных ранее проведенных исследований. Хотелось бы сделать акцент на двух основных подходах к выбору потенциальных DMOADs [7]:
– предпочтительная терапевтическая мишень / зона активного действия препарата (кость, хрящ, синовия);
– механизм действия препарата / антицитокиновая терапия (ингибитор ММП-13, ингибитор ИЛ-1, ИЛ-6, ингибитор TNF-α, NF-κВ, ингибитор индуцируемой синтазы оксида азота (англ. inducible nitric oxide synthase, iNOS) и др.).
Обсуждаются также основные системы доставки (англ. drug delivery systems, DDS) препаратов, претендующих на статус DMOADs [8]: микрочастицы, наночастицы (полимерные наночастицы, мицеллы, липосомы) и гидрогели.
ОСНОВНОЕ ДОСТОИНСТВО ПОТЕНЦИАЛЬНЫХ DMOADs – СПОСОБНОСТЬ РЕГУЛИРОВАТЬ СООТНОШЕНИЕ ПРОИ ПРОТИВОВОСПАЛИИТЕЛЬНЫХ МАРКЕРОВ / THE MAIN ADVANTAGE OF POTENTIAL DMOADs: THE ABILITY TO REGULATE PRO- AND ANTI-INFLAMMATORY MARKERS RATIO
Потенциальные DMOADs должны обладать способностью инактивировать каскад провоспалительных маркеров (ИЛ-1β, ИЛ-6, ИЛ-8, NF-κВ, TNF-α, ММП-1, ММП-13) и активировать противовоспалительные маркеры (ИЛ-4, ИЛ-10, TGF-β).
Медиаторы воспаления, включая ИЛ-8, в тканях межпозвоночных дисков у пациентов с дискогенной болью в спине могут играть ключевую роль в возникновении боли в спине [9]. Аллогенная трансплантация суставных хондроцитов снижает экспрессию гена ИЛ-8 в дегенерирующем межпозвоночном диске кролика in vivo [10]. В другом исследовании [11] in vitro (хрящ кролика) выявлен потенциал ХС в хондрогенной дифференцировке, восстановлении хряща и ингибировании двух важнейших факторов воспаления – простагландина Е2 (ПГЕ2) и оксида азота (англ. nitric oxide, NO). Кроме того, отчетливый противовоспалительный эффект ХС продемонстрирован в снижении iNOS- и PGES1-ферментов, продуцирующих NO и ПГЕ2 соответственно, с помощью иммуногистологии. Таким образом, у ХС отмечена способность стимулировать регенерацию хряща и его потенциал в иммунорегуляции [11].
В экспериментальном исследовании in vitro был создан биомиметический каркас на основе ХС из стволовых клеток [12]. Каркас вводили подкожно мышам, после чего через 24 ч было выявлено снижение инфильтрации лейкоцитов, что коррелировало с большей активацией генов, участвующих в процессах апоптоза воспалительных клеток. Показано, что ХС, иммобилизованный на биомиметическом каркасе, с одной стороны, модулирует воспаление (увеличение продукции NO и ПГЕ2, а также экспрессии индуцируемых ими ферментов iNOS, PGES, циклооксигеназы 2-го типа (ЦОГ-2) и TGF-β), а с другой – стимулирует хондрогенез и усиливает остеогенную дифференцировку стволовых клеток [12].
Среди новых тенденций в фармакотерапии весьма многообещающими являются терапевтические стратегии, основанные на экзосомах [6]. Экзосомы секретируются множеством типов клеток сустава, включая адипоциты, стволовые клетки, полученные из жировой ткани, мезенхимальные стволовые клетки, полученные из синовиальной оболочки, синовиальные фибробласты и макрофаги, хондроциты, остеобласты и остеоциты в субхондральной кости, эндотелиальные клетки сосудов, иммунные клетки (такие как Т-клетки, В-клетки и дендритные клетки), клетки мениска, клетки периодонтальной связки, теноциты, стволовые клетки сухожилий и синовиальной оболочки и клетки, полученные из костного мозга. Экзосомные грузы, которые включают белки, липиды, цитокины и различные подтипы РНК, потенциально способны регулировать межклеточные коммуникации и экспрессию генов в клетках-мишенях и тканях, участвующих в развитии ОА. Экзосомы, полученные из хондроцитов и хондрогенных клеток-предшественников, стимулируют хондрогенез, экзосомы из синовиальных макрофагов регулируют гомеостаз хряща и образование остеофитов. Внутривенная инъекция экзосом, полученных из эмбриональных стволовых клеток, поддерживала фенотип хондроцитов, способствовала восстановлению остеохондральных дефектов и образованию хряща, уменьшала деградацию матрикса и препятствовала разрушению хряща как in vitro, так и при дестабилизации медиального мениска на индуцированной ОА-модели у мышей. Механически эти эффекты были достигнуты за счет стимулирования пролиферации и миграции хондроцитов, увеличения синтеза НК-II и уменьшения экспрессии гена ADAMTS5 (дезинтегрина и металлопротеиназы с тромбоспондиновыми мотивами 5). Таким образом, экзосомы могут рассматриваться в качестве терапии ОА [6].
В ряде исследований при оценке эффектов разных DMOADs ориентируются на их мишени (костная ткань, хрящевая структура, синовиальная оболочка), а терапия DMOADs нацелена на хондроциты или воздействует на них через мезенхимальные стволовые клетки. Данный подход используется с целью продления времени пребывания активного действующего вещества в суставе, вследствие чего ведутся разработки системы DDS. Существует три типа микро/наноносителей ЛП [13]:
– суспензионные носители ЛП, точкой приложения которых является синовиальная жидкость;
– связывающие носители ЛП, действующие на поверхность хряща;
– проницаемые носители ЛП, которые реализуют свои эффекты через глубокое проникновение в хрящ и поверхность субхондральной кости.
Таким образом, именно по месту доставки реализуется DMOAD-эффект.
В одном из исследований показано, что гиалуроновая кислота ингибирует путь NF-κВ, а также экспрессию MMП-1 и ММП-13 и увеличивает экспрессию НК-II [14]. Предлагается воздействовать на НК-II в матриксе хряща и использовать сложную трехмерную структуру внеклеточного матрикса в качестве резервуара для DMOADs, что открывает большие возможности для их проникновения в сустав [14]. Благодаря наличию у НК-II иммунного механизма действия происходит распознавание мишени НК-II в суставном хряще, посредством чего через регуляторные T-лимфоциты секретируют противовоспалительные цитокины (TGF-β, ИЛ-4, ИЛ-10) [15].
В пилотном исследовании 2023 г. [16] показано, что комбинированная терапия олигодезоксинуклеотидами (ОДН) и морфогенным костным белком-7 (МКБ-7) ведет к уменьшению воспаления в синовиально-подобной фиброзной ткани, увеличению образования гликозаминогликанов в хрящевой части костно-хрящевого комплекса. Впервые это исследование продемонстрировало потенциал применения DMOADs на модели искусственного мини-сустава (все компоненты ткани получены путем дифференцировки стволовых клеток костного мозга человека, выделенных из биообразцов ткани пациентов при тотальном эндопротезировании суставов) в разработке DMOADs. Уровни экспрессии репрезентативных хондрогенных генов, включая аггрекан и НК-II, были значительно выше в хряще мини-сустава, обработанного комбинацией ОДН и МКБ-7. Полученные результаты позволяют предположить, что комбинация ОДН и МКБ-7 может оказывать регенеративное действие на хрящ при ОА [16].
ИММУНОЛОГИЧЕСКИЕ МЕХАНИЗМЫ, РЕАЛИЗУЮЩИЕ DMOAD-ЭФФЕКТЫ / IMMUNOLOGICAL MECHANISMS IMPLEMENTING DMOAD EFFECTS
Развитие иммунного ответа определяется клетками врожденного иммунитета – макрофагами. В последние годы макрофаги рассматриваются как потенциальная мишень для регенерации хряща [17]. Макрофаги являются наиболее широко распространенными типами клеток в синовиальной оболочке и располагаются преимущественно в выстилающем слое [18].
Сегодня активно обсуждается эффект врожденного воспаления и роль синовиальных макрофагов в патофизиологии ОА. У пациентов с ОА коленного сустава присутствуют исключительно активированные, а не стабильные формы макрофагов [19]. При ОА макрофаги не в состоянии поддерживать свою стабильность и активируются различными путями. Как правило, они стимулируются молекулярными паттернами, связанными с повреждением (англ. damage associated molecular patterns, DAMPs) [20]. Распределение макрофагов на активированные классическим (М1) и альтернативным (М2) путями генетически детерминировано. Альтернативный путь стимуляции макрофагов запускается при стимуляции клеток ИЛ глюкокортикостероидами, иммунными комплексами и т.д. [21]. Активируясь классическим или альтернативным путем, неактивированные мононуклеарные макрофаги (М0) начинают синтезировать на своей поверхности разные хемокиновые рецепторы (англ. C-C chemokine receptor, CCR), что и обеспечивает различие между макрофагами М1 и М2 [17].
Макрофаги M1 могут индуцироваться интерфероном гамма (англ. interferon gamma, IFN-γ) и липополисахаридом, повышающими экспрессию мембранного белка иммуноглобулинов CD80 и CD86, онкостатина М. Моноциты, подвергнутые воздействию TNF-α, могут поляризовываться до фенотипа M1, что ведет к подавлению ИЛ-10. Стимуляция M1 приводит к выработке NO и большого количества провоспалительных цитокинов. Макрофаги М2 дополнительно подразделяются на подтипы: M2a (индуцируемый ИЛ-4 и ИЛ-13), M2b (индуцируемый агонистами толл-подобных рецепторов (англ. toll-like receptor, TLR)) и M2c (индуцируемый ИЛ-10) [17]. После индукции макрофагов M2 активируется фактор транскрипции гемопоэтических клеток (англ. interferon regulatory factor 4, IRF4), играющих важную роль в процессах развития Т- и В-лимофцитов, который способствует поляризации макрофагов. Макрофаги М2 характеризуются экспрессией маркеров CD163 и CD206 и продукцией аргиназы 1. Эти клетки обладают противовоспалительной функцией, продуцируя ИЛ-10, ИЛ-1RA, хемокиновый лиганд 18 и TGF-β, а также прохондрогенные факторы: TGF-β1, TGF-β2, TGF-β3, инсулиноподобный фактор роста 1 (англ. insulin-like growth factor 1, IGF-1) и IGF-2. Индуцируемый ИЛ-10 подтип M2c играет определенную роль в ремоделировании тканей. Одним из механизмов, с помощью которых мезенхимальные стволовые клетки могут влиять на иммунные клетки, является секреция таких иммунорегулирующих молекул, как TGF-β, фактор роста гепатоцитов, антиген гистосовместимости, ПГЕ2, ИЛ-10 и др. Хорошо изучена взаимосвязь НК-II и макрофагов M2: макрофаги распознают НК-II и способствуют его регенерации, поддерживая гомеостаз внеклеточного матрикса; в свою очередь, НК-II индуцирует поляризацию M2 путем увеличения экспрессии прохондрогенных цитокинов [17].
Через лиганды TLR, хемотоксины под воздействием механизма DAMPs и провоспалительных цитокинов происходит активация макрофагов М1 [18]. Макрофаги М1 сами обладают провоспалительным потенциалом, они отвечают за высвобождение медиаторов, необходимых для инициации и поддержания воспаления (данный тип макрофагов стимулируется IFN-γ), тогда как макрофаги М2 продуцируют много противовоспалительных цитокинов (ИЛ-4, ИЛ-10) [20]. Макрофаги М2 запускают иммунный ответ, который воздействует на внеклеточные изменения, а кроме того, они способствуют ремоделированию поврежденных тканей [22]. Имеются данные о том, что можно индуцировать макрофаги М2, высвобождающие регуляторные цитокины и оказывающие иммуномодулирующее действие на заживление тканей [23]. Было доказано, что макрофаги M2, индуцированные колониестимулирующим фактором макрофагов, усиливают хондрогенез in vitro [24]. Адаптированная схема провоспалительных и прохондрогенных путей макрофагов при повреждении/восстановлении хряща представлена на рисунке 1 [17].
Активировать врожденный клеточный иммунитет возможно также через TLR, которые локализованы на клеточной мембране и способны распознавать бактериальные липополисахариды [25]. Механизм действия TLR связан с провоспалительными цитокинами и лимфоцитами, что включает усиление синтеза NF-κВ-зависимых цитокинов (TNF-α, ИЛ-1, ИЛ-6, IFN-α, IFN-γ) [26], изменение активности хемокиновых рецепторов CCR1, CCR2 и др., повышение синтеза провоспалительных простагландинов, усиление дегрануляции эозинофилов и регуляцию дифференцировки лимфоцитов CD4+ и CD8+ [27], участвующих в механизмах осуществления приобретенного иммунитета. Однако гиперактивность TLR ведет к хронизации воспаления и развитию ряда патологических состояний, включая ОА.
Еще один механизм иммунного ответа запускается Т-лимфоцитами посредством стимуляции иммунного процесса через механизм оральной (кишечной) толерантности [28]. При участии лимфоидной ткани тонкого кишечника (англ. gut-accotiation lymphoid tissue, GALT), мезентериальных лимфатических узлов и участков лимфоидной ткани, окружающей тонкую кишку, в пейеровых бляшках происходит активация наивных T-клеток, которые трансформируются в Treg, и запускается механизм центральной регуляции иммунного ответа. Далее активированные Treg мигрируют из GALT через лимфатическую систему в кровоток и, достигая зоны воспаления в суставе, секретируют противовоспалительные цитокины (TGF-β, ИЛ-4 и ИЛ-10), тем самым подавляя воспалительные реакции [29].
Особый интерес представляет генная терапия, которая пока находится в стадии накопления данных. На 2023 г. обнаружено в общей сложности 29 различных мишеней для генной терапии ОА [30]. В анализ включены исследования, изучающие интерлейкины (ИЛ-1Ra отдельно или в комбинации с другой мишенью – TNF-RI, ИЛ-1RII, ИЛ-10, ИЛ-4, белок гена 6, индуцируемый фактором некроза опухоли (англ. tumor necrosis factor-inducible gene 6, TSG6), модификатор цитокинового ответа A (англ. cytokine response modifier A, CrmA), факторы роста и рецепторы (IGF-1, релаксин, TGF-β1, BMP2 и 4, фоллистатин, GDF-5, FGF-2/bFGF)), а также факторы транскрипции (SOX9 отдельно или в комбинации с другой мишенью – KLF2 и 4 и ATF-4) и другие ключевые мишени, такие как PRG4 (отдельно или в комбинации с другой мишенью), LOXL2, GlcAT-1, GGCX, каллистатин, RHEB, HSP70, PUM1, sCCR2 E3 и LRP3 [30].
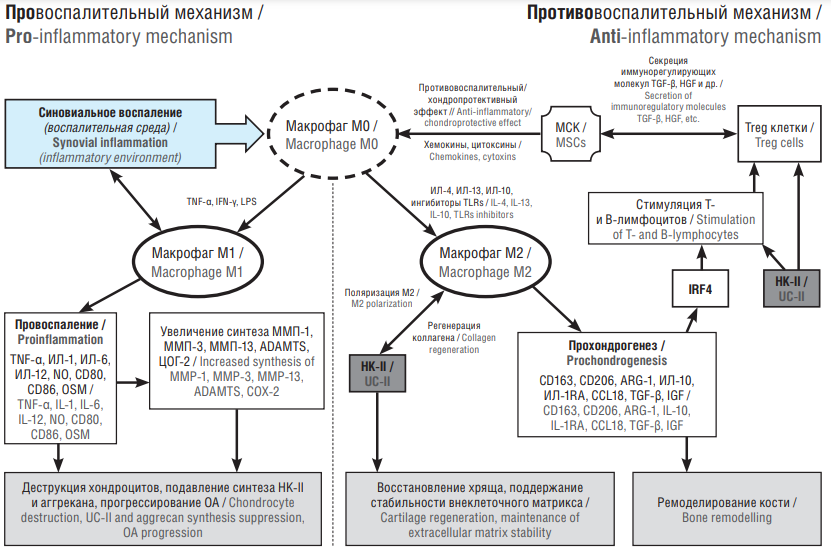
Рисунок 1. Схема иммунологических механизмов макрофагов и лимфоцитов в патогенезе остеоартрита (ОА) [адаптировано по 17].
МСК – мезенхимальные стволовые клетки; TGF-β (англ. transforming growth factor beta) – трансформирующий фактор роста бета; HGF (англ. hepatocyte growth factor) – фактор роста гепатоцитов; Treg (англ. regulatory T cells) – регуляторные Т-клетки; TNF-α (англ. tumor necrosis factor alfa) – фактор некроза опухоли альфа; IFN-γ (англ. interferon gamma) – интерферон гамма; LPS (англ. lipopolysaccharide) – липополисахарид; ИЛ – интерлейкин; TLRs (англ. toll-like receptors) – толл-подобные рецепторы; NO (англ. nitric oxide) – оксид азота; CD80, CD86, CD163, CD206 – мембранные белки иммуноглобулинов; OSM (англ. oncostatin M) – онкостатин М; ММП – металлопротеиназа; ADAMTS – металлопротеиназы, содержащие мотив тромбоспондина; ЦОГ-2 – циклооксигенза 2; НК-II – неденатурированный коллаген II типа; ARG-1 (англ. arginase 1) – аргиназа 1; CCL18 (англ. C-C motif chemokine ligand 18) – хемокиновый лиганд 18; IGF (англ. insulin-like growth factor) – инсулиноподобный фактор роста, IRF4 (англ. interferon regulatory factor) – регуляторный фактор интерферон; ОА – остеоартрит
Figure 1. The layout of the immunological mechanisms of macrophages and lymphocytes in the pathogenesis of osteoarthritis (OA) [adapted from 17].
MSCs – mesenchymal stem cells; TGF-β – transforming growth factor beta; HGF – hepatocyte growth factor; Treg – regulatory T cells; TNF-α – tumour necrosis factor alfa; IFN-γ – interferon gamma; LPS – lipopolysaccharide; IL – interleukin; TLRs – toll-like receptors; NO – nitric oxide; CD80, CD86, CD163, CD206 – membrane proteins of immunoglobulins; OSM – oncostatin M; MMP – metalloproteinase; ADAMTS – metalloproteinases containing thrombospondin motif; COX-2 – cyclooxygenase 2; NC-II – non-denatured type II collagen; ARG-1 – arginase 1; CCL18 – C-C motif chemokine ligand 18; IGF – insulin-like growth factor; IRF4 – interferon regulatory factor; OA – osteoarthritis
ОЦЕНКА ЭФФЕКТИВНОСТИ DMOAD-ТЕРАПИИ / EVALUATION OF DMOAD THERAPY EFFECTIVENESS
Основные клинические ориентиры / Main clinical landmarks
Современное консервативное лечение ОА предполагает применение фармакологических и нефармакологических подходов. Когда все варианты консервативной терапии исчерпаны и не получается облегчить симптомы ОА, тогда рассматривается хирургическое лечение (эндопротезирование). К доступной симптоматической терапии ОА относятся препараты, снимающие симптомы, включая парацетамол, опиоидные анальгетики, нестероидные противовоспалительные препараты (НПВП) и внутрисуставные инъекции (гиалуроновая кислота, стероиды).
В 2016 г. было проведено многоцентровое рандомизированное двойное слепое плацебо-контролируемое исследование по оценке структурно-модифицирующего эффекта на фоне перорального приема комбинации ХС и ГС [31]. В него вошли пациенты с ОА коленного сустава II–III стадий по Келлгрену–Лоуренсу, болью от умеренной до сильной по визуально-аналоговой шкале (ВАШ) – 62,1±11,3 мм, повышенным индексом массы тела – ≥35 кг/м2. Пациенты были рандомизированы в две группы: 1-я группа (n=80, средний возраст 65±8 лет) получала ХС (1200 мг) и ГС (1500 мг), 2-я группа (n=78, средний возраст 67±8 лет) – плацебо в однократной пероральной суточной дозе в течение 6 мес. В исследовании использовали ВАШ для оценки боли, подшкалы боли и функции индекса остеоартрита университетов
Западного Онтарио и Макмастера (англ. Western Ontario and McMaster Universities Osteoarthritis Index, WOMAC), процент ответивших на лечение (согласно критериям OMERACT-OARSI 2004 г.), фиксацию применения обезболивающих «по требованию». Получены статистически значимые различия (p=0,01) между группами по показателю «уменьшение боли, улучшение функции более чем на 50%» (абсолютные изменения ≥20 мм по ВАШ) в группе приема ХС и ГС. Авторы заключили, что ожидавшийся эффект от терапии ХС и ГС не достигнут из-за следующих ограничений [31]:
– высокий процент пациентов с дискомфортом в животе;
– недостаточно большая выборка пациентов;
– активный прием обезболивающих средств (ацетаминофен) пациентами на протяжении всего испытания.
Представлен также анализ результатов исследований, на основании которых сделаны следующие выводы [32]:
– «чистый» ХС (800 мг/сут) при лечении ОА коленного сустава, кисти и тазобедренного сустава клинически эффективен;
– «чистый» ХС (1200 мг/сут) для приема внутрь эффективен и безопасен;
– «чистый» ХС имеет высокий профиль безопасности;
– существует отчетливая разница между «чистым» ХС и фармацевтическими препаратами в составе биологически активных добавок (БАД);
– применение «чистого» ХС фармакоэкономически выгодно.
Данные подтверждают, что «чистый» ХС является эффективным и безопасным препаратом для лечения ОА, причем его эффект проявляется уже через 30 дней. Кроме того, его благотворное действие продлевается и сохраняется по крайней мере в течение 3 мес после отмены препарата [32].
Основные визуальные ориентиры / Main visual landmarks
Авторы подавляющего большинства исследований, посвященных оценке эффективности терапии ОА, для определения степени повреждения хрящевой ткани при ОА придерживаются классификации Международного общества восстановления хрящевой ткани (англ. International Cartilage Regeneration and Joint Preservation Society, ICRS)2 (табл. 1) [33], а при оценке степени выраженности сужения суставной щели ориентируются на рентгенологические стадии ОА по Келлгрену–Лоуренсу (1957 г.) (табл. 2) [34]. Для оценки состояния хрящей, менисков, остеофитов, синовита Хоффа, суставного выпота («выпот – синовит»), в 2020 г. предложена система экспресс-МРТ-оценки при ОА (англ. Rapid Osteoarthritis MRI Eligibility Score, ROAMES) [35]. Клиническая гетерогенность ОА является одной из основных причин неудачи клинических испытаний, что может потребовать применения различных терапевтических подходов, основанных на разных фенотипах ОА (табл. 3) [4, 35].
К сожалению, лишь в небольшом проценте случаев пациентам с ОА проводится регулярный анализ рентгеновских снимков, оценивающих динамику прогрессирования ОА на фоне потенциального DMOAD. Этот факт диктует необходимость длительного наблюдения (средняя продолжительность наблюдения должна составлять 3,7 года) в исследованиях и выборку бо́льших размеров [3]. Однако определение того, какие изменения по ширине суставной щели являются клинически значимыми для пациента с ОА, все еще является предметом дискуссий. В одной из обзорных статей подчеркивается, что пороговое значение оставшегося размера медиальной суставной щели при применении DMOADs составляет (по данным МРТ) 2 мм [4]. Кроме того, отмечено, что пациентов с разрывом корня медального мениска не следует включать в клинические испытания по оценке эффективности DMOADs [4].
Показатели площади поверхности кости при МРТ и формы бедренной кости используются в качестве количественных параметров в клинических испытаниях DMOADs [33]. КТ все чаще используется для 3D-визуализации костной анатомии из-за высокой контрастности кости и мягких тканей [36].
В 2009 г. проведено 2-летнее международное рандомизированное двойное слепое плацебо-контролируемое исследование по рентгенографической оценке долгосрочного влияния ХС-4 и ХС-6 у пациентов с ОА коленного сустава [37]. Больные (n=622) были рандомизированы на две группы: 1-я группа (n=309) получала ХС (800 мг), 2-я группа (n=313) – плацебо 1 раз в день в течение 2 лет. Рентгенограммы были выполнены во время регистрации и через 12, 18 и 24 мес. Минимальную ширину суставной щели медиального отдела большеберцово-бедренного сустава оценивали с помощью анализа цифрового изображения. Основным результатом стала потеря минимальной ширины щели за 2 года. Статистически значимые (р<0,0001) изменения в снижении минимальной потери ширины суставной щели выявлены в группе ХС (–0,07±0,03 мм) против плацебо (–0,31±0,04 мм). Также на фоне приема ХС процент пациентов с рентгенологическим прогрессированием (>0,25 мм) был статистически значимо (р<0,0005) ниже в группе ХС (28% против 41%; относительное снижение риска на 33%). Боль уменьшалась статистически значимо (р<0,01) быстрее в группе ХС. Количество пациентов, нуждавшихся в лечении, в конце исследования составило 8. Различий в безопасности между группами не было. Сделан вывод: долгосрочные комбинированные структурообразующие и симптомокомплексные эффекты ХС позволяют предположить, что он может рассматриваться как DMOAD [37].
Принято считать, что очень важно распознавать различные структурные фенотипы ОА для проведения более целенаправленных клинических исследований, конечная цель которых заключается в разработке персонифицированного подхода в терапии ОА. Инструменты полуколичественного анализа, используемые в ROAMES, облегчают оценку важных характеристик OA и эффективности DMOADs. Выбор подходящих последовательностей МРТ-импульсов в ROAMES и протоколов является ключом к достоверной оценке особенностей визуализации ОА, что наиболее важно для ранней диагностики пред-ОА (0–I степени по Келлгрену–Лоуренсу) [4]. Вполне вероятно, что ЛП – кандидаты на звание DMOADs сначала должны будут продемонстрировать эффективность у больных с симптомами и верифицированным ОА. При выявлении пациентов на самой ранней стадии ОА можно будет лечить их доступными эффективными DMOADs. Появится шанс предотвратить прогрессирование ОА в более запущенный вариант с необратимыми повреждениями, при котором тотальное эндопротезирование коленного сустава (ТЭКС) будет единственным вариантом лечения.
В 2019 г. проведено исследование по оценке с использованием УЗИ и МРТ эффективности комплексного препарата с DMOAD-эффектом: ХС (400 мг) + ГС (500 мг) + НК-II (10 мг) + гарпагофитум (40 мг) [38]. Цель исследования – сравнительная оценка толщины гиалинового хряща бедренной кости у пациентов с ОА коленного сустава (n=20, возраст 40–75 лет, средний возраст 59,3±9,12 года) в исходном состоянии, через 6 и 12 мес и через 1 год. Курс терапии составлял 2 мес. По данным УЗИ были получены статистически значимые различия в толщине хряща коленного сустава через 1 год: медиальный отсек хряща (1,59±0,49 против 1,68±0,49 мм, р=0,0013), межмыщелковая область (1,97±0,66 против 1,98±0,64 мм, p>0,05), латеральный отсек хряща (1,86±0,51 против 1,99±0,47 мм, p=0,0002). Получена высокая корреляция (r=0,63) результатов МРТ с данными УЗИ по значениям толщины хряща, в особенности медиальной части, что позволяет предположить, что УЗИ может быть важным методом оценки гиалинового хряща бедренной кости. Минимальное значение толщины хряща составляло 0,90 мм по данным МРТ, что соответствовало минимальной толщине 0,83 мм по данным УЗИ. Статистически значимые различия получены как в доминантном, так и в недоминантном коленном суставе [38]. Таким образом, УЗИ и МРТ – ценные методы диагностики, дающие сопоставимые результаты в оценке, лечении и мониторинге пациентов с ОА. Метод УЗИ может стать основным инструментом оценки эффектов DMOADs.
Метод артроскопии позволяет обнаружить еле заметные изменения в хрящевой ткани. Используя МРТ 3 Тл с системой трехмерного анализа (МРТ-3D-анализ), можно объективно задокументировать размер, форму, глубину и расположение поражений хряща, в т.ч. в задних отделах бедренной кости [33]. Данную методику рассматривают как один из способов контроля качества при проведении оперативного вмешательства [39]. Целью одного из пилотных исследований, проведенного в 2023 г., была ретроспективная артроскопическая оценка средней толщины хряща, рассчитанная при помощи МРТ-3D-анализа. Обследованы пациенты с ОА коленного сустава (n=102, средний возраст 48±17 лет), которым была выполнена артроскопия для восстановления мениска или остеотомия большой берцовой кости [33]. Все параметры сопоставляли с показателями в соответствии с классификацией ICRS. Средняя толщина хряща, определенная с использованием МРТ-3D-анализа, коррелировала с артроскопической оценкой в 11 из 15 исследуемых областей медиальной области бедра и большеберцовой кости. Авторы заключили, что в данном случае при ретроспективном анализе могли быть упущены некоторые важные моменты, которые требуют уточнения. Однако необходимо собрать гораздо больше доказательств, чтобы МРТ-3D-анализ стал «золотым стандартом» в оценке эффективности качества терапии ОА [36].
В 2022 г. в России проведено открытое проспективное рандомизированное контролируемое исследование (РКИ) по оценке структурно-модифицирующего эффекта ХС (препарат Хондрогард®; ЗАО «ФармФирма «Сотекс», Россия) у пациентов (n=67) с ОА коленного сустава в условиях периоперационной подготовки к эндопротезированию суставов [40]. За 2 мес до ТЭКС по схеме внутримышечно вводили ХС курсом 25 инъекций. Было выполнено морфологическое исследование биообразцов тканей пациентов (субхондральной кости, суставного хряща бедренной и большеберцовой костей, суставной капсулы). Исследование продемонстрировало, что применение ХС приводит к адаптивной перестройке на клеточном и тканевом уровнях во всех слоях гиалинового хряща у пациентов с ОА коленного сустава. Под поверхностным слоем выявлены округлые клетки, напоминающие малодифференцированные хондроциты. Именно эти результаты позволяют заключить, что ХС обладает структурно-модифицирующим действием, которое отмечено даже на III–IV стадиях ОА [40].
Подход с учетом DMOAD-мишеней / An approach considering DMOAD targets
В 2022 г. представлен метаанализ 24 РКИ, оценивающих эффективность различных молекул с точки зрения DMOAD-терапии [2]. Все РКИ относились ко II и III фазам клинических испытаний, были активны или завершены на период 2017–2024 гг. DMOAD-эффекты оценивали по трем основным терапевтическим мишеням: по воздействию на кость, синовию и хрящ. Для анализа были выбраны действующие вещества, которые претендовали на пересмотр/репозиционирование ввиду наличия у них DMOAD-эффектов, и «новые» действующие вещества. Все исследуемые препараты были систематизированы по месту приложения их воздействия на ткани сустава. По результатам проведенного анализа авторы сделали следующие выводы [2]:
– во многих РКИ исследуемые «новые» DMOADs продемонстрировали симптоматическое улучшение при длительном наблюдении;
– попытки репозиционирования рассматриваемых кандидатов в категорию DMOADs при оценке их структурно-модифицирующего эффекта пока остаются безуспешными;
– перспективно использование новых методологий и техник DSS, которые будут способствовать появлению DMOADs для пациентов с ОА.
Данный метаанализ [2] имел избирательный характер, т.к. в него были включены только некоторые представители потенциальных DMOADs.
Российскими учеными еще в 2020 г. был проведен метаанализ 8 РКИ по оценке исследований клинической эффективности препарата Хондрогард® (ХС) в терапии ОА [41]. В таблице 4 представлены обобщенные результаты всех указанных РКИ.
В аналитическом обзоре 2023 г. использован аналогичный подход для оценки эффектов DMOADs [42]. Проанализированы данные 25 РКИ (II и III фазы исследования). Представлены разные группы DMOADs с учетом их основных мишеней (табл. 5). По результатам проведенного исследования авторами сделан вывод: только несколько фармацевтических препаратов предотвращают потерю хряща или сохраняют субхондральную кость при ОА (сприфермин, MIV-711). Кроме того, остается неясным, каким образом положительные структурно-модифицирующие эффекты, наблюдаемые при применении нескольких DMOADs, могут обеспечивать их клинические преимущества, а также долгосрочную эффективность и безопасность. Ингибиторы протеиназы, бисфосфонаты и биологические препараты (включая ингибиторы ИЛ-1β и ингибиторы TNF-α) не дали положительных результатов при ОА [42].
Клиническая гетерогенность ОА является одной из серьезных проблем при разработке DMOADs, поскольку различные фенотипы могут потребовать специфической терапии. Благодаря достижениям в области технологий определения различных биомаркеров, визуализации и эффективных DSS в лечении ОА достигнут значительный прогресс, несмотря на проблемы с ЛП, модифицирующими заболевание, и персонализированной медициной. Таким образом, большинство биологических препаратов (включая ингибиторы ИЛ-1 и TNF-α, сприфермин и бисфосфонаты) не дали удовлетворительных результатов в лечении ОА.
В 2023 г. сформулированы различные типы подходов к определению принадлежности препаратов к категории DMOADs (антицитокиновая терапия, ингибиторы ферментов, факторы роста, генная терапия, пептиды и др.) [8], но пока не доказано, что данные виды воздействий полностью эффективны и безопасны для лечения ОА. Кроме того, сообщалось о значительных побочных эффектах при системном применении DMOADs. До тех пор пока будущие исследования не смогут доказать, что DMOADs эффективны у пациентов с ОА в восстановлении и регенерации пораженных тканей, следует продолжать применять методы лечения, направленные исключительно на облегчение боли в суставах.
ОЧЕВИДНЫЕ ПРЕИМУЩЕСТВА ПОТЕНЦИАЛЬНЫХ DMOADs (ХС, ГС, НК-II) В ТЕРАПИИ ОСТЕОАРТРИТА / OBVIOUS ADVANTAGES OF POTENTIAL DMOADs (CS, GS, UC-II) IN OSTEOARTHRITIS THERAPY
В 2008 г. уже было выдвинуто предположение, что противовоспалительный эффект ХС связан со снижением активации митоген-активируемых протеинкиназ (англ. mitogen-activated protein kinase, MAPK), NF-κВ и активаторного белка 1, благодаря чему ХС предотвращает сужение суставной щели коленного сустава [45].
Изучаются симптом-модифицирующие эффекты НК-II, его
влияние на выраженность болевого синдрома и сенсорные нарушения (аллодинию), сопровождающие воспалительный отек. Также исследуются молекулярные механизмы действия НК-II, которые влияют на функцию дискоидиновых рецепторов 2 (англ. discoidin domain-containing receptor 2, DDR-2), опосредованное угнетение ЦОГ-2, провоспалительных цитокинов (ИЛ-1β, ИЛ-6, ИЛ-8, ММП-1, ММП-3, ММП-13, ММП-14, NF-κB), белки внутриклеточной передачи сигналов (MAPK-p38) [28, 29, 46].
Препараты, используемые для лечения ОА, включают селективные ингибиторы фермента ЦОГ-2, НПВП, глюкокортикостероиды, добавки для повышения вязкости и другие традиционные средства. Однако введение ЛП непосредственно в полость сустава может только облегчить симптомы воспаления и замедлить прогрессирование заболевания, но не способно обратить вспять течение болезни и вылечить ОА. Кроме того, у препаратов есть и недостатки, заключающиеся в том, что они легко выводятся из организма и могут вызвать побочные реакции. Как ожидается, DMOADs изменят патофизиологию, лежащую в основе ОА, путем приостановки структурных изменений в суставе и облегчения симптомов.
Одним из первых упоминаний о ХС как о ЛП со структурным и болезнь-модифицирующим ОА эффектом (англ. structure/disease-modifying osteoarthritis drug, S/DMOAD) относится к 1998 г. [47]. Было проведено рандомизированное двойное слепое плацебо-контролируемое исследование с участием 119 пациентов с ОА мелких суставов кисти, 34 из которых ежедневно принимали ХС (1200 мг/сут). Исследование проводилось на протяжении 3-летнего периода наблюдения с использованием рентгенографии межфаланговых суставов (в начале исследования и с ежегодным обследованием), что позволило рентгенологически задокументировать прогрессирование патологических изменений в суставах пальцев. Пациентов разделили на подгруппы в зависимости от степени выраженности ОА: N (сустав не затронут), S (классический ОА), J (сужение суставной щели), E (эрозивный ОА) и R (реконструированный сустав). В ходе 3-летнего наблюдения в группе пациентов с ОА, получавших ХС, только в 8,8% случаев отмечено прогрессирование ОА до уровня E (2,9% из подгруппы S и 5,9% из подгруппы J). В группе, не получавшей терапию ХС, у 42,4% больных отмечено прогрессирование ОА до уровня E ( (20,0% из подгруппы S и 22,4% из подгруппы J). Тогда бельгийские врачи впервые предложили рассматривать ХС как препарат, препятствующий прогрессии ОА мелких суставов кисти [47].
В 2021 г. для оценки сравнительной эффективности пероральных форм DMOADs (ХС, ГС, неомыляемые соединения авокадо и сои (НСАС), диацереин, бисфосфонаты, доксициклин, ликофелон, ранелат стронция, ингибиторы ММП, витамин E, витамин D, ингибиторы индуцируемой синтазы оксида азота) были проанализированы 28 РКИ с участием пациентов с ОА коленного или тазобедренного сустава (n=11 890) [48]. Одним из критериев включения в анализ была длительность терапии (не менее 12 мес, 6 мес для МРТ). Акцент был сделан на оценку положительной динамики структурных изменений в суставе (ширина суставной щели, объем хряща) и клинические симптомы (боль, функция). Авторы сделали вывод, что только ХС и ГС обладают умеренно выраженными структурными эффектами, клиническая же эффективность других ЛП оказалась незначительной [48]. Таким образом, из всех исследуемых DMOADs только ХС и ГС имеют убедительное долгосрочное выраженное структурно-модифицирующее действие.
На экспериментальных моделях и у пациентов с ОА отмечено уменьшение выраженности боли в суставах (по ВАШ), повышение выносливости, подвижности и улучшение функционального состояния суставов (по WOMAC) на фоне терапии НК-II (10–40 мг/сут) [46].
Продемонстрированы противовоспалительный, анальгезирующий и долгосрочный структурно-модифицирующий (хрящевая ткань, субхондральная кость) эффекты парентеральной формы ХС у пациентов с ОА коленного сустава (n=67) III степени в условиях проведения ТЭКС [49]. Получено статистически значимое снижение:
– выраженности болевого синдрома (ВАШ в покое, при ходьбе);
– уровня функциональной недостаточности (индексы WOMAC и Лекена, шкала оценки исходов травмы колена и ОА (англ. Knee and Osteoarthritis Outcome Score, KOOS));
– уровней всех биомаркеров в крови при увеличении концентраций остеокальцина и 25(ОН)D3 при выписке из стационара и через 3 мес после ТЭКС (в отличие от пациентов, принимавших только НПВП).
Также выявлены признаки адаптивной перестройки во всех слоях гиалинового хряща и уменьшения выраженности воспаления в синовиальной оболочке на момент проведения ТЭКС, тогда как в группе НПВП в гиалиновом хряще отмечено увеличение содержания дистрофически измененных хондроцитов, рыхло расположенного зернистого компонента (протеогликаны), отдельных тонких коллагеновых фибрилл, а также экссудативное воспаление высокого уровня в синовиальной оболочке. Полученные данные позволяют рекомендовать применение парентеральной формы ХС в установленном эффективном и безопасном режиме за 2 мес до проведения ТЭКС с целью улучшения ближайших и отдаленных функциональных результатов оперативного вмешательства [49].
В 2022 г. опубликован анализ 24 систематических обзоров, 150 оригинальных статей и метаанализов, посвященных влиянию на исход терапии и улучшение качества жизни пациентов с ревматическими заболеваниями и заболеваниями опорно-двигательного аппарата диет, лежащих в основе рекомендаций Европейской лиги против ревматизма (англ. European League against Rheumatism, EULAR) 2021 г. [50]. Установлено, что умеренно выраженным эффектом по влиянию на боль и функцию обладают субстанции ХС, ГС, НСАС (табл. 6). Эта характеристика эффектов оказалась наивысшей. Выраженного эффекта не имела ни одна из исследуемых субстанций. Пока что существует большая неоднородность в отношении влияния той или иной субстанции на все проявления. Из всех оцененных диет и используемых БАД умеренная доказательность достигнута только для четырех позиций (рыбий жир, ХС, ГС, витамин D, НСАС), при этом величина эффекта для исходов оказалась незначительной, а следовательно, клинически незначимой [50].
На основании проведенного анализа результатов ряда исследований можно заключить, что ХС, ГС, НК-II, а также витамин D обладают доказанным симптом- и структурно-модифицирующим действием и могут быть отнесены к категории потенциальных DMOADs. Применение фармаконутрицевтиков на основе указанных действующих веществ позволяет влиять на все звенья патогенеза ОА, а в конечном счете – замедлять прогрессию ОА и улучшать качество жизни пациентов. Суммированная схема проанализированной информации об основных DMOAD-эффектах и методах их оценки представлена на рисунке 2. Хондрогард® ТРИО (владелец товарного знака ЗАО «ФармФирма «Сотекс», свидетельство № 831357) – фармаконутрицевтик группы потенциальных DMOADs для нутритивной поддержки пациентов с ОА, содержащий суточные дозы изученных молекул ХС, ГС и НК-II.
Таблица 1. Степени повреждения суставного хряща по классификации Международного общества по восстановлению хрящевой ткани (англ. International Cartilage Regeneration and Joint Preservation Society, ICRS) [33]
Table 1. Degrees of joint cartilage damage according to the International Cartilage Regeneration and Joint Preservation Society (ICRS) [33]
|
Степень / Degree |
Определение / Definition |
Описание / Description |
|
0 |
Интактный хрящ / Intact cartilage |
Хрящ без макроскопически заметных дефектов / Cartilage without macroscopically visible defects |
|
I |
Поверхностное повреждение хряща / Superficial cartilage damage |
А – мягкое углубление / A – soft spots В – хрящ имеет поверхностные разломы и трещины / |
|
II |
Глубина повреждения хряща <50% от глубины хряща / Depth of cartilage damage <50% of cartilage depth |
Повреждение распространяется глубже, но менее чем на 50% глубины хряща / The damage extends deeper but less than 50% of cartilage depth |
|
III |
Глубина повреждения хряща >50% от глубины хряща, а также вплоть до обызвествленного слоя / Depth of cartilage damage >50% of cartilage depth and up to the calcified layer |
А – дефект более 50%, но не до обызвествленного слоя / A – defect over 50%, but not to the calcified layer В – вплоть до обызвествленного слоя / B – up to the calcified layer С – вплоть до субхондральной костной пластинки, но не насквозь / C – down to the subchondral bone plate, but not through it D – дефект более 50%, с волдырями / D – defect over 50%, with blisters |
|
IV |
Дефект хряща во всю толщину / полный разрыв хряща с обнажением субхондральной кости // Full thickness cartilage defect / complete cartilage rupture with exposure of subchondral bone |
А – дефект включает поверхностную субхондральную костную пластинку / A – defect involves the superficial subchondral bone plate В – дефект распространяется на всю глубину субхондральной кости / B – defect extends through the entire depth of the subchondral bone |
Таблица 2. Рентгенологические стадии остеоартрита коленного сустава по Келлгрену–Лоуренсу (1957 г.) [34]
Table 2. Kellgren–Lawrence radiological stages of knee joint osteoarthritis (1957 г.) [34]
|
Степень / Degree |
Определение / Definition |
Описание / Description |
|
0 |
Норма / Norm |
Отсутствие изменений / No changes |
|
I |
Сомнительная / Questionable |
Незначительные остеофиты, истончение хрящевой ткани / Minor osteophytes, cartilage thinning |
|
II |
Минимальная / Mild |
Четко выраженные единичные остеофиты и минимальное сужение суставной щели / Clearly defined single osteophytes and minimal joint gap narrowing |
|
III |
Умеренная / Moderate |
Умеренное сужение суставной щели и множественные остеофиты / Moderate joint gap narrowing and multiple osteophytes |
|
IV |
Тяжелая / Severe |
Выраженное сужение суставной щели с субхондральным склерозом, грубые остеофиты / Severe joint gap narrowing with subchondral sclerosis, coarse osteophytes |
Таблица 3. Фенотипы остеоартрита коленного сустава, основанные на системе быстрой магнитно-резонансной оценки (англ. Rapid Osteoarthritis MRI Eligibility Score, ROAMES) [4, 35]
Table 3. Phenotypes of knee osteoarthritis based on the Rapid Osteoarthritis MRI Eligibility Score (ROAMES) [4, 35]
|
Фенотип / Phenotype |
Описание / Description |
|
Воспалительный / Inflammatory |
Максимальная оценка 3 по синовиту Хоффа или выпотному синовиту и по крайней мере 2 по соответствующему другому признаку на основе MOAKS / Maximum score 3 for Hoffa's synovitis or effusion synovitis and at least 2 for the corresponding other feature based on MOAKS |
|
Хрящ-мениск / Meniscus-cartilage |
Наличие повреждения мениска не менее 3-й степени (т.е. потеря/мацерация вещества мениска любого типа) в медиальном или латеральном отделе и не менее 1-й степени (разрыв любого типа) в другом отделе, наличие повреждений хряща 2.1, 2.2, 3.2 или 3.3 степени по MOAKS // Presence of at least grade 3 meniscus injury (i.e., loss/maceration of meniscus substance of any type) in medial or lateral compartment and at least grade 1 (tear of any type) in the other compartment, presence of MOAKS grades 2.1, 2.2, 3.2, or 3.3 cartilage damage |
|
Субхондральная кость / Subchondral bone |
Субрегиональное поражение костного мозга 3-й степени по крайней мере в одном из трех отделов коленного сустава / Grade 3 subregional bone marrow lesion in at least one of three knee joint regions |
|
Атрофический / Atrophic |
Остеофиты ≤ 1 во всех локализациях ББС и повреждение хряща 3-й степени по крайней мере в одном субрегионе MOAKS одного или обоих отделов ББС / Osteophytes ≤ 1 in all TFJ localizations and |
|
Гипертрофический / Hypertrophic |
По крайней мере один остеофит 3-й степени в медиальной зоне ББС или латеральной зоне ББС и КБС, повреждение хряща не более 1-й степени в любом субрегионе того же отдела ББС / At least one grade 3 osteophyte in TFJ medial zone or TFJ and KHJ lateral zone, cartilage damage of no more than grade 1 in any subregion of the same TFJ section |
Примечание. MOAKS (англ. Magnetic Resonance Osteoarthritis Knee Score) – магнитно-резонансного оценка остеоартрита коленного сустава; ББС – большеберцово-бедренный сустав; КБС – коленно-бедренный сустав.
Note. MOAKS – Magnetic Resonance Osteoarthritis Knee Score; TFJ – tibiofemoral joint; KHJ – knee-hip joint.
Таблица 4. Терапевтические мишени болезнь-модифицирующих остеоартрит препаратов в тканях сустава (данные рандомизированных клинических исследований)
Table 4. Therapeutic targets of disease-modifying osteoarthritis drugs in joint tissues (data from randomized clinical trials)
|
Мишень / Target |
Результаты исследований [41] / Study results [41] |
Результаты исследований [2] / Study results [2] |
|
|
Действующие вещества, подлежащие репозиционированию / Active substances to be repositioned |
«Новые» действующие вещества / “New” active substances |
||
|
Субхондральная кость / |
Хондроитина сульфат (в/м) // Chondroitin sulphate (i/m) |
Гормон паращитовидной железы (терипаратид, п/к), антирезорбтивные средства (золедроновая кислота, в/в), антирезорбтивные средства (денозумаб, п/к), витамин D (п/о), клодронат (в/с) // Parathyroid hormone (teriparatide, s/c), antiresorptive agents (zoledronic acid, i/v), antiresorptive agents (denosumab, s/c), vitamin D (oral), clodronate (i/a) |
Ингибиторы катепсина К (п/о), матриксный внеклеточный фосфогликопротеин (в/с) // Cathepsin K inhibitors (oral), matrix extracellular phosphoglycoprotein (i/a) |
|
Хрящ / Cartilage |
Хондроитина сульфат (в/м) // Chondroitin sulphate (i/m) |
– |
Ингибиторы дезинтегрина и ADAMTS-5 (п/о), FGF18 (в/с), генная терапия (в/с), ингибиторы сигнального пути Wnt/β-катенина (в/с), сенолитик (в/с), ANGPTL3 (в/с) // Disintegrin and ADAMTS-5 inhibitors (oral), FGF18 (i/a), gene therapy (i/a), Wnt/β-catenin signalling pathway inhibitors (i/a), senolytic (i/a), ANGPTL3 (i/a) |
|
Синовия / Sinovia |
Хондроитина сульфат (в/м) // Chondroitin sulphate (i/m) |
Противоревматический препарат (метотрексат, п/о), противоревматический препарат (гидроксихлорохин, п/о), ингибитор TNF-α (этанерцепт, п/к), ингибитор ИЛ-6 (тоцилизумаб, в/в) // Antirheumatic drug (methotrexate, oral), antirheumatic drug (hydroxychloroquine, oral), TNF-α inhibitor (etanercept, s/c), IL-6 inhibitor (tocilizumab, i/v) |
ДНК-плазмид с трансгеном ИЛ-10 (в/с), ингибитор ИЛ-1 (диасереин, п/о) // |
Примечание. в/м – внутримышечно; п/к – подкожно; в/в –внутривенно; п/о – перорально; в/с – внутрисуставно; TNF-α (англ. tumor necrosis factor alfa) – фактор некроза опухоли альфа; ИЛ – интерлейкин; ADAMTS-5 (англ. A disintegrin and metalloproteinase with thrombospondin motifs 5) – дезинтегрин А и металлопротеиназа с тромбоспондиновыми мотивами 5; FGF18 (англ. fibroblast growth factor 18) – фактор роста фибробластов 18; ANGPTL3 (англ. angiopoietin-like 3 protein) – ангиопоэтиноподобный белок 3; ДНК – дезоксирибонуклеиновая кислота.
Note. i/m – intramuscular; s/c – subcutaneous; i/v – intravenous; i/a – intra-articular; TNF-α – tumour necrosis factor alpha; IL – interleukin; ADAMTS-5 – A disintegrin and metalloproteinase with thrombospondin motifs 5; FGF18 – fibroblast growth factor 18; ANGPTL3 – angiopoietin-like protein 3; DNA – deoxyribonucleic acid.
Таблица 5. Систематизация болезнь-модифицирующих остеоартрит препаратов в зависимости от воздействия на различные структуры сустава
Table 5. Systematization of disease-modifying osteoarthritis drugs according to their effects on different joint structurеs
|
Мишень / Target |
Результаты исследований [18, 28, 38, 43–45] / Study results |
Результаты исследования [42] / Study results [42] |
|
|
Группа препаратов / Group of drugs |
Представители / Drugs |
||
|
Синовия / Synovia |
Хондроитина сульфат (в/м), глюкозамина сульфат (п/о), неденатурированный коллаген II типа (п/о) // Chondroitin sulphate (i/m), glucosamine sulphate (oral), undenatured type II collagen (oral) |
Ингибиторы ИЛ-1 / IL-1 inhibitors |
Гевокизумаб (п/к), лутикизумаб (п/к), анакинна (в/с), канакинумаб (в/с), диацереин (п/о) // Gevokizumab (s/c), luticizumab (s/c), anakinna (i/a), canakinumab (i/a), diacerein (oral) |
|
Глюкозамина сульфат (п/о), неденатурированный коллаген II типа (п/о) // Glucosamine sulphate (oral), undenatured collagen type II (oral) |
Ингибиторы TNF-α / TNF-α inhibitors |
Адалимумаб (п/к), этанерцепт (п/к), инфликсимаб (в/с) // Adalimumab (s/c), etanercept (s/c), infliximab (i/a) |
|
|
Неденатурированный коллаген II типа (п/о) // Undenatured collagen type II (oral) |
Сенолитики / Senolytics |
БАД физетин (п/о) // |
|
|
– |
Экстракт куркумы длинной (п/о) // Turmeric extract (oral) |
– |
|
|
Хрящ / Cartilage |
– |
FGF18 |
Сприфермин (в/с) // Sprifermine (i/a) |
|
Хондроитина сульфат (в/м), неденатурированный коллаген II типа (п/о) // Chondroitin sulphate (i/m), undenatured collagen type II (oral) |
Ингибиторы протеиназы / Proteinase inhibitors |
– |
|
|
– |
Ингибиторы передачи сигналов Wnt / Inhibitors of Wnt signal transduction |
Лорецививинт (в/с) // |
|
|
Неденатурированный коллаген II типа (п/о) // Undenatured collagen type II (oral) |
TGF-β |
TG-C (в/с) // TG-C (i/a) |
|
|
– |
Модулятор MAPK / MAPK modulator |
Метформин (п/о) // Metformin (oral) |
|
|
– |
Обогащенная тромбоцитами плазма / Platelet-enriched plasma |
Человеческая тромбоцитарная плазма (в/с) // Human platelet |
|
|
Субхондральная кость / Subchondral bone |
– |
Витамин D (п/о) // Vitamin D (oral) |
|
|
– |
Ингибиторы катепсина К / |
MIV-711 (п/о) // MIV-711 (oral) |
|
|
– |
Паратиреоидный гормон / Parathyroid hormone |
Терипаратид (п/к) // Teriparatide (s/c) |
|
|
– |
Матриксный внеклеточный фосфогликопротеин / Matrix extracellular phosphoglycoprotein |
TPX-100 (в/с) // TPX-100 (i/a) |
|
|
– |
Бисфосфонаты / Bisphosphonates |
Золедроновая кислота / |
|
|
Глюкозамина сульфат (п/о), неденатурированный коллаген II типа (п/о) // Glucosamine sulphate (oral), undenatured type II collagen (oral) |
TGF-β |
TG-C |
|
|
– |
Стронция ранелат / Strontium ranelate |
– |
|
Примечание. в/м – внутримышечно; п/о – перорально; п/к – подкожно; в/с – внутрисуставно; ИЛ – интерлейкин; TNF-α (англ. tumor necrosis factor alfa) – фактор некроза опухоли альфа; FGF18 (англ. fibroblast growth factor 18) – фактор роста фибробластов 18; TGF-β (англ. transforming growth factor beta) – трансформирующий фактор роста бета; MAPK (англ. monophosphate-activated protein kinase) – монофосфат-активируемая протеинкиназа, БАД – биологически активная добавка; TG-C (англ. tissue gene C) – тканевой ген С; MIV-711 – оригинальное название лекарственного препарата; TPX (англ. thyroparathyroidectomized) – тиреопаратиреоидэктомированный гормон паращитовидной железы.
Note. i/m – intramuscular; s/c – subcutaneous; i/a – intra-articular; IL – interleukin; TNF-α – tumour necrosis factor alfa; FGF18 – fibroblast growth factor 18; TGF-β – transforming growth factor beta; MAPK – monophosphate-activated protein kinase; BAA – biologically active additive; TG-C – tissue gene C; MIV-711 – original name of the medicinal product; TPX – thyroparathyroidectomized parathyroid hormone.
Таблица 6 (начало). Сравнение видов диет и нутрицевтиков (биологически активных добавок) по силе выраженности, качеству клинического проявления и уровню доказательности симптом-модифицирующего и структурно-модифицирующего эффектов при остеоартрите [50]
Table 6 (beginning). Comparison of diets and nutraceuticals (dietary supplements) according to the effect size and quality of the clinical manifestation of the symptom-modifying effect and structure-modifying effects in osteoarthritis [50]
|
Параметр / Parameter |
Выраженность эффекта / Effect size |
|||
|
Отсутствует / None |
Незначительный / Small |
Умеренный / Meduim |
Выраженный / Large |
|
|
Высокая степень выраженности клинического проявления эффекта / High quality of the clinical manifestation of effect |
||||
|
– |
– |
– |
– |
– |
|
Средняя степень выраженности клинического проявления эффекта / Moderate quality of the clinical manifestation of effect |
||||
|
Боль, функция / Pain, function |
Рыбий жир / Fish oil |
ХС, ГС, эргокальциферол (витамин D), НСАС / |
– |
– |
|
Низкая степень выраженности клинического проявления эффекта / Low quality of the clinical manifestation of effect |
||||
|
Боль / Pain |
Вишневый сок, экстракт Элеагнуса узколистного + Босвеллии турифера, чеснок, гранат, токоферол (витамин E) / Cherry juice, Elaeagnus angustifoli + Boswellia thurifera extract, garlic, pomegranate, vitamin E |
Аргановое масло, полосатый змееголов (рыба), экстракт Элеагнуса узколистного, фруктовые экстракты в форме порошка, экстракт зеленогубой мидии, низкокалорийная диета, МСМ, мультивитамины / Argan oil, Channa striatus, Elaeagnus angustifoli extract, fruit powder, green lipped mussel extract, low calorie diet, MSM, multi-vitamins |
Босвеллия cеррата, коллаген, клетчатка / Boswellia serrata, collagen, fibre |
Куркума лонга, куркумин, Лактобактерии казеи штамма Shirota, экстракт сосновой коры, микс экстрактов шиповника обыкновенного / Curcuma longa, curcumin, Lactobacillus casei shirota, pine tree extract, Rosa canina mix |
|
Функция / Function |
Вишневый сок, экстракт Элеагнуса узколистного + Босвеллии турифера, чеснок, гранат, токоферол (витамин E) / Cherry juice, Elaeagnus angustifoli + Boswellia thurifera extract, garlic, pomegranate, vitamin E |
Экстракт Элеагнуса узколистного, фруктовые экстракты в форме порошка, низкокалорийная диета / Elaeagnus angustifoli extract, fruit powder, low calorie diet |
Аргановое масло, Босвеллия серрата, полосатый змееголов (рыба), коллаген / Argan oil, Boswellia serrata, Channa striatus, collagen |
Куркума лонга, куркумин, Лактобактерии казеи штамма Shirota, МСМ, экстракт сосновой коры, микс экстрактов шиповника обыкновенного / Curcuma longa, curcumin, Lactobacillus casei shirota, MSM, pine tree extract, Rosa canina mix |
|
Скованность / Stiffness |
– |
– |
Лактобактерии казеи штамма Shirota / Lactobacillus casei shirota |
– |
|
Риск прогрессирования рентгенологических изменений / Risk of progression of radiological changes |
Аскорбиновая кислота (витамин С) / Vitamin C |
Эргокальциферол (витамин D) / Vitamin D |
Жир, молоко / Fat, milk |
– |
|
Очень низкая степень выраженности клинического проявления эффекта / Very low quality of the clinical manifestation of effect |
||||
|
Боль / Pain |
Бромелаин, имбирь, экстракт зеленого чая, экстракт гвианского кошачьего когтя, вегетарианская диета, цианокобаламин (витамин B12) / Bromelain, ginger, green tea extract, Uncaria guianensis extract, WFPB diet, vitamin B12 |
Биологически активный кальций Аквамин, полынь однолетняя, ниацин (витамин B3), аскорбиновая кислота (витамин С) + токоферол (витамин E) / Aquamin, Artemisia annua, vitamin B3, vitamin C + vitamin E |
Креатин, мембрана яичной скорлупы, мультиминералы, гидролизованный морской коллаген, экстракт морских водорослей, порошок черного кунжута, длинная куркума / Creatine, egg-shell membrane, multi-mineral, promerim, seaweed extract, sesame powder, turmeric |
Левокарнитин, экстракт маракуйи, экстракт амурского бархата / L-carnitine, passion fruit extract, Phellodendron amurense extract |
Таблица 6 (окончание). Сравнение видов диет и нутрицевтиков (биологически активных добавок) по силе выраженности, качеству клинического проявления и уровню доказательности симптом-модифицирующего и структурно-модифицирующего эффектов при остеоартрите [50]
Table 6 (end). Comparison of diets and nutraceuticals (dietary supplements) according to the effect size and quality of the clinical manifestation of the symptom-modifying effect and structure-modifying effects in osteoarthritis [50]
|
Параметр / Parameter |
Сила эффекта / Effect size |
|||
|
Отсутствует / None |
Незначительный / Small |
Умеренный / Meduim |
Выраженный / Large |
|
|
Функция / Function |
Полынь однолетняя, экстракт зеленого чая, средиземноморская диета / Artemisia annua, green tea extract, Mediterranean diet |
Бромелаин / Bromelain |
Биологически активный кальций Аквамин, креатин, мембрана яичной скорлупы, мультиминералы, экстракт морских водорослей / Aquamin, creatine, egg-shell membrane, multi-mineral, seaweed extract |
Левокарнитин, экстракт маракуйи / L-carnitine, passion fruit extract |
|
Скованность / Stiffness |
– |
– |
Мембрана яичной скорлупы / Egg-shell membrane |
– |
|
6-минутный тест ходьбы / 6-minute walk test |
Шлемник байкальский, акация катеху / Scutellaria baicalensis, Acacia catechu |
– |
– |
– |
|
СРБ, СОЭ / CRP, ESR |
Шлемник байкальский, акация катеху / Scutellaria baicalensis, Acacia catechu |
– |
– |
Фруктоборат кальция / Calcium fructoborate |
Примечание. СРБ – С-реактивный белок; СОЭ – скорость оседания эритроцитов; ХС – хондроитина сульфат; ГС – глюкозамина сульфат; НСАС – неомыляемые соединения авокадо и сои; МСМ – метилсульфонилметан.
Note. CRP – C-reactive protein; ESR – erythrocyte sedimentation rate; CS – chondroitin sulfate; GS – glucosamine sulfate; ASU – avocado and soybean unsaponifiables;
MSM – methylsulfonylmethane; WFPB – whole food plant based.
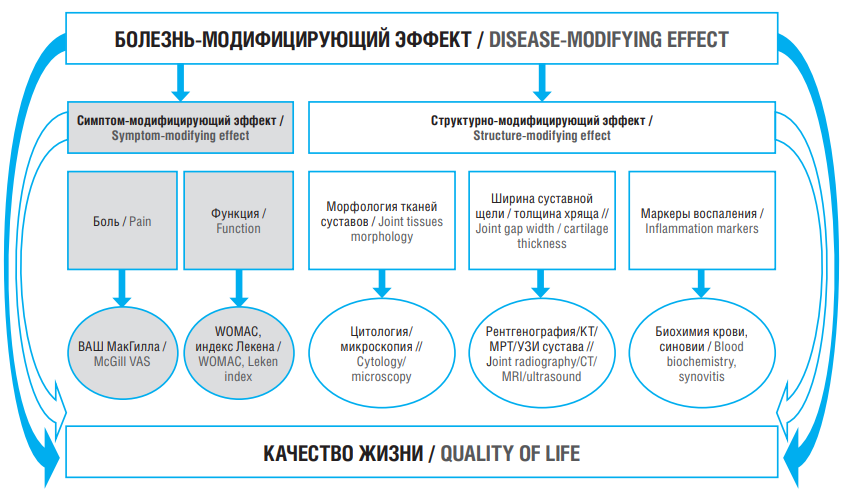
Рисунок 2. Основные эффекты терапии болезнь-модифицирующими остеоартрит препаратами и методы их оценки.
ВАШ – визуально-аналоговая шкала; WOMAC (англ. Western Ontario and McMaster Universities Osteoarthritis Index) – индекс остеоартрита университетов Западного Онтарио и Макмастера; КТ – компьютерная томография; МРТ – магнитно-резонансная томография; УЗИ – ультразвуковое исследование
Figure 2. The main effects of therapy with disease-modifying osteoarthritis drugs and methods of their evaluation.
VAS – visual analogue scale; WOMAC – Western Ontario and McMaster Universities Osteoarthritis Index; CT – computed tomography; MRI – magnetic resonance imaging
ЗАКЛЮЧЕНИЕ / CONCLUSION
Рассматриваются, изучаются, разрабатываются разные подходы к оценке DMOADs. Клинические данные по их применению находятся в стадии накопления, которое сопровождается высокими ожиданиями от будущего применения данных препаратов.
На основании проведенного анализа результатов исследований в качестве потенциальных DMOADs можно рассмотреть такие субстанции, как ХС, ГС, НК-II, витамин D. Каждая из них обладает симптом-модифицирующим и структурно-модифицирующим действием.
1. PGES (англ. рrostaglandin E synthase) – простагландин Е-синтаза.
2. http://www.cartilage.org/.
Список литературы
1. Oo W.M., Little C., Hunter D.J. The development of disease-modifying therapies for osteoarthritis (DMOADS): the evidence to date. Drug Des Devel Ther. 2021; 15: 2921–45. https://doi.org/10.2147/DDDT.S295224.
2. Oo W.M., Hunter D.J. Repurposed and investigational disease-modifying drugs in osteoarthritis (DMOADs). Ther Adv Musculoskel Dis. 2022; 14: 1759720X221090297. https://doi.org/10.1177/1759720X221090297.
3. Oo W.M., Hunter D.J. Disease modification in osteoarthritis: are we there yet? Clin Exp Rheumatol. 2019; 37 (Suppl. 120 (5)): 135–40.
4. Guermazi A., Roemer F.W., Crema M.D., et al. Strategic application of imaging in DMOAD clinical trials: focus on eligibility, drug delivery, and semiquantitative assessment of structural progression. Ther Adv Musculoskelet Dis. 2023; 15: 1759720X231165558. https://doi.org/10.1177/1759720X231165558.
5. Skiöldebrand E., Adepu S., Lützelschwab C., et al. A randomized, triple-blinded controlled clinical study with a novel disease-modifying drug combination in equine lameness-associated osteoarthritis. Osteoarthr Cartil Open. 2023; 5 (3): 100381. https://doi.org/10.1016/j.ocarto.2023.100381.
6. Fan Y., Li Z., He Y. Exosomes in the pathogenesis, progression, and treatment of osteoarthritis. Bioengineering. 2022; 9: 99. https://doi.org/10.3390/bioengineering9030099.
7. Makarczyk M.J., Gao Q., He Y., et al. Current models for development of disease-modifying osteoarthritis drugs. Tissue Eng Part C Methods. 2021; 27 (2): 124–38. https://doi.org/10.1089/ten.TEC.2020.0309.
8. Rodriguez-Merchan E.C. The current role of disease-modifying osteoarthritis drugs. Arch Bone Jt Surg. 2023; 11 (1): 11–22. https://doi.org/10.22038/ABJS.2021.56530.2807.
9. Brent J.M., Tian Z., Yao L., et al. Functional deficits in mice expressing human interleukin 8. Comp Med. 2020; 70 (3): 205–15. https://doi.org/10.30802/AALAS-CM-19-000049.
10. Zhang Y., Chee A., Shi P., et al. Allogeneic articular chondrocyte transplantation down regulates interleukin 8 gene expression in the degenerating rabbit intervertebral disk in vivo. Am J Phys Med Rehabil. 2015; 94: 530–8. https://doi.org/10.1097/PHM.0000000000000194.
11. Chen S., Chen W., Chen Y., et al. Chondroitin sulfate modified 3D porous electrospun nanofiber scaffolds promote cartilage regeneration. Mater Sci Eng C Mater Biol Appl. 2021; 118: 111312. https://doi.org/10.1016/j.msec.2020.111312.
12. Corradetti B., Taraballi F., Minardi S., et al. Chondroitin sulfate immobilized on a biomimetic scaffold modulates inflammation while driving chondrogenesis. Stem Cells Transl Med. 2016; 5: 670–82. https://doi.org/10.5966/sctm.2015-0233.
13. Huanga H., Loua Z., Zhenga S., et al. Intra-articular drug delivery systems for osteoarthritis therapy: shifting from sustained release to enhancing penetration into cartilage. Drug Delivery. 2022; 29 (1): 767–91. https://doi.org/10.1080/10717544.2022.2048130.
14. Wang J., Wang X., Cao Y., et al. Therapeutic potential of hyaluronic acid/chitosan nanoparticles for the delivery of curcuminoid in knee osteoarthritis and an in vitro evaluation in chondrocytes. Int J Mol Med. 2018; 42: 2604–14. https://doi.org/10.3892/ijmm.2018.3817.
15. Gencoglu H., Orhan C., Sahin E., Sahin K. Undenatured type II collagen (UC-II) in joint health and disease: a review on the current knowledge of companion animals. Animals (Basel). 2020; 10 (4): 697. https://doi.org/10.3390/ani10040697.
16. Makarczyk M.J., Hines S., Yagi H., et al. Using microphysiological system for the development of treatments for joint inflammation and associated cartilage loss – a pilot study. Biomolecules. 2023; 13: 384. https://doi.org/10.3390/biom13020384.
17. Fernandes T.L., Gomoll A.H., Lattermann C., et al. Macrophage: a potential target on cartilage regeneration. Front Immunol. 2020; 11: 111. https://doi.org/10.3389/fimmu.2020.00111.
18. Griffin T.M., Scanzello C.R. Innate inflammation and synovial macrophages in osteoarthritis pathophysiology. Clin Exp Rheumatol. 2019; 37 (Suppl. 120): 57–63.
19. Nedunchezhiyan U., Varughese I., Sun A.R., et al. Obesity, inflammation, and immune system in osteoarthritis. Front Immunol. 2022; 13: 907750. https://doi.org/10.3389/fimmu.2022.907750.
20. Wang W., Chu Y., Zhang P., et al. Targeting macrophage polarization as a promising therapeutic strategy for the treatment of osteoarthritis. Int Immunopharmacol. 2023; 116: 109790. https://doi.org/10.1016/j.intimp.2023.109790.
21. Mantovani A., Sica A., Sozzani S., et al. The chemokine system in diverse forms of macrophage activation and polarization. Trends Immunol. 2004; 25 (12): 677–86. https://doi.org/10.1016/j.it.2004.09.015.
22. Martinez F.O., Sica A., Mantovani A., Locati M. Macrophage activation and polarization. Front Biosci. 2008; 1 (13): 453–61. https://doi.org/10.2741/2692.
23. Dai M., Sui B., Xue Y., et al. Cartilage repair in degenerative osteoarthritis mediated by squid type II collagen via immunomodulating activation of M2 macrophages, inhibiting apoptosis and hypertrophy of chondrocytes. Biomaterials. 2018; 180: 91–103. https://doi.org/10.1016/j.biomaterials.2018.07.011.
24. Lepage S.I.M., Robson N., Gilmore H., et al. Beyond cartilage repair: the role of the osteochondral unit in joint health and disease. Tissue Eng Part B Rev. 2019; 25: 114–25. https://doi.org/10.1089/ten.teb.2018.0122.
25. Торшин И.Ю., Громова О.А., Лила А.М. и др. Толл-подобные рецепторы как компонент патофизиологии остеоартрита: противовоспалительное, анальгетическое и нейропротекторное действие. Неврология, нейропсихиатрия, психосоматика. 2021; 13 (4): 123–9. https://doi.org/10.14412/2074-2711-2021-4-123-129.
26. Miller R.E., Scanzello C.R., Malfait A.M. An emerging role for Toll-like receptors at the neuroimmune interface in osteoarthritis. Semin Immunopathol. 2019; 41 (5): 583–94. https://doi.org/10.1007/s00281-019-00762-3.
27. Li Y.S., Luo W., Zhu S.A., Lei G.H. T-cells in osteoarthritis: alterations and beyond. Front Immunol. 2017; 8: 356. https://doi.org/10.3389/fimmu.2017.00356.
28. Громова О.А., Торшин И.Ю., Лила А.М., Шавловская О.А. О перспективах использования неденатурированного коллагена II типа в терапии остеоартрита и других заболеваний суставов. Современная ревматология. 2022; 16 (4): 111–6. https://doi.org/10.14412/1996-7012-2022-4-111-116.
29. Шавловская О.А., Юхновская Ю.Д., Романов И.Д., Бокова И.А. Фармаконутрицевтик Хондрогард® ТРИО – хондропротектор, обладающий иммуномодулирующим действием. Неврология, нейропсихиатрия, психосоматика. 2023; 15 (4): 105–11. https://doi.org/10.14412/2074-2711-2023-4-105-111.
30. Uebelhoer M., Lambert C., Grisart J., et al. Interleukins, growth factors, and transcription factors are key targets for gene therapy in osteoarthritis: a scoping review. Front Med. 2023; 10: 1148623. https://doi.org/10.3389/fmed.2023.1148623.
31. Roman-Blas J.A., Castañeda S., Sánchez-Pernaute O., et al. Chondroitin sulfate plus glucosamine sulfate shows no superiority over placebo in a randomized, double-blind, placebo-controlled clinical trial in patients with knee osteoarthritis. Arthritis Rheumatol. 2017; 69 (1): 77–85. https://doi.org/10.1002/art.39819.
32. Reginster J.V., Veronese N. Highly purified chondroitin sulfate: a literature review on clinical efficacy and pharmacoeconomic aspects in osteoarthritis treatment. Aging Clin Exp Res. 2021; 33 (1): 37–47. https://doi.org/10.1007/s40520-020-01643-8.
33. Ozeki N., Koga H., Nakagawa Y., et al. Association between knee cartilage thickness determined by magnetic resonance imaging three-dimensional analysis and the International Cartilage Repair Society (ICRS) arthroscopic grade. Knee. 2023; 42: 90–8. https://doi.org/10.1016/j.knee.2023.02.005.
34. Li X., Roemer F.W., Flavia Cicuttini F., et al. Early knee OA definition-what do we know at this stage? An imaging perspective. Ther Adv Musculoskelet Dis. 2023; 15: 1759720X231158204. https://doi.org/10.1177/1759720X231158204.
35. Roemer F.W., Collins J., Kwoh C.K., et al. MRI based screening for structural definition of eligibility in clinical DMOAD trials: Rapid Osteoarthritis MRI Eligibility Score (ROAMES). Osteoarthritis Cartilage. 2020; 28 (1): 71–81. https://doi.org/10.1016/j.joca.2019.08.005.
36. Brett A., Bowes M.A., Conaghan P.G. Comparison of 3D quantitative osteoarthritis imaging biomarkers from paired CT and MR images: data from the IMI-APPROACH study. BMC Musculoskelet Disord. 2023; 24 (1): 76. https://doi.org/10.1186/s12891-023-06187-2.
37. Kahan A., Uebelhart D., De Vathaire F., et al. Long-term effects of chondroitins 4 and 6 sulfate on knee osteoarthritis: the study on osteoarthritis progression prevention, a two-year, randomized, double-blind, placebo-controlled trial. Arthritis Rheum. 2009; 60 (2): 524–33. https://doi.org/10.1002/art.24255.
38. Vreju F.A., Ciurea P.L., Rosu A., et al. The effect of glucosamine, chondroitin and harpagophytum procumbens on femoral hyaline cartilage thickness in patients with knee osteoarthritis – an MRI versus ultrasonography study. J Mind Med Sci. 2019; 6 (1): 162–8. https://doi.org/10.22543/7674.61.P162168.
39. van der Meijden O.A., Gaskill T.R., Millett P.J. Glenohumeral joint preservation: a review of management options for young, active patients with osteoarthritis. Adv Orthop. 2012; 2012: 160923. https://doi.org/10.1155/2012/160923.
40. Минасов Т.Б., Лила А.М., Назаренко А.Г. и др. Морфологические проявления действия высокоочищенного хондроитина сульфата у пациентов с декомпенсированной формой остеоартрита коленных суставов. Современная ревматология. 2022; 16 (6): 55–63.
41. Торшин И.Ю., Лила А.М., Наумов А.В. и др. Метаанализ клинических исследований эффективности лечения остеоартита препаратом Хондрогард. ФАРМАКОЭКОНОМИКА. Современная фармакоэкономика и фармакоэпидемиология. 2020; 13 (4): 388–99. https://doi.org/10.17749/2070-4909/farmakoekonomika.2020.066.
42. Li S., Cao P., Chen T., Ding C. Latest insights in disease-modifying osteoarthritis drugs development. Ther Adv Musculoskelet Dis. 2023; 15: 1759720X231169839. https://doi.org/10.1177/1759720X231169839.
43. Громова О.А., Торшин И.Ю., Лила А.М., Громов А.Н. Молекулярные механизмы глюкозамина сульфата при лечении дегенеративно-дистрофических заболеваний суставов и позвоночника: результаты протеомного анализа. Неврология, нейропсихиатрия, психосоматика. 2018; 10 (2): 38–44. https://doi.org/10.14412/2074-2711-2018-2-38-44.
44. Kim H., Seo J., Lee Y., et al. The current state of the osteoarthritis drug development pipeline: a comprehensive narrative review of the present challenges and future opportunities. Ther Adv Musculo-skelet Dis. 2022; 14: 1759720X221085952. https://doi.org/10.1177/1759720X221085952.
45. Jomphe C., Gabriac M., Haleet T.M., et al. Chondroitin sulfate inhibits the nuclear translocation of nuclear factor-kappa B in interleukin-1 beta-stimulated chondrocytes. Basic Clin Pharmacol Toxicol. 2008; 102 (1): 59–65. https://doi.org/10.1111/j.1742-7843.2007.00158.x.
46. Шавловская О.А., Громова О.А., Торшин И.Ю. Точки приложения неденатурированного коллагена II типа в терапии скелетно-мышечных болевых синдромов. Журнал неврологии и психиатрии им. С.С. Корсакова. 2022; 122 (11): 40–5. https://doi.org/10.17116/jnevro202212211140.
47. Verbruggen G., Goemaere S., Veys E.M. Chondroitin sulfate: S/DMOAD (structure/disease modifying anti-osteoarthritis drug) in the treatment of finger joint OA. Osteoarthritis Cartilage. 1998; Suppl. A: 37–8. https://doi.org/10.1016/s1063-4584(98)80010-1.
48. Yang W., Sun C., He S.Q., et al. The efficacy and safety of disease-modifying osteoarthritis drugs for knee and hip osteoarthritis – systematic review and network meta-analysis. J Gen Intern Med. 2021; 36 (7): 2085–93. https://doi.org/10.1007/s11606-021-06755-z.
49. Сарвилина И.В., Минасов Т.Б., Лила А.М. и др. Об эффективности парентеральной формы высокоочищенного хондроитина сульфата в режиме периоперационной подготовки к эндопротезированию коленных суставов. Русский медицинский журнал. 2022; 7: 7–16.
50. Gwinnutt J.M., Wieczorek M., Rodriguez-Carrio J., et al. Effects of diet on the outcomes of rheumatic and musculoskeletal diseases (RMDs): systematic review and meta-analyses informing the 2021 EULAR recommendations for lifestyle improvements in people with RMDs. RMD Open. 2022; 8 (2): e002167. https://doi.org/10.1136/rmdopen-2021-002167.
Об авторах
О. А. ШавловскаяРоссия
д.м.н., профессор кафедры организации медицинской реабилитации и санаторно-курортного лечения АНО ВО «Международный университет восстановительной медицины»
Фурманный пер., д. 8, стр. 2, Москва 105062
О. А. Громова
Россия
д.м.н., ведущий научный сотрудник ФИЦ «Информатика и управление» РАН
ул. Вавилова, д. 44, корп. 2, Москва 211933
А. Ю. Кочиш
Россия
д.м.н., профессор, заместитель директора ФГБУ «Национальный медицинский исследовательский центр травматологии и ортопедии им. Р.Р. Вредена» Минздрава России
ул. Академика Байкова, д. 8, Санкт-Петербург 195427
Ю. Д. Юхновская
Россия
клинический ординатор кафедры клинической иммунологии и аллергологии ФГАОУ ВО «Первый Московский государственный медицинский университет им. И.М. Сеченова» Минздрава России
ул. Трубецкая, д. 8, стр. 2, Москва 119991
И. Д. Романов
Россия
врач-невролог, руководитель по научной и консультативной неврологической помощи ООО «МД Клиник»
ул. Дмитриевского, д. 11, Москва 111675
И. А. Бокова
Россия
к.м.н., доцент кафедры восстановительной медицины, реабилитации и курортологии ФГАОУ ВО «Первый Московский государственный медицинский университет им. И.М. Сеченова» Минздрава России (Сеченовский университет)
ул. Трубецкая, д. 8, стр. 2, Москва 119991
Рецензия
Для цитирования:
Шавловская О.А., Громова О.А., Кочиш А.Ю., Юхновская Ю.Д., Романов И.Д., Бокова И.А. Болезнь-модифицирующие остеоартрит препараты (DMOADs) – новые тенденции в терапии пациентов с остеоартритом. ФАРМАКОЭКОНОМИКА. Современная фармакоэкономика и фармакоэпидемиология. 2023;16(3):482-499. https://doi.org/10.17749/2070-4909/farmakoekonomika.2023.207
For citation:
Shavlovskaya O.A., Gromova О.А., Kochish A.Yu., Yukhnovskaya Yu.D., Romanov I.D., Bokova I.A. Disease-modifying osteoarthritis drugs (DMOADs): new trends in osteoarthritis therapy. FARMAKOEKONOMIKA. Modern Pharmacoeconomics and Pharmacoepidemiology. 2023;16(3):482-499. (In Russ.) https://doi.org/10.17749/2070-4909/farmakoekonomika.2023.207

Контент доступен под лицензией Creative Commons Attribution-NonCommercial-ShareAlike 4.0 International License.






































