Перейти к:
Молекулярная фармакология коэнзима Q10 в контексте лечения гиперлипидемических состояний
https://doi.org/10.17749/2070-4909/farmakoekonomika.2023.186
Аннотация
Актуальность. Терапия гиперлипидемии посредством синтетических статиновых препаратов характеризуется рядом побочных эффектов. В частности, статин-зависимая миопатия возникает в результате ингибирования статинами процессов биосинтеза кофактора коэнзим Q10 (англ. coenzyme Q10, CoQ10), играющего центральную роль в цепях переноса электронов при синтезе аденозинтрифосфата (АТФ) в митохондриях.
Цель: систематический анализ научной литературы по фармакологии коэнзима Q10 с акцентом на его воздействие на липидный профиль.
Материал и методы. В анализ включено 16 788 статей, найденных по запросу “coenzyme Q10 OR ubiquinone” в базе данных биомедицинских публикаций PubMed/MEDLINE. Использованы методы топологического и метрического анализа больших данных, разрабатываемые в научной школе академика РАН Ю.И. Журавлева.
Результаты. Установлен гораздо более широкий диапазон фармакологических эффектов CoQ10, чем просто поддержка биосинтеза АТФ. Коэнзим Q10 оказывает выраженное липидоснижающее, антиастеническое, противовоспалительное действие и может успешно использоваться в терапии астенических состояний, сердечно-сосудистой патологии (в т.ч. гиперлипидемии и миопатии, вызванной статинами), нарушений углеводного обмена (инсулинорезистентность) и множества неврологических заболеваний. Дотации CoQ10 на 50% снижают смертность у пациентов с сердечно-сосудистыми заболеваниями, улучшают гликемический контроль при инсулинорезистентности, функцию почек, полезны в терапии мигрени и нейродегенеративных патологий (болезнь Паркинсона и др.).
Заключение. Экспериментальные данные и доказательная база указывают на перспективность использования CoQ10 у пациентов с гиперлипидемией и другими заболеваниями сердечно-сосудистой системы.
Ключевые слова
Для цитирования:
Громова О.А., Торшин И.Ю. Молекулярная фармакология коэнзима Q10 в контексте лечения гиперлипидемических состояний. ФАРМАКОЭКОНОМИКА. Современная фармакоэкономика и фармакоэпидемиология. 2023;16(2):345-357. https://doi.org/10.17749/2070-4909/farmakoekonomika.2023.186
For citation:
Gromova O.A., Torshin I.Yu. Molecular pharmacology of coenzyme Q10 in the context of treatment of hyperlipidemic conditions. FARMAKOEKONOMIKA. Modern Pharmacoeconomics and Pharmacoepidemiology. 2023;16(2):345-357. (In Russ.) https://doi.org/10.17749/2070-4909/farmakoekonomika.2023.186
ВВЕДЕНИЕ / INTRODUCTION
Высокий уровень общего холестерина является одним из основных модифицируемых факторов риска сердечно-сосудистых заболеваний (ССЗ). Статины могут применяться не у всех пациентов, поскольку в результате их приема уровень креатинкиназы может повышаться в 10–40 раз при развитии рабдомиолиза. Тяжелые формы статин-индуцированной миопатии характеризуются выраженной фибромиалгией, мышечным некрозом и миоглобинурией, приводящей к почечной недостаточности и смерти [1].
Одним из наиболее перспективных направлений лечения гиперхолестеринемии является использование экстрактов красного риса и ферментированного красного риса (ЭФКР), которые содержат полифенолы, проантоцианидины и природные статины (не менее 13, в т.ч. монаколин К) [1]. Сравнительный хемореактомный анализ природных статинов (монаколины K, J, L) и синтетических статинов (аторвастатин, флувастатин) указывает на преимущества природных статинов [2]:
- дифференцированное накопление в тканях;
- отсутствие избыточной активации системы выделения ксенобиотиков;
- выраженное противовоспалительное, цитопротекторное и противоопухолевое действие.
Стандартизированные ЭФКР применяются у пациентов с низким и умеренным риском ССЗ, у которых не обнаруживаются липопротеины низкой плотности, отсутствуют показания к терапии статинами или имеется непереносимость статинов [3]. Их эффекты могут быть усилены синергидными микронутриентами. Например, никотинамид (ниацин, витамин РР) необходим для синтеза никотинамида аденина динуклеотида, который является коферментом белков, вовлеченных в синтез аденозинтрифосфата (АТФ) из жиров и углеводов. В систематическом анализе 70 417 публикаций по никотинамиду описаны вазопротекторные, противовоспалительные, антиатеросклеротические и кардиопротекторные эффекты никотинамида [4].
Весьма важный синергист ЭФКР – коэнзим Q10 (англ. coenzyme Q10, CoQ10), также известный как убихинон, витамин Q. Обеспеченность организма этим коэнзимом принципиально важна для функции митохондрий. В биохимии известны три состояния окисления CoQ10: полностью окисленное (убихинон), полуокисленное (убисемихинон) и полностью восстановленное (убихинол) [5]. Способность CoQ10 действовать как донор-акцептор и переносчик электронов при оксилительно-восстановительных процессах обусловливает центральную роль CoQ10 в цепи переноса электронов от ферментов с железосерными кластерами [6].
Недостаточность CoQ10 в организме связана с митохондриальными заболеваниями, возрастным окислительным стрессом, канцерогенезом, побочными эффектами статинов, ССЗ и нейродегенеративными расстройствами, диабетом, фибромиалгией [7] и бесплодием у мужчин [8]. Статиновые препараты (особенно синтетические) блокируют выработку промежуточного соединения мевалоната (биохимический путь, ведущий к выработке CoQ10), истощают депо CoQ10 в мышцах, приводя к фибромиалгии и судорогам.
Цель – систематический анализ научной литературы по фармакологии CoQ10 с акцентом на его воздействие на липидный профиль.
МАТЕРИАЛ И МЕТОДЫ / MATERIAL AND METHODS
По запросу “coenzyme Q10 OR ubiquinone” в базе данных биомедицинских публикаций PubMed/MEDLINE было найдено 16 788 статей.
Систематический анализ / Systematic analysis
Проведен систематический компьютеризованный анализ массива публикаций с целью изучения основных фармакологических свойств CoQ10 с акцентом на его воздействие на липидный профиль. Анализ литературы выполнен с использованием современных методов топологического и метрического анализа больших данных, разрабатываемых в научной школе академика РАН Ю.И. Журавлева [9–11].
В ходе систематического анализа выделено 129 информативных биомедицинских терминов, отличающих исследования по фармакологии CoQ10 от публикаций в контрольной выборке. В качестве контрольной выборки использовали 28 308 статей, найденных по запросу “((Humans [MeSH Terms] OR Animals [MeSH Terms]) AND (Phospholipids/chemistry [MeSH Terms])) OR (RNA, Ribosomal, 16S/genetics [MeSH Terms] AND Bacterial Typing Techniques [MeSH Terms] AND Phylogeny [MeSH Terms])”.
Выбор перечисленных выше ключевых слов для формирования контрольной группы был сделан на основе наиболее часто встречающихся терминов в выборке публикаций по CoQ10, которые не имеют отношения к фармакологии CoQ10. Аннотация терминов с помощью референсных таблиц позволила рубрицировать тексты исследований по соответствующим молекулярно-биологическим процессам согласно международной номенклатуре Gene Ontology (GO) и построить терминологическую карту молекулярно-физиологического действия CoQ10.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ / RESULTS AND DISCUSSION
Фармакологические эффекты CoQ10 / CoQ10 pharmacological effects
Наиболее информативные ключевые слова, описывающие фармакологию CoQ10, на метрической карте сгруппированы в четыре кластера, включающие последствия дефицита Q10 (кластер 1), аномалии развития (кластер 2), неврологические нарушения (кластер 3) и дисфункцию миокарда и других мышц (кластер 4) (рис. 1).

Рисунок 1. Метрическая карта наиболее информативных терминов, описывающих фармакологические эффекты CoQ10. Расстояние между точками, соответствующими терминам, обратно пропорционально совместной встречаемости терминов в исследованной выборке публикаций (чем ближе две произвольные точки, тем чаще встречается совместное употребление двух соответствующих терминов).
АТФ – аденозинтрифосфат; ГАМК – гамма-аминомасляная кислота; КоА – коэнзим А
Figure 1. Metric map of the most informative terms describing the pharmacological effects of CoQ10. The distance between the points corresponding to the terms is inversely proportional to the joint occurrence of terms in the studied sample of publications (the closer two arbitrary points are, the more often the joint use of the two corresponding terms occurs)
В кластер 1 сгруппированы термины из публикаций, в которых изучались последствия сниженной обеспеченности СоQ10. Поскольку в наибольшем количестве CoQ10 и его производные представлены именно в митохондриях, недостаточная обеспеченность организма CoQ10 неизбежно связана с митохондриальными заболеваниями и соответствующей симптоматикой (утомляемость, надпочечниковая недостаточность, низкая фракция сердечного выброса, нервно-мышечные заболевания, миалгия, боль в спине, кахексия, беспокойство). Дефицит «митохондриального» микронутриента СоQ10 ассоциирован с нарушениями обмена и других микронутриентов (авитаминозы и дефициты жирорастворимых витаминов Е, А, D3), что способствует развитию различных хронических патологий (I25 Хроническая ишемическая болезнь сердца, N19 Почечная недостаточность неуточненная, G70.9 Нарушение нервно-мышечного синапса неуточненное, K76.9 Болезнь печени неуточненная, F20 Шизофрения). И наоборот, дотации CoQ10 снижают смертность от ССЗ, улучшают гликемический контроль, поддерживают функцию почек у пациентов с хроническим заболеванием почек и уменьшают воспаление печени при неалкогольной жировой болезни печени [12].
В кластер 2 входят термины, описывающие молекулярно-биологические аспекты дефицита СоQ10, которые включают не только дисфункцию митохондрий (GO:1990613 Митохондриальная мембрана, GO:1902775 Сборка рибосомы митохондрий), но и нарушения метаболизма аминокислот (GO:0019470 Катаболизм 4-гидроксипролина, GO:0071268 Биосинтез гомоцистеина), стероидов (GO:0045940 Активация метаболизма стероидов), ретиноидов (GO:0052885 Биосинтез 11-цис-ретинола), гормонов (GO:0038106 Связывание хориогонадотропина), жирных кислот (GO:0004466 Длинноцепочечная ацил-КоА-дегидрогеназа, GO:2001306 Биосинтез липоксина В4), инозитолфосфатов (GO:0008440 Инозитол-1,4,5-трифосфат-3-киназа). Эти нарушения связаны с аномалиями роста тканей и органов (GO:0090017 Формирование нервной пластинки, GO:0097187 Дентиногенез), что может способствовать развитию различных патологий (перегрузка железом, H54 Слепота и пониженное зрение, Q90 Синдром Дауна, F84.0 Детский аутизм).
Существенная группа исследований СоQ10 связана с изучением молекулярно-биологических и клинических аспектов неврологических последствий дефицита СоQ10 (кластер 3), включающих нарушения обмена аминокислотных нейротрансмиттеров: гамма-аминомасляной кислоты (ГАМК) (GO:0008503 Бензодиазепиновые рецепторы, GO:0003867 ГАМК трансаминаза, GO:0016917 Рецептор ГАМК), глутамата (GO:0019556 Катаболизм гистидина до глутамата и формамида, GO:0008068 Хлоридный канал, управляемый глутаматом), глицина (GO:0060012 Глицинергические сигналы) и других факторов, участвующих в росте и восстановлении нервной ткани (GO:0061564 Развитие аксона, GO:0006021 Биосинтез инозитола, GO:0031403 Связывание ионов лития, GO:0038046 Рецептор энкефалина, GO:0070054 Сплайсинг мРНК, GO:0015349 Транспортер тиреоидных гормонов). Как результат, дефицит СоQ10 сопровождается рядом невромышечных патологий (периферическая невропатия, митохондриальная миопатия, митохондриальные энцефаломиопатии, G62.9 Полиневропатия неуточненная, G24 Дистония, G43 Мигрень, G40.9 Эпилепсия неуточненная).
Действительно, дотации CoQ10 полезны при лечении некоторых неврологических заболеваний, таких как мигрень, болезнь Паркинсона, болезнь Гентингтона, болезнь Альцгеймера, боковой амиотрофический склероз, атаксия Фридрейха, рассеянный склероз [13], аутизм, эпилепсия, депрессия и биполярное расстройство (которые также связаны с митохондриальными нарушениями) [14].
Поскольку мышцы являются одной из самых энергоемких тканей, то недостаточная обеспеченность СоQ10 обязательно вызывает нарушения мышечной функции (кластер 4). СоQ10 важен для процессов роста всех видов мышечной ткани (GO:0010830 Дифференцировка миоцитов, GO:0014876 Регуляция адаптации мышц, GO:1904117 Клеточный ответ на вазопрессин), в т.ч. миокарда (GO:0003230 Развитие предсердия, GO:0055004 Сборка миофибрилл миокарда, GO:0060419 Рост тканей сердца). Поэтому дефицит СоQ10 неизбежно приводит к дисфункции скелетной мускулатуры (M79.7 Фибромиалгия, G72.9 Миопатия неуточненная, G93.3 Синдром утомляемости после перенесенной вирусной болезни; ацидоз, гиперлактатемия) и сердечной мускулатуры (I42 Кардиомиопатия, I42.0 Дилатационная кардиомиопатия, I51.5 Дегенерация миокарда, I50 Сердечная недостаточность). Дефицит CoQ10 тесно связан с кардиометаболическими нарушениями, включая гипертонию, ишемическую болезнь сердца (ИБС), инфаркт миокарда, хроническую сердечную недостаточность (ХСН), артериальную гипертензию (АГ), вирусный миокардит, кардиомиопатии, дислипидемию, ожирение, сахарный диабет 2-го типа, метаболический синдром. Тяжесть ХСН коррелирует с серьезностью дефицита CoQ10, который стабилизирует кальций-зависимые ионные каналы миокарда и важен для усиления биосинтеза АТФ [15].
Механизмы воздействия дефицита СоQ10 на патофизиологию этих заболеваний связаны как с функцией митохондрий (GO:0033615 Сборка митохондриальной АТФ-синтазы, GO:1904231 Активация сукцинат дегидрогеназы, GO:0019265 Биосинтез глицина путем переаминирования глиоксилата), так и со специфическими сигнальными путями (GO:0060408 Регуляция метаболизма ацетилхолина, GO:0031812 Пуринергический рецептор P2Y1, GO:0016521 Активация аденилатциклазы гипофиза, GO:0038163 Сигнальный путь тромбопоэтина, GO:0004676 3-фосфоинозитид протеинкиназа, GO:0002878 Негативная регуляция острого воспалительного ответа). Дефицит СоQ10 также приводит к нарушениям углеводного метаболизма (E11 Инсулинонезависимый сахарный диабет, E08 Сахарный диабет вследствие других патологий). Помимо своей роли в митохондриальном окислительном фосфорилировании CoQ10 служит жирорастворимым антиоксидантом, играет важную роль в метаболизме жирных кислот, пиримидинов и лизосом и непосредственно опосредует экспрессию генов, участвующих в воспалении [16].
Следует также отметить, что в протеоме человека известны 192 белка, которые так или иначе вовлечены в метаболизм коэнзима Q10. Анализ молекулярных свойств этих белков, в т.ч. метаболических мишеней CoQ10 в митохондриях [17], позволил бы существенно расширить понимание молекулярных ролей СоQ10. Однако такой анализ выходит за рамки настоящего исследования.
В целом коэнзим Q10 проявляет выраженные липидоснижающие, антиастенические, противовоспалительные эффекты. Он может успешно использоваться в терапии астенических состояний, ССЗ (в т.ч. гиперлипидемии и миопатии, вызванной статинами), нарушений углеводного обмена (инсулинорезистентность) и широкого круга неврологических заболеваний. В настоящей статье сделан акцент на применение СоQ10 в терапии сердечно-сосудистых и цереброваскулярных заболеваний, ассоциированных с атеросклерозом.
Недостаточность, фармакокинетика и фармакодинамика CoQ10 / CoQ10 insufficiency, pharmacokinetics and pharmacodynamics
Существует два основных пути формирования недостаточности/дефицита CoQ10: снижение биосинтеза и повышенный расход CoQ10 организмом. Биосинтез в организме – основной источник CoQ10. Для него требуется активность как минимум 12 генов, и мутации в любом из них вызывают дефицит CoQ10. На уровни CoQ10 также могут влиять и другие генетические дефекты (мутации митохондриальной ДНК, генов ETFDH, APTX, FXN и BRAF, генов, которые не имеют прямого отношения к биосинтезу CoQ10). Некоторые из них (например, мутации гена COQ6) могут вызвать серьезные заболевания, такие как стероид-резистентный нефротический синдром с нейросенсорной глухотой. К дефициту CoQ10 также приводит прием синтетических статиновых препаратов [18].
Хотя концентрацию CoQ10 можно измерить в плазме крови, эти измерения отражают потребление пищи, а не состояние тканей. В настоящее время наиболее информативно измерять уровни CoQ10 в культивируемых фибробластах кожи, биоптатах мышц и мононуклеарных клетках крови. Важно отметить, что миотоксичность статинов связана с нарушением биосинтеза CoQ [19].
Как вещество CoQ10 малорастворим в воде, и механизм его всасывания аналогичен всасыванию липидов (т.е. включает эмульгацию и образование мицелл, необходимых для всасывания липофильных веществ, под воздействием ферментов поджелудочной железы и желчных кислот) [20]. Прием пищи, особенно жирной, стимулирует секрецию желчи, что значительно увеличивает абсорбцию CoQ10. Поэтому экзогенный CoQ10 лучше всего всасывается во время еды: концентрация CoQ10 в сыворотке при приеме пищи выше, чем при приеме натощак [21].
Пик концентрации CoQ10 в плазме крови наблюдается через 2–6 ч после перорального приема. Может возникать и второй пик (через 24 ч после приема) вследствие энтерогепатической рециркуляции и перераспределения CoQ10 из печени в кровоток [20]. Исследование CoQ10 с углеродной меткой 14C на крысах показало, что через 2 ч после перорального приема бо́льшая часть изотопа накапливается в печени [22]. CoQ10 метаболизируется во всех тканях, а основным путем его выведения является экскреция с желчью. После отмены дотаций уровни CoQ10 в крови возвращаются к исходному состоянию в течение нескольких дней [23].
Коэнзим Q10 в терапии астенических состояний / Coenzyme Q10 in the treatment of asthenic conditions
Поддерживая метаболизм митохондрий всех тканей, СоQ10 в существенной мере способствует синтезу АТФ и, следовательно, состоянию энергетического метаболизма клеток, в т.ч. мышечных. Обзор 16 клинических исследований эффектов дотаций CoQ10 на усталость (n=1316) подтвердил, что CoQ10 облегчает симптоматику усталости у здоровых добровольцев и пациентов с фибромиалгией, связанной со статинами астенией, рассеянным склерозом и тяжелыми формами ХСН [24].
Дотации CoQ10 (100 мг/сут) улучшали результаты выполнения комплекса лечебной физкультуры (оценка по максимальному потреблению кислорода (VO2), упраженения 5 раз в неделю) у мужчин с ХСН (класс II–III по функциональной классификации Нью-Йоркской ассоциации кардиологов (англ. New York Heart Association, NYHA), n=23, возраст 59±9 лет). Прием CoQ10 повышал пиковое VO2 на 9%, эндотелий-зависимую дилатацию плечевой артерии – на 38%, а индекс систолического утолщения стенки снижался на 12%. При этом не было установлено наличие каких-либо побочных эффектов вследствие приема CoQ10 [25].
Дотации CoQ10 (300 мг/сут, 8 дней) при физической нагрузке (тест на велоэргометре у здоровых добровольцев, n=17) позволили достичь более высокой максимальной скорости, снизить субъективное ощущение усталости (измеренное по визуальной аналоговой шкале) и сократить длительность периода восстановления по сравнению с группой плацебо [26].
Метаанализ 13 рандомизированных исследований (n=1126) подтвердил дозозависимую эффективность дотаций CoQ10 для снижения субъективного чувства усталости у больных с синдромом хронической усталости, фибромиалгией, ХСН, ожирением, почечной недостаточностью и другими заболеваниями. По сравнению с плацебо у пациентов, принимавших CoQ10, отмечено статистически значимое снижение показателей утомляемости (балл по шкале Хеджеса –0,4; 95% доверительный интервал (ДИ) –0,64…–0,16; p=0,001). С более выраженным снижением утомляемости коррелировало увеличение суточной дозы CoQ10 (–0,17 балла на каждые 100 мг, p<0,001) и продолжительности лечения (–0,126 балла на каждый месяц, p=0,007). Среди 602 участников, принимавших CoQ10, был зарегистрирован только 1 случай побочного действия (со стороны желудочно-кишечного тракта) (рис. 2) [27].
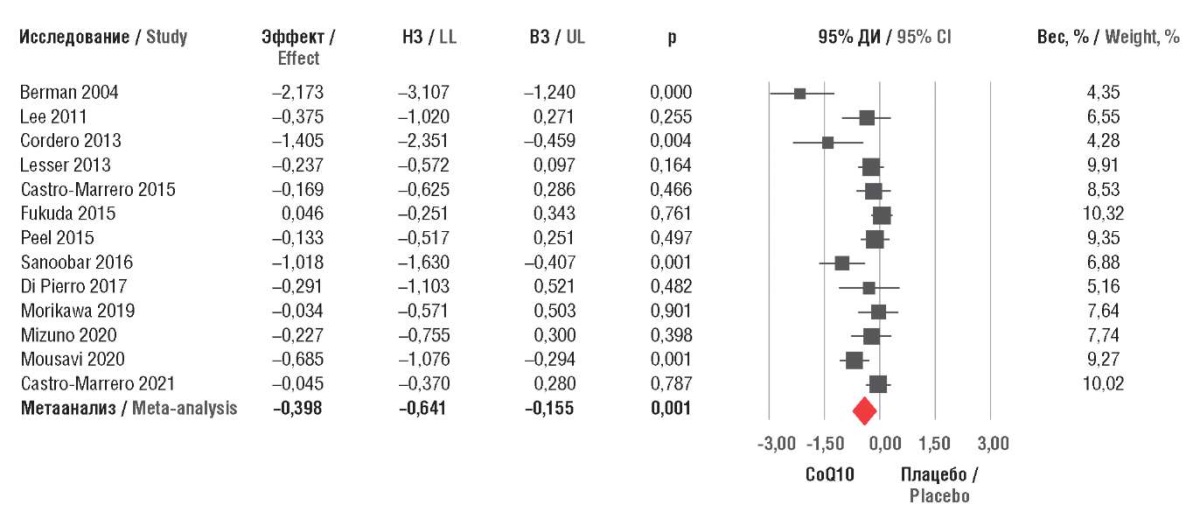
Рисунок 2. Метаанализ эффектов коэнзима Q10 (CoQ10) на усталость в сравнении с плацебо (по данным [27]).
НЗ – нижнее значение; ВЗ – верхнее значение; ДИ – доверительный интервал
Figure 2. Meta-analysis of the effects of coenzyme Q10 (CoQ10) on fatigue versus placebo (after [27]).
LL – lower limit; UL – upper limit; СI – confidence interval
CoQ10 способствует снижению симптоматики слабости, вызванной дисфункцией щитовидной железы. При гипертиреозе уровень CoQ10 в сыворотке крови значительно ниже, чем при эутиреозе [28]. У пациентов с гипертиреозом (n=20) выявлена обратная корреляция между уровнями тиреоидных гормонов и концентрацией CoQ10 в крови: более низкие уровни CoQ10 отмечены у больных с тиреотоксикозом. Прием CoQ10 (120 мг/сут, 1 нед) был эффективен в комплексной терапии застойной ХСН, вызванной тиреотоксикозом [29].
Отметим, что комбинация CoQ10 и липоевой кислоты эффективна в терапии так называемого длительного COVID-19, характеризующегося хронической усталостью, миалгией, депрессией и нарушениями сна. В проспективном исследовании пациенты в дополнение к стандартной терапии получали CoQ10 и альфа-липоевую кислоту (n=116) либо только стандартную терапию (n=58). По шкале оценки усталости (англ. Fatigue Severity Scale, FSS) полное выздоровление было достигнуто у 62 (53,5%) пациентов в основной группе и только у 1 (3,5%) больного в группе контроля [30].
Коэнзим Q10 в терапии сердечно-сосудистой патологии / Coenzyme Q10 in the treatment of cardiovascular pathology
Уровни CoQ10 в сыворотке крови достоверно ниже у пациентов со стабильной ИБС (n=83) по сравнению со здоровыми лицами (n=30) [31]. Поддерживая синтез АТФ в митохондриях кардиомиоцитов, CoQ10 способствует кардиопротекции при воздействии различных патогенов и токсинов. Например, прием CoQ10 (100 мг/кг/сут внутрибрюшинно, 12 дней) защищал мышей от экспериментального миокардита, вызванного заражением мышей линии DBA/2 М-штаммом вируса энцефаломиокардита [32].
CoQ10 защищал от кардиотоксичности, вызванной доксорубицином у крыс линии Wistar. Как известно, доксорубицин – антрациклиновый антибиотик с высокой кардиотоксичностью. У крыс, получавших этот кардиотоксин, отмечена повышенная встречаемость дезорганизованных кардиомиоцитов с увеличенным интерстициальным пространством, вакуолизированной цитоплазмой и множественными пикнотическими ядрами небольшого размера, значительным увеличением экспрессии каспазы-3, соотношения экспрессии генов BAX/BCL-2 и уровней малонового диальдегида (МДА). Введение CoQ10 привело к существенному улучшению гистопатологической картины, иммуноэкспрессии проапоптотической каспазы-3 и снижению соотношения экспрессии генов BAX/BCL-2 (которое повышено при апоптозе) [33].
Антиоксидантные и противовоспалительные эффекты CoQ10 весьма важны в терапии ССЗ, включая ИБС, ХСН и АГ. Дотации CoQ10 (150 мг/сут, 12 нед) уменьшали уровни воспалительных маркеров интерлейкина 6 и МДА у пациентов с ИБС (n=40) [34]. CoQ10 снижал окислительный стресс и увеличивал активность антиоксидантных ферментов (супероксиддисмутаза, каталаза) у больных ИБС, прошедших чрескожную транслюминальную коронарную ангиопластику (n=43) [35]. Метаанализ 4 исследований (n=1139) подтвердил важность использования CoQ10 в лечении пациентов с ХСН. Снижение риска смерти от всех причин, связанное с терапией Q10, составило 36% (отношение шансов (ОШ) 0,64; 95% ДИ 0,48–0,87; р=0,004), риск сердечно-сосудистой смерти понизился на 55% (ОШ 0,45; 95% ДИ 0,32–0,64; р=0,00001) [36].
Прием CoQ10 (300 мг/сут, 12 нед) значительно повышал активность антиоксидантных ферментов и уменьшал воспаление у пациентов с ИБС во время терапии статинами (n=51). В это исследование были включены больные, у которых с помощью катетеризации сердца был выявлен по крайней мере 50% стеноз одной из крупных коронарных артерий и которые получали статины не менее 1 мес. После приема CoQ10 уровни фактора некроза опухоли альфа были достоверно ниже (р=0,039), а уровни витамина Е (р=0,043) и активность антиоксидантных ферментов (супероксиддисмутазы, каталазы, глутатионпероксидазы) (р<0,05) достоверно повысились [37].
ИБС – один из патофизиологических факторов развития цереброваскулярной патологии. В эксперименте показано, что дотации CoQ10 (10 мг/кг, 4 нед) снижали ишемические повреждения мозга, вызванные кратковременной окклюзией средней мозговой артерии у крысы с гипергликемией, индуцированной стрептозотоцином. Предварительный прием CoQ10 значительно уменьшал балл неврологической дисфункции, объем инфаркта и число пикнотических клеток на фоне снижения экспрессии белка Fis1 и увеличения экспрессии белка Mfn2 в мозге (рис. 3) [38].

Рисунок 3. Объем инфаркта мозга через 24 ч после 30-минутной окклюзии средней мозговой артерии (оСМА) и реперфузии (по данным [38]):
а – репрезентативные срезы, краситель TTC, инфаркт (бледный цвет); b – объемы инфаркта (подсчет по Барграгу); с – репрезентативные микрофотографии коры головного мозга (отсутствие пикнотических клеток у интактных крыс; в группах нормогликемических (НГ) и гипергликемических (ГГ) крыс с оСМА, коэнзима Q10 (CoQ10) и инсулина – отек головного мозга, пикнотические нейроны (черные стрелки), выжившие нейроны (белые стрелки)), масштабная линейка 100 мкм; d – подсчет пикнотических нейронов.
* р<0,05 по сравнению с группой НГ; ** р<0,05 по сравнению с группой ГГ
Figure 3. The volume of cerebral infarction 24 hours after 30-minute middle cerebral artery occlusion (MCAo) and reperfusion (after [38]):
а – representative sections, TTC stain, infarction (pale); b – infarction volumes (Bargrag scoring); c – representative photomicrographs of the cerebral cortex (absence of pyknotic cells in intact rats; in groups of normoglycemic (NG) and hyperglycemic (HG) rats with MCAo, coenzyme Q10 (CoQ10), and insulin – cerebral edema, pyknotic neurons (black arrows), surviving neurons (white arrows)), scale bar 100 µm; d – pyknotic neuron count.
* p<0.05 compared with NG group; ** p<0.05 compared with HG group
Поддерживая метаболизм жиров, CoQ10 способствует нормализации липидного профиля. Метаанализ 50 рандомизированных контролируемых исследований (n=2794) подтвердил, что прием CoQ10 в дозе 400–500 мг/сут положительно влияет на липидный профиль при гиперхолестеринемии, снижая уровни общего холестерина (–5,53 мг/дл; 95% ДИ –8,40…–2,66), липопротеинов низкой плотности (–3,03 мг/дл; 95% ДИ –5,25…–0,81), триглицеридов (–9,06 мг/дл; 95% ДИ –14,04…–4,08) и повышая уровень липопротеинов высокой плотности (+0,83 мг/дл; 95% ДИ 0,01–1,65). Анализ «доза – реакция» показал, что доза 400–500 мг/сут оптимальна для достижения максимального антигиперлипидемического эффекта (р<0,01) [39].
CoQ10 при пероральном приеме оказывает благоприятное действие при ХСН, ИБС, АГ и хорошо переносится пациентами. Продемонстрированы благоприятные эффекты CoQ10 на фракцию/объем выброса и на переносимость пациентами физических нагрузок [40]. Метаанализ 11 исследований (n=1573) показал, что применение CoQ10 у пациентов с ХСН по сравнению с плацебо снижало риск смерти от всех причин на 42% (отношение рисков (ОР) 0,58; 95% ДИ 0,35–0,95) и госпитализации в связи с сердечной недостаточностью на 38% (ОР 0,62; 95% ДИ 0,49–0,78) (рис. 4) [41].
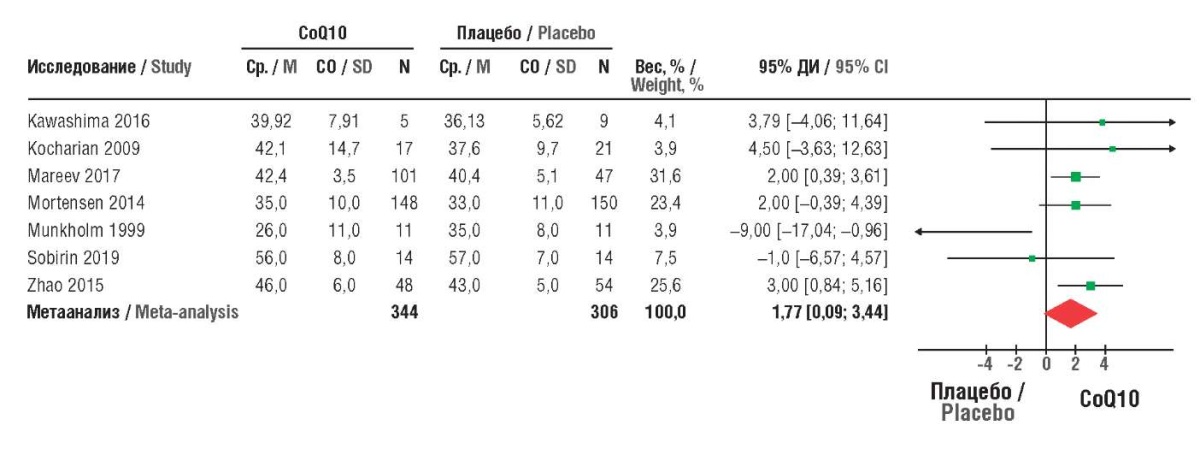
Рисунок 4. Сравнение показателей фракции выброса левого желудочка в группах коэнзима Q10 (CoQ10) и плацебо (по данным метаанализа [41]).
Ср. – среднее значение; СО – стандартное отклонение; N – число пациентов; ДИ – доверительный интервал
Figure 4. Comparison of left ventricular ejection fraction in coenzyme Q10 (CoQ10) and placebo groups (after meta-analysis [41]).
M – mean value; SD – standard deviation; N – number of patients; CI – confidence interval
Добавление дотаций CoQ10 per os (средняя доза 225 мг/сут, индивидуальные дозы корректировались в зависимости от клинического ответа и уровня CoQ10 в крови) к индивидуальным схемам приема антигипертензивных препаратов (АГП) у пациентов с АГ (n=109) показало достоверное улучшение функционального состояния. Прием CoQ10 в течение 1–6 мес приводил к снижению лекарственной нагрузки АГП: 51% больных прекратил прием от 1 до 3 АГП через 4,4 мес от начала приема CoQ10. Средний функциональный класс по NYHA улучшился (от 2,40 до 1,36, р<0,001). У 9,4% пациентов прием CoQ10 улучшил показатели эхокардиограммы [42].
Метаанализ 26 рандомизированных исследований продемонстрировал, что прием CoQ10 снижает систолическое артериальное давление (САД) (–4,77 мм рт. ст., 95% ДИ –6,57…–2,97) у пациентов с кардиометаболическими нарушениями (n=1831). Снижение САД сопровождалось повышением концентраций CoQ10 в крови на 1,62 мкг/мл (95% ДИ 1,26–1,97) по сравнению с контролем. Между приемом CoQ10 и уровнем САД установлено наличие U-образной зависимости с оптимальной дозой CoQ10 порядка 100–200 мг/сут [43].
Обзор 14 исследований по использованию CoQ10 в качестве адъювантной терапии CCЗ и гипертонии (n=1067) подтвердил, что дотации CoQ10 у пациентов с ХСН улучшают функциональные возможности сердца и способствуют уменьшению количества неблагоприятных сердечно-сосудистых событий. CoQ10 оказал положительное количественное влияние на маркеры воспаления у больных ИБС. Гемодинамика миокарда улучшилась у пациентов, принимавших СоQ10 перед проведением кардиохирургических вмешательств [44].
Систематический обзор 26 исследований применения СоQ10 у пациентов с ХСН со сниженной фракцией выброса (n=2250) показал снижение смертности от всех причин на 32% (ОШ 0,68; 95% ДИ 0,45–1,03). Фармакоэкономический анализ продемонстрировал высокую (95,2%) вероятность того, что пероральный прием CoQ10 является более рентабельным, чем медицинская помощь только по стандартам (рис. 5) [45].

Рисунок 5. Эффекты дотаций коэнзима Q10 (CoQ10) у пациентов с хронической сердечной недостаточностью (ХСН) (по данным метаанализа [45]):
а – смертность от всех причин; b – изменения класса ХСН (по шкале NYHA).
N – число пациентов; ОР – отношение рисков; ДИ – доверительный интервал; Ср. – среднее значение; СО – стандартное отклонение
Figure 5. The effects of coenzyme Q10 (CoQ10) supplementation in patients with chronic heart failure (CHF) (after meta-analysis [45]):
а – all-cause mortality; b – changes in CHF class (according to NYHA scale).
N – number of patients; M – mean value; SD – standard deviation; RR – risk ratio; CI – confidence interval
По данным метаанализа, дотации CoQ10 у пациентов с ХСН приводят к повышению фракции выброса (+3,67%; 95% ДИ 1,60–5,74) и снижению функционального класса по шкале NYHA (–0,30; 95% ДИ –0,66–0,06). Анализ подгрупп показал значительное увеличение фракции выброса в перекрестных исследованиях, в исследованиях с продолжительностью лечения более 12 нед и при дозах CoQ10 более 100 мг/сут [46].
Коэнзим Q10 в противодействии миопатии, вызванной статинами / Coenzyme Q10 in countering statin-induced myopathy
Наиболее опасным побочным эффектом статинов (ингибиторов гидрокси-метилглутарил-коэнзим А-редуктазы) является их миотоксичность. Статины ингибируют выработку мевалоната (молекула-предшественник в биосинтезе холестерина и CoQ10), который имеет решающее значение для митохондриальной функции и обеспечения клеточных процессов энергией. Снижение уровней CoQ10 в мышечной ткани вызывает развитие статиновых миопатий, ассоциированных с повреждениями митохондрий [47]. Истощение CoQ10 во время терапии статинами также приводит к субклинической кардиомиопатии, которая полностью компенсируется дотациями CoQ10 [48].
Метаанализ 12 рандомизированных исследований (n=575) подтвердил влияние CoQ10 на статин-индуцированную миопатию. Дотации CoQ10 уменьшали мышечную боль (–1,60; 95% ДИ –1,75…–1,44; р<0,001), слабость в мышцах (–2,28; 95% ДИ –2,79…–1,77; р=0,006), мышечные спазмы (–1,78; 95% ДИ –2,31…–1,24; р<0,001) и усталость мышц (–1,75; 95% ДИ –2,31…–1,19; р<0,001) (рис. 6) [49].

Рисунок 6. Эффекты коэнзима Q10 (CoQ10) на статин-ассоциированные мышечные симптомы (по данным метаанализа [49]).
ДИ – доверительный интервал
Figure 6. Effects of coenzyme Q10 (CoQ10) on statin-associated muscle symptoms (after meta-analysis [49]).
СI – confidence interval
Отметим, что CoQ10 полезен и при других, нестатиновых видах фибромиалгии. Дотации CoQ10 (в форме убихинола-10, 100 мг/сут, 12 нед) у больных с ювенильной фибромиалгией и дефицитом CoQ10 (n=10) приводили к снижению гиперхолестеринемии и усталости по шкале Чалдера [50]. Они также облегчали боль у пациентов с фибромиалгией, получавших прегабалин (n=11) [51]. Прегабалин уменьшал боль и беспокойство (за счет снижения гиперактивности мозга по сравнению с их исходным уровнем), но не влиял на митохондриальный окислительный стресс. Дотации CoQ10 эффективно уменьшали сильную боль и тревогу, митохондриальный окислительный стресс и воспаление, а также повышали уровни глутатиона и супероксиддисмутазы в крови [51].
Таким образом, экспериментальные данные и доказательная база указывают на перспективность использования CoQ10 у пациентов с гиперлипидемией и другими заболеваниями сердечно-сосудистой системы. Эффекты CoQ10 могут быть усилены дополнительными компонентами.
Например, в России представлен экстракт ферментированного красного риса Lactoflorene® Холестерол, стандартизированный по монаколину К (350,9 мг, 3% монаколина) и содержащий ряд синергидных компонентов: пребиотики сорбитол (1253 мг) и мальтодекстрин (1575,5 мг), пробиотические бифидобактерии лонгум ВВ536 (37,5 мг лиофилизата), коэнзим Q10 (21 мг) и витамин РР (никотинамид, 19,4 мг), которые способствуют компенсации нарушений обмена углеводов и липидного профиля.
ЗАКЛЮЧЕНИЕ / CONCLUSION
Вследствие уникальной роли в поддержании функции митохондрий коэнзим Q10 занимает особое место среди средств, используемых для профилактики атеросклероза и его сердечно-сосудистых и цереброваскулярных осложнений. Совместный прием CoQ10 со статинами позволяет снизить риск поражений печени и развития статин-зависимой миопатии. Важно подчеркнуть необходимость использования CoQ10 при лечении гиперлипидемии и других сердечно-сосудистых патологий, в т.ч. ИБС, ХСН и АГ.
Список литературы
1. Торшин И.Ю., Громова О.А. Альтернативные подходы к коррекции гиперхолестеринемии: эффекты стандартизированных экстрактов красного риса и его синергистов. Лечебное дело. 2021; 1: 89–98. https://doi.org/10.24412/2071-5315-2021-12283.
2. Громова О.А., Торшин И.Ю. Хемореактомный анализ природных и синтетических статинов указывает на более благоприятный профиль безопасности монаколина К. Экспериментальная и клиническая гастроэнтерология. 2022; 3: 74–85. https://doi.org/10.31146/1682-8658-ecg-199-3-74-85.
3. Steffen C. Rotschimmelreis: Ein bedenkliches Nahrungsergän-zungsmittel? Bundesgesundheitsbl. 2017; 60 (3): 292–6. https://doi.org/10.1007/s00103-016-2503-8.
4. Громова О.А., Торшин И.Ю. Систематический анализ экспериментальной и клинической фармакологии никотинамида и перспективы лечения атеросклероза. Экспериментальная и клиническая гастроэнтерология. 2022; 10: 111–25. https://doi.org/10.31146/1682-8658-ecg-206-10-111-125.
5. Okamoto T., Matsuya T., Fukunaga Y., et al. Human serum ubiquinol-10 levels and relationship to serum lipids. Int J Vitam Nutr Res. 1989; 59 (3): 288–92.
6. Aberg F., Appelkvist E.L., Dallner G., Ernster L. Distribution and redox state of ubiquinones in rat and human tissues. Arch Biochem Biophys. 1992; 295 (2): 230–4. https://doi.org/10.1016/0003-9861(92)90511-t.
7. Garrido-Maraver J., Cordero M.D., Oropesa-Avila M., et al. Clinical applications of coenzyme Q10. Front Biosci (Landmark Ed). 2014; 19 (4): 619–33. https://doi.org/10.2741/4231.
8. Shahid M.N., Khan T.M., Neoh C.F., et al. Effectiveness of pharmacological intervention among men with infertility: a systematic review and network meta-analysis. Front Pharmacol. 2021; 12: 638628. https://doi.org/10.3389/fphar.2021.638628.
9. Torshin I.Yu., Rudakov K.V. On metric spaces arising during formalization of recognition and classification problems. Part 1: Properties of compactness. Pattern Recognit Image Anal. 2016; 26 (2): 274–84. https://doi.org/10.1134/S1054661816020255.
10. Torshin I.Yu., Rudakov K.V. Combinatorial analysis of the solvability properties of the problems of recognition and completeness of algorithmic models. Part 2: Metric approach within the framework of the theory of classification of feature values. Pattern Recognit Image Anal. 2017; 27 (2): 184–99. https://doi.org/10.1134/S1054661817020110.
11. Torshin I.Yu., Rudakov K.V. On metric spaces arising during formalization of problems of recognition and classification. Part 2: Density properties. Pattern Recognit Image Anal. 2016; 26 (3): 483–96. https://doi.org/10.1134/S1054661816030202.
12. Mantle D., Hargreaves I. Coenzyme Q10 and degenerative disorders affecting longevity: an overview. Antioxidants (Basel). 2019; 8 (2): 44. https://doi.org/10.3390/antiox8020044.
13. Rauchová H. Coenzyme Q10 effects in neurological diseases. Physiol Res. 2021; 70 (Suppl. 4): S683–714. https://doi.org/10.33549/physiolres.934712.
14. Pradhan N., Singh C., Singh A. Coenzyme Q10 a mitochondrial restorer for various brain disorders. Naunyn Schmiedebergs Arch Pharmacol. 2021; 394 (11): 2197–222. https://doi.org/10.1007/s00210-021-02161-8.
15. Zozina V.I., Covantev S., Goroshko O.A., et al. Coenzyme Q10 in cardiovascular and metabolic diseases: current state of the problem. Curr Cardiol Rev. 2018; 14 (3): 164–74. https://doi.org/10.2174/1573403X14666180416115428.
16. Hargreaves I., Heaton R.A., Mantle D. Disorders of human coenzyme Q10 metabolism: an overview. Int J Mol Sci. 2020; 21 (18): 6695. https://doi.org/10.3390/ijms21186695.
17. Hidalgo-Gutiérrez A., González-García P., Díaz-Casado M.E., et al. Metabolic targets of coenzyme Q10 in mitochondria. Antioxidants (Basel). 2021; 10 (4): 520. https://doi.org/10.3390/antiox10040520.
18. Hathcock J.N., Shao A. Risk assessment for coenzyme Q10 (ubiquinone). Regul Toxicol Pharmacol. 2006; 45 (3): 282–8. https://doi.org/10.1016/j.yrtph.2006.05.006.
19. Trevisson E., DiMauro S., Navas P., Salviati L. Coenzyme Q deficiency in muscle. Curr Opin Neurol. 2011; 24 (5): 449–56. https://doi.org/10.1097/WCO.0b013e32834ab528.
20. Bhagavan H.N., Chopra R.K. Coenzyme Q10: absorption, tissue uptake, metabolism and pharmacokinetics. Free Radic Res. 2006; 40 (5): 445–53. https://doi.org/10.1080/10715760600617843.
21. Ochiai A., Itagaki S., Kurokawa T., et al. Improvement in intestinal coenzyme Q10 absorption by food intake. Yakugaku Zasshi. 2007; 127 (8): 1251–4. https://doi.org/10.1248/yakushi.127.1251.
22. Kishi H., Kanamori N., Nisii S., et al. Metabolism and exogenous coenzyme Q10 in vivo and bioavailability of coenzyme Q10 preparations in Japan. Biomedical and clinical aspects of coenzyme Q. Amsterdam: Elsevier; 1964: 131–42.
23. Ozawa Y., Mizushima Y., Koyama I., et al. Intestinal absorption enhancement of coenzyme Q10 with a lipid microsphere. Arzneimittelforschung. 1986; 36 (4): 689–90.
24. Mehrabani S., Askari G., Miraghajani M., et al. Effect of coenzyme Q10 supplementation on fatigue: a systematic review of interventional studies. Complement Ther Med. 2019; 43: 181–7. https://doi.org/10.1016/j.ctim.2019.01.022.
25. Belardinelli R., Muçaj A., Lacalaprice F., et al. Coenzyme Q10 and exercise training in chronic heart failure. Eur Heart J. 2006; 27 (22): 2675–81. https://doi.org/10.1093/eurheartj/ehl158.
26. Mizuno K., Tanaka M., Nozaki S., et al. Antifatigue effects of coenzyme Q10 during physical fatigue. Nutrition. 2008; 24 (4): 293–9. https://doi.org/10.1016/j.nut.2007.12.007.
27. Tsai I.C., Hsu C.W., Chang C.H., et al. Effectiveness of coenzyme Q10 supplementation for reducing fatigue: a systematic review and meta-analysis of randomized controlled trials. Front Pharmacol. 2022; 13: 883251. https://doi.org/10.3389/fphar.2022.883251.
28. Ogura F., Morii H., Ohno M., et al. Serum coenzyme Q10 levels in thyroid disorders. Horm Metab Res. 1980; 12 (10): 537–40. https://doi.org/10.1055/s-2007-999193.
29. Suzuki H., Naitoh T., Kuniyoshi S., et al.. Cardiac performance and coenzyme Q10 in thyroid disorders. Endocrinol Jpn. 1984; 31 (6): 755–61. https://doi.org/10.1507/endocrj1954.31.755.
30. Barletta M.A., Marino G., Spagnolo B., et al. Coenzyme Q10 + alpha lipoic acid for chronic COVID syndrome. Clin Exp Med. 2022; Aug 22: 1–12. https://doi.org/10.1007/s10238-022-00871-8.
31. Büyükkaya E., Evliyaoğlu O., Islamoğlu Y., et al. The relationship between coenzyme Q10 and severity of coronary artery disease. Med Glas (Zenica). 2013; 10 (2): 229–33.
32. Kishimoto C., Tamaki S., Matsumori A., et al. The protection of coenzyme Q10 against experimental viral myocarditis in mice. Jpn Circ J. 1984; 48 (12): 1358–61. https://doi.org/10.1253/jcj.48.1358.
33. Shabaan D.A., Mostafa N., El-Desoky M.M., Arafat E.A. Coenzyme Q10 protects against doxorubicin-induced cardiomyopathy via antioxidant and anti-apoptotic pathway. Tissue Barriers. 2023; 11 (1): 2019504. https://doi.org/10.1080/21688370.2021.2019504.
34. Lee B.J., Huang Y.C., Chen S.J., Lin P.T. Effects of coenzyme Q10 supplementation on inflammatory markers (high-sensitivity C-reactive protein, interleukin-6, and homocysteine) in patients with coronary artery disease. Nutrition. 2012; 28 (7–8): 767–72. https://doi.org/10.1016/j.nut.2011.11.008.
35. Lee B.J., Huang Y.C., Chen S.J., Lin P.T. Coenzyme Q10 supplementation reduces oxidative stress and increases antioxidant enzyme activity in patients with coronary artery disease. Nutrition. 2012; 28 (3): 250–5. https://doi.org/10.1016/j.nut.2011.06.004.
36. Мареев В.Ю., Мареев Ю.В., Беграмбекова Ю.Л. Коэнзим Q-10 в лечении больных с хронической сердечной недостаточностью и сниженной фракцией выброса левого желудочка: систематический обзор и мета-анализ. Кардиология. 2022; 62 (6): 3–14. https://doi.org/10.18087/cardio.2022.6.n2050.
37. Lee B.J., Tseng Y.F., Yen C.H., Lin P.T. Effects of coenzyme Q10 supplementation (300 mg/day) on antioxidation and anti-inflammation in coronary artery disease patients during statins therapy: a randomized, placebo-controlled trial. Nutr J. 2013; 12 (1): 142. https://doi.org/10.1186/1475-2891-12-142.
38. Lu C.J., Guo Y.Z., Zhang Y., et al. Coenzyme Q10 ameliorates cerebral ischemia reperfusion injury in hyperglycemic rats. Pathol Res Pract. 2017; 213 (9): 1191–9. https://doi.org/10.1016/j.prp.2017.06.005.
39. Liu Z., Tian Z., Zhao D., et al. Effects of coenzyme Q10 supplementation on lipid profiles in adults: a meta-analysis of randomized controlled trials. J Clin Endocrinol Metab. 2022; 108 (1): 232–49. https://doi.org/10.1210/clinem/dgac585.
40. Tran M.T., Mitchell T.M., Kennedy D.T., Giles J.T. Role of coenzyme Q10 in chronic heart failure, angina, and hypertension. Pharmacotherapy. 2001; 21 (7): 797–806. https://doi.org/10.1592/phco.21.9.797.34564.
41. Al Saadi T., Assaf Y., Farwati M., et al. Coenzyme Q10 for heart failure. Cochrane Database Syst Rev. 2021; 2 (2): CD008684. https://doi.org/10.1002/14651858.CD008684.pub3.
42. Langsjoen P., Langsjoen P., Willis R., Folkers K. Treatment of essential hypertension with coenzyme Q10. Mol Aspects Med. 1994; 15 (Suppl.): S265–72. https://doi.org/10.1016/0098-2997(94)90037-x.
43. Zhao D., Liang Y., Dai S., et al. Dose-response effect of coenzyme Q10 supplementation on blood pressure among patients with cardiometabolic disorders: a grading of recommendations assessment, development, and evaluation (GRADE) – assessed systematic review and meta-analysis of randomized controlled trials. Adv Nutr. 2022; 13 (6): 2180–94. https://doi.org/10.1093/advances/nmac100.
44. Sue-Ling C.B., Abel W.M., Sue-Ling K. Coenzyme Q10 as adjunctive therapy for cardiovascular disease and hypertension: a systematic review. J Nutr. 2022; 152 (7): 1666–74. https://doi.org/10.1093/jn/nxac079.
45. Claxton L., Simmonds M., Beresford L., et al. Coenzyme Q10 to manage chronic heart failure with a reduced ejection fraction: a systematic review and economic evaluation. Health Technol Assess. 2022; 26 (4): 1–128. https://doi.org/10.3310/KVOU6959.
46. Fotino A.D., Thompson-Paul A.M., Bazzano L.A. Effect of coenzyme Q10 supplementation on heart failure: a meta-analysis. Am J Clin Nutr. 2013; 97 (2): 268–75. https://doi.org/10.3945/ajcn.112.040741.
47. Nawarskas J.J. HMG-CoA reductase inhibitors and coenzyme Q10. Cardiol Rev. 2005; 13 (2): 76–9. https://doi.org/10.1097/01.crd.0000154790.42283.a1.
48. Littarru G.P., Langsjoen P. Coenzyme Q10 and statins: biochemical and clinical implications. Mitochondrion. 2007; 7 (Suppl.): S168–74. https://doi.org/10.1016/j.mito.2007.03.002.
49. Qu H., Guo M., Chai H., et al. Effects of coenzyme Q10 on statin-induced myopathy: an updated meta-analysis of randomized controlled trials. J Am Heart Assoc. 2018; 7 (19): e009835. https://doi.org/10.1161/JAHA.118.009835.
50. Miyamae T., Seki M., Naga T., et al. Increased oxidative stress and coenzyme Q10 deficiency in juvenile fibromyalgia: amelioration of hypercholesterolemia and fatigue by ubiquinol-10 supplementation. Redox Rep. 2013; 18 (1): 12–9. https://doi.org/10.1179/1351000212Y.0000000036.
51. Sawaddiruk P., Apaijai N., Paiboonworachat S., et al. Coenzyme Q10 supplementation alleviates pain in pregabalin-treated fibromyalgia patients via reducing brain activity and mitochondrial dysfunction. Free Radic Res. 2019; 53 (8): 901–9. https://doi.org/10.1080/10715762.2019.1645955.
Об авторах
О. А. ГромоваРоссия
Громова Ольга Алексеевна – д.м.н., профессор, ведущий научный сотрудник
ул. Вавилова, д. 4, Москва 211933
WoS ResearcherID: J-4946-2017
Scopus Author ID: 7003589812
И. Ю. Торшин
Россия
Торшин Иван Юрьевич – к.ф-м.н., к.х.н., старший научный сотрудник
ул. Вавилова, д. 4, Москва 211933
WoS ResearcherID: C-7683-2018
Scopus Author ID: 7003300274
Рецензия
Для цитирования:
Громова О.А., Торшин И.Ю. Молекулярная фармакология коэнзима Q10 в контексте лечения гиперлипидемических состояний. ФАРМАКОЭКОНОМИКА. Современная фармакоэкономика и фармакоэпидемиология. 2023;16(2):345-357. https://doi.org/10.17749/2070-4909/farmakoekonomika.2023.186
For citation:
Gromova O.A., Torshin I.Yu. Molecular pharmacology of coenzyme Q10 in the context of treatment of hyperlipidemic conditions. FARMAKOEKONOMIKA. Modern Pharmacoeconomics and Pharmacoepidemiology. 2023;16(2):345-357. (In Russ.) https://doi.org/10.17749/2070-4909/farmakoekonomika.2023.186

Контент доступен под лицензией Creative Commons Attribution-NonCommercial-ShareAlike 4.0 International License.





































