Перейти к:
Систематический компьютерный анализ фармакологии биофлавоноидов в контексте повышения противовирусной защиты организма
https://doi.org/10.17749/2070-4909/farmakoekonomika.2023.162
Аннотация
Актуальность. Быстро развивающаяся резистентность вирусов к синтетическим противовирусным препаратам указывает на необходимость использования веществ, характеризующихся мультитаргетным действием (во избежание полипрагмазии и для повышения безопасности лечения).
Цель: систематический анализ научной литературы по фармакологии биофлавоноидов c акцентом на их противовирусное действие.
Материал и методы. В базе данных биомедицинских публикаций PubMed/MEDLINE найдено более 150 тыс. первоисточников, в т.ч. 3282 по противовирусным эффектам биофлавоноидов. Проведен систематический компьютерный анализ этого массива публикаций с целью выявления основных направлений фармакологии биофлавоноидов с акцентом на их противовирусные, антибактериальные и иммуномодулирующие эффекты.
Анализ литературы выполнен с использованием современных методов топологического и метрического анализа больших данных.
Результаты. Детально описаны молекулярные механизмы действия биофлавоноидов байкалин, гесперидин, рутин, кверцитин, лейкодельфинидин и полифенолов эпигаллокатехин-3-галлат и куркумин, их противовоспалительные, антиоксидантные, противовирусные, бактерицидные, ангиопротекторные, регенеративные эффекты, а также их перспективы в терапии, профилактике и реабилитации пациентов с COVID-19 и другими респираторными вирусными инфекциями.
Заключение. Биофлавоноиды и синергидные им полифенолы проявляют не только мультитаргетные противовирусные эффекты, ингибируя основную протеазу, спайк-белки и другие таргетные белки, но и выраженное противовоспалительное, гепатопротекторное и иммуномодулирующее действие.
Ключевые слова
Для цитирования:
Громова О.А., Торшин И.Ю., Чучалин А.Г. Систематический компьютерный анализ фармакологии биофлавоноидов в контексте повышения противовирусной защиты организма. ФАРМАКОЭКОНОМИКА. Современная фармакоэкономика и фармакоэпидемиология. 2023;16(1):105-124. https://doi.org/10.17749/2070-4909/farmakoekonomika.2023.162
For citation:
Gromova O.A., Torshin I.Yu., Chuchalin A.G. Systematic computer analysis of the pharmacology of bioflavonoids in the context of increasing the body's antiviral defenses. FARMAKOEKONOMIKA. Modern Pharmacoeconomics and Pharmacoepidemiology. 2023;16(1):105-124. (In Russ.) https://doi.org/10.17749/2070-4909/farmakoekonomika.2023.162
ВВЕДЕНИЕ / INTRODUCTION
Коронавирусная инфекция, вызывающая COVID-19, не сходила с первых полос средств массовой информации до февраля 2022 г. и вскрыла существенные проблемы в профилактике и терапии новых вирусных инфекций. Стало очевидно, что компенсация микронутриентных дефицитов и использование нутрицевтиков – важнейшая мера поддержки врожденного и приобретенного иммунитета, способствующая профилактике тяжелого течения COVID-19. В частности, анализ 20 тыс. публикаций по SARS-CoV-2 и другим коронавирусам показал, что увеличение обеспеченности витаминами А, С, D, E, РР, цинком, магнием, ресвератролом, полифенолом куркумин, биофлавоноидом рутин и другими нутрицевтиками способствует повышению резистентности организма человека к коронавирусной инфекции [1].
Четко обозначились игнорируемые годами проблемы фармакотерапии вирусных заболеваний. Общеизвестно, например, что для лечения инфекций, вызванных вирусами гриппа, используются специфические ингибиторы нейраминидазы и блокаторы вирусных ионных каналов (белки типа М2). Препараты обеих групп гепато- и нефротоксичны (что снижает безопасность лечения), и к ним часто формируется резистентность (что резко снижает эффективность лечения). Кроме того, коронавирусная инфекция, вызывающая COVID-19, не только опасна сама по себе, но и приводит к многочисленным осложнениям, требующим длительной реабилитации (от нескольких месяцев до года).
Поэтому перспективные направления профилактики, терапии и реабилитации после COVID-19, острых респираторных заболеваний (ОРЗ), острых респираторных вирусных инфекций (ОРВИ) и гриппа включают использование таких средств, которые характеризуются мультитаргетным действием, включающим одновременно: 1) противовирусные эффекты, 2) противовоспалительное действие для профилактики гипервоспаления (цитокинового шторма), 3) гепатопротекторный (а не гепатотоксичный) эффект, 4) поддержку систем врожденного и приобретенного противовирусного иммунитета.
Биофлавоноиды и синергидные им полифенольные соединения природного происхождения удовлетворяют всем этим требованиям, характеризуясь не только действием на РНК-вирусы (включая вирусы гриппа, коронавирусы и др.), но и выраженным противовоспалительным, антиоксидантным, ангиопротекторным, гепатопротекторным эффектом.
Цель – систематический анализ научной литературы по фармакологии биофлавоноидов c акцентом на их противовирусное действие.
МАТЕРИАЛ И МЕТОДЫ / MATERIAL AND METHODS
По запросу “(flavonoids OR bioflavonoids)” в базе данных биомедицинских публикаций PubMed/MEDLINE было найдено 152 145 первоисточников, в т.ч. 3282 по противовирусным эффектам биофлавоноидов (запрос “(flavonoids OR bioflavonoids) AND virus”).
Систематический анализ / Systematic analysis
Мы провели систематический компьютерный анализ этого массива публикаций с целью выявления основных направлений фармакологии биофлавоноидов с акцентом на противовирусные, антибактериальные и иммуномодулирующие эффекты флавоноидов, важные для лечения и реабилитации пациентов с ОРВИ, COVID-19, другими вирусными патологиями и для профилактики ОРВИ у пациентов, часто болеющих простудными заболеваниями. Анализ литературы выполнен с использованием современных методов топологического и метрического анализа больших данных, развиваемых в научной школе академика РАН Ю.И. Журавлева [2][3].
В ходе систематического анализа литературы было выделено 45 информативных биомедицинских терминов, отличающих исследования по фармакологии биофлавоноидов от публикаций в контрольной выборке. В качестве контрольной выборки использовались 152 145 случайно выбранных статей из 24 589 974 найденных по запросу “(Humans [MeSH Terms] OR Animals [MeSH Terms] OR Cell Line [MeSH Terms]) NOT flavonoids NOT bioflavonoids NOT virus NOT viral”.
Выбор перечисленных выше ключевых слов для формирования контрольной группы был сделан на основе наиболее часто встречающихся терминов в выборке публикаций по биофлавоноидам. Аннотация полученных терминов посредством референсных таблиц SNAP позволила рубрицировать тексты исследований по соответствующим молекулярно-биологическим процессам согласно международной номенклатуре GO (англ. Gene Ontology) и построить терминологические карты молекулярно-физиологического действия биофлавоноидов, включая противовирусные эффекты.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ / RESULTS AND DISCUSSION
Фармакологические эффекты биофлавоноидов / Pharmacological effects of bioflavonoids
Наиболее информативные ключевые слова, описывающие фармакологию биофлавоноидов, на метрической карте сгруппированы в пять отдельных кластеров, описывающих противовоспалительные, антибактериальные, противовирусные эффекты (кластер 1), противоопухолевые (кластер 2), иммуномодулирующие (кластер 3), гепатопротекторные (кластер 4) и антианемические (кластер 5) свойства биофлавоноидов (рис. 1).
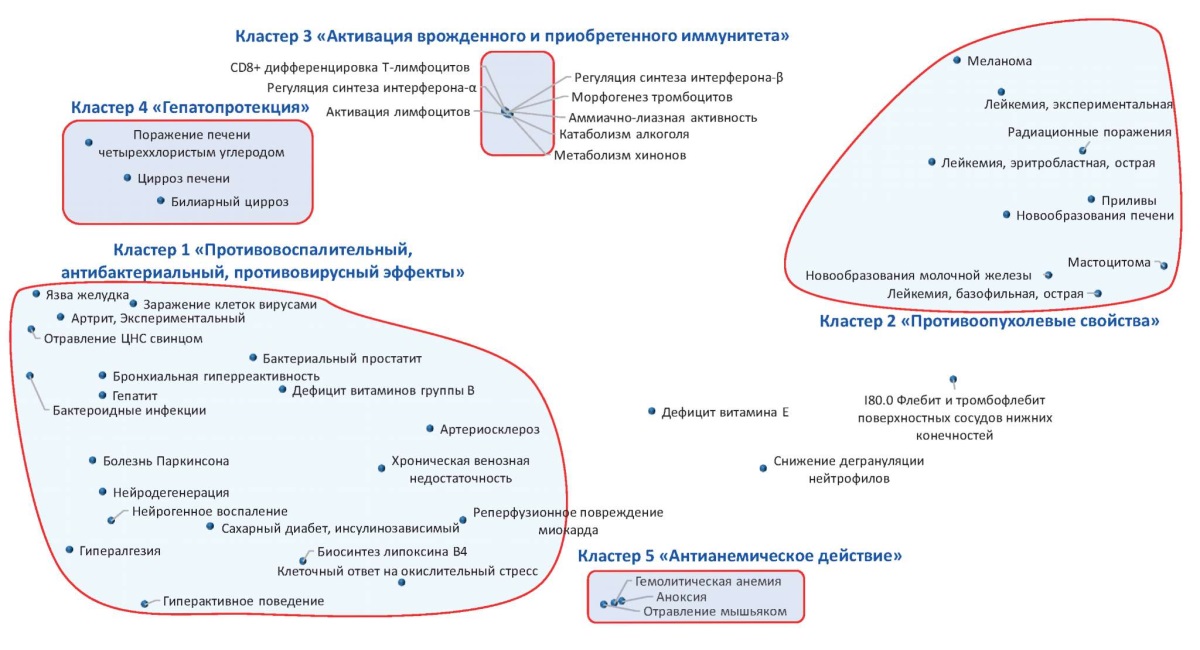
Рисунок 1. Метрическая карта наиболее информативных терминов, описывающих фармакологические эффекты биофлавоноидов. Расстояние между точками, соответствующими терминам, обратно пропорционально совместной встречаемости терминов в исследованной выборке публикаций (чем ближе две произвольные точки, тем чаще встречается совместное употребление двух соответствующих терминов)
ЦНС – центральная нервная система
Figure 1. Metric map of the most informative terms describing the pharmacological effects of bioflavonoids. The distance between the points corresponding to the terms is inversely proportional to the joint occurrence of terms in the studied sample of publications (the closer two arbitrary points are, the more often the joint use of the two corresponding terms occurs)
Анализ терминов в кластере 1 показывает, что противовоспалительный, антибактериальный и противовирусный эффекты биофлавоноидов ассоциированы с дефицитом витаминов группы В, нарушениями антиоксидантного баланса (GO:1900409 Клеточный ответ на окислительный стресс) и могут быть полезны в терапии широкого круга заболеваний дыхательной (бронхиальная гиперреактивность), сердечно-сосудистой (реперфузионное повреждение миокарда, артериосклероз, хроническая венозная недостаточность), нервной (гипералгезия, нейродегенерация, болезнь Паркинсона, нейрогенное воспаление, гиперактивное поведение) и других систем организма (гепатит, язва желудка, артрит, инсулинозависимый сахарный диабет). Особо следует подчеркнуть противоопухолевые (кластер 2), гепатопротекторные (кластер 4) и антианемические (кластер 5) эффекты биофлавоноидов. Каждый из этих эффектов (в т.ч. антистрессовый эффект, воздействие на центральную нервную систему (ЦНС), состояние кожи и ее придатков, зрение, ангиопротекция и др.) является отдельным направлением исследований.
Биофлавоноиды также важны для активации врожденного и приобретенного иммунитета (кластер 3), в т.ч. посредством регуляции биосинтеза интерферонов (GO:0032687 Регуляция синтеза интерферона-α, GO:0045358 Регуляция синтеза интерферона-β), CD8+ дифференцировки Т-лимфоцитов (GO:0043378) и активации лимфоцитов (GO:0051251).
Столь широкий круг воздействия биофлавоноидов на системы организма весьма важен и для профилактики тяжелого, длительного течения COVID-19, и для снижения полиорганной патологии, и для более быстрой реабилитации пациентов. Известно, что пациенты, перенесшие COVID-19 и формально «выздоровевшие» (отрицательный ПЦР-тест), в течение многих месяцев жалуются на хроническую усталость, одышку, нарушения сна, мутность сознания, депрессивные состояния, нарушения обоняния и другие симптомы так называемого постковидного синдрома. Многоплановое клиническое воздействие биофлавоноидов в дополнение к их противовирусному эффекту (см. ниже) может быть важно и для лечения «длинного ковида» (продолжительность характерных симптомов COVID-19 более 8–12 нед) [4].
Противовирусные эффекты биофлавоноидов / Antiviral effects of bioflavonoids
В ходе систематического анализа литературы по противовирусным эффектам биофлавоноидов было выделено 62 информативных биомедицинских термина (рис. 2), сгруппированных в три кластера, связанные с регуляцией воспаления (кластер 1), поддержкой систем врожденного и приобретенного противовирусного иммунитета (кластер 2) и, собственно, вирусами, против которых эффективны определенные биофлавоноиды и их синергисты полифенолы (кластер 3).

Рисунок 2. Метрическая карта наиболее информативных терминов, описывающих противовирусные эффекты биофлавоноидов мРНК – матричная рибонуклеиновая кислота; ИЛ – интерлейкин; ЛПС – липополисахарид; ОРЗ – острое респираторное заболевание
Figure 2. Metric map of the most informative terms describing the antiviral effects of bioflavonoids
Из метрической карты на рисунке 2 следует, что молекулярные механизмы противовирусного действия биофлавоноидов достаточно широки и включают устранение гипервоспаления (посредством регуляции синтеза интерлейкина 4 (ИЛ-4), ИЛ-6, хемокиновых рецепторов CC-типа и липополисахарид-опосредованных сигналов, GO:1900225 Регуляция сборки инфламмосомы NLRP3), прямое ингибирование вирусов (ингибирование входа вируса в клетку, в т.ч. прикрепления вириона к клетке, GO:1903900 Регуляция жизненного цикла вируса), поддержку врожденного (GO:0035455 Ответ на интерферон-α, GO:0035456 Ответ на интерферон-β, GO:0042296 Белок противовирусной защиты ISG15, GO:0043631 Полиаденилирование РНК) и приобретенного противовирусного иммунитета (GO:0002579 Активация презентации антигенов, GO:0002922 Активация гуморального иммунитета, GO:0043369 CD4+/CD8+ Т-лимфоциты).
Противовирусные эффекты биофлавоноидов и полифенолов (кластер 3 на рисунке 2) были изучены на широком спектре вирусных патогенов: коронавирусные инфекции, вирусы, вызывающие ОРЗ, в т.ч. респираторно-синцитиальные (диагнозы: J09 Грипп, вызванный определенным идентифицированным вирусом гриппа; J11.1 Грипп с другими респираторными проявлениями, вирус не идентифицирован; J12.8 Другая вирусная пневмония), герпесвирусы, энтеровирусные инфекции, гепатиты и более экзотические вирусы (вирус чикунгунья, вирус денге, вирус Эпштейна–Барра, возбудители вирусных инфекций A83.0 Японский энцефалит, A95.9 Желтая лихорадка неуточненная, лихорадка зика, африканская чума свиней) и др. Как показано ниже, биофлавоноиды и полифенолы могут непосредственно взаимодействовать с белками этих вирусов, тем самым модулируя взаимодействия вирусных белков с белками-рецепторами протеома человека.
Далее последовательно рассмотрены основные направления исследований биофлавоноидов и полифенолов в лечении вирусных заболеваний: противовоспалительное действие (в т.ч. в легких), противовирусные эффекты (в т.ч. важные для терапии гриппа, ОРЗ и COVID-19), фармакологические роли сапонина глицирризина и его противовирусное действие, перспективы синергидного применения биофлавоноидов и полифенолов в терапии ОРЗ и коронавирусной инфекции.
Общие противовоспалительные эффекты биофлавоноидов и полифенолов / General anti-inflammatory effects of bioflavonoids and polyphenols
В настоящее время наиболее активно исследуются противовоспалительные эффекты биофлавоноида байкалин, выделенного из шлемника байкальского. Байкалин регулирует воспаление (сигнальный путь TLR4-NFkB-MAP), окислительный стресс (путь Nrf2-Keap1) и проявляет противовирусное действие против гриппа, гепатита С, коронавирусов [5]. Он способствует дифференцировке регуляторных Т-лимфоцитов Treg CD4(+), CD25(+)Foxp3(+), ингибирующих аутоиммунные реакции и защищающих ткани от воспалительного повреждения [6]. Байкалин ингибирует образование активных форм кислорода в макрофагах линии RAW 264.7, стимулированных бактериальными липополисахаридами (ЛПС), подавляет уровни экспрессии генов, кодирующих провоспалительные белки Chop, Fas, Nos2, Ptgs2, Stat1, c-Jun, c-Fos и At1a. Значения констант 50%-го ингибирования байкалином (IC50) различных провоспалительных факторов лежат в микромолярном диапазоне: ИЛ-6 (IC50=591 мкМ), фактор некроза опухоли альфа (ФНО-α) (IC50=450 мкМ), колониестимулирующий фактор гранулоцитов G-CSF (IC50=1719 мкМ), MIP-1а (IC50=856 мкМ), RANTES (IC50=378 мкМ), внутриклеточная перекись водорода (IC50=33 мкМ) [7].
Противовоспалительные эффекты байкалина полезны для защиты органов при полиорганной патологии, характерной для COVID-19. Байкалин снижает повышенные уровни ФНО-α, экспрессию ИЛ-6, циклооксигеназы-2, аспартатаминотрансферазы (АСТ), аланинаминотрансферазы (АЛТ) и ослабляет опосредованные толл-подобным рецептором (англ. toll-like receptor) TLR4 воспалительные реакции при алкогольном ожирении печени [8]. Он также ингибирует воспаление микроглии (резидентных макрофагов ЦНС), вызванное ЛПС. Действуя через сигнальный путь TREM2/TLR4/NF-κB, байкалин способствует восстановлению морфологии клеток микроглии, достоверно снижая экспрессию и уровни белков ИЛ-1β, ИЛ-6 на фоне увеличения экспрессии ИЛ-4, ИЛ-10 [9].
Биофлавоноид кверцетин ингибирует высвобождение ИЛ-6 из тучных клеток, индуцированное ИЛ-1β, действуя через инфламмасому NLRP3 [10], активность которой принципиальна для формирования цитокинового шторма. Ингибируя сигнальный путь TLR2/NF-κB, кверцетин ослабляет воспаление в мононуклеарных клетках периферической крови человека, индуцированное ЛПС [11].
Дотации биофлавоноида гесперидин из экстракта кожуры мандарина (600 мг/сут, 4 нед) модулируют воспалительные реакции у пациентов с инфарктом миокарда (n=75). Потребление гесперидина значительно снижает сывороточные уровни Е-селектина, ИЛ-6, высокочувствительного С-реактивного белка (СРБ) и повышает уровни адипонектина и липопротеинов высокой плотности [12].
Полифенол куркумин из экстракта куркумы длинной – эффективный ингибитор ИЛ-6. Показано гепатопротекторное действие куркумина против гепатоцеллюлярной карциномы, индуцированной диэтилнитрозамином у крыс. Он снижает уровни ИЛ-2, ИЛ-6, АСТ, АЛТ, повышает уровни супероксиддисмутазы, каталазы и глутатионпероксидазы [13]. Метаанализ 15 рандомизированных контролируемых исследований показал, что куркумин значительно снижает уровень ИЛ-6 (–2,08; 95% ДИ –3,90…–0,25; p=0,02), высокочувствительного СРБ (–0,65; 95% ДИ –1,20…–0,10; p=0,02) и малонового диальдегида (–3,14; 95% ДИ –4,76…–1,53; p<0,001) (рис. 3) [14].
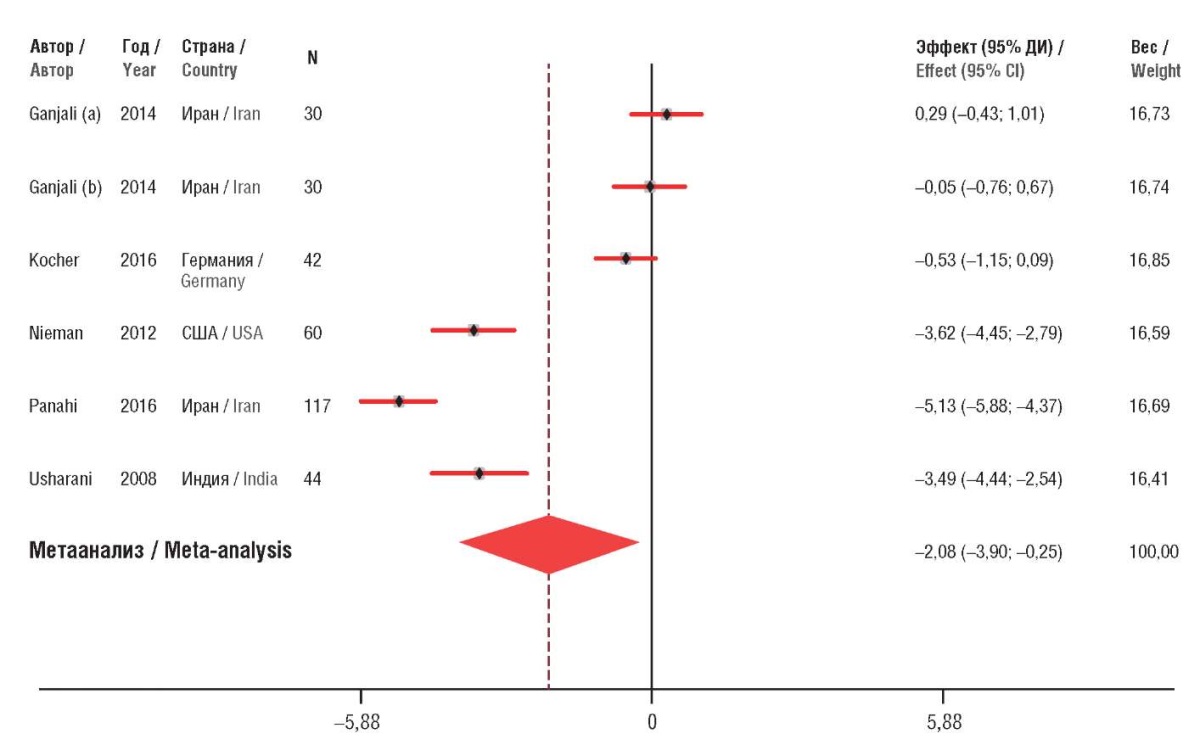
Рисунок 3. Результаты метаанализа эффектов куркумина на провоспалительные маркеры – для интерлейкина-6 (по данным [14]).
ДИ – доверительный интервал
Figure 3. Results of a meta-analysis of the effects of curcumin on pro-inflammatory markers – for interleukin-6 (after [14]).
СI – confidence interval
Полифенол зеленого чая и камелии китайской эпигаллокатехин-3-галлат (ЭГКГ) снижает гипервоспалительные реакции, в которых участвуют тучные клетки. Блокада сигнального пути RANKL/RANK молекулами ЭГКГ приводит к инактивации провоспалительного фактора NF-κB, тем самым снижая продукцию ИЛ-1β, ИЛ-6 и ИЛ-8. Он улучшает передачу сигналов от рецептора инсулина посредством снижения активности TLR4 в жировых тканях крыс на диете с высоким содержанием жиров, снижая уровни TLR-4/6, NF-κB, ФНО-α, ИЛ-6 [15].
Противовоспалительные эффекты биофлавоноидов и полифенолов в ткани легких / Anti-inflammatory effects of bioflavonoids and polyphenols in lung tissue
Описанные выше механизмы противовоспалительного действия биофлавоноидов особенно важны для торможения деструктивного воспаления в ткани легких. Байкалин ингибирует воспаление, вызванное ЛПС, путем блокады передачи сигнала по пути NF-κB в эпителиальных клетках дыхательных путей, снижая уровни ИЛ-6, ИЛ-8 и ФНО-α [16]. Поэтому он облегчает течение хронической обструктивной болезни легких (ХОБЛ). На модели ХОБЛ, вызванной воздействием сигаретного дыма и ЛПС у мышей, байкалин улучшал функцию легких, о чем свидетельствует снижение воспалительной клеточной инфильтрации, уровней ФНО-α, ИЛ-6 и ИЛ-8, наблюдаемых в жидкости бронхоальвеолярного лаважа. Байкалин повышал жизнеспособность альвеоцитов через ингибирование проапоптотического каскада JNK. И наоборот, активация каскада JNK предотвращала действие байкалина на ХОБЛ [17].
Биофлавоноид кверцетин ингибирует сигнальные пути, участвующие в секреции ИЛ-6 фибробластами легких человека и в трансформации бронхиального эпителия под воздействием эпоксида бензопирендиола (канцероген сигаретного дыма). Кверцетин снижает стимулированную канцерогеном секрецию ИЛ-6 посредством ингибирования путей NF-κB и ERK и блокирует индуцированную ИЛ-6 активацию STAT3 [18]. В эксперименте in vivo у крыс кверцетин (50 мг/кг) защищал альвеоциты от ЛПС-индуцированного острого повреждения легких, ослабляя инфильтрацию нейтрофилов, уровни ФНО-α, ИЛ-6 и малонового диальдегида в жидкости бронхоальвеолярного лаважа. Он также повышал активность ферментов-антиоксидантов супероксиддисмутазы, каталазы и глутатионпероксидазы в легких [19].
Куркумин блокирует высвобождение провоспалительных цитокинов, ИЛ-1, ИЛ-6 и ФНО-α. Подавление высвобождения цитокинов куркумином коррелирует с клиническим улучшением в экспериментальных моделях вирусных заболеваний, где цитокиновый шторм играет значительную роль в повышении смертности [20]. Например, куркумин модулирует воспалительную реакцию и ингибирует последующий фиброз у мышей с острым респираторным дистресс-синдромом (ОРДС), вызванном реовирусом 1/L. Прием куркумина (50 мг/кг) за 5 дней до и после интраназального введения реовируса модулировал воспаление и фиброз. Уровни экспрессии хемокинов и цитокинов, участвующие в развитии ОРДС (ИЛ-6, ИЛ-10, интерферона-γ и MCP-1) в воспалительном инфильтрате и легочной ткани, снижались посредством снижения фосфорилированной (активированной) формы NF-κB (субъединица p65). Куркумин также ослаблял экспрессию профибротического рецептора трансформирующего фактора роста 2 (англ. transforming growth factor 2, TGF-2) [21]. Таким образом, байкалин, кверцетин и куркумин могут способствовать уменьшению фибротических изменений в легких, наблюдаемых у пациентов с COVID-19.
Общие противовирусные эффекты биофлавоноидов и полифенолов / General antiviral effects of bioflavonoids and polyphenols
Важность применения биофлавоноидов и полифенолов в профилактике и терапии вирусных инфекций связана не только с модуляцией воспаления, но и с непосредственным противовирусным действием этих соединений. Например, байкалин тормозил репликацию вируса птичьего инфекционного бронхита (IBV) на клетках in vitro на разных стадиях цикла репликации (адсорбция, инвазия, интернализация, высвобождение вирусов) [22]. Он также блокировал экспрессию матричной РНК и полимеразы энтеровируса EV71/3D на ранних стадиях инфекции энтеровирусом, снижая экспрессию FasL и каспазы-3 [23].
Кверцетин тормозит развитие различных вирусных инфекций (гепатит С, лихорадка денге, Эбола, грипп А и др.) посредством прямого взаимодействия с белками-мишенями вирусов: белок NS5A вирусов HCV и DENV-2, белок VP35 вируса EBOV). Потенциально обнаружено 38 генов, взаимодействующих с кверцетином – AKT1, EGFR, SRC, MMP9, MMP2, KDR, IGF1R, PTK2, ABCG2 [24]. Пероральный прием кверцетина у свиней, вакцинированных живым вирусом репродуктивно-респираторного синдрома свиней 1 (PRRSV-1), повышает уровень интерферона-γ и снижает уровень TGF-β, что может способствовать снижению виремии [25]. У мышей линии ABD2F1/Jena кверцетин тормозил распространение вирусов Mengo ML/SK/MM из места инъекции в лимфатические узлы и в другие органы, останавливая развитие вирусного энцефаломиокардита [26].
Рутин, α-токоферол и L-аскорбиновая кислота усиливают экспрессию интерферонов 1-го и 2-го типов и снижают экспрессию провоспалительных цитокинов в макрофагах, инфицированных респираторными вирусами свиней PRRSV. Стимуляция клеток in vitro рутином, α-токоферолом или L-аскорбиновой кислотой значительно повышала уровни экспрессии генов интерферонового ответа (IRF3, IRF7, интерферонов α, β и γ) [27].
Полифенол куркумин ингибирует циклы репликации вируса простого герпеса, цитомегаловируса человека, вируса Эпштейна–Барра, вируса псевдобешенства [28].
Полифенол ЭГКГ (50 мкМ) ингибирует цикл репликации вируса Эпштейна–Барра посредством модуляции LMP1-зависимых сигнальных путей ERK1/2, p3-МАРК и JNK [29]. Молекула ЭГКГ инактивирует клинические изоляты вируса простого герпеса (ВПГ), снижая в 1000 раз титры ВПГ-1/2 (за 10–40 мин). Противовирусная активность ЭГКГ обусловлена прямым действием на ВПГ-вирион [30]. ЭГКГ ингибирует репликацию энтеровируса EV71 на 95% в клетках линии Vero E6 в культуре, что приводит к 5-кратному увеличению жизнеспособности клеток и снижению генерации активных форм кислорода [31]. Микромолярные концентрации ЭГКГ способствуют кластеризации частиц энтеровирусов при высоких титрах вирусов (107 БОЕ/мл). Кластеризация вирусов не нарушалась даже после 50-кратного разведения вирионов, уже кластеризованных посредством ЭГКГ. Данный полифенол осуществляет противовирусный эффект посредством связывания с несколькими сайтами на поверхности вириона, что уменьшает связывание с клеточной поверхностью и предотвращает высвобождение вирусной РНК [32].
Биофлавоноиды и полифенолы в терапии гриппа и острых респираторных заболеваний / Bioflavonoids and polyphenols in the treatment of influenza and acute respiratory diseases
Байкалин индуцирует продукцию интерферона-γ и подавляет репликацию вируса гриппа H1N1. В эксперименте у мышей он ингибировал прогрессирование инфекции, вызванной вирусом гриппа, посредством снижения избыточной активации макрофагов типов CD11b+ и F4/80+ (на 90%) при сохранении доли M1-поляризованных макрофагов в жидкости бронхоальвеолярного лаважа. Отмечены активация путей интерферона и ингибирование репликации вируса [33]. Байкалин блокирует инфекцию, вызванную респираторно-синцитиальным вирусом (РСВ), уменьшает инфильтрацию Т-лимфоцитов и повреждение легких у мышей. IC50 байкалина для инфекции РСВ составила 19,9±1,8 мкМ, тогда как цитотоксическая концентрация была гораздо выше (370±10 мкМ) (рис. 4) [34].

Рисунок 4. Байкалин уменьшает повреждение ткани легких и снижает вирусную нагрузку респираторно-синцитиального вируса (РСВ) у мышей линии Balb/C. Животных заражали РСВ (5×106 БОЕ на 100 мкл) путем назальной инстилляции, и на следующий день байкалин вводили через зонд, а рибавирин (50 мг/кг) внутрибрюшинно в течение 5 сут (по данным [34]):
a – cрезы легких, окрашенные гематоксилином и эозином (масштабная планка 100 мкм); b – вирусные титры из гомогенатов легких.
* p<0,05; ** p<0,01.
Figure 4. Baicalin reduces lung tissue damage and reduces respiratory syncytial virus (RSV) load in Balb/C mice. Animals were infected with RSV (5×106 PFU per 100 μl) by nasal instillation, and the next day baicalin was administered through a tube, and ribavirin (50 mg/kg) was administered intraperitoneally for 5 days (after [34]):
a – lung sections stained with hematoxylin and eosin (scale bar 100 µm); b – viral titers from lung homogenates.
* p<0.05; ** p<0.01
Стимулируя ответ врожденного противовирусного иммунитета, байкалин ингибирует репликацию РСВ. В лимфоцитах он индуцирует биосинтез интерферонов 1-го типа и устраняет формирование фибротических утолщений эпителия в тканях легких. В частности, байкалин ингибирует синтез вирусных белков NS1 и NS2, модулируя активность рибосом (рис. 5, 6) [35].
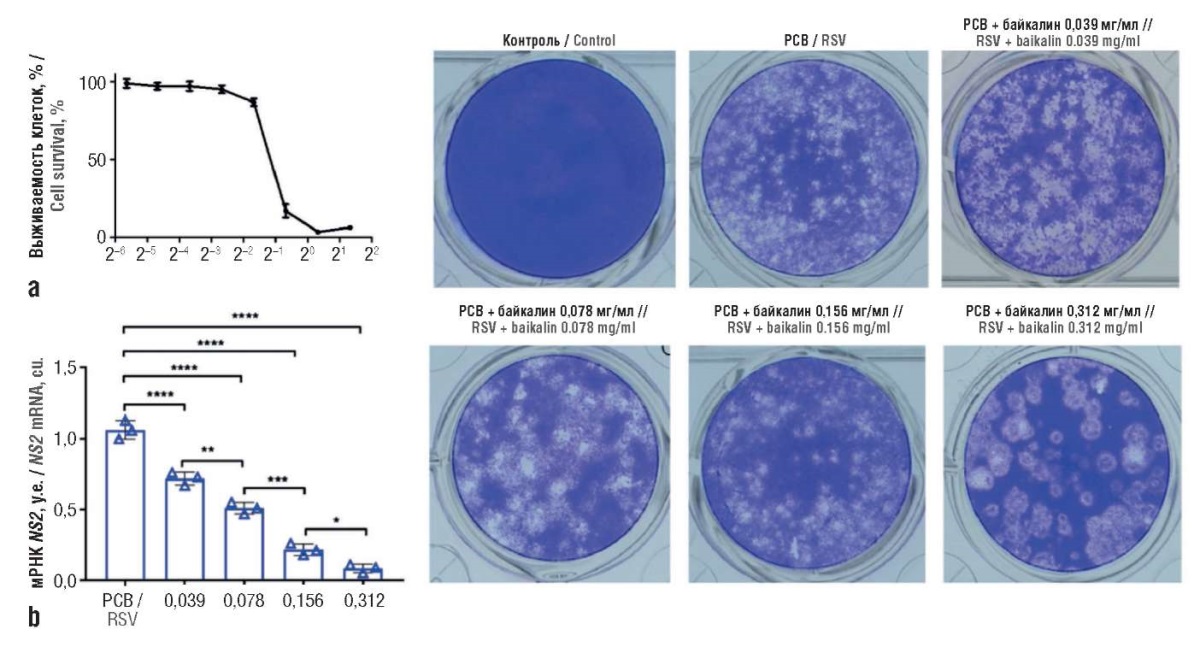
Рисунок 5. Байкалин продемонстрировал противовирусную активность против респираторно-синцитиального вируса (РСВ) in vitro (по данным [35]):
a – цитотоксическое влияние байкалина определяли путем оценки жизнеспособности клеток с помощью теста CCK-8, клетки HEp-2 трижды обрабатывали байкалином в повышенных концентрациях в течение 72 ч, поглощение при 570 нм по отношению к поглощению контрольной пробы наносили на график для оценка значения TC50=0,2 мг/мл;
b – экспрессию вирусных транскриптов гена NS2 анализировали в клетках HEp-2, инфицированных РСВ и обработанных указанными дозами байкалина, нормализация на экспрессию гена активна (Actb).
мРНК – матричная рибонуклеиновая кислота.
* р<0,05; ** р<0,01; *** р<0,001; **** р<0,0001 (по дисперсионному тесту с апостериорным критерием Тьюки)
Figure 5. Baicalin has demonstrated antiviral activity against respiratory syncytial virus (RSV) in vitro (after [35]):
a – the cytotoxic effect of baicalin was determined by assessing cell viability using the CCK-8 assay, HEp-2 cells were treated with baicalin at elevated concentrations three times for 72 hours, the absorbance at 570 nm with respect to the absorbance of the control sample was plotted to evaluate the value of TC50=0.2 mg/ml;
b – expression of viral transcripts of the NS2 gene was analyzed in HEp-2 cells infected with RSV and treated with the indicated doses of baicalin, normalization to gene expression is active (Actb).
mRNA – matrix ribonucleic acid.
* p<0.05, ** p<0.01, *** p<0.001, **** p<0.0001 (according to ANOVA with Tukey's post hoc test)

Рисунок 6. Потенциальный механизм ответа врожденного иммунитета, стимулированного байкалином против респираторно-синцитиального вируса (РСВ). Байкалин подавляет трансляцию вирусного белка М и транскрипцию вирусных генов NS1 и NS2, снижает экспрессию провоспалительных цитокинов, одновременно индуцируя экспрессию интерферона I типа (адаптировано из [35]).
мРНК – матричная рибонуклеиновая кислота; ИФН – интерферон; ИЛ – интерлейкин; ФНО – фактор некроза опухоли
Figure 6. Potential mechanism of innate immune response stimulated by baicalin against respiratory syncytial virus (RSV). Baicalin inhibits the translation of the viral M protein and the transcription of the viral genes NS1 and NS2, reduces the expression of pro-inflammatory cytokines, while simultaneously inducing the expression of type I interferon (adapted from [35]).
mRNA – matrix ribonucleic acid; IFN – interferon; IL – interleukin; TNF – tumor necrosis factor
Гесперидин тормозит репликацию вируса гриппа А in vitro путем ингибирования вирусной сиалидазы, участвующей в проникновении вирусов в клетки [36]. Достаточно низкие дозы гесперидина (18 мг/кг) регулируют сигнальный путь Jagged1/Notch1, снижая повреждение ткани легких у мышей с бронхиолитом, вызванным РСВ. Воспроизведение модели РСВ-бронхиолита повышало уровни ИЛ-4, ИЛ-6 и ФНО-α, сигнальных белков Jagged1 и Notch1 в жидкости бронхоальвеолярного лаважа, увеличивая долю макрофагов типа M1, воспаление легких и показатели секреции слизи (все р<0,001) [37]. Гесперидин ослабляет повреждение легких, индуцированное вирусом гриппа H1N1 у крыс, снижая выработку провоспалительных цитокинов путем подавления сигнальных путей MAPK [38].
Кверцетин ингибирует проникновение различных штаммов вируса гриппа А внутрь клеток со значениями констант IC50 в микромолярном диапазоне (H1N1, IC50=7,8±1,1 мкг/мл, A/FM-1/47/1 – IC50=6,2±0,5 мкг/мл, A/Aichi/2/68 – IC50=2,7±1,9 мкг/мл) [39]. Кверцетин (80 мг/кг, 7 дней) ослаблял воспаление в носовых пазухах и воспалительную реакцию в легких и головном мозге на экспериментальной модели острого риносинусита, вызванного введением ЛПС из E. coli (10 мкг) у крыс. Введение ЛПС повышало уровни ФНО-α, ИЛ-6 и ИЛ-1β в сыворотке, слизистой оболочке носа и ткани легких. Кверцетин уменьшал количество экссудата и степень воспаления в пластинке носа и придаточных пазухах, параллельно снижая секрецию ФНО-α (–35,4%), ИЛ-6 (–35,8%), а также уровни ФНО-α (–43%) и ИЛ-6 (–25%) в головном мозге [40].
Обнаружено, что новый биофлавоноид лейкодельфинидин (антоциан из экстракта скорлупы арахиса) может ингибировать основную протеазу коронавируса SARS-CoV-2 [41], а также проявлять антидиабетические и антибактериальные свойства [42].
Полифенол ЭГКГ проявляет мультитаргетное действие против вирусов гриппа, ингибируя вирусную нейраминидазу, РНК-зависимую РНК-полимеразу, гемагглютинацию, проникновение и адсорбцию вируса, и в то же время не формирует резистентность вирусов [43]. В частности, ЭГКГ инактивирует вирус гриппа и коронавирус человека 229E. При этом противовирусные эффекты ЭГКГ наблюдаются при достаточно низких концентрациях (ЕС50=0,93–2,78 мкг/мл), в то время как цитотоксическая доза ТД50 – на порядок выше (ТД50=65–85 мкг/мл) [44].
Полифенол куркумин предотвращает репликацию РСВ и эпителиальные реакции на него в эпителиальных клетках носа человека путем ингибирования NF-κB и COX2 [45]. Он ингибирует активность вируса гриппа А, снижая репликацию после проникновения вируса внутрь клеток и регулируя продукцию цитокинов макрофагами, облегчает тяжелую гриппозную пневмонию у мышей, поскольку ингибирует NF-κB в макрофагах [46]. Противовоспалительное действие куркумина на РСВ на модели мышей проявлялось как снижение выработки в легких медиаторов воспаления MIP-1a, ФНО-α и интерферона-γ, что приводит к облегчению тяжести патологии легких [47].
Биофлавоноиды и полифенолы в терапии COVID-19 / Bioflavonoids and polyphenols in COVID-19 therapy
Биофлавоноиды и полифенолы могут непосредственно взаимодействовать с белками коронавирусов, тем самым модулируя взаимодействия вирусных белков с белками-рецепторами протеома человека. В предварительных исследованиях вируса SARS-CoV-2 было предположено, что ангиотензин-превращающий фермент (АПФ, ген ACE2) может являться рецептором коронавирусных частиц. К сожалению, некоторые «публикаторы» сделали из АПФ чуть ли не фетиш, постоянно вещая об «исключительной важности» данного рецептора для инфицирования организма человека коронавирусом и делая совершенно неправильные выводы о необходимости отмены ингибиторов АПФ пациентам с артериальной гипертензией, которые заболели COVID-19.
В реальности, однако, взаимодействия белков вируса SARS-CoV-2 с протеомом человека намного сложнее. Крупномасштабная карта взаимодействий белков коронавируса с протеомом человека, построенная в работе [48], выявила 332 таргетных белка протеома человека, достоверно взаимодействующих с 26 белками вируса SARS-CoV-2. Белки человека, с которыми взаимодействуют вирусные белки, участвуют в весьма различных биологических процессах, в т.ч. в репликации ДНК (с этими белками взаимодействует вирусный белок Nsp1), эпигенетической регуляции экспрессии генов (с которыми взаимодействуют вирусные белки Nsp5, Nsp8, Nsp13, E), переносе везикул (Nsp2, Nsp6, Nsp7, Nsp10, Nsp13, Nsp15, Orf3a, E, M, Orf8), модификации липидов (спайк-белок), регуляции метаболизма РНК (Nsp8, N), активности убиквитинлигазы (Orf10), сигнальных каскадах (Nsp8, Nsp13, N, Orf9b), ядерном транспорте и др.
Эти взаимодействия коронавирусных белков с белками протеома человека могут модулироваться биофлавоноидами и полифенолами. ЭГКГ, байкалин и кверцетин ингибируют коронавирусную эндорибонуклеазу SARS-CoV-2 Nsp15, посредством которой коронавирус уклоняется от врожденного иммунного ответа хозяина на начальном этапе инфекции.
Противовирусная активность ЭГКГ была подтверждена в тестах с использованием SARS-CoV-2: значение константы PRNT50 (концентрация лиганда, при которой количество вирусных бляшек снижается на 50%) лежало в наномолярном диапазоне (200 нмоль/л) [49]. Байкалин ингибирует вирусную РНК-полимеразу SARS-CoV-2 [50]. Рутин ингибирует спайк-белок и основную протеазу SARS-CoV-2 3CLpro: значение константы ингибирования лежит в нижнем микромолярном диапазоне (Ki=11 мкМ). При этом рутин напрямую взаимодействует с активным центром протеазы 3CLpro, нейтрализуя активность каталитических остатков His41 и Cys145 (рис. 7) [51].
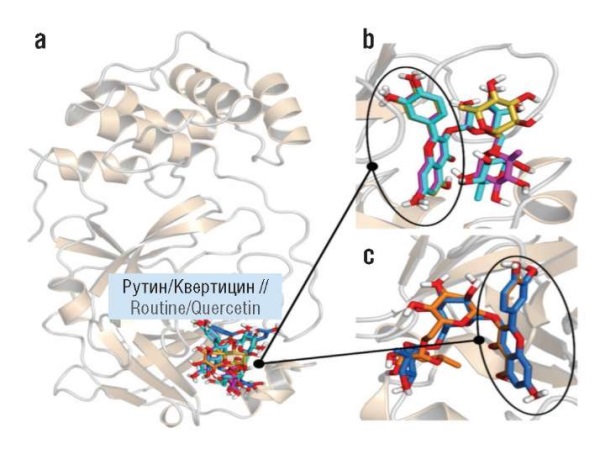
Рисунок 7. Предположительное расположение рутина и кверцетина в активном центре основной вирусной протеазы 3Clpro (адаптировано из [51]):
a – ленточное представление белка с наиболее энергетически выгодными позициями лигандов; b – наложение возможных вариантов расположения рутина и кверцетина (обведены); c – второй вариант расположения рутина и кверцетина
Figure 7. Proposed location of rutin and quercetin in the active site of the main viral protease 3Clpro (adapted from [51]):
a – band representation of the protein with the most energetically favorable ligand positions; b – overlay of possible arrangements of rutin and quercetin (circled);
c – second arrangement of rutin and quercetin
Противовирусные, иммуномодулирующие и антикоагулянтные эффекты кверцетина важны для профилактики и лечения COVID-19. Кверцитин – агонист белка транскрипционного регулятора NRF2, что способствует торможению репликации вируса SARS-CoV-2 в клетках легких. Он ингибирует проникновение коронавирусных вирионов в клетки организма-хозяина, а также воспалительные сигнальные пути (каскады NF-κB, инфламмасомы и ИЛ-6) (pис. 8) [52].

Рисунок 8. Механизм действия кверцетина против SARS-CoV-2 (адаптировано из [52]).
АПФ-2 – ангиотензинпревращающий фермент и другие внеклеточные рецепторы вирионов; оцРНК – одноцепочечная рибонуклеиновая кислота; 3Clpro (англ. 3C-like protease) – 3C-подобные вирусные протеазы; NF-κB (англ. nuclear factor kappa-B) – внутриядерный фактор каппа-B; ИЛ – провоспалительные интерлейкины; NLRP (англ. Nucleotide-binding oligomerization domain, Leucine rich Repeat and Pyrin domain containing Proteins) – нуклеотид-связывающий домен олигомеризации; NRF2 (англ. Nuclear factor-erythroid-2-Related Factor 2) – ядерный фактор-2 эритроидного происхождения
Figure 8. Mechanism of action of quercetin against SARS-CoV-2 (adapted from [52]).
ACE-2 – angiotensin-converting enzyme 2 and other extracellular virion receptors; ssRNA – single stranded RNA; 3Clpro – 3C-like protease; NF-κB – nuclear factor kappa-B; IL – proinflammatory interleukins; NLRP – Nucleotide-binding oligomerization domain, Leucine rich Repeat and Pyrin domain containing Proteins; NRF2 – Nuclear factor-erythroid-2-Related Factor 2
Перспективы применения кверцетина в профилактике и лечении коронавирусных инфекций (SARS, MERS и др.) обусловлены не только его противовирусным действием, но и противомикробным, противовоспалительным, антиоксидантным эффектами. Кверцитин тормозит цикл репликации вирусов на многих стадиях (в т.ч. на стадии проникновения вирусов в клетку), ингибирует основную вирусную протеазу 3CLpro и папаиноподобную вирусную протеазу PLpro. Иммуномодулирующие эффекты кверцетина, особенно в синергизме с цинком, витаминами C, D и E и полифенолами, способствует укреплению врожденного противовирусного иммунитета и торможению гипервоспаления [53].
Прием кверцетина (1000 мг/сут) пациентами на ранней стадии COVID-19 (n=42) приводил к тому, что уже через 1 нед лечения у 16 больных из 21, принимавших кверцетин, анализ на SARS-CoV-2 был отрицательным (группа плацебо: только 2 пациента из 21). При этом у 12 пациентов из 21 интенсивность коронавирусной симптоматики достоверно снизилась (группа плацебо: 4 пациента из 21). Кверцетин снижал уровни лактатдегидрогеназы (–35,5%), ферритина (-40%), СРБ (–54,8%) и D-димера (–11,9%), что свидетельствует о снижении интенсивности воспаления и полиорганной патологии [54]. Прием кверцетина в течение 30 дней пациентами с COVID-19 (n=152) приводил к сокращению продолжительности госпитализации, потребности в неинвазивной кислородной терапии, снижал необходимость размещения пациентов в отделении интенсивной терапии и способствовал снижению смертности. Результаты клинического исследования подтвердили высокий профиль безопасности кверцетина и показали, что его прием способствует преодолению астенических состояний [55].
У госпитализированных пациентов с тяжелым течением COVID-19 (n=60) показана терапевтическая эффективность кверцетина (1000 мг в сочетании с противовирусными препаратами). В течение 7 дней все больные получали противовирусные препараты (ремдесивир или фавипиравир); в опытной группе пациенты получали кверцетин в дополнение к противовирусным препаратам. Прием кверцетина приводил к снижению сывороточных уровней высокочувствительного СРБ и лактатдегидрогеназы (что соответствует снижению риска цитокинового шторма и полиорганной патологии) и способствовал сокращению продолжительности госпитализации [56].
Двойное слепое плацебо-контролируемое исследование с участием невакцинированных пациентов с COVID-19 (n=216) показало, что гесперидин (1000 мг/сут, 14 дней) помогает уменьшить так называемые симптомы группы А (любой из четырех основных симптомов: лихорадка, кашель, одышка, аносмия). На день «0» встречаемость симптомов была следующей: кашель (53,2%), слабость (44,9%), головная боль (42,6%), боль (35,2%), боль в горле (28,7%), насморк (26,9%), озноб (22,7%), одышка (22,2%), аносмия (18,5%), лихорадка (16,2%), диарея (6,9%), тошнота/рвота (6,5%), спутанность сознания (3,2%). На 14-й день в группе принимавших гесперидин показано уменьшение встречаемости симптомов группы А с 50,9% до 36,4% (отношение шансов 0,55; 95% доверительный интервал 0,32–0,96; р=0,03 при сравнении с плацебо) [57].
Полифенол ЭГКГ ингибирует прооксидантные ферменты (в т.ч. НАДФ-оксидазу1), активирует антиоксидантные ферменты (супероксиддисмутазу, каталазу) и биосинтез глутатиона, оказывая противовоспалительное, антифибротическое и метаболическое действие. Следовательно, ЭГКГ может быть полезен для лечения заболеваний органов дыхания с острыми или хроническими воспалительными, окислительными и фиброзирующими процессами в их патогенезе (респираторные инфекции, COVID-19, бронхиальная астма, ХОБЛ, фиброз легких, силикоз) [58]. В эксперименте на мышах ЭГКГ снижал репликацию коронавируса OC43 человека. Сканирующая электронная микроскопия показала, что лечение ЭГКГ снижало продукцию коронавирусных белков и собранных вирионов в клетках in vitro (pис. 9) и уровни коронавирусной матричной РНК в легких мышей in vivo [59].

Рисунок 9. Эпигаллокатехин-3-галлат (ЭГКГ) подавляет репликацию коронавируса OC43 в клетках бронхов линии HCT8 (по данным [59]):
a – ЭГКГ и поверхность клеток эпителия бронхов (клетки были инфицированы вирусом HCoV-OC43 и обработаны указанной концентрацией ЭГКГ, через 72 ч после заражения клетки провели электронную микроскопию – масштабная планка 1 мкм); b – анализ инфицированных клеток антителами против коронавируса OC43 через 4 сут после инфицирования; с – количественная оценка уровней антител против коронавируса.
* р<0,01; ** р < 0,005
Figure 9. Epigallocatechin-3-gallate (EGCG) inhibits OC43 coronavirus replication in HCT8 bronchial cells (after [59]):
a – EGCG and bronchial epithelial cell surface (the cells were infected with the HCoV-OC43 virus and treated with the indicated concentration of EGCG, and electron microscopy was performed 72 hours after infection; the scale bar was 1 µm); b – analysis of infected cells with antibodies against coronavirus OC43 4 days after infection; c – quantification of antibody levels against coronavirus.
* p<0.01; ** p<0.005
Куркумин ингибирует инфламмасому NLRP3, которая усугубляет острое воспаление при СOVID-19. Он модулирует активность ряда белков внутриклеточной передачи провоспалительных сигналов (IBB, NF-κB, ERK1/2, TGF-b, NLRP3, p38MAPK, Nrf2, Notch-1, AMPK, TLR-4) [60]. Куркумин ингибирует репликацию коронавируса SARS-CoV-2 (варианты D614G и Delta) в клетках Vero E6 in vitro посредством множественных противовирусных механизмов. При воздействии на мононуклеарные клетки периферической крови противовоспалительный эффект куркумина проявлялся как снижение уровней цитокинов ИЛ-1β, ИЛ-6 и ИЛ-8 (рис. 10) [61].
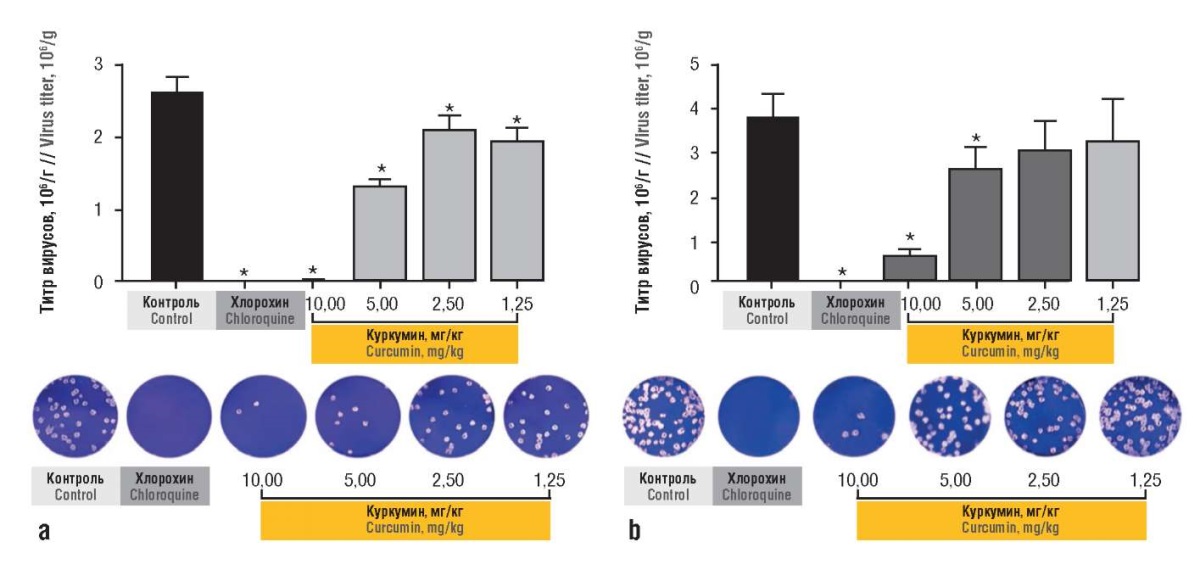
Рисунок 10. Противовирусный эффект куркумина против коронавируса SARS-CoV-2. Показано снижение титра штамма D614G в клетках линии Vero E6 после обработки куркумином до и после инфекции (n=4) (хлорохин был включен в качестве положительного контроля ингибирования вируса, внизу приведены репрезентативные фотографии вирусных бляшек на клетках Vero E6 при различных концентрациях куркумина). Результаты применения куркумина (по данным [61]):
a – до инфицирования клеток (сценарий «профилактика»), b – после инфицирования клеток (сценарий «терапия»).
* р=0,01 (по критерию Манна–Уитни)
Figure 10. Antiviral effect of curcumin against SARS-CoV-2 coronavirus. A decrease in the titer of D614G strain was shown in Vero E6 cells after treatment with curcumin before and after infection (n=4); chloroquine was included as a positive control for viral inhibition; below are representative photographs of viral plaques on Vero E6 cells at various curcumin concentrations. The results of the use of curcumin (after [61]):
a – before infection of cells (Prevention scenario); b – after infection of cells (Therapy scenario).
* p=0.01 (Mann–Whitney test)
Систематический обзор шести клинических исследований подтвердил эффективность куркумина для лечения пациентов, госпитализированных с COVID-19. Дополнение стандартной терапии приемом куркумина приводило к значительному уменьшению симптомов коронавирусной инфекции, снижению продолжительности госпитализации и смертности (за счет профилактики цитокинового шторма и/или ослабления его интенсивности). Метаанализ подтвердил, что прием куркумина статистически значимо (p<0,05) снижает уровни провоспалительных цитокинов ИЛ-1β и ИЛ-6, увеличивая концентрации противовоспалительных цитокинов ИЛ-10 и ИЛ-35 в крови. Очевидно, что адъювантная терапия куркумином является более безопасным вариантом для улучшения исходов COVID-19, чем гепатотоксичные противовирусные препараты синтетического происхождения [62].
Противовирусные эффекты биофлавоноидов и полифенолов могут быть усилены за счет улучшения их всасывания посредством сапонина глицирризина и алкалоида пиперина. Кроме того, глицирризин (сапонин из экстракта солодки) проявляет собственные противовирусные и противовоспалительные эффекты, способствует снижению инсулинорезистентности и нарушений липидного профиля [63]. Противовоспалительное действие глицирризина и его производных связано с модуляцией уровней минералокортикоидов, регулировкой уровней провоспалительных цитокинов, сигнальных каскадов HMGB1 и NF-κB, активности TLR [64]. Глицирризин может ингибировать РНК-полимеразу и вирусную протеазу Mpro вируса SARS-CoV-2, а также блокировать прикрепление вируса к клеткам посредством шиповидного белка оболочки вируса [65].
Терапия пациентов с COVID-19 средней степени тяжести (n=50) посредством смеси глицирризина (60 мг/сут) и босвеллиевой кислоты (200 мг/сут) в течение 14 дней приводила к сокращению времени выздоровления (7±1 сут, плацебо 12,5±4 сут; p=0,0001), более низкой смертности (0%, плацебо 20%; р=0,0035), более низкому уровню СРБ (4,8±1,2 мг/л, плацебо 11±4,6 мг/л; р=0,00004), ферритина (88±70 нг/л, плацебо 119±90 нг/л; р=0,055), АЛТ (25±19 ЕД/л, плацебо 36±10 ЕД/л; р=0,059) и более высокому проценту лимфоцитов (32±5%, плацебо 25±21%: р=0,016) [66].
О синергидном применении биофлавоноидов и полифенолов в терапии ОРВИ и COVID-19 / On the synergistic use of bioflavonoids and polyphenols in the treatment of ARVI and COVID-19
Описанные в предыдущих разделах молекулярные механизмы противовирусного, противовоспалительного и тканезащитного действия биофлавоноидов и полифенолов позволяют предположить, что их совместное использование может существенно повысить эффективность профилактики, терапии и реабилитации пациентов после тяжелых форм ОРВИ и COVID-19. Основные эффекты рассмотренных в настоящем анализе молекул суммированы в таблице 1.
Таблица 1. Основные эффекты исследованных молекул (составлено авторами)
Table 1. Main effects of the studied molecules (compiled by the authors)
|
Молекула / Molecule |
Вид органического соединения / Organic compound type |
Эффект / Effect |
|
Байкалин / Baicalin |
Биофлавоноид / Bioflavonoid |
Оказывает выраженное противовоспалительное, противовирусное, регенеративное и антистрессорное действие (модуляция ГАМК-рецепторов), нормализует обмен сахаров / Has a pronounced anti-inflammatory, antiviral, regenerative and antistress effects (modulation of GABA receptors), normalizes sugar metabolism |
|
Гесперидин / Hesperidin |
Биофлавоноид / Bioflavonoid |
Проявляет антиоксидантные, ангиопротекторные, вазодилаторные, иммуномодулирующие (прежде всего, противовоспалительные) эффекты / Exhibits antioxidant, angioprotective, vasodilatory, immunomodulatory (primarily anti-inflammatory) effects |
|
Рутин / Rutin |
Биофлавоноид / Bioflavonoid |
Антигипоксант, способствующий ангиопротекции, вазодилатации и улучшению клеточного дыхания, проявляет противовирусное и противовоспалительное действие / Antihypoxant that promotes angioprotection, vasodilation and improvement of cell respiration, exhibits antiviral and anti-inflammatory effects |
|
Кверцетин / Quercetin |
Биофлавоноид / Bioflavonoid |
Антиоксидант, проявляющий противовирусные, противовоспалительные, гепатопротекторные, кардиопротекторные эффекты при острых инфекционных процессах / Antioxidant exhibiting antiviral, anti-inflammatory, hepatoprotective, cardioprotective effects in acute infections |
|
Лейкодельфинидин / Leukodelphinidin |
Биофлавоноид и антоциан (из скорлупы арахиса обыкновенного) / Bioflavonoid and anthocyanin (from peanut shells) |
Антиоксидант, проявляющий противовирусное, бактерицидное, противоотечное, ангиопротекторное действие / Antioxidant exhibiting antiviral, bactericidal, antiedematous, angioprotective effect |
|
Эпигаллокатехин-3-галлат / Epigallocatechin-3-gallate |
Полифенол / Polyphenol |
Имеет антиоксидантные, противовоспалительные, нейропротекторные, кардиопротекторные, регенеративные и антидиабетические свойства / It has antioxidant, anti-inflammatory, neuroprotective, cardioprotective, regenerative and antidiabetic properties |
|
Куркумин / Curcumin |
Полифенол / Polyphenol |
Оказывает противовоспалительное, противовирусное, регенераторное и антиоксидантное действие / It has anti-inflammatory, antiviral, regenerative and antioxidant effects |
|
Глицирризин / Glycyrrhizin |
Сапонин солодки / Licorice saponin |
Способствует всасыванию биофлавоноидов и полифенолов, дополнительно проявляет противовоспалительное и противовирусное действие, препятствуя проникновению вирусов в клетку и сборке вирионов / Promotes absorption of bioflavonoids and polyphenols, additionally shows anti-inflammatory and antiviral effect, preventing the penetration of viruses into the cell and virion assembly |
|
Пиперин / Piperine |
Алкалоид (из экстракта перца черного) / Alkaloid (from black pepper extract) |
Стимулирует слизистую кишечника и активирует всасывание биофлавоноидов и полифенолов (повышая, например, всасывание куркумина в 20 раз) / Stimulates the intestinal mucosa and activates the absorption of bioflavonoids and polyphenols (increasing, for example, the absorption of curcumin by 20 times) |
Примечание. ГАМК – гамма-аминомасляная кислота.
Note. GABA – gamma-aminobutyric acid.
Имеющиеся к настоящему времени доказательные данные позволяют констатировать эффективность комбинаций биофлавоноидов, полифенолов, глицирризина и пиперина. В частности, прием куркумина (500 мг/сут) в сочетании с пиперином (5 мг/сут, 14 сут) амбулаторными пациентами с COVID-19 (n=46) приводил к значительному снижению астенических состояний по сравнению с группой плацебо (р=0,025) [67].
Пероральный прием куркумина (1050 мг/сут) совместно с пиперином (5 мг/сут) с целью улучшения всасывания полифенолов снижал смертность и продолжительность госпитализации пациентов с умеренным и тяжелым течением COVID-19 [68]. Важно подчеркнуть, что в данном исследовании все пациенты также принимали пробиотики (которые, как известно, в существенной мере способствуют повышению эффективности терапии COVID-19). У больных с легкой, умеренной и даже тяжелой симптоматикой COVID-19 лечение куркумином и пиперином по сравнению с пациентами контрольной группы способствовало более быстрому симптоматическому выздоровлению (устранение лихорадки, навязчивого «ковидного» кашля, боли в горле и одышки), тормозило прогрессию к более тяжелым формам заболевания, улучшало оксигенацию крови [68].
Пероральный прием куркумина (168 мг/сут), кверцетина (260 мг/сут) и витамина D3 (360 МЕ/сут в течение 14 дней) пациентами с COVID-19 (n=25) приводил к большему снижению СРБ в сыворотке (до 11,0 мг/дл), чем стандартная фармакотерапия (парацетамол и антибиотик азитромицин, 22 мг/дл; p=0,006) [69].
Глицирризин улучшает эффективность нанокапсулирования биофлавоноидов, способствуя улучшению доставки кверцетина к печени и облегчению острой печеночной недостаточности. Нанокапсулы кверцетина и глицирризина были более эффективны в восстановлении повреждения печени с точки зрения снижения уровней АЛТ, АСТ и общего билирубина, чем эти вещества по отдельности. Гистопатологический анализ показал, что нанокапсулы из кверцетина и глицирризина обращали вспять повреждение тканей печени, снижая экспрессию генов провоспалительных факторов (ФНО-α, ИЛ-6, моноцитарный хемотаксический белок MCP-1) [70].
Многокомпонентные фитопрепараты / Multicomponent phytopreparations
Биофлавоноиды байкалин, гесперидин, рутин, кверцетин, лейкодельфинидин, полифенолы эпигаллокатехин-3-галлат и куркумин, сапонин глицирризин и алкалоид перца пиперин входят в состав фитоформулы Валеоникс® (Uniland Swiss Holding AG, Швейцария), предназначенной для профилактики, лечения и реабилитации пациентов с COVID-19. Для профилактики и лечения COVID-19 важны противовирусные [1][5][22][23], бактерицидные, противовоспалительные, противоотечные, иммуномодулирующие эффекты компонентов фитоформулы [47–49]. Для реабилитации переболевших COVID-19 важны антиоксидантные, ангиопротекторные, вазодилаторные, противовоспалительные, регенеративные, антистрессорные, антигипоксантные, антидиабетические, гепатопротекторные и кардиопротекторные эффекты биофлавоноидов и полифенолов фитокомплекса Валеоникс®. Пиперин и глицирризин, способствуя улучшению всасывания биофлавоноидов и полифенолов, улучшают фармакокинетику фитоформулы [67–69] и усиливают синергидные эффекты каждого из ее компонентов.
Результаты фундаментальных и клинических исследований позволяют предположить, что использование многокомпонентных фитоформул – эффективный подход к лечению COVID-19, который предотвращает формирование резистентности коронавируса SARS-CoV-2 к терапии биофлавоноидами и полифенолами [48–55]. Одновременно мультикомпонентная фитоформула вследствие своего мультитаргетного действия позволяет избежать полипрагмазии и повысить безопасность лечения COVID-19. Мультитаргетное действие биофлавоноидов и полифенолов (включая, в частности, антистрессорные эффекты байкалина, реализующиеся через рецепторы гамма-аминомасляной кислоты) важно и для лечения пациентов с «длинным ковидом», сопровождающимся хроническим стрессом. В настоящее время планируется открытое сравнительное исследование эффективности применения фитокомплекса Валеоникс® у пациентов, перенесших COVID-19 в средней или тяжелой форме.
ЗАКЛЮЧЕНИЕ / CONCLUSION
Профилактика и лечение вирусных инфекций, в т.ч. COVID-19, – актуальное направление современной фармакотерапии. Быстро развивающаяся резистентность вирусов к синтетическим противовирусным препаратам указывает на необходимость использования веществ, характеризующихся мультитаргетным действием (во избежание полипрагмазии и для повышения безопасности лечения). Биофлавоноиды и синергидные им полифенолы проявляют не только мультитаргетные противовирусные эффекты, ингибируя основную протеазу, спайк-белки и другие вирусные белки, но и выраженное противовоспалительное, гепатопротекторное и иммуномодулирующее действие.
В статье представлены результаты систематического анализа фармакологии биофлавоноидов. Детально описаны молекулярные механизмы действия биофлаваноидов (байкалин, гесперидин, рутин, кверцетин, лейкодельфинидин) и полифенолов (эпигаллокатехин-3-галлат и куркумин), их противовоспалительные, противовирусные, бактерицидные и регенеративные эффекты, важные для профилактики и реабилитации пациентов, перенесших COVID-19 и другие респираторные вирусные инфекции.
1. НАДФ – никотинамидадениндинуклеотидфосфат.
Список литературы
1. Торшин И.Ю., Громова О.А. Микронутриенты против коронавирусов. М.: ГЭОТАР-Медиа; 2020: 112 с.
2. Торшин И.Ю., Громова О.А., Чучалин А.Г., Журавлев Ю.И. Хемореактомный скрининг воздействия фармакологических препаратов на SARS-CoV-2 и виром человека как информационная основа для принятия решений по фармакотерапии COVID-19. ФАРМАКОЭКОНОМИКА. Современная фармакоэкономика и фармакоэпидемиология. 2021; 14 (2): 191–211. https://doi.org/10.17749/2070-4909/farmakoekonomika.2021.078.
3. Торшин И.Ю., Громова О.А., Стаховская Л.В. и др. Анализ 19,9 млн публикаций базы данных PubMed/MEDLINE методами искусственного интеллекта: подходы к обобщению накопленных данных и феномен “fake news”. ФАРМАКОЭКОНОМИКА. Современная фармакоэкономика и фармакоэпидемиология. 2020; 13 (2): 146–63. https://doi.org/10.17749/2070-4909/farmakoekonomika.2020.021.
4. Sudre C.H., Murray B., Varsavsky T., et al. Attributes and predictors of long COVID. Nat Med. 2021; 27 (4): 626–31. https://doi.org/.1038/s41591-021-01292-y.
5. Bao M., Ma Y., Liang M., et al. Research progress on pharmacological effects and new dosage forms of baicalin. Vet Med Sci. 2022; 8 (6): 2773–84. https://doi.org/10.1002/vms3.960.
6. Yang J., Yang X., Li M. Baicalin, a natural compound, promotes regulatory T cell differentiation. BMC Complement Altern Med. 2012; 12: 64. https://doi.org/10.1186/1472-6882-12-64.
7. An H.J., Lee J.Y., Park W. Baicalin modulates inflammatory response of macrophages activated by LPS via calcium-CHOP pathway. Cells. 2022; 11 (19): 3076. https://doi.org/10.3390/cells11193076.
8. Kim S.J., Lee S.M. Effect of baicalin on toll-like receptor 4-mediated ischemia/reperfusion inflammatory responses in alcoholic fatty liver condition. Toxicol Appl Pharmacol. 2012; 258 (1): 43–50. https://doi.org/10.1016/j.taap.2011.10.005.
9. He C.X., Yu W.J., Yang M., et al. Baicalin inhibits LPS/IFN-γ-induced inflammation via TREM2/TLR4/NF-κB pathway in BV2 cells. Zhongguo Zhong Yao Za Zhi. 2022; 47 (6): 1603–10 (на кит. яз.). https://doi.org/10.19540/j.cnki.cjcmm.20211103.401.
10. Yang S., Zhang J., Chen D., et al. Quercetin supplement to aspirin attenuates lipopolysaccharide-induced pre-eclampsia-like impairments in rats through the NLRP3 inflammasome. Drugs R D. 2022; 22 (4): 271–9. https://doi.org/10.1007/s40268-022-00402-6.
11. Zhang M., Lin J.M., Li X.S., Li J. Quercetin ameliorates LPS-induced inflammation in human peripheral blood mononuclear cells by inhibition of the TLR2-NF-κB pathway. Genet Mol Res. 2016; 15 (2). https://doi.org/10.4238/gmr.15028297.
12. Haidari F., Heybar H., Jalali M.T., et al. Hesperidin supplementation modulates inflammatory responses following myocardial infarction. J Am Coll Nutr. 2015; 34 (3): 205–11. https://doi.org/10.1080/07315724.2014.891269.
13. Kadasa N.M., Abdallah H., Afifi M., Gowayed S. Hepatoprotective effects of curcumin against diethyl nitrosamine induced hepatotoxicity in albino rats. Asian Pac J Cancer Prev. 2015; 16 (1): 103–8. https://doi.org/10.7314/apjcp.2015.16.1.103.
14. Tabrizi R., Vakili S., Akbari M., et al. The effects of curcumin-containing supplements on biomarkers of inflammation and oxidative stress: a systematic review and meta-analysis of randomized controlled trials. Phytother Res. 2019; 33 (2): 253–62. https://doi.org/10.1002/ptr.6226.
15. Bao S., Cao Y., Fan C., et al. Epigallocatechin gallate improves insulin signaling by decreasing toll-like receptor 4 (TLR4) activity in adipose tissues of high-fat diet rats. Mol Nutr Food Res. 2014; 58 (4): 677–86. https://doi.org/10.1002/mnfr.201300335.
16. Dong S.J., Zhong Y.Q., Lu W.T., et al. Baicalin inhibits lipopolysaccharide-induced inflammation through signaling NF-κB pathway in HBE16 airway epithelial cells. Inflammation. 2015; 38 (4): 1493–501. https://doi.org/10.1007/s10753-015-0124-2.
17. Hao D., Li Y., Shi J., Jiang J. Baicalin alleviates chronic obstructive pulmonary disease through regulation of HSP72-mediated JNK pathway. Mol Med. 2021; 27 (1): 53. https://doi.org/10.1186/s10020-021-00309-z.
18. Chen W., Padilla M.T., Xu X., et al. Quercetin inhibits multiple pathways involved in interleukin 6 secretion from human lung fibroblasts and activity in bronchial epithelial cell transformation induced by benzo[a]pyrene diol epoxide. Mol Carcinog. 2016; 55 (11): 1858–66. https://doi.org/10.1002/mc.22434.
19. Huang R., Zhong T., Wu H. Quercetin protects against lipopolysaccharide-induced acute lung injury in rats through suppression of inflammation and oxidative stress. Arch Med Sci. 2015; 11 (2): 427–32. https://doi.org/10.5114/aoms.2015.50975.
20. Sordillo P.P., Helson L. Curcumin suppression of cytokine release and cytokine storm. A potential therapy for patients with Ebola and other severe viral infections. In Vivo. 2015; 29 (1): 1–4.
21. Avasarala S., Zhang F., Liu G., et al. Curcumin modulates the inflammatory response and inhibits subsequent fibrosis in a mouse model of viral-induced acute respiratory distress syndrome. PLoS One. 2013; 8 (2): e57285. https://doi.org/10.1371/journal.pone.0057285.
22. Feng H., Zhang K., Zhang K., et al. Antiviral activity and underlying mechanisms of baicalin against avian infectious bronchitis virus in vitro. Avian Pathol. 2022; 51 (6): 574–89. https://doi.org/10.1080/03079457.2022.2109453.
23. Li X., Liu Y., Wu T., et al. The antiviral effect of baicalin on enterovirus 71 in vitro. Viruses. 2015; 7 (8): 4756–71. https://doi.org/10.3390/v7082841.
24. Rahman M.A., Shorobi F.M., Uddin M.N., et al. Quercetin attenuates viral infections by interacting with target proteins and linked genes in chemicobiological models. In Silico Pharmacol. 2022; 10 (1): 17. https://doi.org/10.1007/s40203-022-00132-2.
25. Ruansit W., Charerntantanakul W. Oral supplementation of quercetin in PRRSV-1 modified-live virus vaccinated pigs in response to HP-PRRSV-2 challenge. Vaccine. 2020; 38 (19): 3570–81. https://doi.org/10.1016/j.vaccine.2020.03.019.
26. Veckenstedt A., Pusztai R. Mechanism of antiviral action of quercetin against cardiovirus infection in mice. Antiviral Res. 1981; 1 (4): 249–61. https://doi.org/10.1016/0166-3542(81)90015-2.
27. Suebsaard P., Charerntantanakul W. Rutin, α-tocopherol, and l-ascorbic acid up-regulate type I interferon-regulated gene and type I and II interferon expressions in monocyte-derived macrophages infected with highly pathogenic porcine virus. Vet Immunol Immunopathol. 2021; 235: 110231. https://doi.org/10.1016/j.vetimm.2021.110231.
28. Šudomová M., Hassan S.T.S. Nutraceutical curcumin with promising protection against herpesvirus infections and their associated inflammation: mechanisms and pathways. Microorganisms. 2021; 9 (2): 292. https://doi.org/10.3390/microorganisms9020292.
29. Li H., Li Y., Hu J., et al. Epigallocatechin-3-gallate inhibits EBV lytic replication via targeting LMP1-mediated MAPK. Oncol Res. 2021; 28 (7): 763–78. https://doi.org/10.3727/096504021X16135618512563.
30. Isaacs C.E., Wen G.Y., Xu W., et al. Epigallocatechin gallate inactivates clinical isolates of herpes simplex virus. Antimicrob Agents Chemother. 2008; 52 (3): 962–70. https://doi.org/10.1128/AAC.00825-07.
31. Ho H.Y., Cheng M.L., Weng S.F., et al. Antiviral effect of epigallocatechin gallate on enterovirus 71. J Agric Food Chem. 2009; 57 (14): 6140–7. https://doi.org/10.1021/jf901128u.
32. Reshamwala D., Shroff S., Sheik Amamuddy O., et al. Polyphenols epigallocatechin gallate and resveratrol, and polyphenol-functionalized nanoparticles prevent enterovirus infection. Pharmaceutics. 2021; 13 (8): 1182. https://doi.org/10.3390/pharmaceutics13081182.
33. Geng P., Zhu H., Zhou W., et al. Baicalin inhibits influenza a virus infection via promotion of M1 macrophage polarization. Front Pharmacol. 2020; 11: 01298. https://doi.org/10.3389/fphar.2020.01298.
34. Shi H., Ren K., Lv B., et al. Baicalin from Scutellaria baicalensis blocks respiratory syncytial virus (RSV) infection and reduces inflammatory cell infiltration and lung injury in mice. Sci Rep. 2016; 6: 35851. https://doi.org/10.1038/srep35851.
35. Qin S., Huang X., Qu S. Baicalin induces a potent innate immune response to inhibit RSV replication via regulating viral non-structural 1 and matrix RNA. Front Immunol. 2022; 13: 907047. https://doi.org/10.3389/fimmu.2022.907047.
36. Saha R.K., Takahashi T., Suzuki T. Glucosyl hesperidin prevents influenza a virus replication in vitro by inhibition of viral sialidase. Biol Pharm Bull. 2009; 32 (7): 1188–92. https://doi.org/10.1248/bpb.32.1188.
37. Zhao X., Tang Z., Yue C., et al. hesperidin regulates Jagged1/Notch1 pathway to promote macrophage polarization and alleviate lung injury in mice with bronchiolitis. Zhongguo Yi Xue Ke Xue Yuan Xue Bao. 2022; 44 (5): 777–84 (на кит. яз.). https://doi.org/10.3881/j.issn.1000-503X.14888.
38. Ding Z., Sun G., Zhu Z. Hesperidin attenuates influenza A virus (H1N1) induced lung injury in rats through its anti-inflammatory effect. Antivir Ther. 2018; 23 (7): 611–5. https://doi.org/10.3851/IMP3235.
39. Wu W., Li R., Li X., et al. Quercetin as an antiviral agent inhibits influenza A virus (IAV) entry. Viruses. 2015; 8 (1): 6. https://doi.org/10.3390/v8010006.
40. Tiboc-Schnell C.N., Filip G.A., Man S.C., et al. Quercetin attenuates naso-sinusal inflammation and inflammatory response in lungs and brain on an experimental model of acute rhinosinusitis in rats. J Physiol Pharmacol. 2020; 71 (4). https://doi.org/10.26402/jpp.2020.4.03.
41. Singh A., Mishra A. Leucoefdin a potential inhibitor against SARS CoV-2 Mpro. J Biomol Struct Dyn. 2021; 39 (12): 4427–32. https://doi.org/10.1080/07391102.2020.1777903.
42. George T.K., Joy A., Divya K., Jisha M.S. In vitro and in silico docking studies of antibacterial compounds derived from endophytic Penicillium setosum. Microb Pathog. 2019; 131: 87–97. https://doi.org/10.1016/j.micpath.2019.03.033.
43. da Silva-Júnior E.F., Silva L.R. Multi-target approaches of epigallocatechin-3-O-gallate (EGCG) and its derivatives against influenza viruses. Curr Top Med Chem. 2022; 22 (18): 1485–500. https://doi.org/10.2174/1568026622666220127112056.
44. Matsuura R., Kawamura A., Matsumoto Y., et al. Epigallocatechin gallate stabilized by cyclodextrin inactivates influenza virus and human coronavirus 229E. Microorganisms. 2022; 10 (9): 1796. https://doi.org/10.3390/microorganisms10091796.
45. Obata K., Kojima T., Masaki T., et al. Curcumin prevents replication of respiratory syncytial virus and the epithelial responses to it in human nasal epithelial cells. PLoS One. 2013; 8 (9): e70225. https://doi.org/10.1371/journal.pone.0070225.
46. Han S., Xu J., Guo X., Huang M. Curcumin ameliorates severe influenza pneumonia via attenuating lung injury and regulating macrophage cytokines production. Clin Exp Pharmacol Physiol. 2018; 45 (1): 84–93. https://doi.org/10.1111/1440-1681.12848.
47. Samadizadeh S., Arabi M.S., Yasaghi M., et al. Anti-inflammatory effects of curcumin-loaded niosomes on respiratory syncytial virus infection in a mice model. J Med Microbiol. 2022; 71 (4). https://doi.org/10.1099/jmm.0.001525.
48. Gordon D.E., Jang G.M., Bouhaddou M., et al. A SARS-CoV-2 protein interaction map reveals targets for drug repurposing. Nature. 2020; 583 (7816): 459–68. https://doi.org/10.1038/s41586-020-2286-9.
49. Hong S., Seo S.H., Woo S.J., et al. Epigallocatechin gallate inhibits the uridylate-specific endoribonuclease Nsp15 and efficiently neutralizes the SARS-CoV-2 strain. J Agric Food Chem. 2021; 69 (21): 5948–54. https://doi.org/10.1021/acs.jafc.1c02050.
50. Zandi K., Musall K., Oo A., et al. Baicalein and baicalin inhibit SARS-CoV-2 RNA-dependent-RNA polymerase. Microorganisms. 2021; 9 (5): 893. https://doi.org/10.3390/microorganisms9050893.
51. Rizzuti B., Grande F., Conforti F., et al. Rutin is a low micromolar inhibitor of SARS-CoV-2 main protease 3CLpro: implications for drug design of quercetin analogs. Biomedicines. 2021; 9 (4): 375. https://doi.org/10.3390/biomedicines9040375.
52. Manjunath S.H., Thimmulappa R.K. Antiviral, immunomodulatory, and anticoagulant effects of quercetin and its derivatives: potential role in prevention and management of COVID-19. J Pharm Anal. 2022; 12 (1): 29–34. https://doi.org/10.1016/j.jpha.2021.09.009.
53. Gasmi A., Mujawdiya P.K., Lysiuk R., et al. Quercetin in the prevention and treatment of coronavirus infections: a focus on SARS-CoV-2. Pharmaceuticals (Basel). 2022; 15 (9): 1049. https://doi.org/10.3390/ph15091049.
54. Di Pierro F., Iqtadar S., Khan A., et al. Potential clinical benefits of quercetin in the early stage of COVID-19: results of a second, pilot, randomized, controlled and open-label clinical trial. Int J Gen Med. 2021; 14: 2807–16. https://doi.org/10.2147/IJGM.S318949.
55. Di Pierro F., Derosa G., Maffioli P., et al. Possible therapeutic effects of adjuvant quercetin supplementation against early-stage COVID-19 infection: a prospective, randomized, controlled, and open-label study. Int J Gen Med. 2021; 14: 2359–66. https://doi.org/10.2147/IJGM.S318720.
56. Shohan M., Nashibi R., Mahmoudian-Sani M.R., et al. The therapeutic efficacy of quercetin in combination with antiviral drugs in hospitalized COVID-19 patients: a randomized controlled trial. Eur J Pharmacol. 2022; 914: 174615. https://doi.org/10.1016/j.ejphar.2021.174615.
57. Dupuis J., Laurin P., Tardif J.C., et al. Fourteen-day evolution of COVID-19 symptoms during the third wave in nonvaccinated subjects and effects of hesperidin therapy: a randomized, double-blinded, placebo-controlled study. Evid Based Complement Alternat Med. 2022; 2022: 3125662. https://doi.org/10.1155/2022/3125662.
58. Mokra D., Adamcakova J., Mokry J. Green tea polyphenol (-)-epigallocatechin-3-gallate (EGCG): a time for a new player in the treatment of respiratory diseases? Antioxidants (Basel). 2022; 11 (8): 1566. https://doi.org/10.3390/antiox11081566.
59. Park R., Jang M., Park Y.I., et al. Epigallocatechin gallate (EGCG), a green tea polyphenol, reduces coronavirus replication in a mouse model. Viruses. 2021; 13 (12): 2533. https://doi.org/10.3390/v13122533.
60. Saeedi-Boroujeni A., Mahmoudian-Sani M.R., Bahadoram M., Alghasi A. COVID-19: a case for inhibiting NLRP3 inflammasome, suppression of inflammation with curcumin? Basic Clin Pharmacol Toxicol. 2021; 128 (1): 37–45. https://doi.org/10.1111/bcpt.13503.
61. Marín-Palma D., Tabares-Guevara J.H., Zapata-Cardona M.I., et al. Curcumin inhibits in vitro SARS-CoV-2 infection in vero E6 cells through multiple antiviral mechanisms. Molecules. 2021; 26 (22): 6900. https://doi.org/10.3390/molecules26226900.
62. Vahedian-Azimi A., Abbasifard M., Rahimi-Bashar F., et al. Effectiveness of curcumin on outcomes of hospitalized COVID-19 patients: a systematic review of clinical trials. Nutrients. 2022; 14 (2): 256. https://doi.org/10.3390/nu14020256.
63. Громова О.А., Торшин И.Ю., Тетруашвили Н.К. Систематический обзор экспериментальных и клинических исследований по фармакологии глицирризина и его производных. Акушерство и гинекология. 2022; 4: 34–46. https://dx.doi.org/10.18565/aig.2022.4.34-46.
64. Zhang N., Lv H., Shi B.H., et al. Inhibition of IL-6 and IL-8 production in LPS-stimulated human gingival fibroblasts by glycyrrhizin via activating LXRα. Microb Pathog. 2017; 110: 135–9. https://doi.org/10.1016/j.micpath.2017.06.021.
65. van de Sand L., Bormann M., Alt M., et al. Glycyrrhizin effectively inhibits SARS-CoV-2 replication by inhibiting the viral main protease. Viruses. 2021; 13 (4): 609. https://doi.org/10.3390/v13040609.
66. Gomaa A.A., Mohamed H.S., Abd-Ellatief R.B., et al. Advancing combination treatment with glycyrrhizin and boswellic acids for hospitalized patients with moderate COVID-19 infection: a randomized clinical trial. Inflammopharmacology. 2022; 30 (2): 477–86. https://doi.org/10.1007/s10787-022-00939-7.
67. Askari G., Sahebkar A., Soleimani D., et al. The efficacy of curcumin-piperine co-supplementation on clinical symptoms, duration, severity, and inflammatory factors in COVID-19 outpatients: a randomized double-blind, placebo-controlled trial. Trials. 2022; 23 (1): 472. https://doi.org/10.1186/s13063-022-06375-w.
68. Pawar K.S., Mastud R.N., Pawar S.K., Pet al. Oral curcumin with piperine as adjuvant therapy for the treatment of COVID-19: a randomized clinical trial. Front Pharmacol. 2021; 12: 669362. https://doi.org/10.3389/fphar.2021.669362.
69. Khan A., Iqtadar S., Mumtaz S.U., et al. Oral co-supplementation of curcumin, quercetin, and vitamin D3 as an adjuvant therapy for mild to moderate symptoms of COVID-19 – results from a pilot open-label, randomized controlled trial. Front Pharmacol. 2022; 13: 898062. https://doi.org/10.3389/fphar.2022.898062.
70. Zhao F.Q., Wang G.F., Xu D., et al. Glycyrrhizin mediated liver-targeted alginate nanogels delivers quercetin to relieve acute liver failure. Int J Biol Macromol. 2021; 168: 93–104. https://doi.org/10.1016/j.ijbiomac.2020.11.204.
Об авторах
О. А. ГромоваРоссия
Громова Ольга Алексеевна – д.м.н., профессор, научный руководитель ФИЦ «Информатика и управление» РАН
Scopus Author ID: 7003589812; ResearcherID: J-4946-2017
ул. Вавилова, д. 4, Москва 119333
И. Ю. Торшин
Россия
Торшин Иван Юрьевич – к.ф-м.н., к.х.н., старший научный сотрудник
Scopus Author ID: 7003300274; ResearcherID: C-7683-2018
ул. Вавилова, д. 4, Москва 119333
А. Г. Чучалин
Россия
Чучалин Александр Григорьевич – д.м.н., профессор, академик РАН, пульмонолог, заведующий кафедрой госпитальной терапии педиатрического факультета
ул. Островитянова, д. 1, Москва 117997
Рецензия
Для цитирования:
Громова О.А., Торшин И.Ю., Чучалин А.Г. Систематический компьютерный анализ фармакологии биофлавоноидов в контексте повышения противовирусной защиты организма. ФАРМАКОЭКОНОМИКА. Современная фармакоэкономика и фармакоэпидемиология. 2023;16(1):105-124. https://doi.org/10.17749/2070-4909/farmakoekonomika.2023.162
For citation:
Gromova O.A., Torshin I.Yu., Chuchalin A.G. Systematic computer analysis of the pharmacology of bioflavonoids in the context of increasing the body's antiviral defenses. FARMAKOEKONOMIKA. Modern Pharmacoeconomics and Pharmacoepidemiology. 2023;16(1):105-124. (In Russ.) https://doi.org/10.17749/2070-4909/farmakoekonomika.2023.162

Контент доступен под лицензией Creative Commons Attribution-NonCommercial-ShareAlike 4.0 International License.






































