Перейти к:
Антибиотикорезистентность уропатогенов у пациентов с нефролитиазом на фоне сопутствующей ишемической болезни сердца
https://doi.org/10.17749/2070-4909/farmakoekonomika.2022.134
Аннотация
Цель: выявить основных возбудителей хронического калькулезного пиелонефрита и определить их антибиотикорезистентность у пациентов с нефролитиазом, сочетающимся с ишемической болезнью сердца (ИБС).
Материал и методы. Проведено ретроспективное эпидемиологическое исследование по типу «случай–контроль», в которое вошел 181 пациент в возрасте от 57 до 82 лет, пролеченный в урологическом центре филиала № 1 Главного военного клинического госпиталя им. академика Н.Н. Бурденко в 2014–2019 гг. Все больные длительно страдали мочекаменной болезнью (МКБ), осложненной хроническим калькулезным пиелонефритом, в сочетании с ИБС. Изучены клинически значимые результаты бактериологических анализов мочи (КОЕ≥103). Посев средней порции мочи выполняли секторным методом на агаре Эндо. Минимальную подавляющую концентрацию исследуемых антибактериальных препаратов для каждого из выявленных микроорганизмов определяли методом разведения на плотной питательной среде агара Мюллера–Хинтон (BBL, США). При статистической обработке результатов использовали критерии Шапиро–Уилка, Колмогорова–Смирнова и χ2 Пирсона. Статистически значимыми считали значения р≤0,05.
Результаты. При посеве у пациентов выявлены: Escherichia coli – в 24,8% случаев, Klebsiella pneumoniae – в 18,3%, Pseudomanas aeruginosa – в 11%. Среди грамположительных возбудителей наибольшее значение имели Staphylococcus spp. и Enterococcus spp. (суммарно 26,6% случаев). Чувствительность обнаруженных инфекционных агентов к основным антибактериальным препаратам оказалась резко сниженной. Обращает на себя внимание тот факт, что к меропенему чувствительными были 65% штаммов P. aeruginosa.
Заключение. У пациентов с рецидивирующей МКБ в сочетании с ИБС на фоне калькулезного пиелонефрита увеличена доля грамположительных кокков с одновременным снижением доли полирезистентных грамотрицательных инфекционных агентов (нозокомиальные штаммы E. coli и K. pneumoniae).
Ключевые слова
Для цитирования:
Роюк Р.В., Яровой С.К., Шикина И.Б. Антибиотикорезистентность уропатогенов у пациентов с нефролитиазом на фоне сопутствующей ишемической болезни сердца. ФАРМАКОЭКОНОМИКА. Современная фармакоэкономика и фармакоэпидемиология. 2022;15(4):453-462. https://doi.org/10.17749/2070-4909/farmakoekonomika.2022.134
For citation:
Royuk R.V., Yarovoy S.K., Shikina I.B. Antibiotic resistance of uropathogens in patients with nephrolithiasis and concomitant coronary heart disease. FARMAKOEKONOMIKA. Modern Pharmacoeconomics and Pharmacoepidemiology. 2022;15(4):453-462. (In Russ.) https://doi.org/10.17749/2070-4909/farmakoekonomika.2022.134
ВВЕДЕНИЕ / INTRODUCTION
Мочекаменная болезнь (МКБ) по распространенности занимает второе место в мире после неспецифических воспалительных заболеваний почек и мочевыводящих путей и встречается почти у 6% мирового населения, при этом в Азии – у 1–5%, в Европе – у 5–9%, в Северной Америке – до 13% [1]. В России прирост пациентов с этим заболеванием за последние 10 лет составил более 15% [2][3]. По данным А.Д. Каприна и др. (2002 г.) [4] и О.И. Аполихина и др. (2014 г.) [5], заболеваемость МКБ в группе лиц 70 лет и старше в 10,5 раза выше по сравнению с группой 18–29 лет при постоянном росте показателей.
МКБ начинает проявляться у людей в трудоспособном возрасте от 20 до 50 лет с преобладанием встречаемости у мужчин. Гендерный коэффициент, т.е. соотношение количества заболевших мужчин и женщин, составляет 1,2–1,3 [6].
Влияние возраста на развитие МКБ можно объяснить, в первую очередь, удлинением срока воздействия различных патогенетических факторов, а именно ухудшением обменных процессов в организме, нарушениями уродинамики, хроническими воспалительно-инфекционными процессами в мочевыводящих путях и клиническими проявлениями сопутствующей патологии. Многие авторы указывают на наличие корреляции между риском развития МКБ и метаболическим синдромом, а также на высокую социальную значимость этих заболеваний из-за их распространенности [2][7–9].
Наиболее частым и серьезным осложнением МКБ являются различные формы пиелонефрита [8][10]. Среди патологий, отягощающих течение калькулезного пиелонефрита, ведущее место занимает сахарный диабет, который ассоциируется со снижением иммунного ответа, ухудшением почечной гемодинамики, полинейропатией [3][11].
Существуют значительные отличия в чувствительности уропатогенов к антибактериальным препаратам в зависимости от фоновых заболеваний, а также от региона одной страны [1][7][8][12].
Сопутствующие заболевания могут значительно изменять распределение возбудителей по относительным частотам встречаемости, что имеет принципиальное практическое значение. Например, декомпенсированный сахарный диабет ассоциирован с повышенной частотой грамположительной мочевой инфекции [3]. При тяжелом иммунодефиците нередки атипичные, малохарактерные возбудители, однако первичное инфицирование полирезистентными штаммами при иммунодефиците случается настолько редко, что этот риск при выборе лекарственного препарата можно и не учитывать1.
Очень частым, значимым для практической урологии, но сравнительно малоизученным, является сочетание нефролитиаза и ишемической болезни сердца (ИБС). По нашим собственным наблюдениям, доля таких пациентов в стационарах урологического профиля иногда превышает 30% от общего числа госпитализированных по поводу МКБ. Результаты лечения не всегда удовлетворительны, причем как с точки зрения хирургической составляющей, так и со стороны лекарственной терапии. Ранее проведенные исследования делают акцент главным образом на антиангинальной и антиаритмической терапиях в рамках подготовки к оперативному лечению или указывают на преимущества той или иной методики по сравнению с оперативным удалением камня, в частности дистанционной литотрипсии [13][14]2.
Поскольку исследований антибиотикорезистентности уропатогенов у данной категории больных не проводилось, представляется актуальным изучить спектр основных инфекционных агентов, вызывающих хронический калькулезный пиелонефрит у пациентов с нефролитиазом, страдающих сопутствующей ИБС, а также изучить их чувствительность к основным антибактериальным препаратам, что позволит делать более обоснованный выбор лекарственной терапии в зависимости от клинической ситуации.
Цель – выявить основных возбудителей хронического калькулезного пиелонефрита и определить их антибиотикорезистентность у пациентов с нефролитиазом, сочетающимся с ИБС.
МАТЕРИАЛ И МЕТОДЫ / MATERIAL AND METHODS
Дизайн исследования / Study design
Проведено ретроспективное эпидемиологическое исследование по типу «случай–контроль» с участием 181 пациента в возрасте от 57 до 82 лет, получившего лечение в условиях стационара урологического центра филиала № 1 ФГБУ «Главный военный клинический госпиталь им. академика Н.Н. Бурденко» Минобороны России в 2014–2019 гг. (основная группа).
В качестве групп сравнения были взяты результаты микробиологического мониторинга возбудителей нозокомиальной инфекции в урологической клинике ГОУ «Санкт-Петербургский государственный медицинский университет им. академика И.П. Павлова» (СПбГМУ) Минздрава России, проведенного в 2018–2020 гг. [15], многоцентрового эпидемиологического исследования динамики антибиотикорезистентности возбудителей внебольничных инфекций мочевых путей в различных субпопуляциях пациентов «ДАРМИС-2018» (2019 г.) [16], а также многоцентрового эпидемиологического исследования антибиотикорезистентности возбудителей нозокомиальных инфекций «МАРАФОН» (2013–2014 гг.) [17].
Критерии включения и исключения / Inclusion and exclusion criteria
Критерий включения – наличие у пациента сочетанной патологии МКБ и ИБС (независимо от функционального класса стенокардии, наличия или отсутствия недостаточности кровообращения).
Критерии исключения:
- симптоматический нефролитиаз (гиперпаратиреоз, дисфункции почечных канальцев любого генеза, стриктура мочеточника, хроническая гемолитическая анемия, псориаз и т.д.);
- сопутствующие хронические инфекционные процессы другой локализации в стадии обострения;
- иммунодефицитные состояния (декомпенсированный сахарный диабет, злокачественные новообразования любой локализации и др.);
- тяжелая почечная недостаточность (скорость клубочковой фильтрации менее 40 мл/мин);
- печеночная недостаточность;
- онкологические заболевания;
- возраст младше 18 лет.
Лабораторный анализ / Laboratory analysis
Проанализированы клинически значимые результаты бактериологических анализов мочи (КОЕ≥10³)3. Отбор проб биологического материала осуществляли в соответствии с правилами, изложенными в методических указаниях МУ 4.2.2039-05 «Техника сбора и транспортирования биоматериалов в микробиологические лаборатории» [18].
Для выявления микроорганизмов среднюю порцию мочи, полученную в стерильных условиях в утреннее время, сеяли секторным методом Гоулда на агаре Эндо. Для дифференциальной диагностики, в частности энзимоидентификации энтеробактерий по 20 биохимическим признакам, использовали пластину биохимическую, дифференцирующую энтеробактерии. В дальнейшем минимальную подавляющую концентрацию антибактериальных препаратов для выявленного микроорганизма определяли методом разведения на плотной питательной среде агара Мюллера– Хинтон (BBL, США). Результаты заносили в учетную книгу в виде антибиотикограмм.
Cтатистический анализ / Statistical analysis
Материалы исследования были подвергнуты статистической обработке с использованием методов параметрического и непараметрического анализа. Накопление, корректировку, систематизацию исходной информации и визуализацию полученных результатов осуществляли в электронных таблицах Microsoft Office Excel 2016 (Microsoft, США). Статистический анализ проводили с использованием программы Statistica 10.0 (StatSoft Inc., США).
Количественные показатели оценивали на предмет соответствия нормальному распределению с помощью критерия Шапиро–Уилка (при числе исследуемых менее 50) или критерия Колмогорова– Смирнова (при числе исследуемых более 50). В случае отсутствия нормального распределения количественные данные описывали с помощью медианы (Me) и нижнего и верхнего квартилей (Q1– Q3). Для описания категориальных данных указывали абсолютные значения и процентные доли. Сравнение процентных долей при анализе многопольных таблиц сопряженности выполняли с использованием критерия χ2 Пирсона. Различия считали достоверными при р≤0,05.
Этические аспекты / Ethical aspects
Изучались результаты исследований, ретроспективно выкопированные из первичной медицинской документации пациентов, которые были обезличены с начального этапа работы. Поэтому подписания информированного согласия не требовалось.
РЕЗУЛЬТАТЫ / RESULTS
Распределение возбудителей по относительной частоте встречаемости / Distribution of pathogens by relative frequency of occurrence
В группе пациентов, страдающих нефролитиазом на фоне сопутствующей ИБС, Escherichia coli была выявлена примерно в 1/4 случаев (24,8%) (табл. 1).
Таблица 1. Распределение возбудителей по относительной частоте встречаемости, %
Table 1. The distribution of causative agents by the relative occurrence rate, %
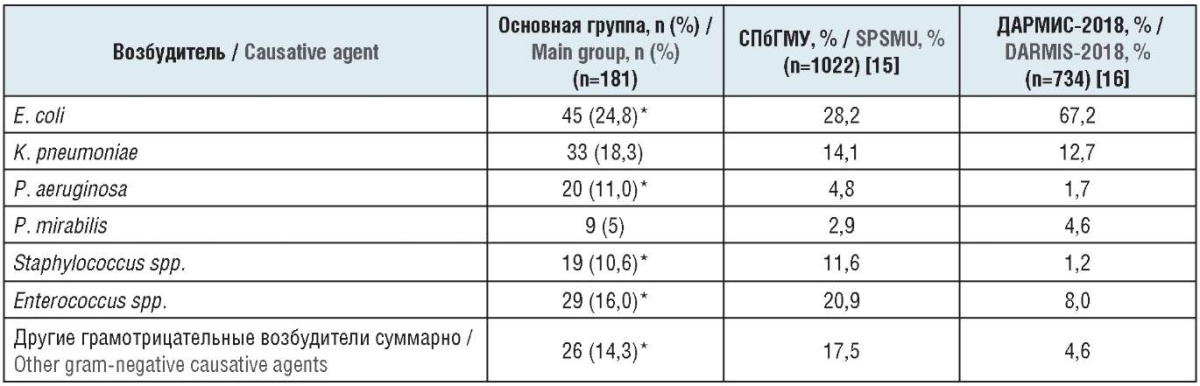
Примечание. * Различия статистически достоверны (р≤0,05) между основной группой и результатами исследования «ДАРМИС-2018».
Note. * The differences are statistically significant (р≤0.05) between the main group and the results of the DARMIS-2018 study.
При микробиологическом мониторинге возбудителей нозокомиальной инфекции в урологической клинике СПбГМУ этот возбудитель выявлен у 28,2% пациентов. В исследовании «ДАРМИС-2018», отражающем распределение возбудителей при осложненных внебольничных инфекциях мочевых путей, частота обнаружения E. coli была значительно выше – 67,2%.
Proteus mirabilis встречался существенно реже – у 5% пациентов с МКБ на фоне ИБС, что несколько отличалось от данных урологической клиники СПбГМУ (2,9%) и почти полностью совпало с результатами исследования «ДАРМИС-2018» (4,6%).
Klebsiella pneumoniae выявлена у 18,3% больных основной группы в нашем исследовании, у 14,1% – в урологической клинике СПбГМУ, у 12,7% – в исследовании «ДАРМИС-2018».
Pseudomоnas aeruginosa – неферментирующая грамотрицательная палочка, нередко являющаяся возбудителем нозокомиального пиелонефрита, простатита, особенно у оперированных пациентов. В нашем исследовании она встречалась у 11% больных, имеющих нефролитиаз и сопутствующую ИБС. В урологической клинике СПбГМУ и в исследовании «ДАРМИС-2018» показатели относительной частоты встречаемости P. aeruginosa составили 4,8% и 1,7% соответственно. Другие грамотрицательные палочки отмечены у 14,3% пациентов, страдающих нефролитиазом и ИБС.
Среди грамположительных возбудителей наибольшее значение имеют Staphylococcus spp. и Enterococcus spp. [19]. У пациентов основной группы встречаемость этих возбудителей составила 10,6% и 16% соответственно. В урологической клинике СПбГМУ грамположительные возбудители мочевой инфекции отмечались еще чаще – Staphylococcus spp. в 11,6% случаев, Enterococcus spp. в 20,9%; в исследовании «ДАРМИС-2018» – 1,2% и 8,0% соответственно.
Чувствительность уропатогенов к основным антибактериальным препаратам / Sensitivity of uropathogens to the main antibacterial drugs
E. coli
Чувствительность E. coli к аминопенициллинам, в т.ч. и ингибиторозащищенным, в настоящее время находится на низком уровне. Чувствительны не более 40% штаммов, выделенных у пациентов, страдающих нефролитиазом на фоне сопутствующей ИБС, и не более 57% штаммов, выделенных у больных с осложненной инфекцией мочевых путей по результатам исследования «ДАРМИС-2018» (табл. 2).
Таблица 2. Чувствительность к антибактериальным препаратам штаммов E. coli, выделенных у больных с различными видами инфекций мочевых путей, %
Table 2. Sensitivity of E. coli strains, isolated from patients with various types of urinary tract infections, to antibacterial agents, %
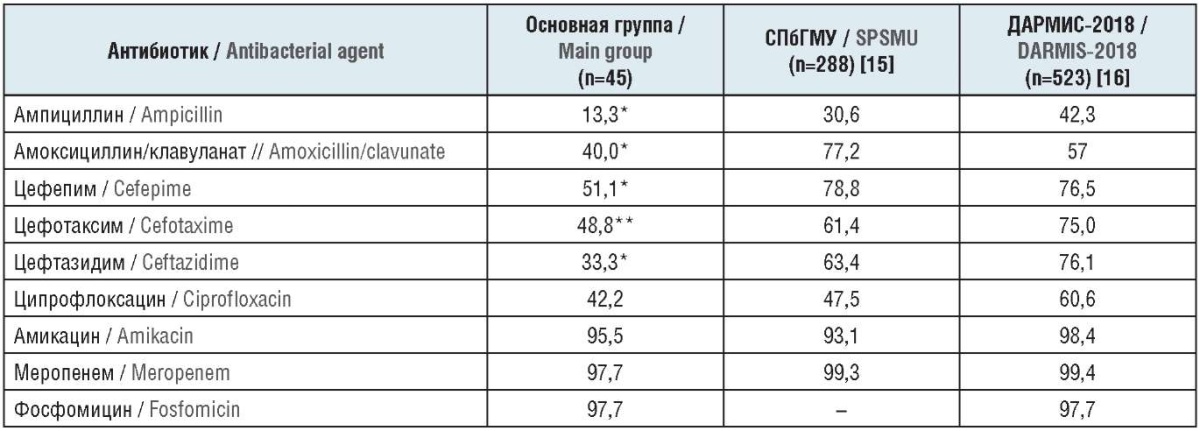
Примечание. * Различия статистически достоверны (р≤0,05) между основной группой и результатами исследования «ДАРМИС-2018», а также данными урологической клиники СПбГМУ. ** Различия статистически достоверны (р≤0,05) между основной группой и данными урологической клиники СПбГМУ.
Note. * The differences are statistically significant (р≤0.05) between the main group and the results of the DARMIS-2018 study as well as data obtained by the SPSMU urologic clinic. ** The differences are statistically significant (р≤0.05) between the main group and data obtained by the SPSMU urologic clinic.
При микробиологическом мониторинге возбудителей нозокомиальной инфекции в урологической клинике СПбГМУ E. coli продемонстрировала несколько большую чувствительность как к ингибиторозащищенному, так и к незащищенному ампициллину – 30,6% и 77,2% соответственно.
Неантисинегнойные цефалоспорины III поколения, в частности, цефотаксим, продемонстрировали более высокую активность в отношении E. coli, по крайней мере ее диких (негоспитальных) штаммов. Чувствительными к этому антибиотику оказались 75% штаммов, выделенных у пациентов с осложненной негоспитальной инфекцией мочевых путей («ДАРМИС-2018»), и лишь 48,8% штаммов, выделенных у больных нефролитиазом на фоне ИБС. В урологической клинике СПбГМУ чувствительность к цефотаксиму показали 61,4% штаммов E. coli.
Антисинегнойные цефалоспорины – цефтазидим (III поколение) и цефепим (IV поколение) ожидаемо оказались более эффективными в отношении негоспитальных штаммов: 76,1% и 76,5% соответственно («ДАРМИС-2018»). Однако госпитальные штаммы E. coli, для подавления которых эти препараты и предназначены, продемонстрировали соизмеримую устойчивость: чувствительны 63,4% и 78,8% штаммов соответственно (урологическая клиника СПбГМУ).
Пациенты, страдающие нефролитиазом на фоне ИБС, оказались носителями штаммов E. coli, обладающих высокой резистентностью к антисинегнойным цефалоспоринам (к цефтазидиму и цефепиму чувствительны 33,3% и 51,1% штаммов соответственно).
Фторхинолоны, в частности ципрофлоксацин, в настоящее время прогрессивно снижает свою эффективность даже в отношении негоспитальной E. coli: чувствительны 60,6% штаммов («ДАРМИС-2018»). Среди нозокомиальных штаммов чувствительными к ципрофлоксацину оказались менее половины – 47,5%. Соизмеримую чувствительность к данному препарату продемонстрировали штаммы E. coli, выделенные у пациентов, имеющих нефролитиаз и сопутствующую ИБС, – 42,2%.
К аминогликозиду III поколения амикацину были чувствительны более 90% штаммов E. coli в исследовании «ДАРМИС-2018» и в урологической клинике СПбГМУ. Среди штаммов E. coli, выделенных у пациентов основной группы нашего исследования, чувствительность к амикацину составила 95,5%.
В изучаемой группе пациентов, а также в многоцентровом исследовании «ДАРМИС-2018» и урологической клинике СПбГМУ E. coli оказалась высокочувствительной к меропенему (более 97% штаммов).
Фосфомицин в отношении E. coli продемонстрировал активность, соизмеримую с меропенемом, причем независимо от наличия осложняющих факторов (чувствительны более 97% штаммов).
K. pneumonia
В урологической клинике K. pneumonia в большинстве случаев выступает возбудителем нозокомиальных инфекционно-воспалительных процессов, поэтому в качестве группы сравнения целесообразно взять результаты микробиологического мониторинга возбудителей нозокомиальной инфекции в урологической клинике СПбГМУ.
K. pneumoniae, выделенная у пациентов, страдающих нефролитиазом на фоне ИБС, обладает очень низкой чувствительностью к нерезервным антибактериальным препаратам – цефотаксиму и ципрофлоксацину (24,2% и 3,0% соответственно) и даже цефтазидиму (51,5%) (табл. 3).
Таблица 3. Чувствительность к антибактериальным препаратам штаммов K. pneumonia, выделенных у больных с различными видами инфекций мочевых путей, %
Table 3. Sensitivity of K. pneumonia strains, isolated from patients with various types of urinary tract infections, to antibacterial agents, %
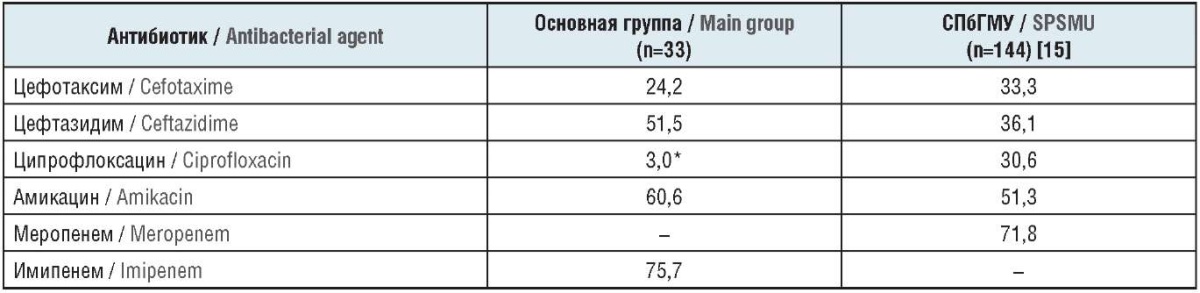
Примечание. * Различия статистически достоверны (р≤0,05).
Note. * The differences are statistically significant (р≤0.05).
Условно приемлемую активность показали только препараты антисинегнойного резерва – амикацин и имипенем (60,6% и 75,7% соответственно). В урологической клинике СПбГМУ нерезервные цефотаксим и ципрофлоксацин оказались более эффективными по отношению к K. pneumonia (33,3% и 30,6% соответственно). Чувствительность K. pneumonia к цефтазидиму была соизмерима с цефотаксимом (36,1% и 33,3% соответственно). Амикацин и меропенем оказались несколько более эффективными (51,3% и 71,8% соответственно).
P. aeruginosa
P. aeruginosa считается типичным возбудителем нозокомиальных воспалительных процессов в урологической клинике. Чувствительность штаммов P. aeruginosa, выделенных у пациентов основной группы, оказалась низкой к ципрофлоксацину (15,3%) и антисинегнойным цефалоспоринам – цефтазидиму и цефепиму (30% и 40% соответственно) (табл. 4).
Таблица 4. Чувствительность к антибактериальным препаратам штаммов P. aeruginosa, выделенных у больных с различными видами инфекций мочевых путей, %
Table 4. Sensitivity of P. aeruginosa strains, isolated from patients with various types of urinary tract infections, to antibacterial agents, %
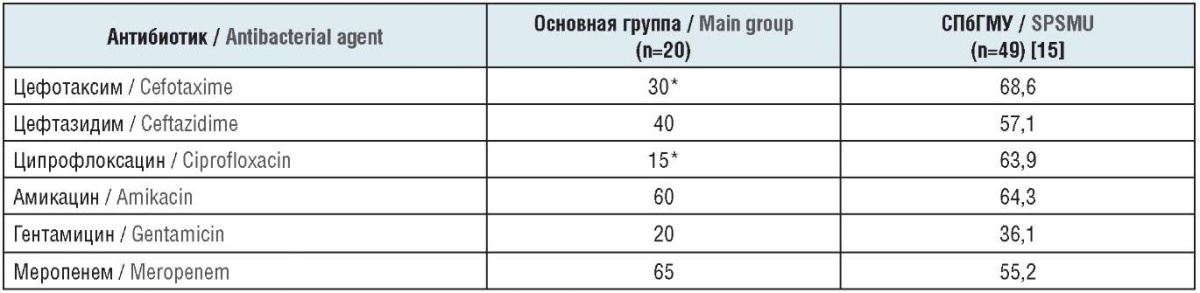
Примечание. * Различия статистически достоверны (р≤0,05).
Note. * The differences are statistically significant (р≤0.05).
Более высокую антисинегнойную активность продемонстрировали амикацин (60%), а также меропенем (65%). В урологической клинике СПбГМУ штаммы P. aeruginosa, выделенные у пациентов с нозокомиальной осложненной инфекцией мочевых путей, также обладали множественной лекарственной устойчивостью. В частности, ни к одному из препаратов, обладающих антисинегнойной активностью, не были чувствительны даже 70% штаммов данного возбудителя. Наилучшие результаты в этом исследовании показал цефтазидим, чувствительность к которому продемонстрировали 68,6% штаммов P. aeruginosa. Антисинегнойная активность меропенема оказалась неожиданно низкой – чувствительны были лишь 55,2% штаммов.
Staphylococcus spp.
Этот микроорганизм никогда не занимал лидирующих позиций по частоте встречаемости среди возбудителей неспецифических инфекционно-воспалительных заболеваний органов мочеполовой системы. Общепризнанным маркером «госпитальности» Staphylococcus spp. служит его отношение в метициллину (оксациллину). Среди штаммов Staphylococcus spp., выделенных у пациентов основной группы, устойчивыми к оксациллину были 78,9% (табл. 5), что соизмеримо с суммарной частотой встречаемости метициллин-резистентных S. aureus и S. epidermidis, выявленных по результатам исследования «МАРАФОН» (75,1%).
Таблица 5. Чувствительность к антибактериальным препаратам штаммов Staphylococcus spp., выделенных у больных с различными видами инфекций мочевых путей, %
Table 5. Sensitivity of Staphylococcus spp. strains, isolated from patients with various types of urinary tract infections, to antibacterial agents, %
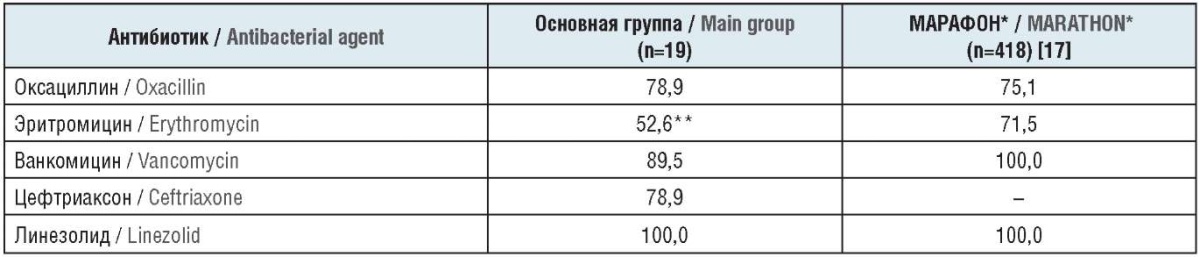
Примечание. * Осложненные нозокомиальные инфекции. ** Различие статистически достоверно (р≤0,05).
Note. * Complicated nosocomial infections. ** The difference is statistically significant (р≤0.05).
Препараты антиграмположительного резерва (ванкомицин, линезолид) оказались высокоэффективными в отношении Staphylococcus spp. как в основной группе пациентов, так и в исследовании «МАРАФОН» (89,5–100%). Ванкомицин-резистентный Staphylococcus spp. выделен у единичных больных с длительным анамнезом нефролитиаза, имеющих сопутствующую ИБС. Штаммов Staphylococcus spp., устойчивых к линезолиду, не наблюдалось.
Enterococcus spp.
В урологической практике Enterococcus spp. сравнительно редко выступает в роли «первичного», изначального возбудителя инфекционного процесса. Более часто этот микроорганизм оказывается в роли суперинфекции после массивной антибактериальной терапии, особенно препаратами антиграмотрицательного резерва. По аналогии с чувствительностью Staphylococcus spp. к метициллину (оксациллину) ключевым маркером полирезистентности, «госпитальности», служит его отношение к аминопенициллинам, в частности к ампициллину.
Ампициллин-резистентный Enterococcus spp. встречался часто. Среди его штаммов, выделенных у пациентов основной группы, чувствительной к ампициллину оказалась половина (табл. 6). В урологической клинике СПбГМУ этот показатель был ниже – 28,3% (чувствительны 71,7% штаммов Enterococcus spp.).
Таблица 6. Чувствительность к антибактериальным препаратам штаммов Enterococcus spp., выделенных у больных с различными видами инфекций мочевых путей, %
Table 6. Sensitivity of Enterococcus spp. strains, isolated from patients with various types of urinary tract infections, to antibacterial agents, %
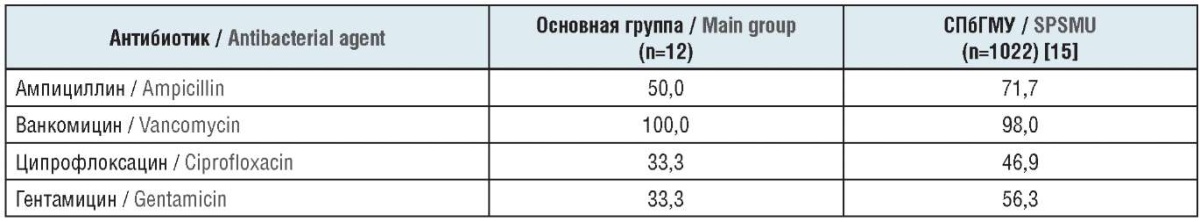
Препараты антиграмположительного резерва, в частности ванкомицин, проявили высокую активность в отношении подавляющего большинства штаммов Enterococcus spp. (98–100%). Ванкомицин-резистентные штаммы Enterococcus spp. встречались единично и эпидемиологическую обстановку не определяли.
ОБСУЖДЕНИЕ / DISCUSSION
Распределение возбудителей неспецифических инфекционно-воспалительных заболеваний органов мочеполовой системы побуждает к дискуссии. Обращает на себя внимание неожиданно низкая относительная частота встречаемости E. coli у пациентов с нефролитиазом на фоне сопутствующей ИБС – всего 24,8%. Тенденция к снижению этого показателя отмечена не только в нашем исследовании, но и в урологической клинике СПбГМУ (28,2%), где объектом изучения были наиболее тяжелые пациенты с осложненной нозокомиальной инфекцией мочевых путей [15]. В исследовании осложненной, но внебольничной инфекции мочевых путей «ДАРМИС-2018» доля E. coli составила 67,2% [16].
В группе пациентов с нефролитиазом на фоне ИБС снижение относительной частоты встречаемости E. coli сопровождалось повышением доли грамположительных кокков – суммарно 26,6%. В исследовании нозокомиальной осложненной инфекции мочевых путей, проведенном на базе урологической клиники СПбГМУ, наблюдалась та же тенденция [15]. Суммарная частота выявления грамположительных возбудителей составила 32,5%.
Увеличение доли грамположительных кокков за счет уменьшения относительной частоты встречаемости E. coli, на наш взгляд, является важной особенностью пациентов с нефролитиазом, рецидивирующим калькулезным пиелонефритом на фоне сопутствующей ИБС. Подобное явление отмечается и при осложненной нозокомиальной мочевой инфекции, но там причина происходящего достаточно очевидна. Частое и длительное применение антибиотиков антиграмотрицательного резерва, например карбапенемов и антисинегнойных цефалоспоринов, создает предпосылки для активного размножения грамположительных возбудителей. Наиболее частым и характерным из них в данной ситуации является Enterococcus spp., имеющий природную резистентность к карбапенемам и цефалоспоринам.
Пациенты с нефролитиазом и сопутствующими хроническими сердечно-сосудистыми заболеваниями массово не получают сверхагрессивную антибактериальную терапию, тем более резервными препаратами. Поэтому о частой суперинфекции Enterococcus spp. или метициллин-резистентных S. aureus в этой группе говорить не приходится. Следовательно, причина в другом. В настоящее время мы затрудняемся дать обоснованную трактовку, однако можно предположить взаимосвязь с нарушениями почечной гемодинамики, снижением местного иммунитета на фоне хронической недостаточности кровообращения и т.д.
По чувствительности к антибактериальным препаратам E. coli, выявленная у пациентов с нефролитиазом и ИБС, может расцениваться как полирезистентная, нозокомиальная, очень сходная со штаммами этого возбудителя, выделенными в ходе микробиологического мониторинга возбудителей нозокомиальной инфекции в урологической клинике СПбГМУ [15]. Достаточную для эмпирического применения эффективность продемонстрировали лишь карбапенемы (меропенем), амикацин и фосфомицин. Антисинегнойные цефалоспорины, вплоть до недавнего времени выступавшие в качестве препаратов первой линии антиграмотрицательного резерва, постепенно утрачивают эту роль. Как ни странно, цефтазидим у пациентов с нефролитиазом и сопутствующей ИБС в отношении E. coli оказался менее действенным по сравнению с цефотаксимом, ципрофлоксацином и даже амоксициллином/клавуланатом. По всей видимости, утрата цефтазидимом своих позиций связана с чрезмерно широким, а иногда и стартовым назначением этого препарата при лечении пиелонефрита в различных стационарах.
Ситуация с K. pneumonia у пациентов в нашем исследовании в целом напоминает положение с E. coli. Так же низка чувствительность возбудителя к цефалоспоринам (в т.ч. и антисинегнойным), а также фторхинолонам. Приемлемую (хотя и формально недостаточную для эмпирического применения) чувствительность продемонстрировали лишь амикацин и карбапенемы. В урологической клинике СПбГМУ K. pneumonia также была в основном полирезистентной, однако частота встречаемости штаммов, устойчивых к амикацину и цефтазидиму, была на 11–14% ниже [15].
Чувствительность P. aeruginosa к антибактериальным препаратам как в нашей группе пациентов, так и в урологической клинике СПбГМУ [15] крайне низка. Ни один из антибиотиков не продемонстрировал формально достаточной для эмпирического применения (более 80% чувствительных штаммов) антисинегнойной активности. Тем не менее в группе больных, страдающих нефролитиазом на фоне ИБС, ситуация немного лучше по сравнению с упомянутой выборкой нозокомиальных возбудителей мочевой инфекции – к меропенему были чувствительны 65% и 55,2% штаммов P. aeruginosa соответственно.
В настоящее время на отечественном рынке появились препараты полимиксинов для системного применения. Это одни из самых активных антисинегнойных средств, поэтому можно ожидать некоторых позитивных подвижек в проблеме лекарственной терапии нозокомиальных грамотрицательных инфекций. Существенным лимитирующим фактором, особенно в урологии и нефрологии, является высокая нефротоксичность всех полимиксинов, соизмеримая с полиенами. Профиль безопасности амфотерицина B (препарата из группы полиенов) удалось довести до приемлемого уровня лишь посредством разработки микросомальных форм. Не исключено, что развитие фармакологической группы полимиксинов пойдет в аналогичным направлении.
Другим путем преодоления резистентности грамотрицательных нозокомиальных штаммов является дальнейшее совершенствование фармакологической группы ингибиторозащищенных β-лактамов. Наряду с широко известным и в целом хорошо себя зарекомендовавшим цефоперазоном/сульбактамом в клинической практике появились и активно применяются цефепим/сульбактам, цефтазидим/авибактам. Опыт их использования в урологии пока ограничен [6][14].
Таким образом, распределение грамотрицательных возбудителей в группе больных, страдающих нефролитиазом, хроническим обструктивным пиелонефритом на фоне сопутствующей ИБС, сходно с таковым у пациентов с неосложненными инфекционно-воспалительными заболеваниями органов мочеполовой системы, а чувствительность грамотрицательных палочек – с показателями больных, имеющих нозокомиальные инфекции мочевых путей.
Staphylococcus spp. и Enterococcus spp. никогда не определяли эпидемическую обстановку в урологической клинике. Грамположительные возбудители обычно выступают в роли суперинфекции у тяжелых, в т.ч. и коморбидных, пациентов. Кроме того, грамположительные кокки могут быть первичной инфекцией у больных с иммунодефицитом. Терапия таких пациентов осложняется необходимостью четкой диагностики возбудителя, т.к. большинство серийно применяемых в урологической практике антибактериальных препаратов, включая резервные, не способны подавлять госпитальные штаммы Staphylococcus spp., у них отсутствует антиэнтерококковая активность.
Полирезистентных штаммов Staphylococcus spp. и Enterococcus spp. выявлено много как в нашем исследовании, так и в ходе микробиологического мониторинга возбудителей нозокомиальной инфекции в урологической клинике СПбГМУ [15]. Если с распространением метициллин-резистентных S. aureus и S. epidermidis в сложившейся ситуации что-либо сделать затруднительно (для этого нужно значительно сократить применение карбапенемов и других антибиотиков резерва в отделениях урологии и интенсивной терапии, что возможно только немедицинскими методами – нормированием потребления или административным запретом на их назначение в определенных ситуациях), то с распространением ампициллин-резистентного Enterococcus spp. можно реально побороться. По крайней мере локально – на уровне урологического стационара. Необходимо отказаться от использования ингибиторозащищенных аминопенициллинов по всем показаниям, кроме энтерококковой суперинфекции (выявленной бактериологически или лишь предполагаемой эмпирически), и не применять эти препараты для эмпирической антибактериальной профилактики при оперативных вмешательствах на органах мочеполовой системы.
Случай рецидивируюшего нефролитиаза в сочетании с ИБС – именно та, в целом нечастая, ситуация, когда представляется оправданным эмпирическое применение ингибиторозащищенных аминопенициллинов для подавления мочевой инфекции.
ЗАКЛЮЧЕНИЕ / CONCLUSION
У пациентов с рецидивирующей МКБ в сочетании с ИБС на фоне калькулезного пиелонефрита увеличена доля грамположительных кокков с одновременным снижением доли полирезистентных грамотрицательных инфекционных агентов (нозокомиальные штаммы E. coli и K. pneumoniae).
Распределение возбудителей определяет выбор препарата для эмпирической антибактериальной терапии и профилактики. Повышенная частота встречаемости грамположительной мочевой инфекции у коморбидных больных, страдающих нефролитиазом с сопутствующей ИБС, вынуждает чаще использовать препараты с высокой антиграмположительной активностью, в частности ингибиторозащищенные аминопенициллины.
1. Ермишина В. И. Оценка клинико-биохимических и иммунологических показателей в диагностике осложненного хронического пиелонефрита. Дис. … канд. мед. наук. М.; 2014.
2. Давыдова С.С. Профилактика осложнений хронических сердечно-сосудистых заболеваний раннего послеоперационного периода после оперативных вмешательств на органах мочеполовой системы у мужчин. Автореф. дис. … д-рa мед. наук. М.; 2012. Капсаргин Ф.П. Клиническое обоснование выбора метода хирургического лечения мочекаменной болезни. Автореф. дис. … д-ра мед. наук. Красноярск; 2010.
3. КОЕ – колониеобразующая единица.
Список литературы
1. Marien T., Mass A.Y., Shah O. Antimicrobial resistance patterns in cases of obstructive pyelonephritis secondary to stones. Urology. 2015; 85 (1): 64–8. https://doi.org/10.1016/j.urology.2014.10.007.
2. Kulchenko N.G., Chibisov S.M., Eremina I.Z., et al. Dinamic changes of the microflora sensitivity to antibiotics in patients with chronic calculous pyelonephritis. Res J Pharm Technol. 2017; 10 (3): 683–6. https://doi.org/10.5958/0974-360X.2017.00127.5.
3. Петров В.И., Винаров А.З., Векильян М.А., Кульченко Н.Г. Изменение структуры возбудителей калькулезного пиелонефрита, осложненного сахарным диабетом 2 типа, в урологическом стационаре Волгограда. Урология. 2016; 4: 58–62.
4. Каприн А.Д., Гафанов Р.А., Миленин К.Н. Пиелонефрит: клиника, диагностика и лечение. Лечащий врач. 2002; 11: 16–9.
5. Аполихин О.И., Сивков А.В., Москалева Н.Г. и др. Анализ уронефрологической заболеваемости и смертности в Российской Федерации за десятилетний период (2002–2012 гг.) по данным официальной статистики. Экспериментальная и клиническая урология. 2014; 2: 4–13.
6. EAU. Guidelines. Urological infections. URL: https://uroweb.org/guidelines/urological-infections/chapter/the-guideline (дата обращения 12.08.2022).
7. Круглякова Л.В., Величко Д.Н., Сулима М.В. и др. Осложнения антибактериальной терапии инфекционных заболеваний мочеполовых органов. В кн.: Актуальные вопросы урологии. Материалы ΧΙ научно-практической конференции урологов Дальнего Востока. Благовещенск–Хэйхе (КНР), 19–21 сентября 2013 г. Благовещенск; 2013: 81–8.
8. Кульченко Н.Г., Векильян М.А. Анализ антибактериальной чувствительности E. coli у пациентов с хроническим калькулезным пиелонефритом. Вестник Российского университета дружбы народов. Серия: Медицина. 2016; 3: 125–31.
9. Шикина И.Б. Обеспечение безопасности пациентов пожилого и старческого возраста в условиях стационара. Проблемы социальной гигиены, здравоохранения и истории медицины. 2007; 6: 44–45.
10. Hamasuna R., Takahashi S., Nagae H., et al. Obstructive pyelonephrit as a result of urolithiasis in Japan: diagnosis, treatment and prognosis. Int J Urol. 2015; 22 (3): 294–300. https://doi.org/10.1111/iju.12666.
11. Гаджиева З.К. Особенности подхода к диагностике и лечению рецидивирующих инфекций нижних мочевыводящих путей. Урология. 2013; 3: 84–91.
12. Галкин В.В., Малев И.В., Довгань Е.В. и др. Эффективность и безопасность цефиксима и ципрофлоксацина при остром цистите (многоцентровое рандомизированное исследование). Урология. 2011; 1: 13–6.
13. Палагин И.С., Сухорукова М.В., Дехнич А.В. и др. Осложненные внебольничные инфекции мочевых путей у взрослых пациентов в России. Клиническая микробиология и антимикробная химиотерапия. 2014; 16 (1): 39–56.
14. Перепанова Т.С. Федеральные клинические рекомендации «Антимикробная терапия и профилактика инфекций почек, мочевыводящих путей и мужских половых органов – 2015 г.». Терапевтический архив. 2016; 88 (4): 100–4. https://doi.org/10.17116/terarkh2016884100-104.
15. Слесаревская М.Н., Спиридонова А.А., Краснова М.В. и др. Микробиологический мониторинг возбудителей нозокомиальной инфекции в урологической клинике. Урологические ведомости. 2020; 10 (4): 293–300. https://doi.org/10.17816/uroved54607.
16. Палагин И.С., Сухорукова М.В., Дехнич А.В. и др. Антибиотикорезистентность возбудителей внебольничных инфекций мочевых путей в России: результаты многоцентрового исследования «ДАРМИС-2018». Клиническая микробиология и антимикробная химиотерапия. 2019; 21 (2): 134–46. https://doi.org/10.36488/cmac.2019.2.134-146.
17. Романов А.В., Дехнич А.В., Сухорукова М.В. и др. Антибиотикорезистентность нозокомиальных штаммов Staphylococcus aureus в стационарах России: результаты многоцентрового эпидемиологического исследования «МАРАФОН» 2013–2014. Клиническая микробиология и антимикробная химиотерапия. 2017; 19 (1): 57–62.
18. Федеральная служба по надзору в сфере защиты прав потребителей и благополучия человека. МУ 4.2.2039—05 «Техника сбора и транспортирования биоматериалов в микробиологические лаборатории». URL: https://www.rospotrebnadzor.ru/documents/details.php?ELEMENT_ID=4750 (дата обращения 12.08.2022).
19. Сычева М.В., Карташова О.Л., Щепитова Н.Е., Сафронов А.А. Антибиотикорезистентность бактерий рода Enterococccus, выделенных из организма человека в норме и при патологии. Антибиотики и химиотерапия. 2016; 61 (7-8): 27–32.
Об авторах
Р. В. РоюкРоссия
Роюк Руслан Валерьевич – к.м.н., начальник урологического отделения
Поперечный просек, д. 17, Москва 107014
С. К. Яровой
Россия
Яровой Сергей Константинович – д.м.н., главный научный сотрудник, врач – клинический фармаколог
3-я Парковая ул., д. 51, Москва 105425
И. Б. Шикина
Россия
Шикина Ирина Борисовна – д.м.н., доцент, главный научный сотрудник отделения научных основ организации здравоохранения
ул. Добролюбова, д. 11, Москва 127254
Scopus Author ID: 6602992806
Рецензия
Для цитирования:
Роюк Р.В., Яровой С.К., Шикина И.Б. Антибиотикорезистентность уропатогенов у пациентов с нефролитиазом на фоне сопутствующей ишемической болезни сердца. ФАРМАКОЭКОНОМИКА. Современная фармакоэкономика и фармакоэпидемиология. 2022;15(4):453-462. https://doi.org/10.17749/2070-4909/farmakoekonomika.2022.134
For citation:
Royuk R.V., Yarovoy S.K., Shikina I.B. Antibiotic resistance of uropathogens in patients with nephrolithiasis and concomitant coronary heart disease. FARMAKOEKONOMIKA. Modern Pharmacoeconomics and Pharmacoepidemiology. 2022;15(4):453-462. (In Russ.) https://doi.org/10.17749/2070-4909/farmakoekonomika.2022.134

Контент доступен под лицензией Creative Commons Attribution-NonCommercial-ShareAlike 4.0 International License.






































