Перейти к:
О перспективах применения хондроитина сульфата и глюкозамина сульфата в терапии пациентов с остеоартритом на фоне ожирения (метаболического синдрома)
https://doi.org/10.17749/2070-4909/farmakoekonomika.2022.145
Аннотация
Взаимосвязь между патофизиологией остеоартрита (ОА) и метаболическими нарушениями (метаболическим синдромом, ожирением) обусловлена не только механическими причинами (усилением давления массы тела на суставы). Установлен комплекс молекулярных механизмов, посредством которых ОА влияет на формирование ожирения. Избыточная активность толл-рецепторов, каскада NF-κB, нарушения метаболизма эндогенных хондроитина сульфатов (ХС) приводят к хронизации воспаления и развитию комплекса коморобидных патологий, включая ОА, атеросклероз, ожирение. Связь резистентности к инсулину и метаболизма ХС также опосредована нарушениями метилирования геномной ДНК. Экзогенные ХС и глюкозамина сульфат (ГС), используемые в долговременной терапии ОА, также способствуют торможению патофизиологии ожирения. Ингибируя О-глюкозаминирование внутриядерных белков (например, р53), ГС может ускорять липолиз висцерального жира. Противовоспалительное воздействие ХС и ГС сопряжено с ингибированием толл-рецепторов и NF-κB, повышением уровней ферментов-антиоксидантов, регуляцией экспрессии фактора роста фибробластов 21, активацией аденозинмонофосфат-активируемой протеинкиназы, ингибированием секреции хемоаттрактантного белка MCP-1 и панкреатической липазы. Положительный эффект воздействия ХС и его олигосахаридов на патофизиологию метаболических нарушений связан не только со снижением воспаления и нормализацией жирового обмена, но и с улучшением состояния микробиоты кишечника. Экспериментальные и клинические исследования подтверждают эффекты ХС и ГС на контроль массы тела. ХС и ГС эффективны и безопасны при использовании у пациентов с ОА на фоне метаболического синдрома и/или ожирения
Ключевые слова
Для цитирования:
Торшин И.Ю., Громова О.А., Лила А.М. О перспективах применения хондроитина сульфата и глюкозамина сульфата в терапии пациентов с остеоартритом на фоне ожирения (метаболического синдрома). ФАРМАКОЭКОНОМИКА. Современная фармакоэкономика и фармакоэпидемиология. 2022;15(3):390-401. https://doi.org/10.17749/2070-4909/farmakoekonomika.2022.145
For citation:
Torshin I.Yu., Gromova О.A., Lila A.M. Prospects for the use of chondroitin sulfate and glucosamine sulfate in the treatment of patients with obesity-associated osteoarthritis (metabolic syndrome). FARMAKOEKONOMIKA. Modern Pharmacoeconomics and Pharmacoepidemiology. 2022;15(3):390-401. (In Russ.) https://doi.org/10.17749/2070-4909/farmakoekonomika.2022.145
ВВЕДЕНИЕ / INTRODUCTION
Остеоартрит (ОА) – дегенеративное заболевание суставов, связанное с гипертрофическими изменениями костей. Современные фармакологические методы лечения ОА включают применение нестероидных противовоспалительных препаратов, анальгетиков, кортикостероидов кратковременного действия, хондроитина сульфата (ХС), глюкозамина сульфата (ГС), гиалуроновой кислоты, экстрактов авокадо и различных комбинаций этих компонентов.
Факторы риска ОА включают травмы в анамнезе, пожилой возраст и ожирение. Высокая распространенность ожирения во всем мире существенно утяжеляет течение ОА в масштабе популяций [1]. В мире распространенность ожирения среди взрослых составляет примерно 13% [2]; в России и других странах ожирение часто сочетается с ОА (10–16%) [3][4]. Ожирение выделяется как отдельный фенотип ОА [5].
У пациентов с избыточной массой тела повышен риск развития ОА и более быстрого прогрессирования этого заболевания. Важной причиной возникновения и прогрессирования OA является инсулинорезистентность, которая запускает порочный круг метаболических изменений в жировой, соединительной и хрящевой тканях [6]. Клинико-эпидемиологические исследования показывают, что метаболический синдром, а не ожирение как таковое является главным фактором риска OA [7].
При снижении избыточной массы тела более чем на 5% отмечено уменьшение не только метаболических нарушений и факторов сердечно-сосудистого риска, но и симптоматики ОА [8]. Исследование пациентов с ОА и ожирением (n=2200, индекс массы тела (ИМТ) ~46 кг/м2) после хирургического лечения ожирения продемонстрировало снижение боли и улучшение функций суставов по шкале WOMAC1 [9]. В другой работе (n=1383, средний возраст 64 года, ИМТ ~34 кг/м2, ожирение у 82%) показано, что для достижения клинически значимой разницы по индексу WOMAC снижение избыточной массы тела должно составлять не менее 7,7% от исходного значения [10].
В статье рассмотрены результаты постгеномных исследований патофизиологии ожирения и ОА, взаимосвязи между метаболизмом жиров, нарушениями метилирования ДНК и О-глюкозаминирования белков, результаты экспериментальных и клинических исследований влияния ХС и ГС на избыточную массу тела, а также положительные эффекты воздействия ХС и его олигосахаридов на микробиом желудочно-кишечного тракта, участвующий в обмене жиров.
ПОСТГЕНОМНЫЕ ИССЛЕДОВАНИЯ ПАТОФИЗИОЛОГИИ ОЖИРЕНИЯ И ОСТЕОАРТРИТА / POSTGENOMIC STUDIES OF OBESITY AND OSTEOARTHRITIS PATHOPHYSIOLOGY
Постгеномные исследования интересны тем, что позволяют получить достаточно широкую картину молекулярных механизмов взаимосвязи патофизиологии различных заболеваний и действия лекарств на эти механизмы. Такие исследования активно проводятся, и их результаты дают возможность утверждать, что существуют сложные взаимосвязи между патофизиологией ОА, метаболического синдрома и эффектами ХС и ГС.
По итогам систематического анализа 37 постгеномных исследований выделено 483 гена и соответствующих белка, связанных с патогенезом ОА: белки регуляции роста соединительной ткани и белки регуляции воспаления, ингибирующие NF-κB и толл-рецепторы липополисахаридов [11]. Избыточная активность толл-рецепторов приводит к хронизации воспаления и развитию комплекса коморбидных патологий, включая ОА и атеросклероз [12]. ХС и ГС, ингибируя сигнальный каскад NF-κB, могут замедлять формирование и рост атеросклеротических бляшек [13]. По данным клинических исследований, регулярное потребление глюкозамина сокращает риск сердечно-сосудистой смертности на 58% [14]. Ингибирование NF-κB посредством ХС и ГС также способствует не только снижению системного воспаления, но и торможению неоваскуляризации при рестенозе после стентирования сосудов [15].
Полногеномное исследование позволило выявить 49 генов-кандидатов, влияющих на риск развития ожирения у человека. Наряду с очевидными генами-кандидатами (инсулин-индуцируемый ген INSIG2, ген FTO, кодирующий белок контроля жировой массы и др.) обнаружено, что важным геном-кандидатом является GNPDA2, кодирующий глюкозамин-6-фосфатдезаминазу 2, участвующую в метаболизме эндогенных ХС и ГС [16].
Взаимосвязь резистентности к инсулину и метаболизмом эндогенных ХС и ГС также опосредована нарушениями метилирования ДНК. Полногеномное исследование выявило 7402 гиперметилированных сайта и 6073 гипометилированных сайта при сравнении геномов здоровых добровольцев с геномами пациентов с инсулинорезистентностью. Дифференциально метилированные гены (SMYD3, UST, BCL11A, BAI3, CHST7, CHST12, CHST11, CHST3, CHST13, CSPG5, DCN, NCAN, DSE и др.) участвуют в процессах биосинтеза хондроитина и дерматансульфата [17]. Важно подчеркнуть, что нарушения метилирования ДНК зачастую связаны с недостаточностью фолатов, витамина В12, пиридоксина и других витаминов группы В.
МЕТАБОЛИЗМ ЖИРОВ И О-ГЛЮКОЗАМИНИРОВАНИЕ БЕЛКОВ / FAT METABOLISM AND PROTEIN O-GLUCOSAMINATION
На метаболизм жиров влияют посттрансляционные модификации белков (биохимические модификации специфических остатков белков после трансляции, т.е. синтеза белка на рибосоме). В частности, O-связанное ацетилглюкозаминирование (О-глюкозаминирование) белков осуществляется посредством O-глюкозаминтрансферазы (англ. O-glucosamine transferase, OGT). Фермент OGT катализирует перенос молекулы N-ацетилглюкозамина (GlcNAc) из комплекса «уридилдифосфат–GlcNAc» на аминокислотные остатки серина/треонина в цитоплазматических и ядерных белках. OGT гликозилирует несколько сотен белков протеома человека, включая гистон H2B, сигнальную киназу AKT1, сигнальные белки EZH2, MAPT/TAU и др. В частности, OGT ингибирует фосфорилирование аминокислотного остатка Thr-308 сигнальной киназы AKT1 и участвует в О-глюкозаминировании сигнальных компонентов инсулина, что приводит к ослаблению передачи сигналов в каскаде рецептора инсулина и формированию резистентности клеток к инсулину [18].
O-глюкозаминирование внутриядерного белка р53 в клетках печени взаимосвязано с выработкой глюкозы в печени. При голодании транскрипционный фактор р53 играет существенную роль в физиологической регуляции гомеостаза глюкозы в печени. Уровни белка р53 в печени пациентов с сахарным диабетом 2-го типа (СД2) повышены и положительно коррелируют с уровнями глюкозы и индекса инсулинорезистентности HOMA2 [19].
Снижение активности OGT или уровней комплекса «уридиндифосфат–GlcNAc», необходимого для работы фермента, снижает О-глюкозаминирование внутриядерных белков и тормозит провоспалительный транскрипционный ответ. Наоборот, повышение активности фермента OGT (например, на фоне дефицита ГС) стимулирует развитие воспаления в белой жировой ткани пациентов с ожирением [20].
Непосредственно участвуя в О-глюкозаминировании белков, фермент OGT ингибирует липолиз висцерального жира и способствует развитию ожирения, особенно на фоне диеты с высоким содержанием насыщенных жиров (рис. 1).

Рисунок 1. Фермент О-глюкозаминтрансфераза (англ. O-glucosamine transferase, OGT) и его участие в метаболизме жировой ткани. OGT катализирует перенос молекулы N-ацетилглюкозамина из комплекса «уридилдифосфат (УДФ) – N-ацетилглюкозамин» на аминокислотные остатки серина/треонина в белках. Представлена пространственная структура OGT (модель на основе PDB файла 4ay5), в которой указан сайт связывания УДФ–N-ацетилглюкозамина (сферическая модель), соответствующий сайту связывания молекулы глюкозамина сульфата (которая ингибирует OGT). Потеря активности фермента OGT в жировой ткани способствует липолизу висцерального жира (авторский рисунок, подготовлен на основании указанной структуры белка – PDB файла 4ay5)
Figure 1. O-glucosamine transferase (OGT) and its involvement in fat metabolism. OGT catalyzes a transfer of N-acetylglucosamine from the complex of “uridylyl phosphate (UDP) – N-acetylglucosamine” to amino acid residues of serine/threonine proteins. A spatial structure of OGT (model based on PDB file 4ay5) is presented showing the site of UDP-N-acetylglucosamine molecule binding (spherical model), which corresponds to the site of binding of glucosamine sulfate molecule (which inhibits OGT). Loss of OGT enzyme activity in adipose tissue promotes visceral fat lipolysis (the authors' drawing, prepared on the basis of the specified protein structure – PDB file 4ay5)
Делеция гена OGT у мышей вызывает быструю потерю висцерального жира за счет стимулирования липолиза. Потеря активности OGT снижает O-глюкозаминирование белка перилипин-1 (PLIN1), участвующего в формировании липопротеиновых частиц, что, в свою очередь, приводит к повышенному фосфорилированию PLIN1 и усилению липолиза. И наоборот, абнормально повышенная экспрессия OGT в жировой ткани ингибирует липолиз и способствует ожирению, вызванному диетой (рис. 2) [21].
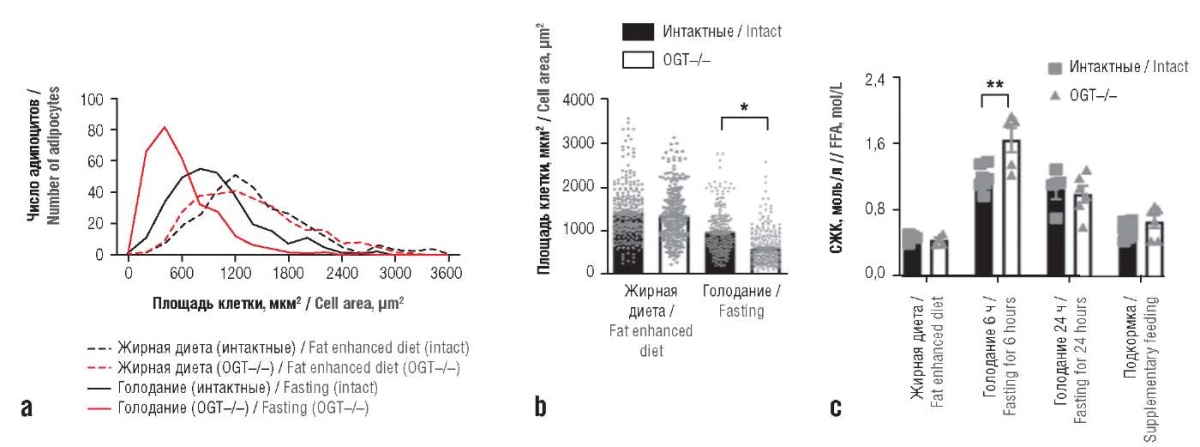
Рисунок 2. Влияние делеции гена О-глюкозаминтрансферазы (англ. O-glucosamine transferase, OGT), стимулирующей липолиз, на темп потери висцерального жира у мышей [21]:
a, b – количественная оценка размера адипоцитов при делеции гена OGT у мышей (OGT–/–); с – динамические изменения уровня свободных жирных кислот (СЖК) в сыворотке крови у интактных мышей и у животных с делецией гена OGT при различных условиях кормления.
* p<0,0001; ** p<0,001
Figure 2. The influence of O-glucosamine transferase (OGT) gene deletion stimulating lipolysis on the rate of visceral fat reduction in mice [21]:
a, b – quantitative assessment of adipocyte size in mice with OGT gene deletion (OGT–/–); c – dynamic changes in the level of free fatty acids (FFA) in the blood serum in intact mice and animals with OGT gene deletion under different feeding conditions.
* p<0.0001; ** p<0.001
Фермент OGT адипоцитов влияет на гиперфагию и ожирение, вызванные несбалансированной диетой. OGT адипоцитов стимулирует гиперфагию за счет транскрипционной активации накопления N-арахидонилэтаноламина – эндогенного каннабиноида, вызывающего аппетит. Фармакологическое воздействие на периферическую передачу сигналов каннабиоидного рецептора CB1 регулирует гиперфагию в зависимости от активности OGT адипоцитов [22].
ЭКСПЕРИМЕНТАЛЬНЫЕ ИССЛЕДОВАНИЯ ЭФФЕКТОВ ГЛЮКОЗАМИНА НА КОНТРОЛЬ МАССЫ ТЕЛА / EXPERIMENTAL STUDIES OF THE EFFECTS OF GLUCOSAMINE ON BODY WEIGHT CONTROL
Воздействия ГС на процессы О-глюкозаминирования белков и на провоспалительный сигнальный каскад NF-κB позволяют предположить положительные эффекты ГС при метаболическом синдроме и ожирении. Следует подчеркнуть, что ГС не оказывает отрицательного влияния на обмен глюкозы. Оценка эффектов ГС и комбинации ГС + ХС у крыс линии Zucker с моделью ожирения показала, что при пероральном приеме D-глюкозамина он не имеет значительного влияния на массу тела, уровень глюкозы в крови или уровень инсулина в сыворотке ни в одной из испытанных доз после приема в течение 13 нед [23]. В обсервационном исследовании ГС не влиял ни на средний уровень гемоглобина A1c, ни на получение его высокого уровня, ни на риск СД2 в течение 6,5 лет [24]. Результаты систематического анализа позволяют утверждать, что, несмотря на присутствие корня «глюко-» в названии ГС, данное вещество не стимулирует формирование или прогрессирование инсулинорезистентности [18].
Более того, данные новейших исследований демонстрируют положительное воздействие ГС на обмен жиров и метаболизм адипоцитов по нескольким молекулярным механизмам. Глюкозамин проявляет миметический эффект, схожий с результатами ограничения калорийности пищи у стареющих крыс. На фоне приема ГС отмечено повышение железовосстанавливающей способности плазмы, уровней ферментов-антиоксидантов супероксиддисмутазы, каталазы и окислительно-восстановительного потенциала плазматических мембран [25].
На клеточной модели in vitro клеток печени мышей линии AML12 и адипоцитов (линия клеток мышей 3T3L1), а также на модели in vivo мышей с нормальной диетой и диетой с высоким содержанием жиров показано, что ГС регулирует экспрессию фактора роста фибробластов 21 в печени и жировой ткани. Глюкозамин улучшает метаболизм глюкозы и повышает уровень FGF21 в печени посредством воздействия на передачу сигналов по каскадам NF-κB и PKA/CREB [26]. Обработка адипоцитов линии 3T3L1 посредством ГС снижает содержание триглицеридов, вызывает подавление адипогенеза, активирует аденозинмонофосфат-активируемую протеинкиназу (англ. adenosine monophosphate-activated protein kinase, AMPK) вместе с ее субстратом ацетил-КоА-карбоксилазой, что может ингибировать дифференциацию адипоцитов [27].
Глюкозамин (500 мг/кг в питьевой воде, 21 нед) снижает скорость накопления внутрибрюшного жира и роста уровней лептина в сыворотке, а также уровень резистентности к инсулину у крыс на жирной диете. У животных, получаюших ГС, уменьшается уровень гликогена в печени. Применение глюкозамина частично ингибирует эффекты жирной диеты за счет снижения жировой массы тела и уровня лептина в сыворотке крови, что приводит к нормализации инсулинемического ответа на инъекцию глюкозы и снижению постабсорбционной гликемии [28].
В эксперименте пероральный прием глюкозамина (500 мг/кг/сут в питьевой воде, 22 нед) снижал резистентность к инсулину и повреждения ткани поджелудочной железы у крыс линии Wistar, находившихся на диете с высоким содержанием жиров. Данная диета стимулировала развитие инсулинорезистентности, повышение пикноза ядер клеток поджелудочной железы и их вакуолизации, жировой инфильтрации на фоне структурных изменений островков Лангерганса. Воспроизведение модели приводило к более высоким концентрациям триглицеридов, свободных жирных кислот и малонового диальдегида по сравнению с интактным контролем. Прием ГС ослаблял резистентность к инсулину и способствовал нормализации уровней триглицеридов, свободных жирных кислот и малонового диальдегида в сыворотке крови и тканях поджелудочной железы, а также тормозил гистопатологические изменения поджелудочной железы. Гистологическое исследование показало, что диета с высоким содержанием жиров приводит к полициклическим контурам, пикнозу, вакуолизации и жировой инфильтрации клеток. При приеме глюкозамина на фоне жирной диеты эти негативные гистологические изменения были существенно снижены [29].
ЭКСПЕРИМЕНТАЛЬНЫЕ И КЛИНИЧЕСКИЕ ИССЛЕДОВАНИЯ ЭФФЕКТОВ ХОНДРОИТИНА НА КОНТРОЛЬ МАССЫ ТЕЛА / EXPERIMENTAL AND CLINICAL STUDIES OF THE EFFECTS OF CHONDROITIN ON BODY WEIGHT CONTROL
Взаимосвязь патофизиологии ожирения и ОА опосредована нарушениями баланса адипокинов и провоспалительных цитокинов, гиперинсулинемией, саркопенией, а также нарушениями метаболизма компонентов соединительной ткани (ХС и других глюкозаминогликанов) [8]. Гепарансульфат, хондроитини кератансульфаты модулируют метаболическую дисфункцию, вызванную ожирением, и способствуют снижению хронического воспаления, влияющего на возникновение и прогрессирование коморбидных ожирению заболеваний [30].
Применение ХС при ожирении снижает и воспаление, и атерогенез. Например, лечение мышей с ожирением посредством ХС уменьшало размер атероматозных бляшек на бифуркациях крупных артерий на 62,5%, концентрацию интерлейкина 1β в сыворотке крови – на 70%, концентрацию фактора некроза опухоли альфа (ФНОα) – на 82%. Культуры коронарных эндотелиальных клеток и моноцитов, стимулированные цитокином ФНОα, секретировали меньшие количества провоспалительных цитокинов в присутствии ХС по сравнению с контролем (р<0,01). ХС снижал активацию сигнального пути ФНОα в эндотелиоцитах (снижение уровней фосфорилированной киназы Erk – на 36%, уровней NFκB – на 33%), а также миграцию активированных моноцитов к очагу воспаления (рис. 3, 4) [31].

Рисунок 3. Влияние хондроитина сульфата (ХС) на профиль провоспалительных цитокинов у мышей с ожирением. По десять образцов сыворотки мышей с диетическим ожирением, получавших плацебо (VH, физраствор) и ХС (1000 мг/кг/сут) в течение 6 сут [31]:
a – концентрации интерлейкина 1 бета (ИЛ-1β) и фактора некроза опухоли альфа (ФНОα); b – концентрации цитокинов.
КС (англ. keratinocytes) – кератиноциты; RANTES (англ. regulated on activation, normal T cell expressed and secreted) – регулируемые при активации нормальные Т-клетки, экспрессируемые и секретируемые; TARC (англ. thymus and activation regulated chemokine) – хемокин, регулируемый активацией тимуса; * p<0,01 по сравнению с плацебо; **p<0,0001 по сравнению с плацебо
Figure 3. Influence of chondroitin sulfate (CS) on the profile of anti-inflammatory cytokines in mice with obesity. Ten samples of mice serum with induced obesity that received placebo (VH, saline solution) and ten samples of mice serum that received CS (1000 mg/kg/day) for 6 days [31]:
a – concentration of interleukin 1 beta (IL-1β) and tumor necrosis factor alfa (TNFα); b – concentration of cytokines.
KC – keratinocytes; RANTES – regulated on activation, normal T cell expressed and secreted; TARC – thymus and activation regulated chemokine; * p<0.01 in comparison with placebo; ** p<0.0001 in comparison with placebo

Рисунок 4. Влияние хондроитина сульфата (ХС) на количество макрофагов в атеросклеротических бляшках в бифуркациях сонных артерий in situ у мышей с ожирением [31]:
a, b – репрезентативные изображения, полученные многофотонной микроскопией (желтые области – макрофаги), исходное увеличение ×25; c – количественная оценка площади покрытия макрофагами (p<0,0001)
Figure 4. Influence of chondroitin sulfate (CS) on macrophage count in atherosclerotic plaques in carotid bifurcations in situ in mice with obesity [31]:
a, b – representative images obtained with multiphoton microscopy (yellow areas – macrophages), magnification ×25; c – quantitative assessment of the area covered with macrophages (p<0.0001)
ХС ингибирует высвобождение белка-хемоаттрактанта MCP-1 из адипоцитов. Основное действие белка MCP-1 заключается в индукции миграции моноцитов в очаг воспаления жировой ткани. ХС в концентрациях 100–200 мкг/мл дозозависимо ингибировал высвобождение MCP-1 из воспаленных адипоцитов (при 100 мкг/мл 95% доверительный интервал (ДИ) –5,89…–3,85, р<0,01; при 200 мкг/мл 95% ДИ –6,03…–3,99, р<0,001) (рис. 5) [32].

Рисунок 5. Хондроитина сульфат (ХС) уменьшает высвобождение белка MCP-1 из адипоцитов, стимулированных липополисахаридами (ЛПС). Клетки 3T3-L1 дифференцировались в адипоциты, а затем стимулировались ЛПС. ХС добавляли в физиологическом диапазоне концентраций (100–200 мкг/мл), что вызывало дозозависимое снижение высвобождения MCP-1 из клеток [32]
Figure 5. Chondroitin sulfate (CS) reduces the release of MCP-1 protein from adipocytes, stimulated by lipopolysaccharides (LPS). 3T3-L1 cells differentiated into adipocytes and were stimulated by LPS. CS was added in physiological range of concentrations (100–200 μg/ml), which caused dose-dependent reduction of MCP-1 release from the cells [32]
Олигсахариды ХС ингибируют панкреатическую липазу, а также пролиферацию и накопление липидов в зрелых адипоцитах. При этом ХС с более высокой молекулярной массой проявляет бо́льшую ингибирующую активность по отношению к липазе. Олигосахариды ХС могут снижать избыточную жировую массу у мышей на диете с высоким содержанием жиров, предотвращая увеличение массы тела, массы печени и жировой ткани, поддерживая более низкое потребление пищи, ингибируя всасывание триглицеридов в кишечнике и снижая уровень эндотоксинов в сыворотке крови [33].
У крыс на диете с высоким содержанием жиров глюкозамин и олигосахариды ХС (6 нед) снижали уровни общего холестерина и липопротеинов низкой плотности в сыворотке крови (р<0,01). Гистологический анализ показал, что на фоне жирной диеты развилась высокая степень стеатоза: обнаруживаются гепатоциты с выраженными жировыми вакуолями и инфильтрацией воспалительных клеток. При применении ХС количество жировых вакуолей и некротических клеток снижалось на фоне редукции гистологических признаков стеатогепатоза [34].
В клинической практике у больных с ожирением, диабетом и/или гиперлипидемией отмечается достаточно быстрая положительная динамика параметров липидного профиля крови, вызванная приемом комплексов глюкуроновой кислоты с глюкозаминогликанами [35]. Например, дотации ХС (600 мг/сут, 2 мес) снижали воспаление, окислительный стресс и улучшали функциональное состояние у пациентов с ОА коленного сустава на фоне ожирения (n=48, возраст 20–50 лет, ИМТ 30–35 кг/м2). Потребление ХС достоверно уменьшило ИМТ, индекс WOMAC, уровни С-реактивного белка, общего холестерина и улучшило индекс инсулинорезистентности HOMA [36].
Следует отметить, что фармакотерапия ХС у больных ОА на фоне атеросклероза и/или ожирения повышает требования к степени очистки субстанции ХС (т.к. ХС – субстанция природного происхождения). Препараты ХС существенно отличаются по качественному и количественному составу. Например, был проведен сравнительный анализ шести препаратов ХС на основании профилей микроэлементного состава, содержания серы, хроматографического анализа ХС и теста на общий белок. Наибольшим содержанием хондроитина сульфата и серы при условии наименьшего содержания токсичных микроэлементов и белковых примесей отличался экстракт ХС, полученный из трахеи быка (Хондрогард®) [37]. Препараты ХС с высокой степенью очистки от неорганических и органических примесей могут проявлять гепатопротекторные эффекты [38].
Среди препаратов ХС для инъекционного введения наилучшей степенью очистки и наибольшей доказательной базой характеризуется Хондрогард® [39–41]. Метаанализ восьми клинических исследований (n=771, возраст 53,6±6,2 года) применения инъекционной формы препарата Хондрогард® в комплексной терапии ОА подтвердил достоверные ассоциации между его использованием и снижением уровня боли по визуальной аналоговой шкале, индексов Лекена и WOMAС при встречаемости побочных эффектов, статистически значимо не отличимой от контроля [42]. Терапия препаратом Хондрогард® способствует существенному снижению болевого синдрома и скованности, улучшению функционального состояния коленных суставов при высоком уровне безопасности, в т.ч. у больных с коморбидными ОА патологиями.
ОЖИРЕНИЕ И ЭФФЕКТЫ ХОНДРОИТИНА НА МИКРОБИОМ ЖЕЛУДОЧНО-КИШЕЧНОГО ТРАКТА / OBESITY AND THE EFFECTS OF CHONDROITIN ON THE GASTROINTESTINAL TRACT MICROBIOME
Наличие хронического воспаления, играющего важную роль в патогенезе ОА, связано с состоянием микробиома кишечника. Систематический анализ 19 исследований подтвердил, что ожирение и диеты с высоким содержанием жиров и сахаров приводят к дисбактериозу кишечника, характеризующемуся повышенным соотношением Firmicutes : Bacteroidetes и повышенной проницаемостью желудочной стенки. Эти изменения связаны с увеличением уровня бактериальных липополисахаридов в сыворотке крови, что приводит к синовиту и утяжелению течения ОА. Анализ подтвердил взаимосвязь между диетой, дисбактериозом кишечника, рентгенологической картиной и клинической симптоматикой ОА [43].
Кроме того, постгеномные исследования показали изменение метаболитов кишечных микробов у взрослых с ожирением. Изменения в кишечной микробиоте могут привести к модуляции кишечных метаболитов, способствующих гликолизу, циклу трикарбоновых кислот и гомолактической ферментации. По результатам метаболического анализа обнаружена корреляция между нарушениями уровней метаболитов в кишечнике (фенилаланин, тирозин, мочевая кислота, кинуреновая кислота, сульфат холестерина и глюкозамин) и ожирением/диабетом. Выявленные изменения метаболитов, связанных с кишечной микробиотой, могут служить полезными биомаркерами для оценки риска ожирения, инсулинорезистентности и глюкозотолерантности [2].
Важным дополнительным эффектом ХС, который отсутствует у большинства других препаратов, применяющихся в терапии ОА, является положительное воздействие на микробиом желудочно-кишечного тракта. Например, в эксперименте на мышах линии C57BL/6, получавших диету с высоким содержанием жиров, прием ХС в течение 8 нед защищал от формирования неалкогольной жировой болезни печени (НАЖБП) посредством модулирования оси «кишечник–печень». Применение ХС тормозило развитие НАЖБП не только за счет снижения накопления липидов, резистентности к инсулину и повреждений печени, но и посредством восстановления баланса кишечной микробиоты. В частности, ХС способствовал увеличению относительной численности бактерий, продуцирующих короткоцепочечные жирные кислоты (КЦЖК), что важно для метаболизма липидов [44].
Фукозилированные формы ХС из морского огурца (Isostichopus badionotus) снижают связанные с ожирением метаболические синдромы и дисбактериоз кишечника, вызванные диетой с высоким содержанием жиров у мышей линии C57BL/6 в течение 6 нед. ХС уменьшал соотношение бактерий Firmicutes : Bacteroidetes за счет сокращения количества Lachnospiraceae и Allobaculum при одновременном увеличении количества Porphyromonadaceae, Barnesiella и бактероидов, продуцирующих масляную кислоту и другие КЦЖК [45]. Микробиомные эффекты ХС включали повышение количеств Lactobacillus (защищает кишечный барьер) и бактерий, продуцирующих КЦЖК (Lactobacillus, Bifidobacterium, Lachnospiraceae), снижение количества продуцента провоспалительных липополисахаридов (кишечная палочка). Показано, что ХС увеличивает уровни фекальных КЦЖК, которые активируют AMPK и сокращают хроническое воспаление тканей [46]. Заметим, что положительное воздействие ХС и его олигосахаридов на кишечную микробиоту делает ХС важным предметом исследований для модуляции свойств лекарственных препаратов посредством нанокапсулирования [47–49].
ЗАКЛЮЧЕНИЕ / CONCLUSION
Остеоартрит и СД2 часто коморбидны с ожирением и/или избыточной массой тела. Резистентность к инсулину оказывает негативное воздействие на течение ОА вследствие увеличения окислительного стресса и хронического воспаления, усиливающегося при гипергликемии. Взаимосвязь между патофизиологией ОА и инсулинорезистентностью поднимает вопросы безопасности применения некоторых препаратов, назначаемых больным ОА (парацетамол, нестероидные противовоспалительные препараты, глюкокортикостероиды).
В то же время фармацевтически стандартизированные субстанции ХС и ГС могут безопасно использоваться (перорально, парентерально) у пациентов с ОА на фоне инсулинорезистентности и метаболического синдрома. Молекулярные механизмы действия ХС и ГС у таких больных включают:
- ингибирование толл-рецепторов;
- ингибирование каскада NF-κB;
- торможение О-глюкозаминирования внутриядерных белков (в т.ч. р53);
- регуляцию экспрессии фактора роста фибробластов 21;
- активацию AMPK;
- ингибирование секреции хемоаттрактантного белка MCP-1;
- ингибирование панкреатической липазы.
Важным эффектом ХС и ГС является положительное влияние на состояние микробиома кишечника. Их воздействие через эти механизмы не только снижает хронизацию воспаления, но и способствует активации липолиза и сокращению гиперлипидемии. Возможность применения ХС и ГС при ОА длительными курсами позволяет корректировать метаболические нарушения, связанные с инсулинорезистентностью и ожирением.
1. WOMAC (англ. Western Ontario and McMaster University Osteoarthritis Index) – индекс остеоартрита университетов Западного Онтарио и Макмастера.
2. HOMA-IR (англ. homeostasis model assessment of insulin resistance) – оценка гомеостатической модели резистентности к инсулину.
Список литературы
1. Лила А.М., Алексеева Л.И., Телышев К.А. Современные подходы к фенотипированию остеоартрита. Современная ревматология. 2019; 13 (2): 4–8. https://doi.org/10.14412/1996-7012-2019-2-4-8.
2. Li R., Huang X., Liang X., et al. Integrated omics analysis reveals the alteration of gut microbe-metabolites in obese adults. Brief Bioinform. 2021; 22 (3): bbaa165. https://doi.org/10.1093/bib/bbaa165.
3. Балабанова Р.М., Дубинина Т.В. Динамика пятилетней заболеваемости болезнями костно-мышечной системы и их распространенности среди взрослого населения России за 2013–2017 гг. Современная ревматология. 2019; 13 (4): 11–7. https://doi.org/10.14412/1996-7012-2019-4-11-17.
4. Alenazi A.M., Alhowimel A.S., Alotaibi M.A., et al. Prevalence and incidence of osteoarthritis among people living in the Gulf Cooperation Council countries: a systematic review and meta-analysis. Clin Rheumatol. 2021; 40 (9): 3523–31. https://doi.org/10.1007/s10067021-05662-2.
5. Сарвилина И.В., Шавловская О.А., Громова О.А. и др. Современные достижения в фармакотерапии остеоартрита на основе эндои фенотипирования. ФАРМАКОЭКОНОМИКА.Современная фармакоэкономика и фармакоэпидемиология. 2021; 14 (3): 379–406. https://doi.org/10.17749/2070-4909/farmakoekonomika.2021.105.
6. Стребкова Е.А., Алексеева Л.И. Остеартроз и ожирение. Научно-практическая ревматология. 2015; 53 (5): 542–52.
7. Puenpatom R.A., Victor T.W. Increased prevalence of metabolic syndrome in individuals with osteoarthritis: an analysis of NHANES III data. Postgrad Med. 2009; 121 (6): 9–20. https://doi.org/10.3810/pgm.2009.11.2073.
8. Conrozier T. How to treat osteoarthritis in obese patients? Curr Rheumatol Rev. 2020; 16 (2): 99–104. https://doi.org/10.2174/1573397115666190625105759.
9. King W.C., Chen J.Y., Belle S.H., et al. Change in pain and physical function following bariatric surgery for severe obesity. JAMA. 2016; 315 (13): 1362–71. https://doi.org/10.1001/jama.2016.3010.
10. Atukorala I., Makovey J., Lawler L., et al. Is there a dose-response relationship between weight loss and symptom improvement in persons with knee osteoarthritis? Arthritis Care Res (Hoboken). 2016; 68 (8): 1106–14. https://doi.org/10.1002/acr.22805.
11. Громова О.А., Торшин И.Ю., Лила А.М. и др. Стандартизированные формы хондроитина сульфата как патогенетическое средство лечения остеоартрита в контексте постгеномных исследований. Современная ревматология. 2021; 15 (1): 136–43. https://doi.org/10.14412/1996-7012-2021-1-136-143.
12. Торшин И.Ю., Громова О.А., Лила А.М. и др. Толл-подобные рецепторы как компонент патофизиологии остеоартрита: противовоспалительное, анальгетическое и нейропротекторное действие. Неврология, нейропсихиатрия, психосоматика. 2021; 13 (4): 123–9. https://doi.org/10.14412/2074-2711-2021-4-123-129.
13. Лила А.М., Торшин И.Ю., Громова О.А. Стоит ли переосмыслить полученный полвека назад положительный опыт применения хондроитинсульфатов при атеросклерозе? ФАРМАКОЭКОНОМИКА. Современная фармакоэкономика и фармакоэпидемиология. 2020; 13 (2): 184–91. https://doi.org/10.17749/2070-4909/farmakoekonomika.2020.043.
14. Conrozier T., Lohse T. Glucosamine as a treatment for osteoarthritis: what if it's true? Front Pharmacol. 2022; 13: 820971. https://doi.org/10.3389/fphar.2022.820971.
15. Громова О.А., Торшин И.Ю., Лила А.М. и др. Профилактика рестеноза у пациентов после чрескожного коронарного вмешательства: возможный патогенетический подход. Русский медицинский журнал. 2019; 8: 33–40.
16. Xu X., Zeng H., Xiao D., et al. Genome wide association study of obesity. Zhong Nan Da Xue Xue Bao Yi Xue Ban. 2013; 38 (1): 95–100. https://doi.org/10.3969/j.issn.1672-7347.2013.01.018.
17. Zhang S.J., Wang Y., Yang Y.L., Zheng H. Aberrant DNA methylation involved in obese women with systemic insulin resistance. Open Life Sci. 2018; 13: 201–7. https://doi.org/10.1515/biol-2018-0024.
18. Громова О.А., Торшин И.Ю., Лила А.М. и др. О безопасности применения глюкозамина сульфата у пациентов с резистентностью к инсулину. Consilium Medicum. 2019; 21 (4): 75–83.
19. Gonzalez-Rellan M.J., Fondevila M.F., Fernandez U., et al. O-GlcNAcylated p53 in the liver modulates hepatic glucose production. Nat Commun. 2021; 12: 5068. https://doi.org/10.1038/s41467-02125390-0.
20. Petrus P., Lecoutre S., Dollet L., et al. Glutamine links obesity to inflammation in human white adipose tissue. Cell Metab. 2020; 31 (2): 375–90.e11. https://doi.org/10.1016/j.cmet.2019.11.019.
21. Yang Y., Fu M., Li M.D., et al. O-GlcNAc transferase inhibits visceral fat lipolysis and promotes diet-induced obesity. Nat Commun. 2020; 11 (1): 181. https://doi.org/10.1038/s41467-019-13914-8.
22. Li M.D., Vera N.B., Yang Y., et al. Adipocyte OGT governs dietinduced hyperphagia and obesity. Nat Commun. 2018; 9 (1): 5103. https://doi.org/10.1038/s41467-018-07461-x.
23. Leakey J.E.A., Ali A.A., Babb A.R., et al. Subchronic toxicity evaluation of glucosamine and glucosamine in combination with chondroitin sulfate in obese Zucker rats. Toxicol Appl Pharmacol. 2021; 412: 115371. https://doi.org/10.1016/j.taap.2020.115371.
24. Gommans Y.M.M., Runhaar J., Jacobs M.L., Bierma-Zeinstra S.M.A. The effect of prolonged glucosamine usage on HbA1c levels and newonset diabetes mellitus in overweight and obese middle-aged women. Am J Med. 2017; 130 (6): 731–7.e6. https://doi.org/10.1016/j.amjmed.2016.11.038.
25. Kumar R., Saraswat K., Rizvi S.I. Glucosamine displays a potent caloric restriction mimetic effect in senescent rats by activating mitohormosis. Rejuvenation Res. 2021; 24 (3): 220–6. https://doi.org/10.1089/rej.2020.2399.
26. Chen T.Y., Sun D., Lin W.S., et al. Glucosamine regulation of fibroblast growth factor 21 expression in liver and adipose tissues. Biochem Biophys Res Commun. 2020; 529 (3): 714–9. https://doi.org/10.1016/j.bbrc.2020.06.070.
27. Kong C.S., Kim J.A., Kim S.K. Anti-obesity effect of sulfated glucosamine by AMPK signal pathway in 3T3-L1 adipocytes. Food Chem Toxicol. 2009; 47 (10): 2401–6. https://doi.org/10.1016/j.fct.2009.06.010.
28. Barrientos C., Racotta R., Quevedo L. Glucosamine attenuates increases of intraabdominal fat, serum leptin levels, and insulin resistance induced by a high-fat diet in rats. Nutr Res. 2010; 30 (11): 791–800. https://doi.org/10.1016/j.nutres.2010.10.008.
29. Barrientos C., Pérez A., Vázquez J. Ameliorative effects of oral glucosamine on insulin resistance and pancreatic tissue damage in experimental Wistar rats on a high-fat diet. Comp Med. 2021; 71 (3): 215–21. https://doi.org/10.30802/AALAS-CM-21-000009.
30. Pessentheiner A.R., Ducasa G.M., Gordts P.L.S.M. Proteoglycans in obesity-associated metabolic dysfunction and meta-inflammation. Front Immunol. 2020; 11: 769. https://doi.org/10.3389/fimmu.2020.00769.
31. Melgar-Lesmes P., Garcia-Polite F., Del-Rey-Puech P., et al. Treatment with chondroitin sulfate to modulate inflammation and atherogenesis in obesity. Atherosclerosis. 2016; 245: 82–7. https://doi.org/10.1016/j.atherosclerosis.2015.12.016.
32. Stabler T.V., Montell E., Vergés J., et al. Chondroitin sulfate inhibits monocyte chemoattractant protein-1 release from 3T3-L1 adipocytes: a new treatment opportunity for obesity-related inflammation? Biomark Insights. 2017; 12: 1177271917726964. https://doi.org/10.1177/1177271917726964.
33. Li W., Kobayashi T., Moroi S., et al. Anti-obesity effects of chondroitin sulfate oligosaccharides from the skate Raja pulchra. Carbohydr Polym. 2019; 214: 303–10. https://doi.org/10.1016/j.carbpol.2019.03.025.
34. Huang L., Chen J., Cao P., et al. Anti-obese effect of glucosamine and chitosan oligosaccharide in high-fat diet-induced obese rats. Mar Drugs. 2015; 13 (5): 2732–56. https://doi.org/10.3390/md13052732.
35. Ferlito S., La Spina E., Fichera C., et al. Rapid changes in blood lipid parameters induced by glucuronyl glucosamine glycan sulfate in obese diabetic and hyperlipidemia patients. Arch Sci Med (Torino). 1982; 139 (4): 441–8.
36. Rondanelli M., Miraglia N., Putignano P., et al. Shortand long-term effectiveness of supplementation with non-animal chondroitin sulphate on inflammation, oxidative stress and functional status in obese subjects with moderate knee osteoarthritis before and after physical stress: a randomized, double-blind, placebo-controlled trial. Antioxidants (Basel). 2020; 9 (12): 1241. https://doi.org/10.3390/antiox9121241.
37. Громова О.А., Торшин И.Ю., Зайчик Б.Ц. и др. О различиях в стандартизации лекарственных препаратов на основе экстрактов хондроитина сульфата. ФАРМАКОЭКОНОМИКА. Современная фармакоэкономика и фармакоэпидемиология. 2021; 14 (1): 50–62. https://doi.org/10.17749/2070-4909/farmakoekonomika.2021.083.
38. Торшин И.Ю., Лила А.М., Громова О.А. Гепатопротекторные эффекты хондроитина сульфата и глюкозамина сульфата. ФАРМАКОЭКОНОМИКА. Современная фармакоэкономика и фармакоэпидемиология. 2021; 14 (4): 537–47. https://doi.org/10.17749/20704909/farmakoekonomika.2021.112.
39. Шарапова Е.П., Таскина Е.А., Кашеварова Н.Г. и др. Эффективность хондроитина сульфата у пациентов с остеоартритом коленных и тазобедренных суставов. Современная ревматология. 2021; 15 (4): 120–5. https://doi.org/10.14412/1996-7012-2021-4-120-125.
40. Шавловская О.А., Бокова И.А., Сарвилина И.В. и др. Хондроитина сульфат в терапии остеоартрита у пациентов с коморбидными сердечно-сосудистыми заболеваниями: артериальной гипертензией, атеросклерозом, ишемической болезнью сердца. Неврология, нейропсихиатрия, психосоматика. 2021; 13 (3): 113–8. https://doi.org/10.14412/2074-2711-2021-3-113-118.
41. Лила А.М., Ткачева О.Н., Наумов А.В. и др. Место и роль парентеральной формы хондроитина сульфата в терапии остеоартрита: мультидисциплинарный консенсус. Русский медицинский журнал. 2021; 29 (6): 68–74.
42. Торшин И.Ю., Лила А.М., Наумов А.В. и др. Метаанализ клинических исследований эффективности лечения остеоартита препаратом Хондрогард. ФАРМАКОЭКОНОМИКА. Современная фармакоэкономика и фармакоэпидемиология. 2020; 13 (4): 388–99. https://doi.org/10.17749/2070-4909/farmakoekonomika.2020.066.
43. Chisari E., Wouthuyzen-Bakker M., Friedrich A.W., Parvizi J. The relation between the gut microbiome and osteoarthritis: a systematic review of literature. PLoS One. 2021; 16 (12): e0261353. https://doi.org/10.1371/journal.pone.0261353.
44. Yu H., Yi X., Gao X., et al. Tilapia-head chondroitin sulfate protects against nonalcoholic fatty liver disease via modulating the gut-liver axis in high-fat-diet-fed C57BL/6 mice. Foods. 2022; 11 (7): 922. https://doi.org/10.3390/foods11070922.
45. Li S., Li J., Mao G., et al. Fucosylated chondroitin sulfate from Isostichopus badionotus alleviates metabolic syndromes and gut microbiota dysbiosis induced by high-fat and high-fructose diet. Int J Biol Macromol. 2019; 124: 377–88. https://doi.org/10.1016/j.ijbiomac.2018.11.167.
46. Hu S., Wang J., Xu Y., et al. Anti-inflammation effects of fucosylated chondroitin sulphate from Acaudina molpadioides by altering gut microbiota in obese mice. Food Funct. 2019; 10 (3): 1736–46. https://doi.org/10.1039/c8fo02364f.
47. Gromova O.A., Maiorova L.A., Salnikov D.S., et al. Vitamin B12 hydrophobic derivative exhibits bioactivity: biomedical and photophysical study. BioNanoSci. 2022; 12: 74–82.
48. Maiorova L.A., Erokhina S.I., Pisani M., et al. Encapsulation of vitamin B12 into nanoengineered capsules and soft matter nanosystems for targeted delivery. Colloids Surf B Biointerfaces. 2019; 182: 110366. https://doi.org/10.1016/j.colsurfb.2019.110366.
49. Gromova O.A., Torshin I.Yu., Maiorova L.A., et al. Bioinformatic and chemoneurocytological analysis of the pharmacological properties of vitamin B12 and some of its derivatives. J Porphyrins Phthalocyanines. 2021; 25 (9): 835–42. https://doi.org/10.1142/S1088424621500644.
Об авторах
И. Ю. ТоршинРоссия
Торшин Иван Юрьевич – кандидат физико-математических наук, кандидат химических наук, старший научный сотрудник Института фармакоинформатики; WoS ResearcherID: C-7683-2018; Scopus Author ID: 7003300274; РИНЦ SPIN-код: 1375-1114.
Ул. Вавилова, д. 44, корп. 2, Москва 119333
О. А. Громова
Россия
Громова Ольга Алексеевна – доктор медицинских наук, профессор, научный руководитель Института фармакоинформатики; WoS ResearcherID: J-4946-2017; Scopus Author ID: 7003589812; РИНЦ SPIN-код: 6317-9833.
Ул. Вавилова, д. 44, корп. 2, Москва 119333
А. М. Лила
Россия
Лила Александр Михайлович – доктор медицинских наук, профессор, директор НИИ ревматологии им. В.А. Насоновой, заведующий кафедрой ревматологии РМАНПО; WoS ResearcherID: W-3334-2017; Scopus Author ID: 6602550827; РИНЦ SPIN-код: 7287-8555.
Каширское ш., д. 34А, Москва 115522; Ул. Баррикадная, д. 2/1, стр. 1, Москва 125993
Рецензия
Для цитирования:
Торшин И.Ю., Громова О.А., Лила А.М. О перспективах применения хондроитина сульфата и глюкозамина сульфата в терапии пациентов с остеоартритом на фоне ожирения (метаболического синдрома). ФАРМАКОЭКОНОМИКА. Современная фармакоэкономика и фармакоэпидемиология. 2022;15(3):390-401. https://doi.org/10.17749/2070-4909/farmakoekonomika.2022.145
For citation:
Torshin I.Yu., Gromova О.A., Lila A.M. Prospects for the use of chondroitin sulfate and glucosamine sulfate in the treatment of patients with obesity-associated osteoarthritis (metabolic syndrome). FARMAKOEKONOMIKA. Modern Pharmacoeconomics and Pharmacoepidemiology. 2022;15(3):390-401. (In Russ.) https://doi.org/10.17749/2070-4909/farmakoekonomika.2022.145

Контент доступен под лицензией Creative Commons Attribution-NonCommercial-ShareAlike 4.0 International License.






































