Перейти к:
Эпигенетические аспекты реабилитации онкогинекологических больных
https://doi.org/10.17749/2070-4909/farmakoekonomika.2022.141
Аннотация
На сегодняшний день влияние эпигенетических процессов на развитие злокачественных заболеваний, включая онкогинекологические, не вызывает сомнений. Метилирование ДНК, модификация гистонов и посттранскрипционная регуляция при помощи микроРНК приводят к изменению активности различных генов, способствуя возникновению рака женских половых органов (шейки матки, эндометрия, яичников). Следует отметить, что нарушения в экспрессии генов появляются не только в злокачественных клетках, но и в микроокружении опухоли, обусловливая прогрессирование и рецидив заболевания. Однако «эпигенетические метки» канцерогенеза могут быть полезными в лечении и реабилитации пациенток, делая возможным применение персонифицированного подхода.
Ключевые слова
Для цитирования:
Солопова А.Г., Блинов Д.В., Демьянов С.В., Демьянов Г.В., Ачкасов Е.Е., Власина А.Ю., Санджиева Л.Н., Ампилогова Д.М. Эпигенетические аспекты реабилитации онкогинекологических больных. ФАРМАКОЭКОНОМИКА. Современная фармакоэкономика и фармакоэпидемиология. 2022;15(2):294-303. https://doi.org/10.17749/2070-4909/farmakoekonomika.2022.141
For citation:
Solopova A.G., Blinov D.V., Demyanov S.V., Demyanov G.V., Achkasov E.E., Vlasina A.Yu., Sandzhieva L.N., Ampilogova D.M. Epigenetic aspects in rehabilitation of female cancer patients. FARMAKOEKONOMIKA. Modern Pharmacoeconomics and Pharmacoepidemiology. 2022;15(2):294-303. (In Russ.) https://doi.org/10.17749/2070-4909/farmakoekonomika.2022.141
ВВЕДЕНИЕ / INTRODUCTION
В 2017 г. Всемирная организация здравоохранения выступила с инициативой «Реабилитация 2030», основной идеей которой было расширение доступности высококачественной реабилитации для пациентов, страдающих неинфекционными заболеваниями, прежде всего для онкологических больных [1]. Учитывая, что в ближайшие десятилетия ожидается увеличение числа людей, прошедших противоопухолевое лечение, восстановительные мероприятия будут иметь огромное значение не только в жизни таких пациентов, но и в экономике стран, обеспечивая две важнейшие функции: улучшение качества жизни и снижение риска рецидива. Однако современная медицина не использует весь потенциал реабилитации. Возможно, это связано с недостаточным пониманием механизмов, заложенных в основе восстановительных процедур [1–3].
Множество процессов в организме человека объясняется влиянием генома. Предполагалось, что успехи в секвенировании генома человека откроют перспективы к персонализированному лечению и реабилитации, т.е. стратегиям ведения больного, специально разрабатывающимся для уникального генотипа каждого пациента. Однако проявились и недостатки такого подхода, поскольку ДНК различных людей по всему миру схожа между собой на 99,9%, но специфичность физиологии каждого конкретного индивидуума очевидна: хотя генетическое наследование человека фиксировано, на биологическую активность его генома через эпигеном может влиять все, что он испытал ранее, – от детского стресса и образования до социальных привычек и образа жизни [4].
В связи с этим эпигенетика, которая изучает механизмы, изменяющие активность генов, но при этом не затрагивающие саму последовательность нуклеотидов в ДНК и, соответственно, определяющие разнообразие протекания одних и тех же процессов у отдельных организмов, может быть ключом как к обоснованию восстановительных мероприятий, так и к изобилию ответных реакций пациентов на них. Следует разобраться, каким образом эпигенетические процессы влияют на канцерогенез и реабилитацию онкобольных, в частности пациенток с гинекологическими раковыми заболеваниями.
ЭПИГЕНЕТИЧЕСКИЕ ОСНОВЫ ОНКОГИНЕКОЛОГИИ / EPIGENETIC BASICS OF ONCOGYNECOLOGY
Полученные в последние годы результаты научных исследований в области эпигенетики обогатили понимание социальных, экологических и организационных факторов здоровья человека, что еще больше укрепляет ценность концепции популяционного здоровья в клинической практике, программах общественного здравоохранения и социальной политике [5].
Известно, что нарушения эпигенетических механизмов оказывают значительное влияние на развитие злокачественных опухолей женской половой системы [6]. Такие дисфункции передаются по наследству, но до конца не известна причина их возникновения. Постоянно открываются их новые разновидности, и с каждым годом научный мир становится ближе к пониманию связи между геномом человека и канцерогенезом. Так, недавно созданные организации Международный консорциум эпигенома человека (англ. International Human Epigenome Consortium, IHEC) и Международный консорциум генома рака (англ. International Cancer Genome Consortium, ICGC) будут поддерживать дальнейшие исследования, демонстрирующие влияние эпигенома на развитие онкогинекологических заболеваний [7].
В эпигенетической системе выделяют три звена, сбои в которых приводят к злокачественным опухолям у женщин. Сюда можно отнести: метилирование ДНК, модификацию гистонов и воздействие микроРНК [8][9]. Самым изученным из этих процессов является метилирование ДНК, при котором специальный фермент ДНК-метилтрансфераза (DNMT) присоединяет метильную группу (-CH3) к цитозину в составе CpG-динуклеотидов, где C – цитозин, G – гуанин, а p – фосфодиэфирная связь, соединяющая два нуклеотида. CpG обнаруживаются в геноме в основном в виде кластеров, объединений, известных как CpG-острова (англ. CpGIslands, CpGIs), которые в большинстве случаев перекрываются с промоторами и таким образом могут влиять на экспрессию различных генов [6][10]. Как правило, при метилировании CpG-островов происходит подавление активности гена, т.к. факторы транскрипции не могут связаться с измененным промотором. Многие злокачественные гинекологические опухоли, особенно рак яичников, демонстрируют гиперметилирование CpG-островов, приводя к инактивации множества генов. Снижение экспрессии генов – супрессоров опухолей (BRCA1, p16, MLH1, OPCML, RASSF1A), проапоптотических генов (LOT1, DAPK), генов клеточной адгезии (ICAM-1, CDH1 (кодирующий E-кадгерин)) и многих других обусловливает образование и рост опухоли. При этом было установлено, что уровень метилирования увеличивается на более поздних стадиях рака. Такие опухоли обозначают как CIMP-положительные (англ. CpGIsland methylator phenotype – фенотип, ассоциированный с метилированным CpG-островом) [11].
Помимо метилирования ДНК в клетках существует и противоположный эффект – деметилирование CpG, осуществляемое при помощи семейства ферментов, именуемого TET (англ. ten-eleven translocation) [6][12]. При многих онкогинекологических заболеваниях наблюдается снижение как экспрессии, так и ферментативной активности TET, что ведет к недостаточному деметилированию CpG-островов, а соответственно, к их чрезмерному метилированию. Однако при раке яичников можно заметить, наоборот, и сверхэкспрессию TET, в основном TET3, что способствует пробуждению определенных генов, которые активируются при избыточном гипометилировании промотора. Чаще всего они являются онкогенами. Таким образом, при раке яичников включаются гены SNCG (кодирующий гамма-синуклеин), CLDN4 (кодирующий клаудин 4) и BORIS [11].
Еще одним эпигенетическим механизмом является модификация гистонов – белков, которые, связываясь с ДНК, участвуют в ее упаковке в ядре. К основным изменениям, которым подвергаются аминокислоты гистонов, можно отнести: ацетилирование, метилирование и фосфорилирование. Наиболее изученным является процесс ацетилирования [8][13]. Под действием фермента ацетилтрансферазы гистонов (HAT) происходит ацетилирование лизина гистона H3, меняющее положительный заряд аминокислоты на нейтральный, что делает невозможной связь такого лизина с отрицательно заряженными фосфатными группами ДНК. В результате участок ДНК освобождается от гистона, и на него могут сесть различные транскрипционные факторы, регулирующие экспрессию тех или иных генов. Поэтому HAT обычно рассматривают как транскрипционные коактиваторы, а ферменты деацетилазы гистонов (HDAC), которые, наоборот, осуществляют деацетилирование, считают транскрипционными корепрессорами, приводящими к конденсации хроматина. При онкогинекологических заболеваниях происходит дисрегуляция процессов модификации гистонов. Нарушенные ацетилирование и метилирование способствуют «закрытию» различных генов-супрессоров опухолей и «открытию» генов лекарственной устойчивости. Так, при опухолях яичников значительно повышен уровень фермента HDAC, который коррелирует с устойчивостью к платинотерапии, применяющейся в лечении гинекологических раковых заболеваний, и прогнозирует низкую выживаемость пациенток [6].
Еще одним эпигенетическим механизмом, который следует рассмотреть, является воздействие микроРНК на мРНК. МикроРНК (англ. miR) представляют собой небольшие двухцепочечные молекулы РНК длиной 18–25 нуклеотидов, которые, связываясь с особой нетранслируемой областью (англ. untranslated region, UTR) на мРНК, подавляют синтез белка с этой молекулы. Иногда микроРНК, соединяясь с мРНК, способствует ее полному уничтожению за счет специального комплекса RISC. При раке яичников были описаны увеличение количества одних микроРНК и снижение других. Например, повышение miR-214 обусловливает резистентность опухоли к платинотерапии, а miR-let-7i, наоборот, усиливает чувствительность злокачественных клеток к препаратам [11].
ЭПИГЕНЕТИКА И МИКРООКРУЖЕНИЕ ОПУХОЛИ / EPIGENETICS AND TUMOR MICROENVIRONMENT
Далеко не всегда нужно искать причину канцерогенеза в самих атипичных клетках. Относительно недавно ученые заинтересовались изменениями, возникающими в микроокружении опухоли (англ. tumor microenvironment, TME), в состав которого входят фибробласты, адипоциты, лейкоциты, а также факторы роста, стероиды, цитокины. При этом TME заметно влияет на сами злокачественные клетки.
Так, было показано, что производные платины индуцируют секрецию интерлейкина-6 (ИЛ-6) фибробластами TME. Интерлейкин, воздействуя на оставшиеся после лечения атипичные клетки, приводит к синтезу в них определенных ферментов, в частности DNMT, которые вновь запускают рост новообразования. Стратегии, нацеленные на ИЛ-6 вместе с ингибиторами DNMT, полностью уничтожали оставшуюся после платинотерапии опухолевую ткань и предотвращали рецидив рака [8][14].
Лейкоциты, окружающие новообразование, также взаимосвязаны с атипичными клетками. Например, при раке эндометрия можно наблюдать повышенное количество макрофагов в TME, что коррелирует с агрессивностью опухоли. Считается, что макрофаги производят ИЛ-17А, который путем нарушения метилирования ДНК приводит к повышенному синтезу эстрогеновых рецепторов, обусловливая гиперпролиферацию клеток эндометрия.
СВЯЗЬ ЭПИГЕНЕТИКИ И РЕАБИЛИТАЦИИ / THE RELATIONSHIP BETWEEN EPIGENETICS AND REHABILITATION
Ранняя постановка диагноза / Early diagnosis
Так как же накопленные знания об этих эпигенетических процессах могут помочь в реабилитации пациенток после проведенного комплекса основных лечебных мероприятий?
Следует начать с того, что уже сама ранняя постановка диагноза злокачественной опухоли увеличивает шанс на полное излечение и восстановление утраченных функций, уменьшает вероятность метастазирования и рецидива, т.е. повышает выживаемость пациенток. Например, при раке яичников, который имеет самый высокий уровень смертности среди онкологических заболеваний репродуктивных органов у женщин, 5-летняя выживаемость составляет всего 30%, если опухоль была диагностирована на поздней стадии, в отличие от 90% для больных на ранней стадии, когда патология еще не вышла за пределы яичника [11]. Однако ранние стадии протекают бессимптомно, поэтому скрининг женщин на определенные онкомаркеры считается приемлемым выходом из такой ситуации.
Наиболее хорошо изученным и давно используемым онкомаркером рака яичников является гликопротеин CA-125, но его уровень также повышается при многих доброкачественных состояниях, включая эндометриоз, миому матки, некоторые воспалительные заболевания. В дополнение к этому он чрезмерно экспрессируется лишь в 80% случаев данной опухоли [7]. Перечисленные недостатки требуют изыскания более специфичного маркера.
Идеальным кандидатом на эту роль следует рассмотреть гиперметилированную при опухолях ДНК. Несмотря на незначительное присутствие в крови, она все равно может быть обнаружена в сыворотке, плазме, а также в перитонеальной жидкости. Хотя оценка отдельных метилированных генов – супрессоров опухолей не обладает достаточной специфичностью, панель из нескольких таких маркеров имеет уже большое значение. Так, специфическое для рака яичников метилирование по крайней мере одного из шести генов – супрессоров опухолей (BRCA1, RASSF1A, APC, p14arf, p16ink4a и DAPK) всегда может быть обнаружено в крови больных с данной опухолью со специфичностью 100% и чувствительностью 82% [15][16].
Помимо данных генов, существуют многие другие, которые могут помочь в ранней диагностике заболевания, а соответственно, привести к меньшему по продолжительности и более эффективному реабилитационному периоду. Эта панель со временем будет постепенно расширяться.
Персонализация системной терапии / Personalization of systemic therapy
Существуют эпигенетические маркеры, не только показывающие наличие опухоли в организме, но и демонстрирующие устойчивость рака к различным препаратам, а также определяющие выживаемость пациента. В научной литературе описано множество генов, при модификации которых опухоль не реагирует на лечение. Примечательно, что многие больные изначально отвечают на химиотерапию, но у большинства спустя некоторое время развивается лекарственная резистентность. Причины такого явления до конца не понятны. Исследователи склоняются к тому, что после начала лечения нарушается процесс модификации гистонов, который приводит к формированию у опухоли свойств, близких к свойствам стволовых клеток, что позволяет новообразованию быстро адаптироваться к неблагоприятным факторам [6].
Итак, какие же маркеры устойчивости можно выделить? Одним из хорошо задокументированных примеров является «глушение» гена MLH1 посредством метилирования. Данный ген участвует в апоптозе клеток, соответственно, при его инактивации снижается степень апоптоза. Однако именно апоптоз опухолевых клеток является конечной целью многих химиотерапевтических препаратов. Таким образом, метилирование гена MLH1 приводит к устойчивости опухоли к платинотерапии, поскольку данная терапия уже не может запустить запрограммированную клеточную гибель [7][17]. Такая же неуязвимость развивается и при метилировании гена ASS1. Метилирование гена TUBB3 было связано с резистентностью к таксанам, еще одному виду препаратов, применяемых в онкогинекологии. Однако некоторые гены активируются в результате гипометилирования – например, при недостаточном метилировании ДНК повышается синтез белка MAL (миелин и лимфоцитарный белок), что также приводит к платинорезистентности [15].
Учитывая подобные маркеры, можно начать лечение с того лекарственного средства первой линии, которое с наибольшей вероятностью поможет пациенту (персонализированное лечение), тем самым помогая предотвращению прогрессирования и рецидива опухоли, что является одним из компонентов реабилитации онкобольных. Помимо этого, контроль таких маркеров позволяет вовремя сменить терапию, когда она становится неэффективной.
Объективная оценка риска рецидива / Objective assessment of the risk of relapse
Разрабатываются также панели маркеров, отражающие выживаемость и риск развития рецидива у пациента. Например, метилирование хотя бы одного из трех генов (SFRP1, SFRP2 и SOX1) увеличивает риск рецидива и уровень смертности от рака яичников в 2 раза, а метилирование нескольких таких генов повышает смертность уже в 6 раз. Метилирование генов HOXA11, FBXO32, CYP39A1, снижение соотношения miR-221 к miR-222 также определяют плохой прогноз и рецидивирование опухоли [15][18].
Некоторые маркеры могут демонстрировать и риск метастазирования рака. К ним относятся метилированный DAPK, LAMA3 и высокий уровень метилтрансферазы гистонов G9a. К примеру, при метилировании гена LAMA3 понижается синтез его продукта – ламинина, что приводит к нарушению формирования базальной мембраны, и, соответственно, к инвазии и метастазированию опухолевых клеток [19].
Таким образом, узнав о плохом прогнозе, высоком риске рецидива и метастазирования опухоли с помощью эпигенетических маркеров, можно усилить интенсивность терапии в реабилитационном периоде для повышения продолжительности жизни пациента.
Вклад в диетотерапию и нутрициальную поддержку / Contribution to diet therapy and nutritional support
Следует отметить, что на эпигенетические процессы влияет большое количество различных стимулов, которые можно разделить на внутренние факторы, такие как мутации, нейроэндокринный баланс, функционирование метаболических путей, и внешние факторы в виде лекарственных средств, инфекционных микроорганизмов, стресса и даже питательных веществ (рис. 1).
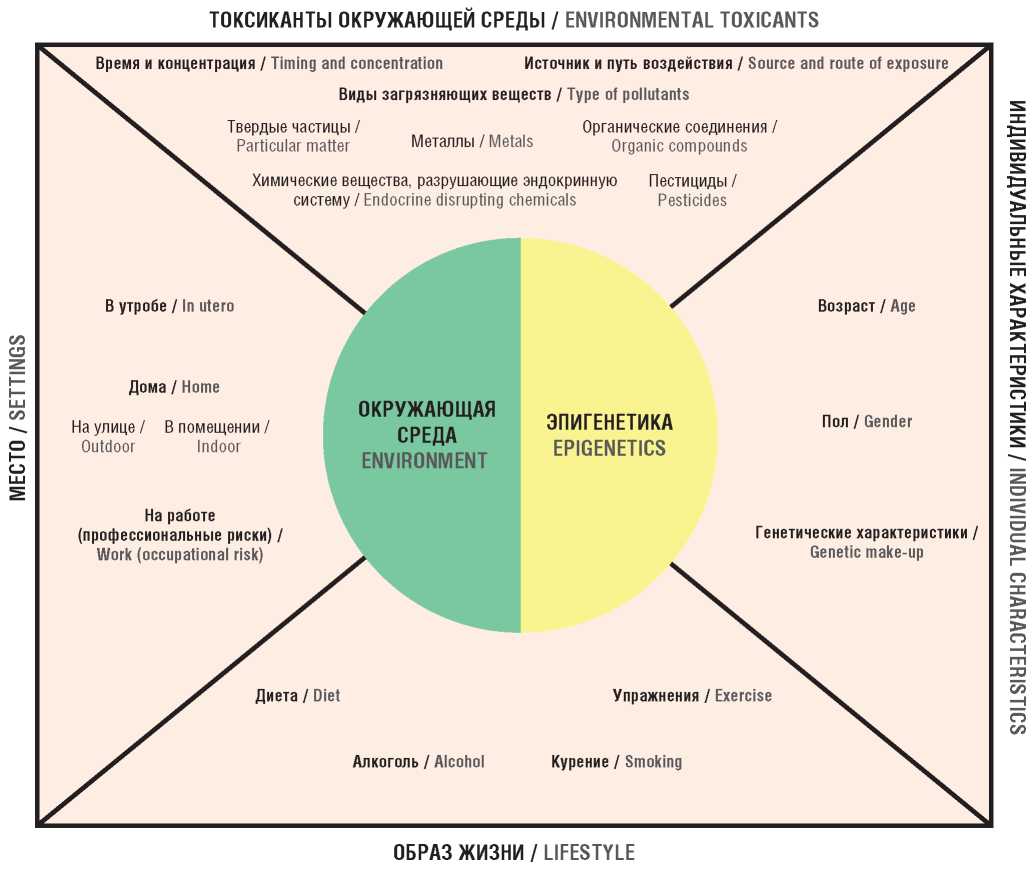
Рисунок 1. Взаимодействия между окружающей средой и эпигенетикой (адаптировано из [20])
Figure 1. Environment-epigenetics interactions (adapted from [20])
В последнее время появляется все больше исследований, посвященных тому, как питание человека связано с его геномом [20][21]. Возникли даже специальные науки – нутригенетика и нутригеномика. Первая дисциплина изучает генетическую основу того, почему люди по-разному реагируют на одинаковые питательные вещества, а вторая, наоборот, исследует действие нутриентов на активацию тех или иных генов. Поэтому уже сейчас ученые и врачи стараются разрабатывать персонализированные диеты, где помимо учета перенесенных заболеваний, образа жизни, вкусовых предпочтений обязательно исследуется ДНК больного, чтобы определить гены, которые требуют повышенного или пониженного поступления конкретных нутриентов. Как следствие, подбирается оптимальный состав питательных веществ, который не навредит пациенту и улучшит исход его заболевания [21].
Учитывая несомненное преимущество подобных персонализированных диет над обычными, их использование в реабилитации, в частности онкогинекологических больных, было бы прорывом в медицине, причем основанным на таком относительно недорогом и вместе с тем эффективном средстве лечения, как питание. Так, эпигенетические процессы, которые, как уже было сказано выше, играют важную роль в возникновении, рецидивировании опухоли, ее устойчивости к химиотерапии, можно с легкостью изменять при помощи питательных веществ (нутриэпигеномика) – нужно только предварительно понять, какое звено эпигенетической системы нарушено.
Самыми активными в этом плане веществами являются полифенолы, входящие в состав чая, кофе, многих овощей и фруктов [22][23]. Например, куркумин понижает гиперметилирование ДНК за счет ингибирования DNMT, также он воздействует на модификацию гистонов, блокируя HAT и синтез HDAC. Деметилирующим потенциалом обладают и генистеин из соевых бобов, и полифенолы кофе и чая. Исследования показали, что азиатские женщины, потребляющие постоянно сою, а вместе с ней и генистеин, в силу особенностей национальной кухни подвержены в 5 раз более низкому риску развития рака молочной железы, чем кавказские женщины, нерегулярно потребляющие сою. Сульфорафан, содержащийся в брокколи, ингибирует HDAC, что приводит к реактивации заглушенных генов – супрессоров опухолей, которые начинают запускать апоптоз злокачественных клеток [22]. Некоторые полифенолы оказывают свое действие через регуляцию синтеза микроРНК.
Однако есть и другие питательные вещества, влияющие на эпигенетические процессы. Витамины группы B (биотин, никотиновая, пантотеновая и фолиевая кислоты) и селен проявляют свою противоопухолевую активность путем модификации гистонов. Также фолат и метилкобаламин могут быть донорами метильных групп, приводя к инактивации онкогенов, включившихся в результате гипометилирования ДНК.
Таким образом, исследовав эпигенетические метки и выбрав из множества питательных веществ подходящие, можно создать специальную лечебную диету для каждой пациентки в дополнение к основной терапии опухоли и противорецидивным реабилитационным мероприятиям [22][24][25].
Физическая активность и лечебная физкультура / Physical activity and physiotherapy exercises
Физические упражнения, как и питание, значительно влияют на развитие опухоли. Было показано, что регулярная физическая нагрузка предотвращает по меньшей мере семь видов рака, в т.ч. рак молочной железы, эндометрия, яичников, увеличивает выживаемость больных с диагнозом злокачественной опухоли и не дает ей рецидивировать [26][27]. Помимо этого, упражнения повышают качество жизни пациенток после операции, снимая усталость, беспокойство и депрессивные симптомы, которые очень часто недооцениваются врачами, а также устраняют некоторые побочныеэффекты от химиотерапии.
Противоопухолевое действие физической нагрузки обусловлено ее влиянием на эпигенетические механизмы [1][28]. В частности, физическая активность вызывает ряд потенциальных физиологических последствий эпигенетической модификации. Так, эпигенетическими механизмами (изменение экспрессии митохондриальной РНК в гранулоцитах, мононуклеарных клетках периферической крови и т.п.) опосредуется связь между физической активностью, снижением уровня провоспалительных цитокинов и повышением уровня противовоспалительных [29].
Интересно, что одни трансформации происходят сразу после начала тренировки (например, деметилирование, а следовательно, и активация гена PPAR-γ, продукт которого может быть ответственен за ингибирование роста раковых клеток), а другие – лишь через 3 ч после упражнений (например, деметилирование гена PPAR-δ, роль которого в развитии рака еще не выяснена) [28][30].
Также постоянная физическая нагрузка повышает метилирование гена, ответственного за синтез белка ASC, что приводит к снижению его образования. ASC выполняет важную функцию в развитии воспаления и апоптоза, и при его дефиците наблюдается уменьшение количества интерлейкинов и фактора некроза опухоли, что также может предотвратить канцерогенез. Физическая активность даже обусловливает функционирование иммунных клеток (например, повышая реактивность T-клеток через микроРНК) и влияет на деятельность головного мозга благодаря выходу миокинов из миоцитов и синтезу нейротрофического фактора мозга (BDNF) в центральной нервной системе во время мышечных сокращений. Миокины и BDNF положительно влияют на процессы в нервной системе, что способствует устранению усталости, тревожных и депрессивных состояний, улучшению качества сна [30][31].
Противодействие стрессу, боли и психологическая реабилитация / Stress, pain management and psychological rehabilitation
Не менее важны и другие методы реабилитации онкологических больных [32][33]. Причем все больше научных работ связывают их пользу с влиянием на эпигенетические процессы. Например, полноценный сон оказывает положительное всестороннее воздействие на организм человека. В частности, мелатонин, который тесно связан с циркадными ритмами и вырабатывается в темное время суток, проявляет выраженную противоопухолевую активность, тормозя пролиферацию злокачественных клеток и ангиогенез. На животных моделях и клеточных линиях рака молочной железы было показано, что мелатонин изменяет уровень метилирования ДНК и микроРНК, приводя к онкостатическому эффекту [34]. Поэтому женщинам, перенесшим лечение по поводу онкогинекологического заболевания, необходимо соблюдать оптимальный режим сна и бодрствования, особенно важен ночной покой.
Еще одним реабилитационным мероприятием можно назвать акупунктуру. Недавние исследования продемонстрировали влияние иглоукалывания на все эпигенетические процессы. Так, данная процедура повышает уровень метилирования ДНК, сниженный в префронтальной коре у людей, страдающих невропатической болью [35][36]. Хроническая боль сама по себе негативно влияет на множество аспектов здоровья пациентов, включая сон, когнитивные функции, настроение, психическое здоровье, нарушения со стороны сердечно-сосудистой системы, расстройство сексуальной функции, что негативно сказывается на общем качестве жизни [37–39]. А именно гипометилированная ДНК в этой зоне мозга, по мнению ученых, может быть связана с подобным недугом. Следует отметить, что после оперативного вмешательства, призванного устранить пораженный опухолью орган, например после гистерэктомии, часто возникает невропатическая боль, что делает акупунктуру полезной процедурой в руках реабилитолога [39–41].
Постоянно увеличивается массив научных данных, согласно которым такие социально неблагоприятные факторы, как социальная изоляция, дискриминация или низкий социальный статус, испытываемые как в раннем возрасте, так и во взрослой жизни, на молекулярном уровне могут начать оказывать неблагоприятное влияние на здоровье человека [42][43]. Стресс и негативные эмоции, которые испытывают онкобольные, также изменяют метилирование различных генов. В связи с этим применение релаксационных методик или психологической помощи (индивидуальная и групповая психотерапия) в послеоперационном периоде является неотъемлемым компонентом реабилитации, который с каждым годом все больше подтверждает свою научно обоснованную пользу [44][45].
ЗАКЛЮЧЕНИЕ / CONCLUSION
Дисрегуляция эпигенетических процессов играет важную роль в развитии онкогинекологических заболеваний. Однако благодаря деятельности ученых медицина смогла извлечь колоссальную пользу из данных о нарушенных механизмах эпигенетики, возникающих не только в самих атипичных клетках, но и в микроокружении опухоли. Стала возможна разработка персонализированной и тем самым более эффективной реабилитационной программы с определенными процедурами индивидуальной продолжительности и интенсивности.
Таким образом, эпигенетические процессы наряду с другими факторами, такими как социально-демографические (возраст, раса и пр.) и клинические (начало заболевания, коморбидность и пр.), безусловно, влияют на назначение и результат реабилитации пациенток с онкогинекологическими заболеваниями. Модуляция эпигенетических процессов положительно сказывается на реабилитации женщин с опухолями репродуктивной системы.
Список литературы
1. Stout N.L., Santa Mina D., Lyons K.D., et al. A systematic review of rehabilitation and exercise recommendations in oncology guidelines. CA Cancer J Clin. 2021; 71 (2): 149–75. https://doi.org/10.3322/caac.21639.
2. Kline R.M., Arora N.K., Bradley C.J., et al. Long-term survivorship care after cancer treatment – summary of a 2017 National Cancer Policy Forum Workshop. J Natl Cancer Inst. 2018; 110 (12): 1300–10. https://doi.org/10.1093/jnci/djy176.
3. Санджиева Л.Н., Солопова А.Г., Блинов Д.В. и др. Персонифицированная программа комплексной реабилитации после хирургического лечения рака эндометрия: результаты проспективного рандомизированного сравнительного исследования. Акушерство, гинекология и репродукция. 2021; 16 (2): 143–57. https://doi.org/10.17749/2313-7347/ob.gyn.rep.2022.318.
4. Shields R.K. Precision rehabilitation: how lifelong healthy behaviors modulate biology, determine health, and affect populations. Phys Ther. 2022; 102 (1): pzab248. https://doi.org/10.1093/ptj/pzab248.
5. Magnusson D.M., Rethorn Z.D. Strengthening population health perspectives in physical therapist practice using epigenetics. Phys Ther. 2022; 102 (1): pzab244. https://doi.org/10.1093/ptj/pzab244.
6. Kumar R., Paul A.M., Rameshwar P., Pillai M.R. Epigenetic dysregulation at the crossroad of women's cancer. Cancers (Basel). 2019; 11 (8): 1193. https://doi.org/10.3390/cancers11081193.
7. Gloss B.S., Samimi G. Epigenetic biomarkers in epithelial ovarian cancer. Cancer Lett. 2014; 342 (2): 257–63. https://doi.org/10.1016/j.canlet.2011.12.036.
8. Matei D., Nephew K.P. Epigenetic attire in ovarian cancer: the emperor's new clothes. Cancer Res. 2020; 80 (18): 3775–85. https://doi.org/10.1158/0008-5472.CAN-19-3837.
9. Natanzon Y., Goode E.L., Cunningham J.M. Epigenetics in ovarian cancer. Semin Cancer Biol. 2018; 51: 160–9. https://doi.org/10.1016/j.semcancer.2017.08.003.
10. Kumar R., Deivendran S., Santhoshkumar T.R., Pillai M.R. Signaling coupled epigenomic regulation of gene expression. Oncogene. 2017; 36 (43): 5917–26. https://doi.org/10.1038/onc.2017.201.
11. Asadollahi R., Hyde C.A., Zhong X.Y. Epigenetics of ovarian cancer: from the lab to the clinic. Gynecol Oncol. 2010; 118 (1): 81–7. https://doi.org/10.1016/j.ygyno.2010.03.015.
12. Torre L.A., Trabert B., DeSantis C.E., et al. Ovarian cancer statistics, 2018. CA Cancer J Clin. 2018; 68 (4): 284–96. https://doi.org/10.3322/caac.21456.
13. Yang Q., Yang Y., Zhou N., et al. Epigenetics in ovarian cancer: premise, properties, and perspectives. Mol Cancer. 2018; 17 (1): 109. https://doi.org/10.1186/s12943-018-0855-4.
14. Gomez S., Tabernacki T., Kobyra J., et al. Combining epigenetic and immune therapy to overcome cancer resistance. Semin Cancer Biol. 2020; 65: 99–113. https://doi.org/10.1016/j.semcancer.2019.12.019.
15. Seeber L.M., van Diest P.J. Epigenetics in ovarian cancer. Methods Mol Biol. 2012; 863: 253–69. https://doi.org/10.1007/978-1-61779-612-8_15.
16. Kroeger P.T. Jr., Drapkin R. Pathogenesis and heterogeneity of ovarian cancer. Curr Opin Obstet Gynecol. 2017; 29 (1): 26–34. https://doi.org/10.1097/GCO.0000000000000340.
17. Kondrashova O., Topp M., Nesic K., et al. Methylation of all BRCA1 copies predicts response to the PARP inhibitor rucaparib in ovarian carcinoma. Nat Commun. 2018; 9 (1): 3970. https://doi.org/10.1038/s41467-018-05564-z.
18. Papp E., Hallberg D., Konecny G.E., et al. Integrated genomic, epigenomic, and expression analyses of ovarian cancer cell lines. Cell Rep. 2018; 25 (9): 2617–33. https://doi.org/10.1016/j.celrep.2018.10.096.
19. Feng L.Y., Huang Y.Z., Zhang W., Li L. LAMA3 DNA methylation and transcriptome changes associated with chemotherapy resistance in ovarian cancer. J Ovarian Res. 2021; 14 (1): 67. https://doi.org/10.1186/s13048-021-00807-y.
20. Alegría-Torres J.A., Baccarelli A., Bollati V. Epigenetics and lifestyle. Epigenomics. 2011; 3 (3): 267–77. https://doi.org/10.2217/epi.11.22.
21. Vesnina A., Prosekov A., Kozlova O., Atuchin V. Genes and eating preferences, their roles in personalized nutrition. Genes (Basel). 2020; 11 (4): 357. https://doi.org/10.3390/genes11040357.
22. Remely M., Lovrecic L., de la Garza A.L., et al. Therapeutic perspectives of epigenetically active nutrients. Br J Pharmacol. 2015; 172 (11): 2756–68. https://doi.org/10.1111/bph.12854.
23. Bush C.L., Blumberg J.B., El-Sohemy A., et al. Toward the definition of personalized nutrition: a proposal by the american nutrition association. J Am Coll Nutr. 2020; 39 (1): 5–15. https://doi.org/10.1080/07315724.2019.1685332.
24. Diószegi J., Llanaj E., Ádány R. Genetic background of taste perception, taste preferences, and its nutritional implications: a systematic review. Front Genet. 2019; 10: 1272. https://doi.org/10.3389/fgene.2019.01272.
25. Солопова А.Г., Власина А.Ю., Сон Е.А. и др. Адъювантная терапия постовариоэктомического синдрома в реабилитации больных пограничными опухолями яичников: роль «противораковой» диеты. Акушерство, гинекология и репродукция. 2020; 14 (3): 296–313. https://doi.org/10.17749/2313-7347/ob.gyn.rep.2020.146.
26. Schmitz K.H., Campbell A.M., Stuiver M.M., et al. Exercise is medicine in oncology: engaging clinicians to help patients move through cancer. CA Cancer J Clin. 2019; 69 (6): 468–84. https://doi.org/10.3322/caac.21579.
27. Cormie P., Atkinson M., Bucci L., et al. Clinical Oncology Society of Australia position statement on exercise in cancer care. Med J Aust. 2018; 209 (4): 184–7. https://doi.org/10.5694/mja18.00199.
28. Soci U.P., Melo S.F., Gomes J.L., et al. Exercise training and epigenetic regulation: multilevel modification and regulation of gene expression. Adv Exp Med Biol. 2017; 1000: 281–322. https://doi.org/10.1007/978-981-10-4304-8_16.
29. Ferioli M., Zauli G., Maiorano P., et al. Role of physical exercise in the regulation of epigenetic mechanisms in inflammation, cancer, neurodegenerative diseases, and aging process. J Cell Physiol. 2019; 234 (9): 14852–64. https://doi.org/10.1002/jcp.28304.
30. Sharma D., Ganai J., Khan S.A. Potential role of physical therapy in the field of genetic and cellular rehabilitation: a review of literature. Int J Health Sci Res. 2019; 9 (2): 267–77.
31. Campbell K.L., Winters-Stone K.M., Wiskemann J., et al. Exercise guidelines for cancer survivors: consensus statement from International Multidisciplinary Roundtable. Med Sci Sports Exerc. 2019; 51 (11): 2375–90. https://doi.org/10.1249/MSS.0000000000002116.
32. Блбулян Т.А., Солопова А.Г., Иванов А.Е., Куркина Е.И. Влияние послеоперационной реабилитации на качество жизни больных раком вульвы. Акушерство, гинекология и репродукция. 2020; 14 (4): 415–25. https://doi.org/10.17749/2313-7347/ob.gyn.rep.2020.156.
33. Власина А.Ю., Солопова А.Г., Сон Е.А. и др. Психоэмоциональное благополучие и сексуальная функция больных пограничными опухолями яичников. Акушерство, гинекология и репродукция. 2020; 14 (5): 551–67. https://doi.org/10.17749/2313-7347/ob.gyn.rep.2020.147.
34. Hardeland R. Melatonin, noncoding RNAs, messenger RNA stability and epigenetics – evidence, hints, gaps and perspectives. Int J Mol Sci. 2014; 15 (10): 18221–52. https://doi.org/10.3390/ijms151018221.
35. Jang J.H., Song E.M., Do Y.H., et al. Acupuncture alleviates chronic pain and comorbid conditions in a mouse model of neuropathic pain: the involvement of DNA methylation in the prefrontal cortex. Pain. 2021; 162 (2): 514–30. https://doi.org/10.1097/j.pain.0000000000002031.
36. Bilbao A., Falfán-Melgoza C., Leixner S., et al. Longitudinal structural and functional brain network alterations in a mouse model of neuropathic pain. Neuroscience. 2018; 387: 104–15. https://doi.org/10.1016/j.neuroscience.2018.04.020.
37. Fine P.G. Long-term consequences of chronic pain: mounting evidence for pain as a neurological disease and parallels with other chronic disease states. Pain Med. 2011; 12 (7): 996–1004. https://doi.org/10.1111/j.1526-4637.2011.01187.x.
38. Янушевич О.О., Рабинович С.А. Неврология лица: пароксизмальные невралгии (вклад профессора В.А. Карлова). Эпилепсия и пароксизмальные состояния. 2021; 13 (1S): 17–20. https://doi.org/10.17749/2077-8333/epi.par.con.2021.073.
39. Солопова А.Г., Блинов Д.В., Бегович Ё. и др. Неврологические расстройства после гистерэктомии: от патогенеза к клинике. Эпилепсия и пароксизмальные состояния. 2022; 14 (1): 54–64. https://doi.org/10.17749/2077-8333/epi.par.con.2022.115.
40. Hong H., Jing X.Y., Liu S.B., et al. Epigenetic landscape changes due to acupuncture treatment: from clinical to basic research. Chin J Integr Med. 2020; 26 (8): 633–40. https://doi.org/10.1007/s11655-020-2852-x.
41. Sun J., Li R., Li X., et al. Electroacupuncture therapy for change of pain in classical trigeminal neuralgia. Medicine (Baltimore). 2020; 99(16): e19710. https://doi.org/10.1097/MD.0000000000019710.
42. Snyder-Mackler N., Snyder-Mackler L. Holistic rehabilitation: biological embedding of social adversity and its health implications. Phys Ther. 2022; 102 (1): pzab245. https://doi.org/10.1093/ptj/pzab245.
43. Блинов Д.В., Акарачкова Е.С., Ампилогова Д.М. и др. Депрессия у женщин в менопаузе: организация междисциплинарного подхода в лечении и перспективы реабилитации. Акушерство, гинекология и репродукция. 2021; 15 (6): 738–54. https://doi.org/10.17749/2313-7347/ob.gyn.rep.2021.280.
44. Rider J.V. Regenerative rehabilitation and genomics: implications for occupational therapy. Open J Occup Ther. 2021; 9 (2): 1–8. https://doi.org/10.15453/2168-6408.1785.
45. Ramos-Lopez O., Milagro F.I., Riezu-Boj J.I., Martinez J.A. Epigenetic signatures underlying inflammation: an interplay of nutrition, physical activity, metabolic diseases, and environmental factors for personalized nutrition. Inflamm Res. 2021; 70 (1): 29–49. https://doi.org/10.1007/s00011-020-01425-y.
46. Власина А.Ю., Идрисова Л.Э., Солопова А.Г. и др. Реабилитация онкогинекологических больных после противоопухолевой терапии: пути решения. Акушерство, гинекология и репродукция. 2020; 14 (1): 44–55. https://doi.org/10.17749/2313-7347.2020.14.1.44-55.
Об авторах
А. Г. СолоповаРоссия
Солопова Антонина Григорьевна – д.м.н., профессор кафедры акушерства и гинекологии Клинического института детского здоровья им. Н.Ф. Филатова. WoS ResearcherID: Q-1385-2015; Scopus Author ID: 6505479504; РИНЦ SPIN-код: 5278-0465
ул. Трубецкая, д. 8/2, Москва 119048
Д. В. Блинов
Россия
Блинов Дмитрий Владиславович – к.м.н., руководитель по научным и медицинским вопросам; врач-невролог; преподаватель кафедры неврологии, психиатрии и наркологии. WoS ResearcherID: J-4946-2017; Scopus Author ID: 7003589812; РИНЦ SPIN-код: 6317-9833
ул. Садовая-Триумфальная, д. 4/10, Москва 127006
1-е Успенское ш., д. 111, Московская обл., Одинцовский р-н, Лапино 143081
ул. 2-я Брестская, д. 5, стр. 1-1а, Москва 123056
С. В. Демьянов
Россия
Демьянов Семен Валерьевич – студент 5-го курса
ул. Трубецкая, д. 8/2, Москва 119048
Г. В. Демьянов
Россия
Демьянов Глеб Валерьевич – студент 5-го курса
ул. Трубецкая, д. 8/2, Москва 119048
Е. Е. Ачкасов
Россия
Ачкасов Евгений Евгеньевич – д.м.н., профессор, заведующий кафедрой спортивной медицины и медицинской реабилитации Института клинической медицины. РИНЦ SPIN-код: 5291-0906
ул. Трубецкая, д. 8/2, Москва 119048
А. Ю. Власина
Россия
Власина Анастасия Юрьевна – аспирант кафедры акушерства и гинекологии Клинического института детского здоровья им. Н.Ф. Филатова. WoS ResearcherID: AAF-3130-2020; Scopus Author ID: 1016902; РИНЦ SPIN-код: 1496-6522
ул. Трубецкая, д. 8/2, Москва 119048
Л. Н. Санджиева
Россия
Санджиева Лидия Николаевна – аспирант кафедры акушерства и гинекологии Клинического института детского здоровья им. Н.Ф. Филатова. РИНЦ SPIN-код: 7228-3726
ул. Трубецкая, д. 8/2, Москва 119048
Д. М. Ампилогова
Россия
Ампилогова Диана Михайловна – клинический ординатор кафедры акушерства и гинекологии Института клинической медицины им. Н.В. Склифосовского
ул. Трубецкая, д. 8/2, Москва 119048
Рецензия
Для цитирования:
Солопова А.Г., Блинов Д.В., Демьянов С.В., Демьянов Г.В., Ачкасов Е.Е., Власина А.Ю., Санджиева Л.Н., Ампилогова Д.М. Эпигенетические аспекты реабилитации онкогинекологических больных. ФАРМАКОЭКОНОМИКА. Современная фармакоэкономика и фармакоэпидемиология. 2022;15(2):294-303. https://doi.org/10.17749/2070-4909/farmakoekonomika.2022.141
For citation:
Solopova A.G., Blinov D.V., Demyanov S.V., Demyanov G.V., Achkasov E.E., Vlasina A.Yu., Sandzhieva L.N., Ampilogova D.M. Epigenetic aspects in rehabilitation of female cancer patients. FARMAKOEKONOMIKA. Modern Pharmacoeconomics and Pharmacoepidemiology. 2022;15(2):294-303. (In Russ.) https://doi.org/10.17749/2070-4909/farmakoekonomika.2022.141

Контент доступен под лицензией Creative Commons Attribution-NonCommercial-ShareAlike 4.0 International License.






































