Перейти к:
Периоперационная подготовка к эндопротезированию: потенциал хондроитина сульфата и глюкозамина сульфата
https://doi.org/10.17749/2070-4909/farmakoekonomika.2022.136
Аннотация
Эндопротезирование суставов – это метод выбора лечения пациентов с декомпенсированным остеоартритом (ОА), у которых исчерпаны возможности фармакотерапии и других способов консервативного вмешательства. Подготовка к эндопротезированию и реабилитация после операции обычно предусматривает меры по улучшению состояния мышц и локального кровообращения в области сустава, а при необходимости – противоболевую терапию. Уникальный спектр противовоспалительного действия хондропротекторов на основе хондроитина сульфата и глюкозамина сульфата включает ингибирование каскада NF-κB, толлподобных рецепторов, провоспалительных цитокинов, металлопротеиназ и существенно смягчает течение ОА. Снижение остроты ОА важно для подготовки к операции, последующей реабилитации и профилактики ревизионных хирургических вмешательств.
Ключевые слова
Для цитирования:
Торшин И.Ю., Минасов Т.Б., Загородний Н.В., Лила А.М., Громова О.А. Периоперационная подготовка к эндопротезированию: потенциал хондроитина сульфата и глюкозамина сульфата. ФАРМАКОЭКОНОМИКА. Современная фармакоэкономика и фармакоэпидемиология. 2022;15(1):162-169. https://doi.org/10.17749/2070-4909/farmakoekonomika.2022.136
For citation:
Torshin I.Yu., Minasov T.B., Zagorodniy N.V., Lila A.M., Gromova O.A. Perioperative pharmacotherapy for endoprosthetics: potential of chondroitin sulfate and glucosamine sulfate. FARMAKOEKONOMIKA. Modern Pharmacoeconomics and Pharmacoepidemiology. 2022;15(1):162-169. (In Russ.) https://doi.org/10.17749/2070-4909/farmakoekonomika.2022.136
ВВЕДЕНИЕ / INTRODUCTION
Остеоартрит (ОА) – дегенеративное заболевание суставов, которое может приводить к утрате трудоспособности. В настоящее время эндопротезирование является основным способом хирургического лечения пациентов при тяжелом течении ОА. Целями этой хирургической процедуры являются: снижение функциональных ограничений и восстановление амплитуды движений в суставе, сохранение пораженного сустава (в случае остеонекроза головки бедренной кости), устранение интенсивных хронических болей.
Адекватная подготовка к эндопротезированию существенным образом влияет как на ближайший, так и на отдаленный функциональный результат. В предоперационном периоде необходимо поддержать мышечный каркас и не допустить мышечной дистрофии, улучшить кровоток и лимфоток в прилегающих к суставу тканях, оказать метаболическую поддержку костной ткани, что будет влиять на вторичную стабильность имплантов.
В послеоперационный период актуальнейшей задачей является качественная реабилитация, включающая специальную гимнастику, противоболевую терапию и реконструкционную фармакотерапию хондропротекторами. Заметим, что хондропротекторная фармакотерапия с целью подготовки условий для более успешной операции, как правило, не проводится.
Фармакотерапия пациентов с ОА в период до и после эндопротезирования включает анальгетики (прежде всего, нестероидные противовоспалительные препараты (НПВП)), хондропротекторы (хондроитина сульфат (ХС), глюкозамина сульфат (ГС), фитонутрицевтики, фитофлавоноиды и полифенолы), спазмолитики [1]. При наличии у пациента подагры и ревматоидного артрита необходимо также провести коррекцию базисной фармакотерапии этих заболеваний.
Перечисленные группы препаратов существенно отличаются по своему действию. Например, длительное использование некоторых НПВП может приводить к серьезным побочным эффектам. Систематический анализ 20 клинических исследований показал, что, по сравнению с другими видами терапии, использование НПВП на основе напроксена было связано с трехкратно повышенным риском смерти (отношение шансов (ОШ) 3; 95% доверительный интервал (ДИ) 1,9–4,6). Для НПВП диклофенак был характерен самый высокий риск желудочно-кишечных расстройств (ОШ 4,77; 95% ДИ 3,94–5,76), а НПВП ибупрофен был ассоциирован с самым высоким риском осложнений со стороны почек (ОШ 2,32; 95% ДИ 1,45–3,71), тогда как целекоксиб характеризовался самым высоким сердечно-сосудистым риском (ОШ 2,26; 95% ДИ 1–5,1) [2]. Таким образом, очевидна насущная необходимость в фармакотерапии ОА, которая бы являлась патогенетической, обладала высоким уровнем безопасности при клиническом применении в течение длительных периодов времени (годы) и могла применяться для улучшения исходов эндопротезирования.
Такой фармакотерапией является, в частности, использование хондропротекторов ХС и ГС в составе препаратов с высокой степенью фармацевтической стандартизации. Как показано далее, ХС и ГС характеризуются уникальным спектром противовоспалительного действия (ингибирование ядерного фактора (англ. nuclear factor) NF-κB, толл-подобных рецепторов (англ. toll-like receptors, TLR), провоспалительных цитокинов, металлопротеиназ и других ферментов, деградирующих хрящевую ткань в рамках патофизиологии ОА). Существующая доказательная база по ХС и ГС позволяет утверждать, что их прием значительно смягчает течение ОА, что важно для подготовки к операции, реабилитации и профилактики ревизионных хирургических вмешательств. Более того, имеются результаты ряда экспериментальных и клинических исследований, подтверждающих перспективность использования ХС и ГС до и после хирургических операций.
Следует отметить, что активно исследуются топические эффекты ХС и ГС при проведении различных операций и заживлении ран. Например, метаанализ 13 экспериментальных исследований подтвердил, что нанесение матрицы из коллагена и ХС на поверхности хирургических имплантатов усиливает остеоинтеграцию за счет ускорения формирования новой кости, улучшенного контакта кости с имплантом, повышения минеральной плотности кости [3]. Введение ХС-коллагенового каркаса снижает посттравматический воспалительный ответ в суставном хряще, способствуя усиленной регенерации хрящевой ткани in vivo [4] Гидрогели на основе ХС улучшают результаты культивирования клеток, ускоряют регенерацию тканей [5] и могут применяться для инженерии хрящевой ткани [6]. На основе ХС разрабатываются гели для ускорения заживления ран, успешно тестируемые in vitro и in vivo. Например, раневая повязка на основе хитозана и ХС при наложении на место ранения образует пористый каркас, улучшающий ранозаживление. Поскольку молекулы хитозана заряжены положительно, а молекулы ХС – отрицательно, то смешивание растворов этих двух биополимеров приводит к электростатической поперечной связи между молекулами полимеров, превращая их в пористую массу, которая поддерживает повышенную миграцию кератиноцитов и фибробластов, тем самым ускоряя регенерацию тканей и заживление ран [7].
Далее будут последовательно рассмотрены молекулярно-биологические механизмы терапевтического действия ХС и ГС у пациентов с ОА, проведен анализ показаний к эндопротезированию крупных суставов конечностей, представлены элементы доказательной базы по воздействию ХС и ГС на снижение остроты течения ОА, что создает благоприятный фон для проведения эндопротезирования.
МЕХАНИЗМЫ ТЕРАПЕВТИЧЕСКОГО ДЕЙСТВИЯ ХС И ГС У ПАЦИЕНТОВ С ОСТЕОАРТРИТОМ / MECHANISMS OF THERAPEUTIC EFFECT OF HS AND GS IN PATIENTS WITH OSTEOARTHRITIS
Применение экзогенных хондропротекторов ХС и ГС зачастую рассматривается как повышение обеспеченности организма своего рода «строительным материалом» для хрящей – ведь эндогенные хондроитин и глюкозамин составляют более 80% гликозаминогликанов суставного хряща и принципиально важны для обеспечения его физиологических функций. При ОА меняются паттерны сульфатирования ХС в хряще: в частности, наблюдаются более низкие уровни хондроитин-4-сульфата вследствие снижения активности сульфотрансфераз (ферментов, ответственных за сульфатирование ХС). При этом анализ микроструктуры хрящей, взятых от пациентов с ОА в ходе хирургических вмешательств, показал, что несульфатированный хондроитин равномерно распределяется по разным зонам остеоартритных хрящей. В то же время уровни хондроитин-4-сульфата значительно снижаются в более глубоких зонах хряща [8]. Поэтому, казалось бы, можно рассматривать хондроитин, глюкозамин и их сульфаты просто как «стройматериал», который будет использоваться организмом для реконструкции хряща.
Однако молекулярные механизмы терапевтического действия ХС и ГС при остеоартрите намного сложнее. Результаты многочисленных фундаментальных и клинических исследований позволяют утверждать, что механизмы действия ХС и ГС в принципе не могут быть адекватно описаны в рамках примитивного воззрения на них только как на «строительный материал» для реконструкции хрящевой ткани. Например, в эксперименте у крыс с моделью ОА отмечено «парадоксальное» повышение содержания ХС при воспроизведении модели ОА (77,7±8,3 мкг/мг) по сравнению с интактными животными (53,5±11,2 мкг/мг) (р<0,05). Более того, прием ХС + ГС снижал (!) абнормально повышенное содержание ХС в хряще и предотвращал гистологические изменения, характерные для ОА [9]. Поэтому ХС и ГС не столько являются «строительными материалами» хряща, сколько оказывают специфические фармакологические эффекты, важные для его реконструкции.
Среди фармакологических эффектов ХС и ГС следует особо выделить уникальный противовоспалительный эффект, осуществляемый не через обычные биохимические пути (ингибирование синтеза простагландинов, ингибирование специфических киназ и т.п.), а через каскад NF-κB. Поступая в организм, цепи экзогенного ХС взаимодействуют с рецептором CD44 на поверхности фибробластов мышц, что тормозит воспаление за счет инактивации провоспалительного транскрипционного фактора NF-κB и способствует повышению активности ферментов гиалоуронидаз, расщепляющих цепи ХС на более короткие олигосахаридные фрагменты. Полученные таким образом олигосахариды ХС распространяются по межклеточной жидкости мышцы и поступают в связки, очаг повреждения хряща, синовиальную жидкость, затем достигая хондроцитов. На поверхности хондроцитов олигосахариды ХС также активируют рецептор CD44 с последующей инактивацией NF-κB в ткани хряща. Олигосахариды экзогенного ХС также ингибируют металлопротеиназы MMP1, MMP3 (их избыточная активность разрушает соединительнотканную основу хряща), MMP16 (вызывает деградацию коллагена III типа) и MMP24 (медиатор воспалительной гипералгезии), что способствует уменьшению симптоматики ОА [10].
ГС и олигосахариды экзогенного ХС также ингибируют TLR, биологические роли которых заключаются в реагировании на бактериальные липополисахариды в контексте функционирования врожденного иммунитета. Как известно, избыточная активность TLR приводит к хронизации воспаления и развитию ряда коморбидных патологий (включая обострение ОА). Механизмы действия TLR, связанные с провоспалительными цитокинами и лимфоцитами, включают усиление синтеза/секреции NF-κB-зависимых цитокинов фактора некроза опухоли альфа, интерлейкина 1, интерлейкина 6, активность хемокиновых рецепторов CCR1, CCR2 и др., повышение синтеза провоспалительных простагландинов, усиление дегрануляции эозинофилов [11].
Избыточная активность TLR связана с повышенным риском формирования и более тяжелого течения хронических коморбидных патологий – нарушений функции почек, печени, ишемических и инфекционных поражений миокарда и головного мозга, острого панкреатита, антифосфолипидного синдрома, поражений хрящевой ткани, простатита и сахарного диабета 1-го типа. Результаты фундаментальных и клинических исследований позволяют утверждать, что ХС и ГС способствуют снижению активности TLR различных типов [11].
По итогам систематического анализа 37 постгеномных исследований были выделены 483 гена и соответствующих белка, нарушение уровней и активности которых участвует в патогенезе ОА. Результаты показали, что экзогенные ХС и ГС помимо ингибирования CD44/NF-κB и TLR также способствуют повышению экспрессии генов структурных белков и ростовых факторов соединительной ткани. Модулируя активность белков ремоделирования и деградации хряща, ХС и ГС непосредственно воздействуют на патогенез ОА [12].
В частности, глюкозамин снижает экспрессию анаболических и катаболических генов в эксплантатах остеоартритного хряща человека, полученных во время операции по эндопротезированию коленного сустава. Добавление 5 мМ ГС к ткани хряща в культуре приводило к значительному подавлению экспрессии генов ХС-содержащего гликана аггрекана (в 2,65–7,73 раза) и коллагена II типа (в 7,75–22,17 раза), что указывает на ингибирование анаболической активности, подавление аггреканазы-1 и металлопротеиназы ММР3 [13]. Таким образом, ХС и ГС характеризуются широким спектром молекулярных механизмов, оказывающих патогенетическое воздействие на ОА. Торможение избыточного системного и локального воспаления через ингибирование каскадов CD44/NF-κB и TLR посредством ХС и ГС важно для подготовки к операции.
ПОКАЗАНИЯ К ЭНДОПРОТЕЗИРОВАНИЮ КРУПНЫХ СУСТАВОВ КОНЕЧНОСТЕЙ / INDICATIONS FOR ENDOPROSTHETICS OF LARGE JOINTS OF LIMBS
Важность назначения ХС и ГС пациентам в процессе подготовки к эндопротезированию становится более очевидной при совместном рассмотрении показаний к эндопротезированию и результатов доказательных исследований по использованию ХС и ГС в терапии ОА.
Эндопротезирование показано только в тех случаях, когда утраченная функция сустава не может быть восстановлена другими методами: артрoпластикой, корригирующей остеотомией и др. При идиопатическом и посттравматическoм ОА эндопротезирование, как правило, рекомендуется пациентам старше 40 лет. При асептическом некрозе головки бедренной кости, ревматических заболеваниях (ревматоидном полиартрите, системной красной волчанке, псориатическим полиартрите и т.п.), опухолевых поражениях показания к эндопротезированию ставятся независимо от возраста [14].
Показаниями к эндопротезированию тазобедренного сустава являются:
- кoксартрозы 3-й стадии по классификации Н.С. Косинской (4-я стадия по классификации Келлгрена–Лоуренса);
- асептический некроз (1–2-я стадии по Н.С. Косинской);
- двусторонний фиброзный или костный анкилоз суставов;
- опухолевые процессы в головке и шейке кости;
- неправильно сросшиеся переломы мыщелков.
Данные поражения должны сопровождаться по крайней мере одним из симптомокомплексов в области сустава: хронической болью, вальгусной деформацией более 20°, варусной деформацией более 15°, сгибательной контрактурой более 15°, наличием сложной нестабильности в суставе [15][16].
Важными критериями коксартроза, определяющими стадию по классификациям Н.С. Косинской и Келлгрена–Лоуренса, являются рентгенологические показатели состояния суставов: снижение просвета суставной щели, наличие краевых остеофитов, субхондральный остеосклероз вертлужной впадины и головки бедренной кости, протрузия дна вертлужной впадины. Наиболее значимым количественным показателем является ширина рентгенологической суставной щели. По критериям Международной классификации болезней 10-го пересмотра ширина суставной щели в норме составляет 4–7 мм для тазобедренного сустава, 6–8 мм для коленного сустава и 3 мм для голеностопного сустава.
Сопоставление приведенных выше показаний к эндопротезированию с результатами имеющихся доказательных исследований применения ХС и ГС в терапии ОА позволяет сделать вывод о том, что их долговременный прием облегчает состояние пациентов с ОА как с точки зрения симптоматики и самочувствия (снижение болей и отека в суставе), так и с объективной точки зрения (состояние тканей сустава). Смягчение остроты течения заболевания исключительно важно для подготовки пациента к эндопротезированию (в частности, за счет снижения системного и локального воспаления).
ДОКАЗАТЕЛЬНАЯ БАЗА КЛИНИКО-ФАРМАКОЛОГИЧЕСКИХ ЭФФЕКТОВ ХС И ГС / EVIDENCE BASE FOR CLINICAL AND PHARMACOLOGICAL EFFECTS OF HS AND GS
Метаанализ трех рандомизированных плацебо-контролируемых исследований показал эффективность стандартизированного препарата ХС при ОА коленного сустава II и III степеней по Келлгрену–Лоуренсу. По сравнению с плацебо, прием ХС стимулировал уменьшение боли при физической активности по визуально-аналоговой шкале (ВАШ) на 6 баллов (95% ДИ –9,50…–1,72; р=0,005), снижение алгофункционального индекса на 0,73 (95% ДИ –1,28…–0,18; р=0,01), увеличение доли пациентов, состояние которых улучшилось в соответствии с критериями OARSI-OMERACT1 (ОШ 1,20; 95% ДИ 1,06–1,36; р=0,003) [17].
Метаанализ восьми исследований (n=3793) подтвердил эффективность и безопасность комбинации ХС + ГС в лечении ОА коленного сустава: по сравнению с группой плацебо, показано статистически достоверное снижение индекса WOMAC (англ. Western Ontario and McMaster University Osteoarthritis Index) (–12; 95% ДИ –22…–1,8; р=0,02) и степени сужения суставной щели по шкале JSN (англ. Joint Space Narrowing) (–0,09; 95% ДИ –0,18…0,00; р=0,04) [18].
Метаанализ долгосрочного (1–4 года) контроля боли у пациентов с ОА коленного сустава включил 47 исследований (n=22 037, возраст пациентов 55–70 лет, 30% мужчины). Прием ГС было достоверно ассоциирован со снижением боли (–0,29 балла; 95% ДИ –0,49…–0,09) и замедлением прогрессии сужения суставной щели (–0,42; 95% ДИ –0,65…–0,19). Прием ХС также способствовал достоверному улучшению состояния суставной щели (–0,20; 95% ДИ –0,31…–0,07) [19].
Следует подчеркнуть высокую безопасность использования стандартизированных форм ХС и ГС при лечении ОА, которую подтвердил метаанализ 13 исследований. Не было отмечено достоверного повышения частоты каких-либо побочных эффектов по сравнению с плацебо [20].
Получены фармакоэкономические оценки парентеральной формы ХС у амбулаторных пациентов с ОА I–II стадий: на фоне парентеральной терапии ОА препаратом ХС достижение положительного клинического эффекта обеспечивало снижение коэффициента «затраты–эффективность» по сравнению с монотерапией НПВП [21].
Проведен метаанализ клинических данных по препарату Хондрогард®, основанному на субстанции ХС с высокой степенью фармацевтической стандартизации. Он включил восемь контролируемых исследований (n=771, возраст пациентов 53,6±6,2 года) и показал, что инъекционное введение Хондрогарда® приводит к достоверному снижению боли по ВАШ (p=0,042), в т.ч. ночью (p=0,05), сидя или лежа (p=0,016) и при ходьбе (p=0,049). Применение Хондрогарда® приводило к значимому снижению баллов индекса Лекена (p=0,0349), индекса WOMAС (p=0,004), в т.ч. WOMAС «функция» (p=0,0027) и WOMAС «скованность» (p=0,0462) [22].
ЭКСПЕРИМЕНТАЛЬНЫЕ И КЛИНИЧЕСКИЕ ПОДТВЕРЖДЕНИЯ ПЕРСПЕКТИВНОСТИ ИСПОЛЬЗОВАНИЯ ХС И ГС В ПЕРИОПЕРАЦИОННЫЙ ПЕРИОД / EXPERIMENTAL AND CLINICAL EVIDENCE OF THE PROSPECTS FOR THE USE OF HS AND GS IN THE PERIOPERATIVE PERIOD
Экспериментальное исследование с использованием технологии протонного ядерного магнитного резонанса показало эффективность использования хирургического вмешательства в сочетании с приемом ХС и ГС при лечении разрыва крестообразной связки (одна из наиболее частых причин хромоты задних конечностей у домашних собак). Динамика синовиальной концентрации четырех метаболитов (лактата, аланина, N-ацетилированных сахаров на гликопротеинах и альфа-изомеров глюкозы) статистически достоверно отличалась от эффекта плацебо, что указывает на модуляцию внутрисуставного метаболизма посредством ХС и ГС [23].
Прием ХС (400 мг/кг) и ГС (500 мг/кг) обеспечивал более полное функциональное и структурное восстановление хряща в модели рассечения передней крестообразной связки у крыс. У крыс, получавших ХС + ГС, отмечено достоверное уменьшение повреждения хряща (р<0,05) (рис. 1) [9].
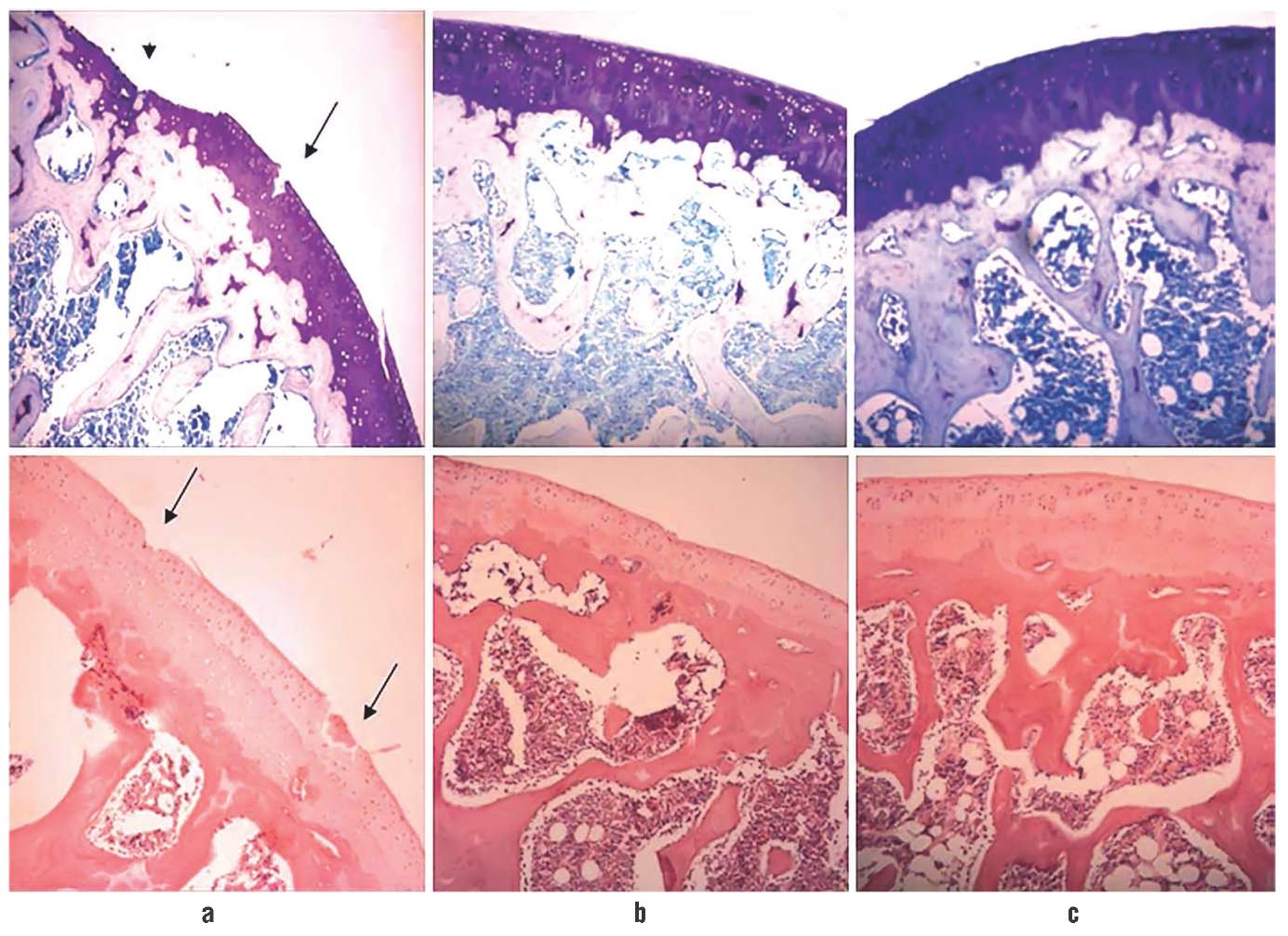
Рисунок 1. Комбинация хондроитина сульфата (ХС) и глюкозамина сульфата (ГС) в модели повреждения хряща, репрезентативная гистология. Дистальные отделы бедренных костей через 70 дней после воспроизведения модели окрашивали гематоксилин-эозином (нижняя панель) или толуидиновым синим (верхняя панель). Группы получали физиологический раствор NT (а), глутаминовую кислоту в дозе 500 мг/кг (b) или ХС + ГС в дозах 500 + 400 мг/кг (с) ежедневно через желудочный зонд начиная с 1-й недели до воспроизведения модели. Показаны сохранение выстилки суставного хряща и более высокая интенсивность окрашивания при приеме ХС + ГС (с) по сравнению с плацебо (а). Стрелками обозначены эрозия и участки потери хряща. Увеличение ×40
Figure 1. Combination of chondroitin sulfate (CS) and glucosamine sulfate (GS) in modeled cartilage lesion, representative histology. Distal sections of femoral bones were hematoxylin-eosin (lower panel) or toluidine blue (upper panel) stained 70 days after model reproduction. The groups received a NT solution (a), glutamic acid 500 mg/kg (b), or CS + GS 500 + 400 mg/kg (c) every day via a gastric tube starting from week 1 before model reproduction. The figure shows preservation of the cartilage layer and higher intensity of staining due to the application of CS + GS (c) in comparison with placebo (a). The arrows point to the areas of erosion and loss of cartilaginous area. Magnification ×40
Исследование очагового повреждения хряща после хирургического вмешательства у кроликов показало, что комбинация имплантации аутологичных хондроцитов и фармакотерапии ХС и ГС ускоряет заживление поврежденного хряща [24].
В клиническом исследовании было показано, что биомаркеры синовиальной жидкости (ХС-содержащий протеогликан агрекан и коллаген II типа) позволяют прогнозировать прогрессирующие поражения суставного хряща через 2 года после оперативной реконструкции передней крестообразной связки. Прогрессирующие повреждения хряща, наблюдаемые артроскопически, отрицательно коррелировали с уровнями Х6С и соотношением Х6С/Х4С. Логистический регрессионный анализ подтвердил достоверные ассоциации между уровнями Х6С (для порогового значения 55,7 нмоль/мл ОШ составило 0,23; 95% ДИ 0,06–0,88) и отношением Х6С/Х4С (порог 4,6; ОШ 0,06; 95% ДИ 0,01–0,74). Отметим, что эти предикторы оставались наиболее информативными после учета поправок на возраст, пол, время, прошедшее от травмы до операции, и количество поражений III и IV степеней на момент начала исследования [25].
Результаты 8-летнего наблюдения за пациентами с ОА коленного сустава (n=340) показали, что курсовой прием ГС снижает необходимость полной замены сустава: частота замены коленного сустава была в 2 раза выше у пациентов из группы плацебо (19/131, 14,5%), чем у пациентов, принимавших ГС (9/144, 6,3%). Иначе говоря, прием ГС соответствовал снижению риска эндопротезирования на 57% по сравнению с плацебо (ОШ 0,43; 95% ДИ 0,20–0,92; р=0,02). Фармакоэкономический анализ показал, что пациенты с ОА, принимавшие ГС, реже использовали противоболевые средства и другие медицинские ресурсы, чем пациенты из группы плацебо. Таким образом, долговременный прием ГС больными с ОА коленного сустава может предотвратить хирургическое вмешательство (в среднем в течение 5 лет после окончания курсового приема препарата в течение 1–3 лет) [26].
ЗАКЛЮЧЕНИЕ / CONCLUSION
При тяжелых поражениях суставов эндопротезирование может являться важной опцией нефармакологической терапии ОА. В подготовке к операции и, особенно, в ходе реабилитации в послеоперационный период используется методика кинезиотерапии, основанная на выполнении тех движений, которые сохранены в суставе, и в том объеме, который может выполнить пациент. Упражнения позволяют улучшить поступление питательных веществ в ткани вокруг сустава, что в последующем благоприятно сказывается на восстановлении в раннем послеоперационном периоде. После этапа оперативного лечения начинается самый сложный и ответственный момент: постепенное возвращение пациента к активному образу жизни через повышение двигательной активности. Регулярные занятия кинезиотерапией позволяют успешно справляться с низким уровнем кровоснабжения и отечностью тканей в зоне операции, которые стимулируют развитие хронической послеоперационной боли.
Дополнение кинезиотерапии хондрои остеопротекторными эффектами препаратов на основе стандартизированных форм ХС и ГС будет способствовать снижению системного и локального воспаления через ингибирование каскада NF-κB, TLR, провоспалительных цитокинов – т.е. по механизмам, независимым от механизмов действия повсеместно используемых НПВП. Можно предположить, что применение стандартизированных препаратов ХС и ГС (например, Хондрогард®, ЗАО «ФармФирма «Сотекс») в подготовке к эндопротезированию суставов и в период послеоперационной реабилитации потенциально может улучшить исходы эндопротезирования, что требует дополнительного изучения.
1. OARSI (англ. Osteoarthritis Research Society International) – Международное общество по исследованию остеоартрита; OMERACT (англ. Outcome Measures in Rheumatoid Arthritis Clinical Trials) – оценка исходов ревматоидного артрита в клинических исследованиях.
Список литературы
1. Sukhikh S., Noskova S., Ivanova S., et al. Chondroprotection and molecular mechanism of action of phytonutraceuticals on osteoarthritis. Molecules. 2021; 26 (8): 2391. https://doi.org/10.3390/molecules26082391.
2. Aweid O., Haider Z., Saed A., Kalairajah Y. Treatment modalities for hip and knee osteoarthritis: a systematic review of safety. J Orthop Surg (Hong Kong). 2018; 26 (3): 2309499018808669. https://doi.org/10.1177/2309499018808669.
3. Kellesarian S.V., Malignaggi V.R., Kellesarian T.V., et al. Does incorporating collagen and chondroitin sulfate matrix in implant surfaces enhance osseointegration? A systematic review and metaanalysis. Int J Oral Maxillofac Surg. 2018; 47 (2): 241–51. https://doi.org/10.1016/j.ijom.2017.10.010.
4. Bauza-Mayol G., Quintela M., Brozovich A., et al. Biomimetic scaffolds modulate the posttraumatic inflammatory response in articular cartilage contributing to enhanced neoformation of cartilaginous tissue in vivo. Adv Healthc Mater. 2022; 11 (1): e2101127. https://doi.org/10.1002/adhm.202101127.
5. Wartenberg A., Weisser J., Schnabelrauch M. Glycosaminoglycanbased cryogels as scaffolds for cell cultivation and tissue regeneration. Molecules. 2021; 26 (18): 5597. https://doi.org/10.3390/molecules26185597.
6. Lee S., Choi J., Youn J., et al. Development and evaluation of gellan gum/silk fibroin/chondroitin sulfate ternary injectable hydrogel for cartilage tissue engineering. Biomolecules. 2021; 11 (8): 1184. https://doi.org/10.3390/biom11081184.
7. Sharma S., Madhyastha H., Laxmi Swetha K., et al. Development of an in-situ forming, self-healing scaffold for dermal wound healing: invitro and in-vivo studies. Mater Sci Eng C Mater Biol Appl. 2021; 128: 112263. https://doi.org/10.1016/j.msec.2021.112263.
8. Lin T.S., Hsieh C.H., Kuo C., et al. Sulfation pattern of chondroitin sulfate in human osteoarthritis cartilages reveals a lower level of chondroitin-4-sulfate. Carbohydr Polym. 2020; 229: 115496. https://doi.org/10.1016/j.carbpol.2019.115496.
9. Silva F.S. Jr., Yoshinari N.H., Castro R.R., et al. Combined glucosamine and chondroitin sulfate provides functional and structural benefit in the anterior cruciate ligament transection model. Clin Rheumatol. 2009; 28 (2): 109–17. https://doi.org/10.1007/s10067-008-0988-8.
10. Лила А.М., Громова О.А. Торшин И.Ю. и др. Молекулярные эффекты хондрогарда при остеоартрите и грыжах межпозвоночного диска. Неврология, нейропсихиатрия, психосоматика. 2017; 9 (3): 88–97. https://doi.org/10.14412/2074-2711-2017-3-88-97.
11. Торшин И.Ю., Громова О.А., Лила А.М. и др. Толл-подобные рецепторы как компонент патофизиологии остеоартрита: противовоспалительное, анальгетическое и нейропротекторное действие. Неврология, нейропсихиатрия, психосоматика. 2021; 13 (4): 123–9. https://doi.org/10.14412/2074-2711-2021-4-123-129.
12. Громова О.А., Торшин И.Ю., Лила А.М. и др. Стандартизированные формы хондроитина сульфата как патогенетическое средство лечения остеоартрита в контексте постгеномных исследований. Современная ревматология. 2021; 15 (1): 136–43. https://doi.org/10.14412/1996-7012-2021-1-136-143.
13. Uitterlinden E.J., Jahr H., Koevoet J.L., et al. Glucosamine decreases expression of anabolic and catabolic genes in human osteoarthritic cartilage explants. Osteoarthritis Cartilage. 2006; 14 (3): 250–7. https://doi.org/10.1016/j.joca.2005.10.001.
14. Кирчанов В.А., Федорищев В.А. Показания и притивопоказания к эндопротезированию крупных суставов конечностей. Методические указания для врачей. Воронеж; 2017.
15. Obertacke U., Nast-Kolb D. Specific features of accidents, injuries and surgical care in the elderly. Unfallchirurg. 2000; 103 (3): 227–2 (на нем. яз). https://doi.org/10.1007/s001130050527.
16. Jawhar A., Skeirek D., Stetzelberger V., Obertacke U. Influence of the tourniquet on pain and function in total knee arthroplasty: a systematic review and meta-analysis. Z Orthop Unfall. 2020; 158 (6): 630–40. https://doi.org/10.1055/a-0983-3808.
17. Schneider H., Maheu E., Cucherat M. Symptom-modifying effect of chondroitin sulfate in knee osteoarthritis: a meta-analysis of randomized placebo-controlled trials performed with Structum®. Open Rheumatol J. 2012; 6: 183–9. https://doi.org/10.2174/1874312901206010183.
18. Meng Z., Liu J., Zhou N. Efficacy and safety of the combination of glucosamine and chondroitin for knee osteoarthritis: a systematic review and meta-analysis. Arch Orthop Trauma Surg. 2022; Jan 13. https://doi.org/10.1007/s00402-021-04326-9.
19. Gregori D., Giacovelli G., Minto C., et al. Association of pharmacological treatments with long-term pain control in patients with knee osteoarthritis: a systematic review and meta-analysis. JAMA. 2018; 320 (24): 2564–79. https://doi.org/10.1001/jama.2018.19319.
20. Honvo G., Reginster J.Y., Rabenda V., et al. Safety of symptomatic slow-acting drugs for osteoarthritis: outcomes of a systematic review and meta-analysis. Drugs Aging. 2019; 36 (Suppl. 1): 65–99. https://doi.org/10.1007/s40266-019-00662-z.
21. Майко О.Ю. Фармакоэкономические аспекты применения хондроитина сульфата у пациентов с остеоартрозом в амбулаторных условиях. Проблемы стандартизации в здравоохранении. 2020; 3-4: 72–7. https://doi.org/10.26347/1607-2502202003-04072-077.
22. Торшин И.Ю., Лила А.М., Наумов А.В. и др. Метаанализ клинических исследований эффективности лечения остеоартита препаратом Хондрогард. ФАРМАКОЭКОНОМИКА. Современная фармакоэкономика и фармакоэпидемиология. 2020; 13 (4): 388– 99. https://doi.org/10.17749/2070-4909/farmakoekonomika.2020.066.
23. Crovace A., Lacitignola L., Miolo A., Fanizzi F.P. Surgery plus chondroprotection for canine cranial cruciate ligament (CCL) rupture: a proton-NMR study. Vet Comp Orthop Traumatol. 2006; 19 (4): 239–45.
24. Kamarul T., Ab-Rahim S., Tumin M., et al. A preliminary study of the effects of glucosamine sulphate and chondroitin sulphate on surgically treated and untreated focal cartilage damage. Eur Cell Mater. 2011; 21: 259–71. https://doi.org/10.22203/ecm.v021a20.
25. Sobue Y., Kojima T., Kurokouchi K., et al. Prediction of progression of damage to articular cartilage 2 years after anterior cruciate ligament reconstruction: use of aggrecan and type II collagen biomarkers in a retrospective observational study. Arthritis Res Ther. 2017; 19 (1): 265. https://doi.org/10.1186/s13075-017-1471-1.
26. Bruyere O., Pavelka K., Rovati L.C., et al. Total joint replacement after glucosamine sulphate treatment in knee osteoarthritis: results of a mean 8-year observation of patients from two previous 3-year, randomised, placebo-controlled trials. Osteoarthritis Cartilage. 2008; 16 (2): 254–60. https://doi.org/10.1016/j.joca.2007.06.011.
Об авторах
И. Ю. ТоршинРоссия
к.ф-м.н., к.х.н., старший научный сотрудник,
ул. Вавилова, д. 4, Москва 2119333
Т. Б. Минасов
Россия
д.м.н., профессор кафедры травматологии и ортопедии с курсом Института дополнительного профессионального образования,
ул. Ленина, д. 3, Уфа 450008
Н. В. Загородний
Россия
д.м.н., чл-корр. РАН, профессор кафедры травматологии и ортопедии, руководитель клиники эндопротезирования суставов, ул. Приорова, д. 10, Москва 127299;
заведующий кафедрой травматологии и ортопедии медицинского факультета, ул. Миклухо-Маклая, д. 6, Москва 117198
А. М. Лила
Россия
д.м.н., профессор, директор,
Каширское ш., д. 34А, Москва 115522
О. А. Громова
Россия
д.м.н., профессор, научный руководитель,
ул. Вавилова, д. 4, Москва 2119333
Рецензия
Для цитирования:
Торшин И.Ю., Минасов Т.Б., Загородний Н.В., Лила А.М., Громова О.А. Периоперационная подготовка к эндопротезированию: потенциал хондроитина сульфата и глюкозамина сульфата. ФАРМАКОЭКОНОМИКА. Современная фармакоэкономика и фармакоэпидемиология. 2022;15(1):162-169. https://doi.org/10.17749/2070-4909/farmakoekonomika.2022.136
For citation:
Torshin I.Yu., Minasov T.B., Zagorodniy N.V., Lila A.M., Gromova O.A. Perioperative pharmacotherapy for endoprosthetics: potential of chondroitin sulfate and glucosamine sulfate. FARMAKOEKONOMIKA. Modern Pharmacoeconomics and Pharmacoepidemiology. 2022;15(1):162-169. (In Russ.) https://doi.org/10.17749/2070-4909/farmakoekonomika.2022.136

Контент доступен под лицензией Creative Commons Attribution-NonCommercial-ShareAlike 4.0 International License.






































