Перейти к:
Систематический обзор данных реальной клинической практики при COVID-19: неинтервенционные исследования
https://doi.org/10.17749/2070-4909/farmakoekonomika.2022.099
Аннотация
Введение. По определению, данному Food and Drug Administration, данные реального мира (англ. real-world data, RWD) – это данные, относящиеся к состоянию здоровья пациента и/или оказанию медицинской помощи, обычно собираемые из различных источников в рамках исследований реальной клинической практики.
Цель: описание возможных и наиболее востребованных дизайнов неинтервенционных исследований реальной клинической практики, которые позволяют получить сведения об эффективности и безопасности применения лекарственных средств в терапии новой коронавирусной инфекции.
Материал и методы. Для извлечения статей, опубликованных с 1 декабря 2020 г., по 12 марта 2021 г., в рамках литературного обзора разработана стратегия поиска по терминам “COVID-19 AND real-life”, “COVID-19 AND real-data”, “COVID-19 AND real-world” в базе данных медицинских публикаций PubMed/MEDLINE, Кокрейновской базе данных систематических обзоров, а также базе данных клинических исследований СlinicalТrials.gov.
Результаты. Было найдено 137 публикаций, из них 32 статьи вошли в обзор. Исключены все рандомизированные клинические испытания (прагматические и упрощенные большие), исследования эффективности методов лабораторной диагностики, медицинской сортировки, социального дистанцирования и других санитарно-эпидемиологических мер по сдерживанию эпидемии.
Заключение. Высококачественные нерандомизированные исследования в рамках RWD способны усилить внешнюю валидность регистрационных рандомизированных клинических испытаний, дополнив их более широким спектром показателей, что имеет существенное значение при поддержке принятия решений в области медицины и общественного здравоохранения в условиях пандемии COVID-19.
Ключевые слова
Для цитирования:
Мишинова С.А., Гомон Ю.М., Колбин А.С., Стрижелецкий В.В., Иванов И.Г. Систематический обзор данных реальной клинической практики при COVID-19: неинтервенционные исследования. ФАРМАКОЭКОНОМИКА. Современная фармакоэкономика и фармакоэпидемиология. 2022;15(1):145-161. https://doi.org/10.17749/2070-4909/farmakoekonomika.2022.099
For citation:
Mishinova S.A., Gomon Yu.M., Kolbin A.S., Strizheletsky V.V., Ivanov I.G. A systematic review of real-world clinical practice data in COVID-19: non-interventional studies. FARMAKOEKONOMIKA. Modern Pharmacoeconomics and Pharmacoepidemiology. 2022;15(1):145-161. (In Russ.) https://doi.org/10.17749/2070-4909/farmakoekonomika.2022.099
ВВЕДЕНИЕ/ INTRODUCTION
Девятого марта 2020 г. Всемирной организацией здравоохранения (ВОЗ) была объявлена пандемия COVID-19 (англ. Cоrona VIrus Disease 2019). На май 2021 г., по данным Европейского центра профилактики и контроля заболеваемости (European Centre for Disease Prevention and Control, ECDC), в мире было зарегистрировано более 170 млн случаев COVID-19, в т.ч. почти 4 млн смертей [1]. Глобальное распространение тяжелого острого респираторного синдрома (англ. Severe Acute Respiratory Syndromerelated CoronaVirus 2, SARS-CoV-2) привело к беспрецедентному росту клинических исследований по различным медицинским технологиям, направленным на диагностику, профилактику и лечение COVID-19. Так, по данным международного реестра Global Coronavirus COVID-19 Clinical Trial Tracker, на май 2021 г. в мире проводится или планируется к проведению почти 3 тыс. клинических исследований. Подавляющее большинство из них – это рандомизированные клинические испытания (РКИ), которые проводят в Китае, Западной Европе и США. На долю Российской Федерации приходится только 2,5% исследований. Более 90% составляют доклинические и клинические исследования I, II, III фаз, 7% – IV пострегистрационной фазы (согласно Coronavirus Vaccine Tracker [2]) (рис. 1).
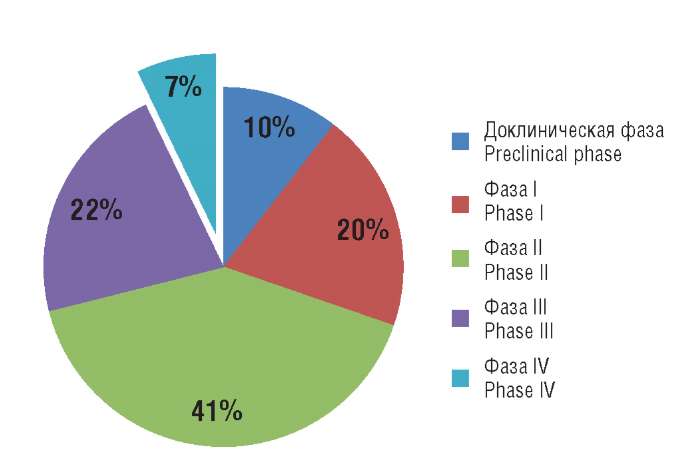
Рисунок 1. Распределение клинических исследований при COVID-19 по фазам [2]
Figure. 1. Phase-based distribution of clinical trials during COVID-19 pandemic [2]
К концу мая 2021 г. основную долю проводимых клинических испытаний составляли исследования переформатирования уже зарегистрированных по другим показаниям лекарственных средств (ЛС) на применение в популяции пациентов с COVID-19 [3]. Идеология переформатирования была сформирована с учетом опыта изучения и использования лекарств при SARS и ближневосточном респираторном синдроме (Middle East Respiratory Syndrome, MERS). Для процесса переформатирования ЛС в условиях текущей пандемии характерны следующие особенности: в его рамках не проводят доклинических исследований при COVID-19; используют данные in vitro, доклинических и клинических наблюдений при SARS-CoV и MERS-CoV; клинические исследования начинают сразу в популяции пациентов с SARS-CoV-2. Безусловно, помимо переформатирования выделяют разработку абсолютно новых лекарств с новыми механизмами действия именно на CoV-2 (стратегия de novo). При данном подходе проводят полноценные долгосрочные клинические исследования: от научного поиска, идентификации цели до доклинических и клинических исследований. Третьим направлением, также относящимся к стратегии de novo, считают изучение эффективности и безопасности различных видов вакцин.
Следствием выбора стратегии переформатирования является как увеличение рисков возникновения серьезных нежелательных реакций, так и возникновение дефицита ЛС на рынке, прежде всего для пациентов с патологиями, при которых они используются по прямым показаниям (например, гидроксихлорохин при системной красной волчанке или ревматоидном артрите) [4].
Наиболее изучаемые группы ЛС при COVID-19 по данным Global Coronavirus COVID-19 Clinical Trial Tracker приведены на рисунке 2 [5].

Рисунок 2. Наиболее изучаемые группы лекарственных средств при COVID-19
по данным международного реестра клинических исследований COVID-19
(Global Coronavirus COVID-19 Clinical Trial Tracker)
Figure. 2. The most studied pharmacological classes of drugs during COVID-19 pandemic
according to the Global Coronavirus COVID-19 Clinical Trial Tracker
С учетом всего вышесказанного растет интерес к исследованиям реальной клинической практики (англ. real-world data, RWD). По определению, данному Управлением по санитарному надзору за качеством пищевых продуктов и медикаментов США (англ. Food and Drug Administration, FDA), RWD – это данные, относящиеся к состоянию здоровья пациента и/или оказанию медицинской помощи, обычно собираемые из различных источников [6]. Такие данные могут быть получены в ходе исследований различного дизайна: большие упрощенные рандомизированные и прагматические рандомизированные клинические исследования; обсервационные исследования (ретроспективные и проспективные); когортные исследования; изучение долговременных тенденций; пострегистрационные исследования эффективности и безопасности. Проводятся они также и на базе регистров, с использованием баз данных страховых компаний, результатов анкетирования пациентов, чек-листов или индивидуальных регистрационных карт. При сборе информации широко применяются медицинские мобильные устройства и медицинские мобильные приложения [7].
Цель – описание возможных и наиболее востребованных дизайнов неинтервенционных исследований реальной клинической практики, которые позволяют получить сведения об эффективности и безопасности применения лекарственных средств в терапии новой коронавирусной инфекции.
МАТЕРИАЛ И МЕТОДЫ / MATERIAL AND METHODS
Методология поиска / Search methodology
В целях проведения литературного обзора разработана стратегия поиска для извлечения статей, опубликованных с 1 декабря 2020 г. по 12 марта 2021 г. Поиск осуществляли по терминам “COVID-19 AND real-life”, “COVID-19 AND real-data”, “COVID-19 AND real-world” в следующих электронных базах: PubMed/MEDLINE, Кокрейновская база данных систематических обзоров (англ. Cochrane Library), а также база данных клинических исследований СlinicalТrials.gov.
Обзор проведен в соответствии с требованиями руководства по предпочтительным элементам отчетности для систематических обзоров и метаанализов (англ. Preferred Reporting Items for Systematic Reviews and Meta-Analyses, PRISMA) [8].
Дизайн исследования / Study design
При извлечении данных два исследователя независимо друг от друга использовали единую матрицу для синтеза данных в программе Excel (Microsoft, США). Результаты поиска были сравнены между собой: различий не идентифицировано. Рассмотрены исследования с оценкой доверительного интервала (ДИ), отношения рисков (ОР), отношения шансов (ОШ) или без нее для событий, выбранных в качестве критериев эффективности/безопасности.
В обзор были включены только нерандомизированные и неинтервенционные исследования с участием взрослых пациентов старше 18 лет с подтвержденной инфекцией SARS-CoV-2. Рассматривали полнотекстовые статьи, описывающие влияние фармакологических медицинских технологий на различные исходы COVID-19.
Из анализа исключены: рандомизированные исследования, в т.ч. большие упрощенные и прагматические, исследования эффективности средств индивидуальной защиты, методов лабораторной и инструментальной диагностики (серологических тестов, полимеразно-цепной реакции, компьютерной томографии), медицинской сортировки, социального дистанцирования, технологий цифрового отслеживания контактов и других санитарно-эпидемиологических мер по сдерживанию эпидемии, исследования влияния самоизоляции на эмоциональное состояние пациентов.
В результате было найдено 137 неповторяющихся публикаций (рис. 3). Из них 69 были исключены после просмотра заголовка и/или абстракта как не соответствующие критериям отбора. Из оставшихся 68 полнотекстовых статей были исключены эпидемиологические исследования влияния различных факторов, в т.ч. этнической принадлежности и индекса массы тела, на тяжесть течения инфекции. Кроме того, в обзор не вошли исследования с размером выборки менее 5 и периодом проведения исследования, не соответствующим периоду пандемии, а также если диагноз COVID-19 не был подтвержден лабораторно.
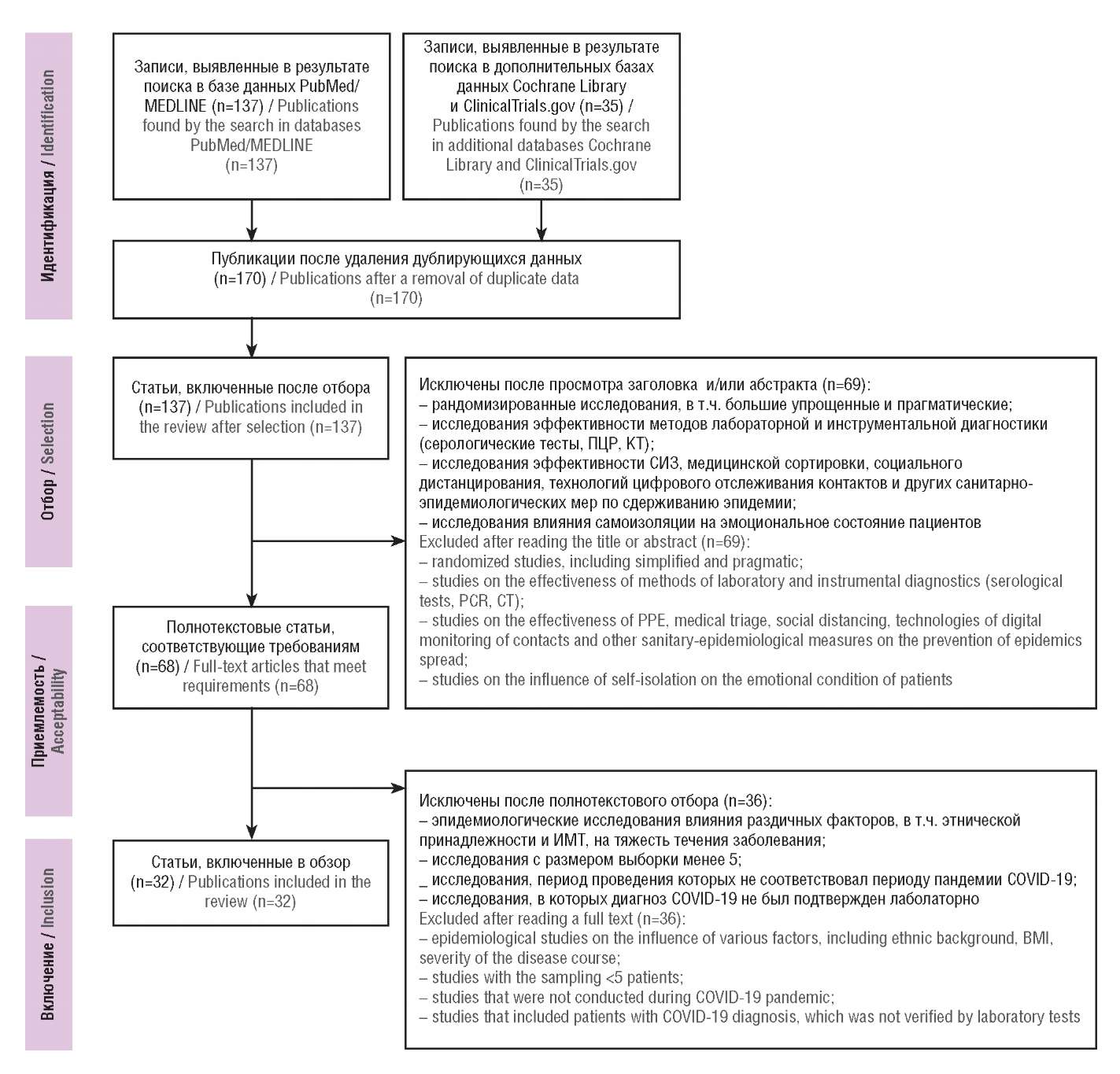
Рисунок 3. Блок-схема дизайна исследования
ПЦР – полимеразная цепная реакция; КТ – компьютерная томография;
СИЗ – средства индивидуальной защиты; ИМТ – индекс массы тела
Figure. 3. Study design block-diagram
PCR – polymerase chain reaction; CT – computed tomography;
PPE – personal protective equipment; BMI – body mass index
Таким образом, после окончательного отбора в систематический обзор включено 32 публикации.
РЕЗУЛЬТАТЫ / RESULTS
Общие характеристики включенных в обзор исследований приведены в таблице 1. Как видно, большинство из них включало разнородные группы пациентов и имело ретроспективный неинтервенционный дизайн. Среди них встречались как крупные многоцентровые исследования, так и работы, выполненные в малой выборке: одно исследование касалось пострегистрационного фармаконадзора с использованием глобальной базы данных ВОЗ по нежелательным лекарственным реакциям (НЛР) (англ. The World Health Organization’s global database of individual case safety reports) VigiBase, еще одно основывалось на анкетировании пациентов о состоянии их здоровья. Всего в исследованиях участвовали 101 149 пациентов с новой коронавирусной инфекцией.
Таблица 1. Общие характеристики исследований реальной клинической практики
по эффективности и безопасности применения лекарственных средств в терапии COVID-19
Table 1. General characteristics of real world data studies
on the effectiveness and safety of pharmaceutical drugs in patients with COVID-1
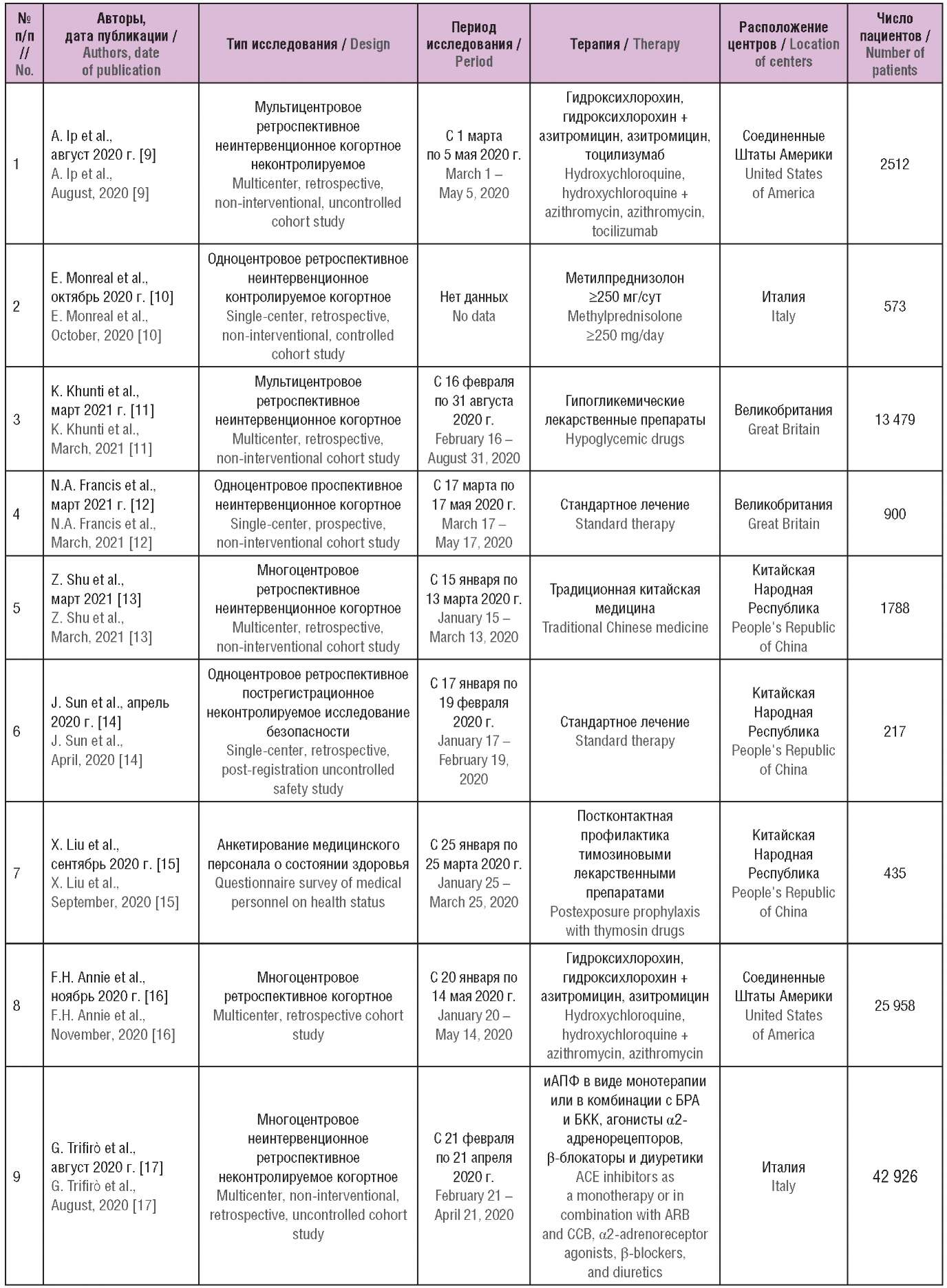
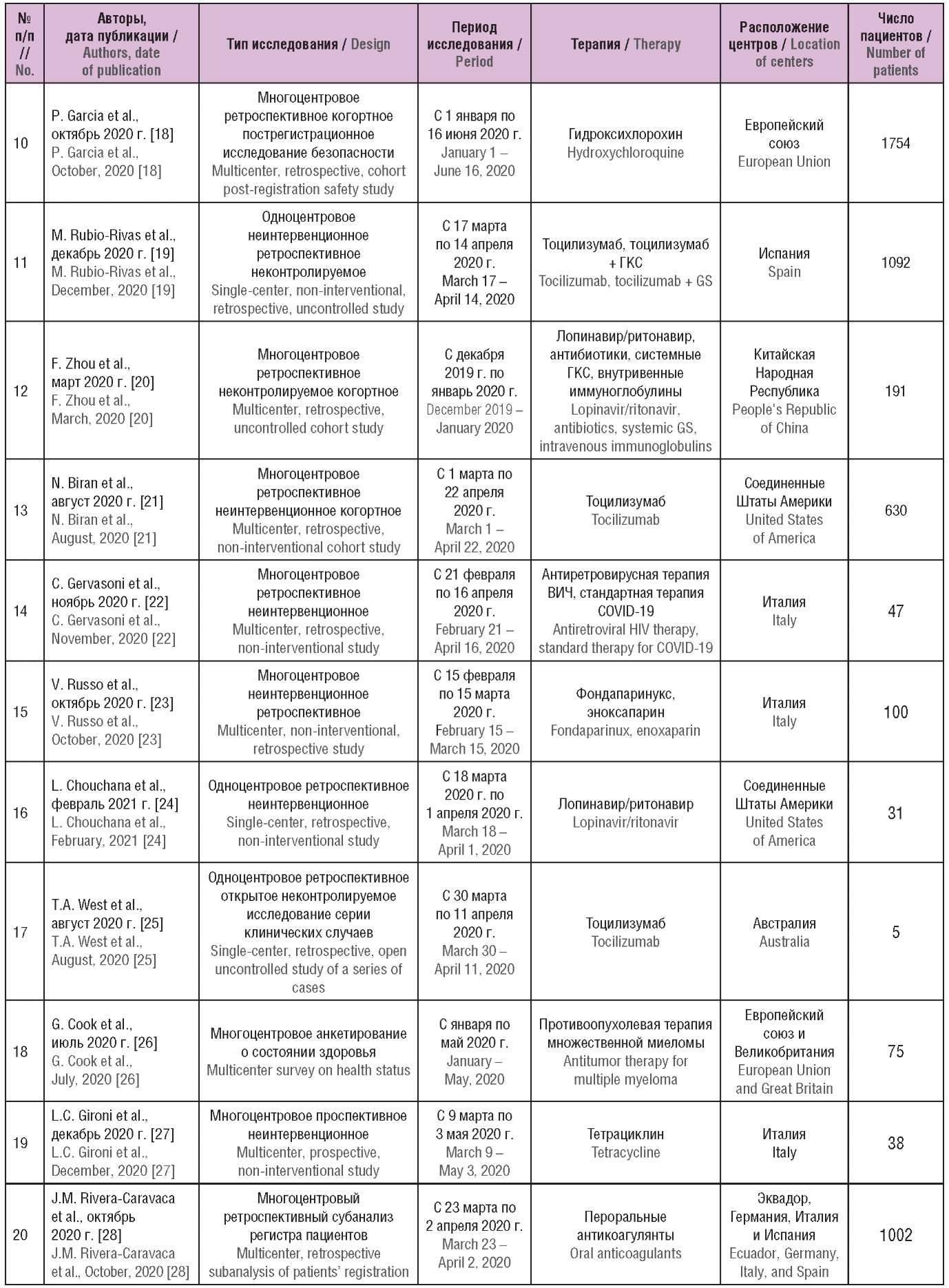

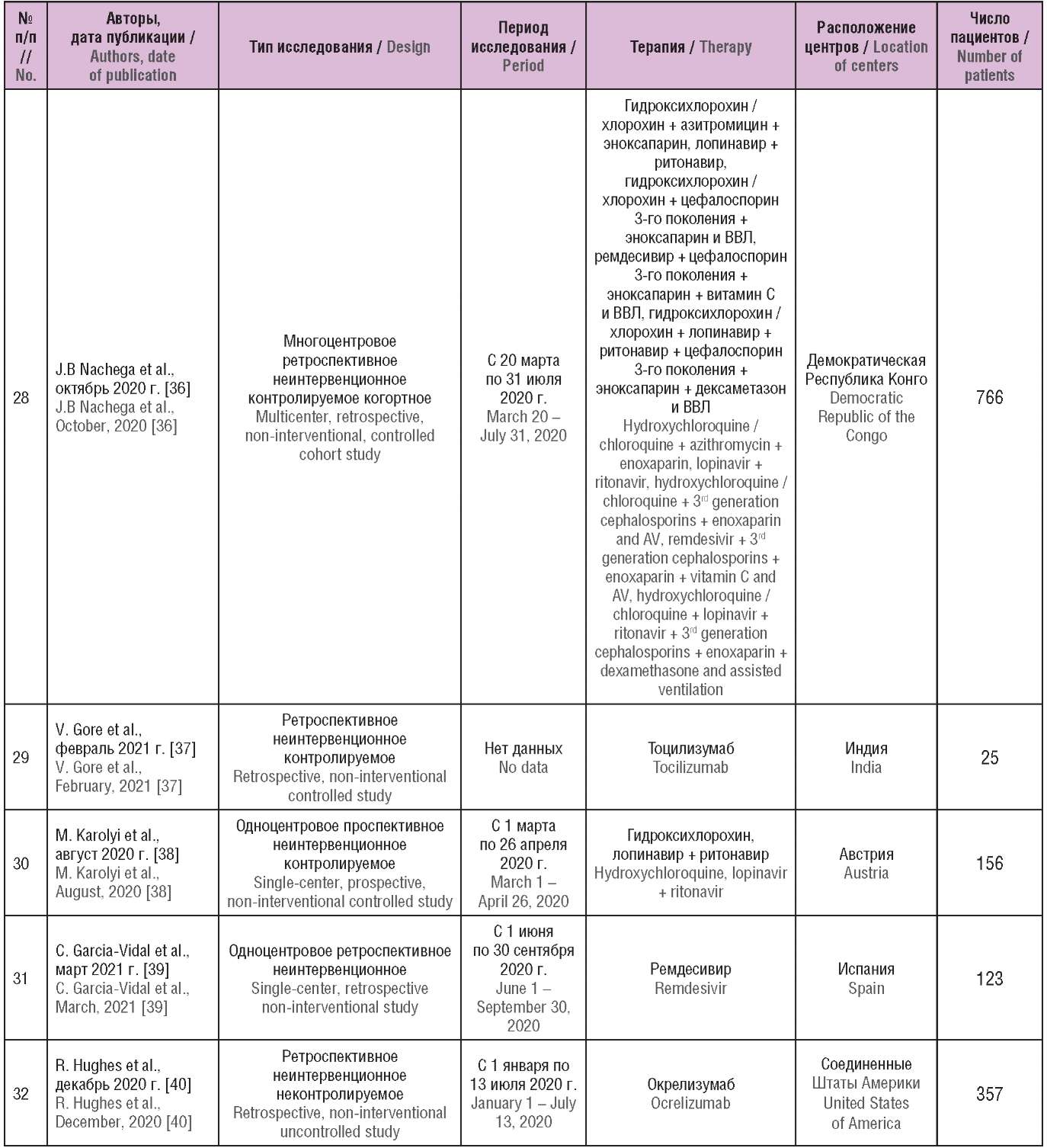
Примечание. иАПФ – ингибиторы ангиотензинпревращающего фермента;
БРА – блокаторы рецепторов к ангиотензину II 1-го типа;
БКК – блокаторы кальциевых каналов; ГКС – глюкортикостероиды;
ВИЧ – вирус иммунодефицита человека; ВВЛ – вспомогательная вентиляция легких.
Note. ACE – angiotensin-converting enzyme; BRA – angiotensin II receptor blocker;
CCB – calcium channel blockers; GS – glucocorticosteroids;
HIV – human immunodeficiency virus; AV – assisted ventilation.
В качестве источников данных чаще выступали архивы интегрированных медицинских электронных карт, собираемых и используемых несколькими медицинскими организациями. Такие архивы включают сведения об обращениях за медицинской помощью, демографические характеристики пациентов, характеристики учреждений здравоохранения и медицинского персонала, информацию об основных и сопутствующих заболеваниях, осложнениях, проведенных диагностических и лечебных процедурах, редко – данные о расходах, ассоциированных с оказанием медицинской помощи.
Оценка клинического статуса / Assessment of clinical status
Оценки эффективности соответствуют конечным точкам и периодам измерения, предусмотренным в протоколе ВОЗ по адаптивному дизайну исследований у пациентов с COVID-19. Первичной конечной точкой являлся уровень летальности, т.е. доля участников, умерших от всех причин в течение исследования, и значение показателя клинического состояния пациента в определенный момент времени [41]. Оценку клинического статуса пациента по 9-балльной порядковой шкале (англ. Ordinal Scale for Clinical Improvement) ВОЗ (табл. 2) осуществляли в 1-й день, а затем вплоть до последнего дня госпитализации (например, через 14, 28 или 60 дней). С помощью данной шкалы определяли:
- долю участников с улучшением клинического состояния не менее чем на 2 балла, например на 7-й, 14-й, 21-й, 28-й дни;
- долю участников с улучшением клинического состояния не менее чем на 1 балл на 7-й, 14-й, 21-й, 28-й дни;
- время до первого улучшения на 1 балл по сравнению с исходным уровнем;
- долю участников в каждой категории шкалы, например на 29-й день;
- среднее изменение оценки по отношению к исходному уровню, например на 15-й и 29-й дни.
Таблица 2. Шкала оценки клинического статуса Всемирной организации здравоохранения
Table 2. The World Health Organization’s Ordinal Scale for Clinical Improvement

Примечание. * Определяется как пациент, не находящийся в стационаре
или готовый к выписке. ** Определяется как насыщение крови кислородом 94% и выше
на атмосферном воздухе. ИВЛ – искусственная вентиляция легких;
ЭКМО – экстракорпоральная мембранная оксигенация.
Note: * A patient who does not receive inpatient treatment or who is ready for discharge.
** Blood saturation with oxygen ≥94% in natural ambient air pressure.
CMV – continuous mandatory ventilation; ECMO – extracorporeal membrane oxygenation.
Характеристика отдельных изучаемых лекарственных средств / Characteristics of individual studied drugs
Противомалярийные препараты
Все исследования, изучающие влияние гидроксихлорохина и хлорохина, показали отсутствие их влияния на внутригоспитальную смертность как первичную конечную точку. Так, крупное мультицентровое ретроспективное неинтервенционное когортное неконтролируемое исследование, выполненное A. Ip et al. (2020 г.), включало 2512 пациентов с подтвержденной коронавирусной инфекцией. Уровни смертности, связанные с госпитализацией в группе больных, получающих гидроксихлорохин (ОР 1,02; 95% ДИ 0,83–1,27) или гидроксихлорохин с азитромицином (ОР 0,98; 95% ДИ 0,75–1,28), не отличались [9].
F.H. Annie et al. (2020 г.) выполнили анализ интегрированного электронного медицинского архива пациентов с диагнозом COVID-19, получавших и не получавших гидроксихлорохин. Авторы показали отсутствие различий в общей 30-дневной смертности между группами пациентов: среди получавших препарат она составила 13,1% (n=367), среди не получавших – 13,6% (n=367) (ОШ 0,95; 95% ДИ 0,62–1,46). Кроме того, исследователи продемонстрировали отсутствие статистически значимого увеличения госпитальной смертности и смертности от аритмии при приеме только гидроксихлорохина или гидроксихлорохина в комбинации с азитромицином [16].
При анализе групп пациентов, получавших комбинации гидроксихлорохина с азитромицином или другими антибиотиками, в турецком одноцентровом кросс-секционном исследовании (E. Tanriverdi et al., 2021 г.) продемонстрировано укорочение сроков госпитализации в группе азитромицина (p=0,027) [35].
В ретроспективном контролируемом когортном исследовании J.B. Nachega et al. (2020 г.), проведенном в Демократической республике Конго среди пациентов, принимавших комбинацию хлорохина и азитромицина, смертность была значительно ниже, чем у тех, кто не принимал указанные ЛС (11,0 и 29,2% соответственно, p<0,001). Смертность среди больных, получавших кислородотерапию, была выше, чем среди тех, кто ее не получал (37,6% и 2,1% соответственно, p<0,001). У пациентов, которые получали комбинацию хлорохина и азитромицина, риск смерти снижался на 74% по сравнению с теми, кто ее не получал (ОР 0,26; 95% ДИ 0,16–0,42). Однако дополнительный анализ не выявил статистически значимой разницы в риске смерти (ОР 0,65; 95% ДИ 0,35–1,20; p=0,166) при сравнении использования комбинации хлорохина и азитромицина с другими схемами лечения [36].
В рамках пострегистрационного исследования 1754 отчетов, поступивших в глобальную базу VigiBase при применении гидроксихлорохина у пациентов с COVID-19, P. Garcia et al. (2020 г.) идентифицировали 56 спонтанных сообщений о психических нарушениях, часть из которых имели критерии серьезности, включая 4 завершенных самоубийства, 3 случая умышленного самоповреждения и 12 случаев психотических расстройств с галлюцинациями. По сравнению с ремдесивиром, тоцилизумабом или лопинавиром/ритонавиром, использование гидроксихлорохина было связано с повышенным риском психических расстройств (ОШ 6,27; 95% ДИ 2,74–14,35). До 2020 г. самоубийства были основной причиной смерти среди всех НЛР, связанных с приемом гидроксихлорохина, далее следовали кардиомиопатии и дыхательная недостаточность [18].
Стероидные противовоспалительные препараты
Результаты исследований подтвердили положительное влияние глюкортикостероидов (ГКС) на снижение показателей внутрибольничной смертности.
Одноцентровое ретроспективное неинтервенционное контролируемое когортное исследование, выполненное E. Monreal et al. (2020 г.), с участием 573 пациентов с подтвержденной коронавирусной инфекцией оценивало эффективность метилпреднизолона в высоких дозировках (250 мг/сут и более) со стандартной дозировкой (1,5 мг/кг/сут). После корректировки по исходным характеристикам смертность среди больных в первой группе была выше (скорректированное ОШ 2,46; 95% ДИ 1,59–3,81; p<0,001), но риск развития тяжелого острого респираторного дистресс-синдрома (ОРДС) был одинаковым между группами [10].
В одноцентровом исследовании M. Rubio-Rivas (2020 г.) у пациентов с тяжелой формой COVID-19, получавших тоцилизумаб из-за синдрома системного иммунного воспалительного ответа, использование ГКС в дополнение к терапии тоцилизумабом показало положительный эффект в предотвращении внутрибольничной смертности. Применение ГКС в сочетании с тоцилизумабом было определено как фактор, снижающий смертность (ОР 0,26; p<0,001) у таких тяжелых пациентов [19].
Гипогликемические препараты
Анализ регистра пациентов с сахарным диабетом 2-го типа, проведенный K. Khunti et al. (2021 г.), показал, что в контексте пандемии COVID-19 нет четких показаний для изменения назначения гипогликемических ЛС. Соотношение рисков смерти у пациентов, получающих метформин, составило 0,77 (95% ДИ 0,73– 0,81), инсулин – 1,42 (95% ДИ 1,35–1,49), меглитиниды – 0,75 (95% ДИ 0,48–1,17), ингибиторы натрий-глюкозного котранспортера 2-го типа – 0,82 (95% ДИ 0,74–0,91), тиазолидиндионы – 0,94 (95% ДИ 0,82–1,07), препараты сульфонилмочевины – 0,94 (95% ДИ 0,89–0,99), агонисты глюкагоноподобного пептида-1 – 0,94 (95% ДИ 0,83–1,07), ингибиторы дипептидилпептидазы-4 – 1,07 (95% ДИ 1,01–1,13), ингибиторы α-глюкозидазы – 1,26 (95% ДИ 0,76–2,09) [11].
Традиционная китайская медицина
Традиционные китайские ЛС растительного происхождения в качестве монотерапии или как компонент политерапии получили неоднозначные оценки экспертов во всем мире. В исследовании Z. Shu et al. (2021 г.) смертность в группе пациентов, принимавших ЛС китайской традиционной медицины в дополнение к стандартной терапии, составила 3,8%, в группе только стандартной терапии – 17%. Добавление ЛС китайской традиционной медицины ассоциировалось со снижением смертности на 58% (ОР 0,42; 95% ДИ; 0,23–0,77) среди всех случаев COVID-19 и на 66% (ОР 0,34; 95% ДИ 0,15–0,76) среди тяжелобольных [13].
Блокаторы ренин-ангиотензин-альдостероновой системы
При изучении влияния блокаторов ренин-ангиотензин-альдостероновой системы на риски смертности от всех причин и риски заражения COVID-19 выводы оказались противоречивыми.
В рамках масштабного многоцентрового анализа регистра пациентов с новой коронавирусной инфекцией, выполненного G. Trifiro et al. (2020 г.), было оценено влияние предшествующей терапии ингибиторами ангиотензин-превращающего фермента (иАПФ) и/или блокаторами рецепторов ангиотензина (БРА) на увеличение риска смерти от всех причин. Авторы показали, что среди более чем 40 тыс. госпитализированных пациентов с COVID-19 риски смерти у принимавших иАПФ (ОР 0,97; 95% ДИ 0,89–1,06) или БРА (ОР 0,98; 95% ДИ 0,89–1,06) по сравнению с блокаторами кальциевых каналов оказались сравнимыми [17].
В результате анализа Йельского регистра пациентов с сердечной недостаточностью C. Caraballo et al. (2020 г.) определили, что менее 4% больных (900 из 26 703) имели симптомы, соответствующие критериям диагноза новой коронавирусной инфекции, после чего им было проведено тестирование на COVID-19. Среди протестированных пациентов 23% имели положительные результаты. Было отмечено, что по сравнению с больными, принимавшими иАПФ и БРА, у пациентов, не использующих эти препараты, вероятность COVID-19 на 50% выше. Полученные данные могут указывать на то, что прием иАПФ и БРА не увеличивает риск заражения COVID-19 у больных с сердечной недостаточностью, и поддерживают мнение о необходимости продолжения приема иАПФ и БРА такими пациентами во время пандемии [31].
Результаты исследования A. De Vito et al. (2021 г.) показывают, что в ограниченных коллективах (таких как, например, дома престарелых) прием БРА увеличивает риск заражения SARSCoV2. Из 452 участников 144 (31,7%) были мужчинами, средний возраст составил 82,2±8,6 года. Пациентов с положительным мазком на SARS-CoV-2 было 306 (67,4%). Значительная разница в количестве инфицированных и не зараженных SARS-CoV-2 (18,6% и 9,5% соответственно, p=0,012) наблюдалась среди тех, кто постоянно лечился БРА II. Напротив, не было никакой разницы в доле тех, кто получал иАПФ (21,2% и 23,6%, p=0,562). Кроме того, прием БРА в качестве постоянной терапии был независимым предиктором риска инфицирования (OШ 1,95; 95% ДИ 1,03–3,72; p=0,041) [33].
Моноклональные антитела к рецептору интерлейкина 6 или интерлейкину 6
Исследования реальной клинической практики подтверждают существование связи между фактом назначения биологических препаратов и снижением смертности среди пациентов с тяжелым течением коронавирусной инфекции.
В обсервационном исследовании N. Biran et al., опубликованном в августе 2020 г., среди больных COVID-19, нуждавшихся в госпитализации в отделения интенсивной терапии (ОИТ) и получавших тоцилизумаб, наблюдалось снижение смертности: общая медиана выживаемости с момента поступления (23 дня) не была достигнута среди пациентов, принимавших препарат, и составила 19 дней (95% ДИ 16–26) у тех, кто не получал тоцилизумаб (ОР 0,71; 95% ДИ 0,56–0,89; p=0,0027). В первичном многовариантном регрессионном анализе Кокса была отмечена ассоциация между получением тоцилизумаба и снижением смертности, связанной с госпитализацией (ОР 0,64; 95% ДИ 0,47–0,87; p=0,0040). Аналогичные связи с приемом тоцилизумаба были отмечены среди подгрупп, нуждающихся в механической вентиляции легких и с исходным уровнем С-реактивного белка (СРБ) 15 мг/дл и выше [21].
T.A. West et al. (2020 г.) выполнили одноцентровое ретроспективное описание 5 клинических случаев заболевания COVID-19 среди пациентов мужского пола в возрасте от 46 до 74 лет с исходным уровнем СРБ более 100 мг/л, госпитализированных в ОИТ. Результаты подтвердили пользу применения тоцилизумаба для лечения больных COVID-19 с тяжелой пневмонией. Первичными конечными точками эффективности были дни с момента начала введения тоцилизумаба до ключевых клинических событий (например, перевод из ОИТ в палату, прекращение кислородотерапии, выписка из стационара, снижение СРБ на 25% и 50%, рентгенологическое улучшение) [25].
По сообщению В.Н. Антонова и др. (2020 г.), применение олокизумаба при новой коронавирусной инфекции продемонстрировало положительное влияние на клинические и лабораторные показатели. Различия в длительности кислородотерапии после назначения препарата Артлегиа® при группировке пациентов по результатам компьютерной томографии статистически значимы (p<0,001), а динамика уровня СРБ при приеме олокизумаба (n=610) показывала выраженную тенденцию к снижению в 89,8% случаев в сравнении с 21,9% у больных на стандартной терапии (n=511) [34].
Моноклональные антитела к CD-6
По результатам исследования V. Gore et al. (2021 г.), разовая доза итолизумаба ускоряла выздоровление у взрослых пациентов с COVID-19 за счет контроля гиперактивации иммунитета. Клиническое улучшение характеризовалось снижением маркеров воспаления (ферритин – на 55,61%, интерлейкин 6 – на 85,4%, СРБ – на 87%), прекращением подачи кислорода, сокращением продолжительности пребывания в больнице и снижением числа баллов по шкале оценки клинического статуса ВОЗ. Пациенты, которым требовалась инвазивная вентиляция легких, исключались из исследования [37].
Моноклональные антитела к CD-20
R. Hughes et al. (2020 г.) в ходе анализа регистра пациентов с рассеянным склерозом (РС) выявили 357 больных с подтвержденным COVID-19, 48 (13,4%) из них получали окрелизумаб и 12 (25%) были госпитализированы, 1 умер (2,1%). Больные РС, принимавшие окрелизумаб, имели преимущественно легкую или среднюю степень тяжести COVID-19, при этом большинство не нуждалось в госпитализации. Показатели летальности среди пациентов с РС, получавших окрелизумаб, были в пределах опубликованных диапазонов для населения в целом и других когорт с РС [40].
Противовирусная терапия
Все исследования лопинавира/ритонавира отразили неудовлетворительный профиль безопасности данных ЛС и отсутствие их влияния на смертность при COVID-19.
В многоцентровом ретроспективном исследовании 47 пациентов с вирусом иммунодефицита человека (ВИЧ) и доказанной или вероятной инфекцией SARS-CoV-2 C. Gervasoni et al. (2020 г.) выявили, что риск тяжелого течения заболевания у больных с ВИЧ ниже, чем в общей популяции пациентов с COVID-19. Риск смерти или госпитализации в ОИТ у ВИЧ-инфицированных ниже, с учетом того что в основном это были мужчины (76%), средний возраст которых составлял 51±11 лет. Половина из них получала лечение препаратами, которые в настоящее время рассматриваются как потенциальные средства лечения инфекции SARS-CoV-2 (гидроксихлорохин, азитромицин, лопинавир/ритонавир, дарунавир/ритонавир, дарунавир/кобицистат). Другое возможное объяснение более благоприятного клинического исхода, наблюдаемого у пациентов с ВИЧ, заключается в том, что, несмотря на эффективность антиретровирусной терапии, у них, возможно, имелся иммунодефицит, на фоне которого не происходило прогрессирование заболевания до серьезного цитокинового шторма [22].
В исследовании L. Chouchana et al. (2021 г.) оценивали концентрацию лопинавира в плазме крови у 31 пациента с COVID-19, которые получали лопинавир/ритонавир в период с 18 марта по 1 апреля 2020 г. Показатели оказались в 4,6 раза выше по сравнению со средней плазменной концентрацией лопинавира/ритонавира при ВИЧ, вследствие чего риски НЛР со стороны печени или желудочно-кишечного тракта возрастали. Однако для противовирусной активности против SARS-CoV-2, как предполагалось in vivo, требуется именно высокая концентрация ЛС в плазме. Поэтому авторы заключили, что не следует снижать дозу лопинавира при условии его хорошей переносимости [24].
В работе, описывающей эффективность и безопасность противовирусного лечения гидроксихлорохином или лопинавиром/ритонавиром в реальной когорте пациентов с COVID-19, M. Karolyi et al. (2020 г.) показали, что среди пациентов с тяжелой формой заболевания, получавших противовирусную терапию, не обнаружено значимой разницы в смертности между группами гидроксихлорохина и лопинавира/ритонавира (15% и 8,5% соответственно, p=0,418), а также в частоте госпитализации в ОИТ (20% и 12,8%, р=0,47) [38].
J. Sun et al. (2020 г.) с помощью госпитальной системы фармаконадзора (англ. China Hospital Pharmacovigilance System, CHPS) провели ретроспективный анализ 217 пациентов с COVID-19, госпитализированных в Первую больницу города Чанша в Китае с 17 января по 29 февраля 2020 г. Распространенность НЛР при применении противовирусных ЛС (умифеновир, лопинавир/ритонавир) составила 37,8%, преобладали желудочно-кишечные расстройства и нарушения со стороны печени (23% и 13,8% соответственно). Развитие НЛР было ассоциировано с применением лопинавира/ритонавира и умифеновира в 63,8% и 18,1% случаев соответственно. У 96,8% больных НЛР возникали в течение 14 дней после госпитализации [14].
Согласно практическому опыту C. Garcia-Vidal et al. (2021 г.) использование ремдесивира у госпитализированных пациентов с COVID-19 было связано с низким уровнем смертности и хорошим профилем безопасности. Среди 242 госпитализированных больных COVID-19 ремдесивир получали 123 (50,8%), при этом 56,9% принимали хотя бы одно другое противовоспалительное ЛС. Показатели потребности в госпитализации в ОИТ, потребности в искусственной вентиляции легких и 30-дневной летальности в группе ремдесивира составили 19,5%, 7,3% и 4,1% соответственно [39].
Анализ польской национальной интегрированной базы медицинских данных пациентов с COVID-19 (SARSTer), проведенный R. Flisiak et al. (2020 г.), подтвердил, что терапия ремдесивиром связана с клиническим улучшением, определяемым как снижение тяжести заболевания на 2 пункта по шкале оценки клинического статуса ВОЗ к 21-му дню по сравнению с группой лопинавира/ритонавира (86% и 71% соответственно, p=0,001) [32].
Препараты, влияющие на гемостаз
Профилактическая антикоагулянтная терапия является действенным методом снижения риска смертности от COVID-19.
V. Russo et al. (2020 г.), оценивая клиническое влияние профилактики венозной тромбоэмболии фондапаринуксом по сравнению с эноксапарином, подтвердили гипотезу о безопасном и эффективном применении фондапаринукса среди госпитализированных больных COVID-19. В рамках проведенного исследования 100 пациентов разделили на две однородные по демографическим, лабораторным и клиническим характеристикам группы. При медиане наблюдения 28 дней (межквартильный размах 12– 45) в группах фондапаринукса и эноксапарина не было продемонстрировано статистически значимой разницы в количестве венозных тромбоэмболий (14,5% и 5,3% соответственно, p=0,20), кровотечений (3,2% и 5,3%, p=0,76), ОРДС (17,7 и 15,8%, p=0,83) и внутрибольничной смертности (9,7% и 10,5%, p=0,97) [23].
В исследовании J.M. Rivera-Caravaca et al. (2020 г.) из 1002 пациентов, включенных в международный регистр HOPE COVID-19 (англ. Health Outcome Predictive Evaluation for COVID-19), 110 принимали оральные антикоагулянты (ОАК) при поступлении: 74,5% получали терапию антагонистами витамина К, 25,5% – пероральными ОАК, в основном при фибрилляции предсердий. Из этих пациентов 67,9% умерли во время госпитализации, что продемонстрировало увеличение риска смерти по сравнению с больными без предшествующей антикоагулянтной терапии (ОР 1,53; 95% ДИ 1,08–2,16). Именно респираторная недостаточность (ОР 6,02; 95% ДИ 2,18–16,62), синдром системного воспалительного ответа (ОР 2,29; 95% ДИ 1,34–3,91) и индекс коморбидности Чарльсона от 1 до 3 (ОР 1,24; 95% ДИ 1,03–1,49) были основными факторами риска смерти у пациентов, ранее получавших ОАК [28].
Общенациональное когортное исследование с участием 4297 госпитализированных пациентов с подтвержденным диагнозом COVID-19 провели C.T. Rentsch et al. (2021 г.) на базе крупнейшей интегрированной медицинской системы здравоохранения США. Авторы показали, что профилактическая антикоагулянтная терапия снижает риск 30-дневной смертности на 27% (ОР 0,73; 95% ДИ 0,66–0,81). Доказательства пользы были наиболее убедительными среди больных, не поступивших в ОИТ в течение первых 24 ч от начала госпитализации. Кроме того, тяжелое кровотечение, определяемое потребностью в переливании крови, было относительно редким событием и не было связано с получением профилактических доз антикоагулянтов [30].
Тетрациклин
В многоцентровом проспективном обсервационном исследовании L. Cristina et al. (2020 г.) участвовали пациенты с легкой степенью тяжести COVID-19, не нуждавшиеся в госпитализации. В период вспышки заболеваемости COVID-19 больные наблюдались теледерматологом в домашних условиях и получали системное лечение дерматологических заболеваний с помощью тетрациклина. Было набрано около 38 взрослых амбулаторных пациентов от 21 до 67 лет. Во время лечения тетрациклином симптомы COVID-19 исчезли у всех участников в течение 10 дней. Авторы подтвердили идею о том, что тетрациклин оказывает непрямое противовирусное действие, опосредованное иммуномодулирующими, противовоспалительными, антиапоптотическими и антиоксидантными свойствами данного ЛС [27].
Профилактика и прогнозирование клинического течения инфекции / Prevention and prediction of the clinical course of infection
Q.L. Zeng et al. (2020 г.) провели первое крупномасштабное многоцентровое ретроспективное фармакоэпидемиологическое исследование, в которое были включены в общей сложности 149 пациентов с COVID-19 из 12 центров в провинциях Хэнань и Шэньси. Демографические, эпидемиологические и клинические данные были извлечены из электронных медицинских карт и записаны в заранее разработанные формы индивидуальных регистрационных карт. Основными конечными точками являлись смерть от всех причин, период выделения SARS-CoV-2 и длительность госпитализации, которые оказались одинаковыми в группах противовирусного лечения и поддерживающей терапии (p>0,05) [29].
Анкетирование 435 медицинских работников больницы города Ухань, получавших или не получивших тимозиновые ЛС в профилактических целях, выполненное X. Liu et al. (2020 г.), не показало очевидного профилактического эффекта тимозина на вероятность заболевания COVID-19, будь то предконтактная или постконтактная профилактика со стороны медицинского персонала. Вместе с тем у 3,7% сотрудников в ответ на введение ЛС была отмечена лихорадка (>37,3° C) [15].
В работе N.A. Francis et al. (2021 г.) продемонстрировано, что основными предикторами клинического ухудшения были возраст (ОР 1,04; 95% ДИ 1,02–1,06), опухолевые заболевания в анамнезе (ОР 2,87; 95% ДИ 1,41–5,82), психические заболевания (ОР 1,76; 95% ДИ 1,02–3,04), тяжелое нарушение функции почек (для уровня экспрессии гена рецептора эпидермального фактора роста менее 30% – ОР 9,09; 95% ДИ 2,01–41,09) и положительный результат теста полимеразной цепной реакции (ПЦР) на SARSCoV2 (ОР 2,0; 95% ДИ 1,11–3,60) [12].
В многоцентровом китайском исследовании F. Zhou et al. (2020 г.) с участием 191 пациента показано, что увеличение шансов неблагоприятного исхода COVID-19 ассоциировано с возрастом (ОШ 1,10; 95% ДИ 1,03–1,17 за каждый год жизни, p=0,0043), количеством баллов по шкале оценки органной дисфункции (англ. Sequential Organ Failure Assessment, SOFA) (p<0,0001) и уровнем D-димера при поступлении более 1 мкг/мл (p=0,0033) [20].
По данным, полученным G. Cook et al. (2020 г.), пациенты с рецидивирующей и/или рефрактерной множественной миеломой имеют высокие риски неблагоприятного исхода COVID-19. Однако среди умерших с симптомами COVID-19 54,8% были с недавно диагностированной множественной миеломой и 50% – с рецидивирующей и/или рефрактерной множественной миеломой, что может отражать большее влияние индуцированной опухолью иммуносупрессии на инфекционные риски в популяции пациентов с недавно диагностированной множественной миеломой [26].
ОБСУЖДЕНИЕ / DISCUSSION
Исследования реальной клинической практики, которые часто могут быть реализованы быстрее, чем предрегистрационные РКИ, позволяют в более короткие сроки получить данные об эффективности и безопасности новых медицинских технологий, что принципиально важно в условиях быстрого распространения эпидемии с высоким уровнем ассоциированной летальности [42]. Однако противоречивость результатов внушает определенные опасения по поводу надежности данных, полученных в рамках RWD [43]. Необходим анализ RWD с помощью инструментов доказательной медицины и получения валидного показателя RWD или RWE (англ. real-world evidence). RWE – это клиническое свидетельство об использовании и потенциальных выгодах или рисках ЛС, полученное в результате анализа RWD [44].
Для всех нерандомизированных данных, кроме неопределенности в отношении внутренней достоверности, наиболее серьезной проблемой является вероятность систематической ошибки, величина которой зависит от дизайна исследования и качества собранной информации (формат данных, наличие пропущенных данных, структурирование и возможность редактирования без «документального следа») [42].
В большинстве опубликованных исследований использовался когортный дизайн с параллельными группами. Однако в рамках этого дизайна было множество различных подвариантов, многие из которых, как известно, приводят к существенным ошибкам. Основными ограничениями исследований были их наблюдательный характер, короткая продолжительность периода наблюдения, ретроспективный сбор электронных данных, малый размер выборки в рамках одного центра, ограниченность административных и кадровых ресурсов. Наконец, исследования имеют ограничения, присущие любому регистру, в котором отсутствует высокая степень детализации.
Следует также отметить возможность влияния других терапевтических средств, действие которых не оценивалось в рамках проведенных исследований, и тяжести течения заболевания, а также вероятность ошибки ввода данных. На сроки нахождения пациента в стационаре влияет возможность выписки без наличия отрицательного результата ПЦР-теста. Кроме того, на начальном этапе пандемии все больные получали почти одинаковые схемы лечения (например, гидроксихлорохин), со временем переход на новые стратегии в различных странах происходил неравномерно.
К инструментам преодоления систематических ошибок и поддержания репрезентативности следует отнести обеспечение формирования основы выборки (англ. sampling frame), стратификацию, кластеризацию и неравные веса наблюдений. Для минимизации ошибок неверной классификации воздействия или исхода могут использоваться: алгебраические методы валидации данных электронных медицинских карт, анализ чувствительности, регрессионная калибровка и вероятностное сопоставление медицинских записей. Самыми распространенными методами борьбы с конфаундингом по показаниям, противопоказаниям, функциональному статусу здоровья, доступу к системе здравоохранения являются стратификация и регрессионное моделирование [7].
ЗАКЛЮЧЕНИЕ / CONCLUSION
Проведение высококачественных нерандомизированных исследований в рамках RWD имеет существенное значение при поддержке принятия решений в области медицины и общественного здравоохранения в условиях пандемии COVID-19. Основным их преимуществом является то, что сбор информации осуществляется в реально существующей гетерогенной популяции пациентов, отражающей текущую повседневную практику оказания медицинской помощи больным с конкретной нозологией. Такие исследования позволяют получить данные, которые невозможно получить в рамках предрегистрационных РКИ ввиду возможных ограничений внешней валидности, – например, в случае определения превосходства близких по фармакологическим свойствам ЛС из одной группы для выявления редких нежелательных событий, долгосрочных результатов лечения. Являясь основным источником доказательств, описывающих симптомы и характеристики пациентов, которые влияют на идентификацию факторов риска заболеваемости и смертности, они способны усилить внешнюю валидность регистрационных РКИ, дополнив их более широким спектром показателей.
Список литературы
1. European Centre for Disease Prevention and Control. COVID-19. Situation updates. URL: https://www.ecdc.europa.eu/en/covid-19-pandemic (дата обращения 29.11.2021).
2. Coronavirus Vaccine Tracker. URL: https://www.nytimes.com/interactive/2020/science/coronavirus-vaccine-tracker.html (дата обращения 29.11.2021).
3. Колбин А.С. COVID-19 и клиническая фармакология. Клиническая фармакология и терапия. 2020; 29 (3): 1–11. https://doi.org/10.32756/0869-5490-2020-3-14-24.
4. Мишинова С.А., Журавков А.А., Журавко В.К. Назначение официально не разрешенных к применению лекарственных средств и использование лекарственных средств с нарушением инструкции по применению: фокус на COVID-19. Качественная клиническая практика. 2020; 4S: 120–9. https://doi.org/10.37489/2588-0519-2020-S4-120-129.
5. Global Coronavirus COVID-19 Clinical Trial Tracker. URL: https://www.covid-trials.org/ (дата обращения 29.11.2021).
6. Framework for FDA’S Real-World Evidence Program. URL: https://www.fda.gov/media/120060/download (дата обращения 29.11.2021).
7. Колбин А.С. (ред.) Исследования реальной клинической практики. М.: Издательство ОКИ; 2020: 208 с.
8. PRISMA transparent reporting of systematic reviews and metaanalyses. URL: http://www.prisma-statement.org/ (дата обращения 29.11.2021).
9. Ip A., Berry D.A., Hansen E., et al. Hydroxychloroquine and tocilizumab therapy in COVID-19 patients – an observational study. PloS One. 2020; 15 (8): e0237693. https://doi.org/10.1371/journal.pone.0237693.
10. Monreal Е., Sainz de la Maza S., Natera-Villalba E., et al. High versus standard doses of corticosteroids in severe COVID-19: a retrospective cohort study. Eur J Clin Microbiol Infect Dis. 2021; 40 (4): 761–9. https://doi.org/10.1007/s10096-020-04078-1.
11. Khunti K., Knighton P., Zaccardi F., et al. Prescription of glucoselowering therapies and risk of COVID-19 mortality in people with type 2 diabetes: a nationwide observational study in England. Lancet Diabetes Endocrinol. 2021; 9 (5): 293–303. https://doi.org/10.1016/S2213-8587(21)00050-4.
12. Francis N.А., Stuart B., Knight M., et al. Predictors of clinical deterioration in patients with suspected COVID-19 managed in a ‘virtual hospital’ setting: a cohort study. BMJ Open. 2021; 11 (3): e045356. https://doi.org/10.1136/bmjopen-2020-045356.
13. Shu Z., Chang K., Zhou Y., et al. Add-On Chinese Medicine for Coronavirus Disease 2019 (ACCORD): a retrospective cohort study of hospital registries. Am J Chin Med. 2021; 49 (3): 543–75. https://doi.org/10.1142/S0192415X21500257.
14. Sun J., Deng X., Chen X., et al. Incidence of adverse drug reactions in COVID-19 patients in China: an active monitoring study by Hospital Pharmacovigilance System. Clin Pharmacol Ther. 2020; 108 (4): 791– 7. https://doi.org/10.1002/cpt.1866.
15. Liu X., Liu Y., Wang L., et al. Analysis of the prophylactic effect of thymosin drugs on COVID-19 for 435 medical staff: a hospital-based retrospective study. J Med Virol. 2021; 93 (3): 1573–80. https://doi.org/10.1002/jmv.26492.
16. Annie F.H., Sirbu C., Frazier K.R., et al. Hydroxychloroquine in hospitalized patients with COVID-19: real-world experience assessing mortality. Pharmacotherapy. 2020; 40 (11): 1072–81. https://doi.org/10.1002/phar.2467.
17. Trifirò G., Massari M., Da Cas R., et al. Renin-angiotensinaldosterone system inhibitors and risk of death in patients hospitalised with COVID-19: a retrospective italian cohort study of 43,000 patients. Drug Saf. 2020; 43 (12): 1297–308. https://doi.org/10.1007/s40264-020-00994-5.
18. Garcia P., Revet A., Yrondi A., et al. Psychiatric disorders and hydroxychloroquine for coronavirus disease 2019 (COVID-19): a VigiBase study. Drug Saf. 2020; 43 (12): 1315–22. https://doi.org/10.1007/s40264-020-01013-3.
19. Rubio-Rivas M., Ronda M., Padulles A., et al. Beneficial effect of corticosteroids in preventing mortality in patients receiving tocilizumab to treat severe COVID-19 illness. Int J Infect Dis. 2020; 101: 290–7. https://doi.org/10.1016/j.ijid.2020.09.1486.
20. Zhou F., Yu T., Du R., et al. Clinical course and risk factors for mortality of adult inpatients with COVID-19 in Wuhan, China: a retrospective cohort study. Lancet. 2020; 395 (10229): 1054–62. https://doi.org/10.1016/S0140-6736(20)30566-3.
21. Biran N., Ip A., Ahn J., et al. Tocilizumab among patients with COVID-19 in the intensive care unit: a multicentre observational study. Lancet Rheumatol. 2020; 2 (10): e603–12. https://doi.org/10.1016/S2665-9913(20)30277-0.
22. Gervasoni C., Meraviglia P., Riva A., et al. Clinical features and outcomes of patients with human immunodeficiency virus with COVID-19. Clin Infect Dis. 2020; 71 (16): 2276–8. https://doi.org/10.1093/cid/ciaa579.
23. Russo V., Cardillo G., Viggiano G.V., et al. Fondaparinux use in patients with COVID-19: a preliminary multicenter real-world experience. J Cardiovasc Pharmacol. 2020; 76 (4): 369–71. https://doi.org/10.1097/FJC.0000000000000893.
24. Chouchana L., Boujaafar S., Gana I., et al. plasma concentrations and safety of lopinavir/ritonavir in COVID-19 patients. Ther Drug Monit. 2021; 43 (1): 131–5. https://doi.org/10.1097/FTD.0000000000000838.
25. Tsukamoto M., Suzuki K., Tsunoda K., et al. Value of labial salivary gland histopathology for diagnosis of Sjögren's syndrome in patients with anti-centromere antibody positivity. Int J Rheum Dis. 2020; 23 (8): 1024–9. https://doi.org/10.1111/1756-185X.13895.
26. Cook G., Ashcroft A.J., Pratt G., et al. Real-world assessment of the clinical impact of symptomatic infection with severe acute respiratory syndrome coronavirus (COVID-19 disease) in patients with multiple myeloma receiving systemic anti-cancer therapy. Br J Haematol. 2020; 190 (2): e83–6. https://doi.org/10.1111/bjh.16874.
27. Gironi L.C., Damiani G., Zavattaro E., et al. Tetracyclines in COVID-19 patients quarantined at home: literature evidence supporting real-world data from a multicenter observational study targeting inflammatory and infectious dermatoses. Dermatol Ther. 2021: 34 (1): e14694. https://doi.org/10.1111/dth.14694.
28. Rivera-Caravaca J.M., Núñez-Gil I.J., Vivas D., et al. Clinical profile and prognosis in patients on oral anticoagulation before admission for COVID-19. Eur J Clin Invest. 2021; 51 (1): e13436. https://doi.org/10.1111/eci.13436.
29. Zeng Q.L., Li G.M., Ji F., et al. Clinical course and treatment efficacy of COVID-19 near Hubei Province, China: a multicentre, retrospective study. Transbound Emerg Dis. 2020; 67 (6): 2971–82. https://doi.org/10.1111/tbed.13674.
30. Rentsch C.T., Beckman J.A., Tomlinson L., et al. Early initiation of prophylactic anticoagulation for prevention of coronavirus disease 2019 mortality in patients admitted to hospital in the United States: cohort study. BMJ. 2021; 372: n311. https://doi.org/10.1136/bmj.n311.
31. Caraballo C., McCullough M., Fuery M.A., et al. COVID-19 infections and outcomes in a live registry of heart failure patients across an integrated health care system. PloS One. 2020; 15 (9): e0238829. https://doi.org/10.1371/journal.pone.0238829.
32. Flisiak R., Zarębska-Michaluk D., Berkan-Kawińska A., et al. Remdesivir-based therapy improved recovery of patients with COVID-19 in the SARSTer study. Pol Arch Intern Med. 2021; 131 (1): 103–10. https://doi.org/10.20452/pamw.15735.
33. De Vito A., Geremia N., Princic E., et al. Does angiotensin II receptor blockers increase the risk of SARS-CoV-2 infection? A real-life experience. Eur Rev Med Pharmacol Sci. 2021; 25 (1): 523–6. https://doi.org/10.26355/eurrev_202101_24424.
34. Антонов В.Н., Игнатова Г.Л., Прибыткова О.В. и др. Опыт применения олокизумаба у больных COVID-19. Терапевтический архив. 2020; 92 (12): 148–54. https://doi.org/10.26442/00403660.2020.12.200522.
35. Tanriverdi E., Çörtük M., Yildirim B.Z., et al. Hydroxychloroquine plus azithromycin and early hospital admission are beneficial in COVID-19 patients: Turkish experience with real-life data. Turk J Med Sci. 2021; 51 (1): 10–5. https://doi.org/10.3906/sag-2005-82.
36. Nachega J.B., Ishoso D.K., Otokoye J.O., et al. Clinical characteristics and outcomes of patients hospitalized for COVID-19 in Africa: early insights from the Democratic Republic of the Congo. Am J Trop Med Hyg. 2020; 103 (6): 2419–28. https://doi.org/10.4269/ajtmh.20-1240.
37. Gore V., Kshirsagar D.P., Bhat S.M., et al. Itolizumab treatment for cytokine release syndrome in moderate to severe acute respiratory distress syndrome due to COVID-19: clinical outcomes, a retrospective study. J Assoc Physicians India. 2021; 69 (2): 13–8.
38. Karolyi M., Pawelka E., Mader T., et al. Hydroxychloroquine versus lopinavir/ritonavir in severe COVID-19 patients. Wien Klin Wochenschr. 2021; 133 (7): 284–91. https://doi.org/10.1007/s00508-020-01720-y.
39. Garcia-Vidal C., Meira F., Cózar-Llistó A., et al. Real-life use of remdesivir in hospitalized patients with COVID-19. Rev Esp Quimioter. 2021; 34 (2): 136–40. https://doi.org/10.37201/req/018.2021.
40. Hughes R., Whitley L., Fitovski K., et al. COVID-19 in ocrelizumabtreated people with multiple sclerosis. Mult Scler Relat Disord. 2021; 49: 102725. https://doi.org/10.1016/j.msard.2020.102725.
41. WHO R&D Blueprint. Novel coronavirus. COVID-19 therapeutic trial synopsis. URL: https://www.who.int/blueprint/priority-diseases/keyaction/COVID-19_Treatment_Trial_Design_Master_Protocol_ synopsis_Final_18022020.pdf (дата обращения 29.11.2021).
42. Марцевич С.Ю., Лукина Ю.В., Кутишенко Н.П. Еще раз об иерархии доказательств в медицине, или можно ли с помощью наблюдательных исследований решить вопрос о выборе наиболее эффективного и безопасного препарата. Рациональная фармакотерапия в кардиологии. 2017; 13 (2): 270–4. https://doi.org/10.20996/1819-6446-2017-13-2-270-274.
43. Franklin J.M., Lin K.J., Gatto N.M., et al. Real-world evidence for assessing pharmaceutical treatments in the context of COVID-19. Clin Pharmacol Ther. 2021; 109 (4): 816–28. https://doi.org/10.1002/cpt.2185.
44. “Guiding principles of real-word evidence supporting drug development and review (trial)” is formally promulgated by NMPA. URL: https://www.accestra.com/guiding-principles-of-real-worldevidence-supporting-drug-development-and-review-trial-is-formallypromulgated-by-nmpa/ (дата обращения 29.11.2021).
Об авторах
С. А. МишиноваРоссия
ассистент кафедры клинической фармакологии и доказательной медицины,
ул. Льва Толстого, д. 6-8, Санкт-Петербург 197022
Ю. М. Гомон
Россия
д.м.н., доцент кафедры клинической фармакологии и доказательной медицины, ул. Льва Толстого, д. 6-8, Санкт-Петербург 197022;
врач – клинический фармаколог, Северный пр-т, д. 1, Санкт-Петербург 194354
А. С. Колбин
Россия
д.м.н., профессор, заведующий кафедрой клинической фармакологии и доказательной медицины, ул. Льва Толстого, д. 6-8, Санкт-Петербург 197022;
профессор кафедры фармакологии медицинского факультета, 21-я линия Васильевского острова, д. 8, Санкт-Петербург 199106
В. В. Стрижелецкий
Россия
д.м.н., главный врач, Северный пр-т, д. 1, Санкт-Петербург 194354;
профессор кафедры госпитальной хирургии, 21-я линия Васильевского острова, д. 8, Санкт-Петербург 199106
И. Г. Иванов
Россия
заместитель главного врача по медицинской части, Северный пр-т, д. 1, Санкт-Петербург 194354;
ассистент кафедры пропедевтики внутренних болезней, 21-я линия Васильевского острова, д. 8, Санкт-Петербург 199106
Рецензия
Для цитирования:
Мишинова С.А., Гомон Ю.М., Колбин А.С., Стрижелецкий В.В., Иванов И.Г. Систематический обзор данных реальной клинической практики при COVID-19: неинтервенционные исследования. ФАРМАКОЭКОНОМИКА. Современная фармакоэкономика и фармакоэпидемиология. 2022;15(1):145-161. https://doi.org/10.17749/2070-4909/farmakoekonomika.2022.099
For citation:
Mishinova S.A., Gomon Yu.M., Kolbin A.S., Strizheletsky V.V., Ivanov I.G. A systematic review of real-world clinical practice data in COVID-19: non-interventional studies. FARMAKOEKONOMIKA. Modern Pharmacoeconomics and Pharmacoepidemiology. 2022;15(1):145-161. (In Russ.) https://doi.org/10.17749/2070-4909/farmakoekonomika.2022.099

Контент доступен под лицензией Creative Commons Attribution-NonCommercial-ShareAlike 4.0 International License.






































