Перейти к:
Реальная практика проведения клинико-экономических исследований лекарственных средств, входящих в федеральную программу высокозатратных нозологий
https://doi.org/10.17749/2070-4909/farmakoekonomika.2022.107
Аннотация
Цель: оценка соответствия реальной практики проведения клинико-экономических исследований действующим в Российской Федерации (РФ) требованиям, предъявляемым при включении лекарственных средств (ЛС) в федеральную программу высокозатратных нозологий (ВЗН).
Материал и методы. В базах данных КиберЛенинка и eLibrary проведен поиск клинико-экономических исследований ЛС, включенных в перечень ВЗН, которые были опубликованы в РФ в период с 2011 г. по июнь 2021 г.
Результаты. Получены сведения о 23 клинико-экономических исследованиях эффективности ЛС, что составляет менее 30% от всех ЛС, включенных в указанный период в программу ВЗН. Более половины исследований хронических инвалидизирующих заболеваний имели горизонт моделирования 1 год. Анализ чувствительности результатов более чем в 1/3 случаев учитывал только отклонение цены рассматриваемых стратегий, а в 1/4 случаев такой анализ вообще не проводился. Только в 4 исследованиях оценивали прирост лет качественной жизни, несмотря на то что для хронических инвалидизирующих заболеваний качество жизни – один из ключевых показателей эффективности.
Заключение. В РФ публикуется менее 30% результатов фармакоэкономических исследований ЛС, включенных в программу ВЗН, что не позволяет в полной мере оценить фармакоэкономические подходы к ее формированию. Для анализа эффективности инструментов, используемых при оценке экономической эффективности дорогостоящих медицинских технологий, требуется дальнейшее ретроспективное изучение проведенных в РФ исследований.
Ключевые слова
Для цитирования:
Колбин А.С., Гомон Ю.М., Касимова А.Р., Курылев А.А., Бем А.Э. Реальная практика проведения клинико-экономических исследований лекарственных средств, входящих в федеральную программу высокозатратных нозологий. ФАРМАКОЭКОНОМИКА. Современная фармакоэкономика и фармакоэпидемиология. 2022;15(1):87-105. https://doi.org/10.17749/2070-4909/farmakoekonomika.2022.107
For citation:
Kolbin A.S., Gomon Yu.M., Kasimova A.R., Kurylev A.A., Bem A.E. The real practice of clinical and economic research of drugs included in the Federal Program of High-Cost Nosologies. FARMAKOEKONOMIKA. Modern Pharmacoeconomics and Pharmacoepidemiology. 2022;15(1):87-105. (In Russ.) https://doi.org/10.17749/2070-4909/farmakoekonomika.2022.107
ВВЕДЕНИЕ / INTRODUCTION
С 2008 г. в Российской Федерации (РФ) существует программа «Семь высокозатратных нозологий» (7 ВЗН), в которую включены лекарственные средства (ЛС), предназначенные для лечения больных гемофилией, муковисцидозом, гипофизарным нанизмом, болезнью Гоше, злокачественными новообразованиями лимфоидной, кроветворной и родственных им тканей, рассеянным склерозом, а также пациентов после трансплантации органов и (или) тканей. Все ЛС в программе 7 ВЗН закупаются централизованно за счет средств федерального бюджета [1]. С 2018 г. программа была расширена за счет ЛС, используемых для лечения гемолитико-уремического синдрома, юношеского артрита с системным началом и мукополисахаридоза I, II и VI типов (12 ВЗН) [2]. В 2020 г. она была дополнена еще двумя ЛС для лечения апластической анемии и наследственного дефицита факторов свертывания крови II, VII и X. Таким образом, к 2021 г. в программе ВЗН из средств федерального бюджета финансируется 14 нозологий (14 ВЗН) [3].
С 2012 г. в РФ существует Перечень жизнеугрожающих и хронических прогрессирующих редких (орфанных) заболеваний, приводящих к сокращению продолжительности жизни граждан или их инвалидности, который включает 17 патологий. Обязательства по льготному лекарственному обеспечению пациентов с заболеваниями, вошедшими в указанный перечень, возложены на субъекты РФ [4]. Лекарственное обеспечение пациентов с редкими заболеваниями, не вошедшими в указанные выше льготные программы, при наличии у больного статуса «инвалид» финансируется за счет средств субъекта РФ или из средств федерального бюджета (если необходимый ЛС включен в перечень жизненно необходимых и важнейших лекарственных препаратов, а также в случае выделения межбюджетных трансфертов из федерального бюджета, предоставляемых бюджетам субъектов РФ) [4][5].
Смыслом составления подобных ограничительных перечней является создание условий доступности ЛС пациентам. Безусловно, необходимо также отметить и снижение финансового бремени для регионов РФ, связанного с обязательствами по лекарственному обеспечению пациентов с редкими жизнеугрожающими заболеваниями. Согласно данным Ежегодного бюллетеня экспертного совета по редким (орфанным) заболеваниям 2020 г., в 2019 г. бюджет на редкие заболевания по программе редких жизнеугрожающих заболеваний в 68 субъектах РФ составил 11,6 млрд руб., по программе ВЗН – 20,8 млрд руб. [1]. В среднем в 2019 г. по регионам доля расходов регионального и федерального бюджетов от общего объема расходов составила 36% и 64% соответственно.
Препараты, включенные в перечень ВЗН, часто относят к инновационным ЛС. В настоящее время унифицированного определения термина «инновационный лекарственный препарат» не существует. В странах Евросоюза и США под инновационным ЛС понимают новую активную субстанцию или уже известную субстанцию, применяемую по новым показаниям, в другой дозе либо иным путем введения [6]. В РФ определения инновационного ЛС нет [6]. Есть несколько экспертных подходов, которые предлагают учитывать различные критерии отнесения ЛС к «инновационному» – от терапевтических (к примеру, ранее не было возможности лечения заболевания) до технологических и коммерческих. Наряду со сложностями в определении понятия «инновационный лекарственный препарат» существуют трудности в оценке их экономической эффективности стандартными фармакоэкономическими методами: прежде всего, из-за отсутствия альтернативных стратегий в таргетной популяции и их высокой стоимости. Для устранения этих препятствий в РФ разработан прецедентный подход, который позволяет сравнивать стоимость дополнительной эффективности с таковой для аналогичного (референтного) ЛС, уже включенного в ограничительные списки или применяющегося при заболеваниях из того же класса Международной статистической классификации болезней и проблем, связанных со здоровьем [7].
Цель – оценка соответствия реальной практики проведения клинико-экономических исследований действующим в РФ требованиям, предъявляемым при включении лекарственных средств в федеральную программу высокозатратных нозологий.
МАТЕРИАЛ И МЕТОДЫ / MATERIAL AND METHODS
Двумя независимыми исследователями в базах данных КиберЛенинка и eLibrary проведен поиск клинико-экономических исследований ЛС, включенных в перечень ВЗН. Для нахождения соответствующих статей, опубликованных с 2011 г. по июнь 2021 г., была использована стратегия поиска, которая включала названия заболеваний (из списка 14 ВЗН) с использованием логического оператора «ИЛИ» и методы экономических оценок с использованием логического оператора «И».
Стратегия поиска / Search strategy
Поиск осуществляли по следующему ключевому запросу: «(гемофилия ИЛИ муковисцидоз ИЛИ гипофизарный нанизм ИЛИ болезнь Гоше ИЛИ хронический миелоидный лейкоз ИЛИ макроглобулинемия Вальденстрема ИЛИ множественная миелома ИЛИ фолликулярная (нодулярная) неходжкинская лимфома ИЛИ мелкоклеточная (диффузная) неходжкинская лимфома ИЛИ мелкоклеточная с расщепленными ядрами (диффузная) неходжкинская лимфома ИЛИ крупноклеточная (диффузная) неходжкинская лимфома ИЛИ иммунобластная (диффузная) неходжкинская лимфома ИЛИ хронический лимфоцитарный лейкоз ИЛИ рассеянный склероз ИЛИ трансплантация органов (с уточнением) ИЛИ гемолитико-уремический синдром ИЛИ юношеский артрит с системным началом ИЛИ мукополисахаридоз II типа ИЛИ апластическая анемия ИЛИ наследственный дефицит факторов свертывания крови II, VII и X) И (фармакоэкономическая оценка ИЛИ фармакоэкономический анализ ИЛИ анализ влияния на бюджет ИЛИ экономическая оценка ИЛИ экономическая целесообразность ИЛИ оценка технологий здравоохранения ИЛИ анализ эффективности затрат)».
Критерии включения и исключения / Inclusion and exclusion criteria
Критерии включения публикаций в исследование:
- ЛС рекомендовано для лечения заболевания, входящего в перечень ВЗН;
- фармакоэкономический анализ включает анализ «затраты – эффективность/полезность», анализ влияния на бюджет (АВБ);
- публикация на русском языке.
Критерии исключения:
- отсутствие полнотекстовой версии отчета о результатах исследования;
- иные виды фармакоэкономических исследований, например анализ стоимости болезни.
РЕЗУЛЬТАТЫ / RESULTS
Результаты поиска публикаций / Results of publications search
Найдено 1387 источников, из них исключено 1156 как повторяющиеся и не соответствующие теме, еще 208 – как не соответствующие критериям включения или соответствующие критериям исключения. Таким образом, получены сведения о 23 клинико-экономических исследованиях эффективности ЛС, включенных в программу ВЗН (рис. 1).

Рисунок 1. Дизайн исследования
Figure 1. Study design
Выявленные статьи были проверены двумя рецензентами независимо друг от друга в соответствии с критериями исключения и включения – сначала по названию, затем по аннотации и, наконец, по полному тексту статьи. Любые расхождения были устранены в ходе обсуждения с третьим рецензентом. Извлеченные данные включали год публикации, клинические показания, исследуемое ЛС и препарат сравнения, метод экономической оценки, временной горизонт, общие затраты на вмешательство и компаратор, прирост лет жизни с поправкой на качество (англ. quality-adjusted life year, QALY), инкрементальный коэффициент полезности затрат (англ. incremental cost-utility ratio, ICUR), прирост показателя эффективности, инкрементальный коэффициент эффективности затрат (англ. incremental cost-effectiveness ratio, ICER), результаты анализа чувствительности, основные результаты исследования, вопросы обобщаемости, ограничения исследования и ключевые методологические проблемы, о которых сообщили авторы каждой публикации.
Результаты анализа исследований / Results of research analysis
Общая характеристика исследований, их результаты, а также основные выводы и методологические проблемы включенных исследований представлены в таблицах 1–3.
Таблица 1. Основные характеристики включенных исследований
(опубликованы в Российской Федерации)
Table 1. The main characteristics of the included studies
(published in the Russian Federation)
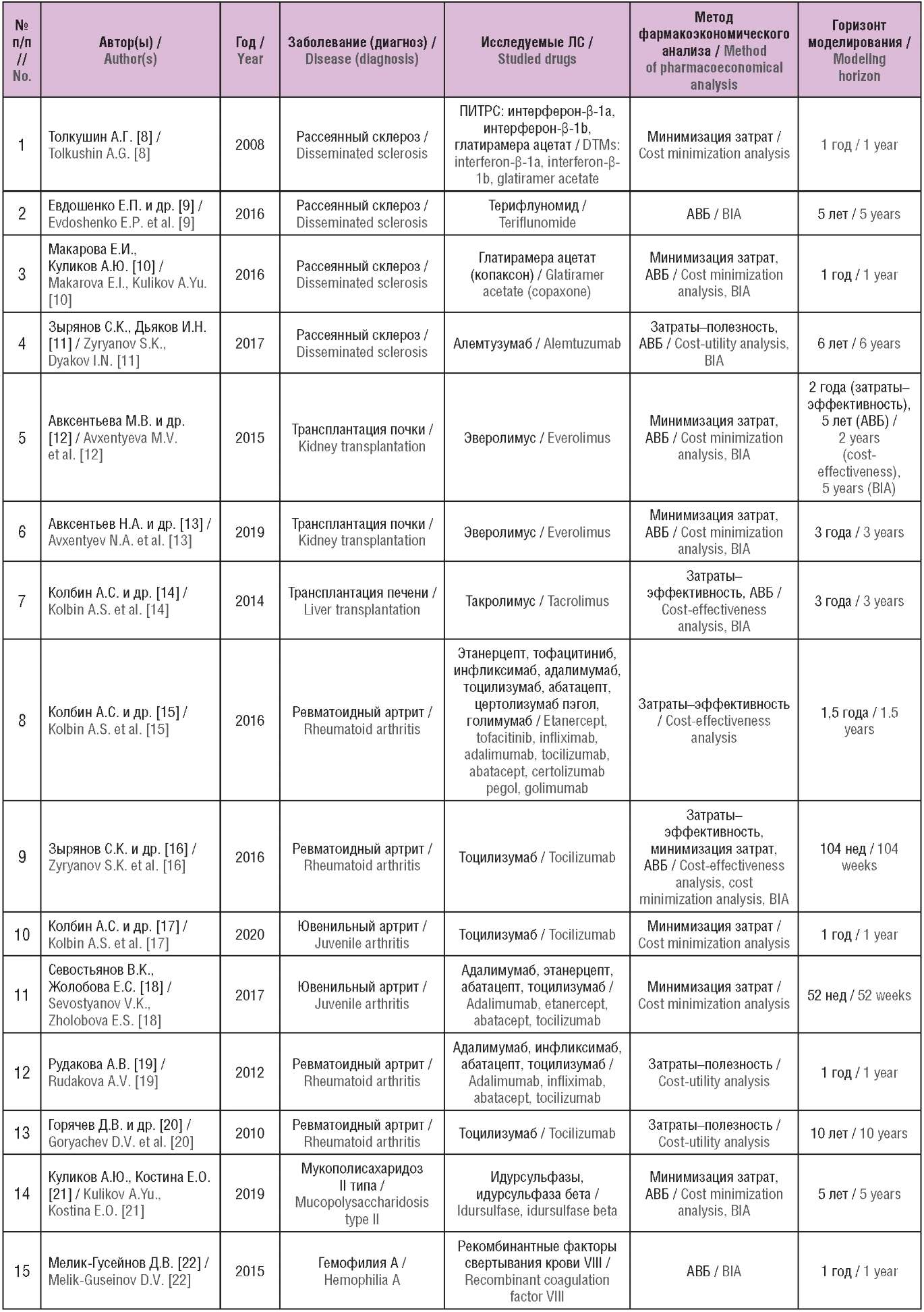
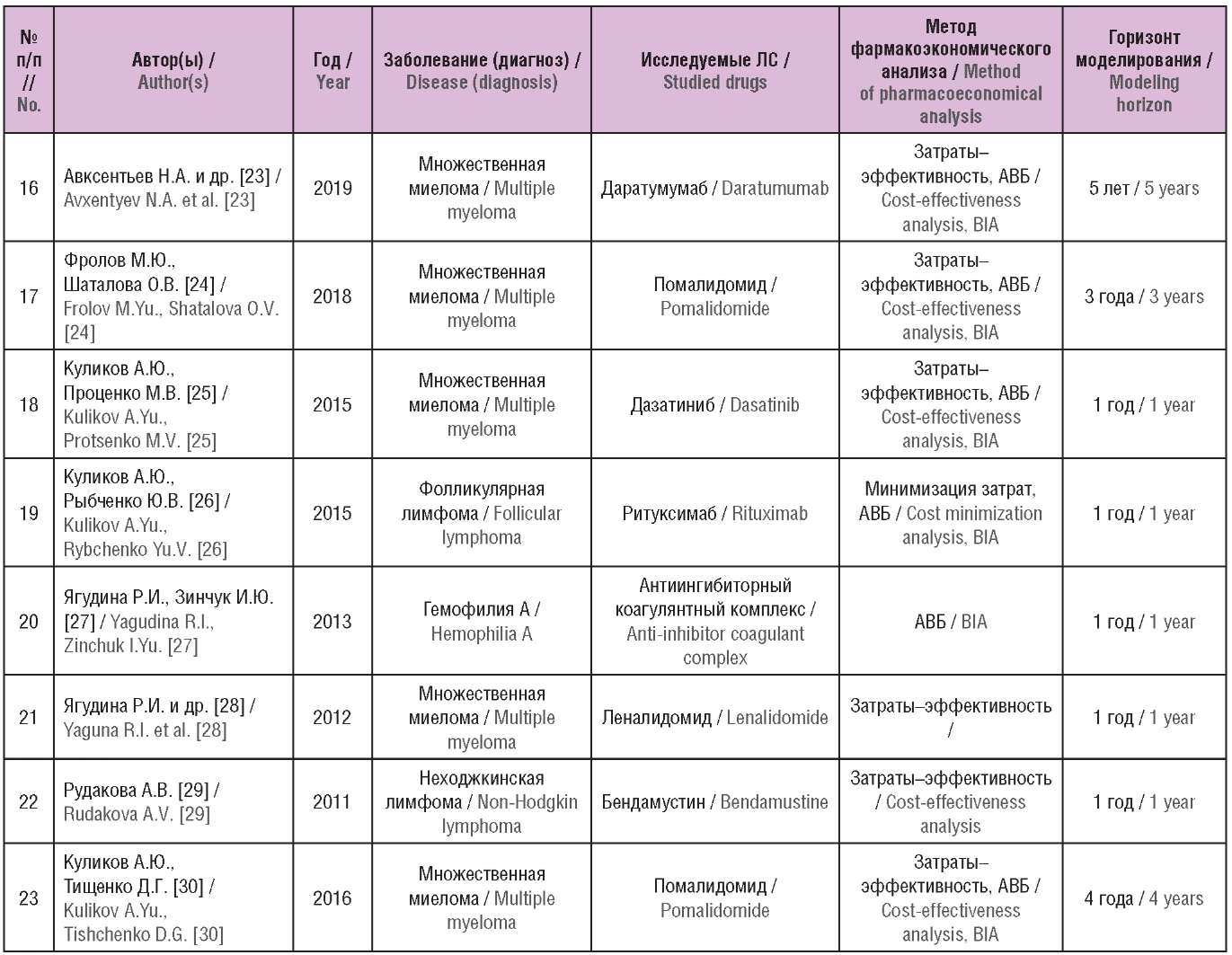
Примечание. ЛС – лекарственное средство; ПИТРС – препараты, изменяющие течение рассеянного склероза; АВБ – анализ влияния на бюджет.
Note. DTMs – disease modifying therapies; BIA – budget impact analysis.
Таблица 2. Основные результаты включенных исследований
(опубликованы в Российской Федерации)
Table 2. The main results of the included studies
(published in the Russian Federation)
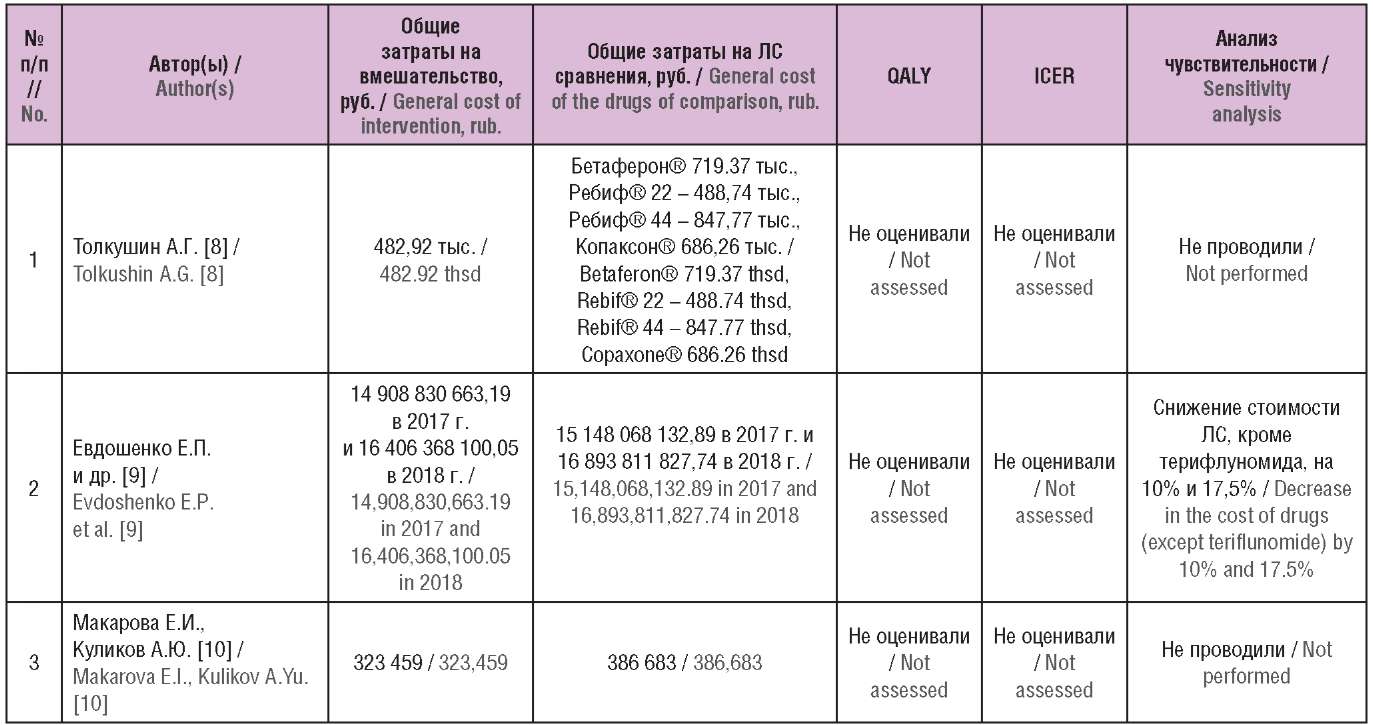
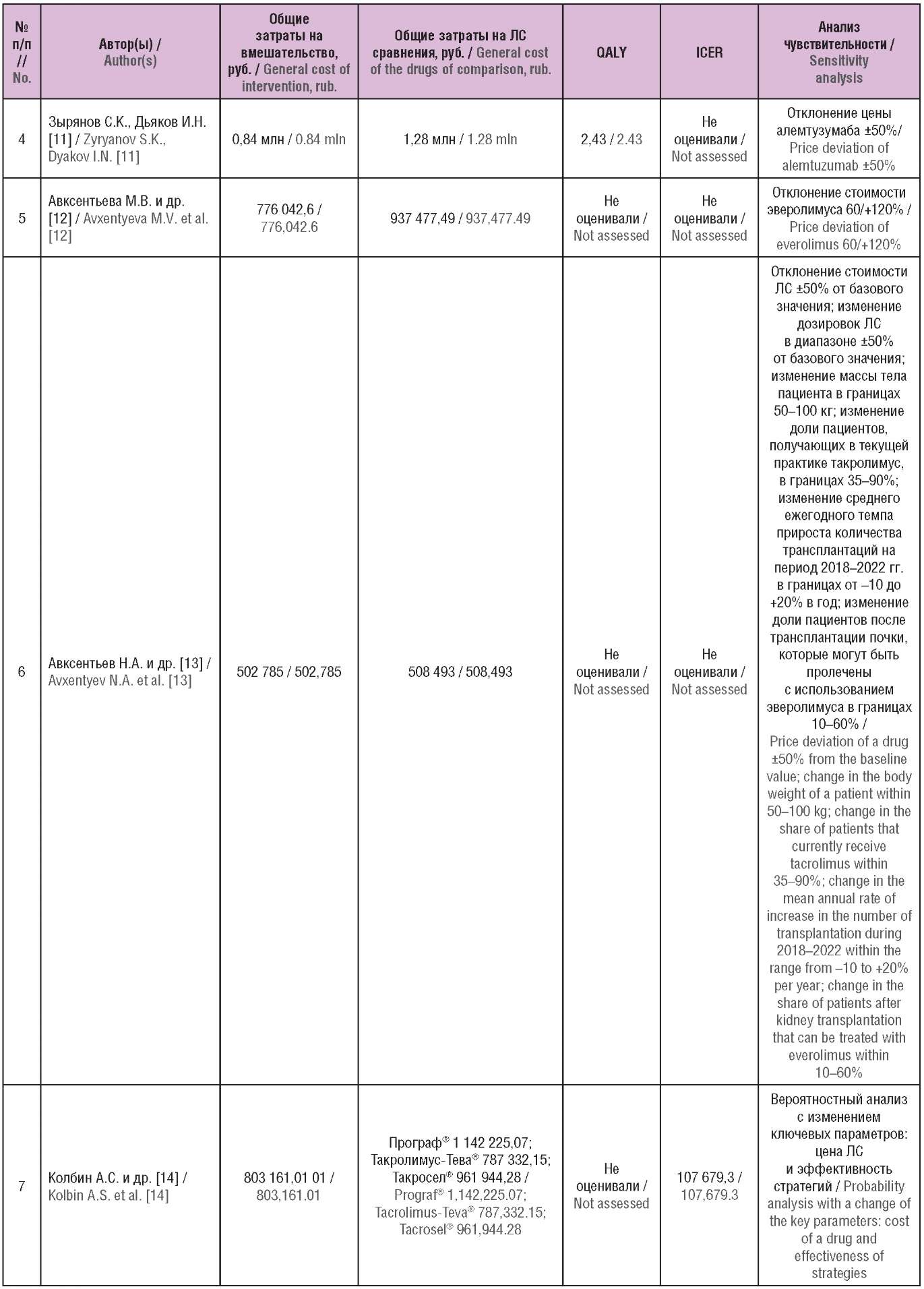
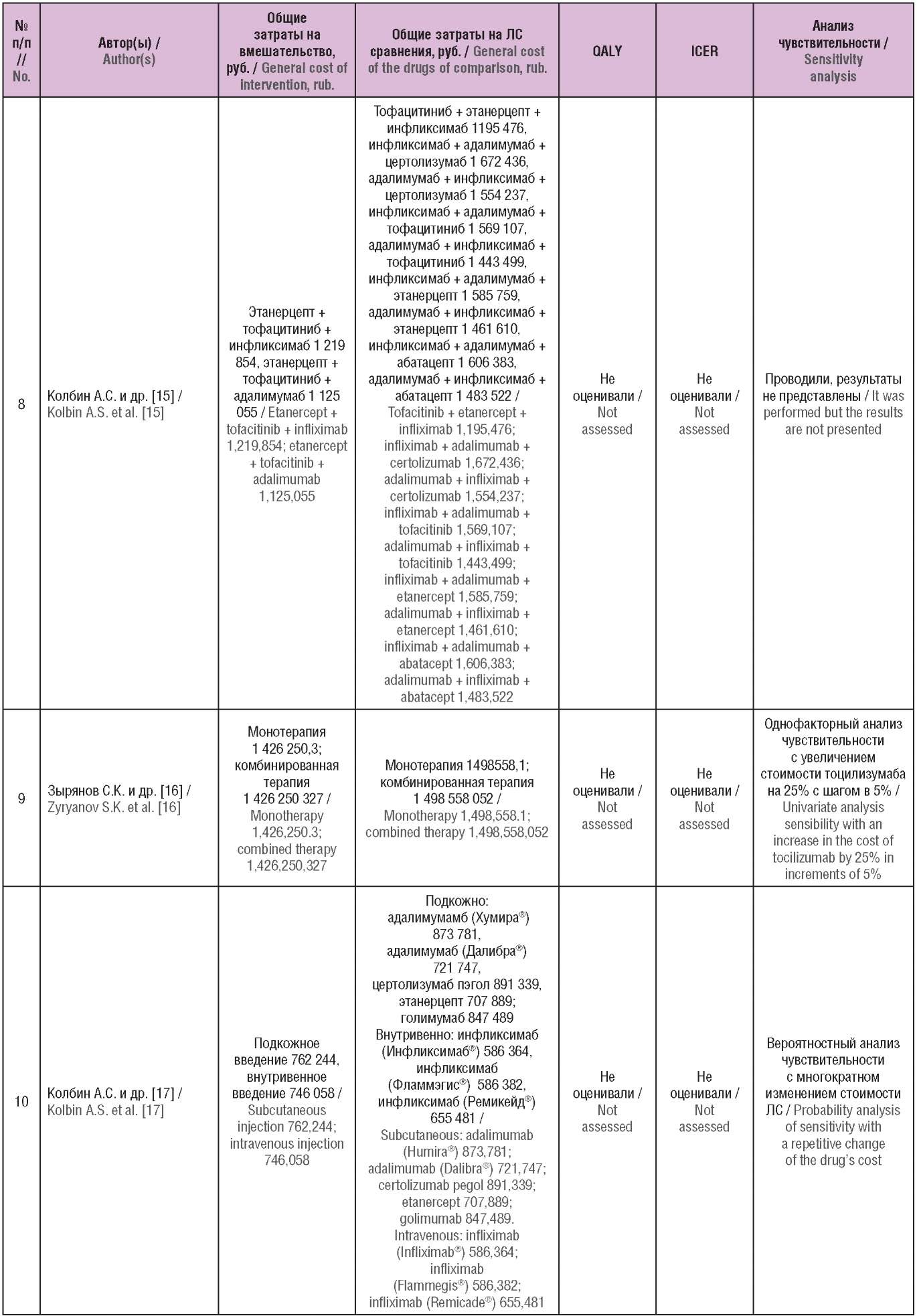
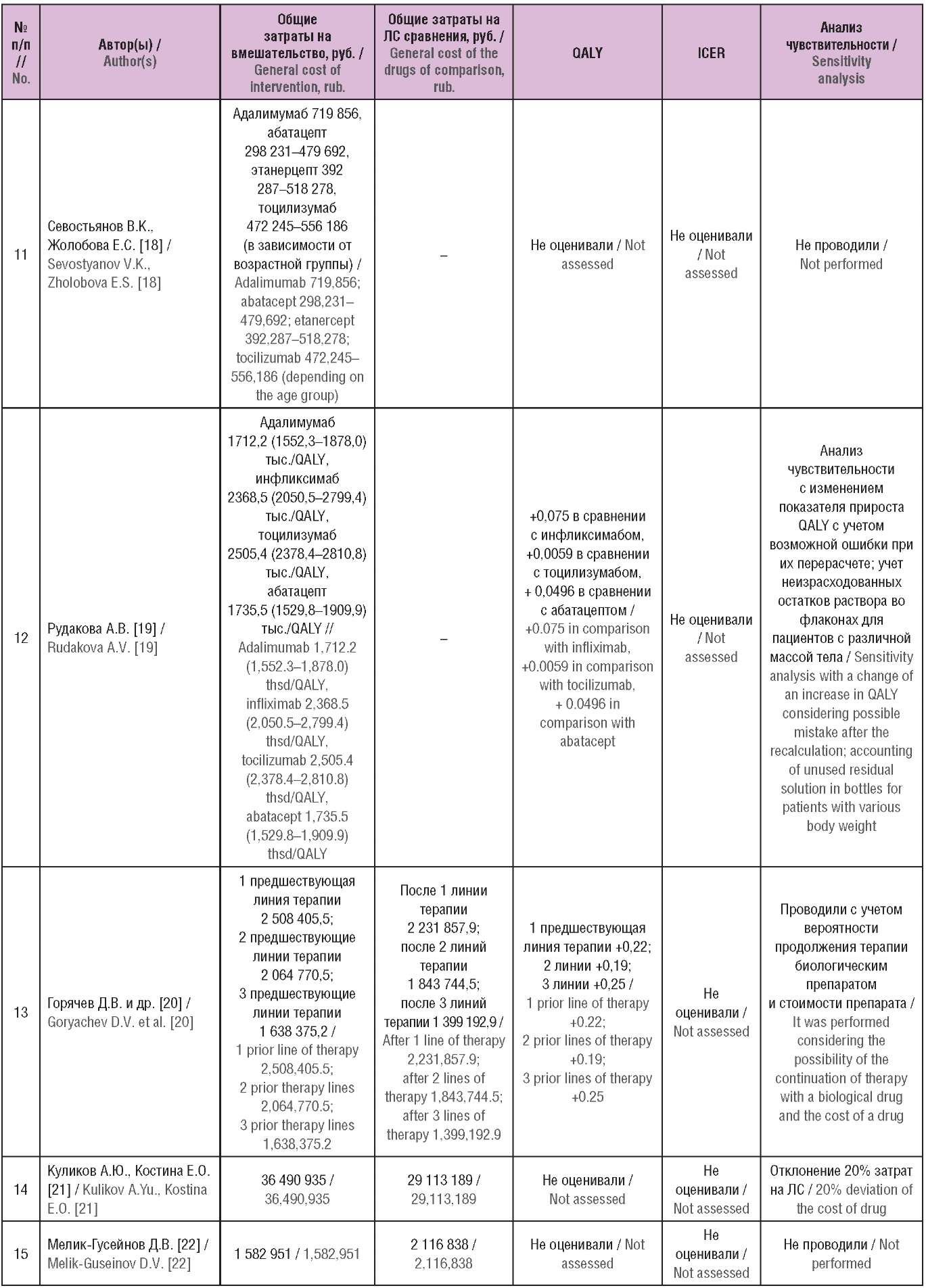
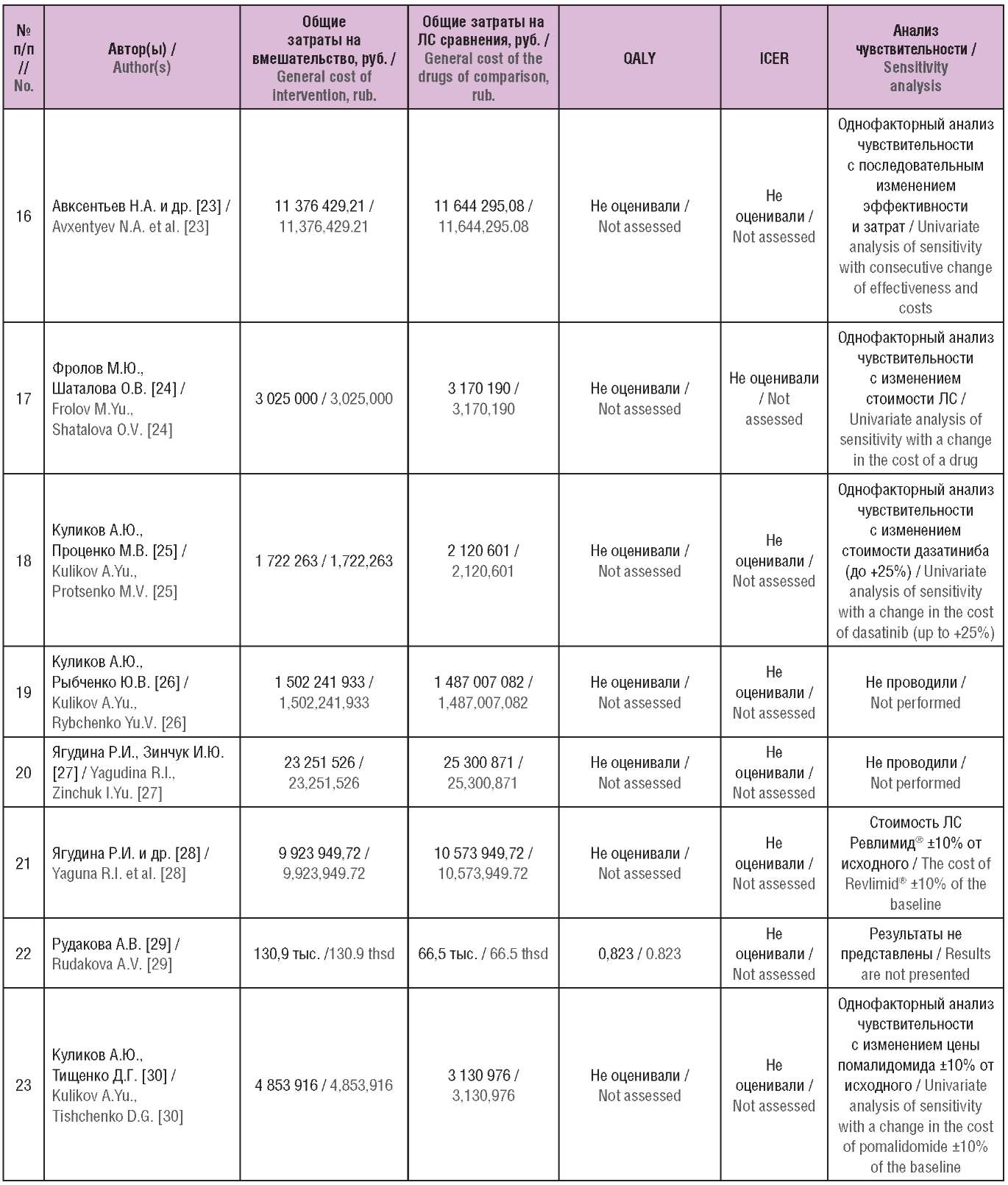
Примечание. ЛС – лекарственное средство; QALY (англ. quality-adjusted life year) – годы жизни с поправкой на качество; ICER (англ. incremental cost-effectiveness ratio) – инкрементальный показатель «затраты–эффективность».
Note. QALY – quality-adjusted life year; ICER – incremental cost-effectiveness ratio.
Таблица 3. Основные выводы и методологические проблемы
включенных исследований (опубликованы в Российской Федерации)
Table 3. The main conclusions and methodological problems
of the included studies (published in the Russian Federation)
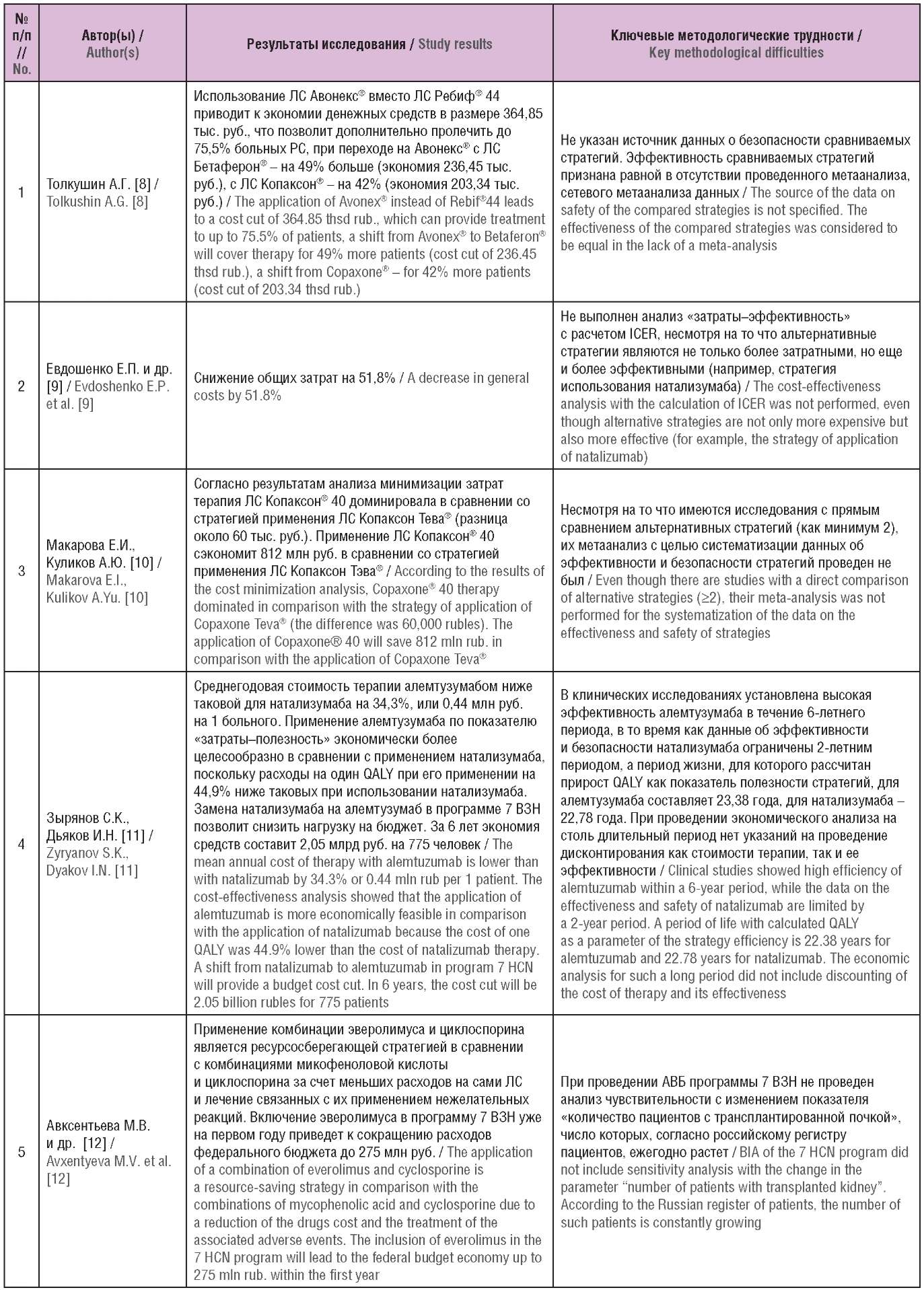
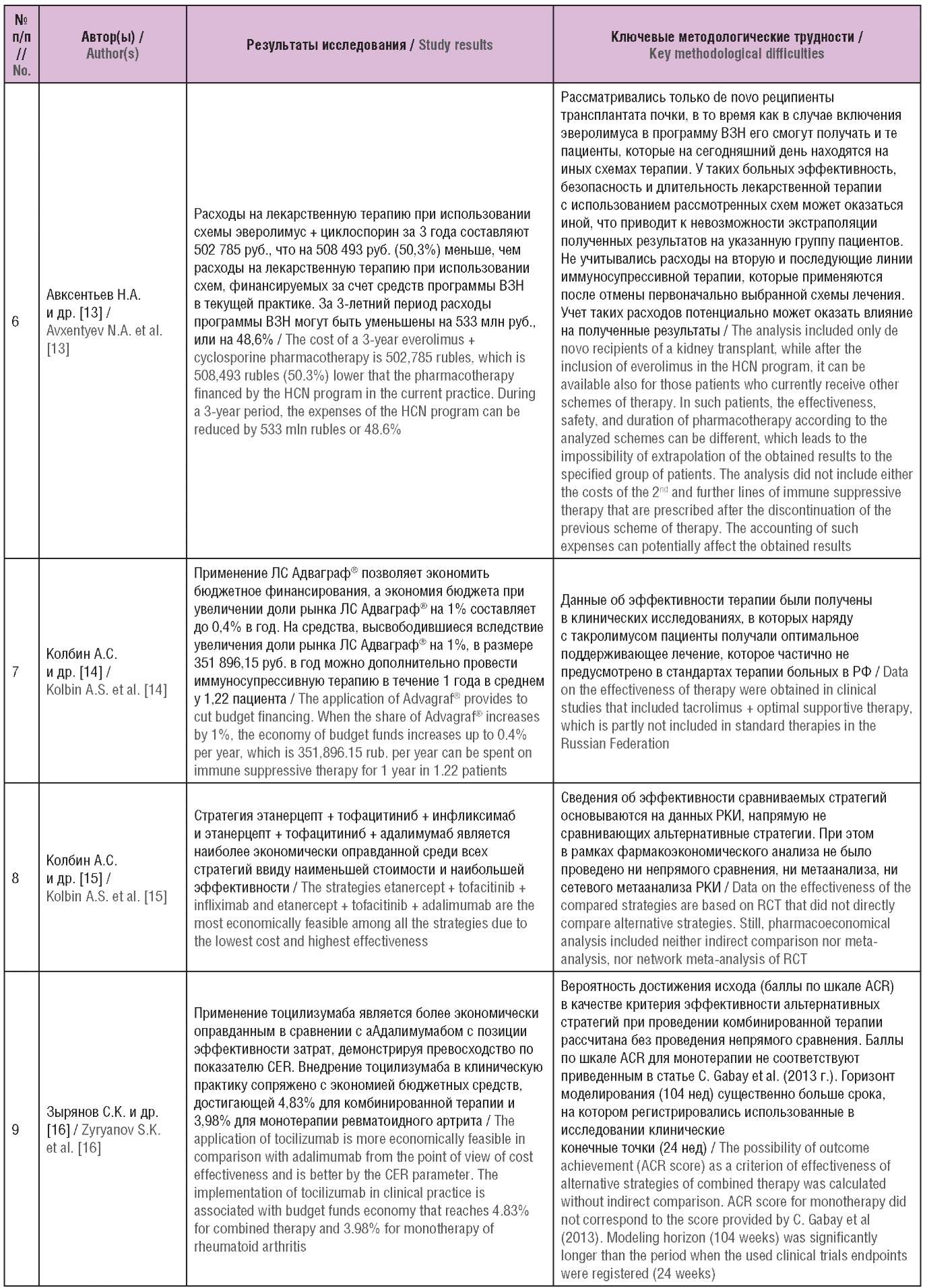
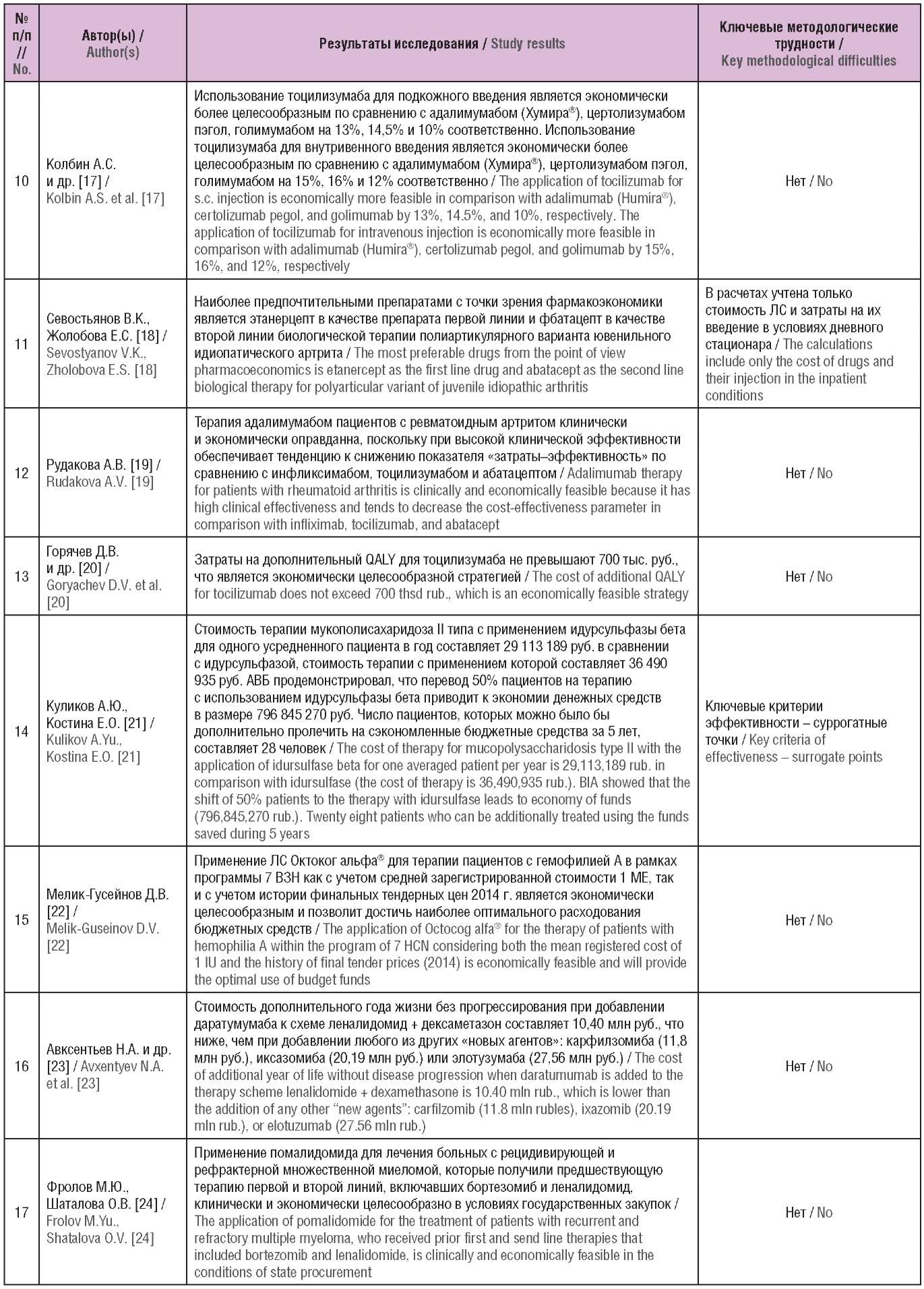

Примечание. ЛС – лекарственное средство; QALY (англ. quality-adjusted life year) – годы жизни с поправкой на качество; ВЗН – высокозатратные нозологии; ICER (англ. incremental cost-effectiveness ratio) – инкрементальный показатель «затраты–эффективность»; АВБ – анализ влияния на бюджет; МЕ – международная единица; ХМЛ – хронический миелолейкоз; РКИ – рандомизированное клиническое исследование; ACR (англ. American College of Rheumatology) – Американская коллегия ревматологов.
Note. QALY – quality-adjusted life year; HCN – high cost nosology; ICER – incremental cost-effectiveness ratio; BIA – budget impact analysis; IU – International Unit; CML – chronic myeloid leukemia; RCT – randomized clinical trial; ACR – American College of Rheumatology.
Основные проблемы обобщения и ограничения включенных исследований
В исследовании Е.П. Евдошенко [9] затраты на ведение больных рассчитывались на основании данных Московского фонда обязательного медицинского страхования (ОМС), доли пациентов и затраты – на основании данных 2016–2018 гг., при этом принято допущение, что заболеваемость рассеянным склерозом и стоимость услуг останутся неизменными. В модели не учитывалась инфляция и дисконтирование. В качестве источников данных о затратах в работе Е.И. Макаровой и А.Ю. Куликова [10] были использованы тарифы оказания медицинской помощи ОМС г. Москвы, стандарты оказания стационарной и амбулаторно-поликлинической помощи, а также зарегистрированные цены на ЛС по г. Москве. При оценке изменения расходов федерального бюджета вследствие включения эверолимуса в программу 7 ВЗН в исследовании М.В. Авксентьевой [12] не учитывались пациенты, которые уже получают эверолимус за счет региональных льгот. В работе В.К. Севостьянова и Е.С. Жолобовой [18] учтены тарифы на введение ЛС согласно Генеральному тарифному оглашению (г. Москва), отсутствует анализ чувствительности. Перерасчет показателей QALY в исследованиях А.В. Рудаковой [19] и Д.В. Горячева [20] проводился по формуле, использованной в Великобритании.
В рассмотренных клинико-экономических исследованиях лекарственных средств, входящих в федеральную программу высокозатратных нозологий А.Г. Толкушина [8], С.К. Зырянова и др. [11][16], Н.А. Авксентьева и др. [13][23], А.С. Колбина и др. [14][15][17], А.Ю. Куликова и др. [21][25][26][30], Д.В. Мелик-Гусейнова [22], М.Ю. Фролова и О.В. Шаталовой [24], Р.И. Ягудиной и др. [27][28] проблемы обобщения и ограничения не выявлены.
Общие выводы
Согласно данным, представленным на рисунке 2, наибольшее количество опубликованных в РФ фармакоэкономических исследований касалось множественной миеломы (5), ревматоидного артрита и рассеянного склероза (по 4). Из 23 исследований в 5 представлен только анализ «затраты–эффективность/ полезность», в 7 – анализ «затраты–эффективность/полезность» и АВБ, в 3 – только анализ минимизации затрат, в 5 – анализ минимизации затрат и АВБ, в 3 – только АВБ. Временной горизонт исследований составлял от 1 до 10 лет.
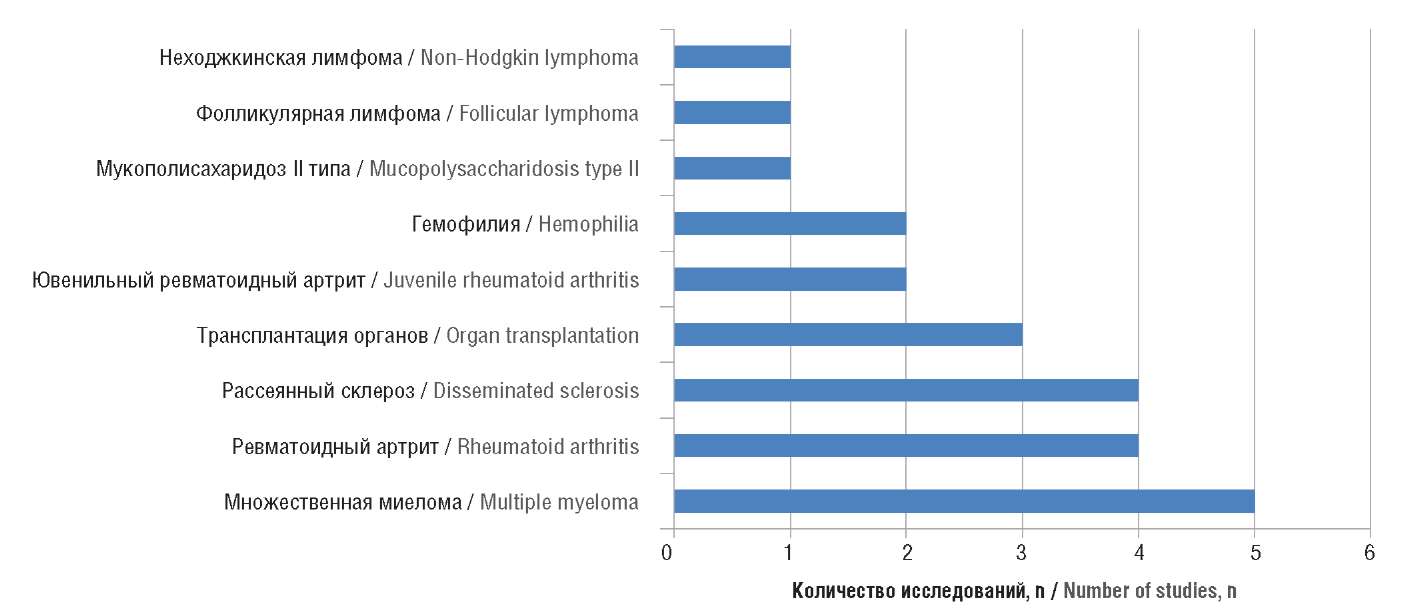
Рисунок 2. Распределение исследований, включенных в анализ, по нозологиям
(опубликованы в Российской Федерации)
Figure 2. Distribution of the studies included in the analysis according to nosologies
(published in the Russian Federation)
Только 4 из 23 включенных фармакоэкономических исследований были выполнены позднее 2018 г., когда были обновлены Методические рекомендации по проведению сравнительной клинико-экономической оценки лекарственного препарата и введено понятие референтного ICER [13][17][21][23]. При этом 3 из них проведены с помощью анализа минимизации затрат, 1 – с использованием анализа «затраты–эффективность», в котором новая стратегия (применение даратумумаба в составе комбинированной терапии у пациентов с множественной миеломой, ранее получавших лечение) была и более эффективной, и менее затратной. Таким образом, проанализировать значения стоимости дополнительной эффективности при включении ЛС в программу ВЗН в настоящее время не представляется возможным.
Показатель ICER оценивали в единственном исследовании и сравнивали его значение с порогом готовности общества платить [14]. В исследовании Е.П. Евдошенко и др. при разных стоимостях и эффективностях альтернативных стратегий не проведен анализ «затраты–эффективность» с расчетом ICER для натализумаба в сравнении с терифлуномидом, для которого продемонстрирована бо́льшая эффективность при наибольшей среди альтернативных стратегий стоимости [9].
Более половины рассмотренных фармакоэкономических исследований хронических инвалидизирующих заболеваний (12 из 23) имели горизонт моделирования 1 год (в одном исследовании 1,5 года).
Анализ чувствительности результатов в отобранных исследованиях более чем в 1/3 случаев учитывал только отклонение цены рассматриваемых стратегий (9 из 23 исследований), а в 1/4 случаев вообще не проводился.
Только в 4 исследованиях оценивали прирост лет качественной жизни, несмотря на то что для хронических инвалидизирующих заболеваний качество жизни – один из ключевых показателей, характеризующих ЛС [11][19][20][29].
Основными ограничениями для обобщения результатов исследований являлись использование региональных тарифов обязательного медицинского страхования, а для исследований полезности затрат – применение в качестве системы пересчета качества жизни пациентов в единицы QALY инструментов, разработанных и использованных в популяциях пациентов вне РФ. Ключевые методологические сложности относились как к оценке эффективности и безопасности сравниваемых стратегий [8][10][11][14][15,][16], так и к методическим ошибкам в проведении фармакоэкономического анализа (см. табл. 3) [9][11][18][27].
ОБСУЖДЕНИЕ / DISCUSSION
В настоящее время в РФ с целью обеспечения пациентов с жизнеугрожающими и хронически прогрессирующими заболеваниями инновационными и высокозатратными ЛС на государственном уровне формируют федеральные программы, одной из которых является программа ВЗН [1]. «Средний» пациент программы ВЗН в 2018 г. обходился федеральному бюджету в 1 052 530 руб., в 2020 г. – в 1 813 274 руб., что связано с переводом пациентов, страдающих орфанными заболеваниями, из региональной программы редких жизнеугрожающих заболеваний в федеральную программу высокозатратных нозологий [1]. Так, в 2019 г. в перечень ВЗН были включены 5 нозологий, ранее входивших в программу редких жизнеугрожающих заболеваний (табл. 4).
Таблица 4. Нозологии и лекарственные средства,
включенные в перечень высокозатратных нозологий в 2019 г.
Table 4. Nosology and drugs included in the list of high-cost nosologies in 2019

Для 7 ВЗН, которые были в действующем перечне в 2019 г., список ЛС пополнился даратумумабом – для больных злокачественными новообразованиями лимфоидной, кроветворной и родственных им тканей, алемтузумабом – для больных рассеянным склерозом, эверолимусом – для пациентов после трансплантации органов и (или) тканей. В 2021 г. в список 14 ВЗН включены эмицизумаб и симоктоког альфа, предназначенные для лечения гемофилии, а также окрелизумаб – для терапии рассеянного склероза.
Несмотря на то что в список ВЗН в период 2019–2021 гг. включено 15 новых ЛС, финансируемых из средств бюджета РФ, при поиске литературы обнаружено только 4 опубликованных фармакоэкономических исследования, выполненных в указанный период (27%).
Заболевания, при которых применяются ЛС из списка ВЗН, являются хроническими инвалидизирующими патологиями. Тем не менее согласно нашему обзору горизонт моделирования в клинико-экономических исследованиях в РФ более чем в половине из них составлял 1 год. Такой методологический подход явно недостаточен для оценки как клинических, так и экономических эффектов терапии хронических заболеваний. Одним из инструментов, который позволяет нивелировать имеющиеся ограничения сведений по отдаленным эффектам рассматриваемых схем терапии, может быть применение многофакторного анализа чувствительности результатов исследований с учетом отклонения не только цены исследуемых ЛС (как это было сделано в 1/3 публикаций, где этот анализ проводился), но и как минимум эффективности сравниваемых стратегий.
Отдельного внимания заслуживает вопрос выбора метода клинико-экономического анализа при оценке инновационных препаратов, в частности ЛС, применяемых при орфанных заболеваниях. Постановление Правительства РФ от 28 августа 2014 г. № 871 «Об утверждении Правил формирования перечней лекарственных препаратов для медицинского применения и минимального ассортимента лекарственных препаратов, необходимых для оказания медицинской помощи» предусматривает ряд четких критериев выбора ЛС сравнения при проведении клинико-экономического исследования. После выбора одного или нескольких ЛС сравнения необходимо обосновать выбор метода клинико-экономического исследования, который основывается на наличии или отсутствии статистически достоверной разницы в эффективности сравниваемых ЛС, однако в случае инновационных (в частности орфанных) ЛС зачастую исследования сравнительной эффективности могут вообще отсутствовать. Возможность проведения непрямых сравнительных исследований или сетевых сравнений также часто отсутствует ввиду особенностей дизайна клинических исследований инновационных ЛС, о которых уже говорилось выше. Таким образом, для инновационных ЛС критерии, предусмотренные Постановлением Правительства РФ от 28 августа 2014 г. № 871, нередко являются неприменимыми из-за невозможности сделать научно обоснованные выводы о сравнительной эффективности двух или более инновационных ЛС, что делает невозможным выбор метода клинико-экономического анализа. Среди представленных в таблице 1 клинико-экономических исследований 12 были выполнены методом оценки эффективности/полезности затрат. При этом лишь в 3 из них (25%) авторы приводят критерии выбора ЛС сравнения.
Важно понимать, что для хронических инвалидизирующих заболеваний ключевым интегративным показателем эффективности терапии является прирост лет качественной жизни. При этом одной из ключевых сложностей, связанных с оценкой качества жизни при анализе опубликованных фармакоэкономических исследований, является заимствование российскими исследователями инструментов для перерасчета показателей QALY, разработанных для других стран, ввиду отсутствия отечественных.
Необходимо отметить, что в оценке экономической эффективности инновационных ЛС имеются некоторые сложности. Прежде всего, это неопределенность в плане оценки клинической эффективности (малые выборки пациентов, зачастую недостаточные для статистического подтверждения разницы в эффективности с альтернативной стратегией, короткие сроки наблюдения, использование суррогатных конечных точек и т.д.) и экономической целесообразности их применения [31].
Безусловно, ретроспективный анализ исследований экономической эффективности применения инновационных ЛС, уже включенных в перечень ВЗН, принципиально важен в плане совершенствования подходов, позволяющих минимизировать возможность ошибки при прогнозировании экономических последствий внедрения как новых инновационных препаратов, так и в будущем прорывных медицинских технологий [31].
ЗАКЛЮЧЕНИЕ / CONCLUSION
В РФ в открытых источниках публикуется менее 30% результатов фармакоэкономических исследований ЛС, включенных в программу ВЗН, что не позволяет оценить фармакоэкономические подходы к формированию программы в полной мере. Для анализа эффективности инструментов, используемых при оценке экономической эффективности дорогостоящих медицинских технологий, какими являются, в частности, орфанные ЛС, требуется ретроспективный анализ проведенных исследований препаратов, включенных в перечень ВЗН.
Список литературы
1. Федеральный закон от 21.11.2011 № 323-ФЗ «Об основах охраны здоровья граждан в Российской Федерации». URL: https://base.garant.ru/12191967/ (дата обращения 20.07.2021).
2. Федеральный закон от 03.08.2018 № 299-ФЗ «О внесении изменений в Федеральный закон «Об основах охраны здоровья граждан в Российской Федерации». URL: https://base.garant.ru/72005588/ (дата обращения 20.07.2021).
3. Распоряжение Правительства РФ от 12.10.2019 №2406-р «Об утверждении перечня жизненно необходимых и важнейших лекарственных препаратов на 2020 год, перечня лекарственных препаратов для обеспечения лиц, больных гемофилией, муковисцидозом, гипофизарным нанизмом, болезнью Гоше, злокачественными новообразованиями лимфоидной, кроветворной и родственной им тканей, рассеянным склерозом, лиц после трансплантации органов и (или) тканей, перечня лекарственных препаратов для медицинского применения, в том числе лекарственных препаратов для медицинского применения, назначаемых по решению врачебных комиссий медицинских организаций, а также минимального ассортимента лекарственных препаратов, необходимых для оказания медицинской помощи». URL: https://base.garant.ru/72861778/ (дата обращения 20.07.2021).
4. Распоряжение Правительства РФ от 10.12.2018 №2738-р «Об утверждении перечня жизненно необходимых и важнейших лекарственных препаратов на 2019 год, а также перечней лекарственных препаратов для медицинского применения и минимального ассортимента лекарственных препаратов, необходимых для оказания медицинской помощи». URL: https://base.garant.ru/72123048/ (дата обращения 20.07.2021).
5. Приказ Министерства здравоохранения РФ от 15.02.2013 № 69н «О мерах по реализации постановления Правительства Российской Федерации от 26 апреля 2012 г. № 404 «Об утверждении Правил ведения Федерального регистра лиц, больных гемофилией, муковисцидозом, гипофизарным нанизмом, болезнью Гоше, злокачественными новообразованиями лимфоидной, кроветворной и родственных им тканей, рассеянным склерозом, лиц после трансплантации органов и (или) тканей». URL: http://base.garant.ru/70362290/ (дата обращения 20.07.2021).
6. Колбин А.С., Иванюк А.Б. Инновационные лекарственные сред ства и их место в системе лекарственного обеспечения. Политика и управление в здравоохранении. 2011; 1: 57–62.
7. Постановление Правительства РФ от 28.08.2014 № 871 «Об утверждении Правил формирования перечней лекарственных препаратов для медицинского применения и минимального ассортимента лекарственных препаратов, необходимых для оказания медицинской помощи». URL: https://base.garant.ru/70728348/ (дата обращения 20.07.2021).
8. Толкушин А.Г. Сравнительное фармакоэкономическое исследование препаратов, изменяющих течение рассеяного склероза (авонекс, бетаферон, ребиф, капаксон). ФАРМАКОЭКОНОМИКА. Современная фармакоэкономика и фармакоэпидемиология. 2008; 1 (1): 18–21.
9. Евдошенко Е.П., Солодун И.Ю., Башлакова Е.Е. и др. Анализ влияния предлагаемого включения препарата терифлуномид (Абаджио) в программу «7 высокозатратных нозологий» на бюджеты федеральных и региональных органов государственной власти российской федерации в сфере охраны здоровья для обеспечения лиц, больных рассеянным склерозом. Фармакоэкономика: теория и практика. 2016; 4 (2): 39–46. https://doi.org/10.30809/phe.2.2016.5.
10. Макарова Е.И., Куликов А.Ю. Фармакоэкономический анализ лекарственного средства Копаксон® 40 в лечении рассеянного склероза. Фармакоэкономика: теория и практика. 2016; 4 (3): 30–4.
11. Зырянов С.К., Дьяков И.Н. Клинико-экономическая оценка алемтузумаба при рецидивирующем-ремиттирующем рассеянном склерозе. Клиническая фармакология и терапия. 2017; 26 (2): 93–6.
12. Авксентьева М.В., Авксентьев Н.А., Фролов М.Ю., Деркач Е.В. Фармакоэкономическое исследование применения Эверолимуса для иммуносупрессивной терапии после пересадки почки. ФАРМАКОЭКОНОМИКА. Современная фармакоэкономика и фармакоэпидемиология. 2015; 8 (1): 7–17. https://doi.org/10.17749/2070-4909.2015.8.1.007-017.
13. Авксентьев Н.А., Деркач Е.В., Прокопенко Е.И. Фармакоэкономическое исследование применения эверолимуса для иммуносупрессивной терапии у de novo реципиентов почечного трансплантата в России. Вестник трансплантологии и искусственных органов. 2019; 21 (1): 23–34. https://doi.org/10.15825/1995-1191-2019-1-23-34.
14. Колбин А.С., Курылев А.А., Проскурин М.А., Балыкина Ю.Е. Фармакоэкономическая целесообразность применения такролимуса пролонгированного действия (Адваграф®) для профилактики и лечения отторжения трансплантата печени у взрослых пациентов. Клиническая фармакология и терапия. 2014; 23 (4): 103–8.
15. Колбин А.С., Курылев А.А., Проскурин М.А., Балыкина Ю. Е. Фармакоэкономический анализ лекарственных средств, применяемых в лечении ревматоидного артрита при неэффективности базовых противовоспалительных средств. ФАРМАКОЭКОНОМИКА. Современная фармакоэкономика и фармакоэпидемиология. 2016; 9 (3): 20–8. https://doi.org/10.17749/2070-4909.2016.9.3.020-028.
16. Зырянов С.К., Чеберда А.Е., Белоусов Д.Ю. Фармакоэкономический анализ применения препарата Актемра® в первой линии лечения ревматоидного артрита в режимах комбинированной и монотерапии. Качественная клиническая практика. 2016; 3: 22–34.
17. Колбин А.С., Курылев А.А., Мишинова С.А. и др. Фармакоэкономический анализ препарата тоцилизумаб при терапии пациентов с ревматоидным артритом и юношеским артритом с системным началом. Качественная клиническая практика. 2020; 1: 23–33. https://doi.org/10.37489/2588-0519-2020-1-23-33.
18. Севостьянов В.К., Жолобова Е.С. Клинико-экономический анализ применения генно-инженерных биологических препаратов в лечении полиартикулярного варианта ювенильного идиопатического артрита. Русский медицинский журнал. 2017; 25 (19): 1385–90.
19. Рудакова А.В. Фармакоэкономические аспекты применения биологических препаратов в терапии ревматоидного артрита. Медицинские технологии: оценка и выбор. 2012; 2: 30–3.
20. Горячев Д.В., Эрдес Ш.Ф, Насонов Е.Л. Фармакоэкономический анализ применения тоцилизумаба в терапии ревматоидного артрита. Имитационное моделирование. Научно-практическая ревматология. 2010; 48 (20): 87–102.
21. Куликов А.Ю., Костина Е.О. Фармакоэкономическая оценка препаратов, используемых при ферментной заместительной терапии в лечении мукополисахаридоза II типа. Оригинальные исследования. Фармакоэкономика: теория и практика. 2019; 7 (2): 10–5. https://doi.org/10.30809/phe.2.2019.2.
22. Мелик-Гусейнов Д.В. Оценка влияния на бюджет применения рекомбинантных факторов свертывания крови VIII у пациентов с гемофилией А. Фармакоэкономика: теория и практика. 2015; 3 (3): 118–22.
23. Авксентьев Н.А., Деркач Е.В., Макаров А.С. Клинико-экономическое исследование даратумумаба в составе комбинированной терапии у пациентов с множественной миеломой, ранее получавших лечение. Медицинские технологии. Оценка и выбор. 2019; 4: 62–75. https://doi.org/10.31556/2219-0678.2019.38.4.062-075.
24. Фролов М.Ю., Шаталова О.В. Фармакоэкономическая оценка применения помалидомида (Имновид) для лечения больных с рецидивирующей и рефрактерной множественной миеломой. ФАРМАКОЭКОНОМИКА. Современная фармакоэкономика и фармакоэпидемиология. 2017; 10 (2): 53–61. https://doi.org/10.17749/2070-4909.2017.10.2.053-061.
25. Куликов А.Ю., Проценко М.В. Фармакоэкономическая оценка применения препарата дазатиниб в терапии второй линии пациентов с хроническим миелоидным лейкозом. Фармакоэкономика: теория и практика. 2015; 3 (2): 88–91.
26. Куликов А. Ю., Рыбченко Ю.В. Фармакоэкономический анализ применения препарата Мабтера® (ритуксимаб) для подкожного введения в сравнении с внутривенной лекарственной формой у больных с фолликулярной лимфомой. Фармакоэкономика: теория и практика. 2015; 3 (2): 14–6.
27. Ягудина Р.И., Зинчук И.Ю. Фармакоэкономический анализ включения в схемы лечения ингибиторной формы гемофилии А лекарственного средства антиингибиторный коагулянтный комплекс (АИКК). ФАРМАКОЭКОНОМИКА. Современная фармакоэкономика и фармакоэпидемиология. 2013; 6 (4): 7–12.
28. Ягудина Р.И., Куликов А.Ю., Мисикова Б.Б. Фармакоэкономическая оценка использования лекарственного средства Ревлимид (леналидомид) для лечения больных с множественной миеломой. ФАРМАКОЭКОНОМИКА. Современная фармакоэкономика и фармакоэпидемиология. 2012; 5 (1): 13–9.
29. Рудакова А.В. Эффективность затрат на бендамустин в терапии индолентных неходжкинских лимфом. ФАРМАКОЭКОНОМИКА. Современная фармакоэкономика и фармакоэпидемиология. 2011; 4 (3): 23–7.
30. Куликов А.Ю., Тищенко Д.Г. Фармакоэкономическая оценка использования лекарственного средства помалидомид (Имновид) для лечения больных с рецидивирующей и рефрактерной множественной миеломой, получивших не менее двух линий терапии, включавших леналидомид и бортезомиб. Фармакоэкономика: теория и практика. 2016; 4 (1): 148–56.
31. Lloyd-Williams H. A systematic review of economic evaluations of advanced therapy medicinal products. Br J Clin Pharmacol. 2021; 87 (6): 2428–43. https://doi.org/10.1111/bcp.14275.
Об авторах
А. С. КолбинРоссия
д.м.н., профессор, заведующий кафедрой клинической фармакологии и доказательной медицины, ул. Льва Толстого, д. 6-8, Санкт-Петербург 197022;
профессор кафедры клинической фармакологии, Университетская наб., д. 7-9, Санкт-Петербург 199034
Ю. М. Гомон
Россия
д.м.н., доцент кафедры клинической фармакологии и доказательной медицины, ул. Льва Толстого, д. 6-8, Санкт-Петербург 197022;
врач – клинический фармаколог, Северный пр-т, д. 1, Санкт-Петербург 194354
А. Р. Касимова
Россия
к.м.н., ассистент кафедры клинической фармакологии и доказательной медицины, ул. Льва Толстого, д. 6-8, Санкт-Петербург 197022;
врач – клинический фармаколог, ул. Академика Байкова, д. 8, Санкт-Петербург 195427
А. А. Курылев
Россия
к.м.н., ассистент кафедры клинической фармакологии и доказательной медицины,
ул. Льва Толстого, д. 6-8, Санкт-Петербург 197022
А. Э. Бем
Россия
к.м.н., научный сотрудник кафедры клинической фармакологии и доказательной медицины,
ул. Льва Толстого, д. 6-8, Санкт-Петербург 197022
Рецензия
Для цитирования:
Колбин А.С., Гомон Ю.М., Касимова А.Р., Курылев А.А., Бем А.Э. Реальная практика проведения клинико-экономических исследований лекарственных средств, входящих в федеральную программу высокозатратных нозологий. ФАРМАКОЭКОНОМИКА. Современная фармакоэкономика и фармакоэпидемиология. 2022;15(1):87-105. https://doi.org/10.17749/2070-4909/farmakoekonomika.2022.107
For citation:
Kolbin A.S., Gomon Yu.M., Kasimova A.R., Kurylev A.A., Bem A.E. The real practice of clinical and economic research of drugs included in the Federal Program of High-Cost Nosologies. FARMAKOEKONOMIKA. Modern Pharmacoeconomics and Pharmacoepidemiology. 2022;15(1):87-105. (In Russ.) https://doi.org/10.17749/2070-4909/farmakoekonomika.2022.107

Контент доступен под лицензией Creative Commons Attribution-NonCommercial-ShareAlike 4.0 International License.






































