Перейти к:
Фармакоэкономический анализ препарата Монофер для использования у пациентов с железодефицитной анемией в рамках оказания медицинской помощи по программе госгарантий в условиях системы здравоохранения Российской Федерации
https://doi.org/10.17749/2070-4909/farmakoekonomika.2022.124
Аннотация
Цель: сравнительный фармакоэкономический анализ препаратов железа для внутривенного введения для лечения железодефицитной анемии (ЖДА) в рамках концепции менеджмента крови пациента.
Материал и методы. Фармакоэкономическое исследование с ретроспективным дизайном выполнено с использованием методов анализа эффективности, затрат и соотношения «затраты–эффективность». Проведено сравнение препаратов олигоизомальтозного железа [III] (Монофер) и карбоксимальтозного железа [III] (Феринжект®).
Результаты. В целом Монофер и Феринжект® характеризуются сопоставимой эффективностью по показателям гематологического ответа. С помощью дозиологической модели повышения уровней гемоглобина в крови в динамике лечения рассматриваемыми препаратами рассчитаны частоты гематологического ответа (Монофер – 79%, Феринжект® – 70%). Затраты на лечение одного пациента со средней массой тела 88,3 кг и исходным уровнем гемоглобина 100 г/л составили 13 043 руб. для препарата Монофер и 15 618 руб. для препарата Феринжект®. Значения показателя «затраты–эффективность», вычисленные в соответствии с критерием эффективности гематологического ответа, составили 16 510 руб. (Монофер) и 22 312 руб. (Феринжект®), что позволяет рассматривать препарат Монофер как строго предпочтительный. На примере колоректальной хирургии показано, что использование данного препарата в менеджменте крови пациентов позволяет сократить общие затраты на лечение (в частности, за счет снижения требуемого числа порций эритроцитарной массы).
Заключение. Более широкое использование препаратов железа для внутривенного введения при ЖДА обладает обоснованными экономическими преимуществами. Препарат олигоизомальтозного железа Монофер является строго предпочтительным по отношению к препарату карбоксимальтозного железа.
Ключевые слова
Для цитирования:
Ягудина Р.И., Куликов А.Ю., Серпик В.Г., Громова О.А., Торшин И.Ю. Фармакоэкономический анализ препарата Монофер для использования у пациентов с железодефицитной анемией в рамках оказания медицинской помощи по программе госгарантий в условиях системы здравоохранения Российской Федерации. ФАРМАКОЭКОНОМИКА. Современная фармакоэкономика и фармакоэпидемиология. 2022;15(1):73-86. https://doi.org/10.17749/2070-4909/farmakoekonomika.2022.124
For citation:
Yagudina R.I., Kulikov A.Yu., Serpik V.G., Gromova O.A., Torshin I.Yu. Pharmacoeconomic analysis of using Monofer in patients with iron deficiency anemia as part of the provision of medical care under the state guarantees program in the health care system of the Russian Federation. FARMAKOEKONOMIKA. Modern Pharmacoeconomics and Pharmacoepidemiology. 2022;15(1):73-86. (In Russ.) https://doi.org/10.17749/2070-4909/farmakoekonomika.2022.124
ВВЕДЕНИЕ / INTRODUCTION
Железодефицитные состояния отмечаются у пациентов с онкологическими заболеваниями (40%), при воспалительных заболеваниях кишечника (45%) и у большинства пациентов с хронической болезнью почек (ХБП) или хронической сердечной недостаточностью. Внутривенное введение препаратов железа широко используется для лечения железодефицитной анемии (ЖДА) в случаях, когда их пероральный прием плохо переносится или характеризуется сниженной эффективностью. Внутривенное введение препаратов железа показано пациентам в пре- и постоперационном периодах, в реанимации, при наличии хронической патологии почек и др. Особенно остро проблема железодефицитных состояний проявляется в хирургии и акушерстве [1].
ЖДА является самостоятельным фактором, оказывающим выраженное негативное воздействие на исходы лечения [2–4]. Внимание медицинского сообщества к проблеме терапии ЖДА выражается не только в разработке соответствующих клинических руководств, но и в создании концепции так называемого менеджмента крови пациента в соответствии с рекомендациями Всемирной ассамблеи здравоохранения – высшего руководящего органа Всемирной организации здравоохранения (ВОЗ). Под менеджментом крови пациента понимается научно-обоснованный комплекс мер по улучшению исходов терапевтического и хирургического лечения путем рационального использования имеющихся ресурсов. Такие меры включают минимизацию объема гемотрансфузий и кровопотерь пациента (в т.ч. посредством эффективной коагуляции крови), снижение риска осложнений при проведении гемотрансфузии, оптимизацию эритропоэза/тромбобопоэза, а также компенсацию железодефицитных состояний [2].
Восполнение уровня железа в организме человека можно проводить посредством назначения лекарственных препаратов (ЛП) железа и гемотрансфузий [3]. Лекарственные формы препаратов железа делятся на пероральные и парентеральные (точнее, инфузионные). Например, при достаточном запасе времени перед операцией больному заблаговременно назначаются пероральные ЛП железа. Парентеральные ЛП железа используются при непереносимости или низкой эффективности пероральных форм у пациента, при наличии противопоказаний к их применению, а также в случаях, когда требуется быстрое поднятие уровня железа в крови (например, в послеоперационный период).
Для терапии ЖДА необходимо использовать эффективные и безопасные препараты железа. Достаточно популярным заблуждением является утверждение о том, что ЛП для лечения ЖДА просто должен «содержать железо, неважно в какой форме». Подобного рода ошибки возникают на почве глубоких пробелов в экспериментальной и клинической фармакологии железа [5].
В частности, использование устаревших форм железа 1-го поколения (таких, как неорганические сульфат, хлорид или оксиды железа) связано со значительными побочными эффектами. Среди этих устаревших форм сульфат железа отличается максимальной токсичностью. Например, еще в 1991 г. Американская академия клинической токсикологии (англ. American Academy of Clinical Toxicology) сообщила о 3 578 случаях отравления сульфатом железа у детей до 6 лет. При этом летальность составила 25% [6].
Хотя в упомянутом исследовании речь идет о сверхвысоких дозах сульфата железа (граммы), многочисленные работы показали, что токсические эффекты перорального приема этой формы наблюдаются и при гораздо меньших дозах. В базе данных PubMed/MEDLINE за период с 1983 по 2021 гг. содержится 350 исследований, сообщающих о нежелательных побочных явлениях и осложнениях при приеме сульфата железа (железного купороса). Побочные эффекты наблюдались в очень широком диапазоне клинических проявлений: от диареи и тошноты до аллергии и анафилактического шока. Пероральный прием сульфата железа может вызывать повреждения пищевода, боли в эпигастрии, язвенные повреждения мукозного слоя желудка, ульцерацию ротовой полости, провоцировать инфекционные заболевания, сыпь на коже, тератогенез, неврологические нарушения. Такая «терапия» может приводить к усилению кровоточивости слизистой желудочно-кишечного тракта и дальнейшим потерям железа через микрокровоизлияния [5].
Сравнительное исследование физико-химических свойств декстрана железа (КосмоФер), глюконата натрия и железа (Феррлецит®), сахарозного железа (Венофер®), карбоксимальтозного железа (Феринжект®), ферумокситола (Ферагем®) и изомальтозного железа (Монофер) показало, что эти продукты заметно различаются по среднему размеру частиц (в 2–2,5 раза), содержанию свободного/лабильного железа и степени высвобождения железа в сыворотке крови. Данные ядерного магнитного резонанса на ядрах углерода-13 (13С-ЯМР) препарата Монофер продемонстрировали уширение линий, соответствующих сигналам от различных атомов углерода в составе изомальтозы (C1, C5, C6 и, в меньшей степени, C2 и C3), и снижение интенсивности соответствующих линий. Данные ЯМР позволяют утверждать, что комплексообразование между изомальтозой и ионом железа III происходит в особой полости, образованной цепями изомальтозного полимера (рис. 1). Благодаря такому связыванию Монофер характеризуется очень низким иммуногенным потенциалом и крайне низким содержанием лабильного и свободного железа. Это позволяет ему быть, пожалуй, единственным препаратом железа для быстрого внутривенного введения в высоких дозах [7].
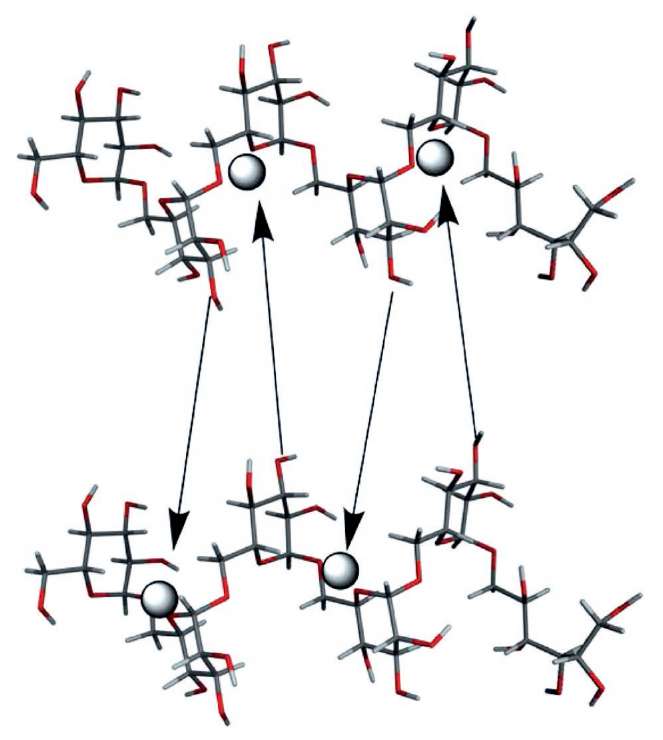
Рисунок 1. Схематическое изображение сайта комплексообразования железа
в составе изомальтозного комплекса Монофер
(по данным ядерного магнитного резонанса на ядрах углерода-13)
Figure 1. Schematic representation of the iron complexation site
in the Monofer isomaltose complex
(according to nuclear magnetic resonance at carbon-13 nuclei)
Помимо клинических аспектов различных методов коррекции железодефицитных состояний в современном здравоохранении уделяется большое внимание их экономическим аспектам. Наличие множественного выбора ставит перед организаторами здравоохранения задачу определения наилучшего варианта лечения среди возможных альтернатив с точки зрения как клинической эффективности, так и оптимального использования ресурсов системы. Общепринятым инструментом для решения поставленной задачи является проведение сравнительного фармакоэкономического анализа.
Цель – сравнительный фармакоэкономический анализ препаратов железа для внутривенного введения для лечения ЖДА в рамках концепции менеджмента крови пациента.
МАТЕРИАЛ И МЕТОДЫ / MATERIAL AND METHODS
Этапы исследования / Study stages
Анализ включал два основных этапа. На первом этапе был определен фармакоэкономически предпочтительный ЛП железа для коррекции железодефицитных состояний. Определение проводилось по данным клинических исследований карбоксимальтозного и изомальтозного трехвалентного железа, результатам сравнительных анализов эффективности этих форм. На втором этапе проведена фармакоэкономическая экспертиза использования выбранного ЛП железа в сравнении с применением гемотрансфузий в рамках концепции менеджмента крови пациентов.
Методы анализа / Methods of analysis
Фармакоэкономическая оценка включала анализ эффективности, анализ затрат, анализ «затраты–эффективность», анализ минимизации затрат. Фармакоэкономический анализ имел ретроспективный дизайн, в соответствии с которым материалами исследования являлись опубликованные результаты клинических исследований, систематических обзоров, метаанализов и непрямых сравнений, а также инструкции по применению изучаемых ЛП, соответствующие клинические рекомендации и прайс-листы, находящиеся в открытом доступе [4].
Выбор объектов исследования / Selection of study objects
В настоящее время в России зарегистрировано четыре международных непатентованных наименования (МНН) парентеральных ЛП железа, из которых три были включены в перечень жизненно необходимых и важнейших лекарственных препаратов (ЖНВЛП) (табл. 1) [8].
Таблица 1. Зарегистрированные в России
международные непатентованные наименования (МНН)
парентеральных лекарственных препаратов железа
Table 1. International nonproprietary names (INN)
of parenteral iron drugs registered in Russia
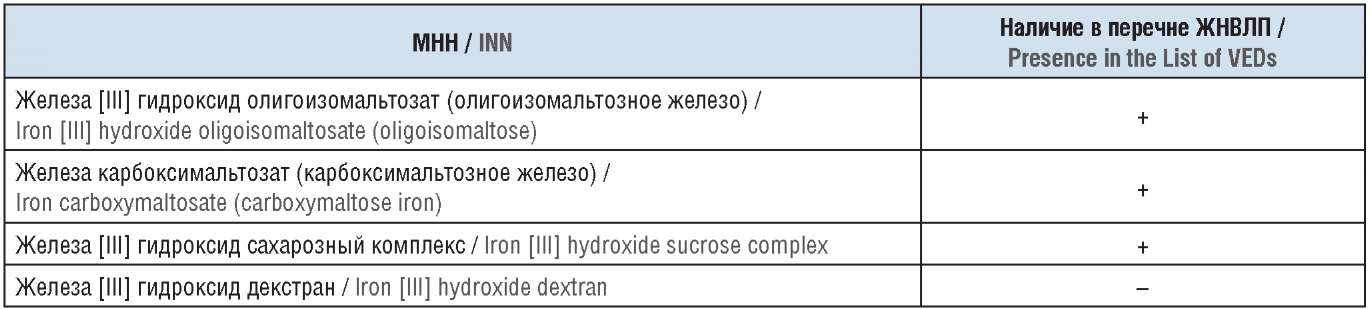
Примечание. ЖНВЛП – жизненно необходимые и важнейшие лекарственные препараты.
Note. VEDs – vital and essential drugs.
Для трех МНН, включенных в перечень ЖНВЛП, ранее были проведены и опубликованы исследования и систематические обзоры их эффективности и безопасности. Результаты сравнительных анализов (работы M. Gordon et al. (2021 г.) [9], H.W. Shin et al. (2021 г.) [10], А. Aksan et al. (2017 г.) [11] и R.F. Pollock et al. (2019 г.) [12]) свидетельствуют о преимуществе в клинической эффективности ЛП на основе олигоизомальтозного и карбоксимальтозного железа перед ЛП на основе гидроксид сахарозного комплекса железа.
Эта информация определила выбор ЛП на основе олигоизомальтозного и карбоксимальтозного железа в качестве объектов исследования. Важным аргументом в поддержку указанного выбора являлся тот факт, что препараты на основе этих двух действующих начал занимают большую долю в структуре потребления парентеральных ЛП железа [13]. Данные о соответствующих ЛП приведены в таблице 2 [8]. Сведения о стоимости изученных ЛП и соответствующих фармакоэкономических моделях были взяты из различных источников [14–21].
Таблица 2. Информация о включенных в фармакоэкономический анализ препаратах
Table 2. Information about the drugs included in the pharmacoeconomic analysis
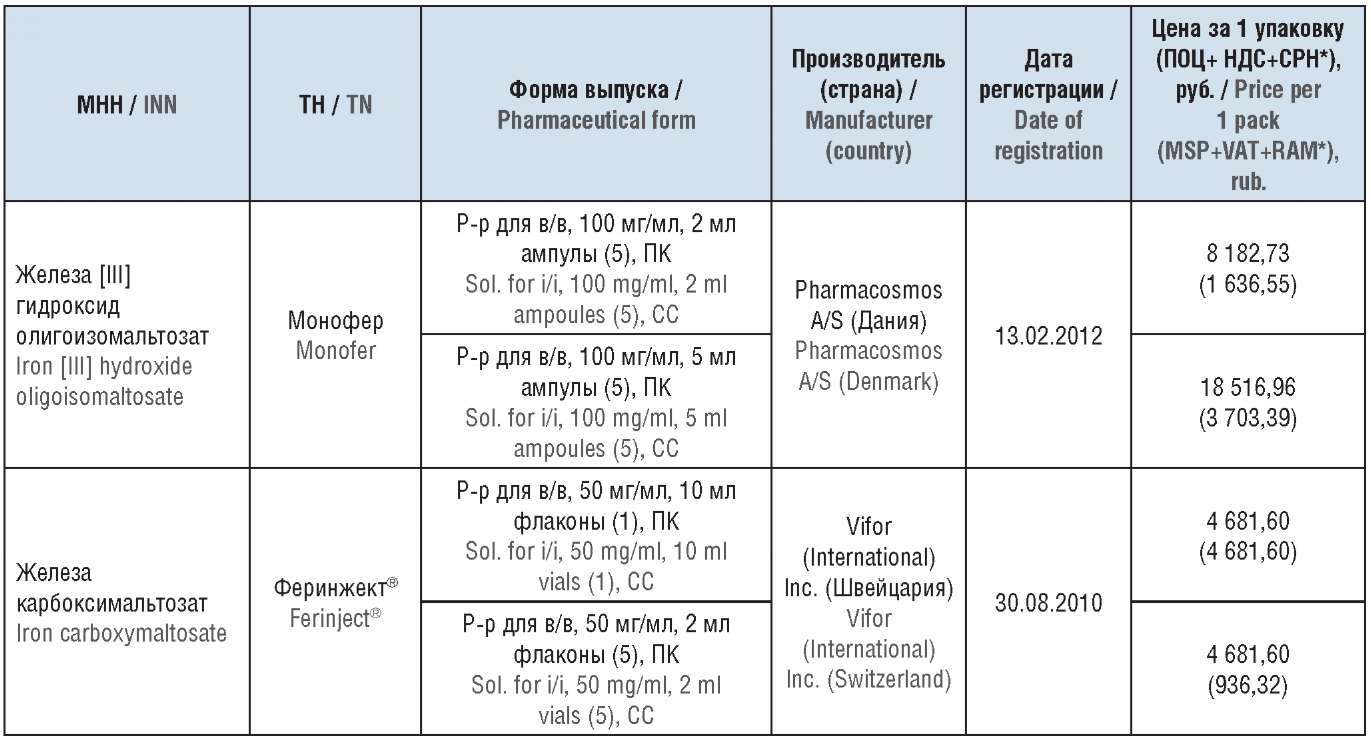
Примечание. МНН – международное непатентованное наименование; ТН – торговое наименование; р-р для в/в – раствор для внутривенного введения; ПК – пачки картонные; ПОЦ – предельная отпускная цена; НДС – налог на добавленную стоимость; СРН – средняя региональная надбавка. * Предельная отпускная цена производителя приводится с НДС и оптовой надбавкой как цена ампулы/флакона.
Note. INN – international nonproprietary name; TN – trade name; sol. for i/i – solution for intravenous infusion; CC – cardboard carton; MSP – maximum selling price; VAT – value added tax; RAM – regional average mark-up. * Manufacturer's maximum selling price is given with VAT and wholesale mark-up as ampoule/vial price.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ / RESULTS AND DISCUSSION
Обзор клинических исследований карбокcимальтозного железа / Review of clinical studies of carboxymaltose iron
Карбоксимальтозное железо (внутривенное введение) сравнивалось с сульфатом железа (per os) в терапии пациентов с ЖДА на фоне воспалительного заболевания кишечника (n=200). Пациенты были рандомизированы на группы получения карбоксимальтозного железа (1 000 мг инфузии с интервалами 1 нед до достижения рассчитанного для пациента общего дефицита железа – в среднем 2 000 мг) и сульфата железа (100 мг/сут, 12 нед). Уровни гемоглобина повысились от 87 до 123 г/л в группе карбоксимальтозного железа и от 91 до 121 г/дл в группе сульфата железа, что свидетельствует о сравнимой эффективности обоих подходов (р=0,69). В то же время число связанных с лечением нежелательных явлений, которые привели к прекращению приема лекарств, составило 1,5% в группе карбоксимальтозного железа и 7,9% в группе сульфата железа [22].
Эффективность внутривенного введения карбоксимальтозного железа была оценена в исследовании пациентов с опухолями желудочно-кишечного тракта, получающих химиотерапию и страдающих ЖДА. Помимо статистически значимого увеличения среднего уровня гемоглобина (от 103 до 112 г/л) и сывороточного железа (от 42 до 60 мг/мл) наблюдалось повышение уровня ферритина (от 230 до 877 нг/мл) [23].
Следует отметить, что уровень ферритина в крови является маркером не только обмена железа, но и воспаления [24]. Поскольку ферритин – белок острой фазы воспаления (наряду с С-реактивным белком, интерлейкинами ИЛ-1β, ИЛ-6), при наличии инфекции (в т.ч. при COVID-19 и других вирусных пневмониях) концентрация ферритина резко возрастает. Ферритин повышается при патологии печени, аутоиммунных и опухолевых заболеваниях, при гемофагоцитарном лимфогистиоцитозе. Высокие уровни ферритина могут указывать на активный цитолиз (например, массовая гибель эритроцитов, гепатоцитов и других типов клеток при COVID-19) [25].
Исследована эффективность и безопасность внутривенного введения карбоксимальтозного железа пациентам старше 75 лет с ЖДА (n=51). В соответствии с критериями ВОЗ, диагноз ЖДА ставился при сниженном гемоглобине (менее 130 г/л для мужчин и менее 120 г/л для женщин) на фоне низкого насыщения трансферрина (менее 20%). Средняя кумулятивная доза внутривенного карбоксимальтозного железа составила 784,4±271,7 мг (1–3 инфузии), 18 (47%) больных соответствовали критериям ответа на лечение (повышение гемоглобина на 10 г/л и более между исходным уровнем и выпиской из стационара) [26].
У пациентов с колоректальным раком (n=20) показана клиническая эффективность внутривенного введения карбоксимальтозного железа при наличии ЖДА накануне операции. Уровень гемоглобина увеличился на 18 г/л (р<0,001). При этом у больных, ответивших на терапию, отмечены более высокие уровни эритропоэтина (р<0,01) и более низкие значения гемоглобина, трансферрина и С-реактивного белка (р<0,05) [27].
В метаанализе 14 исследований была сделана попытка проиллюстрировать эффективность и безопасность внутривенного введения карбоксимальтозного железа [28]. Однако данная публикация [28] содержит многочисленные ошибки не только в фармакологии (игнорирование дозировок, форм перорального железа, различий в протоколах применения перорального и внутривенного железа и др.), но и в анализе собранных данных (неверно определены первичные точки и другие исходы, отсутствует анализ однородности групп пациентов, нет стратификационного анализа, допущены статистические ошибки и т.д.).
Симптоматическая гипофосфатемия после внутривенной терапии карбоксимальтозным железом – эффект, мало известный среди врачей. В информационном листе с маркировкой продукта упоминается, что гипофосфатемия может быть побочным эффектом, но также говорится, что этот побочный эффект обычно преходящий и бессимптомный. Тем не менее заметим, что тяжелая, симптоматическая и продолжительная гипофосфатемия после внутривенной инфузии железа действительно имела место в ряде клинических случаев [29]. Таким пациентам может потребоваться заместительная терапия фосфатами и витамином D, а также длительное наблюдение.
Клинические исследования изомальтозного железа / Clinical studies of iron isomaltase
Применение при хронической болезни почек
Лечение дефицита железа у пациентов с ХБП (n=108, 55% мужчин, возраст 67±15 лет) посредством введения изомальтозного железа показало, что повышение уровней гемоглобина на 10 г/л и более было достигнуто у 57% больных, так что средний уровень гемоглобина после лечения составил 105 г/л [30].
Изомальтозное железо (Монофер) у пациентов с ХБП (n=182) применялось либо в виде 4 внутривенных болюсных инъекций по 100–200 мг на дозу, либо в виде быстрой высокодозной (1 000 мг) инфузии. Лечение, стимулирующее эритропоэз, получали 82% больных. Гемоглобин увеличился от 99±9 до 111±15 г/л через 8 нед после введения. Связанные с лечением побочные эффекты наблюдались у 13 (7%) пациентов, анафилактических или отсроченных аллергических реакций не отмечено [31].
Проведено рандомизированное исследование применения изомальтозного железа по сравнению с пероральным приемом железа у пациентов с ХБП и ЖДА (n=351). Больные были рандомизированы на группы изомальтозного железа в дозе 1000 мг однократно (1000 мг в течение 15 мин) либо сульфата железа per os (200 мг/сут, 8 нед). Использование изомальтозного железа показало статистически достоверное увеличение гемоглобина с 3-й недели до конца исследования (р=0,009) [32] (рис. 2).
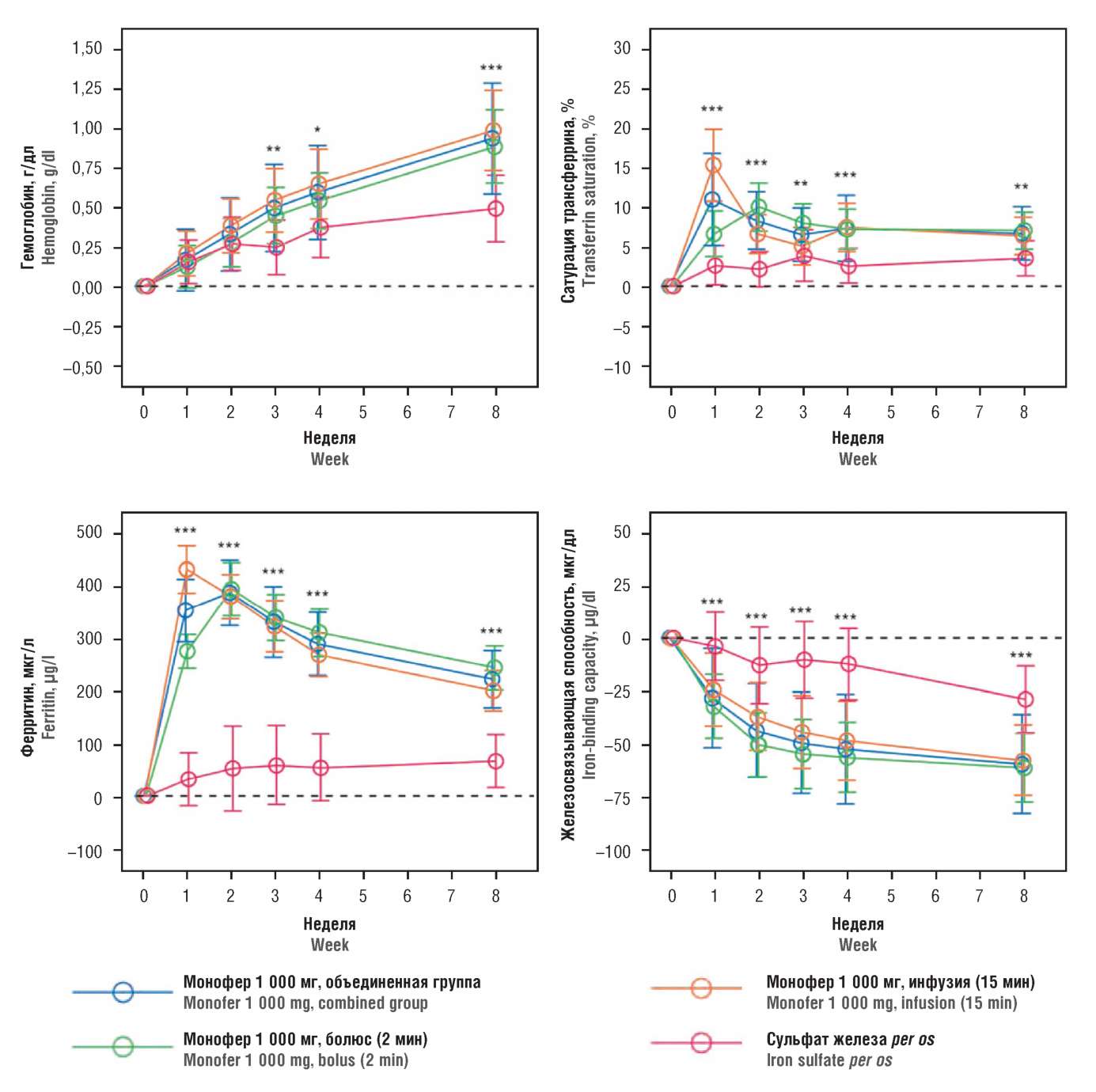
Рисунок 2. Гемоглобин и ферритин в динамике лечения внутривенным введением
изомальтозной формы железа (адаптировано из [32])
Figure 2. Hemoglobin and ferritin over time in treatment with intravenous administration
of isomaltose form of iron (adopted from [32])
Применение при хирургических вмешательствах
Показано влияние внутривенного введения изомальтозного железа (Монофер) при хирургических вмешательствах на снижение риска смерти пожилых пациентов, перенесших операцию по поводу перелома бедра (n=210). На 3-е сутки после операции больные были живы, гемоглобин был снижен (менее 105 г/л). Из 210 пациентов 17 (8,1%) умерли в течение 30 сут после операции. Тридцатидневная смертность среди больных, получавших Монофер, была в 5 раз ниже по сравнению с пациентами, не получавшими лечения (отношение шансов 0,17; 95% доверительный интервал (ДИ) 0,03–0,93; р=0,041) [33].
Внутривенное введение препарата Монофер снижает послеоперационную анемию у пациентов с уросепсисом, перенесших плановую операцию в урологическом отделении (n=82, 60% мужчин, средний возраст 67 лет). Средний предоперационный уровень гемоглобина до введения препарата составил 85 г/л, после введения – 99 г/л (p=0,006). Применение препарата не сопровождалось побочными эффектами [34].
Внутривенное введение изомальтозного железа уменьшает послеоперационную анемию у больных, не страдавших анемией до проведения кардиохирургии (коронарное шунтирование или протезирование клапанов, n=60). Средний уровень гемоглобина до операции составил 142 г/л во всей группе. При выписке через 5 сут после хирургического вмешательства уровень гемоглобина снизился до 106 г/л. Через 1 мес после операции концентрация гемоглобина увеличилась в среднем до 126 г/л в группе получивших изомальтозное железо и только до 118 г/л в группе плацебо (p=0,012). Не отмечено побочных эффектов, связанных с терапией препаратом Монофер [35].
Эффекты внутривенного введения изомальтозного комплекса железа (инфузия 1 200 мг) изучены у женщин, страдающих выраженной астенией вследствие послеродового кровотечения (n=85). Утомляемость пациенток была оценена по многомерной шкале астении (англ. Multidimensional Fatigue Inventory, MFI) и по Эдинбургской шкале послеродовой депрессии (англ. Edinburgh Postnatal Depression Scale, EPDS). Суммарное изменение интегрального показателя физической усталости составило –2,3 балла (95% ДИ –3,3…–1,3; p<0,0001) при сравнении групп применения изомальтозной формы железа и перорального приема железа (рис. 3). Различий в побочных эффектах между группами не установлено [36].
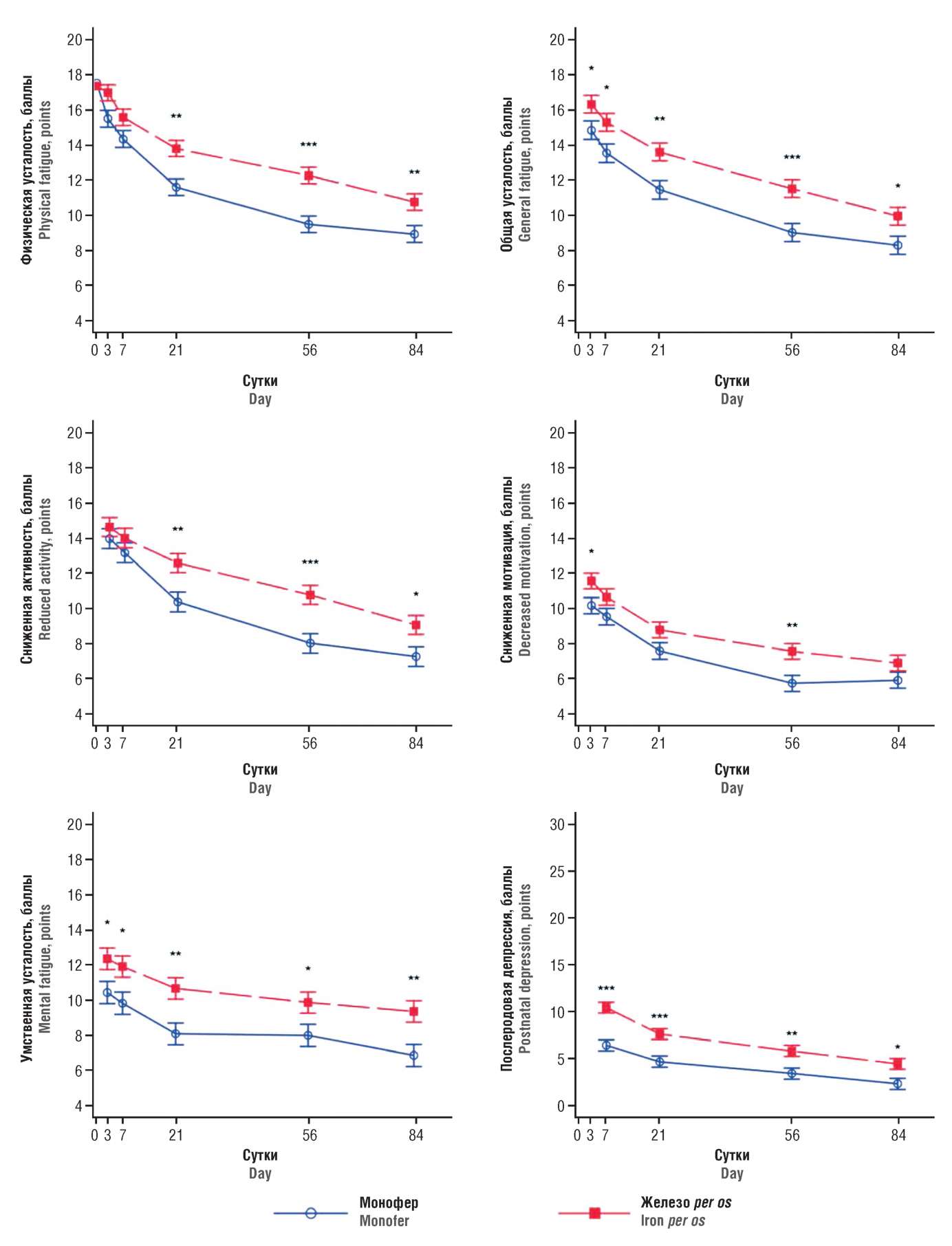
Рисунок 3. Показатели утомляемости и депрессии.
Результаты представлены в виде средних баллов по многомерной шкале астении (англ. Multidimensional Fatigue Inventory) и Эдинбургской шкале послеродовой депрессии (англ. Edinburgh Postnatal Depression Scale) (адаптировано из [36])
Figure 3. Fatigue and depression scores.
Results are presented as mean scores on the Multidimensional Fatigue Inventory and the Edinburgh Postnatal Depression Scale (adopted from [36])
Применение при других патологиях
Внутривенное введение изомальтозного железа улучшает концентрацию гемоглобина и запасы железа у женщин – доноров крови с дефицитом железа (n=85). Увеличение гемоглобина было достоверно выше при использовании изомальтозида железа по сравнению с плацебо непосредственно перед второй (p=0,0327) и третьей сдачей крови (p<0,0001) [37].
Быстрая инфузия высоких доз изомальтозного железа эффективна у пациентов с ЖДА вследствие воспалительного заболевания кишечника (n=23). Больные получали инфузии 1 500 мг (n=7), 2 000 мг (n=8), 2 500 мг (n=4) или 3 000 мг (n=2) железа. Серьезных побочных реакций не наблюдалось. У 75% пациентов отмечено повышение гемоглобина на 20 г/л и более на фоне нормализации уровней ферритина без достоверных изменений уровней фосфатов или фактора роста фибробластов 23 [38].
Сравнительный анализ эффективности / Comparative analysis of efficiency
После выбора объектов исследования в соответствии с методологией фармакоэкономического анализа нами был проведен сравнительный ретроспективный анализ эффективности. Информационный поиск выявил два непрямых сравнения ЛП на основе олигоизомальтозного железа и карбоксимальтозного железа (А. Aksan et al. (2017 г.) [11] и R.F. Pollock et al. (2019 г.) [12]). Непрямые сравнения подразумевают, во-первых, различные методы статистической обработки результатов клинических исследований, а во-вторых, сравнение интересующих исследователя ЛП с одним и тем же препаратом.
Непрямое сравнение на основе метода байесовского сетевого метаанализа 15 рандомизированных клинических исследований пациентов с воспалительными заболеваниями [11] оценивало эффективность и безопасность ряда ЛП железа, в т.ч. олигоизомальтозного и карбоксимальтозного. В результате было установлено, что при использовании сульфата железа per os в качестве компаратора отмечается статистически значимое преимущество карбоксимальтозного железа. В то же время, когда в роли препарата сравнения выступал железосахарозный комплекс, статистически значимой разницы в эффективности олигоизомальтозного и карбоксимальтозного железа выявлено не было. Заметим, что результаты публикации [11] были получены с использованием ряда существенных допущений (различные временной горизонт, режимы дозирования изучаемых ЛП, исходные уровни гемоглобина у пациентов).
Непрямое сравнение, представленное в работе R.F. Pollock et al. [12], включило результаты четырех рандомизированных клинических исследований пациентов с ЖДА, вызванной воспалительными заболеваниями кишечника, ХБП, сильными маточными кровотечениями и другими причинами. Следует подчеркнуть, что во всех включенных в сравнение исследованиях в качестве компаратора использовался ЛП на основе железосахарозного комплекса. Сравнение не выявило статистически значимой разницы в уровнях гематологического ответа. Однако была выявлена статистически значимая разница между олигоизомальтозным и карбоксимальтозным железом с точки зрения среднего увеличения уровня гемоглобина от исходного: гемоглобин достоверно повышался при использовании олигоизомальтозного железа (+2,5 г/л, 95% ДИ 0,72–4,3; p=0,006). Таким образом, результаты проведенных непрямых сравнений [11][12] позволяют утверждать, что эффективность ЛП на основе олигоизомальтозного и карбоксимальтозного железа сопоставима.
Дополнительно в метаанализе В. Schaefer et al. (2021 г.) [15], включившем 42 клинических исследования, были оценены риски развития гипофосфатемии как значимого осложнения при использовании парентеральных ЛП железа. Применение ЛП на основе карбоксимальтозного железа характеризовалось бо́льшим риском развития гипофосфатемии (47%, 95% ДИ 36–58) по сравнению с ЛП олигоизомальтозного железа (4%, 95% ДИ 2–5). Однако частота гипофосфатемии вряд ли является релевантным критерием эффективности в фармакоэкономической оценке рассматриваемых ЛП.
По этой причине источником дозиологической модели для настоящего фармакоэкономического анализа стала публикация дозозависимой модели [16], сравнивающей указанные ЛП и базирующейся на данных непрямого сравнения [12]. Предлагаемая в [13] дозиологическая модель учитывает: распределение уровней гемоглобина в крови, массу тела пациентов, величину изменения уровня гемоглобина от исходного уровня, режимы дозирования рассматриваемых ЛП в соответствии с их инструкциями по медицинскому применению. Исходные характеристики пациентов для основной формы модели составили 100,4 г/л для начальных уровней гемоглобина и 88,3 кг для средней массы тела пациента. При указанных значениях параметров модель позволяет прогнозировать частоту гематологического ответа при применении ЛП на основе олигоизомальтозного железа (79%) и карбоксимальтозного железа (70%). Принимая во внимание релевантность частоты гематологического ответа как критерия эффективности в анализе «затраты–эффективность» и допустимость экстраполяции данных по клинической эффективности, результаты исследования [16] были использованы для наших фармакоэкономических оценок.
Анализ затрат / Cost analysis
Был осуществлен расчет курсовой стоимости лечения рассматриваемыми ЛП, входящими в перечень ЖНВЛП, с использованием предельных отпускных цен производителей (НДС 10%, оптовая надбавка 11,53% [39]). Расчет проводили для пациентов с упоминаемыми выше значениями параметров (исходный уровень гемоглобина 100,4 г/л, средняя масса тела 88,3 кг). Расчет дозы рассматриваемых ЛП выполняли по формуле Ганзони [8]. Согласно последней при указанных исходных параметрах необходимая доза железа составила 1551 мг. При расчете затрат использовали алгоритм оптимизации применения ЛП, подразумевающий возможность совмещения различных форм выпуска с целью минимизации потери действующего вещества ЛП. В этом случае курсовая доза препарата Монофер (100 мг/мл) подразумевала однократную внутривенную инъекцию с использованием 3 ампул по 5 мл и 1 ампулы по 2 мл. Для препарата Феринжект® (50 мг/мл) согласно инструкции требовалось 3 флакона по 10 мл и 1 флакон по 2 мл (2 введения в течение 1 нед). Затраты на курс лечения одного пациента с указанными исходными параметрами составили 12 693,23 руб. для препарата Монофер и 14 918,25 руб. для препарата Феринжект®.
В расчетах также была учтена стоимость процедуры введения рассматриваемых ЛП в размере 350 руб. [17]. Лечение препаратом Монофер требовало однократной инъекции, тогда как Феринжект® вводился посредством двух инъекций. Следовательно, затраты на введение анализируемых ЛП составили 350 и 700 руб. соответственно. Суммарные затраты на лечение одного пациента препаратами Монофер и Феринжект® равны 13 043,23 и 15 618,25 руб. соответственно. Представленные результаты анализа затрат демонстрируют экономию средств при использовании препарата Монофер по сравнению с препаратом Феринжект® (рис. 4).
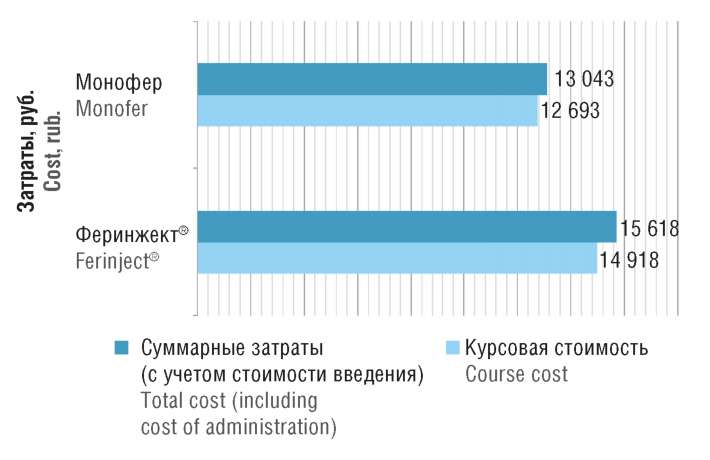
Рисунок 4. Результаты анализа затрат курсовой стоимости лечения
рассматриваемыми лекарственными препаратами в расчете на одного пациента
Figure 4. Results of the cost analysis for the course of treatment
with the drugs in question per patient
Анализ «затраты–эффективность» / Cost-effectiveness analysis
На основе проведенного анализа эффективности и анализа затрат были рассчитаны значения показателя «затраты–эффективность» [4], отражающего стоимость достижения пациентом гематологического ответа для каждого из рассматриваемых ЛП. Они составили 16 510 руб. для препарата Монофер и 22 312 руб. для препарата Феринжект® (табл. 3, рис. 5).
Таблица 3. Результаты анализа «затраты-эффективность»
по показателю гематологический ответ
Table 3. Results of the cost-effectiveness analysis of hematological response
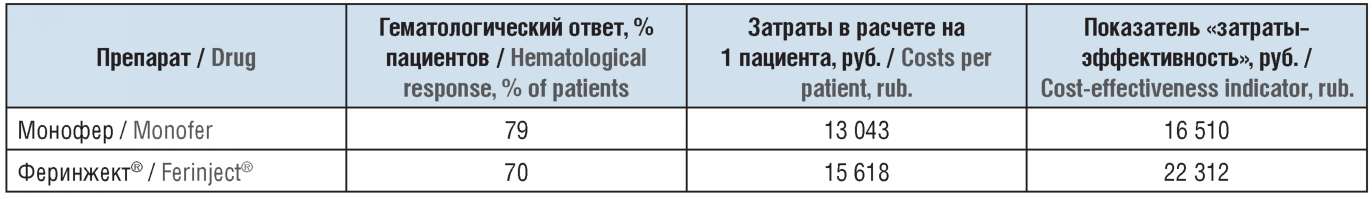
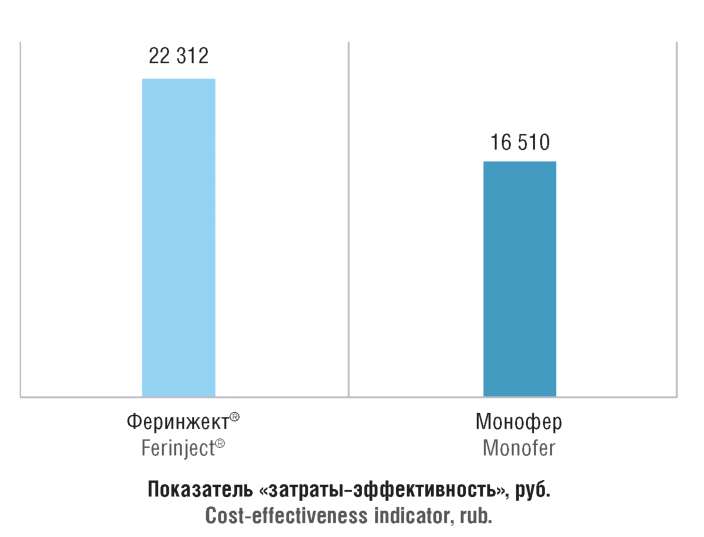
Рисунок 5. Значения показателя «затраты–эффективность»
для рассматриваемых лекарственных препаратов
Figure 5. Cost-effectiveness indicators for the drugs in question
Принимая во внимание, что олигоизомальтозное железо характеризуется лучшей эффективностью (см. табл. 3), результаты анализа «затраты–эффективность» определяют Монофер как строго предпочтительный при сравнении с препаратом Феринжект®.
Анализ чувствительности по факторам стоимости рассматриваемых ЛП продемонстрировал стабильность полученных выводов даже при условии снижения цены на Феринжект® на 25% (при этом значение показателя «затраты–эффективность» составит 16 984 руб.).
Анализ минимизации затрат / Cost minimization analysis
В рамках проведенного анализа чувствительности нами была рассмотрена ситуация варьирования параметров клинической эффективности, в которой эффективность ЛП на основе олигоизомальтозного железа будет сопоставима с эффективностью карбоксимальтозного железа. Для этой ситуации был проведен анализ минимизации затрат [4], показавший, что Монофер по сравнению с препаратом Феринжект® все равно предоставляет экономию средств на 16,5% (2 575 руб.) на одного пациента. Последний вывод подтверждает фармакоэкономическое преимущество препарата Монофер (рис. 6).
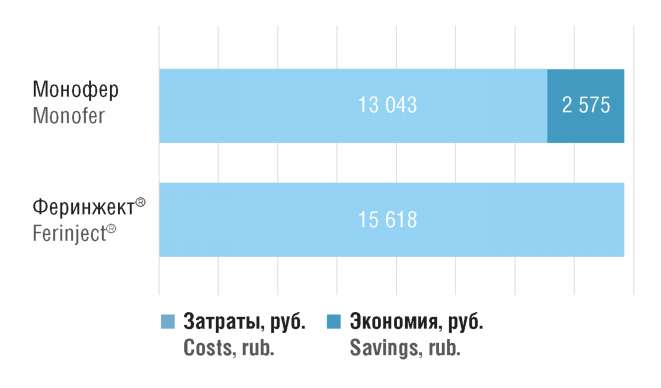
Рисунок 6. Результаты анализа минимизации затрат
в рамках проведенного анализа чувствительности
Figure 6. Results of сost minimization evaluation in sensitivity analysis
Фармакоэкономическая оценка использования препарата Монофер в сравнении с гемотрансфузиями в рамках менеджмента крови пациентов / Pharmacoeconomical evaluation of using Monofer in comparison with blood transfusions in patient blood management
Анализ «затраты–эффективность» позволил определить препарат Монофер как строго предпочтительный по сравнению с препаратом Феринжект®. Поэтому Монофер был выбран для следующего этапа настоящего исследования: экономической оценки эффекта более широкого применения данного ЛП в менеджменте крови пациента в сравнении с гемотрансфузией. Менеджмент крови пациента как комплекс мероприятий, сформированный прежде всего в хирургической практике, включает три периода: предоперационный, периоперационный и постоперационный. Наибольшее значение ЛП железа приобретают на предоперационном и постоперационном этапах.
Экономический эффект от применения препарата Монофер был рассмотрен на примере конкретной области – колоректальной хирургии. Отечественных исследований, оценивающих менеджмент крови пациента с точки зрения затрат ресурсов системы здравоохранения, обнаружено не было. Поэтому соответствующие данные были извлечены из работы K.M. Trentino et al. (2021 г.) [18], в которой оценивался эффект от внедрения скрининга и коррекции железодефицитных состояний в практике колоректальной хирургии в крупном медицинском центре западной Австралии. Результаты анализа 544 госпитализаций в течение 3 лет после внедрения процедур менеджмента крови пациента показывают, что доля скрининга железодефицитных состояний при госпитализации возросла с 13,4% до 73,4%. При этом число больных, которым назначались ЛП железа внутривенно, увеличилось от 5,2% до 31,4%. Одновременно установлены 53% снижение общего числа порций крови в расчете на каждую госпитализацию и сокращение сроков госпитализации на 15% (от 9,1 до 7,7 сут). У пациентов, получавших парентеральные ЛП железа, исходное значение гемоглобина составляло в среднем 110,9 г/л, а после курса лечения – 120,3 г/л [18].
Заметим, что в приводимых ниже расчетах не учитывалось выявленное в работе K.M. Trentino et al. [18] сокращение сроков госпитализации при более активном скрининге и лечении пациентов парентеральным ЛП железа. Причиной этого является используемая в России схема расчетов стоимости услуг в стационарах, которая осуществляется по тарифам контрольно-счетных групп без указания длительности госпитализации.
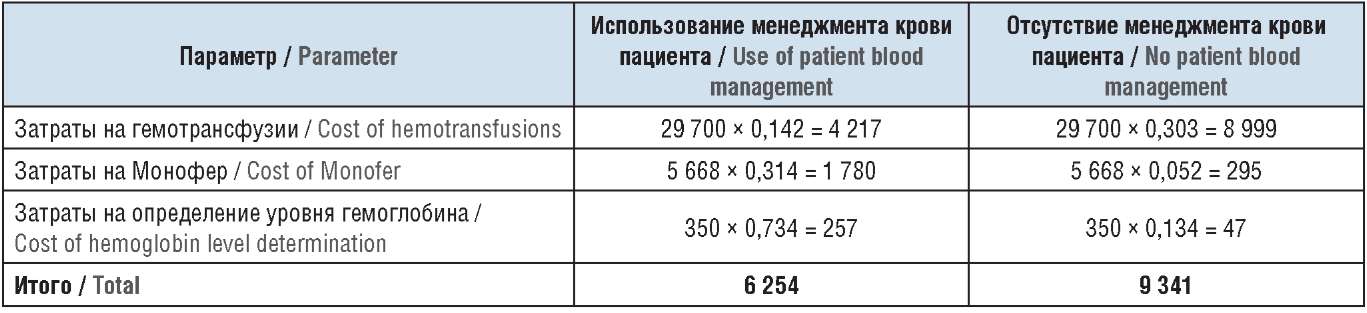
В рамках проводимой фармакоэкономической оценки представленные данные по использованию ресурсов системы здравоохранения были экстраполированы на Россию. При расчете необходимой дозы железа (в мг) по формуле Ганзони средняя масса тела пациентов была принята за 70 кг, так что необходимая доза железа составила 658 мг. На первом этапе расчетов была определена стоимость коррекции железодефицитного состояния больного с использованием препарата Монофер или гемотрансфузии. Стоимость порции эритроцитарной массы для гемотрансфузии была взята из работы М.О. Баговой и др. [19] и составила 9 900 руб. Согласно методическому руководству [20] в одной порции эритроцитарной массы содержится 200–250 мг железа, поэтому в расчетах мы исходили из среднего значения (225 мг).
При описанных выше начальных условиях затраты на коррекцию уровня гемоглобина в расчете на одного пациента составили 5 668 руб. при использовании препарата Монофер (1 ампула 100 мг/мл 5 мл и 1 ампула 100 мг/мл 2 мл) и 29 700 руб. на три порции эритроцитарной массы для гемотрансфузии. Стоимость определения уровня гемоглобина в расчетах была принята за 350 руб. [21]. На следующем этапе были рассчитаны затраты на одного больного для коррекции железодефицитных состояний при использовании менеджмента крови пациента (6 254 руб.) и без него (9 341 руб.) (табл. 4).
Таблица 4. Расчет и результаты экономического эффекта
использования менеджмента крови пациента, руб.
Table 4. Calculation and results of economic effect of patient blood management, rub.
Таким образом, более широкое использование препарата Монофер в рамках менеджмента крови пациента не только позволяет достичь целей этого подхода, снизив объем гемотрансфузий на 53%, но и сопровождается положительным экономическим эффектом: экономией средств на 33% (3 087 руб.) в расчете на одного пациента.
ЗАКЛЮЧЕНИЕ / CONCLUSION
Полученные в настоящей работе фармакоэкономические оценки позволяют определить ЛП олигоизомальтозного железа как строго предпочтительный по отношению к ЛП карбоксимальтозного железа. Препарат Монофер характеризуется как меньшей величиной затрат, так и более низким значением показателя «затраты–эффективность», обладая при этом преимуществом по эффективности (большее увеличение уровня гемоглобина от исходного уровня). Обосновано экономическое преимущество для более широкого использования данного препарата в рамках менеджмента крови пациента.
Список литературы
1. Peyrin-Biroulet L., Williet N., Cacoub P. Guidelines on the diagnosis and treatment of iron deficiency across indications: a systematic review. Am J Clin Nutr. 2015; 102 (6): 1585–94. https://doi.org/10.3945/ajcn.114.103366.
2. Хофманн А., Аапро М., Федорова Т.А. и др. Менеджмент крови пациентов в онкологии в Российской Федерации. Резолюция во имя улучшения оказания помощи онкологическим больным. Современная онкология. 2020; 22 (3): 59–78. https://doi.org/10.26442/18151434.2020.3.200340.
3. Клинические рекомендации. Железодефицитная анемия. 2021 год. URL: https://labdep.com/storage/editor/JDA_2021_klin_rek.pdf (дата обращения 05.02.2022)
4. Ягудина Р.И., Куликов А.Ю., Серпик В.Г. Фармакоэкономика. Учебное пособие. 2-е изд. Ростов-на Дону: Феникс; 2018: 237 с.
5. Торшин И.Ю., Громова О.А. Экспертный анализ данных в молекулярной фармакологии. М.: МЦНМО; 2012: 748 с.
6. Маркова И.В, Афанасьев В.В., Цыбулькин Э.К. Клиническая токсикология детей и подростков. СПб.: Интермедика; 1999: 399 c.
7. Jahn M.R., Andreasen H.B., Fütterer S., et al. A comparative study of the physicochemical properties of iron isomaltoside 1000 (Monofer), a new intravenous iron preparation and its clinical implications. Eur J Pharm Biopharm. 2011; 78 (3): 480–91. https://doi.org/10.1016/j.ejpb.2011.03.016.
8. Государственный реестр лекарственных средств. URL: https://grls.rosminzdrav.ru (дата обращения 02.09.2021).
9. Gordon M., Sinopoulou V., Iheozor-Ejiofor Z., et al. Interventions for treating iron deficiency anaemia in inflammatory bowel disease. Cochrane Database Syst Rev. 2021; 1 (1): CD013529. https://doi.org/10.1002/14651858.CD013529.pub2.
10. Shin H.W., Go D.Y., Lee S.W., et al. Comparative efficacy and safety of intravenous ferric carboxymaltose and iron sucrose for iron deficiency anemia in obstetric and gynecologic patients: a systematic review and meta-analysis. Medicine (Baltimore). 2021; 100 (20): e24571. https://doi.org/10.1097/MD.0000000000024571.
11. Aksan A., Işık H., Radeke H.H., et al. Systematic review with network meta-analysis: comparative efficacy and tolerability of different intravenous iron formulations for the treatment of iron deficiency anaemia in patients with inflammatory bowel disease. Aliment Pharmacol Ther. 2017; 45 (10): 1303–18. https://doi.org/10.1111/apt.14043.
12. Pollock R.F., Muduma G. A systematic literature review and indirect comparison of iron isomaltoside and ferric carboxymaltose in iron deficiency anemia after failure or intolerance of oral iron treatment. Expert Rev Hematol. 2019; 12 (2): 129–36. https://doi.org/10.1080/17474086.2019.1575202.
13. Официальный сайт Единой информационной системы в сфере закупок. URL: https://zakupki.gov.ru (дата обращения 03.09.2021).
14. Государственный реестр предельных отпускных цен производителей на лекарственные препараты, включенные в перечень жизненно необходимых и важнейших лекарственных препаратов. URL: https://minzdrav.gov.ru/opendata/7707778246-gosreestrpredelnyhotpusknyhcen/visual (дата обращения 02.09.2021).
15. Schaefer B., Tobiasch M., Viveiros A., et al. Hypophosphataemia after treatment of iron deficiency with intravenous ferric carboxymaltose or iron isomaltoside-a systematic review and meta-analysis. Br J Clin Pharmacol. 2021; 87 (5): 2256–73. https://doi.org/10.1111/bcp.14643.
16. Pollock R.F., Muduma G. A patient-level cost-effectiveness analysis of iron isomaltoside versus ferric carboxymaltose for the treatment of iron deficiency anemia in the United Kingdom. J Med Econ. 2020; 23 (7): 751–9. https://doi.org/10.1080/13696998.2020.1745535.
17. Городская поликлиника № 2 Департамента здравоохранения города Москвы. Стоимость услуг. URL: https://gp2dzm.ru/stoimostuslug (дата обращения 04.09.2021).
18. Trentino K.M., Mace H., Symons K., et al. Associations of a preoperative anemia and suboptimal iron stores screening and management clinic in colorectal surgery with hospital cost, reimbursement, and length of stay: a net cost analysis. Anish Analog. 2021; 132 (2): 344–52. https://doi.org/10.1213/ANE.0000000000005241.
19. Багова М.О., Магомедова А.У., Кравченко С.К. и др. Фармакоэкономический анализ комбинированной иммунохимиотерапии R-DA-EPOCH и R-mNHL-BFM-90 у пациентов с прогностически неблагоприятной диффузной В-крупноклеточной лимфомой в рамках рандомизированного многоцентрового клинического исследования ДВККЛ-2015. Клиническая онкогематология. 2021; 14 (3): 321–32. https://doi.org/10.21320/2500-2139-2021-14-3-321-332.
20. Серов В.Н. (ред.) Диагностика и лечение периоперационной анемии и дефицита железа у хирургических пациентов: методическое руководство. Чебоксары: ИД «Среда»; 2021: 60 с.
21. Прайс-лист сети лабораторий Invitro. URL: https://www.invitro.ru (дата обращения 04.09.2021).
22. Kulnigg S., Stoinov S., Simanenkov V., et al. A novel intravenous iron formulation for treatment of anemia in inflammatory bowel disease: the ferric carboxymaltose (FERINJECT) randomized controlled trial. Am J Gastroenterol. 2008; 103 (5): 1182–92. https://doi.org/10.1111/j.1572-0241.2007.01744.x.
23. Lima J., Gago P., Rocha M., et al. Role of intravenous iron in the treatment of anemia in patients with gastrointestinal tract tumors undergoing chemotherapy: a single-center, observational study. Int J Gen Med. 2018; 11: 331–6. https://doi.org/10.2147/IJGM.S165947.
24. Slaats J., ten Oever J., van der Veerdonk F.L., Netea M.G. IL-1β/ IL-6/СRP and IL-18/ferritin: distinct inflammatory programs in infections. PloS Pathog. 2016; 12 (12): e1005973. https://doi.org/10.1371/journal.ppat.1005973.
25. Торшин И.Ю., Громова О.А. Микронутриенты против коронавирусов. М.: ГЭОТАР-Медиа; 2020: 112 с.
26. Bach M., Geisel T., Martin J., et al. Efficacy and safety of intravenous ferric carboxymaltose in geriatric inpatients at a German Tertiary University Teaching Hospital: a retrospective observational cohort study of clinical practice. Anemia. 2015; 2015: 647930. https://doi.org/10.1155/2015/647930.
27. Keeler B.D., Simpson J.A., Ng S., et al. The feasibility and clinical efficacy of intravenous iron administration for preoperative anaemia in patients with colorectal cancer. Colorectal Dis. 2014; 16 (10): 794– 800. https://doi.org/10.1111/codi.12683.
28. Moore R.A., Gaskell H., Rose P., Allan J. Meta-analysis of efficacy and safety of intravenous ferric carboxymaltose (Ferinject) from clinical trial reports and published trial data. BMC Blood Disord. 2011; 11: 4. https://doi.org/10.1186/1471-2326-11-4.
29. Ifie E., Oyibo S.O., Joshi H., Akintade O. Symptomatic hypophosphataemia after intravenous iron therapy: an underrated adverse reaction. Endocrinol Diabetes Metab Case Rep. 2019; 2019 (1): 19–0065. https://doi.org/10.1530/EDM-19-0065.
30. Jensen G., Gøransson L.G., Fernström A., et al. Treatment of iron deficiency in patients with chronic kidney disease: a prospective observational study of iron isomaltoside (NIMO Scandinavia). Clin Nephrol. 2019; 91 (4): 246–53. https://doi.org/10.5414/CN109474.
31. Wikström B., Bhandari S., Barany P., et al. Iron isomaltoside 1000: a new intravenous iron for treating iron deficiency in chronic kidney disease. J Nephrol. 2011; 24 (5): 589–96. https://doi.org/10.5301/JN.2011.6248.
32. Kalra P.A., Bhandari S., Saxena S., et al. A randomized trial of iron isomaltoside 1000 versus oral iron in non-dialysis-dependent chronic kidney disease patients with anaemia. Nephrol Dial Transplant. 2016; 31 (4): 646–55. https://doi.org/10.1093/ndt/gfv293.
33. Clemmensen S.Z., Kragholm K.H., Melgaard D., et al. Association between intravenous iron therapy and short-term mortality risk in older patients undergoing hip fracture surgery: an observational study. J Orthop Surg Res. 2021; 16 (1): 320. https://doi.org/10.1186/s13018-021-02462-x.
34. Goh H.J., Lee K.S., Kim T.H., et al. Intravenous iron isomaltoside 1000 reduces postoperative anemia in patients undergoing elective urologic surgery and those with urosepsis. Drug Des Devel Ther. 2020; 14: 5679–87. https://doi.org/10.2147/DDDT.S276904.
35. Johansson P.I., Rasmussen A.S., Thomsen L.L. Intravenous iron isomaltoside 1000 (Monofer) reduces postoperative anaemia in preoperatively non-anaemic patients undergoing elective or subacute coronary artery bypass graft, valve replacement or a combination thereof: a randomized double-blind placebo-controlled clinical trial (the PROTECT trial). Vox Sang. 2015; 109 (3): 257–66. https://doi.org/10.1111/vox.12278.
36. Holm C., Thomsen L.L., Langhoff-Roos J. Intravenous iron isomaltoside treatment of women suffering from severe fatigue after postpartum hemorrhage. J Matern Fetal Neonatal Med. 2019; 32 (17): 2797–804. https://doi.org/10.1080/14767058.2018.1449205.
37. Gybel-Brask M., Seeberg J., Thomsen L.L., Johansson P.I. Intravenous iron isomaltoside improves hemoglobin concentration and iron stores in female iron-deficient blood donors: a randomized double-blind placebo-controlled clinical trial. Transfusion. 2018; 58 (4): 974–81. https://doi.org/10.1111/trf.14521.
38. Dahlerup J.F., Jacobsen B.A., van der Woude J., et al. High-dose fast infusion of parenteral iron isomaltoside is efficacious in inflammatory bowel disease patients with iron-deficiency anaemia without profound changes in phosphate or fibroblast growth factor 23. Scand J Gastroenterol. 2016; 51 (11): 1332–8. https://doi.org/10.1080/00365521.2016.1196496.
39. Федеральная антимонопольная служба. Предельные размеры оптовых надбавок и предельные размеры розничных надбавок к ценам на жизненно необходимые и важнейшие лекарственные препараты, установленные в субъектах Российской Федерации (данные по состоянию на 21.10.2020). URL: https://fas.gov.ru/documents/687272 (дата обращения 01.07.2021).
Об авторах
Р. И. ЯгудинаРоссия
д.фарм.н., профессор, заведующая кафедрой организации лекарственного обеспечения и фармакоэкономики,
ул. Трубецкая, д. 8, стр. 2, Москва 119991
А. Ю. Куликов
Россия
к.м.н., д.э.н., профессор кафедры организации лекарственного обеспечения и фармакоэкономики,
ул. Трубецкая, д. 8, стр. 2, Москва 119991
В. Г. Серпик
Россия
к.фарм.н., доцент кафедры организации лекарственного обеспечения и фармакоэкономики,
ул. Трубецкая, д. 8, стр. 2, Москва 119991
О. А. Громова
Россия
д.м.н., профессор, научный руководитель,
ул. Вавилова, д. 4, Москва 211933
И. Ю. Торшин
Россия
к.ф-м.н., к.х.н., старший научный сотрудник,
ул. Вавилова, д. 4, Москва 211933
Рецензия
Для цитирования:
Ягудина Р.И., Куликов А.Ю., Серпик В.Г., Громова О.А., Торшин И.Ю. Фармакоэкономический анализ препарата Монофер для использования у пациентов с железодефицитной анемией в рамках оказания медицинской помощи по программе госгарантий в условиях системы здравоохранения Российской Федерации. ФАРМАКОЭКОНОМИКА. Современная фармакоэкономика и фармакоэпидемиология. 2022;15(1):73-86. https://doi.org/10.17749/2070-4909/farmakoekonomika.2022.124
For citation:
Yagudina R.I., Kulikov A.Yu., Serpik V.G., Gromova O.A., Torshin I.Yu. Pharmacoeconomic analysis of using Monofer in patients with iron deficiency anemia as part of the provision of medical care under the state guarantees program in the health care system of the Russian Federation. FARMAKOEKONOMIKA. Modern Pharmacoeconomics and Pharmacoepidemiology. 2022;15(1):73-86. (In Russ.) https://doi.org/10.17749/2070-4909/farmakoekonomika.2022.124

Контент доступен под лицензией Creative Commons Attribution-NonCommercial-ShareAlike 4.0 International License.






































