Перейти к:
О перспективах применения хондропротекторов для торможения остеодеструктивных процессов в субхондральной кости при остеоартрите
https://doi.org/10.17749/2070-4909/farmakoekonomika.2022.126
Аннотация
Актуальность. Остеоартрит (ОА) сопровождается активацией локального воспаления и не может не затрагивать костной ткани, непосредственно прилегающей к хрящу сустава.
Цель: систематический анализ научной литературы по взаимосвязи ОА с нарушениями метаболизма кости.
Материал и методы. Проведен компьютерный анализ 3926 публикаций по исследованиям ОА и нарушений метаболизма костной ткани методом топологической теории распознавания, отобранных по запросу “osteoarthritis AND (bone resorption OR osteopenia OR osteoporosis)” в базе данных биомедицинских публикаций PubMed/MEDLINE. В качестве контрольной выборки использовали 4000 статей, случайно выбранных из 97 331 текста, найденного по запросу “osteoarthritis NOT bone NOT resorption NOT osteopenia NOT osteoporosis” (т.е. публикации по ОА, не затрагивающие вопросов метаболизма кости). Р
Результаты. Взаимосвязи между патологией хряща и деструкцией костной ткани опосредованы: провоспалительными цитокинами, нарушениями баланса активности остеобластов и остеокластов, гормональным дисбалансом эстрогенов, нарушениями углеводного обмена. Нарушения метаболизма кости ассоциированы с увеличением болевой симптоматики ОА. Хондропротекторы хондроитина сульфат (ХС), глюкозамина сульфат (ГС) и неденатурированный коллаген блокируют активность провоспалительных цитокинов (каскады NF-κB и толл-рецепторов), стимулируют активность остеобластов (клетки, синтезирующие костную ткань) и снижают избыточную активность остеокластов (клетки, деградирующие костную ткань).
Заключение. Фармацевтически стандатизированные формы ХС и ГС могут наряду с безопасными остеопротекторными средствами (витамин D, кальций и др.) использоваться для нормализации костного метаболизма при ОА.
Ключевые слова
Для цитирования:
Громова О.А., Лила А.М., Торшин И.Ю., Рейер И.А. О перспективах применения хондропротекторов для торможения остеодеструктивных процессов в субхондральной кости при остеоартрите. ФАРМАКОЭКОНОМИКА. Современная фармакоэкономика и фармакоэпидемиология. 2022;15(1):107-118. https://doi.org/10.17749/2070-4909/farmakoekonomika.2022.126
For citation:
Gromova О.А., Lila А.М., Torshin I.Yu., Reier I.А. Application of chondroprotective agents to inhibit osteodestructive processes in the subchondral bone in patients with osteoarthritis. FARMAKOEKONOMIKA. Modern Pharmacoeconomics and Pharmacoepidemiology. 2022;15(1):107-118. https://doi.org/10.17749/2070-4909/farmakoekonomika.2022.126
ВВЕДЕНИЕ / INTRODUCTION
Долгое время остеоартрит (ОА) рассматривался преимущественно как дегенеративное заболевание хряща. Несмотря на то что при ОА происходит деградация хряща (стимулируемая во многом хроническим воспалением [1]), cистематический анализ 37 постгеномных исследований ОА указал на гораздо более сложную картину патогенеза данного заболевания. ОА ассоциирован с нарушениями экспрессии 483 генов и соответствующих белков, включающих: структурные белки соединительной ткани (СТ); белки, поддерживающие активность ростовых факторов СТ; белки, способствующие ремоделированию и деградации СТ; белки, связанные с регуляцией воспаления, – каскады фактора некроза опухоли альфа (ФНОα), интерлейкина (ИЛ) 1, толл-рецепторов, ядерного фактора каппа B (NF-κB) и др. [2].
Таким образом, в патогенезе ОА существенную роль играют воспаление и нарушения метаболизма СТ. Основными разновидностями СТ являются хрящ, кость, сухожилия и соединительнотканная основа различных органов. Хроническое воспаление, возникающее на фоне дефицита ряда микронутриентов (магний, цинк, железо, марганец, медь, витамины С и D), негативно влияет на все виды СТ [3][4]. Поэтому ОА рассматривается как заболевание всего сустава, затрагивающее не только хрящ, но и синовиальную оболочку, надкостницу и субхондральную кость.
В настоящей работе рассмотрена взаимосвязь между ОА и нарушениями метаболизма костной ткани. Известно, что у пациентов с ОА коленного сустава наблюдается более низкая минеральная плотность бедренной кости на стороне поражения [5]. Аномалии субхондральной кости при ОА способствуют возникновению боли в суставах и дегенерации суставного хряща. Поддержка физиологического состояния субхондральной кости может уменьшать боль в суставах и замедлять дегенерацию хряща. Лечение, нацеленное на реконструкцию субхондральной кости, является перспективным направлением в терапии ОА [6].
Хондропротекторные препараты на основе хондроитина сульфата (ХС) и глюкозамина сульфата (ГС) помимо противовоспалительного действия и репарации ткани хряща характеризуются существенным регенеративным потенциалом для костной ткани [7]. Антирахитическое действие ГС известно с начала 1960-х гг. [8], широко изучается антирезорбтивная активность высокоочищенных фармацевтических форм ХС [9]. ХС повышает активность факторов роста СТ и снижает воспалительную деструкцию соединительной ткани (ингибирование секреции гистамина, провоспалительных хемокинов, толл-рецепторов и каскада NF-κB через воздействие на рецептор CD44) [4]. Таким образом, хондропротекторы ХС и ГС могут использоваться также и для поддержки костной ткани при ОА.
Цель – систематический анализ научной литературы по взаимосвязи ОА с нарушениями метаболизма кости.
МАТЕРИАЛ И МЕТОДЫ / MATERIAL AND METHODS
Методология отбора материала / Methodology of material selection
По запросу “osteoarthritis AND (bone resorption OR osteopenia OR osteoporosis)” в базе данных биомедицинских публикаций PubMed/MEDLINE было найдено 3926 текстов (данные на ноябрь 2021 г.). Мы провели систематический компьютеризованный анализ этого массива публикаций посредством современных методов анализа больших данных, развиваемых в рамках топологического и метрического подходов к задачам распознавания и классификации [10–12]. Применение этих математических методов к проблематике анализа текстов подробно описано в работе И.Ю. Торшина и др. [12]. Также использованы результаты исследований, опубликованных нами ранее [2][4].
В качестве контрольной выборки взяты 4000 статей, случайно отобранных из 97 331 текста, найденного по запросу “osteoarthritis NOT bone NOT resorption NOT osteopenia NOT osteoporosis” (т.е. публикации по ОА, не затрагивающие вопросов метаболизма кости). Аннотация полученных терминов посредством референсных таблиц SNAP [13] позволила рубрицировать тексты исследований по молекулярно-биологическим процессам в соответствии с международной номенклатурой Gene Ontology (GO) [14].
Cистематический анализ / Systematic analysis
В ходе систематического анализа литературы были выделены более 110 информативных биомедицинских терминов, отличающих публикации по ОА в сочетании с нарушениями метаболизма кости от публикаций в контрольной выборке.
Экспертный анализ полученного списка рубрик GO указал на 98 наиболее информативных терминов, которые достоверно чаще встречались в выборке публикаций по ХС/ГС, чем в контроле (в 3–195 раз чаще, p<0,05 для каждого из терминов). В результате была получена своего рода «терминологическая карта», описывающая молекулярную патофизиологию ОА в контексте остеопороза, остеопении и усиленной резорбции костной ткани (pис. 1).
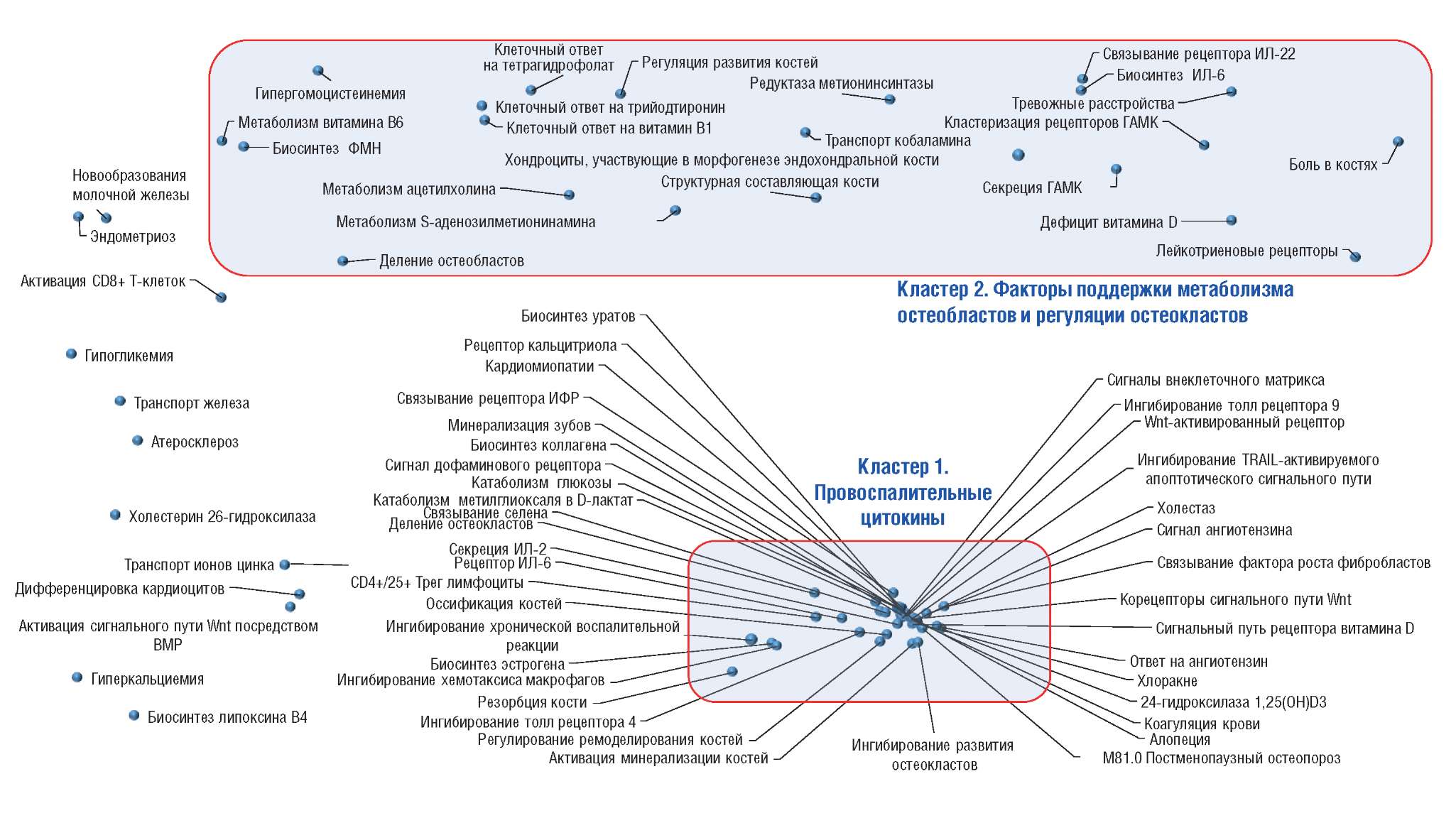
Рисунок 1. Метрическая диаграмма, отражающая карту молекулярной патофизиологии остеоартрита и нарушений метаболизма кости. Также приведены диагнозы по Международной классификации болезней 10-го пересмотра, отдельные симптомы и биологические процессы по номенклатуре Gene Ontology (коды GO приведены в тексте статьи). Расстояние между точками, соответствующими терминам, обратно пропорционально совместной встречаемости терминов в исследованной выборке публикаций (чем ближе две произвольные точки, тем чаще встречается совместное употребление двух соответствующих терминов). ФМН – флавинмононуклеотид; ИЛ – интерлейкин; ГАМК – гамма-аминомасляная кислота; ИФР – инсулиноподобный фактор роста
Figure 1. Metric diagram that reflects the International Classification of Diseases (10th revision) diagnoses, separate symptoms, and biological process according to Gene Ontology classification are specified (GO codes are mentioned in the article). The distance between the points that correspond to the respective terms is inversely proportional to the co-occurrence of the terms in the studied sampling of publications (the closer are the two points, the higher is the co-occurrence of the terms)
Анализ метрической диаграммы показывает, что наиболее информативные ключевые слова, описывающие молекулярную физиологию ОА, группируются в два терминологических кластера: «Кластер 1. Провоспалительные цитокины» и «Кластер 2. Факторы поддержки метаболизма остеобластов и регуляции остеокластов». Молекулярные механизмы формирования патологии костной ткани на фоне ОА расположены преимущественно в терминологическом кластере 1.
Анализ публикаций, ассоциированных с кластером 1 (1329 статей), показал, что процессы оссификации и резорбции кости (GO:0045453 Резорбция кости, GO:0046850 Регулирование ремоделирования костей, GO:0043932 Оссификация костей) тесно связаны не только с процессами воспаления (GO:0004915 Рецептор ИЛ-6, GO:0070970 Секреция ИЛ-2, GO:0034144 Ингибирование толл-рецептора 4, GO:0034164 Ингибирование толл-рецептора 9 и др.), но и с другими молекулярными механизмами: биосинтезом коллагена (GO:0035426 Сигналы внеклеточного матрикса, GO:0032964 Биосинтез коллагена), метаболизмом углеводов (GO:0005159 Связывание рецептора инсулиноподобного фактора роста, GO:0006007 Катаболизм глюкозы) и активностью эстрогенов (GO:0006703 Биосинтез эстрогена). Перечисленные процессы тем или иным образом воздействуют на деление остеобластов (GO:0002158), ингибирование остеокластов (GO:2001205), в т.ч. при участии фактора роста фибробластов (GO:0017134) и каскада Wnt (активация которого способствует остеогенезу [15]).
Эти воздействия опосредуются при участии важных антиоксидантных микронутриентов: витамина D (GO:0008434 Рецептор кальцитриола, GO:0030342 24-гидроксилаза 1,25(OH)D3, GO:0070561 Сигнальный путь рецептора витамина D) и селена (GO:0008430 Связывание селена). Дефицит эссенциального (незаменимого) микроэлемента селена, стимулируя окислительный стресс и аутоиммунные реакции, ассоциирован с артропатиями (болезнь Кашина–Бека, ревматоидный артрит, ОА) и остеопорозом [16]. Минеральная плотность костной ткани, микроструктура кости и уровни маркеров распада костной ткани у женщин с ОА нижнечелюстного сустава зависят от уровней 25-дигидроксивитамина D в крови [17]. Такой микронутриент, как D-манноза, подавляет развитие остеоартрита in vivo и задерживает индуцированную ИЛ-1β дегенерацию кости, также снижая аутоиммунные реакции посредством активации регуляторных Т-клеток [18].
Провоспалительные факторы, определяющие развитие ОА, представлены и в терминологическом кластере 2 (GO:0036037 Активация CD8+ Т-клеток, GO:0042226 Биосинтез ИЛ-6, GO:0031774 Лейкотриеновые рецепторы, GO:0045518 Связывание рецептора ИЛ-22 и др.). В выборке статей, соответствующей данному кластеру (1078 публикаций), рассматриваются взаимосвязи между воспалением при ОА, нарушениями процессов морфогенеза костей (GO:0003433 Хондроциты, участвующие в морфогенезе эндохондральной кости, GO:0008147 Структурная составляющая кости, GO:0033687 Деление остеобластов, GO:1903010 Регуляция развития костей) и нервно-психическими расстройствами (боль в костях, тревожные расстройства, GO:0014051 Секреция гамма-аминомасляной кислоты, GO:0008291 Метаболизм ацетилхолина). Эти эффекты взаимосвязаны с обменом витамина D (DOID:10574 Дефицит витамина D) и витаминов группы В (В1 – GO:0071301 Клеточный ответ на витамин B1, В2 – GO:0009398 Биосинтез флавинмононуклеотида, В6 – GO:0042816 Метаболизм витамина B6, В12 – GO:0015889 Транспорт кобаламина, фолаты – GO:0046499 Метаболизм S-аденозилметионинамина, GO:1904482 Клеточный ответ на тетрагидрофолат, гипергомоцистеинемия).
Вышеперечисленные патофизиологические процессы ассоциированы с различными костными и внекостными патологиями, коморбидными ОА. Рубрикация наиболее информативных терминов на рисунке 1 по разделам Международной классификации болезней 10-го пересмотра показала, что к таковым относятся патологии собственно костной ткани (Q78.2 Остеопетроз, E55.0 Рахит активный, M89.3 Гипертрофия костей, M35.3 Ревматическая полимиалгия, M88 Болезнь Педжета, K05.6 Болезнь пародонта неуточненная, M48.1 Анкилозирующий гиперостоз Форестье, N25.0 Почечная остеодистрофия), соединительной ткани (Q79.6 Синдром Элерса–Данло, Q87.4 Синдром Марфана) и другие, внекостные патологии, также связанные с хроническим воспалением и нарушениями метаболизма СТ (I51.9 Болезнь сердца неуточненная, E21.3 Гиперпаратиреоз неуточненный, E03.9 Гипотиреоз неуточненный, N19 Почечная недостаточность неуточненная, H26 Другие катаракты, G90.5 Рефлекторная симпатическая дистрофия, E34.8 Другие уточненные эндокринные расстройства) (рис. 2).
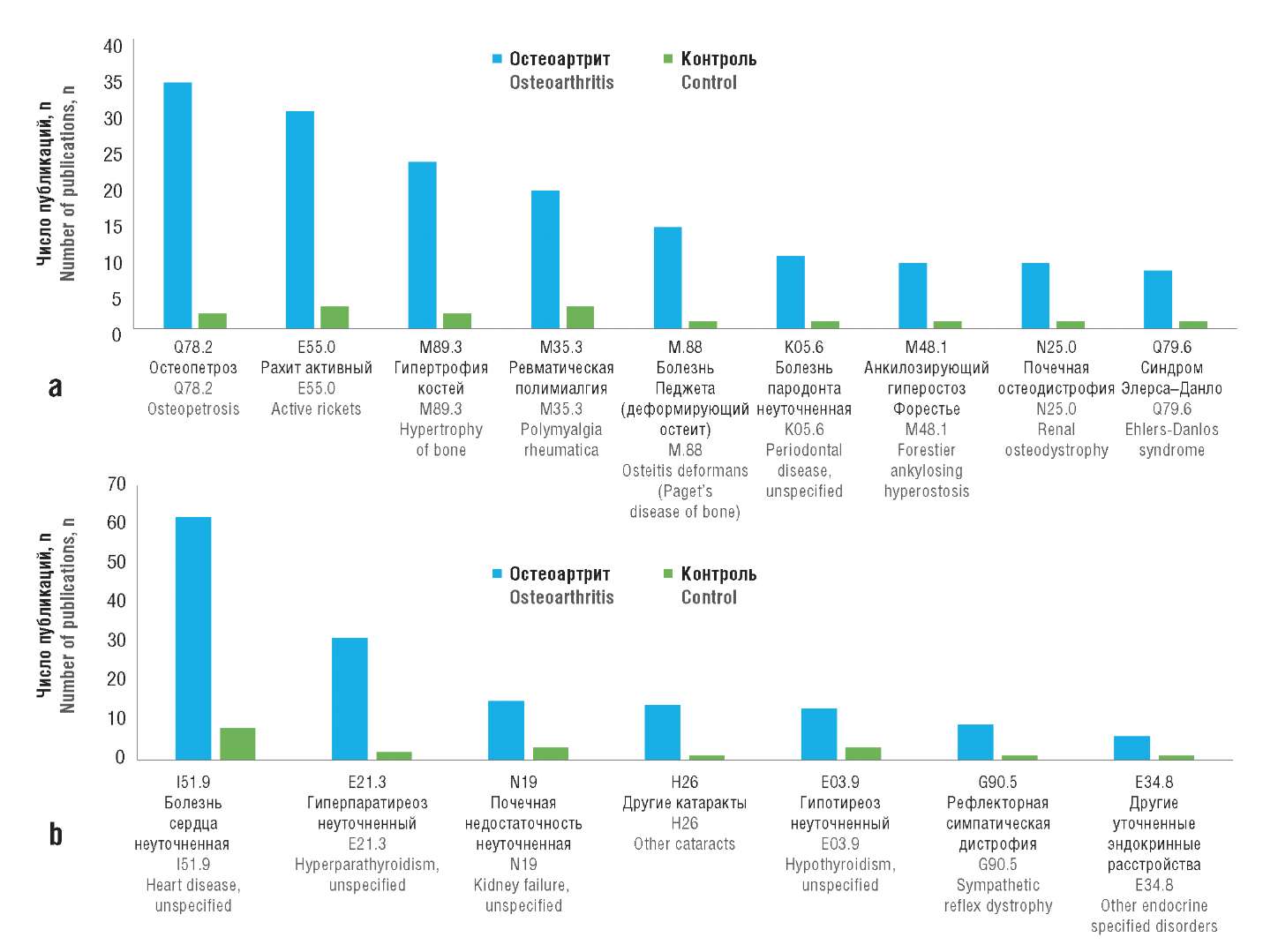
Рисунок 2. Патологии по Международной классификации болезней 10-го пересмотра,
ассоциированные с нарушениями метаболизма кости при остеоартрите (a, b)
Figure 2. International Classification of Diseases (10th revision)
pathologies associated with bone metabolism disorders in patients with оsteoarthritis (a, b)
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Последовательно рассмотрены процессы резорбции кости на фоне ОА, которые ассоциированы с перечисленными выше молекулярными механизмами: воспалением, нарушениями углеводного обмена, нарушениями метаболизма эстрогенов. Также проанализирована болевая симптоматика при ОА на фоне усиления резорбции кости. В каждом из соответствующих разделов рассмотрены эффекты хондропротекторов ХС и ГС на баланс процессов резорбции-ресинтеза костной ткани.
Резорбция кости при остеоартрите, ассоциированная с воспалением / Bone resorption in osteoarthritis associated with inflammation
В патогенезе ОА участвует ось Th1/Th17/Th22 провоспалительного ответа, активация которой приводит к повышению уровней ИЛ-1β, ИЛ-17, ИЛ-22, хемокиновых рецепторов CCR5, CCR6, CCR7 и их лигандов CCL5 и CCL20 в синовиальной жидкости, что соответствует активации Т-клеток. Эксперименты in vitro показали, что добавление синовиальной жидкости от пациентов с ОА к культурам клеток усиливает генез остеокластов и индуцируемую остеокластами резорбцию кости [19]. Провоспалительные цитокины ФНОα и ИЛ-1β, действующие через каскад NF-κB, стимулируют патологическую резорбцию кости, осуществляемую остеокластами, а также ингибируют дифференцировку и функцию остеобластов, что и приводит к снижению минерализации кости [20].
Негативные эффекты воспаления на костную ткань также опосредуются при участии тучных клеток. Тучные клетки секретируют широкий спектр медиаторов, способствующих активации остеокластов (гистамин, ФНОα, ИЛ-6) и ингибированию остеобластов (ИЛ-1β, ФНОα), тем самым внося вклад в патогенез первичного и вторичного остеопороза, ревматоидного артрита и остеоартрита. Поскольку ХС/ГС ингибируют NF-κB (один из основных медиаторов воспалительного ответа), можно предположить, что хондропротекторы будут компенсировать повреждающее воздействие гиперактивированных тучных клеток на костную и хрящевую ткани [21]. Заметим, что блокада активности цитокина ИЛ-6 на модели ишемического остеонекроза у мышей приводила к сохранению суставного хряща и увеличивала трабекулярный объем костной ткани [22][23].
В эксперименте показаны остеопротекторные эффекты ГС, который благоприятно воздействует на оба механизма сохранения костной ткани: ингибирование активности остеокластов и стимулирование остеобластов (кластер 2 на рисунке 1). ГС подавляет дифференцировку остеокластов за счет модуляции гликозилирования внутриклеточных белков. Добавление ГС подавляло активацию специфичных для остеокластов генов (тартрат-резистентной кислой фосфатазы TRAP, катепсина K, матриксной металлопептидазы-9) и провоспалительного активатора рецептора NF-κB [24]. ГС, улучшая дифференцировку остеобластов (линия клеток MC3T3-E1 в культуре), достоверно повышал экспрессию маркера средней стадии дифференциации остеобластов (остеопонтин) и маркеров поздней стадии дифференциации (остеокальцин и степень минерализации кости). ГС подавлял экспрессию активатора рецептора лиганда NF-κB RANKL (ключевой фактор, участвующий в дифференцировке и активации остеокластов), что соответствует упрочнению костного матрикса и уменьшению резорбции кости [25].
Модулируя баланс воспалительных и противовоспалительных процессов, ГС ослаблял резорбцию кости у мышей с моделью ОА, вызванного коллагеназой. Он ингибировал потерю протеогликанов в хряще, эрозию костей и образование остеофитов, снижая уровни провоспалительных RANKL, ИЛ-6 и индуцируя увеличение противовоспалительного ИЛ-10 в синовиальной жидкости. Глюкозамин ограничивал количество CD11b+ нейтрофилов и RANKL+ Т-клеток в суставах, подавлял резорбцию костей за счет ингибирования экспрессии RANKL, снижения экспрессии ростовых факторов BMP-2, TGF-3 и сигнального белка pSMAD-2 [26].
Показаны антирезорбтивные и противовоспалительные эффекты ХС (Хондрогард®, 2 мес) у пациентов с ОА коленного сустава и болями в пояснице (n=231). По сравнению с группой принимавших только нестероидные противовоспалительные препараты (НПВП), у больных в группе НПВП+Хондрогард® отмечено более выраженое снижение уровней изученных провоспалительных цитокинов. Также у пациентов, принимавших ХС+НПВП, наблюдалось достоверное (р<0,001) снижение уровней в моче маркеров костной резорбции бета-CrossLaps и дезоксипиридинолина (продукт разрушения коллагена остеокластами), что указывает на антирезорбтивный эффект стандартизированных форм ХС [27].
В рамках противовоспалительной терапии, направленной на остеопротекцию при ОА, следует подчеркнуть важность поддержания здоровой диеты. Например, приверженность средиземноморской диете (оливки, оливковое масло, авокадо, цельные зерна, бобы и орехи, рыба и другие морепродукты, большое количество овощей, очень мало красного мяса) связана с меньшим риском усиления боли у пациентов с ОА коленного сустава. Наблюдения за когортой участников (n=4330, средний возраст 61 год, 42% мужчин) в течение 4 лет показали, что у приверженцев средиземноморской диеты установлено снижение риска усиления боли на 4% (отношение рисков (ОР) 0,96; 95% доверительный интервал (ДИ) 0,91–0,99), а риска развития ОА, подтвержденного рентгенологически, – на 9% (ОР 0,91; 95% ДИ 0,82–0,99) [28].
Нарушения метаболизма костной ткани при остеартрите на фоне нарушений углеводного обмена / Disorders of bone metabolism in osteoarthritis during carbohydrate metabolism disorders
Сахарный диабет 2-го типа (СД2) стимулирует развитие ОА через окислительный стресс и хроническое воспаление, возникающее в результате хронической гипергликемии и инсулинорезистентности. Метформин, известный противодиабетический препарат, улучшает состояние костной ткани и снижает риск переломов у пациентов с сахарным диабетом. АМФ-активированная протеинкиназа (англ. AMP-activated protein kinase, AMPK), ключевая молекула в противодиабетическом механизме действия метформина, также участвует и в сигнальных путях, вовлеченных в физиологию костной ткани [29]. Таким образом, нормализация обмена углеводов играет важную роль в снижении деградации кости при ОА.
В эксперименте у крыс было показано, что ХС нормализует метаболизм глюкозы, снижает активность воспалительного процесса, экспрессию остеопротегерина и предотвращает развитие диабетического остеопороза, вызванного стрептозотоцином. Применение ХС (500 мг/кг/сут, 8 нед per os) сопровождалось уменьшением у животных избыточного апетита, снижением уровня глюкозы в крови, увеличением минеральной плотности костной ткани, улучшением морфологии костей и уменьшением количества остеокластов и адипоцитов в большеберцовой кости. После лечения ХС гистоморфометрические параметры кости вернулись к норме, уровни воспалительных цитокинов сыворотки ИЛ-1β, ИЛ-6 и ФНОα значительно снизились, активность сывороточных антиоксидантных ферментов (супероксид дисмутазы SOD1, глутатион пероксидазы GPX и каталазы CAT) увеличилась. Параллельно уровни сывороточной щелочной фрсфатазы, CTX-1, TRACP 5b, остеокальцина и RANKL снизились. Результаты иммуногистохимического исследования костной ткани показали, что ХС может эффективно увеличивать экспрессию костнообразующих белков остеопротеина остеопротегерин (ОПГ) и RUNX2 [30].
Остеопротекторные эффекты ХС могут быть оптимизированы действием стандартизированных экстрактов коллагена. В частности, экстракт неденатурированного коллагена II типа (англ. undenatured type II collagen, UC-II) тормозил деградацию костной ткани у старых мышей с гипергликемией (линия db/db), а прием UC-II приводил к повышению минерализации костей, снижению резорбции костной ткани и экспрессии воспалительных цитокинов ИЛ-1β, RANKL и TRAP [31].
Следует отметить, что наиболее часто назначаемые препараты против ОА (парацетамол, НПВП, кортикостероиды) могут быть не вполне безопасны у пациентов с СД2 [32]. В то же время ХС, ГС и пептиды коллагена можно безопасно назначать больным ОА в сочетании с СД2 даже при условии долговременного приема. Важным условием безопасности применения препаратов ХС и ГС является степень их очистки от примесей (что актуально, принимая во внимание природное происхождение экстрактов ХС и ГС). Комплексное сравнение препаратов на основе экстрактов ХС, включившее данные микроэлементного состава, содержание серы, хроматографического анализа и теста на общий белок, позволило выделить кластер наиболее стандартизированных препаратов ХС (в т.ч. Хондрогард®). Оценки фармацевтического качества исследованных экстрактов, выполненные по микроэлементному профилю, соответствуют оценкам качества по степени очистки от белков и молекулярно-весовым характеристикам экстрактов ХС [33].
Остеопения при остеоартрите, связанная с нарушениями обмена эстрогенов / Osteopenia in osteoarthritis associated with disorders of estrogen metabolism
Сочетание чрезмерного механического стресса и дефицита эстрогена после овариэктомии у 8-недельных самок мышей утяжеляет ОА височно-нижнечелюстного сустава. Гистоморфометрический анализ показал наименьшую толщину хряща по сравнению с контролем, а структурный анализ кости указал на значительно более низкую массу субхондральной кости, повышенные активность остеокластов, апоптоз хондроцитов и экспрессию провоспалительных цитокинов [34].
ХС и производные глюкозамина способствуют улучшению состояния костной ткани, которые сопровождают нарушения метаболизма эстрогенов. Глюкозамин и его производные уменьшают потерю костной массы, регулируя функцию остеокластов у мышей после овариэктомии. После 12 нед кормления 0,2% ГС и 0,2% N-ацетилглюкозамином минеральная плотность бедренной кости значительно увеличилась по сравнению с контрольной диетой. Гистоморфометрический анализ показал, что степень эрозии большеберцовой кости у мышей, получавших ГС или N-ацетилглюкозамин, была значительно ниже, чем в контроле [35].
Прием N-ацетилглюкозамина в эксперименте у крыс с удаленными яичниками (модель постменопаузального остеопороза) предотвращал потерю костной массы. N-ацетилглюкозамин увеличивал объем трабекулярной кости и количество трабекул, содержание кальция в бедренной и большеберцовой костях, улучшал биомеханические свойства бедренной кости, повышал содержание кальция и снижал уровень щелочной фосфатазы в сыворотке крови. Данное производное глюкозамина способствовало делению и дифференцировке остеобластов, защищая их от окислительного стресса [36].
ХС-4,6-дисульфат связывается с белком остеоактивином, блокируя его связывание с клетками и ингибируя дифференцировку остеокластов [37]. ХС-4,6-дисульфат опосредует анаболизм кости, индуцированный эстрогеном [38].
При прогнозировании риска остеопороза у пациенток с ОА (чувствительность 78%, специфичность 76%) наиболее значимыми предикторами были возраст, индекс массы тела, продолжительность грудного вскармливания, гиперлипидемия, гипертоническая болезнь или СД2 в анамнезе, продолжительность менопаузы, терапия эстрогенами [39]. Пациенткам с соответствующими факторами риска остеопороза можно порекомендовать регулярный прием ХС и ГС для снижения резорбции кости.
Болевая симптоматика при усиленной резорбции кости на фоне остеоартрита / Pain symptoms with increased bone resorption during osteoarthritis
В эксперименте у мышей с моделью ОА отмечена интенсификация распада костной ткани, остеопороза и болевых ощущений [40]. Было показано, что гормон паращитовидной железы ослабляет боль при ОА: происходят ремоделирование субхондральной кости, улучшение микроархитектуры кости, снижение уровня простагландина E2 и улучшение сенсорной иннервации надкостницы [41].
У людей с ОА коленного сустава предиктором боли является уровень биомаркера костного обмена TRAcP5b (тартрат-резистентная кислая фосфатаза 5b) в сыворотке крови. Данный фермент в больших количествах экспрессируется остеокластами и воспалительными макрофагами, разрушающими ткань кости [42]. У пациентов с ОА голеностопного сустава, подтвержденного магнитно-резонансной томографией, костные изменения достоверно ассоциировались с усилением боли [43].
Метаанализ 8 контролируемых исследований (n=771, возраст 53,6±6,2 года) применения препарата Хондрогард® в комплексной терапии ОА подтвердил ассоциации между применением препарата и снижением боли по визуальной аналоговой шкале, индексу Лекена и по WOMAС (англ. Western Ontario and McMaster Universities Osteoarthritis Index) [44].
Непосредственные эффекты ХС и ГС на баланс процессов резорбции-синтеза костной ткани / Direct effects of HS and GS on the balance of bone resorption-synthesis processes
Нормальный метаболизм эндогенных форм ХС принципиально важен для полноценной минерализации кости. Эндогенные сульфатированные ХС и другие гликозаминогликаны (ГАГ) поддерживают функции остеобластов и одновременно подавляют активность остеокластов. В частности, добавление высокосульфатированных ГАГ к культуре остеобластов приводило к тому, что экспрессия маркеров остеобластов (щелочная фосфатаза, ОПГ и остеокальцин) увеличивалась на порядок (р<0,05), а отложение кальция – в 4 раза (р<0,05). Сульфатирование ГАГ привело к значительному ингибированию дифференцировки и резорбции остеокластов, что зависело от степени сульфатирования ГАГ, а не от состава моносахаридов [45]. Высокосульфатированные ХС дозозависимо подавляли дифференцировку остеокластов, экспрессию таких белковых маркеров остеокластов, как TRAP, катепсин K, SWAP-70 и OSCAR (на 63–95%) [46].
Косвенным подтверждением важности эндогенных ХС для метаболизма кости являются мукополисахаридозы – редкие генетические заболевания, при которых нарушается лизосомная деградация ГАГ. Например, инактивация арилсульфатазы K вызывает мукополисахаридоз из-за недостаточной десульфатации эндогенных ГАГ гепарансульфата и ХС [47]. В результате накапливающиеся внутри лизосом метаболиты ГАГ стимулируют развитие неврологической симптоматики и аномалий в различных органах (печень, почки, селезенка и кости). В частности, эндохондральная оссификация существенно замедляется у пациентов с мукополисахаридозом VII, при котором происходит прогрессирующая деформация скелета (кифосколиоз, дисплазия суставов и т.д.) [48].
Нарушения баланса роста, дифференциации и активности остеобластов и остеокластов определяют патогенез ОА, ревматоидного артрита, спондилоартрита и остеопороза. Выше было отмечено, что экзогенные ХС и ГС могут тормозить резорбцию кости, ассоциированную с воспалением, инсулинорезистентностью и нарушениями обмена эстрогенов. Эффекты ХС и ГС реализуются посредством рецепторов CD44 [49].
Данный рецептор экспрессируется в заметных количествах в костной ткани. Например, в проксимальном отделе большеберцовой кости крыс рецептор CD44 обнаружен на различных типах клеток – остеокластах, хондрокластах, остеоцитах, кроветворных клетках костного мозга, синовиальных клетках, фибробластах соединительной ткани, региональных областях надкостницы и эндоста (вокруг остеобластов, остеопрогениторных клеток и остеокластов) [50].
Прием ХС+ГС дозозависимо снижал встречаемость нарушений опорно-двигательного аппарата у цыплят-бройлеров. Увеличение дозы ГС линейно увеличивало прибавку в весе птиц в период от 1 до 42 дней (р=0,047), количество бройлеров без дегенерации бедренной кости (р<0,02), а также площадь пролиферирующего хряща проксимального эпифиза (р=0,028). Увеличение суммарной дозы ХС+ГС увеличивало число бройлеров без вальгусных или варусных отклонений (р=0,014) [51].
Исследования остеокластов/остеобластов человека в культуре показали положительное влияние ГС на качество кости. Мелкокристаллический ГС снижал дифференцировку и функцию остеокластов, в особенности клеток, выделенных от пациентов с ОА. ГС также усиливал метаболические процессы в остеобластах [52]. Глюкозамин способствует делению остеобластов (линия FOB1.19), модулируя аутофагию посредством ингибирования белка mTOR. При более низких концентрациях (менее 0,6 мМ) он стимулировал пролиферацию остеобластов, а при более высоких концентрациях (более 0,8 мМ) доказана его способность к индукции апоптоз [53].
ЗАКЛЮЧЕНИЕ / CONCLUSION
Остеорезорбция неразрывно связана с деструкцией хряща при прогрессировании остеоартрита. Патофизиология остеорезорбции при ОА многогранна и включает, в частности, эффекты провоспалительных цитокинов (ИЛ-1β, ИЛ-6, ИЛ-17, ИЛ-22, CCL5, CCL20, ФНОα, RANKL), дефицит эстрогенов (прежде всего в период менопаузы), нарушения углеводного обмена (инсулинорезистентность). Хроническое воспаление, опосредованное активацией каскада NF-κB, развивается в синовиальной оболочке, хряще и костной ткани, нарушая баланс активности остеобластов и остеокластов, что приводит к снижению минерализации костной ткани.
Результаты представленного систематического компьютерного анализа показывают, что применение хондропротекторов (ХС, ГС, пептиды коллагена) при ОА способствует поддержке не только хрящевой ткани, но и костной основы сустава. При этом ХС и ГС положительно влияют на различные патофизиологические механизмы резорбции костной ткани на фоне ОА (воспаление, дефицит эстрогенов, инсулинорезистентность). Результаты исследований, представленные в статье, указывают на эффективное торможение резорбции кости при использовании каждого из хондропротекторов (ХС, ГС, стандартизированные пептиды коллагена) в отдельности. Поэтому перспективно исследовать общий эффект всех трех разновидностей хондропротекторов при совместном применении.
Список литературы
1. Herrero-Beaumont G., Pérez-Baos S., Sánchez-Pernaute O., et al. Targeting chronic innate inflammatory pathways, the main road to prevention of osteoarthritis progression. Biochem Pharmacol. 2019; 165: 24–32. https://doi.org/10.1016/j.bcp.2019.02.030.
2. Громова О.А., Торшин И.Ю., Лила А.М. и др. Стандартизированные формы хондроитина сульфата как патогенетическое средство лечения остеоартрита в контексте постгеномных исследований. Современная ревматология. 2021; 15 (1): 136–43. https://doi.org/10.14412/1996-7012-2021-1-136-143.
3. Barreto G., Manninen M., Eklund K.K. Osteoarthritis and toll-like receptors: when innate immunity meets chondrocyte apoptosis. Biology (Basel). 2020; 9 (4): 65. https://doi.org/10.3390/biology9040065.
4. Торшин И.Ю., Громова О.А., Нечаева Г.И. и др. Систематический анализ молекулярно-биологических механизмов поддержки хондроитина сульфатом метаболизма соединительной ткани. Неврология, нейропсихиатрия, психосоматика. 2021; 13 (1): 154– 62. https://doi.org/10.14412/2074-2711-2021-1-154-162.
5. Goerres G.W., Häuselmann H.J., Seifert B., et al. Patients with knee osteoarthritis have lower total hip bone mineral density in the symptomatic leg than in the contralateral hip. J Clin Densitom. 2005; 8 (4): 484–7. https://doi.org/10.1385/jcd:8:4:484.
6. Yu D., Xu J., Liu F., et al. Subchondral bone changes and the impacts on joint pain and articular cartilage degeneration in osteoarthritis. Clin Exp Rheumatol. 2016; 34 (5): 929–34.
7. Salbach J., Rachner T.D., Rauner M., et al. Regenerative potential of glycosaminoglycans for skin and bone. J Mol Med (Berl). 2012; 90 (6): 625–35. https://doi.org/10.1007/s00109-011-0843-2.
8. Fournier P., Dupuis Y. Antirachitic power of various socalled structural compounds: lactose, glucosamine, L-xylose, mannitol. C R Hebd Seances Acad Sci. 1960; 250: 3050–2 (на фр. яз.).
9. Шавловская О.А., Золотовская И.А., Прокофьева Ю.С. Антирезорбтивная активность фармацевтического хондроитина сульфата у лиц старшей возрастной группы. Терапевтический архив. 2020; 92 (12): 75–9. https://doi.org/10.26442/00403660.2020.12.200448.
10. Torshin I.Yu., Rudakov K.V. On the theoretical basis of the metric analysis of poorly formalized problems of recognition and classification. Pattern Recognition and Image Analysis. 2015; 25 (4): 577–87. https://doi.org/10.1134/S1054661815040252.
11. Torshin I.Yu., Rudakov K.V. On metric spaces arising during formalization of problems of recognition and classification. Part 1: properties of compactness. Pattern Recognition and Image Analysis. 2016; 26 (2): 274–84. https://doi.org/10.1134/S1054661816020255.
12. Торшин И.Ю., Громова О.А., Стаховская Л.В. и др. Анализ 19,9 млн публикаций базы данных PubMed/MEDLINE методами искусственного интеллекта: подходы к обобщению накопленных данных и феномен “fake news”. ФАРМАКОЭКОНОМИКА. Современная фармакоэкономика и фармакоэпидемиология. 2020; 13 (2): 146–63. https://doi.org/10.17749/2070-4909/farmakoekonomika.2020.021.
13. Stanford Biomedical Network Dataset Collection. URL: http://snap.stanford.edu/biodata (дата обращения 27.12.2021).
14. The Gene Ontology Consortium. The Gene Ontology Resource: 20 years and still GOing strong. Nucleic Acids Res. 2019; 47 (D1): D330– 8. https://doi.org/10.1093/nar/gky1055.
15. Maeda K., Kobayashi Y., Koide M., et al. The regulation of bone metabolism and disorders by Wnt signaling. Int J Mol Sci. 2019; 20 (22): 5525. https://doi.org/10.3390/ijms20225525.
16. Deng H., Liu H., Yang Z., et al. Progress of selenium deficiency in the pathogenesis of arthropathies and selenium supplement for their treatment. Biol Trace Elem Res. 2021; Nov. 15. https://doi.org/10.1007/s12011-021-03022-4.
17. Hong S.W., Kang J.H. Bone mineral density, bone microstructure, and bone turnover markers in females with temporomandibular joint osteoarthritis. Clin Oral Investig. 2021; 25 (11): 6435–48. https://doi.org/10.1007/s00784-021-03946-0.
18. Lin Z., Miao J., Zhang T., et al. d-Mannose suppresses osteoarthritis development in vivo and delays IL-1β-induced degeneration in vitro by enhancing autophagy activated via the AMPK pathway. Biomed Pharmacother. 2021; 135: 111199. https://doi.org/10.1016/j.biopha.2020.111199.
19. Monasterio G., Castillo F., Rojas L., et al. Th1/Th17/Th22 immune response and their association with joint pain, imagenological bone loss, RANKL expression and osteoclast activity in temporomandibular joint osteoarthritis: a preliminary report. J Oral Rehabil. 2018; 45 (8): 589–97. https://doi.org/10.1111/joor.12649.
20. Berardi S., Corrado A., Maruotti N., et al. Osteoblast role in the pathogenesis of rheumatoid arthritis. Mol Biol Rep. 2021; 48 (3): 2843–52. https://doi.org/10.1007/s11033-021-06288-y.
21. Ragipoglu D., Dudeck A., Haffner-Luntzer M., et al. The role of mast cells in bone metabolism and bone disorders. Front Immunol. 2020; 11: 163. https://doi.org/10.3389/fimmu.2020.00163.
22. Kamiya N., Kuroyanagi G., Aruwajoye O., Kim H.K.W. IL6 receptor blockade preserves articular cartilage and increases bone volume following ischemic osteonecrosis in immature mice. Osteoarthritis Cartilage. 2019; 27 (2): 326–35. https://doi.org/10.1016/j.joca.2018.10.010.
23. Ren Y., Deng Z., Gokani V., et al. Anti-interleukin-6 therapy decreases hip synovitis and bone resorption and increases bone formation following ischemic osteonecrosis of the femoral head. J Bone Miner Res. 2021; 36 (2): 357–68. https://doi.org/10.1002/jbmr.4191.
24. Takeuchi T., Sugimoto A., Imazato N., et al. Glucosamine suppresses osteoclast differentiation through the modulation of glycosylation including O-GlcNAcylation. Biol Pharm Bull. 2017; 40 (3): 352–6. https://doi.org/10.1248/bpb.b16-00877.
25. Nagaoka I., Igarashi M., Sakamoto K. Biological activities of glucosamine and its related substances. Adv Food Nutr Res. 2012; 65: 337–52. https://doi.org/10.1016/B978-0-12-416003-3.00022-6.
26. Ivanovska N., Dimitrova P. Bone resorption and remodeling in murine collagenase-induced osteoarthritis after administration of glucosamine. Arthritis Res Ther. 2011; 13 (2): R44. https://doi.org/10.1186/ar3283.
27. Золотовская И.А., Давыдкин И.Л. Антирезорбтивноцитокиновые эффекты хондропротективной терапии у пациентов с болью в нижней части спины. Журнал неврологии и психиатрии им. С.С. Корсакова. 2020; 120 (4): 65–71. https://doi.org/10.17116/jnevro202012004165.
28. Veronese N., Koyanagi A., Stubbs B., et al. Mediterranean diet and knee osteoarthritis outcomes: a longitudinal cohort study. Clin Nutr. 2019; 38 (6): 2735–9. https://doi.org/10.1016/j.clnu.2018.11.032.
29. Bahrambeigi S., Yousefi B., Rahimi M., Shafiei-Irannejad V. Metformin; an old antidiabetic drug with new potentials in bone disorders. Biomed Pharmacother. 2019; 109: 1593–601. https://doi.org/10.1016/j.biopha.2018.11.032.
30. Zheng H.X., Chen J., Zu Y.X., et al. Chondroitin sulfate prevents STZ induced diabetic osteoporosis through decreasing blood glucose, antioxidative stress, anti-inflammation and OPG/RANKL expression regulation. Int J Mol Sci. 2020; 21 (15): 5303. https://doi.org/10.3390/ijms21155303.
31. Fan R., Hao Y., Liu X., et al. Undenatured type II collagen relieves bone impairment through improving inflammation and oxidative stress in ageing db/db mice. Molecules. 2021; 26 (16): 4942. https://doi.org/10.3390/molecules26164942.
32. Veronese N., Cooper C., Reginster J.Y., et al. Type 2 diabetes mellitus and osteoarthritis. Semin Arthritis Rheum. 2019; 49 (1): 9–19. https://doi.org/10.1016/j.semarthrit.2019.01.005.
33. Громова О.А., Торшин И.Ю., Зайчик Б.Ц. и др. О различиях в стандартизации лекарственных препаратов на основе экстрактов хондроитина сульфата. ФАРМАКОЭКОНОМИКА. Современная фармакоэкономика и фармакоэпидемиология. 2021; 14 (1): 40– 52. https://doi.org/10.17749/2070-4909/farmakoekonomika.2021.083.
34. Wu Y., Kadota-Watanabe C., Ogawa T., Moriyama K. Combination of estrogen deficiency and excessive mechanical stress aggravates temporomandibular joint osteoarthritis in vivo. Arch Oral Biol. 2019; 102: 39–46. https://doi.org/10.1016/j.archoralbio.2019.03.012.
35. Asai H., Nakatani S., Kato T., et al. Glucosamines attenuate bone loss due to menopause by regulating osteoclast function in ovariectomized mice. Biol Pharm Bull. 2016; 39 (6): 1035–41. https://doi.org/10.1248/bpb.b16-00066.
36. Jiang Z., Li Z., Zhang W., et al. Dietary natural N-acetyl-Dglucosamine prevents bone loss in ovariectomized rat model of postmenopausal osteoporosis. Molecules. 2018; 23 (9): 2302. https://doi.org/10.3390/molecules23092302.
37. Miyazaki T., Miyauchi S., Anada T., et al. Chondroitin sulfate-E binds to both osteoactivin and integrin αVβ3 and inhibits osteoclast differentiation. J Cell Biochem. 2015; 116 (10): 2247–57. https://doi.org/10.1002/jcb.25175.
38. Koike T., Mikami T., Shida M., et al. Chondroitin sulfate-E mediates estrogen-induced osteoanabolism. Sci Rep. 2015; 5: 8994. https://doi.org/10.1038/srep08994.
39. Yoo T.K., Kim S.K., Kim D.W., et al. Osteoporosis risk prediction for bone mineral density assessment of postmenopausal women using machine learning. Yonsei Med J. 2013; 54 (6): 1321–30. https://doi.org/10.3349/ymj.2013.54.6.1321.
40. Kiyomoto K., Iba K., Hanaka M., et al. High bone turnover state under osteoporotic changes induces pain-like behaviors in mild osteoarthritis model mice. J Bone Miner Metab. 2020; 38 (6): 806–18. https://doi.org/10.1007/s00774-020-01124-y.
41. Sun Q., Zhen G., Li T.P., et al. Parathyroid hormone attenuates osteoarthritis pain by remodeling subchondral bone in mice. Elife. 2021; 10: e66532. https://doi.org/10.7554/eLife.66532.
42. Nwosu L.N., Allen M., Wyatt L., et al. Pain prediction by serum biomarkers of bone turnover in people with knee osteoarthritis: an observational study of TRAcP5b and cathepsin K in OA. Osteoarthritis Cartilage. 2017; 25 (6): 858–65. https://doi.org/10.1016/j.joca.2017.01.002.
43. Nakamura Y., Uchiyama S., Kamimura M., et al. Bone alterations are associated with ankle osteoarthritis joint pain. Sci Rep. 2016; 6: 18717. https://doi.org/10.1038/srep18717.
44. Торшин И.Ю., Лила А.М., Наумов А.В. и др. Метаанализ клинических исследований эффективности лечения остеоартита препаратом Хондрогард. ФАРМАКОЭКОНОМИКА. Современная фармакоэкономика и фармакоэпидемиология. 2020; 13 (4): 18– 29. https://doi.org/10.17749/2070-4909/farmakoekonomika.2020.066.
45. Salbach-Hirsch J., Ziegler N., Thiele S., et al. Sulfated glycosaminoglycans support osteoblast functions and concurrently suppress osteoclasts. J Cell Biochem. 2014; 115 (6): 1101–11. https://doi.org/10.1002/jcb.24750.
46. Salbach J., Kliemt S., Rauner M., et al. The effect of the degree of sulfation of glycosaminoglycans on osteoclast function and signaling pathways. Biomaterials. 2012; 33 (33): 8418–29. https://doi.org/10.1016/j.biomaterials.2012.08.028.
47. Trabszo C., Ramms B., Chopra P., et al. Arylsulfatase K inactivation causes mucopolysaccharidosis due to deficient glucuronate desulfation of heparan and chondroitin sulfate. Biochem J. 2020; 477 (17): 3433–51. https://doi.org/10.1042/BCJ20200546.
48. Peck S.H., Tobias J.W., Shore E.M., et al. Molecular profiling of failed endochondral ossification in mucopolysaccharidosis VII. Bone. 2019; 128: 115042. https://doi.org/10.1016/j.bone.2019.115042.
49. Лила А.М., Громова О.А., Торшин И.Ю. и др. Молекулярные эффекты хондрогарда при остеоартрите и грыжах межпозвоночного диска. Неврология, нейропсихиатрия, психосоматика. 2017; 9 (3): 88–97. https://doi.org/10.14412/2074-2711-2017-3-88-97.
50. Noonan K.J., Stevens J.W., Tammi R., et al. Spatial distribution of CD44 and hyaluronan in the proximal tibia of the growing rat. J Orthop Res. 1996; 14 (4): 573–81. https://doi.org/10.1002/jor.1100140411.
51. Martins J.M.S., Dos Santos Neto L.D., Noleto-Mendonça R.A., et al. Dietary supplementation with glycosaminoglycans reduces locomotor problems in broiler chickens. Poult Sci. 2020; 99 (12): 6974–82. https://doi.org/10.1016/j.psj.2020.09.061.
52. Lambertini E., Penolazzi L., Pandolfi A., et al. Human osteoclasts/ osteoblasts 3D dynamic co culture system to study the beneficial effects of glucosamine on bone microenvironment. Int J Mol Med. 2021; 47 (4): 57. https://doi.org/10.3892/ijmm.2021.4890.
53. Lv C., Wang L., Zhu X., et al. Glucosamine promotes osteoblast proliferation by modulating autophagy via the mammalian target of rapamycin pathway. Biomed Pharmacother. 2018; 99: 271–7. https://doi.org/10.1016/j.biopha.2018.01.066.
Об авторах
О. А. ГромоваРоссия
д.м.н., профессор, научный руководитель,
ул. Вавилова, д. 4, Москва 2119333
А. М. Лила
Россия
д.м.н., профессор, директор,
Каширское ш., д. 34А, Москва 115522
И. Ю. Торшин
Россия
к.ф-м.н., к.х.н., старший научный сотрудник,
ул. Вавилова, д. 4, Москва 2119333
И. А. Рейер
Россия
к.т.н., научный сотрудник,
ул. Вавилова, д. 4, Москва 2119333
Рецензия
Для цитирования:
Громова О.А., Лила А.М., Торшин И.Ю., Рейер И.А. О перспективах применения хондропротекторов для торможения остеодеструктивных процессов в субхондральной кости при остеоартрите. ФАРМАКОЭКОНОМИКА. Современная фармакоэкономика и фармакоэпидемиология. 2022;15(1):107-118. https://doi.org/10.17749/2070-4909/farmakoekonomika.2022.126
For citation:
Gromova О.А., Lila А.М., Torshin I.Yu., Reier I.А. Application of chondroprotective agents to inhibit osteodestructive processes in the subchondral bone in patients with osteoarthritis. FARMAKOEKONOMIKA. Modern Pharmacoeconomics and Pharmacoepidemiology. 2022;15(1):107-118. https://doi.org/10.17749/2070-4909/farmakoekonomika.2022.126

Контент доступен под лицензией Creative Commons Attribution-NonCommercial-ShareAlike 4.0 International License.






































