Перейти к:
Эффективность применения искусственного интеллекта в клинической медицине
https://doi.org/10.17749/2070-4909/farmakoekonomika.2025.287
Аннотация
Цель: исследовать эффективность применения искусственного интеллекта (ИИ) в клинической медицине (на основе показателей точности, чувствительности и специфичности).
Материал и методы. Проведены поиск и анализ научных публикаций, представленных в базах данных PubMed/MEDLINE, Scopus, Web of Science, Embase, eLibrary и КиберЛенинка с 2009 по 2023 гг. и включающих различные виды и подходы к обучению ИИ, а так же различные сферы его применения в клинической практике. Методом последовательного анализа статей, попавших в случайную выборку, было отобрано 30 публикаций, посвященных применению ИИ в эндокринологии (4 статьи), дерматовенерологии (3), кар диологии (1), рентгенологии (1), гастроэнтерологии (1), неврологии (5), гематологии (5), нефрологии (4), ортопедии и ревматоло гии (4), онкологии (2).
Результаты. ИИ продемонстрировал достаточную эффективность: точность варьировалась от 49% до 99%, чувствительность – от 42% до 100%, а специфичность – от 48% до 100% в таких областях, как кардиология, эндокринология, гастроэнтерология, дерма товенерология и рентгенология. В некоторых случаях ИИ превосходил по эффективности клиническую диагностику врачей-специа листов, например при выявлении меланомы и в диагностике фибрилляции предсердий.
Заключение. ИИ показывает высокую эффективность в диагностике, повышает точность и ускоряет проведение диагностического поиска, что делает перспективным его более широкое применение в клинической медицине.
Ключевые слова
Для цитирования:
Корабельников Д.И., Ламоткин А.И. Эффективность применения искусственного интеллекта в клинической медицине. ФАРМАКОЭКОНОМИКА. Современная фармакоэкономика и фармакоэпидемиология. 2025;18(1):114-124. https://doi.org/10.17749/2070-4909/farmakoekonomika.2025.287
For citation:
Korabelnikov D.I., Lamotkin A.I. The effectiveness of using artificial intelligence in clinical medicine. FARMAKOEKONOMIKA. Modern Pharmacoeconomics and Pharmacoepidemiology. 2025;18(1):114-124. (In Russ.) https://doi.org/10.17749/2070-4909/farmakoekonomika.2025.287
ВВЕДЕНИЕ / INTRODUCTION
Искусственный интеллект (ИИ) – это обширная отрасль компьютерных наук, связанная с созданием интеллектуальных компьютерных программ, способных выполнять задачи, которые обычно требуют человеческого интеллекта. Некоторые приложения ИИ включают автоматизированные интерфейсы для визуального восприятия, распознавания речи, принятия решений и перевода с одного языка на другой. В повседневной жизни человек сталкивается с технологиями ИИ в таких областях, как персонализированная реклама, голосовые помощники, системы распознавания речи и изображения, а также поиск в интернете [1].
Современные технологии все активнее интегрируются в клиническую медицину, особенно через ИИ. Он широко применяется для повышения точности диагностики и лечения, например при кожных заболеваниях, сердечных болезнях, диабете и анализе рентгеновских изображений [2–5]. Количество исследований и публикаций об использовании ИИ в клинической медицине растет [4]. Технологии ИИ уже изменяют медицинскую практику, однако важно учитывать его влияние на качество медицинских услуг и оценивать его эффективность [5].
Для оценки эффективности ИИ и сравнения ее с результатами клинической практики врачей используются различные показатели эффективности.
Матрица ошибок (англ. сonfusion matrix) – это таблица для оценки производительности алгоритма классификации. Она использует целевые значения для сравнения с прогнозируемыми значениями машинного обучения. Каждая строка в матрице представляет экземпляры прогнозируемого класса, а каждый столбец – экземпляры фактического класса или наоборот.
Матрицу ошибок можно разделить на четыре комбинации [6]:
– истинно положительный (ИП) результат указывает, что заболевание есть, и оно действительно есть;
– ложноположительный (ЛП) результат указывает, что заболевание есть, но на самом деле его нет;
– истинно отрицательный (ИО) результат указывает, что заболевания нет, и его действительно нет;
– ложно отрицательный (ЛО) результат указывает, что заболевания нет, но на самом деле оно есть.
Точность (англ. accuracy, Ac) – это способность модели давать правильный результат относительно общего количества исследований, которая рассчитывается по формуле [6]:
Ac = (ИП + ИО) / все исследования × 100%.
Взвешенная ошибка (англ. weighted error) – это метрика, используемая для оценки качества моделей машинного обучения в задаче бинарной классификации. Бинарная классификация – метод машинного обучения, при котором объекты делятся на два класса или категории. Например, 0 – заболевание отсутствует, 1 – заболевание есть. Это способ оценки качества моделей, которые учатся на примерах и делают прогнозы [7]. Особенность данной метрики в том, что она учитывает не только правильные прогнозы, но и случаи, когда модель ошибается, называя отрицательные случаи положительными. Это важно для того, чтобы понять, насколько хорошо модель справляется с задачей.
Специфичность (англ. specificity, Sp) – это показатель, отражающий точность работы модели бинарной классификации. Специфичность определяется как отношение числа истинно отрицательных результатов к сумме истинно отрицательных и ложноположительных результатов:
Sp = ИО / (ИО + ЛП).
Если число ложноположительных результатов велико, т.е. модель допустила большое количество ошибок, распознав отрицательные примеры как положительные, то специфичность стремится к 0. Напротив, если число ложноположительных наблюдений стремится к 0, то специфичность стремится к 1. Модель, обладающая высокой специфичностью, обеспечивает бо́льшую вероятность правильного распознавания для отрицательных наблюдений [8].
Чувствительность (англ. sensitivity, Se) – это показатель, отражающий точность модели бинарной классификации. Он определяется как отношение числа истинно положительных результатов к сумме истинно положительных и ложноотрицательных результатов:
Se = ИП / (ИП + ЛО).
Чувствительность тем ниже, чем больше число ложноотрицательных наблюдений, т.е. положительных наблюдений, ошибочно распознанных как отрицательные. Верхний предел чувствительности равен 1, когда ложноотрицательные результаты отсутствуют, т.е. не допущено ни одной ошибки. Модель, обладающая высокой чувствительностью, обеспечивает бо́льшую вероятность правильного распознавания для положительных примеров [9].
Площадь под кривой (англ. area under curve, AUC) рабочей характеристики приемника (англ. receiver operating characteristic, ROC), или так называемая кривая ошибок, – это метрика оценки для задач бинарной классификации (англ. binary classification). AUС ROC является мерой способности классификатора различать классы и используется в качестве сводки ROC-кривой [10][11]. AUC и ROC представлены на рисунке 1.
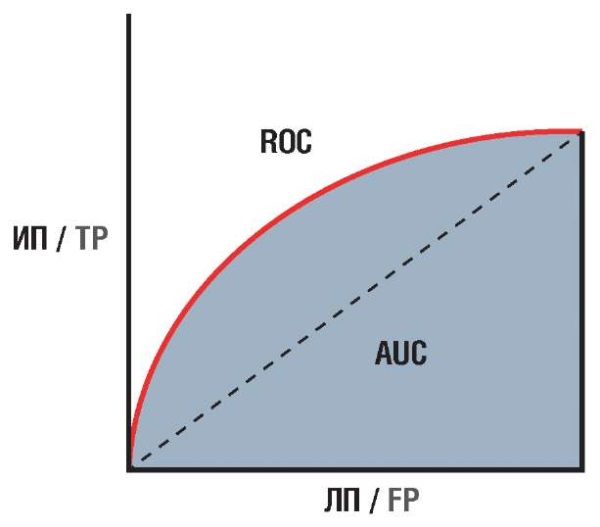
Рисунок 1. Площадь под кривой (англ. area under curve, AUC) рабочей характеристики приемника (англ. receiver operating characteristic, ROC).
ЛП – ложноположительные результаты; ИП – истинно положительные результаты
Figure 1. Area under curve (AUC) of receiver operating characteristic (ROC).
FP – false positive results; TP – true positive results
AUС ROC показывает, насколько хорошо модель разделяет два класса: объекты положительного класса и объекты отрицательного класса. Значение AUС ROC может варьироваться от 0 до 1, где 0 соответствует случайному классификатору, а 1 – идеальному классификатору. Чем выше значение AUС ROC, тем лучше модель способна различать между объектами двух классов. AUС ROC также можно интерпретировать как вероятность того, что случайно выбранный объект положительного класса будет оценен моделью выше, чем случайно выбранный объект отрицательного класса [11].
Индекс Юдена (также известный как индекс J или статистика Юдена) – это показатель эффективности диагностического теста, который используется для оценки точности бинарной классификации. Он рассчитывается по формуле:
J = Se + Sp – 1.
Индекс Юдена варьируется от 0 до 1, где 1 означает идеальный тест (100% чувствительность и специфичность), а 0 означает, что тест не лучше случайного угадывания. Таким образом, чем выше индекс Юдена, тем лучше способность теста различать положительные и отрицательные случаи.
Цель – исследовать эффективность применения ИИ в клинической медицине (на основе показателей точности, чувствительности и специфичности).
МАТЕРИАЛ И МЕТОДЫ / MATERIAL AND METHODS
Поисковая стратегия / Search strategy
На первом этапе поиск в наукометрических базах данных PubMed/MEDLINE, Scopus, Web of Science, Embase, eLibrary и КиберЛенинка был проведен с помощью сочетаний ключевых слов “medicine” или “healthcare”, “artificial intelligence” или “neural network”, “machine learning” и “deep learning”. Для поиска русскоязычной литературы в научных электронных библиотеках eLibrary и КиберЛенинка использовали ключевые слова: «медицина» или «здравоохранение», «искусственный интеллект» или «нейронные сети», «машинное обучение» или «глубокое обучение».
На втором этапе к найденным на первом этапе публикациям применяли сочетания ключевых слов “clinical practice” или “clinical medicine”, “diagnosis” или “treatment” / “therapy”. Для поиска русскоязычной литературы использовали ключевые словосочетания «клиническая практика» или «клиническая медицина», «диагностика» или «лечение» / «терапия».
На третьем этапе к отобранным на втором этапе публикациям применяли сочетания ключевых слов “efficiency”, “accuracy”, “sensitivity” и “specificity”. Для поиска русскоязычной литературы использовали ключевые слова «эффективность», «точность», «чувствительность» и «специфичность».
На четвертом этапе с использованием метода случайной последовательной выборки 30 научных статей проводилась оценка качества исследований на основе:
– методологии исследования;
– описания использованных методов оценки эффективности ИИ;
– адекватности подходов к исследованию эффективности ИИ;
– репрезентативности выборок;
– качества данных (сбор, обработка) для обучения ИИ.
Глубина поиска: статьи, опубликованные с 2009 по 2023 гг.
Критерии включения и исключения / Inclusion and exclusion criteria
В обзор включали статьи на русском и английском языках, описывающие применение ИИ в клинической медицине и опубликованные за последние 15 лет (с 2009 по 2023 гг.). Не включали статьи на отличных от английского и русского языках, публикации, описывающие применение ИИ в смежных, но не клинических областях медицины (например, исследования, посвященные только теоретическим аспектам ИИ без практического применения в клинической медицине).
Критерии исключения:
– публикации по результатам исследований, не прошедшие оценку качества;
– публикации, в которых отсутствовала оценка эффективности ИИ.
Процесс отбора научных статей / The process of selecting scientific articles
Методология поиска представлена на рисунке 2. Первоначальный поиск по ключевым словам выявил 3022 статьи, опубликованные с 2009 по 2023 гг. После отбора на втором этапе осталось 758 публикаций. На третьем этапе было отобрано 226 публикаций. На четвертом этапе методом случайной выборки в анализ были включены 30 статей.
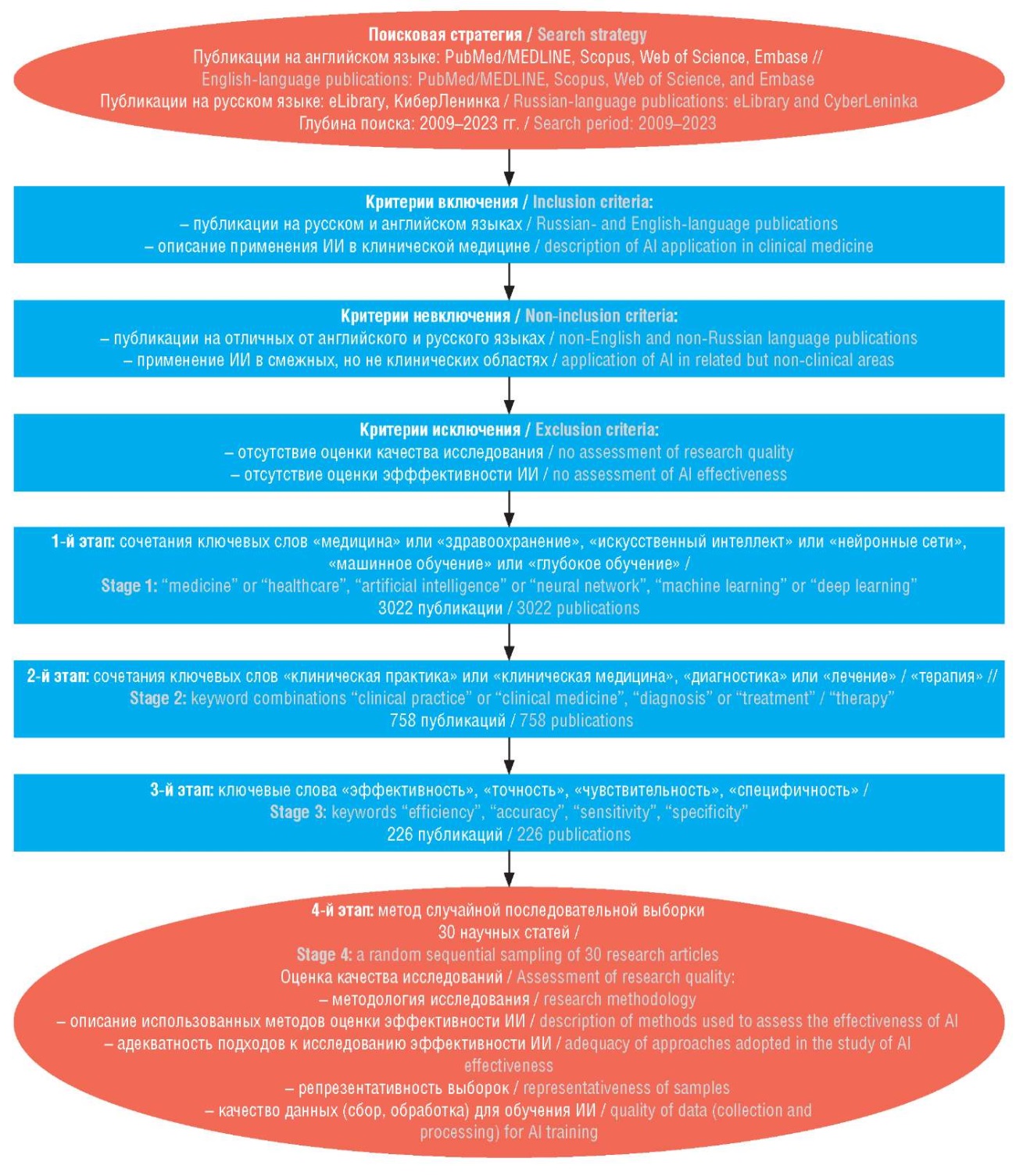
Рисунок 2. Блок-схема отбора и анализа первоисточников.
ИИ – искусственный интеллект
Figure 2. Flowchart for the selection and analysis of sources.
AI – artificial intelligence
После прохождения первичного анализа выполнялась оценка качества публикаций, адекватности подходов к исследованию эффективности ИИ по нескольким ключевым критериям. Анализировали методологию исследования, включая четкость формулировок целей, описание использованных методов и дизайна исследования, достаточность и репрезентативность выборок. Оценивали, насколько подходы к исследованию эффективности ИИ были адекватны задачам клинической практики. Публикации охватывали различные методы машинного обучения и глубокого обучения, а также их применение в клинической медицине. В статьях часто использовались методы обучения с учителем (англ. supervised learning) и глубокое обучение, включая сверточные нейронные сети (англ. сonvolutional neural network, CNN), деревья решений, методы регрессии опорных векторов и искусственные нейронные сети. Эти подходы направлены на решение задач классификации, прогнозирования и диагностики различных заболеваний.
Затем проверяли качество данных (в т.ч. их репрезентативность, методы сбора и обработки, статистики), необходимых для оценки достоверности результатов. Также рассматривали наличие сравнения данных о точности модели с клиническими данными, позволяющего оценить эффективность ИИ в сопоставлении с традиционными методами диагностики. Анализировали уровень детализации в описании моделей ИИ и методов их обучения, чтобы убедиться в практической применимости представленных подходов.
Вышеуказанным методом последовательного анализа статей, попавших в случайную выборку, было выбрано 30 публикаций: 4 были посвящены применению ИИ в эндокринологии, 3 – в дерматовенерологии, 1 – в кардиологии, 1 – в рентгенологии, 1 – в гастроэнтерологии, 5 – в неврологии, 5 – в гематологии, 4 – в нефрологии, 4 – в ортопедии и ревматологии, 2 – в онкологии.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ / RESULTS AND DISCUSSION
Обобщенные сведения по отобранным и включенным в анализ публикациям представлены в Приложении 11.
Кардиология / Cardiology
Практическим примером оценки эффективности ИИ в кардиологии является использование CNN для диагностики фибрилляции предсердий (ФП) [12]. Нейронная сеть анализировала большую выборку электрокардиограмм (ЭКГ) при синусовом ритме, зарегистрированных у пациентов с наличием пароксизмальной ФП (диагноз подтверждался по наличию других ЭКГ с признаками ФП либо соответствующего диагноза у данного пациента). Затем она самостоятельно создавала алгоритм, позволяющий предсказать наличие пароксизмальной ФП при анализе ЭКГ при синусовом ритме [12].
Всего выполнен анализ ЭКГ у 180 921 пациента. Для обучения CNN использовалось 70% всех ЭКГ, для внутренней валидации – 10%, для тестирования – 20%. Эффективность созданного алгоритма оказалась достаточно высокой: чувствительность составила 79,0%, специфичность – 79,5%, AUС ROC – 0,87 (95% доверительный интервал 0,86–0,88). Таким образом, ИИ позволил с высокой степенью достоверности выявлять пациентов с пароксизмальной ФП при оценке ЭКГ покоя при синусовом ритме. Подобные алгоритмы могут существенно упростить выявление ФП [12].
Эндокринология / Endocrinology
В эндокринологии ИИ чаще всего применяют для управления терапией сахарного диабета (СД). Внедрение ИИ в лечение СД целесообразно, поскольку обеспечивает эффективную обработку данных и разработку инструментов и технических устройств для улучшения качества медицинской помощи. В частности, методы глубокого обучения, активно применяемые в медицине, позволяют алгоритмам обучаться на больших наборах данных. Один из таких алгоритмов, разработанный для автоматического выявления диабетической ретинопатии и макулярного отека, был обучен на 128 175 изображениях сетчатки. Алгоритм прошел валидацию на двух наборах данных, показав высокие значения чувствительности (до 97,5%) и специфичности (до 98,5%), что подтверждает его эффективность в диагностике этих состояний [13].
Подходы машинного обучения могут быть использованы для решения задачи прогнозирования возникновения гипогликемии у больных СД. Гипогликемические эпизоды у пациентов с СД 2-го типа можно точно диагностировать даже на основе спорадических показателей уровня глюкозы в крови, собираемых один или два раза в день с помощью самоконтроля. Прогностическая модель развития гипогликемии в течение следующих 24 ч имела чувствительность 92% и специфичность 70% после того, как она была обучена на результатах постоянного динамического наблюдения, охватывающего примерно 10 нед. Хотя диапазон прогнозов был ограничен временем возникновения гипогликемии, точность прогноза увеличилась до 90% за счет включения информации о принимаемых лекарствах за предыдущие несколько дней [14].
У пациентов с СД с помощью ИИ можно определять вариабельность гликемии. Это важно, т.к. колебания уровня сахара в крови, которые повышают риск гипо- и гипергликемии, являются признаком недостаточного контроля СД. Практическим примером использования ИИ для скрининга диабетической ретинопатии является исследование X. Pei et al. [15]. Авторы оценили эффективность систем EyeWisdom®DSS и EyeWisdom®MCS у 549 пациентов с СД 2-го типа. Точность EyeWisdom®DSS составила 91,0%, чувствительность – 91,0%, специфичность – 81,3%, а EyeWisdom®MCS показала чувствительность 76,2% и специфичность 92,4% при выявлении пациентов с диабетической ретинопатией и без нее.
Еще одним практическим примером оценки эффективности ИИ для определения вариабельности гликемии является исследование С.R. Marlin et al. [16]. Авторы использовали методы регрессии опорных векторов (англ. support vector regression, SVR) и многослойного персептрона (англ. multilayer perceptron, MLP) для разделения согласованного показателя предполагаемой вариабельности гликемии на четыре класса (низкий, пограничный, высокий и очень высокий) на основе 250 карт непрерывного 24-часового мониторинга уровня глюкозы. Точность исследования составила 90,1%, чувствительность – 97,0%, специфичность – 74,1% [16].
Рентгенология / Radiology
Эффективность ИИ в оценке изменений на рентгенограммах изучили J.G. Nam et al. [17], которые применили подход автоматического обнаружения на основе глубокого обучения (англ. deep-learning-based automatic detection, DLAD) для бинарной классификации рентгенограмм грудной клетки: рентгенограммы без патологии и рентгенограммы со злокачественным поражением легких в виде очагов. Анализ изображений на рентгеновских снимках выполнялся у больных с подтвержденным диагнозом злокачественного поражения легких в виде очагов и у пациентов с нормальной рентгеновской картиной. Исследование проводилось в трех южнокорейских больницах и одной больнице в США [17].
Был выполнен анализ 43 292 рентгенограмм грудной клетки. Обучающий набор состоял из 42 092 рентгенограмм, включая 33 467 нормальных и 8625 рентгенограмм со злокачественным очаговым поражением. Кроме того, были использованы наборы для настройки (600 рентгенограмм) и внутренней проверки (600 рентгенограмм), а также набор для внешней валидации/тестирования (693 рентгенограммы). DLAD был обучен с использованием всех меток на уровне изображений и комментариев 13 сертифицированных рентгенологов. Обучение проходило с применением 25 сверточных нейронных слоев. Для внутренней валидации и проверки эффективности обнаружения узлов DLAD использовались один внутренний и четыре внешних набора данных [17].
Классификация рентгенограмм и эффективность обнаружения узлов DLAD были оценены с использованием показателей AUС ROC. Для внешней валидации и проверки результатов исследования были привлечены 18 врачей, включая 3 врачей общей практики, 6 ординаторов-рентгенологов, 5 рентгенологов и 4 радиологов. Чувствительность ИИ составила 80,7%, что превышает чувствительность диагностики, проведенной врачами-специалистами (среднее значение 70,4%). Таким образом, метод глубокого обучения DLAD может быть эффективным в обучении ИИ для классификации рентгенограмм [17].
Гастроэнтерология / Gastroenterology
Применение ИИ в гастроэнтерологии демонстрирует значительный потенциал в улучшении диагностики заболеваний пищеварительного тракта. Например, исследование, проведенное M. Misawa et al. в 2018 г. [18], было направлено на обнаружение полипов толстой кишки с использованием модели на основе CNN.
В исследовании использовано 546 коротких видео, разделенных на две группы данных: 105 полип-позитивных и 306 полип-негативных видео для обучения, а также 50 полип-позитивных и 85 полип-негативных видео для тестирования. Модель показала высокие точность (76,5%), чувствительность (90,0%) и специфичность (63,3%) при выявления полипов в режиме реального времени. Это исследование демонстрирует возможность использования ИИ для автоматического выявления полипов при колоноскопии, что может повысить эффективность диагностики [18].
Дерматовенерология / Dermatovenerology
Практическим примером оценки эффективности ИИ в дерматовенерологии являются результаты исследования, которое выполнили Т.J. Brinker et al. с помощью CNN, обученной на дермоскопических изображениях, для классификации меланом и диспластических невусов [19].
Для этого исследования был использован архив Международного сотрудничества в области визуализации кожи (англ. International Skin Imaging Collaboration, ISIC), который содержал общий набор данных из 13 737 изображений. Обучающий набор данных состоял из 12 378 изображений, включая 1888 изображений меланом и 10 490 изображений диспластических невусов, валидационный набор – из 1359 изображений, включая 230 изображений меланом и 1129 изображений диспластических невусов. Для тестирования было использовано 100 дермоскопических изображений. Модель остаточного обучения (англ. residual network, ResNet) CNN ResNet50 была использована для классификации меланом и диспластических невусов. Внешняя валидация проводилась с помощью 145 врачей-дерматовенерологов из 12 университетских больниц Германии, которым были предоставлены 100 изображений для оценки. Эффективность данного исследования оказалась достаточно высокой: чувствительность составила 86,1%, специфичность – 73,3%. Таким образом, ИИ позволил с высокой степенью достоверности выявлять пациентов с меланомой. Подобные алгоритмы могут существенно упростить дифференциальную диагностику между меланомой и диспластическими невусами [19].
В другом исследовании эффективности ИИ для интерпретации поражений кожи А. Esteva et al. [20] использовали технологию ИИ в виде CNN, архитектура которой была предварительно обучена на базе данных ImageNet (объемный набор данных, применяемый для задач компьютерного зрения). Цель исследования заключалась в разработке системы компьютерного зрения, способной классифицировать клинические изображения кожи на основе двух критических бинарных классов, помеченных врачами-дерматовенерологами. Для этого были использованы различные онлайн-репозитории с открытым доступом и клинические данные из Медицинского центра Стэнфордского университета (США). Общий размер выборки данных составил 129 405 изображений. Для обучения и валидации было использовано 127 463 изображения с помощью 9-кратной перекрестной валидации, а для тестирования – 1942 изображения [20].
Процесс обучения модели включал классификацию поражений кожи с использованием единой CNN-архитектуры. Внутренняя валидация была выполнена с помощью 2 врачей-дерматовенерологов, которые использовали 9-кратную перекрестную проверку для оценки производительности модели. Внешняя валидация проводилась с помощью 21 врача-дерматовенеролога, которые классифицировали эпидермальные и меланоцитарные заболевания. Для большей эффективности алгоритма исследование было проверено двумя способами. Первый способ заключался в разделении заболеваний кожи на три класса: доброкачественные, злокачественные и неопухолевые поражения. При втором способе все заболевания кожи были разделены на девять классов: лимфопролиферативные заболевания кожи (англ. cutaneous lymphoma and lymphoid infiltrates), доброкачественные дермальные опухоли кожи и кисты (англ. benign dermal tumors, cysts), злокачественные дермальные опухоли кожи (англ. malignant dermal tumor), доброкачественные эпидермальные опухоли, гамартомы, милиумы (англ. benign epidermal tumors, hamartomas, milia), злокачественные и предраковые эпидермальные опухоли (англ. malignant and premalignant epidermal tumors), генодерматозы и дополнительные новообразования (англ. genodermatoses and supernumerary growths), воспалительные состояния (англ. inflammatory conditions), доброкачественные меланоцитарные поражения (benign melanocytic lesions), меланомы (англ. melanomas) [20].
В первой группе, где болезни были разделены на три класса, точность ИИ составила 72,1%, а во второй группе – 55,4%. Кроме того, эти значения оказались выше, чем показатели у врачей-дерматовенерологов, у которых точность диагнозов составила 65,56% для трех классов и 53,3% для девяти классов. Также было отмечено, что ИИ превзошел средние показатели ответов врачей-дерматовенерологов в чувствительности и специфичности [20].
Очередным практическим примером оценки эффективности ИИ для интерпретации поражений ногтевых пластинок является исследование S.S. Han et al. [21], которые использовали технологию ИИ в виде сверточной нейронной сети на основе регионов (англ. region-based convolutional neural network, R-CNN). Исследование включало две классификации. В первую вошли четыре группы поражений ногтевых пластинок (онихомикоз, ониходистрофии, онихолизис и меланонихия), во вторую – шесть (онихомикоз, ониходистрофии, онихолизис, меланонихия, нормальное состояние ногтей и другие). Изначально диагнозы были установлены врачами-дерматовенерологами. Для исследования использованы данные из четырех медицинских учреждений Южной Кореи с общим размером выборки 57 983 изображений. Работа проводилась с помощью двух современных моделей CNN: ResNet-152 и VGG-19. Процесс обучения включал несколько этапов: извлечение клинических фотографий, автоматическое обрезание изображений с помощью R-CNN, ручное кадрирование изображений врачами-дерматовенерологом, исключение несфокусированных фотографий с помощью точного селектора изображений и установление соответствия клинического диагноза и изображения тремя врачами-дерматовенерологами. Внутренняя валидация проводилась с применением ансамблевой модели, которая объединяла системы ResNet-152 и VGG-19. Внешняя валидация осуществлялась с помощью 42 врачей-дерматовенерологов и 57 врачей и обучающихся, которые не являлись врачами-дерматовенерологами (врачи общей практики, врачи-терапевты, студенты-медики и др.). Обучение выполнялось на наборах данных A1 (49 567 изображений) и A2 (3741 изображение), а тестирование – на наборах данных B1 (100 изображений), B2 (194 изображения), C (125 изображений) и D (939 изображений). Результаты ИИ для наборов данных B1, B2, C и D показали чувствительность / специфичность / AUС ROC: 96,0/94,7/0,98, 82,7/96,7/0,95, 92,3/79,3/0,93 и 87,7/69,3/0,82 соответственно [21].
Также оценка эффективности ИИ проводилась с помощью индекса Юдена, значения которого для наборов данных B1 и C составили 67,62% (ИИ обучен набору данных A1) и 63,03% (ИИ обучен набору данных A2). Это может указывать на то, что модель показывает хорошую разницу между истинно положительными и ложноположительными результатами. У медицинских работников (включая врачей-дерматовенерологов, врачей общей практики и др.) результаты исследования были хуже, только один врач-дерматовенеролог показал лучшие результаты, чем модель ИИ. Таким образом, при диагностике онихомикоза технологии ИИ R-CNN продемонстрировали более высокую диагностическую точность, чем врачи-дерматовенерологи и врачи общей практики, участвовавшие в исследовании [21].
Неврология / Neurology
ИИ в неврологии продемонстрировал значительные успехи в диагностике, прогнозировании и лечении заболеваний. Например, машинное обучение эффективно предсказывает рецидив ишемического инсульта, достигая точности 88%, при этом чувствительность составляет 42%, а специфичность – 96% [22]. В выявлении эпилепсии глубокие нейронные сети демонстрируют почти идеальные результаты: точность предсказания эпилептических приступов достигает 99,66%, чувствительность – 99,72%, а специфичность – 99,60% [23]. Для нейродегенеративных заболеваний, таких как болезнь Альцгеймера, CNN с MLP обеспечивают точность диагностики до 96,8%, что превосходит традиционные подходы [24].
ИИ также активно применяется для анализа изображений головного мозга, например для оценки коллатерального кровообращения у пациентов с инсультом, где достигается точность 85% [25], и диагностики болезни Паркинсона с точностью классификации пациентов до 80% [26].
Эти разработки способствуют развитию более точной персонализированной медицины, позволяя врачам принимать обоснованные решения о лечении.
Гематология / Hematology
В гематологии ИИ применяется для диагностики, прогноза и оптимизации лечения различных заболеваний крови, включая лейкемии, анемии и талассемии. Например, модель ALNet, основанная на глубоком обучении, продемонстрировала точность 94,2% в прогнозировании острого лейкоза с использованием изображений клеток крови (с точностью 100% для диагностики острого промиелоцитарного лейкоза и 93,7% для острого миелоидного лейкоза) [27].
Также методы ИИ, основанные на тепловых картах, показали точность 81,3% при интеграции характеристик ядра для оценки центров пролиферации у пациентов с хроническим лимфоцитарным лейкозом [28]. В другом исследовании метод машинного обучения с использованием данных 45 498 пациентов выявил носителей β-талассемии с чувствительностью 98,81% и специфичностью 99,47% [29].
Применение методов ИИ также помогло улучшить прогнозирование выживаемости пациентов с острым миелоидным лейкозом: точность составила 68,5% для больных на интенсивной терапии и 62,1% для получающих азатиоприн [30]. Кроме того, подходы, использующие голографическую микроскопию и иерархический классификатор, достигли точности 84,3% в бинарной классификации видов анемии [31].
Эти достижения демонстрируют значительный потенциал ИИ для повышения точности и доступности диагностики, особенно в сложных случаях или при ограниченных ресурсах.
Нефрология / Nephrology
Развитие ИИ в нефрологии открывает новые возможности для диагностики, прогноза и лечения заболеваний почек. Например, метод глубокого обучения, предложенный N. Tomašev et al., использует рекуррентную нейронную сеть (англ. recurrent neural network, RNN) для непрерывного прогнозирования риска ухудшения состояния у пациентов с острым повреждением почек (ОПП). Этот подход позволяет своевременно выявлять больных, находящихся в группе риска, что создает возможность для раннего вмешательства и улучшения исходов лечения [32].
Алгоритм экстремального повышения градиента (англ. Extreme Gradient Boosting, XGBoost), примененный H. Mohamadlou et al., продемонстрировал эффективность при прогнозировании ОПП на основании ретроспективных данных [33]. Этот метод предоставляет клиницистам инструмент для выявления пациентов с высокой вероятностью развития ОПП, хотя его влияние на клинические результаты требует дальнейшего изучения.
В свою очередь, L. Adhikari et al. предложили модель встроенной аналитики интраоперационных данных (англ. Intraoperative Data Embedded Analytics, IDEA), которая учитывает физиологические параметры, собираемые во время хирургических вмешательств. Эта модель улучшила прогнозирование послеоперационного ОПП благодаря учету динамических данных с высокими чувствительностью и специфичностью [34].
В области хронических заболеваний почек также активно используются методы ИИ. Например, модель CNN ResNet, разработанная C.C. Kuo et al., была успешно применена для автоматического определения скорости клубочковой фильтрации на основе ультразвуковых изображений почек, продемонстрировав высокую точность и сильную корреляцию с расчетами, основанными на биохимических данных [35].
Эти примеры подчеркивают значимость ИИ для улучшения диагностики и прогноза нефрологических заболеваний, а также для разработки персонализированных подходов к лечению пациентов.
Ортопедия и ревматология / Orthopedics and rheumatology
Применение ИИ в ортопедии и ревматологии активно развивает возможности диагностики и лечения заболеваний суставов и костей. В исследовании V. Couteaux et al. [36] использована R-CNN для автоматического обнаружения разрывов мениска на магнитно-резонансных томограммах колена. В работу включено 1128 изображений с несбалансированным количеством разрывов. Модель показала точность 83% для выявления разрывов и 86% для классификации ориентации разрыва [36].
В другом исследовании, проведенном P. Rouzrokh et al. [37], применена модель YOLO-V3 (англ. You Only Look Once, Version 3) в сочетании с ResNet18 (CNN) для оценки риска вывиха бедра после тотального эндопротезирования. Для обучения модели использовались ретроспективные рентгенограммы 13 970 первичных операций по эндопротезированию тазобедренного сустава, в т.ч. 374 случая вывихов. Модель показала точность 49,55%, чувствительность 89,02% и специфичность 48,77%, что подтверждает ее способность быстро анализировать послеоперационные рентгенограммы [37].
M.T. Patrick et al. [38] применили несколько алгоритмов машинного обучения для прогнозирования уровня псориатического артрита у пациентов с псориазом, используя данные шести когорт, включавших свыше 7 тыс. генотипированных пациентов. Модель продемонстрировала точность более 90% для 5% лучших пациентов, у которых прогнозировался псориатический артрит, и специфичность 100%, что делает ее мощным инструментом для раннего выявления заболевания [38].
В исследовании N.P. Long et al. [39] использовалось несколько алгоритмов машинного обучения для дифференциации ревматоидного артрита (РА) от остеоартрита (ОА) на основе данных генетической экспрессии. Результаты показали высокие точность (86% для РА и 85% для ОА), чувствительность (100% для РА и 90% для ОА), а также хорошую специфичность (77% для РА и 80% для ОА), что подтверждает эффективность применения генетических данных в диагностике этих заболеваний [39].
Онкология / Oncology
В онкологии ИИ активно применяется для диагностики и дифференциальной диагностики образований. Например, J. Lu et al. [40] разработали систему на основе модели Faster RCNN для распознавания прорастания опухолей при колоректальном раке. В ретроспективном исследовании собрано 100 биопсий, на основе которых получено 1000 изображений. Модель автоматически определяла области прорастания и подсчитывала их с высокой точностью (точность диагностики изображений составила 89%, чувствительность – 94%, специфичность – 83%) [40].
Исследование, проведенное L. Pantanowitz et al. [41], было посвящено применению многоуровневой CNN для выявления, классификации и оценки клинически значимых результатов на оцифрованных препаратах, полученных при биопсии предстательной железы. Обучение проводилось на 1 357 480 фрагментах изображений с 549 препаратов, а для тестирования использовались внутренние и внешние наборы данных. Эффективность модели в выявлении раковых клеток и их классификации достигала высоких показателей: чувствительность 99,59% и специфичность 90,14% для внутреннего теста [41].
Общие выводы / General findings
Анализ научных публикаций за последние 15 лет проведен с целью оценки эффективности моделей в течение этого времени. Результаты пилотного анализа показали, что даже в ранние годы ИИ уже демонстрировал значимую эффективность, что свидетельствует о его потенциале для дальнейшего улучшения. Таким образом, можно сделать вывод, что с развитием технологий и увеличением объемов данных, с которыми работают современные модели, их производительность и точность будут продолжать расти. Это открывает новые перспективы для применения ИИ в медицине и других областях.
Следует отметить, что метрики качества моделей во многом зависят от качества и объема данных, на которых они обучаются, выбранной архитектуры, а также от подхода к обучению. Кроме того, качество модели связано и с другими факторами. Дисбаланс классов может привести к предвзятости оценки, игнорированию некоторых из них. Важна предобработка данных, включая очистку от шума, аугментацию и нормализацию. Переобучение и недообучение модели негативно сказываются на ее производительности. Оптимизация гиперпараметров, таких как скорость обучения и глубина сети, также критична. Чем больше классов в задаче, тем сложнее модели правильно их распознавать, что может снижать точность. Качество классификации также зависит от набора данных, на котором тестируется модель. Например, в исследовании A. Esteva еt al. [20], где применялись методы компьютерного зрения для диагностики меланомы, отмечено, что точность классификации существенно варьировалась между группами: в первой группе она составила 72,1%, а во второй – всего 55,4%. Это подчеркивает, что выбор и качество обучающего набора изображений, а также используемые алгоритмы и подходы к обучению оказывают значительное влияние на итоговую эффективность ИИ.
Следует отметить, что приведенные исследования не дают конкретики относительно условий, в которых проводилась оценка эффективности моделей: использовались ли только тестовые данные или также учитывалась клиническая практика. Это создает определенные ограничения в интерпретации результатов. Нельзя однозначно утверждать, что заявленные показатели эффективности отражают успешность применения моделей именно в условиях реальной клинической апробации.
ЗАКЛЮЧЕНИЕ / CONCLUSION
ИИ продемонстрировал достаточно высокую эффективность: точность варьировалась от 49% до 99%, чувствительность – от 42% до 100%, специфичность – от 48% до 100% в таких областях, как кардиология, эндокринология, гастроэнтерология, дерматовенерология и рентгенология. В некоторых случаях ИИ превосходил по эффективности клиническую диагностику врачей-специалистов, например при выявлении меланомы и в диагностике ФП.
Таким образом, ИИ показывает эффективность и высокий потенциал возможностей в диагностике и классификации заболеваний, повышает точность и ускоряет проведение диагностического поиска, что делает перспективным более широкое его применение в клинической медицине. В дальнейшем развитии ИИ может достичь или превзойти эффективность клинической деятельности врачей-специалистов, врачей общей практики. В настоящее время целесообразно использовать ИИ в системе поддержки принятия решений врачами.
Врачами-специалистами и врачами общей практики ИИ в виде программ ЭВМ для компьютеров и приложений смартфонов может применяться в телемедицине и системе поддержки принятия решений при оказании первичной медико-санитарной помощи, диагностике, лечении и маршрутизации пациентов в различных областях медицины: кардиология, эндокринология, гастроэнтерология, дерматовенерология, рентгенология и др. При выборе вида и подхода к обучению ИИ необходимо учитывать различные факторы для определения наиболее подходящего метода для конкретного приложения (компьютерной программы) и заболевания.
1. См. электронную версию журнала: https://www.pharmacoeconomics.ru.
Список литературы
1. Kusters R., Misevic D., Berry H., et al. Interdisciplinary research in artificial intelligence: challenges and opportunities. Front Big Data. 2020; 3: 577974. https://doi.org/10.3389/fdata.2020.577974.
2. Куракова Н. Г., Цветкова Л. А., Черченко О.В. Технологии искус ственного интеллекта в медицине и здравоохранении: позиции России на глобальном патентном и публикационном ландшафте. Врач и информационные технологии. 2020; 2: 81–100. https://doi.org/10.37690/1811-0193-2020-2-81-100.
3. Jimma B.L. Artificial intelligence in healthcare: a bibliometric analysis. Telemat Inform Rep. 2023; 9 (Suppl. 1): 100041. https://doi.org/10.1016/j.teler.2023.100041.
4. Guo Y., Hao Z., Zhao S., et al. Artificial intelligence in health care: bibliometric analysis. J Med Internet Res. 2020; 22 (7): e18228. https://doi.org/10.2196/18228.
5. Ламоткин А.И., Корабельников Д.И., Ламоткин И.А. и др. Искус ственный интеллект в здравоохранении и медицине: история клю чевых событий, его значимость для врачей, уровень развития в разных странах. ФАРМАКОЭКОНОМИКА. Современная фармакоэкономика и фармакоэпидемиология. 2024; 17 (2): 243–50. https://doi.org/10.17749/2070-4909/farmakoekonomika.2024.254.
6. Hicks S.A., Strümke I., Thambawita V., et al. On evaluation metrics for medical applications of artificial intelligence. Sci Rep. 2022; 12 (1): 5979. https://doi.org/10.1038/s41598-022-09954-8.
7. Соловьев А.А. Взвешенная погрешность – новая метрика для оценки качества валидации ответов в задаче вопросно-ответного поиска. Вестник МГТУ им. Н.Э. Баумана. Серия «Приборостроение». 2013; 1: 58–64.
8. van Stralen K.J., Stel V.S., Reitsma J.B., et al. Diagnostic methods I: sensitivity, specificity, and other measures of accuracy. Kidney Int. 2009; 75 (12): 1257–63. https://doi.org/10.1038/ki.2009.92.
9. Shreffler J., Huecker M.R. Diagnostic testing accuracy: sensitivity, specificity, predictive values and likelihood ratios. In: StatPearls. Treasure Island (FL): StatPearls Publishing; 2024.
10. Çorbacıoğlu Ş.K., Aksel G. Receiver operating characteristic curve analysis in diagnostic accuracy studies: a guide to interpreting the area under the curve value. Turk J Emerg Med. 2023; 23 (4): 195–8. https://doi.org/10.4103/tjem.tjem_182_23.
11. Zhou J., Gandomi A., Chen F., Holzinger A. Evaluating the quality of machine learning explanations: a survey on methods and metrics. Electronics. 2021; 10 (5): 593. https://doi.org/10.3390/electronics10050593.
12. Attia Z.I., Noseworthy P.A., Lopez-Jimenez F., et al. An artificial intelligence-enabled ECG algorithm for the identification of patients with atrial fibrillation during sinus rhythm: a retrospective analysis of outcome prediction. Lancet. 2019; 394 (10201): 861–7. https://doi.org/10.1016/S0140-6736(19)31721-0.
13. Gulshan V., Peng L., Coram M., et al. Development and validation of a deep learning algorithm for detection of diabetic retinopathy in retinal fundus photographs. JAMA. 2016; 316 (22): 2402–10. https://doi.org/10.1001/jama.2016.17216.
14. Sudharsan B., Peeples M., Shomali M. Hypoglycemia prediction using machine learning models for patients with type 2 diabetes. J Diabetes Sci Technol. 2015; 9 (1): 86–90. https://doi.org/10.1177/1932296814554260.
15. Pei X., Yao X., Yang Y., et al. Efficacy of artificial intelligence-based screening for diabetic retinopathy in type 2 diabetes mellitus patients. Diabetes Res Clin Pract. 2022; 184: 109190. https://doi.org/10.1016/j.diabres.2022.109190.
16. Marling C.R., Struble N.W., Bunescu R.C., et al. A consensus perceived glycemic variability metric. J Diabetes Sci Technol. 2013; 7 (4): 871–9. https://doi.org/10.1177/193229681300700409.
17. Nam J.G., Park S., Hwang E.J., et al. Development and validation of deep learning-based automatic detection algorithm for malignant pulmonary nodules on chest radiographs. Radiology. 2019; 290 (1): 218–28. https://doi.org/10.1148/radiol.2018180237.
18. Misawa M., Kudo S.E., Mori Y., et al. Artificial intelligence-assisted polyp detection for colonoscopy: initial experience. Gastroenterology. 2018; 154 (8): 2027–9.e3. https://doi.org/10.1053/j.gastro.2018.04.003.
19. Brinker T.J, Hekler A., Enk A.H., et al. A convolutional neural network trained with dermoscopic images performed on par with 145 dermatologists in a clinical melanoma image classification task. Eur J Cancer. 2019; 111: 148–54. https://doi.org/10.1016/j.ejca.2019.02.005.
20. Esteva A., Kuprel B., Novoa R.A., et al. Dermatologist-level classification of skin cancer with deep neural networks. Nature. 2017; 542 (7639): 115–8. https://doi.org/10.1038/nature21056.
21. Han S.S., Park G.H., Lim W., et al. Deep neural networks show an equivalent and often superior performance to dermatologists in onychomycosis diagnosis: automatic construction of onychomycosis datasets by region-based convolutional deep neural network. PLoS One. 2018; 13 (1): e0191493. https://doi.org/10.1371/journal.pone.0191493.
22. Abedi V., Avula V., Chaudhary D., et al. Prediction of long-term stroke recurrence using machine learning models. J Clin Med. 2021; 10 (6): 1286. https://doi.org/10.3390/jcm10061286.
23. Daoud H., Bayoumi M.A. Efficient epileptic seizure prediction based on deep learning. IEEE Transact Biomed Circuits Syst. 2019; 13 (5): 804–13. https://doi.org/10.1109/TBCAS.2019.2929053.
24. Qiu S., Joshi P.S., Miller M.I., et al. Development and validation of an interpretable deep learning framework for Alzheimer’s disease classification. Brain. 2020; 143 (6): 1920–33. https://doi.org/10.1093/brain/awaa137.
25. Rava R.A., Seymour S.E., Snyder K.V., et al. Automated collateral flow assessment in patients with acute ischemic stroke using computed tomography with artificial intelligence algorithms. World Neurosurg. 2021; 155: e748–60. https://doi.org/10.1016/j.wneu.2021.08.136.
26. Shinde R., Gupta D., Bansal S., et al. Predictive modeling for stroke outcomes: a comparison of machine learning algorithms. NeuroImage. 2021; 227: 117726. https://doi.org/10.1016/j.neuroimage.2020.117726.
27. Boldú L., Merino A., Acevedo A., et al. A deep learning model (ALNet) for the diagnosis of acute leukaemia lineage using peripheral blood cell images. Comput Methods Programs Biomed. 2021; 202: 105999. https://doi.org/10.1016/j.cmpb.2021.105999.
28. El Hussein S., Chen P., Medeiros L.J., et al. Artificial intelligence assisted mapping of proliferation centers allows the distinction of accelerated phase from large cell transformation in chronic lymphocytic leukemia. Mod Pathol. 2022; 35 (8): 1121–5. https://doi.org/10.1038/s41379-022-01015-9.
29. AlAgha A.S., Faris H., Hammo B.H., Al-Zoubi A.M. Identifying β-thalassemia carriers using a data mining approach: the case of the Gaza Strip, Palestine. Artif Intel Med. 2018; 88: 70–83. https://doi.org/10.1016/j.artmed.2018.04.009.
30. Didi I., Simoncini D., Vergez F., et al. Artificial intelligence-based predictive models for acute myeloid leukemia. Blood. 2021; 138 (Suppl. 1): 3389. https://doi.org/10.1182/blood-2021-145122.
31. Memmolo P., Aprea G., Bianco V., et al. Differential diagnosis of hereditary anemias from a fraction of blood drop by digital holography and hierarchical machine learning. Biosens Bioelectron. 2022; 201: 113945. https://doi.org/10.1016/j.bios.2021.113945.
32. Tomašev N., Glorot X., Rae J.W., et al. A clinically applicable approach to continuous prediction of future acute kidney injury. Nature. 2019; 572 (7767): 116–9. https://doi.org/10.1038/s41586-019-1390-1.
33. Mohamadlou H., Lynn-Palevsky A., Barton C., et al. Prediction of acute kidney injury with a machine learning algorithm using electronic health record data. Can J Kidney Health Dis. 2018; 5: 2054358118776326. https://doi.org/10.1177/2054358118776326.
34. Adhikari L., Ozrazgat-Baslanti T., Ruppert M., et al. Improved predictive models for acute kidney injury with IDEA: Intraoperative Data Embedded Analytics. PLoS One. 2019; 14 (4): e0214904. https://doi.org/10.1371/journal.pone.0214904.
35. Kuo C.C., Chang C.M., Liu K.T., et al. Automation of the kidney function prediction and classification through ultrasound-based kidney imaging using deep learning. NPJ Digit Med. 2019; 2: 29. https://doi.org/10.1038/s41746-019-0104-2.
36. Couteaux V., Si-Mohamed S., Nempont O., et al. Automatic knee meniscus tear detection and orientation classification with Mask-RCNN. Diagn Interv Imaging. 2019; 100 (4): 235–42. https://doi.org/10.1016/j.diii.2019.03.002.
37. Rouzrokh P., Ramazanian T., Wyles C.C., et al. Deep learning artificial intelligence model for assessment of hip dislocation risk following primary total hip arthroplasty from postoperative radiographs. J Arthroplasty. 2021; 6 (6): 2197–203.e3. https://doi.org/10.1016/j.arth.2021.02.028.
38. Patrick M.T., Stuart P.E., Raja K. et al. Genetic signature to provide robust risk assessment of psoriatic arthritis development in psoriasis patients. Nat Commun. 2018; 9 (1): 4178. https://doi.org/10.1038/s41467-018-06672-6.
39. Long N.P., Park S., Anh N.H., et al. Efficacy of integrating a novel 16-gene biomarker panel and intelligence classifiers for differential diagnosis of rheumatoid arthritis and osteoarthritis. J Clin Med. 2019; 8 (1): 50. https://doi.org/10.3390/jcm8010050.
40. Lu J., Liu R., Zhang Y., et al. Development and application of a detection platform for colorectal cancer tumor sprouting pathological characteristics based on artificial intelligence. Intel Med. 2022; 2 (2): 82–7. https://doi.org/10.1016/j.imed.2021.08.003.
41. Pantanowitz L., Quiroga-Garza G.M., Bien L., et al. An artificial intelligence algorithm for prostate cancer diagnosis in whole slide images of core needle biopsies: a blinded clinical validation and deployment study. Lancet Digit Health. 2020; 2 (8): e407-e416. https://doi.org/10.1016/S2589-7500(20)30159-X.
Об авторах
Д. И. КорабельниковРоссия
Корабельников Даниил Иванович, к.м.н., доцент
2-я Брестская ул., д. 5, Москва 123056
А. И. Ламоткин
Россия
Ламоткин Андрей Игоревич
2-я Брестская ул., д. 5, Москва 123056;
ул. Добролюбова, д. 11, Москва 127254
Дополнительные файлы

|
1. Приложение 1. Эффективность искусственного интеллекта по данным включенных в обзор публикаций (n=30) | |
| Тема | ||
| Тип | Прочее | |
Скачать
(1MB)
|
Метаданные ▾ | |
Что уже известно об этой теме?
► Искусственный интеллект (ИИ) активно внедряется в медицину, обеспечивая более точную диагностику и эффективное лечение различных заболеваний
► Машинное обучение и глубокое обучение применяются для анализа клинических данных, прогнозирования развития заболеваний и их осложнений, а также в телемедицинских технологиях
► Оценка эффективности ИИ в медицине проводится с использованием показателей матрицы ошибок, взвешенных ошибок, точности, чувствительности, специфичности, площади под кривой и индекса Юдена
Что нового дает статья?
► Проанализированы возможности и приведены примеры успешного применения ИИ в некоторых областях медицины, таких как кардиология, эндокринология, гастроэнтерология, дерматовенерология, неврология, гематология, нефрология, онкология, ортопедия и ревматология, дерматовенерология
► Представлены результаты исследований, демонстрирующих высокий уровень эффективности ИИ в сравнении с традиционными методами диагностики
Как это может повлиять на клиническую практику в обозримом будущем?
► Использование ИИ в медицине может повысить точность диагностики и эффективность лечения, что приведет к улучшению качества медицинской помощи и снижению затрат на нее
► Выбор подходящего подхода к обучению ИИ в медицине может улучшить результаты диагностики и лечения различных заболеваний
► Результаты прикладных исследований указывают, что ИИ может применяться в виде программ ЭВМ для компьютеров и приложений для смартфонов и являться вариантом телемедицины в системе поддержки принятия решений врачами
Рецензия
Для цитирования:
Корабельников Д.И., Ламоткин А.И. Эффективность применения искусственного интеллекта в клинической медицине. ФАРМАКОЭКОНОМИКА. Современная фармакоэкономика и фармакоэпидемиология. 2025;18(1):114-124. https://doi.org/10.17749/2070-4909/farmakoekonomika.2025.287
For citation:
Korabelnikov D.I., Lamotkin A.I. The effectiveness of using artificial intelligence in clinical medicine. FARMAKOEKONOMIKA. Modern Pharmacoeconomics and Pharmacoepidemiology. 2025;18(1):114-124. (In Russ.) https://doi.org/10.17749/2070-4909/farmakoekonomika.2025.287

Контент доступен под лицензией Creative Commons Attribution-NonCommercial-ShareAlike 4.0 International License.






































