Перейти к:
Изучение эффективности гидролизата плаценты человека на новой модели метаболически-ассоциированной жировой болезни печени с перегрузкой железом
https://doi.org/10.17749/2070-4909/farmakoekonomika.2024.274
Аннотация
Актуальность. Сочетание метаболически-ассоциированной жировой болезни печени (МАЖБП) с перегрузкой железом встречается примерно у 1/3 пациентов и весьма трудно поддается лечению. Для этой формы МАЖБП не разработано специальных средств лечения, малочисленны и экспериментальные модели, на которых могли бы апробироваться такие средства.
Цель: создание модели МАЖБП и изучение эффективности применения гидролизата плаценты человека (ГПЧ) в эксперименте.
Материал и методы. В эксперименте крысы разделены на три группы: 1-я группа на нормальной диете и питье, во 2-й и 3-й группах воспроизводилась модель перегрузки печени железом путем внутрибрюшинного введения сернокислого железа в течение 12 дней в условиях добавления в диету насыщенных жиров (пальмовое масло) и фруктозы. На 13-й день исследования у животных 1-й и 2-й групп проводили забор крови для биохимического исследования и секционного материала (печень, почки, мозг, сердце). В 3-й группе крысам вводили стандартизированный ГПЧ в терапевтической дозе внутримышечно в течение 4 нед. На 41-й день проводили забор крови и секционного материала. На данной модели апробирована эффективность применения ГПЧ на основании изменений более 20 биомаркеров функций печени, почек, кроветворения, воспаления и тромбообразования.
Результаты. Показано, что инъекции ГПЧ являются эффективным средством лечения МАЖБП с перегрузкой железом. В частности, после воспроизведения модели на 41-й день достоверно возрастали уровни ферритина (интактные: 201±45 мкг/л; модель:
254±12 мкг/л; р<0,0001), аспартатаминотрансферазы (АСТ) (интактные: 114,9±27,3 Ед/л; модель: 301,3±30,3 Ед/л;р<0,000001), аланинаминотрансферазы (АЛТ) (интактные: 22,8±3,2 Ед/л; модель: 58,7±5,5 Ед/л; р<0,00014), лейкоцитов (интактные: 4,6±1,3×109 кл/л; модель: 6,9±0,8×109 кл/л; р<0,01), тромбоцитов (интактные: 509,7±121,6×109 кл/л; модель: 820,2±50,5×109 кл/л; р<0,01) и падали уровни общего белка (интактные: 46,2±4,6 г/л; модель: 45,5±5,8 г/л; р=0,002), креатинина (интактные: 35,7±1,2 мкмоль/л; модель: 23,3±1,4 мкмоль/л; р<0,00001) в крови и скорости клубочковой фильтрации (СКФ) (интактные: 169±5 мл/мин/1,73 м2; модель: 154,1±7,1 мл/мин/1,73 м2; р=0,04). Применение ГПЧ приводило к нормализации перечисленных показателей полиорганной патологии на 41-й день: достоверному снижению концентрации ферритина (141±24 мкг/л; р<0,001), АСТ (166,7±51,3 Ед/л; р=0,00027), АЛТ (36,4±7,2 Ед/л; р=0,00001), лейкоцитов (4,5±2,7×109 кл/л; р=0,039), тромбоцитов (639,0±92,3×109 кл/л; р=0,00157) и достоверному повышению уровня общего белка (55,9±3,8 г/л; р=0,0014), нормализации креатинина (27,7±1,5 мкмоль/л; р=0,0002) и СКФ (169,8±6,2 мл/мин/1,73 м2; р=0,0011). Гистологический анализ продемонстрировал, что ГПЧ способствует выведению железа из печени, одновременно препятствуя повреждениям почек, головного мозга и миокарда в предлагаемой модели МАЖБП с перегрузкой железом.
Заключение. Применение ГПЧ в терапии экспериментальной МАЖБП с перегрузкой железом является эффективным и безопасным, профилактирует полиорганную патологию.
Ключевые слова
Для цитирования:
Богачева Т.Е., Громова О.А., Торшин И.Ю., Демидов В.И., Калачева А.Г., Гаранин А.А., Гоголева И.В., Федотова Л.Э., Лиманова О.А., Мнацаканьян А.Н., Жидоморов Н.Ю., Гришина Т.Р. Изучение эффективности гидролизата плаценты человека на новой модели метаболически-ассоциированной жировой болезни печени с перегрузкой железом. ФАРМАКОЭКОНОМИКА. Современная фармакоэкономика и фармакоэпидемиология. 2024;17(4):489-503. https://doi.org/10.17749/2070-4909/farmakoekonomika.2024.274
For citation:
Bogacheva T.E., Gromova O.A., Torshin I.Yu., Demidov V.I., Kalacheva A.G., Garanin A.A., Gogoleva I.V., Fedotova L.E., Limanova O.A., Mnatsakanyan А.N., Zhidomorov N.Yu., Grishina T.R. Study of the effect of human placenta hydrolysate in a new model of metabolic-associated fatty liver disease with iron overload. FARMAKOEKONOMIKA. Modern Pharmacoeconomics and Pharmacoepidemiology. 2024;17(4):489-503. (In Russ.) https://doi.org/10.17749/2070-4909/farmakoekonomika.2024.274
ВВЕДЕНИЕ / INTRODUCTION
Метаболически-ассоциированная жировая болезнь печени (МАЖБП) – патология, характеризующаяся избыточным разрастанием жирового компонента ткани [1]. Заболевание имеет две основные морфологические формы: неалкогольный стеатоз (жировой гепатоз) и неалкогольный стеатогепатит (НАСГ) [2].
Перегрузка железом при МАЖБП встречается весьма часто (до 30% пациентов), тем не менее она практически не учитывается при терапии МАЖБП. Важно отметить, что перегрузка железом при МАЖБП приводит к гемосидерозу: накоплению мелкодисперсных оксидов железа в печени и других органах. Гемосидероз утяжеляет МАЖБП через активацию прооксидантных, провоспалительных и протромботических процессов, приводящих к ферроптозу (буквально «железоапоптозу») гепатоцитов, НАСГ и циррозу печени [2].
Перспективным средством для лечения МАЖБП и профилактики НАСГ являются стандартизированные гидролизаты плаценты человека (ГПЧ), начало изучения которых было положено научной школой В.П. Филатова. Экспериментальные и клинические исследования ГПЧ подтвердили его высокую эффективность и безопасность для терапии МАЖБП и ее осложнений [3]. В частности, в разработанной нами ранее модели МАЖБП, основанной на хроническом приеме твердых фракций рафинированного пальмового масла, применение ГПЧ достоверно снижало уровни биомаркеров дисфункции печени, возрастающие при воспроизведении модели (билирубин, общий белок, аспартатаминотрансфераза (АСТ), аланинаминотрансфераза (АЛТ)). Гепатопротекторный эффект ГПЧ был подтвержден результатами гистологических исследований [4].
В открытом контролируемом исследовании эффективности и безопасности ГПЧ с участием 60 пациентов (средний возраст 47±9 лет) его применение в качестве монотерапии МАЖБП в течение 2 нед приводило к значимому уменьшению встречаемости симптоматики МАЖБП. Через 2 нед терапии ГПЧ было отмечено достоверное снижение уровней АСТ, АЛТ и гамма-глутамилтрансферазы [5].
Важной особенностью использования ГПЧ при терапии МАЖБП с перегрузкой железом является наличие в составе стандартизированных ГПЧ 19 пептидов, вовлеченных в регулировку гомеостаза железа: хелаторы ионов железа, гормоноподобные пептиды геморфин, спинорфин, пептиды – ингибиторы специфических таргетных белков гамма-секретазы, протеазы фурина, FKBP1A, CUL1 и SKP1, активаторы ретиноидного рецептора RXRA, ингибиторы растворимого белка гемохроматоза HFE2. Идентифицированные пептиды способствуют устранению перегрузки тканей железом посредством регуляции уровней гепцидина и ферритина [6].
Клиническое применение ГПЧ у 14 пациентов с длительным, застойным течением COVID-19 приводило к положительной клинической динамике (увеличению оксигенации крови, снижению объема повреждения легких, повышению уровня лимфоцитов, нормализации АСТ, АЛТ), в т.ч. к снижению уровней ферритина. При этом достоверное сокращение среднего уровня ферритина наблюдалось и у мужчин, и у женщин [7].
Снижение концентрации ферритина под воздействием терапии ГПЧ было показано и у пациентов с МАЖБП: в группе плацебо уровни ферритина практически не уменьшались, а применение ГПЧ приводило к их снижению на фоне значимого улучшения концентрации АСТ, АЛТ, липидного профиля, результатов транзиентной эластографии и биомаркеров фиброза по ФиброТесту, а также результатов стеатометрии [8].
При переизбытке железа по ятрогенным или генетическим причинам МАЖБП развивается быстрее и прогрессирует в полиорганную патологию, связанную с повреждением печени, почек, сердца, головного мозга и других органов. Перегрузка железом является одним из наиболее трудно поддающихся лечению осложнений МАЖБП, поскольку инициирует образование активных форм кислорода и окислительный стресс, резистентность к инсулину и провоспалительные реакции [9][10]. МАЖБП и перегрузка печени железом усугубляются при высоким потреблении фруктозы [11]. Избыток пищевой фруктозы стимулирует быстрое накопление внутрипеченочного жира, окислительный стресс, митохондриальную дисфункцию гепатоцитов [12] и развитие резистентности к инсулину [13]. Пациенты с МАЖБП и/или ожирением потребляют почти в два раза больше безалкогольных напитков по сравнению со здоровыми людьми контрольной группы [14–18]. Следовательно, использование рациона, богатого фруктозой, также является важным направлением для разработки моделей МАЖБП.
Цель – создание модели МАЖБП и изучение эффективности применения ГПЧ в эксперименте.
МАТЕРИАЛ И МЕТОДЫ / MATERIAL AND METHODS
Разработанная модель МАЖБП с перегрузкой железом у крыс приводит к формированию полиорганной патологии. В данной модели МАЖБП воспроизводимо индуцируется посредством диеты с высоким содержанием насыщенных жиров (твердая фракция рафинированного пальмового масла), углеводов (фруктоза в питьевой воде) и инъекций (неорганического) сульфата железа в течение 12 дней. На этой модели были апробированы гепатопротекторные и другие тканерегенераторные эффекты ГПЧ.
Экспериментальные группы / Experimental groups
Эксперимент был проведен на 24 белых крысах-самцах массой 300–400 г. Животные были разделены на три группы: 1-я группа (n=6) – интактный контроль (на нормальной диете и питье в виде чистой питьевой воды), во 2-й (n=12) и 3-й (n=6) группах воспроизводилась модель перегрузки печени железом в условиях добавления в диету насыщенных жиров и фруктозы. В 3-й группе крысам вводили препарат ГПЧ в дозе 0,6 мл/кг/сут внутримышечно в течение 4 нед.
Животные были распределены по группам так, чтобы индивидуальное значение массы тела не отклонялось от среднего по группе значения более чем на 20% в пределах одного пола. Взвешивание осуществляли на электронных весах для взвешивания крыс/мышей (Cas Corporation, Россия).
Условия содержания животных / Animal upkeep conditions
Корм для содержания лабораторных животных ЛБК-120 (АО «БиоПро», Россия), приготовленный по ГОСТ Р50258-92 «Комбикорма полнорационные для лабораторных животных. Технические условия», давался ad libitum. Данные о составе и качестве корма от производителя хранились в документации лаборатории и в файле исследования. В группе интактных контролей животным давалась ad libitum в стандартных поилках со стальными крышками-носиками вода, соответствующая ГОСТ Р51232-98 «Вода питьевая. Общие требования к организации и методам контроля качества».
В комнатах содержания животных поддерживались контролируемые условия окружающей среды (18–26 °C, относительная влажность воздуха 30–70%, 12-часовой цикл освещения). Контроль условий окружающей среды осуществлялся комбинированным прибором Testo (Testo AG, Германия) и фиксировался в соответствующем журнале. Для акклиматизации лабораторные животные до начала исследования содержались 5 дней в одиночных клетках. Во время этого периода у них ежедневно контролировалось клиническое состояние путем визуального осмотра. Животные с обнаруженными в ходе осмотра отклонениями не были включены в экспериментальные группы.
Методы исследования / Study methods
Для воспроизведения модели особям внутрибрюшинно вводили химически чистое двухвалентное сернокислое железо (АО «ЛенРеактив», Россия, паспорт № 070051-81) в дозе 50 мг/кг/сут в течение 12 сут. Одновременно в рацион питания добавляли твердую фракцию пальмового масла (Candle M, Индонезия) в дозе 30 г/кг/сут. Раствор фруктозы (ООО «Компания «Сладкий мир», Россия, ТУ 10.86.10-027-72315488-2019, партия 210723) в дозе 1 г/кг/сут использовали вместо питьевой воды в течение 12 сут.
После воспроизведения модели во 2-й и 3-й группах (т.е. начиная с 13-го дня от начала эксперимента) животные переводились на стандартную диету и обычный питьевой режим. Наблюдения за животными проводили ежедневно: фиксировали общее состояние, аппетит, особенности поведения, интенсивность и характер двигательной активности, частоту и глубину дыхательных движений, состояние волосяного и кожного покрова, положение хвоста, количество и консистенцию фекальных масс.
В крови определяли более 20 биохимических показателей: ферритин, насыщение трансферрина, железо сыворотки, ретикулоциты (%), ретикулоциты (абс.), фракция ретикулоцитов (%), лейкоциты (абс.), эритроциты (абс.), гемоглобин, гематокрит (%), объем эритроцита, гемоглобин эритроцита, содержание гемоглобина в эритроците, тромбоциты (абс.), индекс Ментцера, индекс Сирдаха, фолаты сыворотки, белок сыворотки, АСТ, АЛТ, креатинин сыворотки, скорость клубочковой фильтрации (СКФ), билирубин общий и прямой, витамины В9 и В12 в сыворотке крови.
Уровни лейкоцитов, эритроцитов, тромбоцитов, ретикулоцитов, гемоглобина, гематокрита, средний объем эритроцита, среднее содержание гемоглобина в эритроците, среднюю концентрацию гемоглобина в эритроците определяли проточной цитофлуориметрией с помощью цитофлуоритметра BC-6200 (Mindray, Китай). Остальные биохимические показатели оценивали на универсальном анализаторе крови Cobas 6000 (Roche Diagnostics, Швейцария) с использованием различных подходов. Ферритин и трансферрин определяли иммунотурбидиметрией, железо сыворотки, общий белок, билирубин общий и прямой – колориметрией, АСТ и АЛТ – ультрафиолетовым кинетическим тестом, креатинин сыворотки и СКФ – кинетическим методом Яффе, витамин В12 – иммунохемилюминесценцией, витамин В9 (фолаты) – твердофазным хемилюминесцентным иммуноферментным анализом.
На 41-й день животных 2-й и 3-й групп наркотизировали, проводили забор крови для биохимического исследования и секционного материала (печень, почки, мозг, сердце) для патогистологического исследования. Животные выводились из эксперимента путем достижения наркозной смерти с использованием золазепама (Золетил® – Virbac, Франция).
Патогистологическое исследование / Pathohistological study
Материал для патогистологического исследования получали в ходе аутопсии экспериментальных животных. Посредством краниотомии головной мозг извлекали целиком и выделяли зону прецентральной извилины переднего мозга, мозжечок, ствол головного мозга. После эвисцерации сердце, печень и почки фиксировали, выделяли фрагменты миокарда левого желудочка, правой и левой долек печени, кортикальные отделы правой и левой почек, которые повторно фиксировали. После вторичной фиксации и промывки материала проводку (обезвоживание) тканей головного мозга, печени и почек осуществляли с помощью 99% изопропилового спирта.
В дальнейшем фрагменты заливали парафином и изготовленные на санном микротоме Microm (Carl Zeiss, Германия) гистологические срезы толщиной 5 мкм окрашивали гематоксилином и эозином. Дубликаты срезов с помощью набора реактивов (ООО «БиоВитрум», Россия) окрашивали по Перльсу для выявления в тканях трехвалентного железа. Результатом проведенной реакции должно быть образование окрашенной в синий цвет соли – берлинской лазури (по уравнению химической реакции FeIIICl3 + K4[FeII(CN)6] → KFeIII[FeII(CN)6] + 3KCl).
Оценка патологических изменений органов крыс при моделировании вторичного гемохроматоза и стеатоза печени учитывала степень расстройства кровообращения, наличие и локализацию берлинской лазури, особенности ответной воспалительной реакции, структурные изменения паренхиматозных элементов. Микрофотографии получены с помощью исследовательского микроскопа Micros МС-200 (Micros, Австрия) и цифровой окулярной камеры (ООО «Микромед», Россия). С использованием полученных изображений для образцов печени был проведен морфометрический анализ посредством подсчета среднего числа купферовских клеток, в цитоплазме которых содержится берлинская лазурь, на одно поле зрения.
Представление данных / Data presentation
В результате проведения описанного комплекса исследований установлено, что и воспроизведение модели МАЖБП с перегрузкой железом, и применение терапевтических подходов приводят к комплексным и взаимосвязанным изменениям сразу многих биохимических показателей крови. Поэтому для полноценного описания результатов использованы особые формы представления данных, развиваемые в топологическом подходе к распознаванию: метрические карты показателей (параметров) исследования и профиль-диаграммы нормализованных значений всех исследованных показателей.
Метрические карты
Метрические карты показателей (параметров) исследования представляют собой отображение всего комплекса взаимодействий параметров, спроецированных на плоскость диаграммы. Каждая точка метрической диаграммы соответствует одному показателю исследования (например, уровням ферритина) в определенный день исследования в определенной группе. Соответственно, метрическая диаграмма позволяет оценивать:
– степень взаимодействия показателей (чем больше коррелируют два показателя/параметра, тем ближе соответствующие точки на диаграмме);
– динамику изменения параметров (т.к. значение одного и того же показателя в разные моменты времени в общем случае соответствует двум разным точкам);
– различия между группами (значение одного показателя для разных групп соответствует двум разным точкам).
Профиль-диаграммы
Профиль-диаграммы нормализованных значений всех исследованных показателей позволяют целостно описывать динамику и различия между группами, формировать и оценивать интегральные оценки (баллы) состояния групп животных в различные моменты времени. Как известно, значения различных биомедицинских показателей могут лежать в разных диапазонах (0–1, 50–500 и т.д.), поэтому не всегда могут быть представлены на одной диаграмме.
Для построения таких диаграмм необходимо сначала вычислить эмпирические функции распределения (ЭФР) каждого из исследованных показателей. Напомним, что ЭФР F(X) значений показателя Х – это функция в диапазоне значений [ 0…1], на графике которой по оси Х отложены наблюдаемые во всех экспериментах значения показателя Х (например, ферритина), а по оси Y – вероятность того, что значение Х меньше заданного. Затем значения показателей в их общепринятых единицах измерения заменяются на значения ЭФР в безразмерных единицах в диапазоне значений [ 0...1].
Далее значения показателей в их общепринятых единицах измерения (например, мкг/л для ферритина) заменяются на значения ЭФР в безразмерных единицах в диапазоне значений [ 0...1]. Использование значений ЭФР вместо исходных значений показателей позволяет наглядно сравнивать эффекты различных терапевтических воздействий в единой шкале значений в диапазоне [ 0…1]. В то же время абсолютные значения исследованных показателей могут отличаться на 1–2 порядка. Например, значения ферритина лежат в диапазоне 72–277 мкг/л, а общего билирубина – в диапазоне 0,3–6,7 мкмоль/л. Диаграмма со столь существенными различиями в порядках значений показателей не будет информативной.
Статистический анализ / Statistical analysis
Статистическая обработка данных проводилась с помощью программы Statistica 10.0 (StatSоft Inc., США). Для изученных показателей проводили подсчет среднего и стандартного отклонения (M±SD). Оценку статистической достоверности осуществляли по критерию Манна–Уитни. Результаты считали статистически значимыми при p<0,05. Тесты на нормальность распределения выполняли с подтверждением критерием χ² нулевой гипотезы об отсутствии отличий между наблюдаемым и ожидаемым нормальным распределением (р>0,05).
РЕЗУЛЬТАТЫ / RESULTS
В целом разработанная комплексная модель вторичного гемохроматоза и стеатоза печени имела достоверное морфологическое подтверждение. При воспроизведении модели установлены структурные изменения печени, почек, головного мозга и миокарда на микроскопическом уровне, характерные для полиорганной патологии.
Воспроизведение модели / Model reproduction
Метрическая карта
Из метрической диаграммы для воспроизведения модели (рис. 1) очевидно, что при воспроизведении модели характерно движение точек слева направо (это соответствует усилению полиорганной патологии: возрастание уровней лейкоцитов, тромбоцитов, АСТ, АЛТ, нарушение индексов Сирдаха, Ментцера и др.) и сверху вниз (противоположно действию терапии: нарушение уровней эритроцитов, гемоглобина, возрастание уровня железа сыворотки и др.). Воспроизведение модели соответствует усилению патофизиологических процессов в различных системах органов.
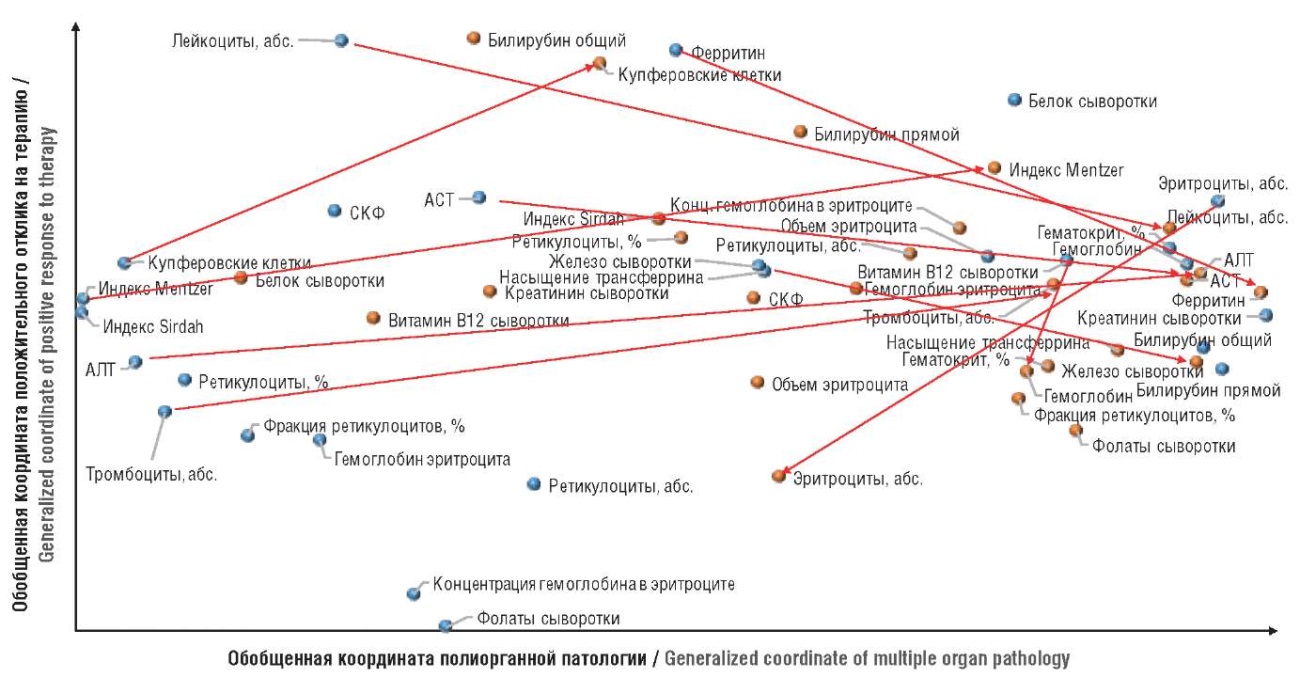
Рисунок 1. Метрическая диаграмма, отражающая согласованные изменения биохимических показателей при воспроизведении модели МАЖБП. Точками голубого цвета обозначены параметры в группе интактных животных, оранжевого – параметры при воспроизведении модели (данные на 41-й день исследования).
АСТ – аспартатаминотрансфераза; АЛТ – аланинаминотрансфераза; СКФ – скорость клубочковой фильтрации
Figure 1. Metric chart reflecting the consistent changes in biochemical parameters when reproducing the iron-overload metabolic-associated fatty liver disease model. Blue points indicate the parameters in the intact animal group, orange points indicate the parameters when reproducing the model (data on Day 41).
AST – aspartate aminotransferase; ALT – alanine aminotransferase; GFR – glomerular filtration rate
Профиль-диаграммы
Анализ нормализованных профиль-диаграмм значений биохимических показателей при воспроизведении модели (рис. 2) указывает на резкое возрастание показателя 1 (ферритин), резкое падение показателей 8–11 (эритроциты, гемоглобин, гематокрит, средний объем эритроцита), возрастание показателей 12–17 (среднее содержание гемоглобина в эритроците, средняя концентрация гемоглобина в эритроците, тромбоциты, индексы Ментцера и Сирдаха, фолаты), падение белка в сыворотке и др.
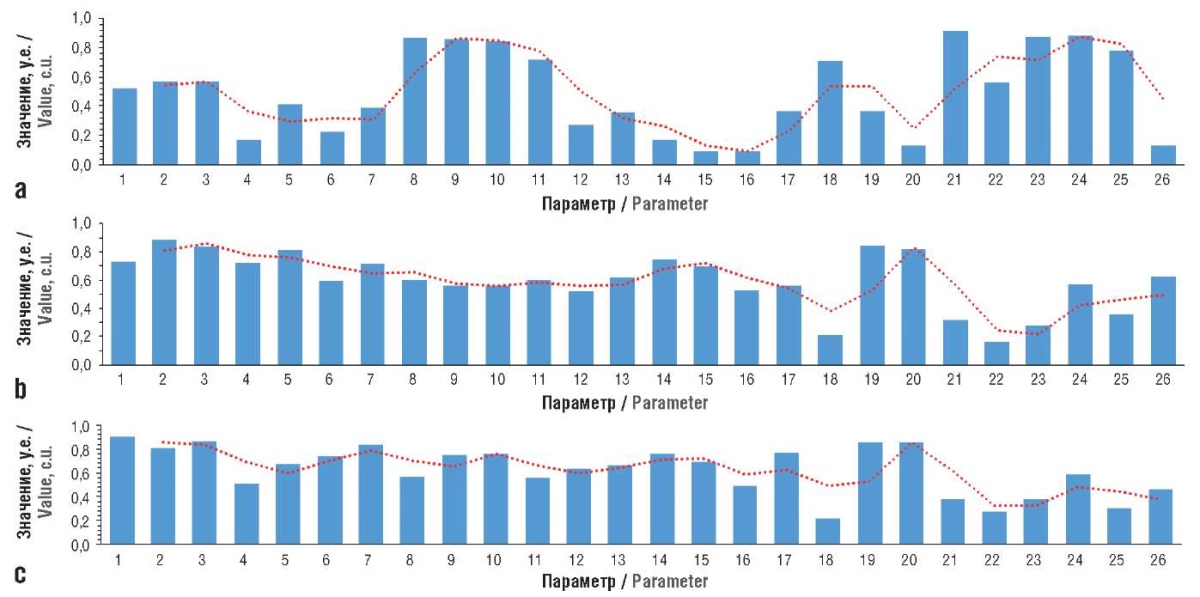
Рисунок 2. Нормализованные профили значений биохимических показателей при воспроизведении модели (красная пунктирная линия описывает профиль изменений в целом по всем показателям):
а – интактные животные; b – модель (13-й день); с – модель (41-й день).
1 – ферритин (мкг/л); 2 – коэффициент насыщения трансферрина железом (%); 3 – железо сыворотки (мкмоль/л); 4 – ретикулоциты (%); 5 – ретикулоциты (×10⁹/л); 6 – фракция ретикулоцитов (%); 7 – лейкоциты (×10⁹/л;) 8 – эритроциты (×10¹²/л); 9 – гемоглобин (г/л); 10 – гематокрит (%); 11 – средний объем эритроцита (фл); 12 – среднее содержание гемоглобина в эритроците (пг); 13 – средняя концентрация гемоглобина в эритроците (г/л); 14 – тромбоциты (×10⁹/л); 15 – индекс Ментцера; 16 – индекс Сирдаха; 17 – фолаты (нмоль/л); 18 – белок общий в сыворотке (г/л); 19 – аспартатаминотрансфераза (Ед/л); 20 – аланинаминотрансфераза (Ед/л); 21 – креатинин сыворотки (мкмоль/л); 22 – скорость клубочковой фильтрации (мл/мин/1,73 м²); 23 – билирубин общий (мкмоль/л); 24 – билирубин прямой (мкмоль/л); 25 – витамин В12 (пг/мл); 26 – купферовские клетки, в цитоплазме которых содержится берлинская лазурь (n)
Figure. 2. Normalized profiles of biochemical parameter values during model reproduction (the red dashed line describes the change profile overall across all indicators):
а – intact animals; b – model (Day 13); с – model (Day 41).
1 – ferritin (μg/l); 2 – iron transferrin saturation ratio (%); 3 – serum iron (μmol/l); 4 – reticulocytes (%); 5 – reticulocytes (×10⁹/l); 6 – reticulocyte fraction (%); 7 – leukocytes ×10⁹/l); 8 – erythrocytes (×10¹²/l); 9 – hemoglobin (g/l); 10 – hematocrit (%); 11 – mean erythrocyte volume (fl); 12 – mean hemoglobin content in erythrocyte (pg); 13 – mean hemoglobin concentration in erythrocyte (g/l); 14 – thrombocytes (×10⁹/l); 15 – Mentzer index; 16 – Sirdah index; 17 – folate (nmol/l); 18 – total serum protein (g/l); 19 – aspartate aminotransferase (U/l); 20 – alanine aminotransferase (U/l); 21 – serum creatinine (μmol/l); 22 – glomerular filtration rate (ml/min/1,73 m²); 23 – total bilirubin (μmol/l); 24 – direct bilirubin (μmol/l); 25 – vitamin B12 (pg/ml); 26 – Kupffer cells, whose cytoplasm contains Prussian blue (n)
Гистологические подтверждения
Во всех наблюдениях группы интактных контролей микроскопическая картина ткани печени соответствовала норме. В пределах отдельно взятой печеночной дольки при сохранении гистоархитектоники гепатоциты имели привычную конфигурацию и равномерную окраску с равномерным распределением ультраструктур в цитоплазме без образования берлинской лазури. Наблюдалась равномерная перфузия синусоидов в центральной и перипортальной зонах, в строме портальных трактов присутствовали единичные лимфоциты. Исследование корковой зоны почек показало привычное строение клубочков с нормальным уровнем перфузии кровью, свободным мезангиальным пространством. Нефроциты в пределах извитых проксимальных и дистальных канальцев не имели повреждений. Головной мозг крыс контрольной группы имел нормальный уровень перфузии без признаков агрегации эритроцитов в капиллярах и отека нервной ткани. Нейроны были привычной формы и размеров с четкими контурами ядер. В цитоплазме пирамидных нейронов коры полушарий переднего мозга глыбки Ниссля имели равномерное распределение. В миокарде левого желудочка интактных крыс наблюдались ориентированные сократительные волокна с сохраненной поперечной исчерченностью.
Эффекты на печень
Через 12 дней введения сульфата железа, пальмового масла и раствора фруктозы в печени наблюдалось накопление железосодержащих соединений в пространстве Диссе, цитоплазме гепатоцитов и купферовских клеток перипортальной зоны печеночных долек (рис. 3а). В центральных отделах печеночной дольки гепатоциты содержали мелкие капли липидов (рис. 3b). На 41-й день от начала эксперимента железосодержащий субстрат в печени перераспределился и активно накапливался в цитоплазме купферовских клеток (рис. 3c) и между соединительнотканными волокнами капсулы печени (рис. 3d), причем большинство гепатоцитов были свободны от берлинской лазури. Наблюдалось прогрессирование жировой дистрофии гепатоцитов с образованием крупных вакуолей с липидами в их цитоплазме (рис. 3e). В большинстве наблюдений строма портальных трактов имела воспалительно-клеточный инфильтрат, состоящий преимущественно из Т-лимфоцитов и эозинофилов (рис. 3f, 3g). Гистологическая картина соответствовала умеренной выраженности воспалительной реакции как к 13-му, так и к 41-му дню после воспроизведения модели.
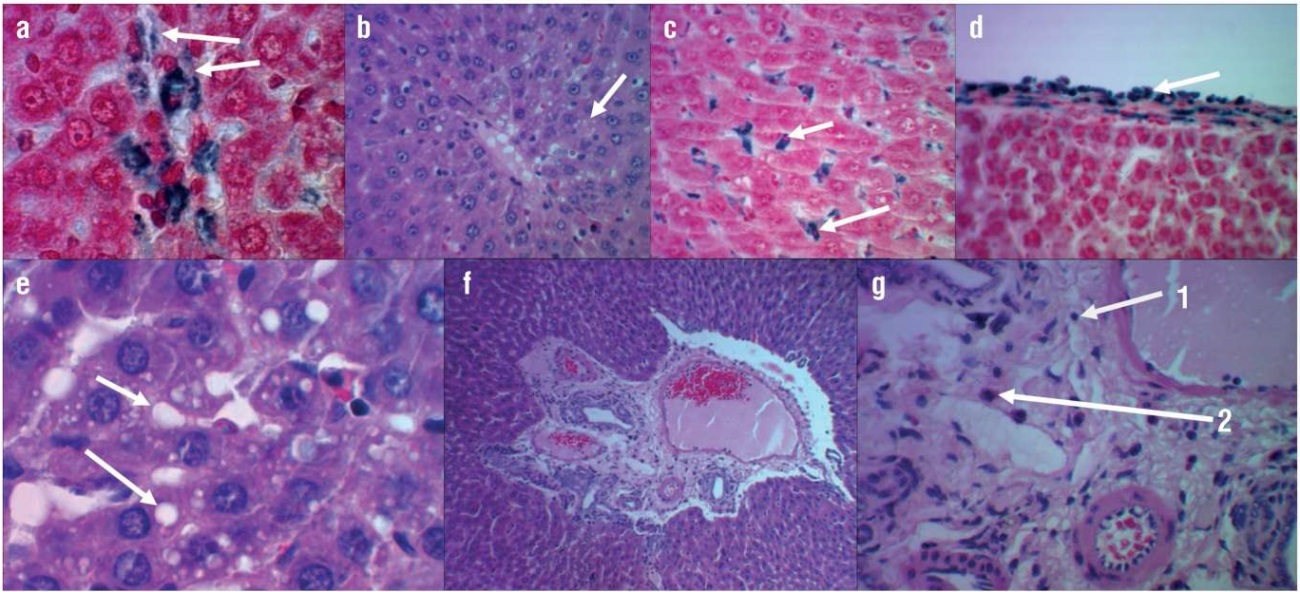
Рисунок 3. Результаты гистологического анализа тканей печени при воспроизведении модели «сульфат железа + пальмовое масло + раствор фруктозы»:
а – внутри- и внеклеточное отложение глыбок берлинской лазури на периферии печеночной дольки (увеличение ×1200, окраска реакцией Перльса); b – мелкокапельное ожирение гепатоцитов центра печеночной дольки (увеличение ×480, окраска гематоксилином и эозином); c – цитоплазма звездчатых ретикулоэндотелиоцитов (купферовских клеток) насыщена берлинской лазурью (увеличение ×480, окраска реакцией Перльса); d – очаговое скопление берлинской лазури в капсуле печени (увеличение ×480, окраска реакцией Перльса); e – крупнокапельное ожирение гепатоцитов центра печеночной дольки (увеличение ×1200, окраска гематоксилином и эозином); f – воспалительно-клеточная инфильтрация стромы портального тракта (увеличение ×1200, окраска гематоксилином и эозином); g – в составе инфильтрата Т-лимфоциты (1), эозинофилы (2) (увеличение ×1200, окраска гематоксилином и эозином)
Figure 3. Liver tissue histological analysis in “iron sulfate + palm oil + fructose solution” model reproduction:
а – intra- and extracellular deposition of deep Prussian blue at the periphery of hepatic lobule (magnification ×1200, Perls reaction staining); b – shallow droplet obesity of hepatocytes of liver lobule center (magnification ×480, hematoxylin and eosin staining); c – cytoplasm of stellate reticuloendotheliocytes (Kupffer cells) is stained with Prussian blue (magnification ×480, Perls reaction staining); d – focal accumulation of Prussian blue in liver capsule (magnification ×480, Perls reaction staining); e – coarse-drop obesity of hepatocytes of liver lobule center (magnification ×1200, hematoxylin and eosin staining); f – inflammatory-cell infiltration of portal tract stroma (magnification ×1200, hematoxylin and eosin staining); g – in the infiltrate, T lymphocytes (1), eosinophils (2) are visible (magnification ×1200, hematoxylin and eosin staining)
Эффекты на почки
Исследование гистологических срезов кортикальной зоны почек на 13-й день проведения эксперимента показало накопление мелких «зерен железа» в цитоплазме нефроцитов проксимальных извитых канальцев, которое носило диффузно-очаговый характер. В 2 наблюдениях просветы дистальных извитых канальцев были обтурированы эозинофильными массами из нерастворимых углеводов и липидов, что свидетельствовало о нарушении гломерулярного фильтра.
К 41-му дню эксперимента наблюдалась активная экскреция железосодержащих соединений, что подтверждается прокрашиванием в синий цвет мочи в просветах дистальных отделов извитых канальцев. При этом нефроциты дистальных канальцев, учитывая их реабсорционную компетентность, стали активно накапливать «зерна железа» в цитоплазме, a нефроциты проксимальных канальцев сохраняли в цитоплазме единичные зерна берлинской лазури.
Эффекты на головной мозг
При исследовании головного мозга к 13-му дню эксперимента на фоне умеренно выраженного периваскуляного и перицеллюлярного отека нервной ткани наблюдалось очаговое накопление железосодержащих веществ в периваскулярном пространстве. Структурных нарушений нейронов не обнаружено.
К 41-му дню в нервной ткани полушарий большого мозга и мозжечка сохранялись одиночные очаги с глыбками берлинской лазури. Кроме того, отмечалась активность астроцитов, в цитоплазме которых располагались мелкие гранулы железосодержащих продуктов.
Эффекты на сердце
Исследование сердца экспериментальных животных показало сохранность паренхиматозных и стромально-сосудистых элементов миокарда (13-й и 41-й дни). Минимальные изменения обнаружены лишь в 2 наблюдениях в виде мелкоочагового отложения гранул берлинской лазури в цитоплазме кардиомиоцитов.
Полипептидная терапия ГПЧ / HPH рolypeptide therapy
Метрическая карта
Применение ГПЧ соответствует движению точек, соответствующих биохимических показателям исследования, справа налево (снижение полиорганной патологии: нормализация АСТ, АЛТ, ферритина, железа сыворотки крови, нормализация уровней билирубина и др.) и снизу вверх (положительный эффект терапии: снижение абнормально повышенных уровней лейкоцитов, нормализация уровней витамина В12, белка сыворотки и др. (рис. 4).
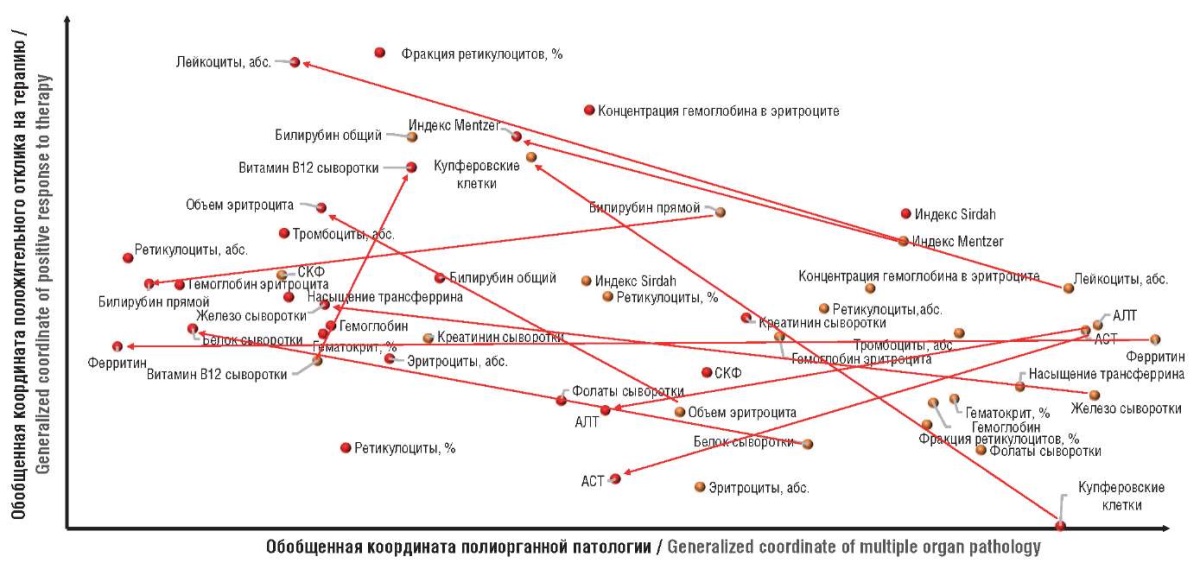
Рисунок 4. Метрическая диаграмма согласованной динамики показателей при терапии гидролизатом плаценты человека в модели метаболически-ассоциированной жировой болезни печени. Оранжевым цветом обозначены точки, соответствующие показателям в группе воспроизведения модели (41-й день), красным – точки в группе, получавшей лечение (41-й день).
АСТ – аспартатаминотрансфераза; АЛТ – аланинаминотрансфераза; СКФ – скорость клубочковой фильтрации
Figure 4. Metric diagram of matched dynamics of parameters during human placenta hydrolyzate therapy for iron overload metabolic-associated fatty liver disease model. The points corresponding to the parameters in the model reproduction group (Day 41) are marked in orange, the points in the treated group (Day 41) are marked in red.
AST – aspartate aminotransferase; ALT – alanine aminotransferase; GFR – glomerular filtration rate
Профиль-диаграммы
Нормализованные профили значений биохимических показателей наглядно характеризуют различия при использовании различных подходов к терапии на 41-й день эксперимента (рис. 5). Для ГПЧ характерно, прежде всего, снижение значений показателей 1–12 (обмен железа (ферритин, коэффициент насыщения трансферрина железом, железо сыворотки) и общий анализ крови (ретикулоциты, эритроциты и др.)), нормализация (снижение) показателей 19, 20 (АСТ, АЛТ).
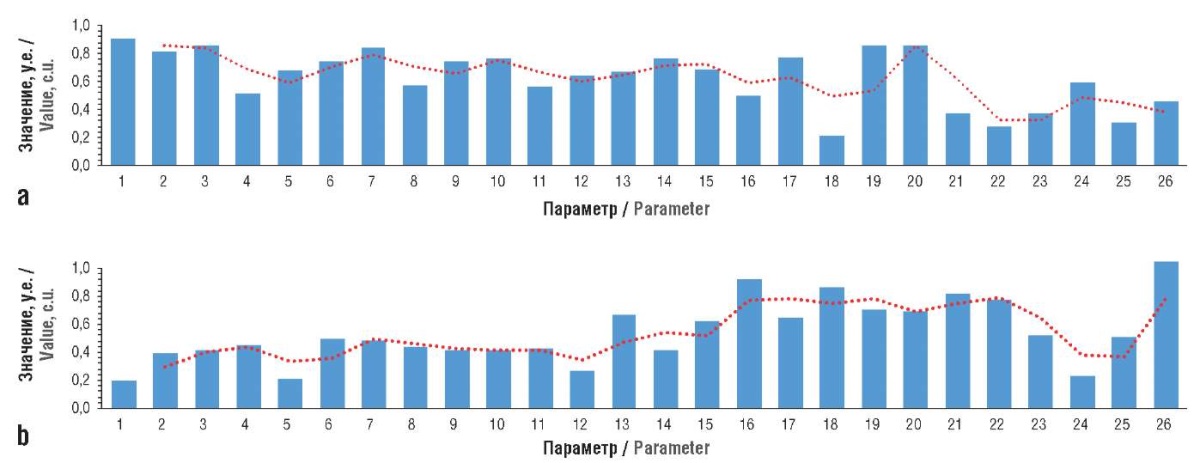
Рисунок 5. Нормализованные профили значений биохимических показателей при терапии гидролизатом плаценты человека:
a – модель (41-й день); b – терапия (41-й день).
1 – ферритин (мкг/л); 2 – коэффициент насыщения трансферрина железом (%); 3 – железо сыворотки (мкмоль/л); 4 – ретикулоциты (%); 5 – ретикулоциты (×10⁹/л); 6 – фракция ретикулоцитов (%); 7 – лейкоциты (×10⁹/л;) 8 – эритроциты (×10¹²/л); 9 – гемоглобин (г/л); 10 – гематокрит (%); 11 – средний объем эритроцита (фл); 12 – среднее содержание гемоглобина в эритроците (пг); 13 – средняя концентрация гемоглобина в эритроците (г/л); 14 – тромбоциты (×10⁹/л); 15 – индекс Ментцера; 16 – индекс Сирдаха; 17 – фолаты (нмоль/л); 18 – белок общий в сыворотке (г/л); 19 – аспартатаминотрансфераза (Ед/л); 20 – аланинаминотрансфераза (Ед/л); 21 – креатинин сыворотки (мкмоль/л); 22 – скорость клубочковой фильтрации (мл/мин/1,73 м²); 23 – билирубин общий (мкмоль/л); 24 – билирубин прямой (мкмоль/л); 25 – витамин В12 (пг/мл); 26 – купферовские клетки, в цитоплазме которых содержится берлинская лазурь (n)
Figure 5. Normalized profiles of biochemical parameter values during therapy with human placenta hydrolyzate:
a – model (Day 41); b – therapy (Day 41).
1 – ferritin (μg/l); 2 – iron transferrin saturation ratio (%); 3 – serum iron (μmol/l); 4 – reticulocytes (%); 5 – reticulocytes (×10⁹/l); 6 – reticulocyte fraction (%); 7 – leukocytes ×10⁹/l); 8 – erythrocytes (×10¹²/l); 9 – hemoglobin (g/l); 10 – hematocrit (%;) 11 – mean erythrocyte volume (fl); 12 – mean hemoglobin content in erythrocyte (pg); 13 – mean hemoglobin concentration in erythrocyte (g/l); 14 – thrombocytes (×10⁹/l); 15 – Mentzer index; 16 – Sirdah index; 17 – folates (nmol/l); 18 – total serum protein (g/l); 19 – aspartate aminotransferase (U/l); 20 – alanine aminotransferase (U/l); 21 – serum creatinine (μmol/l); 22 – glomerular filtration rate (ml/min/1,73 m²); 23 – total bilirubin (μmol/l); 24 – direct bilirubin (μmol/l); 25 – vitamin B12 (pg/ml); 26 – Kupffer cells, whose cytoplasm contains Prussian blue (n)
Группы профилей биохимических показателей
Анализ нормализованных профилей биохимических показателей по сравнению с использованием каких-либо отдельных показателей позволяет получить более целостную картину отличий в эффектах исследованных подходов к терапии перегрузки железом. Мы разделили эти профили на три сегмента: показатели обмена железа, показатели общего анализа крови, биохимические показатели полиорганной дисфункции.
Показатели обмена железа
Анализ показателей обмена железа (рис. 6а) указал на формирование перегрузки железом при воспроизведении модели с последующей нормализацией уровней железа в крови. Из профилей очевидно, что значения трех «быстрых» показателей обмена железа (ферритин, коэффициент насыщения трансферрина железом, железо сыворотки) резко повышались при воспроизведении модели. Значения ферритина возрастали от 201±45 мкг/л у интактных контролей до 229±13 мкг/л в модели на 13-й день (р<0,0001) и на 41-й день (р<0,0001). Значения коэффициента насыщения трансферрина железом повышались от 57±8% у интактных крыс до 88±15% на 13-й день (р<0,0001) и 81±27% на 41-й день (р<0,0001) в группе модели. Уровни железа в сыворотке крови увеличивались от 28±5 мкмоль/л в контроле до 50±10 мкмоль/л на 13-й и 41-й дни (р<0,0001). Терапия ГПЧ приводила к достоверному снижению уровня ферритина на 41-й день до 141±24 мкг/л (р<0,00001), коэффициента насыщения трансферрина железом – до 30±6% (р<0,00005), железа в сыворотке крови – до 21±4 мкмоль/л (р<0,0001).
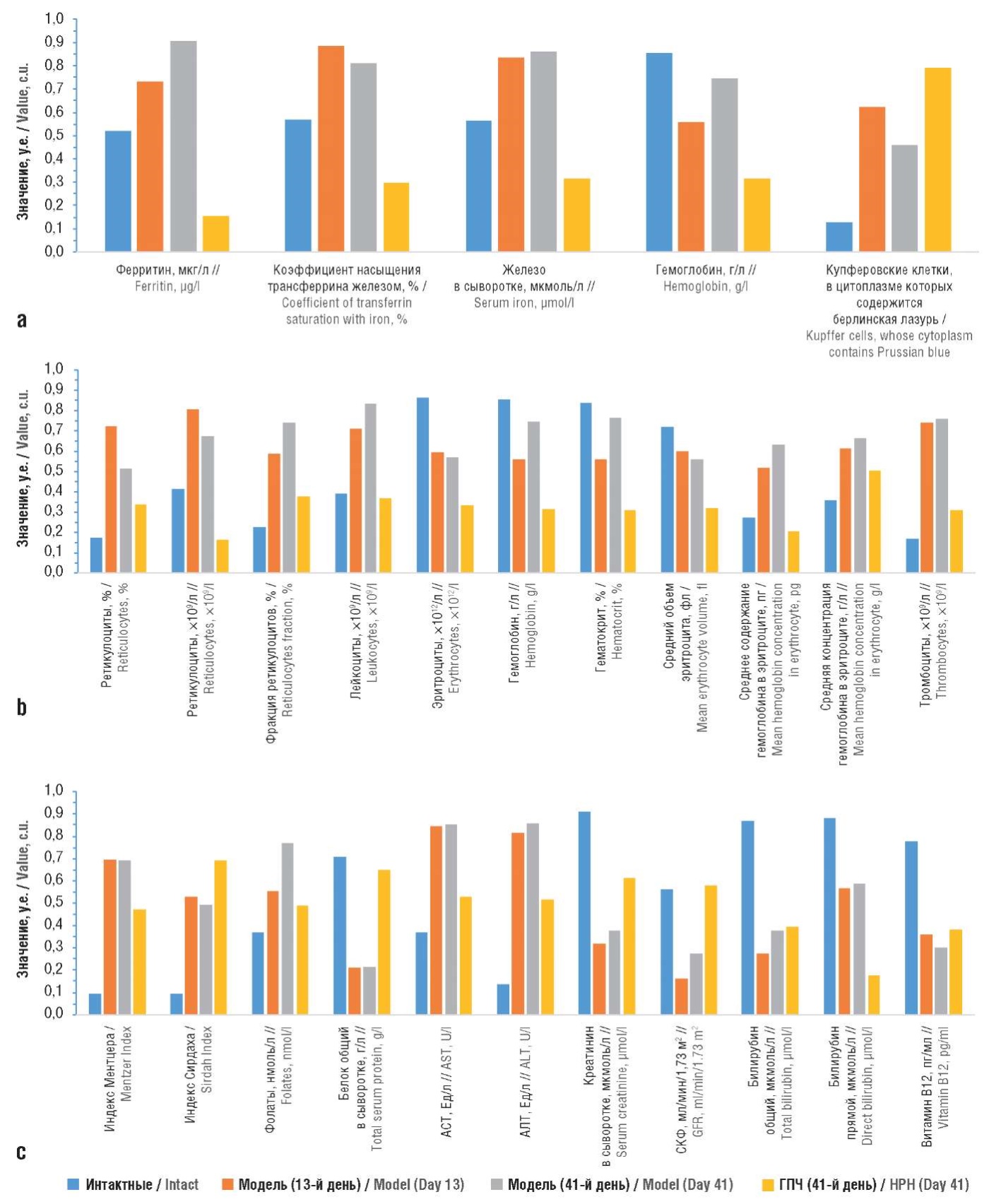
Рисунок 6. Профили биохимических показателей исследованных групп:
а – обмен железа; b – общий анализ крови; c – полиорганная дисфункция.
ГПЧ – гидролизат плаценты человека; АСТ – аспартатаминотрансфераза; АЛТ – аланинаминотрансфераза; СКФ – скорость клубочковой фильтрации
Figure 6. Profiles of biochemical parameters of the studied groups:
а – iron metabolism; b – сomplete blood count; c – multiple organ dysfunction.
HPH – human placenta hydrolysate; AST – aspartate aminotransferase; ALT – alanine aminotransferase; GFR – glomerular filtration rate
Показатели общего анализа крови
Рассмотрение изменений показателей общего анализа крови (рис. 6b) позволило оценить эффекты модели и ГПЧ на состояние кроветворения. Одним из основных параметров обмена железа и кроветворения является уровень гемоглобина в крови. С концентрациями гемоглобина ассоциированы такие показатели общего анализа крови, как средний объем эритроцита, среднее количество гемоглобина в эритроците и средняя концентрация гемоглобина в эритроците.
При воспроизведении модели отмечается достоверное падение общего числа эритроцитов в крови (интактные: 8,7±0,8×10¹² кл/л; модель (13-й день): 7,4±1,2×10¹² кл/л; р=0,022; модель (41-й день): 7,1±1,4×10¹² кл/л). При этом средний объем эритроцита не изменялся, отмечены достоверное возрастание среднего количества гемоглобина в эритроците (интактные: 15,8±0,3 пг; модель (13-й и 41-й дни): 16,2±0,1 пг; р=0,013) и тренд к увеличению средней концентрации гемоглобина в эритроците (р=0,06). Применение ГПЧ приводило к достоверному снижению среднего объема эритроцита до 45±5 фл (р=0,025) на фоне снижения среднего количества гемоглобина в эритроците в сторону нормы – до 299±17 г/л (р=0,005). ГПЧ не оказывал достоверного влияния на общее количество эритроцитов.
Воспроизведение модели привело к достоверному повышению процента ретикулоцитов (интактные: 3,1±0,7%; модель (13-й день): 5,2±1,0%; р=0,00115), общего количества ретикулоцитов (интактные: 288±61×10⁹ кл/л; модель (13-й день): 433±116×10⁹ кл/л; р=0,014), фракции ретикулоцитов (интактные: 43,3±6,1%; модель (13-й день): 54,5±7,0%; р=0,007) с небольшим и статистически недостоверным снижением всех трех показателей к 41-му дню. На 41-й день ГПЧ достоверно способствовал нормализации общего количества ретикулоцитов (215±52×10⁹ кл/л; р=0,00012) и фракции ретикулоцитов (48,5±11%; р=0,048).
Показатели полиорганной дисфункции
Другие биохимические показатели (рис. 6с) связаны с характеризацией полиорганной дисфункции: воспаление и тромбообразование, функция почек, функция печени.
Уровни лейкоцитов у интактных животных составили 4,6±1,3×10⁹ кл/л, а при воспроизведении модели повышались к 13-му дню (6,2±1,0×10⁹ кл/л; р=0,022) с трендом к повышению к 41-му дню. Применение ГПЧ приводило фактически к возвращению уровней лейкоцитов в диапазон нормы (4,5±2,7×10⁹ кл/л; р=0,039). Уровни тромбоцитов составили 509,7±121,6×10⁹ кл/л в группе интактных животных и возрастали до 860,8±156,2×10⁹ кл/л (р=0,00083) на 13-й день после воспроизведения модели с недостоверным снижением к 41-му дню (820,2±50,5×10⁹ кл/л; р>0,1). Применение ГПЧ способствовало выраженной нормализации уровней тромбоцитов на 41-й день (639,0±92,3×10⁹ кл/л; р=0,00157).
Креатинин сыворотки крови падал от 35,7±1,2 мкмоль/л у интактных животных до 22,5±2,4 мкмоль/л в модели на 13-й день (р<0,00001) без изменений к 41-му дню. ГПЧ способствовал восстановлению уровней креатинина в сторону диапазона нормы на 41-й день до 27,7±1,5 мкмоль/л (р=0,0002). СКФ у интактных животных составила 169±5 мл/мин/1,73² м², а при воспроизведении модели падала до 142,4±12,3 мл/мин/1,73 м² на 13-й день (р=0,0011) с частичным улучшением к 41-му дню исследования до 154,1±7,1 мл/мин/1,73 м² (р=0,04). ГПЧ практически полностью восстанавливал СКФ до исходного уровня у интактных животных на 41-й день – 169,8±6,2 мл/мин/1,73 м² (р=0,0011).
Уровни АСТ составили 114,9±27,3 Ед/л у интактных животных. При воспроизведении модели во 2-й и 3-й группах отмечено более чем двукратное повышение АСТ до 299,9±27,9 Ед/л (р<0,000001) на 13-й день без изменений к 41-му дню. ГПЧ способствовал достоверному снижению АСТ на 41-й день до 166,7±51,3 Ед/л (р=0,00027). Уровни АЛТ изменялись подобным образом: при воспроизведении модели достоверно повышалось содержание АЛТ на 13-й день без изменений к 41-му дню. Применение ГПЧ приводило к нормализации АЛТ. Воспроизведение модели вызывало снижение уровней общего белка на 13-й день без изменений к 41-му дню. ГПЧ оказывал положительное действие на биосинтетическую функцию печени, способствуя восстановлению уровней общего белка на 41-й день.
При воспроизведении модели уровни фолатов в крови показали тренд к повышению к 13-му дню (62,4±5,6 нмоль/л; р=0,078) по сравнению с интактными животными (52,5±15,0 нмоль/л). Динамика повышения уровней фолатов достигла статистической значимости к 41-му дню (67,6±3,1 нмоль/л; р=0,043).
Интегральная оценка изменений состояния животных
Результаты расчетов интегральной балльной оценки наглядно показывают различия между группами (рис. 7). Так, для группы интактных животных значения интегрального балла были положительны и составили +2,87±1,50. Воспроизведение модели МАЖБП с перегрузкой железом приводило к резкому снижению значения балла (–7,01±1,34) на 13-й день с незначительной положительной динамикой к 41-му дню (–6,51±0,73). Применение ГПЧ вызывало достоверное повышение интегрального балла оценки к 41-му дню – до 2,21±2,00, что указывает на высокую общую эффективность терапии ГПЧ в данной модели полиорганной патологии с перегрузкой железом.
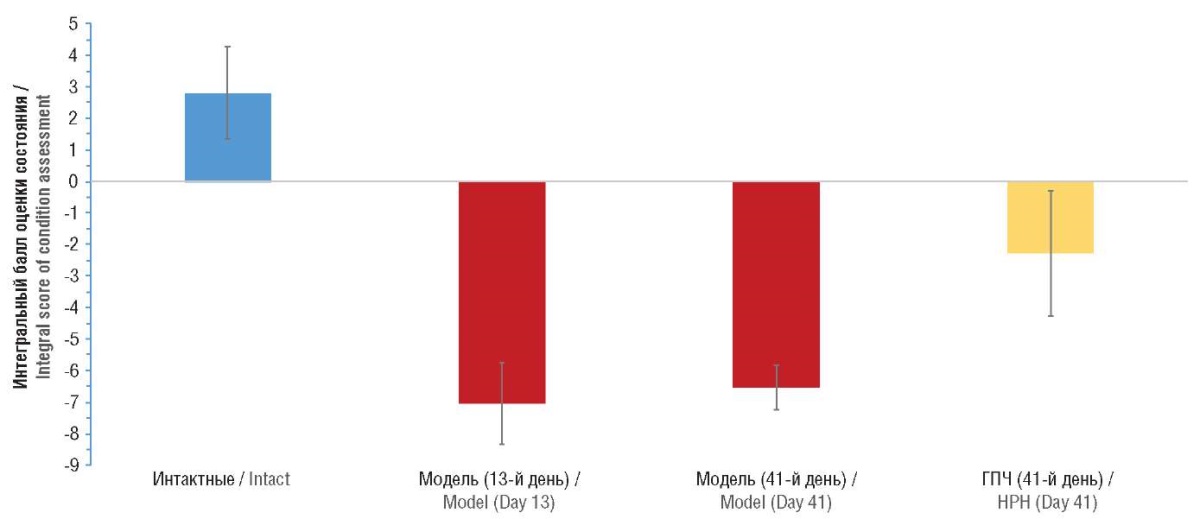
Рисунок 7. Значения интегральной балльной оценки состояния животных в исследованных группах. Положительные значения соответствуют нормофизиологическим состояниям, отрицательные – патофизиологическим
Figure 7. Integral score of animals’ condition in the studied groups. Positive values correspond to normal physiological conditions, negative values correspond to pathophysiological conditions
Гистологический анализ эффектов ГПЧ
На момент завершения эксперимента (41-й день) печень лабораторных животных сохранила нормальный уровень гемоперфузии, жировая дистрофия гепатоцитов наблюдалась лишь у 2 из 6 крыс.
Реакция Перльса показала, что во всех случаях железосодержащие продукты накапливались в цитоплазме купферовских клеток, гистиоцитах стромы портальных трактов и капсулах печени (рис. 8а, 8b). При этом сами гепатоциты оказались свободныыми от окраски на гемосидерин. Уровень выраженности воспалительного инфильтрата стромы портальных трактов также оказался неодинаковым, в состав инфильтрата в основном входили Т-лимфоциты и эозинофилы (рис. 8c). Исследование почек показало, что во всех случаях при сохранении нормального уровня перфузии почечной ткани железосодержащие продукты накапливались в цитоплазме нефроцитов дистальных извитых канальцев в виде мелких гранул берлинской лазури (рис. 8d, 8e). В головном мозге наблюдался слабовыраженный перицеллюлярный отек нервной ткани, реакция Перльса во всех наблюдениях не позволила выявить присутствие железосодержащих соединений (рис. 8f). У всех крыс, получавших терапию ГПЧ, миокард не имел структурных нарушений (рис. 8g).
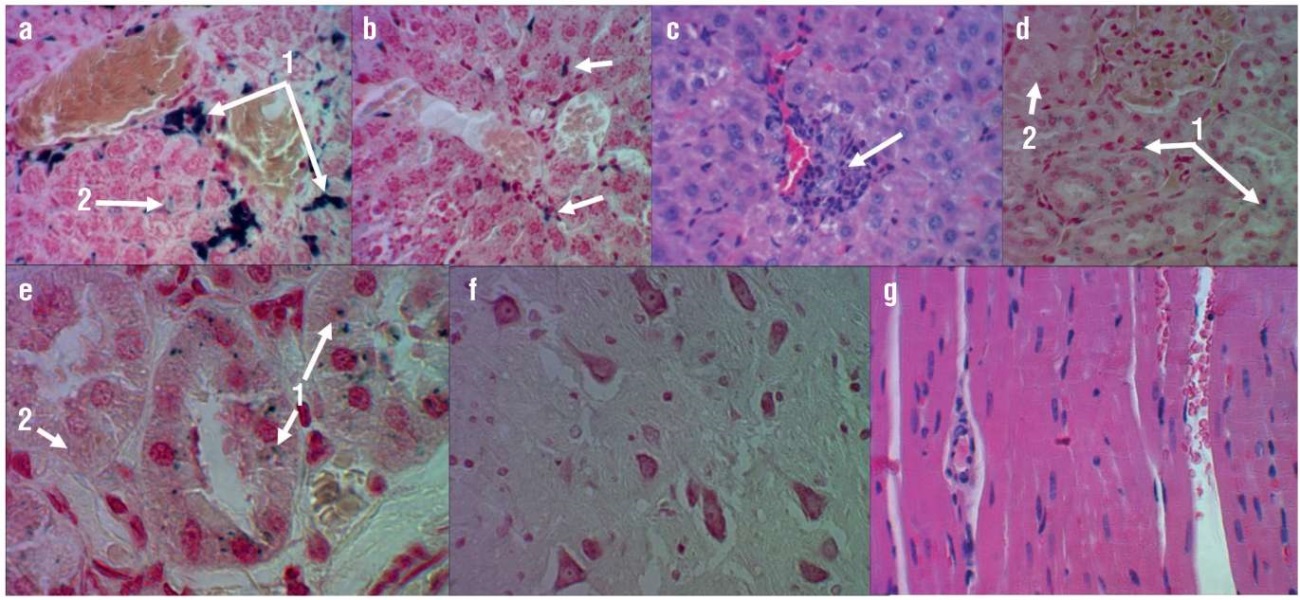
Рисунок 8. Гистологический анализ эффектов терапии гидролизатом плаценты человека:
а – в зоне портального тракта идет активное накопление макрофагами (купферовскими клетками и гистиоцитами) железосодержащих продуктов (1), мелкие гранулы берлинской лазури в пространствах Диссе (2) (окраска реакцией Перльса, увеличение ×480); b – в перипортальной зоне цитоплазма купферовских клеток содержит незначительное количество железосодержащих продуктов (окраска реакцией Перльса, увеличение ×480); c – умеренно выраженная воспалительно-клеточная инфильтрация стромы портального тракта на фоне сохраненной гемоперфузии печеночной дольки (окраска гематоксилином и эозином, увеличение ×480); d – мелкие гранулы берлинской лазури в цитоплазме нефроцитов дистальных извитых канальцев (1), нефроциты проксимальных извитых канальцев свободны от железосодержащих продуктов (2) (окраска реакцией Перльса, увеличение ×480); е – мелкие гранулы берлинской лазури в цитоплазме нефроцитов дистальных извитых канальцев (1), нефроциты проксимальных извитых канальцев свободны от железосодержащих продуктов (2) (окраска реакцией Перльса, увеличение ×1200); f – перицеллюлярный отек нервной ткани, пирамидные нейроны без структурных нарушений (окраска реакцией Перльса, увеличение ×480); g – cократительные волокна миокарда левого желудочка сохраняют поперечную исчерченность на фоне удовлетворительной гемоперфузии (окраска гематоксилином и эозином, увеличение ×480)
Figure 8. Histological analysis of the effects of human placenta hydrolysate therapy:
a – in the portal tract zone, there is an active accumulation of iron-containing products by macrophages (Kupffer cells and histiocytes) (1), small granules of Prussian blue in Disse spaces (2) (Perls reaction staining, magnification ×480); b – in the periportal zone, the cytoplasm of Kupffer cells contains an insignificant amount of iron-containing products (Perls reaction staining, magnification ×480); c – moderate inflammatory cell infiltration of portal tract stroma with preserved hemoperfusion of liver lobule (hematoxylin and eosin staining, magnification ×480); d – small granules of Prussian blue in cytoplasm of distal convoluted tubule nephrocytes (1), nephrocytes of proximal convoluted tubules are free from iron-containing products (2) (Perls reaction staining, magnification ×480); e – small granules of Prussian blue in cytoplasm of distal convoluted tubule nephrocytes (1), proximal convoluted tubule nephrocytes are free from iron-containing products (2) (Perls reaction staining, magnification ×1200); f – pericellular edema of nervous tissue, pyramidal neurons without structural abnormalities (Perls reaction staining, magnification ×480); g – contractile fibers of left ventricular myocardium retain transverse striation with satisfactory hemoperfusion (hematoxylin and eosin staining, magnification ×480)
ОБСУЖДЕНИЕ / DISCUSSION
Перегрузка железом характерна для различных форм полиорганной патологии. Анализ показателей обмена железа при воспроизведении модели указал на ее формирование. Рассмотрение изменений показателей общего анализа крови позволило оценить эффекты модели и ГПЧ на состояние кроветворения.
Так, при воспроизведении модели отмечается достоверное падение общего числа эритроцитов в крови. Это может быть связано с тем, что перегрузка железом стимулирует гибель эритроцитов и/или сокращает жизненный цикл эритроцитов (в частности, их деградацию). На ускорение жизненного цикла эритроцитов (что подразумевает, в частности, активацию процессов кроветворения) в условиях перегрузки железом указывает и резкое возрастание уровней ретикулоцитов при воспроизведении модели. Напомним, что ретикулоциты – это молодые эритроциты, образующиеся в костном мозге (клетки – предшественники эритроцитов). Содержание ретикулоцитов в крови отражает состояние системы кроветворения (прежде всего, эритропоэза). ГПЧ стимулировал снижение общего количества ретикулоцитов и фракции ретикулоцитов в сторону диапазона нормы.
Одним из основных признаков полиорганной дисфункции является возрастание провоспалительных и протромботических реакций организма (повышение уровней лейкоцитов и тромбоцитов). Применение ГПЧ приводило к возвращению уровней лейкоцитов в диапазон нормы, способствовало выраженной нормализации уровней тромбоцитов.
Креатинин в сыворотке крови и СКФ являются показателями функционирования почек. При воспроизведении модели эти параметры достоверно снижались к 13-му дню, что указывает на формирование поражения почек при перегрузке железом на фоне перегрузки липидного и углеводного метаболизма. ГПЧ способствовал восстановлению уровней креатинина.
Уровни общего белка, АСТ, АЛТ, билирубина (общего, прямого), витаминов В9 (фолатов) и витамина В12 (цианокобаламина) в сыворотке крови являются биомаркерами функции печени. Повышение АСТ и АЛТ – характерная особенность МАЖБП, а снижение этих показателей в сторону диапазона нормы характеризует эффективность терапии МАЖБП. При воспроизведении настоящей модели уровни АСТ, АЛТ, фолатов действительно возрастали, а уровни общего белка – падали. Однако отмечена необычная динамика (падение) уровней билирубина (общего и прямого) и витамина В12. ГПЧ способствовал восстановлению значений этих показателей в сторону диапазона значений, характерных для интактных животных.
При применении ГПЧ наблюдался гистологически выраженный гепатопротекторный эффект (отсутствие жировой дистрофии гепатоцитов, возросшая макрофагальная активность купферовских клеток и снижение выраженности воспалительно-клеточной инфильтрации) на фоне снижения уровня накопления гемосидерина почками: в просветах дистальных канальцев отсутствовала железопозитивная реакция (что, вероятно, связано с ускорением экскреции отложений железа).
Сочетание МАЖБП с перегрузкой железом встречается примерно у 1/3 пациентов и весьма трудно поддается лечению. Помимо того, что для такой формы МАЖБП не разработано специальных средств лечения, малочисленны и экспериментальные модели, на которых могли бы апробироваться такие средства [19–21]. Направления будущих исследований включают проведение крупномасштабных рандомизированных плацебо-контролируемых клинических исследований стандартизированных препаратов ГПЧ, метаанализа на основе клинических исследований [2–8] и проводимого в настоящее время крупномасштабного многоцентрового исследования ГПЧ.
ЗАКЛЮЧЕНИЕ / CONCLUSION
В работе предложена гистологически подтвержденная модель МАЖБП с полиорганной патологией у крыс, вызванная сочетанным приемом избытка жиров, углеводов и неорганического железа. Охарактеризованы сложные изменения биомаркеров функции печени, почек, кроветворения, воспаления и тромбообразования, возникающие при воспроизведении модели. Гистологический анализ показал, что ГПЧ способствует выведению железа из печени, одновременно препятствуя повреждениям почек, головного мозга и миокарда в предлагаемой модели МАЖБП с перегрузкой железом.
Список литературы
1. Райхельсон К.Л., Маев М.В., Жаркова М.С. и др. Жировая болезнь печени: новая номенклатура и ее адаптация в Российской Федерации. Российский журнал гастроэнтерологии, гепатологии, колопроктологии. 2024; 34 (2): 35–44. https://doi.org/10.22416/1382-4376-2024-961.
2. Торшин И.Ю., Громова О.А., Богачева Т.Е. Систематический анализ взаимосвязей между неалкогольной жировой болезнью печени и перегрузкой тканей железом: перспективные направления применения полипептидной терапии. Экспериментальная и клиническая гастроэнтерология. 2023; 10: 139–52. ht tps://doi.org/10.31146/1682-8658-ecg-218-10-139-152.
3. Торшин И.Ю., Громова О.А., Тихонова О.В., Чучалин А.Г. О молекулярных механизмах воздействия пептидов стандартизированного гидролизата плаценты на функционирование митохондрий. Терапевтический архив. 2023; 95 (12): 1133–40. https://doi.org/10.26442/00403660.2023.12.202494.
4. Богачева Т.Е., Калачева А.Г., Громова О.А. и др. Изучение эффективности препарата Лаеннек при повреждении печени пальмовым маслом у крыс. Фармакокинетика и фармакодинамика. 2023; 4: 23–31. https://doi.org/10.37489/2587-7836-2023-4-23-31.
5. Тран В.Т., Торшин И.Ю., Громова О.А. Открытое контролируемое исследование эффективности и безопасности применения Лаеннека для улучшения функции печени у пациентов с неалкогольной жировой болезнью печени. Экспериментальная и клиническая гастроэнтерология. 2023; 8: 48–56. https://doi.org/10.31146/1682-8658-ecg-216-8-48-56.
6. Громова О.А., Торшин И.Ю., Максимов В.А. и др. Пептиды в составе препарата Лаеннек, способствующие устранению гиперферритинемии и перегрузки железом. ФАРМАКОЭКОНОМИКА. Современная фармакоэкономика и фармакоэпидемиология. 2020; 13 (4): 413–25. https://doi.org/10.17749/2070-4909/farmakoekonomika.2020.070.
7. Максимов В.А., Торшин И.Ю., Чучалин А.Г. и др. Эффективность и безопасность полипептидного препарата (Лаеннек) в терапии COVID-19. Экспериментальная и клиническая гастроэнтерология. 2020; 6: 55–63. https://doi.org/10.31146/1682-8658-ecg-178-6-55-63.
8. Винницкая Е.В., Сандлер Ю.Г., Салиев К.Г. и др. Эффективность гидролизата плаценты человека при метаболически ассоциированной жировой болезни печени н астадии фиброза (пилотное исследование). Терапевтический архив. 2024; 96 (2): 107–16. https://doi.org/10.26442/00403660.2024.02.202582.
9. Zhuo Z., Fan S., Hu K., et al. Analysis of digital profiling of duodenal transcriptome gene expression in SD rats injected with iron sulfate or iron glycine chelate through a probe. Sci Rep. 2016; 6: 37923. https://doi.org/10.1038/srep37923.
10. Luo G., Xiang L., Xiao L. Acetyl-CoA deficiency is involved in the regulation of iron overload on lipid metabolism in apolipoprotein E knockout mice. Molecules. 2022; 27 (15): 4966. https://doi.org/10.3390/molecules27154966.
11. Hilton S., Sabaratnam R., Drakesmith H., Karpe F. Metabolism of iron, glucose and fats and obesity: the relationship. Int J Obes. 2023; 47 (7): 554–63. https://doi.org/10.1038/s41366-023-01299-0.
12. Jensen T., Abdelmalek M.F., Sullivan S., et al. Fructose and sugar: the main mediators of non-alcoholic fatty liver disease. J Hepatol. 2018; 68 (5): 1063–75. https://doi.org/13.1016/j.jhep.2018.01.019.
13. Ma J., Sloan M., Fox K.S., et al. Consumption of sugar-sweetened beverages is associated with the breakdown of abdominal fat in healthy adults. J Nutr. 2014; 144 (8): 1283–90. https://doi.org/10.3945/jn.113.188599.
14. Di Stefano J.K. Fructose-mediated effect on gene expression and epigenetic mechanisms associated with the pathogenesis of NAFLD. Cell Mol Life Sci. 2020; 77 (11): 2079–90. https://doi.org/10.1007/s00018-019-03390-0.
15. Vos M.B., Lavin J.E. Dietary fructose in non-alcoholic fatty liver disease. Hepatology. 2013; 57 (6): 2525–31. https://doi.org/10.1002/hep.26299.
16. Kanerva N., Sandboge S., Kaartinen N.E., et al. Higher consumption of fructose is inversely proportional to the risk of non-alcoholic Golic fatty liver disease in elderly Finns 1–4 years. Am J Clin Nutr. 2014; 100: 1133–41. https://doi.org/10.3945/ajcn.114.086074.
17. Ma J., Fox K.S., Jacques F., Speliotes E.K., et al. Sugar-sweetened beverage, diet soda, and fatty liver disease in the Framingham Heart Study cohorts. J Hepatol. 2015; 63 (2): 462–9. https://doi.org/10.1016/j.jhep.2015.03.032.
18. Шептулина А.Ф., Голубева Ю.А., Драпкина О.М. Фруктоза и ее влияние на обмен веществ и риск развития неалкогольной жировой болезни печени. Доказательная гастроэнтерология. 2023; 12 (1): 85–92. https://doi.org/10.17116/dokgastro20231201185.
19. Wu J., Yang T., Wang C., et al. Laennec protects murine from concavalin A-induced liver injury through inhibition of inflammamory reactions and hepatocyte apoptosis. Biol Pharm Bull. 2008; 31 (11): 2040–4. https://doi.org/10.1248/bpb.31.2040.
20. Jung J.C., Lee H.J., Lee J.M., et al. Placenta extract promote liverregeneration in CCI4-injured liver rat model. Int Immunopharmacol. 2011; 11 (8): 976–84. https://doi.org/10.1016/j.intimp.2011.02.012.
21. Yamauchi A., Kamiyoshi A., Koyama T., et al. Placental extract ameliorates non-alcoholic steatohepatitis (NASH) by exerting protective effects on endothelial cells. Heliyon. 2017; 3 (9): e00416. https://doi.org/10.1016/j.heliyon.2017.e00416.
Об авторах
Т. Е. БогачеваРоссия
Богачева Татьяна Евгеньевна - к.м.н., доцент. Scopus Author ID: 57188826213. eLibrary SPIN-code: 8970-6270.
Шереметевский пр-т, д. 8, Иваново 153012
О. А. Громова
Россия
Громова Ольга Алексеевна - д.м.н., проф. WoS ResearcherID: J-4946-2017. Scopus Author ID: 7003589812. eLibrary SPIN-code: 6317-9833.
Шереметевский пр-т, д. 8, Иваново 153012; ул. Вавилова, д. 44, корп. 2, Москва 119333
И. Ю. Торшин
Россия
Торшин Иван Юрьевич - к.ф-м.н., к.х.н. WoS ResearcherID: C-7683-2018. Scopus Author ID: 7003300274. eLibrary SPIN-code: 1375-1114.
Ул. Вавилова, д. 44, корп. 2, Москва 119333
В. И. Демидов
Россия
Демидов Вадим Игоревич - к.м.н., доцент. WoS ResearcherID: F-9158-2019. Scopus Author ID: 56806409700.
Шереметевский пр-т, д. 8, Иваново 153012
А. Г. Калачева
Россия
Калачева Алла Геннадьевна - к.м.н., доцент. Scopus Author ID: 55227267300. eLibrary SPIN-code: 4917-2391.
Шереметевский пр-т, д. 8, Иваново 153012
А. А. Гаранин
Россия
Гаранин Алексей Алексеевич
Шереметевский пр-т, д. 8, Иваново 153012
И. В. Гоголева
Россия
Гоголева Ирина Викторовна - к.м.н., доцент. Scopus Author ID: 35773149200. eLibrary SPIN-code: 6599-7955.
Шереметевский пр-т, д. 8, Иваново 153012
Л. Э. Федотова
Россия
Федотова Любовь Эдуардовна - к.м.н., доцент.
Шереметевский пр-т, д. 8, Иваново 153012
О. А. Лиманова
Россия
Лиманова Ольга Адольфовна, к.м.н., доцент.
Шереметевский пр-т, д. 8, Иваново 153012
А. Н. Мнацаканьян
Россия
Мнацаканьян Анна Никитична - к.ф.н., доцент.
Ул. 2-я Бауманская, д. 5, стр. 1, Москва 105005
Н. Ю. Жидоморов
Россия
идоморов Николай Юрьевич - к.м.н., доцент.
Шереметевский пр-т, д. 8, Иваново 153012
Т. Р. Гришина
Россия
Гришина Татьяна Романовна - д.м.н., проф.
Шереметевский пр-т, д. 8, Иваново 153012
Что уже известно об этой теме?
► Гидролизаты плаценты человека (ГПЧ) используют для лечения стеатогепатита (алкогольной, метаболической и смешанной этиологии)
► Результаты экспериментальных и клинических исследований показали эффективность применения ГПЧ для лечения жировой дистрофии печени при перегрузке железом
Что нового дает статья?
► Впервые изучено влияние ГПЧ на выведение железа из печени с одновременным препятствованием повреждению почек, головного мозга и миокарда в предлагаемой модели метаболически-ассоциированной жировой болезни печени (МАЖБП) с перегрузкой железом у крыс
► Охарактеризованы сложные изменения биомаркеров функций печени, почек, кроветворения, воспаления и тромбообразования, возникающие при воспроизведении модели
► Показаны эффективность и безопасность применения ГПЧ в терапии экспериментальной МАЖБП с перегрузкой железом
Как это может повлиять на клиническую практику в обозримом будущем?
► Стандартизированный ГПЧ – весьма перспективное направление поиска гепатопротекторов для лечения МАЖБП. Однако требуются дополнительные исследования в клинических уcловиях для подтверждения этих результатов
Рецензия
Для цитирования:
Богачева Т.Е., Громова О.А., Торшин И.Ю., Демидов В.И., Калачева А.Г., Гаранин А.А., Гоголева И.В., Федотова Л.Э., Лиманова О.А., Мнацаканьян А.Н., Жидоморов Н.Ю., Гришина Т.Р. Изучение эффективности гидролизата плаценты человека на новой модели метаболически-ассоциированной жировой болезни печени с перегрузкой железом. ФАРМАКОЭКОНОМИКА. Современная фармакоэкономика и фармакоэпидемиология. 2024;17(4):489-503. https://doi.org/10.17749/2070-4909/farmakoekonomika.2024.274
For citation:
Bogacheva T.E., Gromova O.A., Torshin I.Yu., Demidov V.I., Kalacheva A.G., Garanin A.A., Gogoleva I.V., Fedotova L.E., Limanova O.A., Mnatsakanyan А.N., Zhidomorov N.Yu., Grishina T.R. Study of the effect of human placenta hydrolysate in a new model of metabolic-associated fatty liver disease with iron overload. FARMAKOEKONOMIKA. Modern Pharmacoeconomics and Pharmacoepidemiology. 2024;17(4):489-503. (In Russ.) https://doi.org/10.17749/2070-4909/farmakoekonomika.2024.274

Контент доступен под лицензией Creative Commons Attribution-NonCommercial-ShareAlike 4.0 International License.






































