Перейти к:
Протеомный анализ синергетического нейропротекторного действия аденозина, тиамина, ниацина и цианокобаламина в патофизиологии диабетической полинейропатии
https://doi.org/10.17749/2070-4909/farmakoekonomika.2024.285
Аннотация
Актуальность. Нейротрансмиттер аденозин и витамины группы В характеризуются нейропротекторными, ремиелинизирующими и противонейровоспалительными свойствами. Несмотря на исследования этих молекул в течение десятилетий, молекулярные механизмы синергизма их влияния на процессы нейровоспаления не изучены и не систематизированы.
Цель: установление молекулярных механизмов синергизма аденозина, тиамина, ниацина и цианокобаламина в противодействии патологии диабетической полинейропатии (ДПН).
Материал и методы. Определение молекулярных механизмов действия аденозина, тиамина (витамин В1), ниацина (витамин РР) и цианокобаламина (витамин В12) в патофизиологии ДПН проведено посредством функционального анализа геномных и протеомных баз данных.
Результаты. В результате проведенного анализа из 20 180 аннотированных белков протеома человека выделено 504 витамин-РРзависимых, 22 витамин-В1-зависимых, 24 витамин-В12-зависимых и 50 аденозин-зависимых. Установлены белки протеома человека, активность или уровни которых важны для снижения нейровоспаления, ремиелинизации, нейрогенеза, биосинтеза нейронального аденозинтрифосфата, гомеостаза миелина, нейропластичности, обезвреживания гомоцистеина, регенерации нервных волокон и поддержки эндотелия микрососудистого русла.
Заключение. Установленные молекулярные механизмы синергизма изученных молекул имеют фундаментальное значение для понимания процессов регуляции нейровоспаления и ремиелинизации в целях профилактики ДПН и других нейродегенеративных заболеваний.
Ключевые слова
Для цитирования:
Громова О.А., Торшин И.Ю., Мойсеенок А.Г. Протеомный анализ синергетического нейропротекторного действия аденозина, тиамина, ниацина и цианокобаламина в патофизиологии диабетической полинейропатии. ФАРМАКОЭКОНОМИКА. Современная фармакоэкономика и фармакоэпидемиология. 2024;17(4):542-557. https://doi.org/10.17749/2070-4909/farmakoekonomika.2024.285
For citation:
Gromova O.A., Torshin I.Yu., Moiseenok A.G. Proteomic analysis of synergetic neuroprotective effect of adenosine, thiamine, niacin and cyanocobalamin in pathophysiology of diabetic polyneuropathy. FARMAKOEKONOMIKA. Modern Pharmacoeconomics and Pharmacoepidemiology. 2024;17(4):542-557. (In Russ.) https://doi.org/10.17749/2070-4909/farmakoekonomika.2024.285
ВВЕДЕНИЕ / INTRODUCTION
По эпидемическим данным, 537 млн людей в возрасте от 20 до 79 лет во всем мире страдают сахарным диабетом 2-го типа (СД2). Ожидается, что к 2030 г. число случаев СД2 увеличится до 643 млн [1]. Начало формирования сосудистых и нейродегенеративных осложнений при СД2 зависит от возраста, своевременности начала и адекватности подбора терапии (включая диетическую коррекцию и двигательный режим).
Диабетическая полинейропатия (ДПН) формируется вследствие диффузного повреждения морфологии периферических нервных волокон на фоне избыточного гликирования белков при СД2 [2]. Формирование ДПН утяжеляет риски СД2 (изъязвление стоп, инвалидизация [3], ретинопатия и нефропатия, летальность от всех причин [4]). В России ДПН отмечена у 50–70% больных СД2, а ДПН с болью, резко снижающая качество жизни пациентов, – у 16–30% [5][6].
Нейровоспаление и связанная с ним демиелинизация наблюдаются при широком спектре нейропатологий, включая ДПН. Старение шванновских клеток вследствие ферроптоза и воспаления приводит к потере миелина, нарушению аксональной функции, повышает уязвимость аксонов к гипоксическому или оксидантному повреждению, нейроаксональной дегенерации [7]. Поэтому медикаментозные способы лечения ДПН направлены на восстановление жизнедеятельности синтезирующих миелин шванновских клеток в условиях нейровоспаления, ферроптоза и нарушений полиолового пути обмена сахаров, тесно переплетенных друг с другом [8].
Как известно, шванновские клетки являются основными клетками глии периферической нервной системы, дисфункция которых связана с патофизиологией воспалительных и метаболических нейропатий [9]. При ДПН отмечается их повышенная гибель по полиоловому пути нейроапоптоза [10], по пути пироптоза, ферроптоза и некроптоза [11]. Изменения морфологии и функциональности митохондрий шванновских клеток ассоциируют с ферроптозом – формой апоптоза, характеризующейся перегрузкой клеток железом, истощением глутатиона с инактивацией глутатионпероксидазы 4 и накоплением липотоксичных метаболитов [12].
Нейровоспаление также представляет собой важнейший фактор патогенеза ДПН: длительная гипергликемия приводит к абнормальному гликированию и высвобождению провоспалительных цитокинов, которые стимулируют переход ДПН в болевую форму. Таким образом, противовоспалительное воздействие – неотъемлемый компонент терапии ДПН [13]. Механизмы развития ДПН представлены на рисунке 1 [5].

Рисунок 1. Механизмы развития диабетической нейропатии (адаптировано из [5]).
РФК – реактивные формы кислорода; РФА – реактивные формы азота; ДНК – дезоксирибонуклеиновая кислота; ЭР-стресс – стресс эндоплазматического ретикулума; ЛПНП – липопротеины низкой плотности; ЛПВП – липопротеины высокой плотности; СЖК – свободные жирные кислоты; Р13К (англ. рhosphatidylinositol 3-kinase) – фосфатидилинозитол-3-киназа; Akt – протеинкиназа B
Figure 1. Mechanisms of diabetic neuropathy development (аdapted from [5]).
ROS – reactive oxygen species; RNS – reactive nitrogen species; DNA – deoxyribonucleic acid; ER-stress – endoplasmic reticulum stress; LDLs – low-density lipoproteins; HDLs – high-density lipoprotein; FFAs – free fatty acids; Р13К – рhosphatidylinositol 3-kinase; Akt – protein kinase B
Перспективным направлением терапии ДПН является использование витаминов группы В в фармакологических дозировках. Витамины группы В и синергидные им соединения входят в состав многих неврологических препаратов. В частности, препарат Кокарнит® (Уорлд Медицин Илач Сан ве Тидж А.Ш., Турция), улучшающий метаболизм и регенерацию нервных волокон, относится к клинико-фармакологической подгруппе анатомо-терапевтическо-химической классификации A11EX Витамины группы B, в комбинации с другими препаратами. Он включает четыре основных компонента:
– производное аденозина трифосаденина динатрия тригидрат – 10 мг;
– тиамина пирофосфат (кофермент витамина В1 кокарбоксилаза) – 50 мг;
– цианокобаламин (витамин В12) – 0,5 мг;
– никотинамид (ниацин, витамин РР) – 20 мг.
В препарате также содержится аминокислота глицин (106 мг), которая может активировать глициновые рецепторы.
Несмотря на то что данная комбинация используется в медицине более 10 лет, механизмы ее молекулярного действия остаются практически не изученными. В то же время постгеномная перспектива системной биологии позволяет утверждать, что аденозин и витамины группы В оказывают воздействие на центральную нервную систему (ЦНС), активируя сотни ферментов протеома человека (рис. 2). В настоящей работе таргетные белки компонентов препарата Кокарнит® исследовались биоинформационным методом анализа функциональных взаимосвязей [14][15] на основе информации в постгеномных базах данных.

Рисунок 2. Постгеномная перспектива изучения молекулярных механизмов нейрофизиологического действия витаминов группы В и аденозина.
ДНК – дезоксирибонуклеиновая кислота; РНК – рибонуклеиновая кислота
Figure 2. Postgenomic perspective for investigating molecular mechanisms of B-group vitamins and adenosine neurophysiological action.
DNA – deoxyribonucleic acid; RNA – ribonucleic acid
Цель – установление молекулярных механизмов синергизма аденозина, тиамина, ниацина и цианокобаламина в противодействии патологии ДПН.
МАТЕРИАЛ И МЕТОДЫ / MATERIAL AND METHODS
Анализ выборок / Sample analysis
На основе информации, представленной в базах данных (БД) NCBI’s Protein1, EMBL2, UniProt3, HPM4, были получены выборки таргетных белков. Затем каждую из выборок анализировали посредством метода функционального связывания, включающего системно-биологическое рассмотрение свойств белков в контексте пирамиды биологических подсистем (органы, ткани, клетки, макромолекулярные и просто молекулярные компоненты клеток, данные о врожденных нуклеотидных дефектах генома и др.) (рис. 3) [16].

Рисунок 3. Основы системно-биологического подхода к анализу витамин-зависимых белков.
ДНК – дезоксирибонуклеиновая кислота; МКБ-10 – Международная классификация болезней 10-го пересмотра; OMIM (англ. Online Mendelian Inheritance in Man) – Менделевское наследование у человека; HGMD (англ. Human Gene Mutation Database) – База данных о мутациях генов человека; KEGG (англ. Kyoto Encyclopedia of Genes and Genomes) – Киотская энциклопедия генов и геномов; Swiss-Prot – швейцарская база данных о последовательностях белков; TrEMBL (англ. translated European Molecular Biology Laboratory database) – база данных, состоящая из записей в формате Swiss-Prot, которые получены на основе перевода всех кодирующих последовательностей в EMBL; GO (англ. Gene Ontology) – Генная онтология; ORPHA (англ. Orphanet nomenclature of rare diseases) – номенклатура редких заболеваний
Figure 3. Fundamentals of a systematic biological approach to the analysis of vitamin-dependent proteins.
DNA – deoxyribonucleic acid; ICD-10 – International Classification of Diseases, 10th Revision; OMIM – Online Mendelian Inheritance in Man; HGMD – Human Gene Mutation Database; KEGG – Kyoto Encyclopedia of Genes and Genomes; Swiss-Prot – Swiss database on protein sequences; TrEMBL (translated European Molecular Biology Laboratory database) – protein sequence database that contains all the translations of EMBL nucleotide sequences; GO – Gene Ontology; ORPHA – Orphanet nomenclature of rare diseases
Статистический анализ / Statistical analysis
На основании информации из перечисленных выше БД проводился подсчет числа белков, взаимодействующих с аденозином, тиамином, ниацином и цианокобаламином. Для статистической обработки материала использовали прикладную программу Statistica 10.0 (StatSoft Inc., США) и электронные таблицы Excel (Microsoft, США).
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ / RESULTS AND DISCUSSION
В результате проведенного анализа среди известных 50 168 белков протеома человека выделено 20 180 аннотированных белков протеома, из них: 504 витамин-РР-зависимых, 22 витамин-В1-зависимых, 24 витамин-В12-зависимых и 50 аденозин-зависимых.
Белки протеома, участвующие во взаимодействии
изученных молекул / Proteome proteins involved in the interaction of the studied molecules
Белки протеома, участвующие в реализации синергидных взаимодействий аденозина и витаминов В1, РР, В12, могут быть сгруппированы в четыре основные рубрики (рис. 4):
– торможение ферроптоза, нейровоспаления и поддержка выживания нервных клеток при гипоксии/воспалении;
– поддержка структуры нейронов при ишемии/гипоксии;
– поддержка нейротрансмиссии при гипоксии/воспалении;
– поддержка нейролипидного гомеостаза при атеросклерозе / нарушении микроциркуляции.
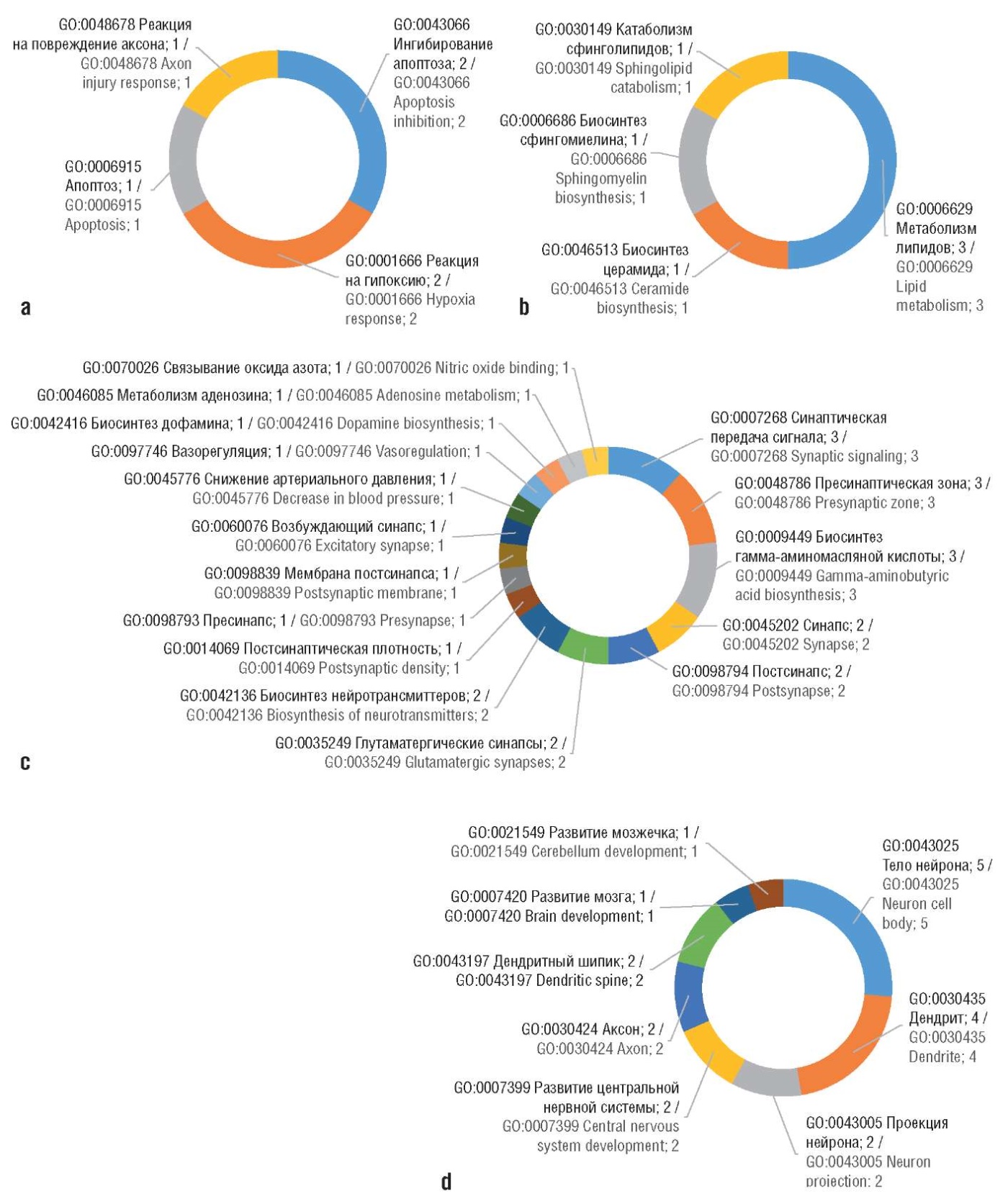
Рисунок 4. Таргетные белки протеома, ответственные за синергизм молекулярно-биологических эффектов квадрокомбинации «аденозин + тиамин + никотинамид + цианокобаламин» при лечении диабетической полинейропатии (биологические роли таргетных белков приведены в соответствии с международной номенклатурой Gene Ontology (GO), указано количество белков, у которых выявлены неврологические роли):
а – торможение апоптоза и ферроптоза нейронов; b – поддержка нейролипидов мембраны нейронов; c – регуляция нейротрансмиссии; d – регенерация структуры нейронов.
Figure 4. Target proteome proteins responsible for synergism of molecular biological effects of the quadruple combination “adenosine + thiamine + nicotinamide + cyanocobalamin” in the treatment of diabetic polyneuropathy (biological roles of target proteins are given in accordance with the international Gene Ontology (GO) nomenclature; the numbers of proteins with identified neurological roles are indicated):
а – inhibition of neuron apoptosis and ferroptosis; b – maintaining of neuronal membrane neurolipids; c – neurotransmission regulation; d – neuronal structure regeneration
С белками ингибирования апоптоза (GO:0043066 Ингибирование апоптоза) при ишемии мозга связаны такие биологические процессы, как поддержка нейронов в условиях гипоксии (GO:0001666 Реакция на гипоксию) и реакции на повреждение аксона (травма, ишемия, воспаление) (GO:0048678 Реакция на повреждение аксона). Метаболизм нейролипидов включает поддержку обмена церамида и сфинголипидов миелина (GO:0046513 Биосинтез церамида, GO:0006686 Биосинтез сфингомиелина, GO:0030149 Катаболизм сфинголипидов).
Аденозин-зависимые и витамин-В1/РР/12-зависимые белки, вовлеченные в нейротрансмиссию, включают белки поддержки структуры и функции синапсов (GO:0007268 Синаптическая передача сигнала, GO:0048786 Пресинаптическая зона, GO:0045202 Синапс, GO:0098794 Постсинапс, GO:0035249 Глутаматергические синапсы, GO:0014069 Постсинаптическая плотность, GO:0098793 Пресинапс) и биосинтеза нейротрансмиттеров (GO:0009449 Биосинтез гамма-аминомасляной кислоты, GO:0042136 Биосинтез нейротрансмиттеров, GO:0042416 Биосинтез дофамина, GO:0046085 Метаболизм аденозина) и белков, связанных с оксидом азота (GO:0070026 Связывание оксида азота, GO:0045776 Снижение артериального давления, GO:0097746 Вазорегуляция).
Белки, участвующие в поддержке структуры нейронов (в т.ч. шванновских клеток) принципиально необходимы для сохранения различных структур нейрона (GO:0043025 Тело нейрона, GO:0030425 Дендрит, GO:0043005 Проекция нейрона, GO:0030424 Аксон) и для развития/репарации ЦНС (GO:0043197 Дендритный шипик, GO:0007399 Развитие ЦНС, GO:0007420 Нейрорегенерация).
В целом проведенный анализ выявил конкретные таргетные белки, посредством которых аденозин участвует в нейрогенезе и нейропротекции, витамин В1 – в биосинтезе нейронального аденозинтрифосфата (АТФ) и поддержании структуры нейронов, витамин РР – в снижении нейровоспаления, гомеостазе миелина, нейронального синтеза АТФ, нейропластичности и аутофагии (внутриклеточной переработки дисфункциональных белков), а витамин В12 – в обезвреживании гомоцистеина, поддержке миелина и в нейропротекции. Рассмотрим эти результаты подробнее.
Аденозин
Аденозин – нуклеозид, состоящий из аденина, соединенного с молекулой сахарида (рибозой), который входит в состав АТФ, циклического аденозинмонофосфата (цАМФ), дезоксирибонуклеиновой кислоты (ДНК), рибонуклеиновой кислоты (РНК) и является сигнальной молекулой с тормозящими нейротрансмиттерными свойствами, что снижает судорожную активность периферических нервных волокон. Концентрация аденозина в крови увеличивается во время продолжительного бодрствования организма и уменьшается во время сна [17]. Анализ показал наличие в протеоме человека не менее 10 белков, нейроактивность которых может зависеть от поступления экзогенного аденозина (табл. 1).
Таблица 1. Неврологические роли аденозин-зависимых белков
Table 1. Neurological roles of adenosine-dependent proteins
|
Белок / Protein |
Ген / Gene |
Функция белка / Protein function |
Кофактор / Cofactor |
|
Тиаминмонофосфатаза / Thiamine monophosphatase |
ACP3 |
Дефосфорилирование белков протеома, регуляция первичных сенсорных нейронов, биосинтез аденозина / Dephosphorylation of proteome proteins, regulation of primary sensory neurons, adenosine biosynthesis |
– |
|
Цистатионин-бета-синтаза / Cystathionine beta synthase |
CBS |
Переработка L-метионина и L-гомоцистеина, цитопротекция при выработке сероводорода / Processing of L-methionine and L-homocysteine, cytoprotection during hydrogen sulfide production |
П5Ф / P5P |
|
Рецептор глутамата GluR-2, селективный AMPA / Glutamate receptor GluR-2, selective AMPA |
GRIA2 |
Ионотропный рецептор глутамата, профилактика демиелинизации и судорог / Ionotropic glutamate receptor, prevention of demyelination and seizures |
– |
|
Аденозиновый рецептор A1 / Adenosine receptor A1 |
ADORA1 |
Микроциркуляция, защита от ишемии, высвобождение глутамата и дофамина / Microcirculation, protection from ischemia, release of glutamate and dopamine |
– |
|
Аденозиновый рецептор A2А / Adenosine receptor A2A |
ADORA2A |
Микроциркуляция, противовоспалительное действие, высвобождение глутамата и дофамина / Microcirculation, anti-inflammatory action, release of glutamate and dopamine |
– |
|
Аденозиновый рецептор А2В / Adenosine receptor A2B |
ADORA2B |
Противовоспалительное действие, иммунитет / Anti-inflammatory action, immunity |
– |
|
Аденозиновый рецептор A3 / Adenosine receptor A3 |
ADORA3 |
Противовоспалительное действие, иммунитет / Anti-inflammatory action, immunity |
– |
|
Рецептор стимулятора секреции гормона роста типа 1 (рецептор грелина) / Growth hormone secretagogue receptor type 1 (ghrelin receptor) |
GHSR |
Опосредование эффектов пептида, высвобождающего гормон роста, мет-энкефалина и аденозина / Mediating the effects of growth hormone-releasing peptide, met-enkephalin and adenosine |
П5Ф / P5P |
|
Фосфатидилэтаноламин N-метилтрансфераза / Phosphatidylethanolamine N-methyltransferase |
PEMT |
Биосинтез фосфатидилхолина, холина, ацетилхолина / Biosynthesis of phosphatidylcholine, choline, acetylcholine |
– |
|
N6-аденозинметилтрансфераза / N6-adenosine methyltransferaseа |
METTL3 |
Метилирование остатков аденозина в РНК путем регулирования нейрогенеза и выживания нейронов / Methylation of adenosine residues in RNA by regulating neurogenesis and neuronal survival |
– |
Примечание. П5Ф – пиридоксаль-5’-фосфат; AMPA (англ. alpha-amino-3-hydroxy-5-methyl-4-isoxazolepropionic acid) – альфа-амино-3-гидрокси-5-метил-4-изоксазолпропионовая кислота; РНК – рибонуклеиновая кислота.
Note. P5P – pyridoxal-5’-phosphate; AMPA – alpha-amino-3-hydroxy-5-methyl-4-isoxazolepropionic acid; RNA – ribonucleic acid.
Основной группой белков, реализующих нейропротекцию и регулирующих нейровоспаление, противовоспалительные эффекты аденозина, являются рецепторы аденозина. Они широко известны своими антагонистами кофеином, теофиллином и теобромином, действие которых на рецепторы вызывает стимулирующие эффекты кофе, чая и шоколада. Рецепторы А1 и А2А регулируют потребление кислорода миокардом и коронарный кровоток, рецептор А2А также оказывает противовоспалительное действие. Рецепторы A1 и A2A ответственны за высвобождение глутамата и дофамина, рецепторы A2B и A3 участвуют в воспалении и иммунитете [18].
Активность аденозинового рецептора A1 (ген ADORA1) опосредуется G-белками, которые ингибируют аденилатциклазу. Активация ADORA1 на фоне гипоксии стимулирует синаптическое торможение посредством активируемых митогеном протеинкиназ (англ. mitogen-activated protein kinase, МАРК) и транскрипционного фактора C-Jun N-концевая киназа (англ. C-Jun N-terminal kinase, JNK) [19].
Аденозиновый рецептор A3 (ген ADORA3) участвует в ингибировании дегрануляции нейтрофилов, что связано с торможением нейровоспаления и нейропротекцией [20]. В модели ишемии миокарда у мышей селективный агонист рецептора A3 защищал животных от гипоксии и ишемического повреждения тканей [21].
Биологические роли аденозина также реализуются посредством рецептора стимулятора секреции гормона роста, или рецептора грелина (ген GHSR). Рецептор грелина (кофактором которого является пиридоксаль 5’-фосфат) опосредует эффекты пептида, высвобождающего гормон роста, мет-энкефалина и непептидного стимулятора секреции белков – аденозина [22]. Активация рецептора GHSR защищает от нейротоксичности, вызванной 6PPD-хиноном у крыс [23].
Аденозин-зависимые сигнальные каскады необходимы для реализации активности AMPA рецептора GluR-2 (ген GRIA2) – ионотропного рецептора глутамата [24]. L-глутамат действует как возбуждающий нейротрансмиттер во многих синапсах ЦНС и играет важную роль в возбуждающей синаптической передаче [25]. Дефицит GluR-2 приводит к нарушению нейроразвития, гиперактивности, демиелинизации и судорогам [24]. В эксперименте у крыс аденозин-связанные сигнальные каскады модулируют активность рецепторов глутамата GluR-2 при гипоксическом повреждении нервной ткани [26].
Аденозин также необходим для биосинтеза S-аденозилметионина – субстрата реакций метилирования, в т.ч. поддерживаемых посредством ферментов цистатионин-бета-синтазы, фосфатидил-этаноламин-N-метилтрансферазы, N6-аденозин-метилтрансферазы. Метилирование белков и ДНК – важнейший компонент эпигенетической регуляции клетки, без которого выживание нейронов невозможно. В частности, нарушения метилирования в шванновских клетках приводят к их ускоренному старению и гибели.
Цистатионин-бета-синтаза (ген CBS) катализирует первый этап транссульфурации, в котором гидроксильная группа L-серина замещается L-гомоцистеином с образованием L-цистатионина, предшественника L-цистеина (кофактор пиридоксаль-5’-фосфат). Этот катаболический путь позволяет устранить L-метионин и токсичный метаболит L-гомоцистеин [27] и участвует в цитопротекторном действии на нейроны [28]. Метаболиты гомоцистеина подавляют аутофагию, повышают уровень бета-амилоида и вызывают нейропатию, нарушая эпигенетическую регуляцию гена mTOR у мышей с дефицитом активности фермента [29]. S-аденозилметионин, активируя фермент CBS, способствует выработке сероводорода, проявляющего нейропротекторные и нейротрофические свойства при ишемии мозга [30]. На модели паркинсонизма у крыс повышение экспрессии гена CBS соответствовало нейропротекторному действию [31].
Фосфатидилэтаноламин-N-метилтрансфераза (ген PEMT) участвует в биосинтезе фосфатидилхолина (критически необходимого компонента структуры нейрональной мембраны [32]), обмене адреналина, биосинтезе холина, из которого синтезируется нейротрансмиттер ацетилхолин [33]. Данный фермент использует S-аденозилметионин в качестве донора метильной группы.
N6-аденозинметилтрансфераза (ген METTL3) не только метилирует остатки аденозина в положении N(6) последовательностей РНК, но и регулирует циркадный ритм, дифференцировку нейронов, кортикальный нейрогенез и ответ нейронов на повреждение геномной ДНК [34]. Используя S-аденозилметионин как источник метиловых групп, метилтрансфераза метилирует остатки аденозина в матричной РНК (мРНК). Фермент действует как ключевой регулятор стабильности мРНК [35], регулируя нейрогенез посредством метилирования тех мРНК, что связаны с факторами транскрипции, нейральными стволовыми клетками и дифференцировкой нейронов. Метилтрансфераза METTL3 регулирует нейропатическую боль посредством модификации метилирования мРНК гена SOCS1 [36]. Истощение METTL3 в холинергических нейронах вызывает нервно-мышечную дегенерацию [37]. METTL3 снижает нейровоспаление нейронов через ось MALAT1/SFRP2/Wnt/бета-катенин [38]. Исследования in vivo и in vitro показали, что ингибирование белка аннексин-А2 при участии METTL3 обеспечивает нейропротекцию при ишемическом повреждении нервной ткани [39].
Тиамин
Молекулярные механизмы реализации биологических функций тиамина включают:
– биосинтез АТФ;
– переработку жиров, белков и углеводов;
– нейрофизиологические эффекты, заключающиеся в поддержании структуры миелина, функций аденозина, развитии коры;
– гемопоэз.
Нейрофизиологические роли тиамин-зависимых белков представлены в таблице 2. Во многом они обусловлены поддержкой ферментов энергетического метаболизма (и, следовательно, выживания) нейронов: пируватдегидрогеназы E1 (ген PDHA1, катализирует превращение пирувата в ацетил-кофермент А [40]) и 2-оксоизовалератдегидрогеназы (ген BCKDHA, катализирует декарбоксилирование альфа-кетокислот).
Таблица 2. Неврологические роли витамин-В1-зависимых белков
Table 2. Neurological roles of vitamin B1-dependent proteins
|
Белок / Protein |
Ген / Gene |
Функция белка / Protein function |
Кофактор / Cofactor |
|
E1-альфа-субъединица пируватдегидрогеназы / E1 alpha subunit of pyruvate dehydrogenase |
PDHA1 |
Связь гликолиза и цикла Кребса, выживание нейронов при ишемии / The relationship between glycolysis and the Krebs cycle, neuronal survival during ischemia |
ТДФ / TDP |
|
Субъединица альфа-2-оксоизовалератдегидрогеназы / Subunit of alpha-2-oxoisovalerate dehydrogenase |
BCKDHA |
Биосинтез ацетил-кофермента А из альфа-кетокислот, выживание нейронов при ишемии / Biosynthesis of acetyl-coenzyme A from alpha-keto acids, neuronal survival during ischemia |
ТДФ / TDP |
|
Транскетолаза-2 / Transketolase-2 |
TKTL1 |
Перенос кетоловой группы от донора кетозы к акцептору альдозы, развитие мозга, поддержание глии / Transfer of a ketol group from a ketose donor to an aldose acceptor, brain development, glia maintenance |
ТДФ, Mg²⁺ / TDP, Mg²⁺ |
|
2-оксоглутаратдегидрогеназа / 2-oxoglutarate dehydrogenase |
OGDHL |
Цикл Кребса, метаболизм митохондрий, выживание нейронов / Krebs cycle, mitochondrial metabolism, neuronal survival |
ТДФ / TDP |
Примечание. ТДФ – тиаминдифосфат.
Note. TDP – thiamine diphosphate.
Варианты гена PDHA1 связаны с наследственными периферическими нейропатиями [41]. Дефицит 2-оксоизовалератдегидрогеназы в нейронах коры головного мозга снижает энергетические [42] и регенераторные [43] функции нервной ткани. Инактивация фермента 2-оксоизовалератдегидрогеназы фосфорилированием приводит к повышению уровня аминокислот с разветвленной цепью после ишемического повреждения ЦНС [44].
Транскетолаза (ген TKTL1) катализирует перенос двухуглеродной кетоловой группы от донора кетозы к акцептору альдозы через ковалентное промежуточное соединение с кофактором тиаминпирофосфатом [45]. Активность транскетолазы необходима для сохранения пула клеток-предшественников глии и нейронов [46], поэтому снижение активности фермента (например, вследствие нуклеотидных дефектов гена TKTL1) стимулирует развитие нейродегенерации и инсулинорезистентности [47].
2-оксоглутаратдегидрогеназа (ген OGDHL), участвующая в цикле трикарбоновых кислот (цитратном цикле, цикле Кребса), опосредует декарбоксилирование альфа-кетоглутарата, одновременно восстанавливая никотинамидадениндинуклеотид (НАД+) до НАДН (восстановленный НАД) и участвуя в делении и выживании клеток [48]. Мутации в гене OGDHL вызывают широкий спектр неврологических фенотипов, в т.ч. эпилепсию, повышенную судорожную готовность, нарушения слуха и зрения, атаксию [49].
Ниацин
Никотинамид (ниацин) – витамин РР, на основе которого происходит биосинтез НАД, важнейшего кофактора белков энергетического метаболизма. Он проявляет антигиперлипидемические эффекты и способствует улучшению микроциркуляции крови. Важнейшие исследовательские направления фармакологии никотинамида могут быть сгруппированы в пять кластеров [50]:
– атеросклероз, дисфункция печени, нейровоспаление;
– энергетический и биосинтетический метаболизм;
– нарушения функции лейкоцитов;
– неврологические роли;
– функция тучных клеток.
Неврологические роли витамин-РР-зависимых белков суммированы в таблице 3. Рецептор ниацина 1 (ген HCAR2), опосредует повышенную секрецию адипонектина и сниженный липолиз посредством ингибирования аденилатциклаз через G(i)-белок. Активация рецептора приводит к снижению уровня цАМФ, что регулирует активность цАМФ-зависимой протеинкиназы А, фосфорилирование целевых белков и приводит к гибели нейтрофилов, тем самым уменьшая нейровоспаление [51] (рис. 5). Опосредованные рецептором действия никотинамида включают поддержку иммунитета, гомеостаз миелина и бета-амилоида, отток холестерина из клеток. Активация рецепторов HCAR2 молекулами ниацина – перспективное направление терапии рассеянного склероза, болезни Альцгеймера, болезни Паркинсона, бокового амиотрофического склероза [52].
Таблица 3. Неврологические роли витамин-РР-зависимых белков
Table 3. Neurological roles of vitamin PP-dependent proteins
|
Белок / Protein |
Ген / Gene |
Функция белка / Protein function |
Кофактор / Cofactor |
|
Рецептор ниацина 1 / Niacin receptor 1 |
HCAR2 |
Снижение воспаления, поддержка иммунитета, гомеостаз миелина и бета-амилоида / Reduced inflammation, immune support, myelin and beta-amyloid homeostasis |
Ниацин / Niacin |
|
Никотинамид мононуклеотид аденозилтрансфераза / Nicotinamide mononucleotide adenosyltransferase |
NMNAT2 |
Фактор выживания аксонов, синтез белка в нейронах / Axon survival factor, protein synthesis in neurons |
НАД, Mg²⁺ / NAD, Mg²⁺ |
|
Глюкозо-6-фосфат-1-дегидрогеназа / Glucose-6-phosphate-1-dehydrogenase |
G6PD |
Биосинтез миелина, снижение нейропатической боли / Myelin biosynthesis, reduction of neuropathic pain |
НАД / NAD |
|
L-лактатдегидрогеназа / L-lactate dehydrogenase |
LDHAL6A |
Фермент гликолитического пути, выживание нейронов, эндотелиальная функция сосудов / Glycolytic pathway enzyme, neuronal survival, vascular endothelial function |
НАД+ / NAD+ |
|
НАД-зависимая протеиндеацетилаза сиртуин-1 / NAD-dependent protein deacetylase sirtuin-1 |
SIRT1 |
Деацетилирование белков энергетического метаболизма, аутофагии, уменьшение нейровоспаления, ремонт ДНК, биологические эффекты нейротрансмиттеров, антиоксидантная защита / Deacetylation of energy metabolism proteins, autophagy, reduction of neuroinflammation, DNA repair, biological effects of neurotransmitters, antioxidant protection |
НАД, Zn²⁺ / NAD, Zn²⁺ |
|
Серин/треонин-протеинкиназа 2, богатая лейцином (дардарин) / Serine/threonine protein kinase 2, leucine-rich (dardarin) |
LRRK2 |
Нейрональная пластичность, аутофагия, транспорт нейротрансмиттеров / Neuronal plasticity, autophagy, neurotransmitter transport |
НАД, Mg²⁺ / NAD, Mg²⁺ |
Примечание. НАД – никотинамидадениндинуклеотид; ДНК – дезоксирибонуклеиновая кислота.
Note. NAD – nicotinamide adenine dinucleotide; DNA – deoxyribonucleic acid.

Рисунок 5. Участие ниацина 1 в липолизе и регуляции нейровоспаления (адаптировано из [51]).
АТФ – аденозинтрифосфат; цАМФ – циклический аденозинмонофосфат; HCAR2 (англ. hydroxycarboxylic acid receptor 2) – рецептор гидроксикарбоновой кислоты 2; NF-κB (англ. nuclear factor kappa B) – ядерный фактор каппа В; PLC (англ. phospholipase C) – фосфолипаза C; IP3 (англ. inositol triphosphate) – инозитолтрифосфат
Figure 5. Involvement of niacin receptor 1 in lipolysis and regulation of neuroinflammation (аdapted from [51]).
ATP – adenosine triphosphate; cAMP – cyclic adenosine monophosphate; HCAR2 – hydroxycarboxylic acid receptor 2; NF-κB – nuclear factor kappa B; PLC – phospholipase C; IP3 – inositol triphosphate
Никотинамид мононуклеотид аденозилтрансфераза (ген NMNAT2) – фактор выживания аксонов, действующий путем задержки валлеровой дегенерации аксонов, вызванной дефицитом кофактора НАД. Напомним, что валлеровой дегенерацией нейрона называется деструкция аксона, целостность которого была нарушена при травме нерва. Регенерация аксона происходит вдоль шванновских клеток, которые активно делятся в месте повреждения нерва. Фермент NMNAT2 катализирует образование НАД+ из никотинамидмононуклеотида и АТФ и действует как активатор АДФ-рибозилирования, поддерживая каталитическую активность PARP16, способствуя моно-АДФ-рибозилированию рибосом PARP16 [53] и тем самым регулируя рибосомальный синтез белков в нейронах и шванновских клетках [54].
Глюкозо-6-фосфат-1-дегидрогеназа (ген G6PD) обеспечивает биосинтез НАДФН в нейронах [55]. Снижение активности глюкозо-6-фосфатдегидрогеназы нарушает биосинтез миелина и способствует диабетической нейропатической боли посредством активации провоспалительных толл-рецепторов TLR4 [56].
L-лактатдегидрогеназа (ген LDHAL6A) – фермент гликолитического пути, который катализирует взаимопревращение L-лактата и пирувата при участии кофактора НАД+, что важно для выживания нейронов. Лактатдегидрогеназа значительно увеличивает активность транскрипционного фактора JUN [57], тем самым поддерживая эндотелиальную функцию микрососудистого русла.
НАД-зависимая протеиндеацетилаза сиртуин-1 (ген SIRT1) связывает транскрипционную регуляцию с внутриклеточным биосинтезом АТФ и участвует в координации цикла деления клетки, ответа на повреждение ДНК, улучшает энергетический метаболизм и стимулирует аутофагию [58], способствует репарации разрывов ДНК [59]. Сиртуин-1 модулирует функцию хроматина геномной ДНК посредством деацетилирования белков «наматывания» ДНК (гистонов), приводя к репрессии транскрипции генов через изменения в метилировании гистонов и ДНК [60]. Сиртуин-1 служит «датчиком» цитозольного соотношения НАД+/НАДН, которое является важным биомаркером энергетического статуса нейронов. При дефиците глюкозы в клетке (например, при ишемии) повышение соотношения НАД+/НАДФ+ активирует SIRT1. Это приводит к деацетилированию гистона H3, ускоряет обновление гетерохроматина, что коррелирует с повышением геномной целостности в условиях клеточного стресса [61]. Также сиртуин-1 деацетилирует димер p65(RelA) ядерного фактора каппа-B, тем самым уменьшая нейровоспаление [62].
Сиртуин-1 деацетилирует протеинкиназу А (AKT1), это приводит к усилению связывания AKT1 и PDK1 с PIP35 и способствует их активации, что соответствует повышению выживаемости нейронов [63]. Сиртуин-1 необходим для активации сигнального каскада инозитолфосфатов PI3K6, участвующего в опосредовании биологических эффектов практически всех нейротрансмиттеров [64].
Ниацин-зависимый сиртуин-1 модулирует сигнальные пути, участвующие в аутофагии, антиоксидантной защите, митохондриальной функции, нарушения активности которых имеют решающее значение в патогенезе нейродегенеративных заболеваний. Активаторы сиртуина-1 (например, ресвератрол) снижают окислительный стресс, усиливают аутофагию дисфункциональных белков, содействуют выживанию нейронов. Поэтому повышение активности сиртуина-1, в т.ч. посредством НАД как кофактора, –перспективная терапевтическая стратегия лечения нейродегенеративных заболеваний [65].
Серин/треонин-протеинкиназа 2, богатая лейцином (дардарин, ген LRRK2), фосфорилирует широкий спектр белков, участвующих в нейрональной пластичности, аутофагии дисфункциональных белков [66] и везикулярном транспорте нейротрансмиттеров внутри синапсов различных типов [67]. Она активирует аутофагию посредством кальций-зависимой активации сигнального пути CaMKK/AMPK7, причем данный процесс с необходимостью включает активацию рецепторов HCAR2 посредством НАД [68].
Цианокобаламин
Дефицит витамина В12 может провоцироваться приемом метформина, широко используемого в терапии СД2. Поэтому низкие концентрации витамина В12 типично сопровождают СД2 и ДПН [69], стимулируя прогрессию нейропатии. Системно-биологический анализ кобаламина в контексте протеома человека указал на следующие механизмы его действия (рис. 6):
– метаболизм жиров и холестерина;
– гемопоэз (дифференцировка клеток-предшественников);
– нейропротекторный и нейротрофический эффекты.

Рисунок 6. Аннотации В12-зависимых белков протеома человека в базе данных Reactome
Figure 6. Annotations for B12-dependent proteins of human proteome in the Reactome database
Неврологические роли витамин-В12-зависимых белков протеома человека представлены в таблице 4. Метионинсинтаза (ген MTR, кофакторы метилкобаламин и Zn²⁺) катализирует перенос метильной группы от метилкобаламина (MeCbl) к гомоцистеину, что приводит к образованию ферментативно-связанного кобаламина и метионина в цитозоле. MeCbl – активная форма витамина B12, используемая в качестве кофактора для биосинтеза метионина. При этом кобаламин трансформируется в MeCbl путем переноса метильной группы от молекулы 5-метилтетрагидрофолата [70]. Дефицит активности нейрональной метионинсинтазы связан с глутаматергической дисфункцией, когнитивными нарушениями [71] и нарушениями функции зрения.
Таблица 4. Неврологические роли витамин-В12-зависимых белков протеома человека
Table 4. Neurological roles of vitamin B12-dependent proteins in human proteome
|
Белок / Protein |
Ген / Gene |
Функция белка / Protein function |
Кофактор / Cofactor |
|
Метионинсинтаза / Methionine synthase |
MTR |
Перенос метильной группы от метилкобаламина к гомоцистеину, глутаматергическая нейротрансмиссия, зрение, развитие ЦНС / Transfer of a methyl group from methylcobalamin to homocysteine, glutamatergic neurotransmission, vision, CNS development |
Метилкобаламин, Zn²⁺ / Methylcobalamin, Zn²⁺ |
|
Метилмалонил-КоА-мутаза, митохондриальная / Methylmalonyl-CoA mutase, mitochondrial |
MMUT MUT |
Биосинтез метилмалонил-КоА в метаболизме аминокислот с разветвленной цепью и жирных кислот / Methylmalonyl-CoA biosynthesis in branched chain amino acids and fatty acids metabolism |
Аденозилкобаламин / Adenosylcobalamin |
|
Метионинсинтаза редуктаза (аквакобаламинредуктаза) / Methionine synthase reductase (aquacobalamin reductase) |
MTRR |
Гомеостаз метионина и фолата, метаболизм холина / Methionine and folate homeostasis, choline metabolism |
ФАД, ФМН / FAD, FMN |
|
Цианокобаламинредуктаза / Cyanocobalamin reductase |
MMACHC |
Восстановительное децианирование цианокобаламина / Reductive decyanation of cyanocobalamin |
ФАД, ФМН, НАДФ-Н / FAD, FMN, NADPH |
|
Митохондриальный рецептор бензодиазепинов / Mitochondrial benzodiazepine receptor |
TSPO |
Транспорт гема и холестерина через митохондриальные мембраны, обмен липидов, выживание нейронов / Transport of heme and cholesterol across mitochondrial membranes, lipid metabolism, neuronal survival |
ТДФ, П5Ф, цианокобаламин / TDP, P5P, cyanocobalamin |
|
Кальциевый канал N-типа A1B (Cav2.2) / N-type calcium channel A1B (Cav2.2) |
CACNA1B |
Кальциевый канал, участвующий в ноцицепции, миграции нейронов, синаптической передаче сигналов, сокращении мышц, высвобождении нейромедиаторов, регуляции секреции глутамата / Calcium channel involved in nociception, neuronal migration, synaptic signaling, muscle contraction, neurotransmitter release, regulation of glutamate secretion |
ФАД, цианокобаламин / FAD, cyanocobalamin |
Примечание. КоА – кофермент А; ЦНС – центральная нервная система; ФАД – флавинаденин динуклеотид; ФМН – флавин мононуклеотид; НАДФ-Н – никотинамидаденин динуклеотид фосфат, восстановленная форма; ТДФ – тиаминдифосфат; П5Ф – пиридоксаль-5’-фосфат.
Note. CoA – coenzyme A; CNS – central nervous system; FAD – flavin adenine dinucleotide; FMN – flavin mononucleotide; NADPH – nicotinamide adenine dinucleotide phosphate, reduced; TDP – thiamine diphosphate; P5P – pyridoxal-5’-phosphate.
Фермент метилмалонил-КоА-мутаза (ген MMUT), кофактором которого является аденозилкобаламин, необходим для переработки аминокислот с разветвленной цепью, жирных кислот с нечетной длиной углеродной цепи и при биотрансформации холестерина в сукцинил-КоА в цикле Кребса [72]. Метионинсинтаза редуктаза (аквакобаламинредуктаза) (ген MTRR), кофакторами которой являются флавинаденин динуклеотид (ФАД) и флавин мононуклеотид (ФМН), стимулирует активность метионинсинтазы [73]. Модель дефицита метионинсинтазы редуктазы у мышей демонстрирует расстройство памяти и хронические нарушения метаболизма холина в мозге [74]. Поглощение и реактивация кобаламина происходят посредством специфических белковых взаимодействий в комплексе «метионинсинтаза – метионинсинтаза редуктаза» [75].
Цианокобаламинредуктаза (ген MMACHC) катализирует восстановительное децианирование цианокобаламина с образованием кобаламина и цианида, используя ФАД и ФМН в качестве кофакторов и НАДФН в качестве косубстрата [76]. Цианокобаламин преобразуется в активные кофакторы метилкобаламин и 5’-дезоксиаденозилкобаламин, связанные с поддержкой активности цикла Кребса [77].
Митохондриальный рецептор бензодиазепинов (ген TSPO) необходим для биосинтеза нейропротекторных и нейротрофических нейростероидов [78], торможения ноцицепции [79]. При дефиците витамина В1 формируется нарушение окислительного метаболизма, приводящее к гибели митохондрий и нейронов, и снижается активность бензодиазепиновых рецепторов [80]. Ранний дефицит доноров метила (возникающий на фоне дефицита В12, фолатов и витамина В6) изменяет сигнальный путь цАМФ и нейростероидогенез [81].
Ca-канал Cav2.2 (ген CACNA1B) необходим для модуляции процессов восприятия боли, функции синапсов, высвобождения нейромедиаторов и выживания нейронов [82]. Цианокобаламин ингибирует экспрессию глутамата, снижая приток ионов кальция через Cav2.2-каналы [83].
Комплекс механизмов действия изученных молекул / Сomplex of mechanisms of action of the studied molecules
ДПН, особенно ее болевая форма, зачастую сопровождается нейровоспалением и демиелинизацией вследствие глубокого нарушения обмена аденозина и дефицита никотинамида, тиамина и цианокобаламина, приводит к нарушениям активности таргетных белков протеома нервного волокна и микрососудистого русла. В результате резко падает продукция АТФ в нейронах и глии (в т.ч. в шванновских клетках), формируются эндотелиопатия, нейровоспаление, старение нервного волокна.
Представленные результаты анализа белков протеома по отношению к витаминам В1, РР, В12 и аденозину (компонентам препарата Кокарнит®), которые снижают нейровоспаление, улучшают метаболизм и регенерацию нервных волокон периферической нервной системы, позволили детально описать комплекс молекулярных механизмов действия препарата при ДПН и других нейродегенеративных патологиях (рис. 7).

Рисунок 7. Молекулярный синергизм аденозина, витаминов В1, РР, В12 в контексте лечения полинейропатии.
PEMT (англ. phosphatidylethanolamine N-methyltransferase) – фосфатидилэтаноламин N-метилтрансфераза; TKTL1 (англ. transketolase-like-1) – транскетолазоподобный-1; HCAR2 (англ. hydroxycarboxylic acid receptor 2) – рецептор гидроксикарбоновой кислоты 2; G6PD (англ. glucose-6-phosphate dehydrogenase) – глюкозо-6-фосфатдегидрогеназа; SIRT1 (англ. sirtuin 1) – сиртуин-1; ADORA1/A2/A3 (англ. adenosine A1/A2/A3 receptor) – рецептор аденозина A1/A2/A3; ACP3 (англ. acid phosphatase 3) – кислая фосфатаза 3; METTL3 (англ. methyltransferase-like protein 3) – белок, подобный метилтрансферазе 3; TSPO (англ. translocator protein) – белок-транслокатор; GHSR (англ. growth hormone secretagogue receptor) – рецептор, стимулирующий секрецию гормона роста; LRRK2 (англ. leucine-rich repeat kinase 2) – богатая лейцином повторяющаяся киназа 2; CACNA1B (англ. calcium voltage-gated channel subunit alpha1 B) – субъединица альфа-1B кальциевого вольтаж-зависимого канала; CBS (англ. cystatione beta-synthase) – цистатион бета-синтетаза; ADORA2B (англ. adenosine A2B receptor) – рецептор аденозина A2B3; MTR (англ. methionine synthase) – метионинсинтаза; MTRR (англ. methionine synthase reductase) – метионинсинтаза редуктаза; PDHA1 (англ. pyruvate dehydrogenase E1 subunit alpha 1) – E1-альфа-субъединица пируватдегидрогеназы; BCKDHA (англ. branched chain keto acid dehydrogenase E1 subunit alpha) – Е1-альфа-субъединица кетодегидрогеназы с разветвленной цепью; OGDHL (англ. oxoglutarate dehydrogenase like protein) – оксоглутаратдегидрогеназоподобный белок; LDHAL6A (англ. lactate dehydrogenase A-like 6A) – лактатдегидрогеназа А-подобная 6А; MMUT (англ. methylmalonyl-СoА mutase) – метилмалонил-КоА-мутаза; АТФ – аденозинтрифосфат
Figure 7. Molecular synergism of adenosine and vitamins B1, PP, B12 in the context of polyneuropathy treatment.
PEMT – phosphatidylethanolamine N-methyltransferase; TKTL1 – transketolase-like-1; HCAR2 – hydroxycarboxylic acid receptor 2; G6PD – glucose-6-phosphate dehydrogenase; SIRT1 – sirtuin 1; ADORA1/A2/A3 – adenosine A1/A2/A3 receptor; ACP3 – acid phosphatase 3; METTL3 – methyltransferase-like protein 3; TSPO – translocator protein; GHSR – growth hormone secretagogue receptor; LRRK2 – leucine-rich repeat kinase 2; CACNA1B – calcium voltage-gated channel subunit alpha1 B; CBS – cystatione beta-synthase; ADORA2B – adenosine A2B receptor; MTR – methionine synthase; MTRR – methionine synthase reductase; PDHA1 – pyruvate dehydrogenase E1 subunit alpha 1; BCKDHA – branched chain keto acid dehydrogenase E1 subunit alpha; OGDHL – oxoglutarate dehydrogenase like protein; LDHAL6A – lactate dehydrogenase A-like 6A; MMUT – methylmalonyl-СoА mutase; ATP – adenosine triphosphate
В целом аденозин участвует в нейрогенезе, нейропротекции и снижении нейровоспаления, тиамин – в биосинтезе нейронального АТФ и поддержании структуры нейронов, ниацин – в снижении воспаления, гомеостазе миелина, нейронального синтеза АТФ, нейропластичности и аутофагии, а цианокобаламин – в обезвреживании гомоцистеина, поддержке биосинтеза миелина и нейропротекции.
ЗАКЛЮЧЕНИЕ / CONCLUSION
Молекулярные механизмы синергизма между витаминами В1, РР, В12 и аденозином включают:
– торможение возраст-ассоциированного нейровоспаления (англ. neuroanti-aging), стимулирование выживания нейронов в условиях ишемии/гипоксии;
– поддержку структурных компонент нейронов и глии (тело нейрона, аксоны, дендриты, миелиновые оболочки и др.);
– поддержку нейротрансмиссии (и тормозящей, и возбуждающей);
– обмен нейролипидов (прежде всего, сфингомиелина для сохранения стенки нейронов).
В результате проведенного анализа для каждого из компонентов препарата Кокарнит® установлены таргетные белки, опосредующие восстановление нервных волокон путем регуляции нейровоспаления и ремиелинизации. Изучение биологических каскадов, в которых участвуют эти таргетные белки, указывает на молекулярные механизмы синергидного действия компонентов препарата и позволяет врачу сделать фундаментально обоснованные выводы о возможностях персонализации терапии диабетической нейропатии.
1. https://www.ncbi.nlm.nih.gov/protein/.
2. https://www.ebi.ac.uk.
3. https://www.uniprot.org.
4. http://www.humanproteomemap.org.
5. PDK1 (англ. рhosphoinositide-dependent kinase-1) – 3-фосфоинозитид-зависимая протеинкиназа 1; PIP3 (англ. рhosphatidylinositol (3,4,5)-trisphosphate) – фосфатидилинозитол (3,4,5)-трифосфат.
6. PI3K (англ. phosphoinositide 3-kinase) – фосфоинозитид-3-киназа.
7. CaMKK/AMPK (англ. Ca2+ calmodulin-dependent protein kinase kinase/AMP-activated protein kinase) – Ca2+ кальмодулин-зависимая протеинкиназа киназа / AMФ-активируемая протеинкиназа.
Список литературы
1. Khatun S., Prasad Bhagat R., Dutta R., et al. Unraveling HDAC11: epigenetic orchestra in different diseases and structural insights for inhibitor design. Biochem Pharmacol. 2024; 225: 116312. https://doi.org/10.1016/j.bcp.2024.116312.
2. Dyck P.J., Albers J.W., Andersen H., et al. Diabetic polyneuropathies: update on research definition, diagnostic criteria and estimation of severity. Diabetes Metab Res Rev. 2011; 27 (7): 620–8. https://doi.org/10.1002/dmrr.1226.
3. Lipsky B.A., Senneville E., Abbas Z.G., et al. Guidelines on the diagnosis and treatment of foot infection in persons with diabetes (IWGDF 2019 update). Diabetes Metab Res Rev. 2020; 36 (Suppl. 1): e3280. https://doi.org/10.1002/dmrr.3280.
4. Goldney J., Barker M.M., Thomas M., et al. Age at onset of type 2 diabetes and prevalence of vascular disease and heart failure: Systematic review and dose-response meta-analysis. J Diabetes Complications. 2024; 38 (10): 108849. https://doi.org/10.1016/j.jdiacomp.2024.108849.
5. Галстян Г.Р., Старостина Е.Г., Яхно Н.Н. и др. Диагностика и рациональная терапия болевой формы диабетической периферической нейропатии: междисциплинарный консенсус экспертов. Сахарный диабет. 2019; 22 (4): 305–27. https://doi.org/10.14341/DM9625.
6. Senneville E., Albalawi Z., van Asten S.A., et al. IWGDF/IDSA guidelines on the diagnosis and treatment of diabetes-related foot infections (IWGDF/IDSA 2023). Diabetes Metab Res Rev. 2024; 40 (3): e3687. https://doi.org/10.1002/dmrr.3687.
7. Roikjer J., Wegeberg A.M., Nikontovic A., et al. Prevalence of painful and painless diabetic peripheral neuropathy in the Northern Danish Region: a population-based study. Prim Care Diabetes. 2024: S1751-9918(24)00164-5. https://doi.org/10.1016/j.pcd.2024.08.006.
8. Shrimpton M., Shaw C. Concurrent transverse myelitis and acute inflammatory demyelinating polyneuropathy. BMJ Case Rep. 2024; 17 (5): e259732. https://doi.org/10.1136/bcr-2024-259732.
9. Vincent A.M., Callaghan B.C., Smith A.L., Feldman E.L. Diabetic neuropathy: cellular mechanisms as therapeutic targets. Nat Rev Neurol. 2011; 7 (10): 573–83. https://doi.org/10.1038/nrneurol.2011.137.
10. Niimi N., Yako H., Takaku S., et al. Aldose reductase and the polyol pathway in schwann cells: old and new problems. Int J Mol Sci. 2021; 22 (3): 1031. https://doi.org/10.3390/ijms22031031.
11. Aziz N., Dash B., Wal P., et al. New horizons in diabetic neuropathies: an updated review on their pathology, diagnosis, mechanism, screening techniques, pharmacological, and future approaches. Curr Diabetes Rev. 2024; 20 (6): e201023222416. https://doi.org/10.2174/0115733998242299231011181615.
12. Liang Z., Zhang N., Wang X., et al. Corrigendum to “Epothilone B inactivation of Sirtuin1 promotes mitochondrial reactive oxygen species to induce dysfunction and ferroptosis of Schwann cells” [European Journal of Pharmaeutical Sciences 181 (2023) 106350]. Eur J Pharm Sci. 2024:106854. https://doi.org/10.1016/j.ejps.2024.106854.
13. Chong Z.Z., Menkes D.L., Souayah N. Targeting neuroinflammation in distal symmetrical polyneuropathy in diabetes. Drug Discov Today. 2024; 29 (8): 104087. https://doi.org/10.1016/j.drudis.2024.104087.
14. Громова О.А., Торшин И.Ю., Путилина М.В. и др. О механизмах синергидного действия толперизона, мелоксикама и витаминов группы В в терапии периферических болевых синдромов. Медицинский совет. 2020; 8: 54–64. https://doi.org/10.21518/2079-701X-2020-8-54-64.
15. Громова О.А., Торшин И.Ю., Тапильская Н.И., Галустян А.Н. Системно-биологический анализ синергидного воздействия прогестерона, витаминов и микроэлементов на нейропротекцию и развитие мозга плода. Вопросы гинекологии, акушерства и перинатологии.2019; 18 (6): 65–75. https://doi.org/10.20953/1726-1678-2019-6-65-75.
16. Torshin I.Yu. Sensing the change: from molecular genetics to personalized medicine. Nova Science Pub Inc.; 2012: 366 pp.
17. Huang Z.L., Urade Y., Hayaishi O. The role of adenosine in the regulation of sleep. Curr Top Med Chem. 2011; 11 (8): 1047–57. https://doi.org/10.2174/156802611795347654.
18. Schettler G. The role of the physician in political environmental discussions. Offentl Gesundheitswes. 1990; 52 (Suppl. 1): 7–11 (in German).
19. Chen Z., Xiong C., Pancyr C., et al. Prolonged adenosine A1 receptor activation in hypoxia and pial vessel disruption focal cortical ischemia facilitates clathrin-mediated AMPA receptor endocytosis and longlasting synaptic inhibition in rat hippocampal CA3-CA1 synapses: differential regula. J Neurosci. 2014; 34 (29): 9621–43. https://doi.org/10.1523/JNEUROSCI.3991-13.2014.
20. Atkinson M.R., Townsend-Nicholson A., Nicholl J.K., et al. Cloning, characterisation and chromosomal assignment of the human adenosine A3 receptor (ADORA3) gene. Neurosci Res. 1997; 29 (1): 73–9. https://doi.org/10.1016/s0168-0102(97)00073-4.
21. Wan T.C., Ge Z.D., Tampo A., et al. The A3 adenosine receptor agonist CP-532,903 [N6-(2,5-dichlorobenzyl)-3'-aminoadenosine-5'N-methylcarboxamide] protects against myocardial ischemia/ reperfusion injury via the sarcolemmal ATP-sensitive potassium channel. J Pharmacol Exp Ther. 2008; 324 (1): 234–43. https://doi.org/10.1124/jpet.107.127480.
22. Smith R.G., Leonard R., Bailey A.R., et al. Growth hormone secretagogue receptor family members and ligands. Endocrine. 2001; 14 (1): 9–14. https://doi.org/10.1385/ENDO:14:1:009.
23. Huang Z., Chen C., Guan K., et al. Protective role of ghrelin against 6PPD-quinone-induced neurotoxicity in zebrafish larvae (Danio rerio) via the GHSR pathway. Ecotoxicol Environ Saf. 2024; 285: 117031. https://doi.org/10.1016/j.ecoenv.2024.117031.
24. Salpietro V., Dixon C.L., Guo H., et al. AMPA receptor GluA2 subunit defects are a cause of neurodevelopmental disorders. Nat Commun. 2019; 10 (1): 3094. https://doi.org/10.1038/s41467-019-10910-w.
25. Kolleker A., Zhu J.J., Schupp B.J., et al. Glutamatergic plasticity by synaptic delivery of GluR-B(long)-containing AMPA receptors. Neuron. 2003; 40 (6): 1199–212. https://doi.org/10.1016/s0896-6273(03)00722-0.
26. Qin X., Zaki M.G., Chen Z., et al. Adenosine signaling and clathrinmediated endocytosis of glutamate AMPA receptors in delayed hypoxic injury in rat hippocampus: role of casein kinase 2. Mol Neurobiol. 2021; 58 (5): 1932–51. https://doi.org/10.1007/s12035-020-02246-0.
27. Kozich V., Sokolová J., Klatovská V., et al. Cystathionine betasynthase mutations: effect of mutation topology on folding and activity. Hum Mutat. 2010; 31 (7): 809–19. https://doi.org/10.1002/humu.21273.
28. Casique L., Kabil O., Banerjee R., et al. Characterization of two pathogenic mutations in cystathionine beta-synthase: different intracellular locations for wild-type and mutant proteins. Gene. 2013; 531 (1): 117–24. https://doi.org/10.1016/j.gene.2013.08.021.
29. Witucki Ł., Jakubowski H. Homocysteine metabolites inhibit autophagy, elevate amyloid beta, and induce neuropathy by impairing Phf8/H4K20me1-dependent epigenetic regulation of mTOR in cystathionine β-synthase-deficient mice. J Inherit Metab Dis. 2023; 46 (6): 1114–30. https://doi.org/10.1002/jimd.12661.
30. Wang F., Zhou H., Zhang X. SAM, a cystathionine beta-synthase activator, promotes hydrogen sulfide to promote neural repair resulting from massive cerebral infarction induced by middle cerebral artery occlusion. Metab Brain Dis. 2022; 37 (5): 1641–54. https://doi.org/10.1007/s11011-022-00976-9.
31. Yin W.L., Yin W.G., Huang B.S., Wu L.X. Neuroprotective effects of lentivirus-mediated cystathionine-beta-synthase overexpression against 6-OHDA-induced Parkinson's disease rats. Neurosci Lett. 2017; 657: 45–52. https://doi.org/10.1016/j.neulet.2017.07.019.
32. Shields D.J., Lingrell S., Agellon L.B., et al. Localization-independent regulation of homocysteine secretion by phosphatidylethanolamine N-methyltransferase. J Biol Chem. 2005; 280 (29): 27339–44. https:// doi.org/10.1074/jbc.M504658200.
33. Wittmann G., Liposits Z., Lechan R.M., Fekete C. Medullary adrenergic neurons contribute to the cocaineand amphetamineregulated transcript-immunoreactive innervation of thyrotropinreleasing hormone synthesizing neurons in the hypothalamic paraventricular nucleus. Brain Res. 2004; 1006 (1): 1–7. https://doi.org/10.1016/j.brainres.2003.12.049.
34. Alarcón C.R., Goodarzi H., Lee H., et al. HNRNPA2B1 is a mediator of m(6)A-dependent nuclear RNA processing events. Cell. 2015; 162 (6): 1299–308. https://doi.org/10.1016/j.cell.2015.08.011.
35. Ke S., Pandya-Jones A., Saito Y., et al. m(6)A mRNA modifications are deposited in nascent pre-mRNA and are not required for splicing but do specify cytoplasmic turnover. Genes Dev. 2017; 31 (10): 990–1006. https://doi.org/10.1101/gad.301036.117.
36. Wu L., Ning P., Liang Y., et al. Methyltransferase METTL3 regulates neuropathic pain through m6A methylation modification of SOCS1. Neuropharmacology. 2024; 261: 110176. https://doi.org/10.1016/j.neuropharm.2024.110176.
37. Dermentzaki G., Furlan M., Tanaka I., et al. Depletion of Mettl3 in cholinergic neurons causes adult-onset neuromuscular degeneration. Cell Rep. 2024; 43 (4): 113999. https://doi.org/10.1016/j.celrep.2024.113999.
38. Ming Y., Deng Z., Tian X., et al. m6A Methyltransferase METTL3 reduces hippocampal neuron apoptosis in a mouse model of autism through the MALAT1/SFRP2/Wnt/β-catenin axis. Psychiatry Investig. 2022; 19 (10): 771–87. https://doi.org/10.30773/pi.2021.0370.
39. Liu B., Xing Z., Song F., et al. METTL3-mediated ANXA2 inhibition confers neuroprotection in ischemic stroke: evidence from in vivo and in vitro studies. FASEB J. 2023; 37 (7): e22974. https://doi.org/10.1096/fj.202300246R.
40. Kato M., Wynn R.M., Chuang J.L., et al. Structural basis for inactivation of the human pyruvate dehydrogenase complex by phosphorylation: role of disordered phosphorylation loops. Structure. 2008; 16 (12): 1849–59. https://doi.org/10.1016/j.str.2008.10.010.
41. Ferreira T., Polavarapu K., Olimpio C., et al. Variants in mitochondrial disease genes are common causes of inherited peripheral neuropathies. J Neurol. 2024; 271 (6): 3546–53. https://doi.org/10.1007/s00415-024-12319-y.
42. Mizusawa A., Watanabe A., Yamada M., et al. BDK deficiency in cerebral cortex neurons causes neurological abnormalities and affects endurance capacity. Nutrients. 2020; 12 (8): 2267. https://doi.org/10.3390/nu12082267.
43. Joshi M.A., Jeoung N.H., Obayashi M., et al. Impaired growth and neurological abnormalities in branched-chain alpha-keto acid dehydrogenase kinase-deficient mice. Biochem J. 2006; 400 (1): 153–62. https://doi.org/10.1042/BJ20060869.
44. Li T., Zhao L., Li Y., Dang M., et al. PPM1K mediates metabolic disorder of branched-chain amino acid and regulates cerebral ischemiareperfusion injury by activating ferroptosis in neurons. Cell Death Dis. 2023; 14 (9): 634. https://doi.org/10.1038/s41419-023-06135-x.
45. Gao R., Liu Z., Meng M., et al. Neurogenesis-associated protein, a potential prognostic biomarker in anti-PD-1 based kidney renal clear cell carcinoma patient therapeutics. Pharmaceuticals. 2024; 17 (4): 451. https://doi.org/10.3390/ph17040451.
46. Pinson A., Xing L., Namba T., et al. Human TKTL1 implies greater neurogenesis in frontal neocor tex of modern humans than Neanderthals. Science. 2022; 377 (6611): eabl6422. https://doi.org/10.1126/science.abl6422.
47. Coy J.F., Dressler D., Wilde J., Schubert P. Mutations in the transketolase-like gene TKTL1: clinical implications for neurodegenerative diseases, diabetes and cancer. Clin Lab. 2005; 51 (5–6): 257–73.
48. Liu Y., Meng F., Wang J., et al. A novel oxoglutarate dehydrogenaselike mediated miR-214/TWIST1 negative feedback loop inhibits pancreatic cancer growth and metastasis. Clin Cancer Res. 2019; 25 (17): 5407–21. https://doi.org/10.1158/1078-0432.CCR-18-4113.
49. Yap Z.Y., Efthymiou S., Seiffert S., et al. Bi-allelic variants in OGDHL cause a neurodevelopmental spectrum disease featuring epilepsy, hearing loss, visual impairment, and ataxia. Am J Hum Genet. 2021; 108 (12): 2368–84. https://doi.org/10.1016/j.ajhg.2021.11.003.
50. Громова О.А., Торшин И.Ю. Систематический анализ экспериментальной и клинической фармакологии никотинамида и перспективы лечения атеросклероза. Экспериментальная и клиническая гастроэнтерология. 2022; 10: 111–25. https://doi.org/10.31146/1682-8658-ecg-206-10-111-125.
51. Kostylina G., Simon D., Fey M.F., et al. Neutrophil apoptosis mediated by nicotinic acid receptors (GPR109A). Cell Death Differ. 2008; 15 (1): 134–42. https://doi.org/10.1038/sj.cdd.4402238.
52. Wuerch E., Urgoiti G.R., Yong V.W. The promise of niacin in neurology. Neurotherapeutics. 2023; 20 (4): 1037–54. https://doi.org/10.1007/s13311-023-01376-2.
53. Challa S., Khulpateea B.R., Nandu T., et al. Ribosome ADPribosylation inhibits translation and maintains proteostasis in cancers. Cell. 2021; 184 (17): 4531–46.e26. https://doi.org/10.1016/j.cell.2021.07.005.
54. Berger F., Lau C., Dahlmann M., Ziegler M. Subcellular compartmentation and differential catalytic properties of the three human nicotinamide mononucleotide adenylyltransferase isoforms. J Biol Chem. 2005; 280 (43): 36334–41. https://doi.org/10.1074/jbc.M508660200.
55. Kotaka M., Gover S., Vandeputte-Rutten L., et al. Structural studies of glucose-6-phosphate and NADP+ binding to human glucose-6phosphate dehydrogenase. Acta Crystallogr D Biol Crystallogr. 2005; 61 (Pt. 5): 495–504. https://doi.org/10.1107/S0907444905002350.
56. Sun Q., Zhang B.Y., Zhang P.A., et al. Downregulation of glucose-6-phosphate dehydrogenase contributes to diabetic neuropathic pain through upregulation of toll-like receptor 4 in rats. Mol Pain. 2019; 15: 1744806919838659. https://doi.org/10.1177/1744806919838659.
57. Chen X., Gu X., Shan Y., et al. Identification of a novel human lactate dehydrogenase gene LDHAL6A, which activates transcriptional activities of AP1(PMA). Mol Biol Rep. 2009; 36 (4): 669–76. https://doi.org/10.1007/s11033-008-9227-2.
58. Yuan Z., Zhang X., Sengupta N., et al. SIRT1 regulates the function of the Nijmegen breakage syndrome protein. Mol Cell. 2007; 27 (1): 149–62. https://doi.org/10.1016/j.molcel.2007.05.029.
59. Uhl M., Csernok A., Aydin S., et al. Role of SIRT1 in homologous recombination. DNA Repair. 2010; 9 (4): 383–93. https://doi.org/10.1016/j.dnarep.2009.12.020.
60. Vaquero A., Scher M., Lee D., et al. Human SirT1 interacts with histone H1 and promotes formation of facultative heterochromatin. Mol Cell. 2004; 16 (1): 93–105. https://doi.org/10.1016/j.molcel.2004.08.031.
61. Bosch-Presegué L., Raurell-Vila H., Marazuela-Duque A., et al. Stabilization of Suv39H1 by SirT1 is part of oxidative stress response and ensures genome protection. Mol Cell. 2011; 42 (2): 210–23. https://doi.org/10.1016/j.molcel.2011.02.034.
62. Yeung F., Hoberg J.E., Ramsey C.S., et al. Modulation of NF-kappaBdependent transcription and cell survival by the SIRT1 deacetylase. EMBO J. 2004; 23 (12): 2369–80. https://doi.org/10.1038/sj.emboj.7600244.
63. Sundaresan N.R., Pillai V.B., Wolfgeher D., et al. The deacetylase SIRT1 promotes membrane localization and activation of Akt and PDK1 during tumorigenesis and cardiac hypertrophy. Sci Signal. 2011; 4 (182): ra46. https://doi.org/10.1126/scisignal.2001465.
64. Wang J., Chen J. SIRT1 regulates autoacetylation and histone acetyltransferase activity of TIP60. J Biol Chem. 2010; 285 (15): 11458–64. https://doi.org/10.1074/jbc.M109.087585.
65. Thapa R., Moglad E., Afzal M., et al. The role of sirtuin 1 in ageing and neurodegenerative disease: a molecular perspective. Ageing Res Rev. 2024; 102: 102545. https://doi.org/10.1016/j.arr.2024.102545.
66. Zach S., Felk S., Gillardon F. Signal transduction protein array analysis links LRRK2 to Ste20 kinases and PKC zeta that modulate neuronal plasticity. PLoS One. 2010; 5 (10): e13191. https://doi.org/10.1371/journal.pone.0013191.
67. Piccoli G., Onofri F., Cirnaru M.D., et al. Leucine-rich repeat kinase 2 binds to neuronal vesicles through protein interactions mediated by its C-terminal WD40 domain. Mol Cell Biol. 2014; 34 (12): 2147–61. https://doi.org/10.1128/MCB.00914-13.
68. Gómez-Suaga P., Luzón-Toro B., Churamani D., et al. Leucine-rich repeat kinase 2 regulates autophagy through a calcium-dependent pathway involving NAADP. Hum Mol Genet. 2012; 21 (3): 511–25. https://doi.org/10.1093/hmg/ddr481.
69. Громова О.А., Стаховская Л.В., Торшин И.Ю., Томилова И.К. Прием метформина провоцирует нарушения гомеостаза витамина В12. Consilium Medicum. 2017; 19 (4): 58–64.
70. Wolthers K.R., Toogood H.S., Jowitt T.A., et al. Crystal structure and solution characterization of the activation domain of human methionine synthase. FEBS J. 2007; 274 (3): 738–50. https://doi.org/10.1111/j.1742-4658.2006.05618.x.
71. Hassan Z., Coelho D., Bossenmeyer-Pourié C., et al. Cognitive impairment is associated with AMPAR glutamatergic dysfunction in a mouse model of neuronal methionine synthase deficiency. Cells. 2023; 12 (9): 1267. https://doi.org/10.3390/cells12091267.
72. Takahashi-Íñiguez T., García-Arellano H., Trujillo-Roldán M.A., Flores M.E. Protection and reactivation of human methylmalonyl-CoA mutase by MMAA protein. Biochem Biophys Res Commun. 2011; 404 (1): 443–7. https://doi.org/10.1016/j.bbrc.2010.11.141.
73. Wolthers K.R., Lou X., Toogood H.S., et al. Mechanism of coenzyme binding to human methionine synthase reductase revealed through the crystal structure of the FNR-like module and isothermal titration calorimetry. Biochemistry. 2007; 46 (42): 11833–44. https://doi.org/10.1021/bi701209p.
74. Jadavji N.M., Bahous R.H., Deng L., et al. Mouse model for deficiency of methionine synthase reductase exhibits short-term memory impairment and disturbances in brain choline metabolism. Biochem J. 2014; 461 (2): 205–12. https://doi.org/10.1042/BJ20131568.
75. Wolthers K.R., Scrutton N.S. Cobalamin uptake and reactivation occurs through specific protein interactions in the methionine synthasemethionine synthase reductase complex. FEBS J. 2009; 276 (7): 1942–51. https://doi.org/10.1111/j.1742-4658.2009.06919.x.
76. Kim J., Gherasim C., Banerjee R. Decyanation of vitamin B12 by a trafficking chaperone. Proc Natl Acad Sci USA. 2008; 105 (38): 14551–4. https://doi.org/10.1073/pnas.0805989105.
77. Kim J., Hannibal L., Gherasim C., et al. A human vitamin B12 trafficking protein uses glutathione transferase activity for processing alkylcobalamins. J Biol Chem. 2009; 284 (48): 33418–24. https://doi.org/10.1074/jbc.M109.057877.
78. Taylor J.M., Allen A.M., Graham A. Targeting mitochondrial 18 kDa translocator protein (TSPO) regulates macrophage cholesterol efflux and lipid phenotype. Clin Sci. 2014; 127 (10): 603–13. https://doi.org/10.1042/CS20140047.
79. Liu J., Huang J., Zhang Z., Zhang R., et al. Translocator protein 18 kDa (TSPO) as a novel therapeutic target for chronic pain. Neural Plast. 2022; 2022: 8057854. https://doi.org/10.1155/2022/8057854.
80. Bettendorff L., Goessens G., Sluse F., et al. Thiamine deficiency in cultured neuroblastoma cells: effect on mitochondrial function and peripheral benzodiazepine receptors. J Neurochem. 1995; 64 (5): 2013–21. https://doi.org/10.1046/j.1471-4159.1995.64052013.x.
81. El Hajj Chehadeh S., Dreumont N., Willekens J., et al. Early methyl donor deficiency alters cAMP signaling pathway and neurosteroidogenesis in the cerebellum of female rat pups. Am J Physiol Endocrinol Metab. 2014; 307 (11): E1009–19. https://doi.org/10.1152/ajpendo.00364.2014.
82. Chen K., Wang T., Li Y., et al. Rhodojaponin VI indirectly targets Cav2.2 channels via N-ethylmaleimide-sensitive fusion protein to alleviate neuropathic pain. Acta Pharm Sin B. 2023; 13 (3): 1326–36. https://doi.org/10.1016/j.apsb.2023.01.021.
83. Huang S.K., Lu C.W., Lin T.Y., Wang S.J. Neuroprotective role of the B vitamins in the modulation of the central glutamatergic neurotransmission. CNS Neurol Disord Drug Targets. 2022; 21 (4): 292–301. https://doi.org/10.2174/1871527320666210902165739.
Об авторах
О. А. ГромоваРоссия
Громова Ольга Алексеевна - д.м.н., проф. WoS ResearcherID: J-4946-2017. Scopus Author ID: 7003589812. eLibrary SPIN-code: 6317-9833.
Ул. Вавилова, д. 44, корп. 2, Москва 119333
И. Ю. Торшин
Россия
Торшин Иван Юрьевич - к.ф-м.н., к.х.н. WoS ResearcherID: C-7683-2018. Scopus Author ID: 7003300274. eLibrary SPIN-code: 1375-1114.
Ул. Вавилова, д. 44, корп. 2, Москва 119333
А. Г. Мойсеенок
Беларусь
Мойсеенок Андрей Георгиевич - д.м.н., проф., академик БАН.
Пл. Антония Тызенгауза, д. 7, Гродно 230023
Что уже известно об этой теме?
► По эпидемиологическим данным, 537 млн людей в возрасте от 20 до 79 лет в мире страдают сахарным диабетом 2-го типа (СД2). Ожидается, что к 2030 г. число больных СД2 увеличится до 643 млн
► При диабетической полинейропатии нейровоспаление приводит к демиелинизации. Старение шванновских клеток вызывает потерю миелина, нарушение аксональной функции, повышает уязвимость аксонов к гипоксическому или оксидантному повреждению, нейроаксональной дегенерации
Что нового дает статья?
► Установлены белки протеома, активность которых связана с эффектами аденозина и витаминов В1, РР, В12
► Выделены таргетные белки, участвующие в снижении нейровоспаления, ремиелинизации, нейрогенезе, биосинтезе нейронального аденозинтрифосфата, гомеостазе миелина
Как это может повлиять на клиническую практику в обозримом будущем?
► Молекулярные механизмы синергизма изученных молекул имеют фундаментальное значение для понимания процессов регуляции нейровоспаления и ремиелинизации для профилактики диабетической полинейропатии и других нейродегенеративных заболеваний
Рецензия
Для цитирования:
Громова О.А., Торшин И.Ю., Мойсеенок А.Г. Протеомный анализ синергетического нейропротекторного действия аденозина, тиамина, ниацина и цианокобаламина в патофизиологии диабетической полинейропатии. ФАРМАКОЭКОНОМИКА. Современная фармакоэкономика и фармакоэпидемиология. 2024;17(4):542-557. https://doi.org/10.17749/2070-4909/farmakoekonomika.2024.285
For citation:
Gromova O.A., Torshin I.Yu., Moiseenok A.G. Proteomic analysis of synergetic neuroprotective effect of adenosine, thiamine, niacin and cyanocobalamin in pathophysiology of diabetic polyneuropathy. FARMAKOEKONOMIKA. Modern Pharmacoeconomics and Pharmacoepidemiology. 2024;17(4):542-557. (In Russ.) https://doi.org/10.17749/2070-4909/farmakoekonomika.2024.285

Контент доступен под лицензией Creative Commons Attribution-NonCommercial-ShareAlike 4.0 International License.






































