Перейти к:
Тенденции развития индустрии клинических исследований
https://doi.org/10.17749/2070-4909/farmakoekonomika.2024.257
Аннотация
Актуальность. Индустрия клинических исследований (КИ) подвержена изменениям, одни из которых развиваются на коротком промежутке времени и их направление можно спрогнозировать, в то время как другие изменения развиваются постепенно и длительно, формируя устойчивые тенденции, анализ которых необходим, в частности, и для их подтверждения и прогнозирования. Согласно общепринятой временной градации выделяют оперативный (до 1 мес), краткосрочный (до 1 года), среднесрочный (до 5 лет), долгосрочный (до 20 лет) и дальнесрочный (свыше 20 лет) прогноз. В индустрии КИ распространен краткосрочный прогноз.
Цель: выявить тенденции развития индустрии КИ до конца 2024 г.
Материал и методы. Проведен поиск публикаций в русскоязычном и англоязычном сегментах сети Интернет в источниках с открытым доступом в базах данных ClinicalTrials.gov, PubMed/MEDLINE, Google Scholar, Academia, ResearchGate, КиберЛенинка, eLibrary по ключевым запросам “trends in clinical trials” и «тенденции в клинических исследованиях» за период январь с января по март 2023 г. Также использовали запрос «история клинических исследований» в русскоязычной части интернета через поиск Google. В анализ попали публикации по истории развития КИ за период 1936–2023 гг. Общее количество проанализированных источников составило 59, из них 9 русскоязычных и 50 англоязычных.
Результаты. Тенденции развития КИ можно разделить на две группы – связанные с организацией и проведением КИ и с трендами в разработке инновационных лекарственных препаратов. В первой группе тенденции остались сходными с 2022 г. – продолжающаяся дигитализация операционной деятельности, смещение централизованных исследований в сторону децентрализации, a дизайна протокола – в сторону пациентоцентричности. Во второй группе количество ожидаемых препаратов уменьшилось и наблюдается смещение в сторону биологических препаратов, препаратов генной и клеточной терапии.
Заключение. Тенденции в КИ характеризуются целым рядом новаций, связанных в первую очередь с цифровизацией, развитием телемедицинских технологий, математического моделирования, искусственного интеллекта, виртуальных КИ, децентрализацией и пациентоцентричностью.
Ключевые слова
Для цитирования:
Милованов С.С., Попов В.В., Теплова Н.В. Тенденции развития индустрии клинических исследований. ФАРМАКОЭКОНОМИКА. Современная фармакоэкономика и фармакоэпидемиология. 2025;18(1):104-113. https://doi.org/10.17749/2070-4909/farmakoekonomika.2024.257
For citation:
Milovanov S.S., Popov V.V., Teplova N.V. Trends in the industry of clinical trials. FARMAKOEKONOMIKA. Modern Pharmacoeconomics and Pharmacoepidemiology. 2025;18(1):104-113. (In Russ.) https://doi.org/10.17749/2070-4909/farmakoekonomika.2024.257
ВВЕДЕНИЕ / INTRODUCTION
Для наиболее полного раскрытия темы целесообразно начать с рассмотрения некоторых исторических фактов, связанных с такой специфической областью человеческой деятельности, как клинические исследования (КИ). Прообразы КИ, которые можно охарактеризовать как «эмпирический» период (на основе опыта), находят в 2000 г. до Р.Х. [1]. Так, например, в Вавилоне больной человек выходил на площадь и ждал наиболее подходящего совета, как лечить его болезнь, что можно считать примером публичности КИ.
Первое в мире исследование на научной основе, которое ознаменовало «научный» период КИ, провел главный врач Морского госпиталя Госпорта Джеймс Линд. В середине XVIII века он доказал, что цитрусовые способны предотвратить развитие цинги1. Впервые термин «клиническое исследование» (англ. clinical trial, СТ) в современном понимании появляется в 1931 г. [2][3]. К 1996 г. формируется общепринятая сейчас структура организации КИ, состоящая из спонсора, монитора (контрактная исследовательская организация), исследователя, пациента, независимого комитета по мониторингу данных, независимого этического комитета и клинического центра (стационар или поликлиника, частная практика), где концентрируются пациенты и проводятся основные процедуры протокола КИ (там же часто находится этический комитет.
Таким образом, сформировались так называемые «централизованные» КИ, закрепленные в международных документах, таких как Нюрнбергский кодекс 1947 г., Хельсинкская декларация 1964 г., Правила надлежащей клинической практики (англ. Good Clinical Practice, GCP), принятые Управлением по санитарному надзору за качеством пищевых продуктов и медикаментов США (англ. U.S. Food and Drug Administration, FDA) в 1978 г., Европейские правила GСP 1991 г. с ревизиями 1996 г. (R1) и 2016 г. (R2), а также локальные регуляторные документы – Правила проведения качественных клинических испытаний в Российской Федерации (ОСТ 42-511-99 от 29 декабря 1998 г.) и Руководство по надлежащей клинической практике (англ. Consolidated Guideline for Good Clinical Practice) Международной конференции по гармонизации технических требований к регистрации фармацевтических продуктов, предназначенных для применения человеком (англ. International Conference on Harmonization of Technical Requirements for Registration of Pharmaceuticals for Human Use).
С развитием технологий дистанционной обработки, хранения и передачи данных необходимость централизации в исследованиях стала уменьшаться, хотя роль клинического центра сохраняется и в настоящее время [4].
Отличительными особенностями классической «централизованной» модели проведения КИ являлись: глобализация КИ, «мегатрайлы», гонка фармацевтических компаний за «блокбастерами», поиск мишеней и разработка лекарственных средств для наиболее распространенных заболеваний – патологий сердечно-сосудистой системы и онкологии с преимущественным созданием инновационных препаратов малых молекул химического синтеза.
В 1975 г. с открытием гибридомных технологий [5] началась эра КИ биологических препаратов, а 1990-е гг., когда стали развиваться геномные и генные технологии [6], можно считать началом эры КИ генных препаратов и препаратов клеточной терапии.
В методах проведения КИ [7] изменения стали происходить в последние десятилетия (наиболее бурно это проявилось в период пандемии COVID-19 в 2020–2022 гг.). К концу 2022 г. классическая «централизованная» модель уже претерпела определенные видоизменения, связанные с внедрением новых технологий – в первую очередь цифровых. На наш взгляд, сейчас можно говорить о новой эре многовекторности в организации КИ2 [8–10].
В настоящее время известны следующие модели организации КИ:
– централизованные КИ (англ. сentralized CT) – конвенциональные или обычные;
– децентрализованные КИ (англ. decentralized CT);
– персонализированные КИ (англ. рersonаlyzed CT);
– гибридные КИ (англ. hybrid CT);
– виртуальные КИ (англ. virtual CT);
– КИ с использованием байесовской статистики (англ. Bayesian CT);
– КИ с использованием данных реальной клинической практики (англ. real world data / real world evidence, RWD/RWE);
– КИ с использованием искусственного интеллекта (ИИ).
По-прежнему на создание инновационных лекарственных средств оказывают влияние бремя болезни и социальная значимость заболевания, открытие новых мишеней, развитие геномных и клеточных технологий.
Цель – выявить тенденции развития индустрии КИ до конца 2024 г.
МАТЕРИАЛ И МЕТОДЫ / MATERIAL AND METHODS
Стратегия поиска / Search strategy
Проведен поиск публикаций в русскоязычном и англоязычном сегментах сети Интернет в источниках с открытым доступом в базах данных ClinicalTrials.gov, PubMed/MEDLINE, Google Scholar, Academia, ResearchGate, КиберЛенинка, eLibrary по ключевым запросам “trends OR/AND in OR/AND clinical OR/AND trials” и «тенденции И/ИЛИ в И/ИЛИ клинических И/ИЛИ исследованиях» за период с января 2023 г. по октябрь 2024 г. Также использовали запрос «история клинических исследований» в русскоязычной части интернета через поиск Google.
Отбор публикаций / Selection of publications
В анализ вошли публикации по истории развития КИ за период 1936–2023 гг. Используя приверженность к стандартизации, мы взяли упрощенный метод систематических обзоров PRISMA [11][12], и на этапе идентификации по вышеупомянутым критериям было найдено более 1000 публикаций. Далее, учитывая экспертное мнение авторов, на скрининге оставлены уникальные (в единичном упоминании) и повторяющиеся материалы по выявленным направлениям и тенденциям. Окончательно общее количество отобранных и проанализированных источников составило 47, из них 6 русскоязычных и 41 англоязычный.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ / RESULTS AND DISCUSSION
После изучения 47 отобранных публикаций по предложенной теме выделены основные векторы современного развития КИ:
– изменения в организации и проведении КИ;
– изменения в исследовании препаратов.
В рамках этих векторов развития отмечены тенденции в КИ 2023 г., представленные в таблице 1.
Таблица 1. Тенденции и тренды в индустрии клинических исследований (КИ)
Table 1. Tendencies and trends in clinical trial (CT) industry
|
№ / No. |
Тенденция/тренд // Tendency/trend |
|
1. Изменения в организации и проведении КИ / Changes in CT organizing and conducting |
|
|
1.1 |
Цифровизация документооборота и образования / Digitalization of document flow and education |
|
1.1.2 |
Cоздание цифровых копий документов по исследованию / Creating digital copies of study documents |
|
1.1.3 |
Разработка цифрового информированного согласия пациента / Developing digital informed patient consent |
|
1.1.4 |
Удаленный мониторинг и проверка первичной документации / Remote monitoring and verification of primary documentation |
|
1.1.5 |
Электронная подача документов в регуляторные органы, этический комитет и т.д. / Electronic submission of documents to regulatory authorities, ethics committee, etc. |
|
1.1.6 |
Электронная индивидуальная регистрационная карта и мастер-файл исследования / Electronic individual registration card and study master file |
|
1.1.7 |
Дистанционное онлайн-обучение исследователей и проектной команды с использованием образовательных платформ / Online distance learning for researchers and project team using educational platforms |
|
1.1.8 |
Регулярные совещания проектной команды, заседания этических комитетов, независимого комитета по мониторингу данных в дистанционном режиме с использованием видеоконференций (Zoom, Skype, Microsoft Teams, Cisco Webex Meetings, GoToMeeting, FreeConference и т.д.) / Regular meetings of the project team, meetings of the ethics committees and independent data monitoring committee in remote mode using video conferencing (Zoom, Skype, Microsoft Teams, Cisco Webex Meetings, GoToMeeting, FreeConference, etc.) |
|
1.1.9 |
Электронная цифровая подпись / Electronic digital signature |
|
1.1.10 |
Удаленный аудит / Remote audit |
|
1.2 |
Централизация КИ / CT centralization |
|
1.3 |
Децентрализация КИ / CT decentralization |
|
1.4 |
КИ на основе реальных клинических данных / CTs based on real world data |
|
1.5 |
Риск-ориентированный подход к организации и проведению КИ / Risk-oriented approach to CT organizing and conducting |
|
1.6 |
Виртуальные доклинические и клинические исследования / Virtual preclinical and clinical trials |
|
1.7 |
Соединенные КИ / Connected CTs |
|
1.8 |
Искусственный интеллект в КИ / Artificial Intelligence in CTs |
|
1.9 |
Персонализация КИ / CT personalization |
|
1.10 |
Внедрение статистики Байеса в КИ / Implementing Bayesian statistics in CTs |
|
1.11 |
КИ с максимальным разнообразием вовлеченных пациентов / CTs with maximum diversity of patients involved |
|
1.12 |
Технологии игр в КИ – смешение игровых технологий с КИ / Gaming technologies in CI – mixing gaming technologies with CTs |
|
1.13 |
Глобальная стандартизация КИ / Global CT standardization |
|
1.14 |
Внедрение телемедицинских технологий в КИ / Implementation of telemedicine technologies in CTs |
|
1.15 |
Одобрение КИ одним этическим комитетом / CT approval by one ethics committee |
|
1.16 |
Проведение КИ крупными аптечными сетями / Conducting CTs by large pharmacy networks |
|
1.17 |
Пациентоцентричные КИ / Patient-centric CTs |
|
1.18 |
КИ с использованием иммуномостов для ускорения вывода на рынок иммунобиологических препаратов / CTs using immunobridging to accelerate the launch of immunobiological drugs to the market |
|
2. Изменения в исследовании препаратов / Changes in drug research |
|
|
2.1 |
Рост числа КИ биотехнологических лекарственных средств, препаратов генной и клеточной терапии. Увеличение доли КИ в области лечения онкологических, нейродегенеративных, орфанных и аутоимунных заболеваний / Increase in the number of CTs in terms of biotechnological drugs, gene and cell therapy drugs. Increased proportion of CTs on the treatment of oncological, neurodegenerative, orphan and autoimmune diseases |
|
2.2 |
КИ известных веществ по новым показаниям (каннабиноиды, талидомид) / CTs of known substances on new indications (cannabinoids, thalidomide) |
Изменения в организации и проведении КИ / Changes in CT organizing and conducting
Цифровизация документооборота и образования
Цифровизация документооборота и образования в КИ в 2024 г. продолжается. На сегодня большинство действий, связанных с проведением КИ, получили свою оцифрованную копию. В частности, ускоряются процессы внедрения электронного информированного согласия, и это позволит увеличить информированность пациентов путем облегчения доступа к данному документу и получения его в любом месте, где находится пациент, а не только в клиническом центре, как в случае с бумажной версией информированного согласия, что в итоге повысит возможность его участия в исследовании.
В 2016 г. FDA выпустило регулирующий документ по внедрению электронного информированного согласия [13]. Помимо преимущества максимальной доступности аспектов исследования электронное согласие может привлекать пациентов из отдаленных регионов. Бумажные оригиналы и копии документов по исследованию также переносятся в цифровой формат, включая первичную документацию, и этому способствует развитие технологий электронных медицинских карт (англ. electronic medical health record, EMHR). Технологии электронной подписи DocuSign3 и оплаты исследователям Popsipay4 позволяют упростить и ускорить платежи.
На наш взгляд, такие современные направления цифровизации и обработки данных, как блокчейн, облачные технологии, кибербезопасность, также относятся к трендам дигитализации КИ5, позволяя сохранять целостность получаемых данных путем невозможности вмешательства извне в уже сгенерированные данные с технологией блокчейна, начиная с момента их генерации.
Удаленный аудит в КИ, так же как и удаленный мониторинг, активно применялись во время пандемии COVID-19 [14].
Централизация
Централизация КИ6 связана с тем, что усложняются процедуры7 для выполнения КИ, которые можно провести только в клиническом центре. С одной стороны, усложнение процедур связано с исследованиями в области генной терапии и клеточных технологий, что требует сложных исследований с высокотехнологичным оборудованием, которые сконцентрированы в крупных клиниках [15], и сосредоточения пациентов в специализированных центрах.
Децентрализация
Децентрализация КИ стала возможна при появлении новых носимых (англ. wearable) пациентом устройств, которые позволяют регистрировать электрокардиограмму (ЭКГ), артериальное давление (АД), электроэнцефалограмму, осуществлять суточное мониторирование ЭКГ, АД, спирометрию и т.д. Совершенствуются возможности удаленной передачи данных [16].
M. Alsumidae указывает, что драйвером для развития децентрализованных исследований является факт, что 70% пациентов живут на расстоянии более чем 2 ч от клинического центра. Автор рассматривает следующие варианты децентрализации: полное отсутствие (т.е. централизованное КИ, когда все процедуры проводятся в исследовательском центре), частичная децентрализация (когда только часть процедур КИ делается удаленно), полностью децентрализованное и централизованное виртуально КИ (когда часть его элементов выполняется удаленно, а часть – централизованно) [17].
Усилению децентрализации также способствуют следующие технологии: мобильные сайты, приложения для смартфонов, повсеместная передача данных и многие другие. Децентрализация дала толчок для развития сестринского ухода в контрактных организациях [18–20].
Данные реальной клинической практики
RWD – данные реальной клинической практики, относящиеся к состоянию здоровья пациента и (или) к процессу оказания медицинской помощи, полученные из различных источников. RWE – доказательства, полученные на основе RWD (клинические доказательства в отношении применения и потенциальной пользы или риска использования лекарственного препарата, полученные на основе сбора и анализа RWD).
Исследования RWD/RWE позволяют изучать любые медицинские данные, генерируемые пациентами в ходе прохождения медицинских процедур, и выявлять те или иные закономерности [21][22]. Планируется использовать RWD/RWE при проведении пострегистрационных КИ и/или при организации фармаконадзора по аналогии с подходом в ограниченных и описанных областях КИ, как, например, в документе Framework for FDA’s Real-World Evidence Program, где детально прописано, в каких именно областях, при каких условиях КИ возможно применение подхода RWD/RWE [23].
Риск-ориентированный подход
Риск-ориентированный подход продолжает оставаться актуальным. В его рамках осуществляется поиск эффективных решений при просчитанных рисках, возникающих в ходе проведения КИ, в частности путей успешного набора пациентов [24].
Виртуальные исследования
Виртуальные доклинические и клинические исследования проводятся на основе математического моделирования многих физиологических и патологических процессов, что позволяет в некоторых случаях отказаться от доклинических исследований. На сегодняшний день FDA может выдать регуляторное разрешение на проведение КИ без доклинических этапов, которое было выпущено в конце 2022 г.8 [25][26].
Соединенные КИ
Рассматривается вопрос об объединенной платформе для доклинических и клинических исследований9, что позволяет рассматривать это как отдельную тенденцию, т.к. она объединяет возможности, открывающиеся при использовании RWD, децентрализованных исследований, и возможность одобрять КИ без тестирования на животных.
Следует отметить, что термин еще не устоялся, под ним могут иметься в виду и исследования, и использование удаленного (без визита в лечебно-профилактическое учреждение) мониторинга функций организма при помощи девайсов (смарт-часы и т.п.) [27][28].
Искусственный интеллект
Активно идет работа над совершенствованием применения ИИ в медицине [29]. В 2023 г. первый разработанный с помощью ИИ лекарственный препарат прошел I фазу КИ10. Из имеющихся в открытом доступе технологий ИИ chatGPT и Google Gemini (до марта 2023 г. – Google Bard) пока находятся на начальной стадии развития11.
Персонализация
Персонализация КИ стала возможна с развитием генных и геномных технологий. Эта тенденция тесно переплетена с тенденций разнообразия пула пациентов, RWD, телемедицины [30]. Если при одобрении нового продукта есть указание на связь с генным маркером, то он считается персонализированным [31] (рис. 1, 2).
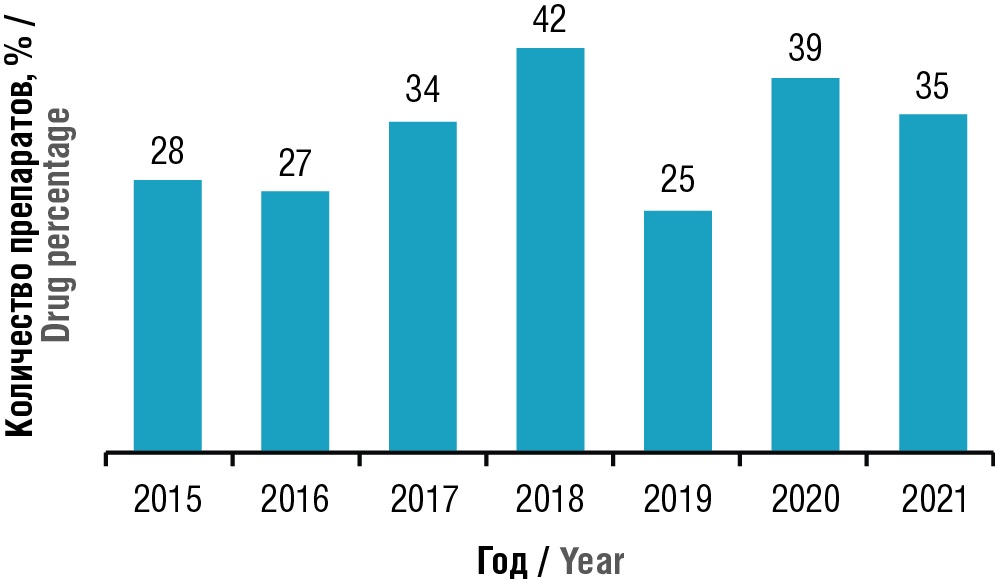
Рисунок 1. Препараты персонализированной медицины, зарегистрированные в США с 2015 по 2021 гг. [30]
Figure 1. Personalized medicine products registered in the USA from 2015 to 2021 [30]
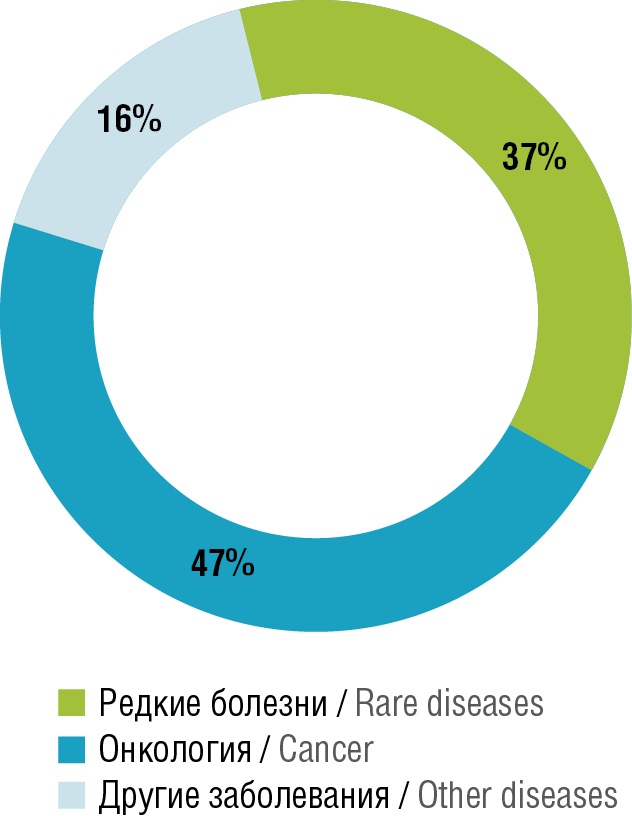
Рисунок 2. Терапевтические области персонализированной медицины – препараты, для которых выданы одобрения Управления по санитарному надзору за качеством пищевых продуктов и медикаментов США в 2021 г. [30]
Figure 2. Therapeutic areas of personalized medicine – drugs approved by the U.S. Food and Drug Administration in 2021 [30]
Из генных технологий, используемых в персонализированных КИ, наиболее известна CRISPR/Cas. Свыше 80 КИ с CRISPR/Cas проводится в настоящее время12: онкология (61%), гематология (19%), иммунология (7%), неврология (5%), офтальмология (3,5%), инфекционные болезни (3,5%), генетика (1%).
Внедрение статистики Байеса
Статистика Байеса позволяет «переставить причину и следствие» по известному факту события и вычислить вероятность того, что оно было вызвано данной причиной. С ее помощью можно ускорить получение результатов в КИ, в частности статистика Байеса применяется в онкологии [32–34].
Максимальное разнообразие пациентов
КИ с максимальным разнообразием вовлеченных пациентов по полу, расе, возрасту и этнической принадлежности является наиболее востребованным на сегодня форматом, т.к. позволяет получить расширенные данные по эффективности и безопасности лекарственного препарата [35]. Чем разнообразнее группы пациентов в КИ, тем больше будет установлено показаний к применению одобренного препарата.
Технологии игр
Созданы международные рабочие группы для внедрения в КИ технологий игр дополненной реальности (англ. augmented reality, AR), смешанной реальности (англ. mixed reality, MR), виртуальной реальности (англ. virtual reality, VR) [36] и расширенной реальности (англ. extended reality, XR).
XR включает в себя AR, MR, VR и любые существующие или будущие технологии в континууме виртуальности13,14. Эти технологии позволяют создавать итерации – экспериментировать виртуально и в реальном времени, не подвергая риску здоровье добровольца или пациента. Кроме того, они сокращают время обработки данных и снижают затраты. AR – это система с тремя основными функциями: сочетание реального и виртуального миров, взаимодействие в реальном времени и точное трехмерное совмещение виртуальных и реальных объектов. MR расширяет возможности, добавляя датчики для сканирования реального мира и создания невидимого виртуального клона. VR формирует опыт полного погружения в виртуальный мир.
Проведение доклинических и клинических испытаний в рамках XR может дать ответы на вопросы об эффективности, количестве, побочных эффектах, периоде полувыведения, а также о взаимодействии с пищей и лекарствами на молекулярном уровне в виртуальной среде. Это значительно снижает затраты и риски еще до начала КИ с участием человека.
Глобальная стандартизация
Глобальная стандартизация КИ предложена G. Koski et al. [37]. Стандартизация процессов с внедрением единых стандартных операционных процедур и системы менеджмента качества на уровне исследовательского центра позволила бы облегчить проведение КИ как в опытных центрах, так и в открываемых впервые.
Телемедицинские технологии
Внедрениe телемедицинских технологий в КИ связано с развитием децентрализованных КИ [38], исследований реальной клинической практики и применения носимых устройств мониторинга состояния здоровья, удаленной передачи данных. Это позволяет на любых расстояниях отслеживать состояние пациента, проводить визиты на дому, сокращая нагрузку на исследовательский центр.
Одобрение одним этическим комитетом
Данная тенденция подразумевает одобрение КИ одним этическим комитетом на все клинические центры в исследовании, и она поддержана регуляторами США [39].
Проведение КИ крупными аптечными сетями
Тренд появился под давлением регуляторов (FDA), которые стремятся к обязательному включению в КИ пациентов различных групп (пола, возраста, расы и др.). Аптечные сети США подхватили эту инициативу, позволяющую создать разнообразие исследуемой популяции. Сети Walgreens, CVS в 2022 г. запустили свои КИ15.
Пациентоцентричность
При использовании принципа пациентоцентричности пациенты и их сообщества активно участвуют в разработке протокола КИ, информированного согласия, подходов к проведению процедур по протоколу [9]. Данный тренд отражает поиск решения проблемы набора пациентов в КИ.
Иммуномосты
Использование иммуномостов (англ. immunobridging)16 как ответ на вызовы, возникшие во время пандемии COVID-19, заключается в перекрестном сравнении точек эффективности при исследовании иммунобиологических препаратов для ускорения вывода на рынок, в частности, новых вакцин [40].
Изменения в исследовании препаратов / Changes in drug research
Второй пул тенденций – это выход на рынок инновационных препаратов в определенной терапевтической области и создание принципиально новых технологий и классов лекарственных средств.
КИ биотехнологических лекарственных средств
В ближайшей перспективе на 5 лет мы ожидаем, что к сохраняющейся тенденции роста КИ биотехнологических препаратов для лечения онкологических, нейродегенеративных, орфанных и аутоиммунных заболеваний добавится тенденция исследования препаратов генной терапии. Из 10 наиболее ожидаемых одобрений FDA [41] новых препаратов 10% – это средства для генной терапии: онкологические препараты (20%), препараты для лечения дегенеративных заболеваний у пожилых (20%), биологические препараты – моноклональные антитела (70%).
Развитие персонализированных КИ тесно связано с развитием исследований на основе RWD, телемедицины, разнообразия пула пациентов. Почти все ожидаемые17 к одобрению в 2023 г. FDA лекарственных средств были препаратами персонализированной медицины (либо генные, либо маркерные), однако в итоге одобрение FDA получили 55 препаратов, из которых 51% были препаратами для лечения орфанных заболеваний, превалировали моноклональные антитела [42].
КИ известных веществ по новым показаниям
Изменения в соотношении одобренных FDA новых малых молекул (англ. new molecular entity, NME) и биологических препаратов (англ. biologics license applications, BLA) показаны на рисунке 3 [43].
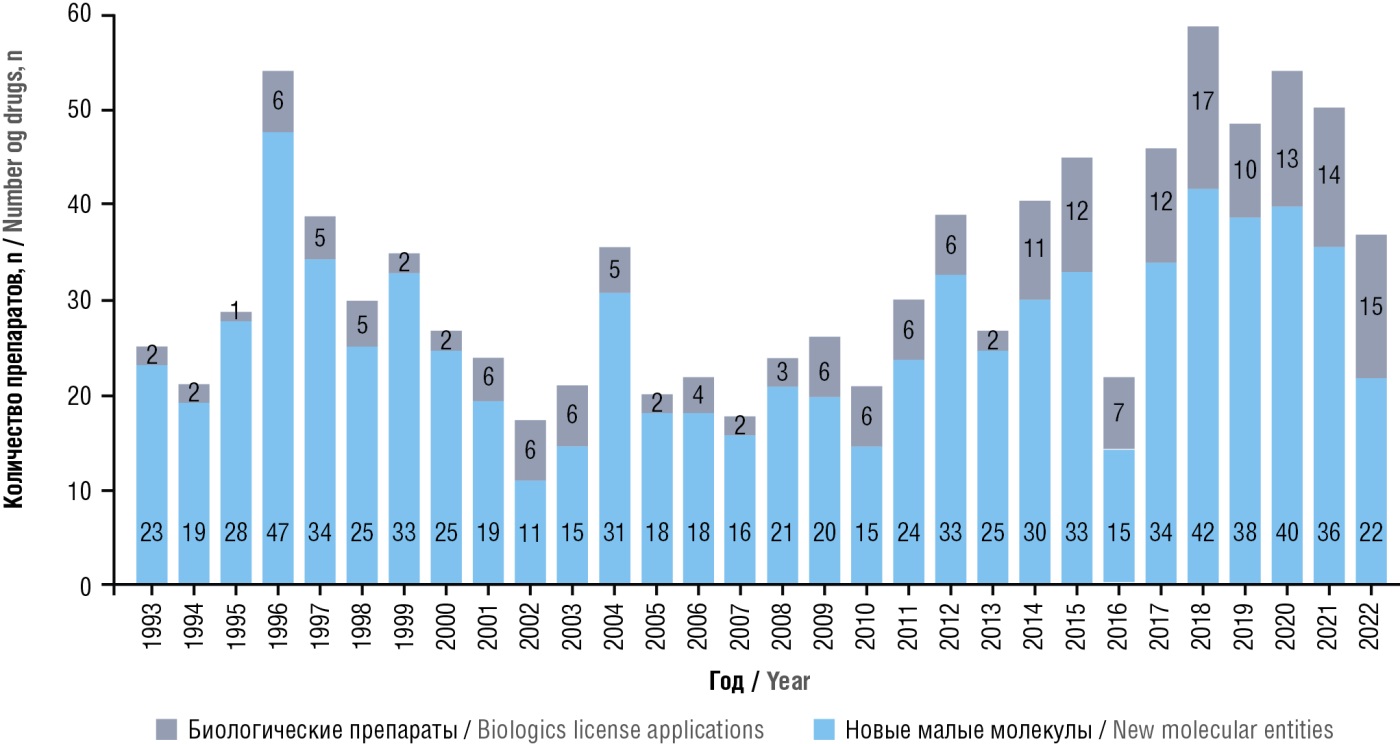
Рисунок 3. Соотношение одобренных Управлением по санитарному надзору за качеством пищевых продуктов и медикаментов США новых малых молекул и биологических препаратов с 1993 по 2022 гг. [41]
Figure 3. Ratio of novel small molecules and biologics approved by the U.S. Food and Drug Administration from 1993 to 2022 [41]
В открытом доступе есть данные о 25 ожидавшихся в 2023 г. одобрений лекарственных средств, где относительное количество биологических препаратов и препаратов персонализированной медицины превалирует над малыми молекулами химического синтеза18.
Новая тенденция – это КИ препаратов, имеющих ограничения по новым показаниям, в частности каннабиноидов19, талидомида [44].
Общие выводы / General findings
Сгруппированные нами группы тенденций в КИ показывают, как динамически меняется в последние годы данная крайне зарегулированная отрасль под воздействием цифровизации и фармацевтических биотехнологий.
В первой группе большинство тенденций сохраняется с предыдущих лет, а новые, в частности проведение КИ в крупных аптечных сетях, появились недавно.
Во второй группе тенденций на первое место вышли препараты персонифицированной (персонализированной) медицины (маркерные препараты генной и биологической терапии). Тем не менее мы считаем, что в разработке лекарственных средств необходимо сделать также упор на новые антимикробные препараты – возможно, биологические [45].
Актуальным является поиск путей успешного набора пациентов [46], который прослеживается в основе риск-ориентированного подхода, децентрализованных исследований. Исходом удачного набора пациентов может служить успех или неуспех КИ20.
Следует обратить внимание, что внедрение инноваций, особенно в области организации и проведения КИ, требует серьезных регуляторных изменений в существующих нормативных документах. В связи с тем, что изменения в сфере разработки инновационных препаратов и организационных аспектов проведения КИ исходят из США [47] и некоторых стран Западной Европы21,22,23, следует ожидать выхода соответствующих рекомендаций и норм FDA и Европейского агентства лекарственных средств (European Medicines Agency, EMA), которые в дальнейшем могут стать основой для обновления правил ICH GCP и Правил надлежащей клинической практики Евразийского экономического союза.
ЗАКЛЮЧЕНИЕ / CONCLUSION
Тенденции в КИ характеризуются целым рядом новаций, связанных в первую очередь с цифровизацией, развитием телемедицинских технологий, математического моделирования, ИИ, виртуальных КИ, децентрализацией и пациентоцентричностью.
КИ становятся персонализированными, эпоха кардиологических «мегатрайлов» малых молекул уходит в прошлое. RWD находят свое применения для подтверждения эффективности и безопасности. Приоритетной для фармкомпаний становится разработка биотехнологических лекарственных средств, препаратов генной и клеточной терапии. Ведущими терапевтическими областями КИ инновационных препаратов являются: онкология, нейродегенеративные, орфанные и аутоимунные заболевания.
Несмотря на то что исследования становятся более технологичными, комфортными и приближенными к пациенту, остаются неразрешимыми некоторые принципиальные проблемы эпохи централизованных КИ, в частности набора пациентов, который продолжает сохраняться как задача, требующая разрешения.
1. https://www.kommersant.ru/doc/3076261.
2. https://florencehc.com/blog-post/decentralized-clinical-trials-what-the-future-holds.
3. https://www.docusign.com.
4. https://www.popsicube.com.
5. https://www.startus-insights.com/innovators-guide/clinical-trial-trends.
6. https://info.advarra.com/trend-report-eb.html.
7. https://info.advarra.com/research-site-perspective-ebook.html.
8. https://www.science.org/content/article/fda-no-longer-needs-require-animal-tests-human-drug-trials.
9. https://share.vidyard.com/watch/CxJrESDy2wFR1J6Nd1pF1e.
10. https://www.eurekalert.org/news-releases/976036.
11. https://www.cnews.ru/news/top/2023-02-17_otets_interneta_predostereg.
12. https://innovativegenomics.org/news/crispr-clinical-trials-2023.
13. https://www.lifescienceleader.com/doc/the-future-of-pharma-lies-in-gaming-technologies-0001.
14. https://medvr.io.
15. https://pharmvestnik.ru/content/news/Aptechnaya-set-Walgreens-zapustit-svou-programmu-klinicheskih-ispytanii.html.
16. https://cdn.who.int/media/docs/default-source/blue-print/doran-fink_4_immunobridging_vrconsultation_6.12.2021.pdf.
17. https://ramaonhealthcare.com/top-10-most-anticipated-drug-launches-of-2023.
18. https://www.drugdiscoverytrends.com/25-potential-blockbusters-to-keep-an-eye-on-in-2023.
19. https://www.forbes.com/sites/dariosabaghi/2021/12/20/pfizer-to-enter-the-medical-cannabis-industry-with-67-billion-acquisition.
20. https://www.fiercebiotech.com/special-reports/2022s-top-10-clinical-trial-flops.
21. https://www.drugdiscoverytrends.com/the-top-10-pharma-ma-deals-of-2022.
22. https://medicalxpress.com/news/2023-02-scientists-breakthrough-generation-cancer-treatment.html.
23. https://www.technologyreview.com/2023/01/09/1064735/us-tech-policy-changing-innovation.
Список литературы
1. Bull J.P. The historical development of clinical therapeutic trials. J Chronic Dis. 1959; 10: 218–48. https://doi.org/10.1016/0021-9681(59)90004-9.
2. Lilienfeld A.M. The Fielding H. Garrison Lecture: Ceteris paribus: the evolution of the clinical trial. Bull Hist Med. 1982; 56 (1): 1–18.
3. Koterov A.N., Tikhonova O.A., Ushenkova L.N., Biryukov A.P. History of controlled trials in medicine: real priorities are little-known. Report 1. Basic concepts, terms, and disciplines that use medical experiment: historical and philosophical sources. FARMAKOEKONOMIKA. Sovremennaya farmakoekonomika i farmakoepidemiologiya / FARMAKOEKONOMIKA. Modern Pharmacoeconomics and Pharmacoepidemiology. 2021; 14 (1): 72–98 (in Russ.). https://doi.org/10.17749/2070-4909/farmakoekonomika.2021.059.
4. Milovanov S. Principal investigators and site in the challenges of clinical trials – recruitment and contemporary tendencies. Clinical Research and Clinical Trials. 2022; 6 (1). https://doi.org/10.31579/2693-4779/108.
5. Kozlov I.G. Monoclonal antibodies: a new era in pharmacology and therapy. Lechebnoe delo. 2006; 1: 26–9 (in Russ.).
6. Anguela X.M., High K.A. Entering the modern era of gene therapy. Annu Rev Med. 2019; 70: 273–88. https://doi.org/10.1146/annurevmed-012017-043332.
7. Belousov D.Yu., Zyryanov S.K., Kolbin A.S. The training manual “Clinical project management”. Kachestvennaya klinicheskaya praktika / Good Clinical Practice. 2017; 3: 80–4 (in Russ.)
8. Rezzan H., Kutub N., VanHouten C., et al. Accelerating clinical trial design and operations. March 9, 2021. Appl Clin Trial. 2021; 30 (3): 25–9.
9. Li B.T., Daly B., Gospodarowicz M., et al. Reimagining patient-centric cancer clinical trials: a multi-stakeholder international coalition. Nat Med. 2022; 28 (4): 620–6. https://doi.org/10.1038/s41591-022-01775-6.
10. Popov V.V., Saverskaya E.N., Bulanova N.A. Clinical trials of drugs: what the doctor-researcher needs to know. Moscow: LARGO; 2022: 206 pp. (in Russ.).
11. Powers E.M., Shiffman R.N., Melnick E.R., et al. Efficacy and unintended consequences of hard-stop alerts in electronic health record systems: a systematic review. J Am Med Inform Assoc. 2018; 25 (11): 1556–66. https://doi.org/10.1093/jamia/ocy112.
12. Moher D., Liberati A., Tetzlaff J., et al. Preferred reporting items for systematic reviews and meta-analyses: the PRISMA statement. Int J Surg. 2010; 8 (5): 336–41. PLoS Med. 2009; 6 (7): e1000097. https://doi.org/10.1371/journal.pmed.1000097.
13. Use of electronic informed consent in clinical investigations – questions and answers. Guidance for institutional review boards, investigators, and sponsors. U.S. Food and Drug Administration. December 2016. Available at: https://www.fda.gov/regulatoryinformation/search-fda-guidance-documents/use-electronic-informedconsent-clinical-investigations-questions-and-answers/ (accessed 12.03.2023).
14. Guidance on remote GCP inspections during the COVID19 pandemic. European Medicines Agency. Available at: https://www.ema.europa.eu/en/documents/regulatory-procedural-guideline/guidanceremote-gcp-inspections-during-covid-19-pandemic_en.pdf (accessed 12.03.2023).
15. Top 8 trends in clinical research for 2023. Clinical Leader. Available at: https://www9.clinicalleader.com/cl-clinical-trends-2023-specialreport/?utm_source=linkedin&utm_medium=social&utm_campaign=clncl-social-02-13-2023 (accessed 12.03.2023).
16. Petrini C., Mannelli C., Riva L., et al. Decentralized clinical trials (DCTs): a few ethical considerations. Front Public Health. 2022; 15 (10): 1081150. https://doi.org/10.3389/fpubh.2022.1081150.
17. Alsumidae M. Scope 2023: adapting to the changing landscape of clinical trials and the biopharmaceutical industry. Available at: https://www.appliedclinicaltrialsonline.com/view/scope-2023-adapting-to-thechanging-landscape-of-clinical-trials-and-the-biopharmaceuticalindustry (accessed 12.03.2023).
18. Grady C., Edgerly M. Science, technology, and innovation: nursing responsibilities in clinical research. Nurs Clin North Am. 2009; 44 (4): 471–81. https://doi.org/10.1016/j.cnur.2009.07.011.
19. Johnson E.A., Hill G., Smith H.A., et al. A global pilot comparative, cross-sectional study of clinical research nurses/research midwives: definition, knowledge base, and communication skills related to the conduct of decentralized clinical trials. J Clin Transl Sci. 2024: 8 (1): e90. https://doi.org/10.1017/cts.2024.535.
20. Stabile S., Franchina V., Testoni S., et al. Perception of decentralized clinical trials and home nursing in oncology clinical research: insights from a survey of clinical research professionals across experimental sites. Int J Clin Trials. 2024; 11 (3): 162–9. https://doi.org/10.18203/2349-3259.ijct20241997.
21. Mukhina S.M., Baranova M.I., Balykina Yu.E. HARPER – protocol template for real-world trials for evaluating treatment efficacy. Real-World Data & Evidence. 2022; 2 (4): 17–25 (in Russ.). https://doi.org/10.37489/2782-3784-myrw
22. Kolbin A.S., Belousov D.Yu. A brief report of real-world evidence development (RWD/RWE) in 2021: United States, Russia, and the Eurasian Economic Union (EAEU). Real-World Data & Evidence. 2022; 2 (1): 1–9 (in Russ.). https://doi.org/10.37489/2782-3784-myrwd-6.
23. Framework for FDA’s Real-World Evidence Program. Available at: https://www.fda.gov/media/120060/download?attachment (accessed 12.10.2024)
24. Gruzdeva A.A., Khokhlov A.L., Ilyin M.V. Risk management strategy for preventing the reduced treatment effectiveness from the position of drug interactions and polypharmacy in patients with coronary heart disease. Res Result Pharmacol. 2020; 6 (4): 85–92. https://doi.org/10.3897/rrpharmacology.6.60164.
25. S.5002 – FDA Modernization Act 2.0. Available at: https://www.congress.gov/bill/117th-congress/senate-bill/5002 (accessed 12.10.2024).
26. Han J.J. FDA Modernization Act 2.0 allows for alternatives to animal testing. Artif Organs. 2023; 47 (3): 449–50. https://doi.org/10.1111/aor.14503.
27. Pothier K., Soriano G., Lussier M., et al. A web-based multidomain lifestyle intervention with connected devices for older adults: research protocol of the eMIND pilot randomized controlled trial. Aging Clin Exp Res. 2018; 30 (9): 1127–35. https://doi.org/10.1007/s40520-018-0897-x.
28. Gomez-Peralta F., Abreu C., Fernández-Rubio E., et al. Efficacy of a connected insulin pen cap in people with noncontrolled type 1 diabetes: a multicenter randomized clinical trial. Diabetes Care. 2023; 46 (1): 206–8. https://doi.org/10.2337/dc22-0525.
29. Singhal K., Azizi S., Tu T., et al. Large language models encode clinical knowledge. Nature. 2023; 620 (7972): 172–80. https://doi.org/10.1038/s41586-023-06291-2.
30. Personalized medicine at FDA. The scope & significance of progress in 2021. Available at: https://www.personalizedmedicinecoalition.org/Userfiles/PMC-Corporate/file/Personalized_Medicine_at_FDA_The_Scope_Significance_of_Progress_in_2021.pdf (accessed 12.03.2023).
31. Rytkin E., Mirzaev K., Bure I., et al. MicroRNAs as novel biomarkers for P2Y12 – inhibitors resistance prediction. Pharmgenomics Pers Med. 2021; 14: 1575–82. https://doi.org/10.2147/PGPM.S324612.
32. A study of ALRN-6924 for protection of chemotherapy-induced side effects in patients with TP53-mutant breast cancer. ClinicalTrials.gov ID NCT05622058. Available at: https://clinicaltrials.gov/ct2/show/NCT05622058 (accessed 12.03.2023).
33. Berry D.A. Bayesian clinical trials. Nat Rev Drug Discov. 2006; 5 (1): 27–36. https://doi.org/10.1038/nrd1927.
34. Fors M., González P. Current status of Bayesian clinical trials for oncology, 2020. Contemp Clin Trials Commun. 2020; 20: 100658. https://doi.org/10.1016/j.conctc.2020.100658.
35. 2020 Drug Trials Snapshots summary report. Available at: https://www.fda.gov/media/145718/download (accessed 12.03.2023).
36. Birckhead B., Khalil C., Liu X., et al. Recommendations for methodology of virtual reality clinical trials in health care by an international working group: iterative study. JMIR Ment Health. 2019; 6 (1): e11973. https://doi.org/10.2196/11973.
37. Koski G., Kennedy L., Tobin M.F., Whalen M. Accreditation of clinical research sites – moving forward. New Engl J Med. 2018; 379 (5): 405–7. https://doi.org/10.1056/NEJMp1806934.
38. Cummins M.R., Soni H., Ivanova J., et al. Narrative review of telemedicine applications in decentralized research. J Clin Transl Sci. 2024; 8 (1): e30. https://doi.org/10.1017/cts.2024.3.
39. Federal register. Available at: https://www.federalregister.gov/documents/search?conditions%5Bpublication_date%5D%5Bis%5D=2022-09-28&conditions%5Btype%5D%5B%5D=PRORULE (accessed 12.03.2023).
40. Access Consortium: alignment with ICMRA consensus on immunobridging for authorising new COVID-19 vaccines. Medicines & Healthcare products Regulatory Agency. Available at: https://www.gov.uk/government/publications/access-consortium-alignment-with-icmraconsensus-on-immunobridging-for-authorising-new-covid-19-vaccines/access-consortium-alignment-with-icmra-consensus-onimmunobridging-for-authorising-new-covid-19-vaccines (accessed 03.04.2023).
41. Drugs to watch 2023. Clarivate. Available at: https://clarivate.com/wp-content/uploads/dlm_uploads/2022/12/J0541_Drugs-to-Watch_Report_2023_V8.2.pdf (accessed 04.04.2023).
42. Novel Drug Approvals for 2023. https://www.fda.gov/drugs/noveldrug-approvals-fda/novel-drug-approvals-2023 (дата обращения 12.10.2024)
43. 2022 FDA approvals. Available at: https://www.nature.com/articles/d41573-023-00001-3 (accessed 12.03.2023).
44. The efficacy and safety of thalidomide combined with low-dose hormones in the treatment of severe COVID-19. ClinicalTrials.gov ID NCT04273581. Available at: https://clinicaltrials.gov/ct2/show/NCT04273581 (accessed 06.06.2023).
45. Hodin M.W. Antimicrobial resistance: a major threat to the promise of healthy aging. Health Affairs. https://doi.org/10.1377/forefront.20230110.717379.
46. Milovanov S.S. Predicting of patient’s enrollment to multicentral international clinical trials of II–III phase. Int J Clin Trials. 2021; 8 (1): 73–8. https://doi.org/10.18203/2349-3259.ijct20210147.
47. A strategic plan for advancing personalized medicine in 2023. Personalized Medicine Coalition. Available at: https://www.personalizedmedicinecoalition.org/Userfiles/PMC-Corporate/file/strategic_plan1.pdf (accessed 12.03.2023).
Об авторах
С. С. МиловановРоссия
Милованов Святослав Сергеевич, к.м.н.
Scopus Author ID: 58575569000
Ленинский пр-т, д. 73/8, Москва 119296
В. В. Попов
Россия
Попов Владимир Васильевич, д.м.н., проф.
WoS ResearcherID: G-9168-2018
Scopus Author ID: 57195756066
Волоколамское ш., д. 11, Москва 125310;
ул. Советская/Коммунальная, д. 93/2, Тамбов 392000
Н. В. Теплова
Россия
Теплова Наталья Вадимовна, д.м.н., проф.
Scopus Author ID: 55199144000
ул. Островитянова, д. 1, Москва 117997
Что уже известно об этой теме?
► С внедрением новых технологий передачи и обработки данных, а также с открытием новых подходов в лечении заболеваний происходят изменения и в проведении клинических исследований (КИ)
► Тенденции в проведении КИ связаны с их децентрализацией и усложнением протоколов, а также с другими возможностями, которые предоставляют современные технологии
► Появление гибридомных технологий, технологий коррекции генов служит вектором для разработок методов лечения и диагностики, которые на сегодняшний день достигли клинических фаз. Все большее число КИ запускается в этом направлении
Что нового дает статья?
► По результатам обзора материалов впервые выделены две большие группы тенденций в КИ – связанные с организацией и проведением КИ и с разработкой инновационных лекарственных препаратов
► В группе тенденций, связанных с организацией и проведением КИ, выделено 18 направлений и подгрупп
► В группе тенденций, связанных с разработкой инновационных лекарственных препаратов, выделено два масштабных тренда
Как это может повлиять на клиническую практику в обозримом будущем?
► Выявленные тенденции позволяют делать долгосрочные прогнозы в планировании различных областей медицинской деятельности, а также ожидать появления методов лечения заболеваний, которые до последнего времени считались неизлечимыми
► Тренды в организации КИ указывают на возможность ускоренного вывода на рынок новых препаратов с более высокой достоверностью данных об эффективности и безопасности
Рецензия
Для цитирования:
Милованов С.С., Попов В.В., Теплова Н.В. Тенденции развития индустрии клинических исследований. ФАРМАКОЭКОНОМИКА. Современная фармакоэкономика и фармакоэпидемиология. 2025;18(1):104-113. https://doi.org/10.17749/2070-4909/farmakoekonomika.2024.257
For citation:
Milovanov S.S., Popov V.V., Teplova N.V. Trends in the industry of clinical trials. FARMAKOEKONOMIKA. Modern Pharmacoeconomics and Pharmacoepidemiology. 2025;18(1):104-113. (In Russ.) https://doi.org/10.17749/2070-4909/farmakoekonomika.2024.257

Контент доступен под лицензией Creative Commons Attribution-NonCommercial-ShareAlike 4.0 International License.






































