Перейти к:
Проблемы использования фенола (гидроксибензола) и парабенов в качестве стабилизаторов фармацевтических средств: анализ с применением методов машинного обучения
https://doi.org/10.17749/2070-4909/farmakoekonomika.2024.263
Аннотация
Актуальность. Фенол и парабены проявляют бактерицидные свойства, сравнительно малотоксичны (в тестах на острую токсичность) и используются в фармацевтической, косметической и пищевой промышленности как стабилизаторы/консерванты конечного продукта. Несмотря на повсеместное применение, долговременные токсикологические эффекты фенола и парабенов остаются практически не исследованными.
Цель: провести анализ результатов фундаментальных и клинических исследований по хронической токсичности фенола и парабенов. Материал и методы. В анализ включены 544 статьи, найденные по запросу “Preservatives, Pharmaceutical [MeSH Terms] AND Phenol [MeSH Terms]” в базе данных биомедицинских публикаций PubMed/MEDLINE. Использованы методы топологического и метрического анализа больших данных, разрабатываемые в научной школе академика РАН Ю.И. Журавлёва. Ключевые слова сортировались по эмпирическим функционалам информативности Рудакова–Торшина в контексте комбинаторной теории разрешимости с последующим комбинаторным тестированием разрешимости для нахождения терминов с наибольшей информативностью.
Результаты. Несмотря на существование отдельных исследований острой токсичности фенола и его производных (в т.ч. парабенов), хроническая токсичность фенола и парабенов остается малоизученной. На этот факт указывает не только отсутствие тщательно выполненных исследований, но и информация в паспортах безопасности, предоставляемая самими производителями соответствующих веществ. Слабо исследованы ассоциации уровней фенола и парабенов в крови с теми или иными хроническими патологиями у человека. В то же время авторы фундаментальных работ если не «бьют тревогу», то настоятельно подчеркивают необходимость проведения крупномасштабных клинических исследований долговременного токсического действия фенола и парабенов. Во-первых, это связано с комплексным эстрогеноподобным действием фенола и парабенов, включающим: 1) воздействие на эстроген-сульфотрансферазы; 2) непосредственные взаимодействия с эстрогеновыми рецепторами; 3) влияние на экспрессию генов стероидных рецепторов. Во-вторых, имеющиеся данные фундаментальных исследований указывают на очевидное стимулирование фенолом/парабенами молекулярных механизмов патофизиологии онкогенеза (систематические нарушения экспрессии генов и соответствующие изменения структуры тканей органов). В-третьих, продемонстрировано тератогенное и прочее токсическое воздействие на эмбрион и беременность, причем не только в экспериментальных исследованиях (нейротоксичность и тератогенез на моделях животных), но и в клинических наблюдениях (нарушения метаболизма организма беременной, в т.ч. метаболизма пуринов и бета-окисления жирных кислот, гиперактивность и/или избыточная масса тела у детей, астма, дисфункция щитовидной железы и др.).
Заключение. Результаты фундаментальных и отдельных клинических испытаний диктуют насущную необходимость изучения ассоциации уровней фенола/парабенов в крови с хроническими патологиями в рамках крупномасштабных клинических исследований поперечного и продольного дизайна. Отсутствие указания на токсическое действие парабенов и фенолов в тех или иных публикациях может быть всего лишь артефактом неверно проведенного анализа данных.
Ключевые слова
Для цитирования:
Торшин И.Ю., Громова О.А. Проблемы использования фенола (гидроксибензола) и парабенов в качестве стабилизаторов фармацевтических средств: анализ с применением методов машинного обучения. ФАРМАКОЭКОНОМИКА. Современная фармакоэкономика и фармакоэпидемиология. 2025;18(1):125-139. https://doi.org/10.17749/2070-4909/farmakoekonomika.2024.263
For citation:
Torshin I.Yu., Gromova O.A. Problems of using phenol (hydroxybenzene) and parabens as pharmaceutical stabilizers: analysis using machine learning methods. FARMAKOEKONOMIKA. Modern Pharmacoeconomics and Pharmacoepidemiology. 2025;18(1):125-139. (In Russ.) https://doi.org/10.17749/2070-4909/farmakoekonomika.2024.263
ВВЕДЕНИЕ / INTRODUCTION
Фенол (также известный как «карболовая кислота») представляет собой ароматический спирт (соединение с гидроксильной группой –ОН) с молекулярной формулой C6H5OH, обладающий характерным резким и въедливым запахом. Несмотря на то что фенол является спиртом, при растворении в воде данное вещество действительно образует кислые растворы (рН 6,5), которые при высоких концентрациях вызывают химические ожоги.
В более широком смысле слово «фенол» также используется для обозначения любого соединения, которое содержит шестичленное ароматическое кольцо, непосредственно связанное с гидроксильной группой –ОН. Таким образом, фенолы представляют собой класс органических соединений, простейшим представителем которого является собственно фенол – C6H5OH (рис. 1).
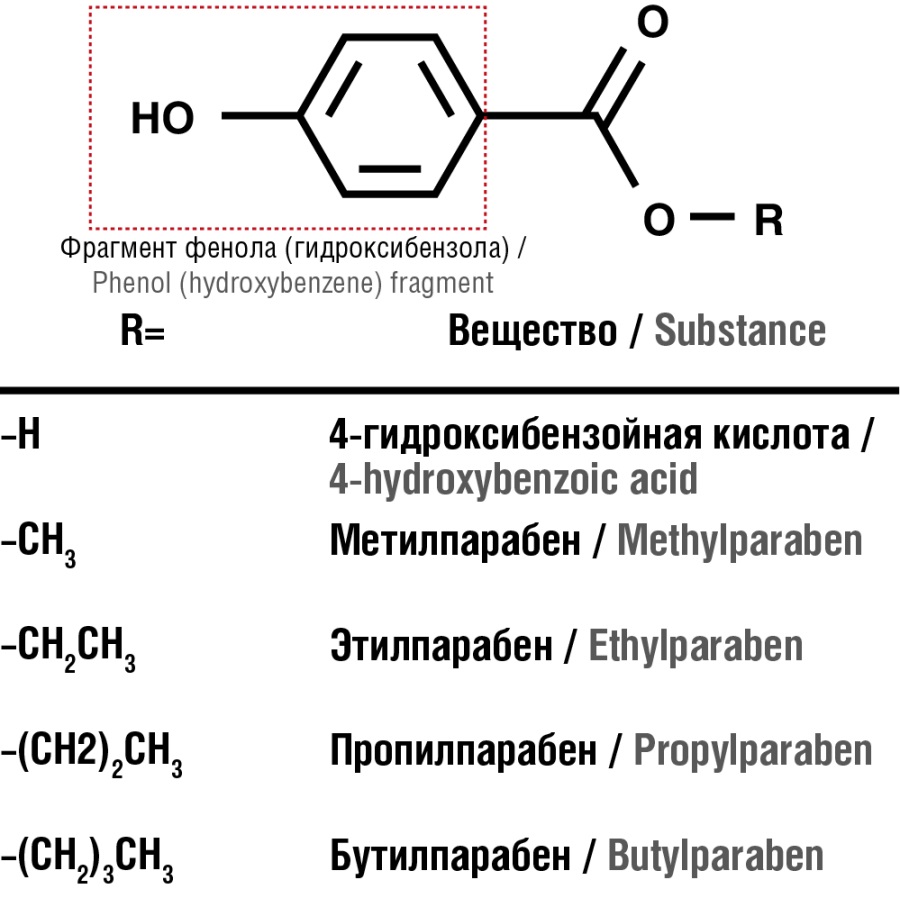
Рисунок 1. Химическая структура фенола и его наиболее часто исследуемых производных – парабенов
Figure 1. Chemical structure of phenol and its most commonly studied derivatives – parabens
В органической химии фенол впервые был извлечен в процессе переработки угля. В настоящее время он является одним из сотен продуктов переработки нефти и применяется в органическом синтезе (производство пластмасс, поликарбонатов, эпоксидных смол, материалов типа бакелит, текстолит, гетинакс, нейлон, моющих средств, гербицидов), медицине (как антисептик, антигрибковый препарат, анестетик при отологических процедурах) и фармацевтике (молекула-предшественник для синтеза салициловой кислоты, стабилизатор отдельных препаратов природного происхождения).
В исторической перспективе фенол использовался как антисептик (в т.ч. внутриматочный) со второй половины XIX века. Несмотря на то что его бактерицидный эффект по механизму схож с действием тепла (E.A. Cooper, 1912 г.) [1], установлена устойчивость к фенолу стафилококков (G.F. Reddish, 1925 г.) [2], а потом и других бактерий: Micrococcus pyogeis var. aureus [3][4]. В частности, бактерии Rhodococcus Phenolicus и Cryptanaerobacter phenolicus вообще могут использовать фенол как единственный источник углерода (т.е. буквально «питаться» им). Вирус энцефаломиелита устойчив к фенолу: в 1% растворе фенола вирус сохраняет активность в течение 5 нед [5].
Существует и ряд курьезных «медицинских применений» данного вещества. Например, один британский ученый в 1936 г. использовал 98,5% водный раствор фенола для подкожного введения в плечо в качестве «лечения простуды у больных туберкулезом легких» [6]. Другой пример: фенол использовался для «местной анальгетической терапии», осуществляемой на самом деле посредством разрушения фенолом болевых нервов [7]. Сообщалось также об облегчении боли при болезни Педжета путем инъекции фенола в симпатические нервы с их последующей деструкцией [8]. Такого рода курьезы напоминают не только об использовании так называемой каломели (HgCl2) в качестве панацеи в период темного европейского средневековья, но и о более недавних экспериментах на людях: инъекции фенола (порядка 1 г) применялись в качестве средства для индивидуальных казней в нацистской Германии, в т.ч. в ходе массовой экстерминации инвалидов [9].
С начала ХХ века фенол использовался для стабилизации препаратов природного происхождения (инсулина и др. – см. далее) [10]. Напомним, что характерной особенностью фенола как консерванта является сильный, резкий и легко узнаваемый запах («пахнет карболкой»). Поскольку фенол проявил в общем-то неплохие качества как антисептик и/или консервант против некоторых бактерий, для устранения коммерчески невыгодной особенности («запах карболки») стали активно проводиться эксперименты с введением карбоксильной группы (–СООН) в пара-(4)-положение бензольного кольца (т.к. в органической химии давно известно, что бензойная кислота имеет гораздо более слабый запах, чем фенол). Кроме того, введение карбоксила позволяет регулировать не только запах, но и гидрофобность, другие химические и биологические свойства путем образования сложных эфиров пара-(4)-гидроксибензойной кислоты (ПГБК) с различными простыми спиртами (метиловым, этиловым, пропиловым, бутиловым, бензиловым и др.). Этим молекулам дали название «парабены» – очевидно, имея в виду пара-положение карбоксила в 4-гидроксибензойной кислоте (см. рис. 1).
В настоящее время парабены все еще применяются как консерванты для пищи, косметики и фармацевтических препаратов, т.к. проявляют родственные фенолу антисептические и фунгицидные свойства. Они входят в регистр пищевых добавок под идентификаторами E218 (метилпарабен), E214 (этилпарабен), E216 (пропилпарабен), E209 (гептилпарабен) и др. ПГБК синтезируют из фенола, а парабены получают в результате этерификации ПГБК соответствующими спиртами. В организме человека возможны взаимопревращения фенола и парабенов (в т.ч. с участием микробиома), в частности гидролиз парабенов и их аэробная трансформация в фенол посредством энтеробактерий человека [11].
Вследствие фенолоподобных противомикробных свойств парабенов на фоне более слабого запаха они повсеместно используются в качестве консерванта в пищевых продуктах, средствах личной гигиены и фармацевтических препаратах, в результате чего постоянно попадают в окружающую среду при смывании косметики или утилизации отходов фармацевтической, пищевой и бумажной промышленности. Парабены были обнаружены в домашней пыли, сточных водах, поверхностных водах рек, они способствуют загрязнению морской воды. Токсическое действие парабенов включает канцерогенез, бесплодие, нарушения эндокринной активности, сперматогенеза, адипогенеза, эмбриогенеза и аллергию. Чтобы утверждать, что парабены безопасны для использования в том виде, в каком они сейчас применяются в косметической, пищевой и фармацевтической промышленности, необходимо учитывать все аспекты токсикологии этих соединений [12].
Цель – провести анализ результатов фундаментальных и клинических исследований по хронической токсичности фенола и парабенов.
МАТЕРИАЛ И МЕТОДЫ / MATERIAL AND METHODS
Методология поиска публикаций / Publication search methodology
Несмотря на кажущийся большим объем научных исследований по токсичности фенола и парабенов (например, по запросу “Phenols/toxicity [MeSH Terms] AND (Drug OR pharmacology)” в базе данных PubMed/MEDLINE найдено 19 306 публикаций, по аналогичному запросу по парабенам – 1530 статей), подавляющее большинство этих работ не имеют ничего общего с фенолом или парабенами, а касаются совершенно иных соединений, содержащих гидроксибензоловые фрагменты.
При анализе результатов запроса “Preservatives, Pharmaceutical [MeSH Terms]” (3314 публикаций) почти четверть работ (795) затрагивает вопросы исследования токсичности и побочных эффектов фармацевтических консервантов (в т.ч. аллергических реакций). В качестве стабилизаторов лекарств исследуются не только парабены и гидроксибензол, но и хлориды бензалкония (антисептик, оказывающий противогрибковое, вирулицидное, антипротозойное действие) и даже ртутьсодержащее соединение тимеросал.
Указанные выборки публикаций крайне неоднородны, включают существенно разные профили токсикологии фенола/парабенов, хлоридов бензалкония и других веществ с антисептическими свойствами. Поэтому в настоящей работе мы остановились на выборке, полученной по запросу “Preservatives, Pharmaceutical [MeSH Terms] AND Phenol [MeSH Terms]”, – найдено 544 статьи. Парабены являются производными фенола, поэтому публикации по парабенам всегда аннотируются ключевым словом «фенол». В данной выборке большинство публикаций относилось именно к свойствам парабенов.
Методы анализа / Methods of analysis
Проведен системный компьютерный анализ массива публикаций с использованием методов топологического и метрического анализа больших данных, разрабатываемых в научной школе академика РАН Ю.И. Журавлёва и неоднократно описанных на страницах журнала [13].
Анализ основан на нахождении наиболее информативных терминов (ключевых слов, их сочетаний, рубрик Международной классификации болезней 10-го пересмотра, разделов международной номенклатуры Gene Ontology и др.) при сравнении выборки литературы с контрольной выборкой публикаций по биомедицине (с целью устранения чересчур общих ключевых слов наподобие «медицина», «терапия» и тысяч других). В качестве контрольной использовалась выборка из 544 текстов, случайно отобранных из массива 881 645 публикаций, найденных по запросу “Pharmaceutical [MeSH Terms] NOT Preservatives NOT Phenol” в базе данных PubMed/MEDLINE.
Все ключевые слова сортировались по эмпирическим функционалам информативности Рудакова–Торшина в контексте комбинаторной теории разрешимости [14]. Затем проводилось комбинаторное тестирование условия разрешимости (как описано в [14]), чтобы из списка терминов выделить только те, которые обладают наибольшей информативностью и принципиально необходимы для выполнимости условия разрешимости. В результате анализа литературы выявлено 65 наиболее информативных биомедицинских терминов, отличающих тексты исследований по теме от публикаций в контроле. На основании данного списка терминов осуществлялся дальнейший поиск и отбор источников для обзора.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ / RESULTS AND DISCUSSION
Направления исследований фенола и парабенов / Research directions for phenol and parabens
Проведенный анализ позволил разделить публикации по различным аспектам исследования фенола и его производных как фармацевтических консервантов на пять рубрик:
– острая токсичность;
– функция биомаркеров крови;
– эстрогеноподобное действие;
– риски опухолевых заболеваний;
– тератогенное и прочее токсическое воздействие на эмбрион и беременность.
Острая токсичность
Токсичность фенола изучалась редко – как правило, сообщалось только о тяжелых случаях [15] или промышленной патологии с отравлением фенолом либо его производными [16]. Представленные в настоящей работе результаты анализа литературы по данному вопросу позволяют утверждать, что долговременная (хроническая) токсичность фенола и, особенно, его производных (парабены и др.) остается практически не изученной. На этот факт постоянно указывают и производители соответствующих веществ в паспортах безопасности (см., например, паспорта безопасности фенола [17] и пропилпарабена [18]).
По показателям острой токсичности даже сам фенол относится к 3-й категории «Вещества умеренно опасные». В самом деле, у крыс значения полумаксимальной летальной дозы (англ. half-maximal lethal dose, LD50) достаточно высоки (перорально 340 мг/кг, ингаляционно более 900 мг/м³, дермально 660 мг/кг). Однако по отношению к гаметоцитам (так называемая мутагенность зародышевой клетки), показателям специфической токсичности, опасности в водной среде и по предельно допустимым концентрациям (ПДК) в воздухе (0,3 мг/м³) фенол относится ко 2-й категории «Вещества высокоопасные» (при работе с веществом требуется специальная защита кожи и глаз) [17]. Фенол и его производные (парабены, хлорфенолы и др.), используемые как антибактериальные консерванты, провоцируют гемолиз эритроцитов [19].
У людей воздействие фенола вызывает раздражение кожи, глаз, носа, горла, потерю массы тела, слабость, истощение, мышечные боли, раздражительность, повреждения печени и почек, ожоги кожи и судороги. Фенол и его пары разъедают глаза и кожу (феноловый дерматит) [20]. Вдыхание паров фенола может вызвать отек легких, приводит к аритмии и судорогам, они гепато- и нефротоксичны [21][22]. Поскольку фенол сравнительно быстро всасывается через кожу, то помимо местных едких ожогов может возникнуть системное отравление. LD50 при пероральной токсичности составляет менее 500 мг/кг для собак, кроликов или мышей; минимальная смертельная доза для человека – 140 мг/кг [23]. Токсическое действие фенола на центральную нервную систему вызывает внезапный коллапс и потерю сознания как у людей, так и у животных. Этим симптомам предшествует состояние спазмов из-за двигательной активности, контролируемой центральной нервной системой [23].
По показателям острой токсичности парабены выглядят намного безопаснее. Например, для пропилпарабена у крыс per os LD50 составляет более 5000 мг/кг, а данных по ингаляционной и дермальной токсичности не имеется. При интоксикации повторными дозами уровень ненаблюдаемого вредного воздействия (англ. no observed effect concentration, NOEC) более 1000 мг/кг. ПДК в воздухе – более 10 мг/м³, что формально относит пропилпарабен (как, впрочем, и другие парабены) к 4-й категории «Малоопасные вещества» [18].
В то же время показатели экотоксичности фенола и парабенов, особенно в водной среде, относят их к характеристике опасности H411 «Токсично для водных организмов с долгосрочными последствиями». Например, полумаксимальная летальная концентрация (англ. half-maximal lethal concentration, LC50) фенола для радужной форели (Oncorhynchus mykiss) составляет 8,9 мг/л [17]. Сопоставимые значения получены для пропилпарабена в случае Danio rerio (рыбка-зебра) – 6,4 мг/л [18]. Токсичность фенола по отношению к дафнии (Ceriodaphnia dubia) и другим водным беспозвоночным выше (полумаксимальная эффективная концентрация (англ. half-maximal effective concentration, ЕС50) 3,1 мг/л) [17], чем у пропилпарабена (EC50 15,4 мг/л) [18], а токсичность по отношению к морским водорослям Pseudokirchneriella subcapitata, наоборот, выше в случае пропилпарабена (EC5 16 мг/л), чем фенола (EC50 61,1 мг/л) [17]. Таким образом, экотоксичность фенола и парабенов по крайней мере сопоставима.
Аллергия на парабены давно известна [24]. Описаны случаи контактного дерматита при использовании парабенов в качестве консервантов в глазных каплях [25]. Пероральная провокация парабенами у пациентов с чувствительностью к ним весьма наглядна: достаточно 100 мг метилпарабена и 100 мг пропилпарабена, чтобы вызвать обострение экземы или дерматита [26].
В двойном слепом рандомизированном исследовании отмечены анафилактоидные кожные реакции после внутривенной региональной анестезии с использованием 0,5% прилокаина с консервантом метилпарабеном (n=100) при сравнении с инъекциями без этого консерванта (n=100). У 17 пациентов в группе с метилпарабеном и только у 4 пациентов в группе без парабена развились эритематозные кожные реакции на внутренней поверхности предплечья после снятия жгута (р<0,05) [27].
Функция биомаркеров крови
Крайне слабо изучены ассоциации между уровнями фенолов и парабенов в крови с различными показателями здоровья у пациентов в поперечных и продольных эпидемиологических исследованиях. С одной стороны, фенол является нормальным продуктом обмена веществ, у человека выводится с мочой в количестве до 40 мг/л [23]. Достаточно давно известно, что уровень фенола в крови повышается на фоне уремии [28] и при почечной недостаточности [29]. Содержание фенола в крови и других биосубстратах повышается после местного применения фенолсодержащих препаратов [30], а также вследствие профессиональных или экологических рисков.
Например, увеличение концентрации фенола (в логарифмической шкале) в моче работников коксовых печей было достоверно ассоциировано с повышением уровня мочевой кислоты (+9,8 мкмоль/л; 95% доверительный интервал (ДИ) 2,20–17,47) и холестерина (+0,1 ммоль/л; 95% ДИ 0,0–0,2) в сыворотке крови [31]. Вследствие биотрансформации бензола в фенол, катализируемой внутриклеточным цитохромом P450 BM3 [32], существует связь между концентрацией фенола в моче и содержанием бензола в атмосфере [33]. Метаболическая активация фенола миелопероксидазой человека в 4,4'-бифенол и дифенохинон играет важную роль в гематопоэтической токсичности, наблюдаемой при хроническом воздействии бензола [34].
Основные метаболиты парабенов в организме человека включают пара-гидроксибензойную кислоту, пара-гидроксигиппуровую кислоту, пара-гидроксибензойный глюкуронид. Поскольку парабены являются ярко выраженными ксенобиотиками, их уровни в крови указывают на активное употребление парабеносодержащих средств (фармацевтических, косметологических) или на неблагоприятную экологическую обстановку (например, загрязнение парабенами водных источников).
Эстрогеноподобное действие
Многие лосьоны для местного применения, солнцезащитные кремы и лекарства содержат парабены в качестве консервантов, которые могут легко проникать через роговой слой в эпидермальный отдел кожи. Парабены ингибируют активность эстрогенсульфотрансферазы кожи человека, что обеспечивает возможную связь с эстрогенными эффектами парабенов.
Эффективность ингибирования сульфотрансферазы повышается по мере увеличения длины цепи сложного эфира парабена. Обнаружено, что бутилпарабен является наиболее активным из парабенов в цитозоле кожи: полумаксимальная концентрация ингибирования (англ. half-maximal inhibitory concentration, IC50) 37±5 мкМ. Бутилпарабен блокирует сульфатирование эстрадиола и эстрона в цитозоле кератиноцитов (но не андрогена дегидроэпиандростерона), что соответствует пролонгированному эстрогеноподобному эффекту. В результате парабены могут напрямую взаимодействовать с рецепторами эстрогенов. Кроме того, ингибируя сульфатирование эстрогенов в коже, парабены косвенно усиливают эстрогенные эффекты за счет повышения уровня эстрадиола [35].
Бутилпарабен оказался самым мощным ингибитором сульфатирования эстрадиола в коже (IC50 37±5 мкМ) – сульфатация полностью блокировалась 1 мМ бутилпарабена. Фракции печени демонстрировали в 18 раз более высокую скорость сульфатирования эстрадиола, чем кожа. В печени значения IC50 для метилпарабена, этилпарабена, пропилпарабена и бутилпарабена составили 330±140, 80±40, 30±5 и 21±5 мкМ соответственно [35].
Вмешательство парабенов в молекулярные эффекты эстрогенов наглядно иллюстрируется тем, что парабены ингибируют раннюю фазу фолликулогенеза и стероидогенеза в яичниках новорожденных крыс. Новорожденным самкам (n=55) ежедневно вводили подкожные инъекции метил-, пропил- и бутилпарабена или 17-бета-эстрадиола (Е2) в течение 1–7-го дней новорожденности. При высоких дозах пропил- и бутилпарабена число примордиальных фолликулов увеличивалось, тогда как число ранних первичных фолликулов уменьшалось [36].
Примордиальные, ранние первичные и первичные фолликулы характеризовались гистологической морфологией гранулезных клеток и ооцита. Примордиальные фолликулы содержали ооцит, окруженный уплощенными плоскими прегранулезными клетками, ранние первичные фолликулы – недифференцированный и неполный слой кубовидной формы и гранулезные клетки (рис. 2), а первичные фолликулы имели полный однослойный кубовидный слой [36].
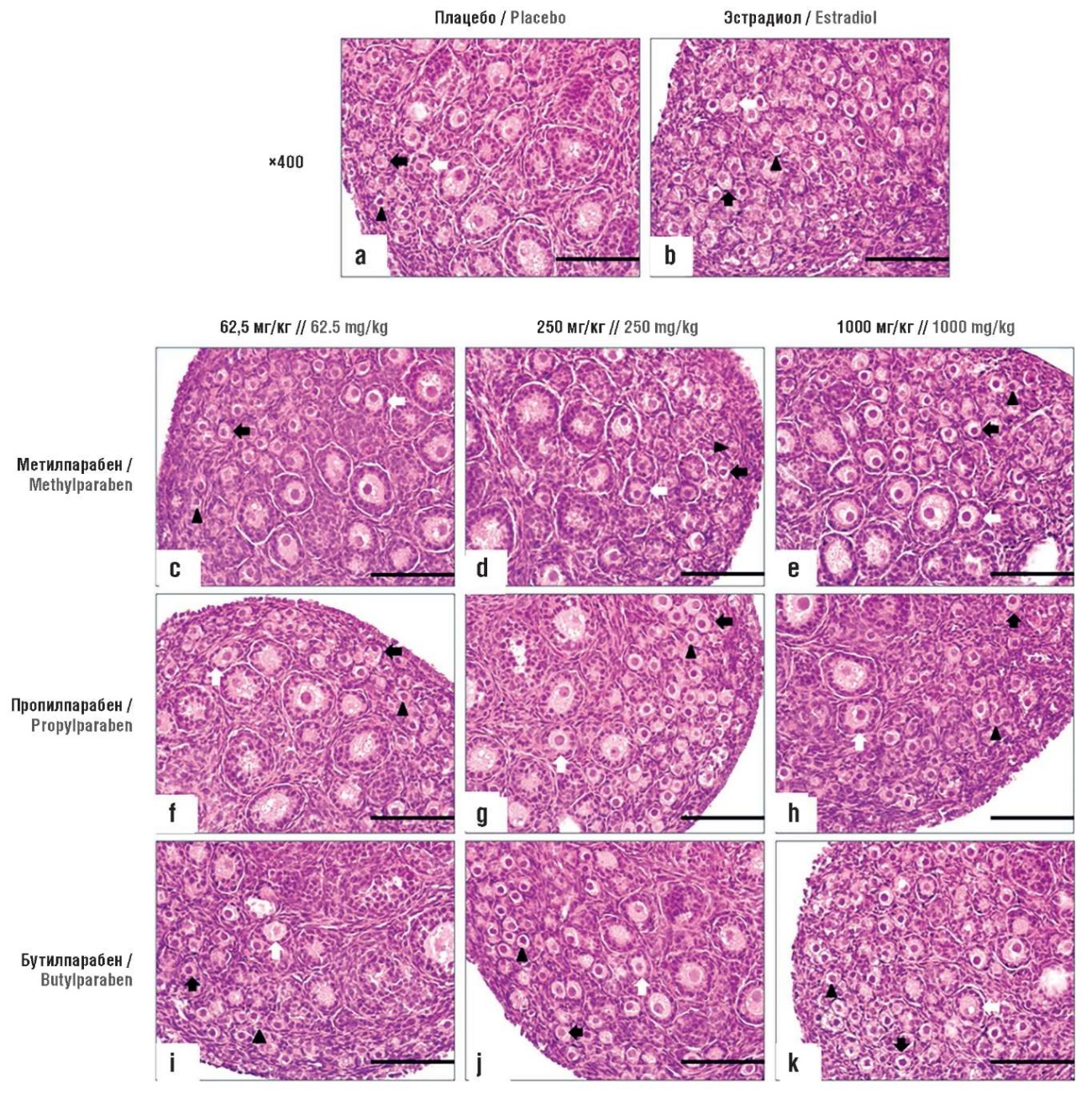
Рисунок 2. Влияние парабенов на фолликулулогенез в яичниках новорожденных крыс (окраска гематоксилином и эозином, увеличение ×400) [36]. Треугольники указывают на примордиальные фолликулы, черные стрелки – на ранние первичные фолликулы, белые стрелки – на первичные фолликулы:
а – плацебо; b – эстрадиол; c–k – 62,5, 250 и 1000 мг/кг/сут метилпарпабена, пропилпарабена и бутилпарабена соответственно
Figure 2. The effect of parabens on folliculogenesis in the ovaries of newborn rats (stained with hematoxylin and eosin, magnification ×400) [36]. Triangles indicate primordial follicles, black arrows – early primary follicles, white arrows – primary follicles:
а – placebo; b – estradiol; c–k – 62.5, 250 and 1000 mg/kg/day of methylparpaben, propylparaben, and butylparaben, respectively
Продукты биотрансформации бензилпарабена, бензилпарабен-о-фенола и бензилпарабен-м-фенола проявляли в 10 раз более высокую проэстрогенную активность (в наномолярном диапазоне концентраций, IC50 300–500 нМ) по сравнению с самим бензилпарабеном (IC50 6400 нМ) [37]. Бутилпарабен и пропилпарабен модулируют концентрацию димера фенола, бисфенола А (БФА) и эстрадиола у самок и самцов мышей (линия CF1). Мышам вводили физраствор, 3 мг бутилпарабена или 3 мг пропилпарабена и через 2–12 ч в моче измеряли уровень эстрадиола. В то время как пропилпарабен слабо влиял на эстрадиол, бутилпарабен значительно повышал его уровни через 6–10 ч после инъекции у самок и через 8 ч после инъекции у самцов [38].
Димер фенола БФА также проявляет эстрогеноподобные свойства, связываясь эстрогеновым рецептором гамма (англ. еstrogen-related receptor gamma, ERRγ) человека. На основании рентгеноструктурного анализа комплекса лиганд-связывающего домена рецептора ERRγ с БФА показано, что аминокислотные остатки Glu275 и Arg316 рецептора ERRγ функционируют как сайт внутреннего связывания фенолгидроксильной группы БФА (т.е. фрагмента БФА, идентичного по структуре фенолу). Водородные связи фенол-Glu275 и фенол-Arg316 стабилизируют фенольное кольцо в связывающем кармане рецептора. Мутагенез кармана рецептора показал, что аминокислотные остатки Leu268, Leu271, Leu309 и Tyr326, в дополнение к Glu275 и Arg316, являются существенной частью фенол-связывающего кармана, а Ile279, Ile310 и Val313 структурно поддерживают карман-образующие остатки, обеспечивая прочное связывание фенольного кольца с ERRγ (рис. 3) [39]. Из полученных данных очевидно, что карман эстрогенового рецептора, участвующий в связывании БФА, также может связывать и молекулу фенола.
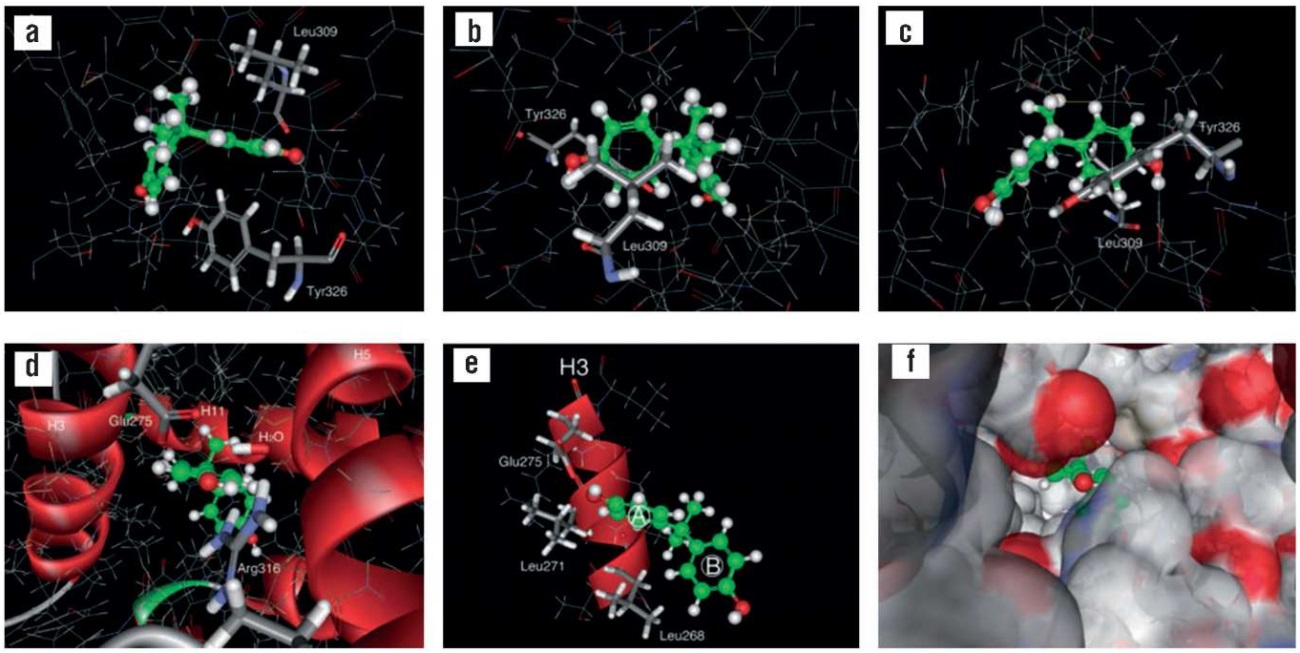
Рисунок 3. Структура сайтов связывания бисфенола А (БФА) в лиганд-связывающем домене рецептора эстрогена [39]:
a – вид взаимодействия сбоку; b – вид сверху от Leu309 и вид снизу от Tyr 326 (oбе метильные группы Leu309 находятся во взаимодействии c фенольным кольцом); c – cэндвич-взаимодействие бензольного A-кольца БФА между остатками Leu309 и Tyr326 в БФА-связывающем кармане; d – cети водородных связей фенольной гидроксильной группы кольца БФА (oстатки Arg316 и Glu275 образуют водородные связи через молекулу воды в кармане связывания БФА); e – взаимодействие между остатками Leu268 и Leu271 и бензольным A-кольцом БФА; f – поверхность кармана, визуализирующая гидроксильно-кислородный фармакофор фенола в кармане, связывающем БФА
Figure 3. Structure of bisphenol A (BPA) binding sites in the ligand-binding domain of estrogen receptor [39]:
a – side view of the interaction; b – top view from Leu309 and bottom view from Tyr 326 (both Leu309 methyl groups interact with the phenolic ring); c – sandwich interaction of BPA benzene A ring between Leu309 and Tyr326 residues in BPA binding pocket; d – hydrogen bonding networks of phenolic hydroxyl group of BPA ring (Arg316 and Glu275 residues form hydrogen bonds through a water molecule in BPA binding pocket); e – interaction between Leu268 and Leu271 residues and BPA benzene A ring; f – pocket surface visualizing the hydroxyl-oxygen pharmacophore of phenol in BPA-binding pocket
Следует подчеркнуть, что фенол/парабены ни в коей мере не представляют собой «аналоги эстрогенов». Вмешиваясь в метаболизм эндогенных эстрогенов, эти молекулы, скорее, являются нарушителями обмена эстрогенов с эффектами, существенно отличными от эффектов эстрогенов.
В частности, эстрадиол регулирует экспрессию генов KIT, STAR и CYP11A1, но не влияет на уровни антимюллерова гормона (АМГ) и гена FOXL2. В то же время под действием пропил- и бутилпарабенов повышались уровни АМГ (вырабатываемого зрелыми фолликулами и действующего как ингибитор фолликулогенеза) и экспрессии гена FOXL2 (регулирующего дифференцировку гранулезных клеток и поддерживающего рост преовуляторных фолликулов). Под действием бутилпарабена повышалась экспрессия фактора стволовых клеток KITL (фактор роста яичников) [36].
После обработки метил-, пропил- и бутилпарабенами значительно снижались уровни экспрессии стероидогенного белка-регулятора STAR (транспортного белка, контролирующего перенос холестерина внутри митохондрий, что является лимитирующей стадией в биосинтезе стероидных гормонов) и фермента CYP11A1 (расщепляющего боковую цепь холестерина) [36].
Таким образом, эстрадиол и парабены по-разному влияют на регуляцию фолликулогенных и стероидогенных генов, так что парабены проявляют как эстрогеноподобные, так и неэстрогенные свойства. Уровни стероидогенных ферментов, индикаторов дифференцировки фолликулов, по-видимому, регулируются парабенами посредством ингибирования их репрессора транскрипции FOXL2 [36].
Приведенный выше анализ взаимодействий парабенов и других производных фенола с эстрогеновыми рецепторами позволяет сформулировать гипотезу о том, что фармакофором токсичности парабенов является фенильная группа. В самом деле, и метил, и этил-, и пропил-/изопропил-, и бутил/изобутил-парабены токсичны, так что замена короткого хвоста спирта (1 атом цикла, метил) на более длинные не только приводит к снижению токсичности, но и может увеличивать ее. Вследствие весьма разных размеров (1–4 атома, т.е. от 0,4 до 1,6 нм) маловероятно, что все эти парабены связываются одним и тем же набором целевых белков через «парабеновую» группу –COOR (R=Me, Et, Pr, Bu). Эти же хвосты не могут разместиться, например, в рассмотренной выше структуре эстрогенового рецептора (см. рис. 3). Соответственно, роль сложного эфира – хвоста состоит не в повышении специфичности взаимодействия с белками, а в обеспечении различной степени донорства электронной плотности в пи-систему фенольной группы (которая и осуществляет свое токсичное воздействие через взаимодействия фенольного фармакофора с белками протеома).
Показаны антиандрогенные свойства парабенов и других молекул, содержащих фенольный фармакофор. В концентрации 10 мкМ метил-, пропил- и бутилпарабены in vitro ингибировали тестостерон-индуцированную транскрипционную активность на 40%, 33% и 19% соответственно (р<0,05) [40].
Патофизиология опухолевых заболеваний
Метилпарабен, нанесенный на кожу, взаимодействует с ультрафиолетом, способствуя старению кожи и повреждению ДНК [41]. Установлена значительная связь между более высоким уровнем фенола и парабенов в образцах мочи и более высокими уровнями экспрессии онкогенов BUB1B, TOP2A, UBE2C, RRM2 и CENPF на агрессивных стадиях рака простаты (более 8 баллов по шкале Глисона) [42]. Высокая концентрация парабенов была обнаружена в раковых опухолях (например, в 18 из 20 случаев рака молочной железы [43]), что может быть связано с чрезмерно частым применением парабеносодержащих антиперспирантов, дезодорантов и т.п. [44].
При воздействии низких доз производных фенола (метилпарабен, триклозан) у крыс в критические периоды развития наблюдаются изменения в гистологии молочной железы и профилях транскриптома. Длительное воздействие парабенов от рождения до лактации было связано с увеличением жировой ткани и уменьшением количества железистой и секреторной ткани, а также с изменениями экспрессии 993 генов, участвующих в таких путях, как синтез холестерина и адипогенез. Гены, на экспрессию которых влиял метилпарабен, были чрезмерно представлены в сигнатурах генов рака молочной железы, что указывает на возможную связь с канцерогенезом [45].
Срезы молочной железы окрашивали трихромом Массона для оценки распределения коллагена в строме и определения относительной доли каждого типа ткани (железистой, жировой, соединительной и секреторной) на каждой стадии развития железы в контрольной и основной группах (рис. 4). Молочные железы от перинатального до пубертатного периода имели оценку 0 для секреторной ткани у всех исследованных животных – следовательно, показан только компонент секреторной ткани крыс, получавших лечение в течение длительного времени (от рождения до лактации). На каждой стадии развития в контрольных молочных железах наблюдались различные гистологические особенности. В перинатальном окне (рис. 4a, 4b) паренхима была рудиментарной, а стромальный отсек был заполнен адипоцитами. Каждая ветвь состояла из одного слоя эпителиальных клеток, окружающих центральный просвет. Препубертатные молочные железы (рис. 4e, 4f) имели разбросанные протоки, выстланные одним или двойным слоем кубовидного эпителия, который становился многослойным, образуя концевые зачатки, состоящие из трех-шести слоев эпителиальных клеток. Высокие темпы пролиферации клеток связаны с увеличением количества клеток в концевых зачатках. В пубертатных железах (рис. 4i, 4j) отмечено усиленное боковое ветвление и образование альвеолярных зачатков, а дольки сложных разветвленных альвеолярных желез были разделены плотной междольковой соединительной тканью и жиром. На рисунках 4m, 4n альвеолы расширились, заполнив железу; по мере установления лактации на этом этапе жир в адипоцитах метаболизировался и происходила мобилизация жира из адипоцитов в эпителиальные клетки альвеол. Одновременно наблюдалось уменьшение количества внутри- и междольковой соединительной ткани. У животных, получавших метилпарабен, в перинатальном окне было значительно уменьшено количество жировой ткани и увеличено расширение дерева протоков внутри жировой подушки (рис. 4c). Препубертатное применение метилпарабена также было связано со значительным уменьшением жировой ткани и увеличением количества железистой ткани (рис. 4g). У пубертатных животных метилпарабен значительно увеличивал количество железистой ткани по сравнению с контролем, что видно по более высокой степени ветвления относительно общей площади желез (рис. 4k) [45].
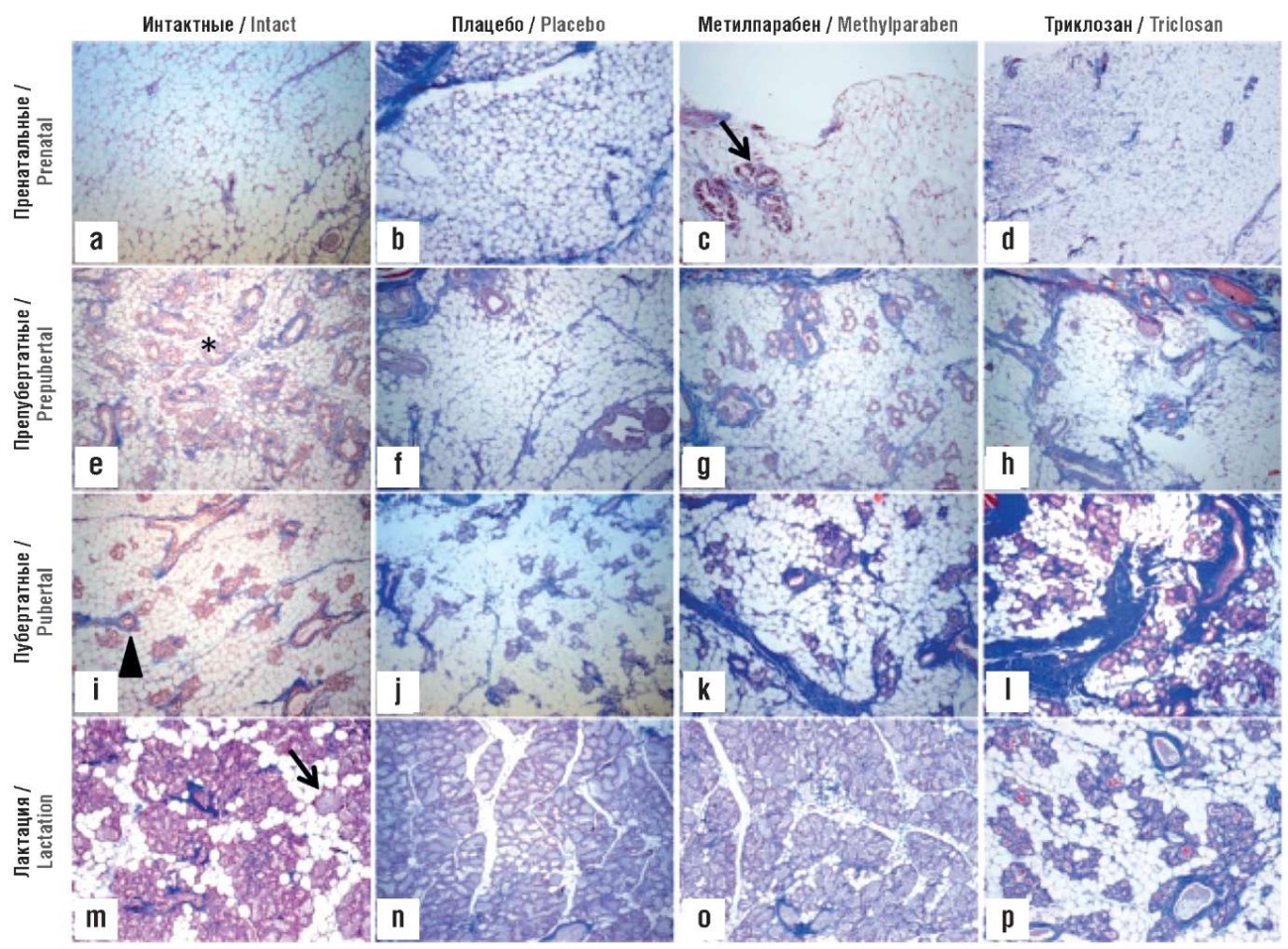
Рисунок 4. Гистология молочной железы с окрашиванием трихромом по Массону (исходное увеличение ×10) [45]:
a, b, d – преобладает стромальный компартмент, заполненный адипоцитами; c – уменьшение жировой ткани, виден зачаток протоков (стрелка); e, f – на рост протоков указывают концевые зачатки (звездочка), преобладает жировая ткань; g, h – уменьшение жировой ткани, более обильное ветвление и концевые зачатки; i, j – ветвление и образование альвеолярных зачатков, стрелка указывает на плотную строму, окружающую протоки; k, l – молочные железы расположены в виде долек сложных разветвленных альвеолярных желез, разделенных плотной междольковой соединительной тканью и жиром; m – секреторные альвеолярные структуры заполняют жировой слой, стрелка указывает на секрецию капель липидов молока в просветные пространства; n, o – наблюдаются полное развитие дольковых структур, заполнение жировой подушки молочной железы и секреция капель молочного жира; p – выраженное уменьшение размеров и количества дольковых структур с увеличением ожирения вокруг скоплений спавшихся альвеол
Figure 4. Breast histology with Masson trichrome staining (original magnification ×10) [45]:
a, b, d – the stromal compartment filled with adipocytes predominates; c – reduced adipose tissue, the rudiment of the ducts is visible (arrow); e, f – the growth of the ducts is indicated by the terminal buds (asterisk), adipose tissue predominates; g, h – reduced adipose tissue, more abundant branching and terminal buds; i, j – branching and formation of alveolar primordia, the arrow indicates the dense stroma surrounding the ducts; k, l – the mammary glands are located in the form of lobules of complex branched alveolar glands, separated by dense interlobular connective tissue and fat; m – secretory alveolar structures fill the fatty layer, the arrow indicates the secretion of milk lipid droplets into the luminal spaces; n, o – full developed lobular structures, filling of mammary gland fat pad and secretion of milk fat droplets are observed; p – a marked decrease in the size and number of lobular structures with an increase in obesity around clusters of collapsed alveoli
Воздействие на эмбрион и беременность
Проспективное исследование беременных в первом триместре (n=221) продемонстрировало, что более высокие концентрации 2,5-дихлорфенола соответствовали увеличению риска прерывания беременности на ранних сроках (отношение шансов (ОШ) 4,8; 95% ДИ 1,1–21) [46]. Воздействие фенолов, парабенов и фталатов на плод стимулирует развитие ожирения у ребенка в более позднем возрасте [47].
Пренатальный эффект фталатов, парабенов и фенолов также связан с повышением риска астмы, ухудшения функции легких и развития аллергии на дыхательные стимулы [48]. Метаболомный анализ мочи беременных (n=88) показал, что парабены нарушают метаболизм пуринов, бета-окисление жирных кислот и регуляцию других биохимических маршрутов [49].
Парабены отрицательно влияли на уровни свободного трийодтиронина (Т3) и соотношение Т3/Т4 (общий тироксин) [50]. У беременных женщин снижался общий Т3 на фоне увеличения бензофенона-3 (–2,1%; 95% ДИ –4,2…0,0) и бутилпарабена (–2,8%, 95% ДИ –5,3…–0,3) [51]. Концентрация фенола в моче матери и ребенка влияют на функцию щитовидной железы у новорожденных и поведенческие проблемы в возрасте до 10 лет. Концентрация БФА в материнской моче была достоверно ассоциирована с повышенным риском когнитивных нарушений по опроснику SDQ1 (ОШ 1,45; 95% ДИ 1,07–1,97), а уровни бензофенона-3 – с ухудшением социального поведения (ОШ 1,6; 95% ДИ 1,0–2,4) в возрасте 10 лет [52].
В пренатальном периоде фенол и парабены влияют на развитие нервной системы [53], включая усиление патофизиологии расстройств аутистического спектра [54]. Обследование детей в возрасте 6–8 лет (n=446) показало, что повышенные концентрации пропилпарабена в моче были ассоциированы с более высокими баллами по шкале K-CPT-22 [55].
Пропилпарабен снижает возбудимость нейронов гиппокампа, блокируя натриевые каналы [56]. Фенол и его хлор-производные повышали цитозольный уровень ионов кальция в эритроцитах человека, стимулировали активацию каспазы-3 и кальпаина, что соответствует инициации фенолами апоптоза эритроцитов [57]. Хроническое воздействие пропилпарабена на эмбрионы и мальков рыбок Danio rerio вызывает развитие долгосрочной нейротоксичности [58].
В последнем исследовании эмбрионы Danio rerio подвергались воздействию двух разных концентраций парабена (10 и 1000 мкг/л, что соответствует потреблению парабена в количестве примерно 0,05–5 мг/сут). Затем оценивались поведенческие фенотипы мальков (поведение в открытом поле, реакция на испуг, циркадианная ритмичность) и экспрессия генов в мозге (в т.ч. CYP19A1B, PAX6A, SHANK3A и GAD1B). Пропилпарабен подавлял экспрессию генов SHANK3A (морфогенез мозга и плавательное поведение, глутамергическая нейротрансмиссия) и GAD1B (глутаматдекарбоксилаза 1b), что указывает на негативное влияние на синаптогенез и развитие нервной системы. Протеомный анализ выявил изменения, связанные с нарушениями обмена липидов [58].
Анализ токсичности парабенов на червях C. elegans позволил получить оценки LD50 при 72-часовом воздействии (от стадии личинки до стадии взрослой особи). Значения LD50 для метил-, этил-, пропил-, бутилпарабена составили 278, 218, 169 и 132 мкг/мл соответственно (рис. 5) [59]. Хроническое воздействие на C. elegans более низкими дозами парабенов (1/5 LD50) приводило к возрастанию внутренней концентрации парабенов почти в 2 раза (от 1,67 до 2,83 мкг/г сухой массы организма). Токсичность парабенов в отношении выживаемости, роста, поведения и размножения C. elegans убывала в ряду бутилпарабен → пропилпарабен → этилпарабен → метилпарабен. У червей, подвергшихся воздействию парабенов, наблюдались значительное снижение активности гена вителлогенина (основного белка ооцита, который транспортирует белки и липиды), высокий уровень активных форм кислорода (АФК) и повышение экспрессии антиоксидантных ферментов на фоне нарушений ядерной локализации регуляторного белка DAF-16 и абнормальной активации сигнальных белков HSF-1 и SKN-1. Следовательно, парабены вызывают эндокринные нарушения, окислительный стресс и токсичность у C. elegans при воздействии в период роста от стадии личинки [59].
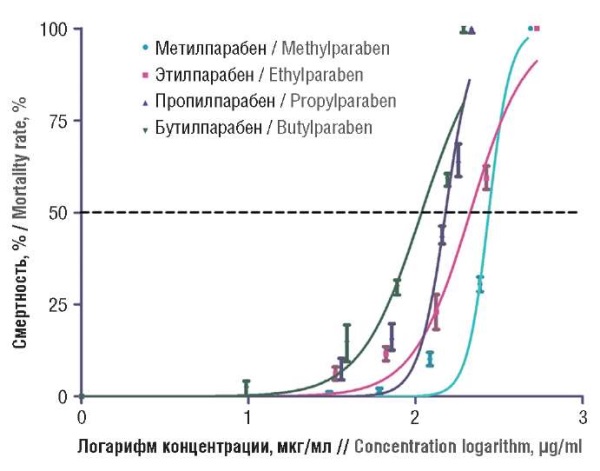
Рисунок 5. Смертность червей C. elegans при воздействии парабенов [59]
Fig. 5. Mortality rate in C. elegans worms due to exposure to parabens [59]
Сравнительный транскрипционный анализ метилпарабена (100 мкМ) и пропилпарабена (10 мкМ) у рыбок Danio rerio показал, что оба парабена дозозависимо токсичны для эмбрионов, приводя к аномалиям развития (дефекты позвоночника, отек перикарда, дефекты пигментации), задержке вылупления и повышению смертности. По тератогенному эффекту и смертности пропилпарабен оказался более токсичным, чем метилпарабен. Анализ экспрессии генов при еще более низких дозах (1 и 10 мкМ) продемонстрировал нарушение регуляции генов, участвующих в реакции на стресс, клеточном цикле и повреждении ДНК, воспалении, метаболизме жирных кислот, эндокринных функциях. В частности, парабены вызывают окислительный стресс, разрывы ДНК, апоптоз. Изменения экспрессии рецепторов андрогенов и эстрогенов указывают на антиандрогенную и эстрогенную активность парабенов [60].
Пороки развития эмбрионов и мальков Danio rerio наблюдались после воздействия метилпарабена (100 мкМ) и пропилпарабена. Эмбрионы дозозависимо светлели в ответ на пробилпарабен (≥25 мкМ) (рис. 6). Воздействие на эмбрионы 50 и 100 мкМ пропилпарабена выявило аномальную морфологию через 72 ч после оплодотворения, а позже, через 96 ч после оплодотворения, эмбрионы сморщились, что привело к 100% смертности. Через 96 ч после оплодотворения воздействие метилпарабена в концентрациях 50, 100 и 200 мкМ вызывало пороки развития (в т.ч. отек перикарда и дефекты позвоночника) [60].
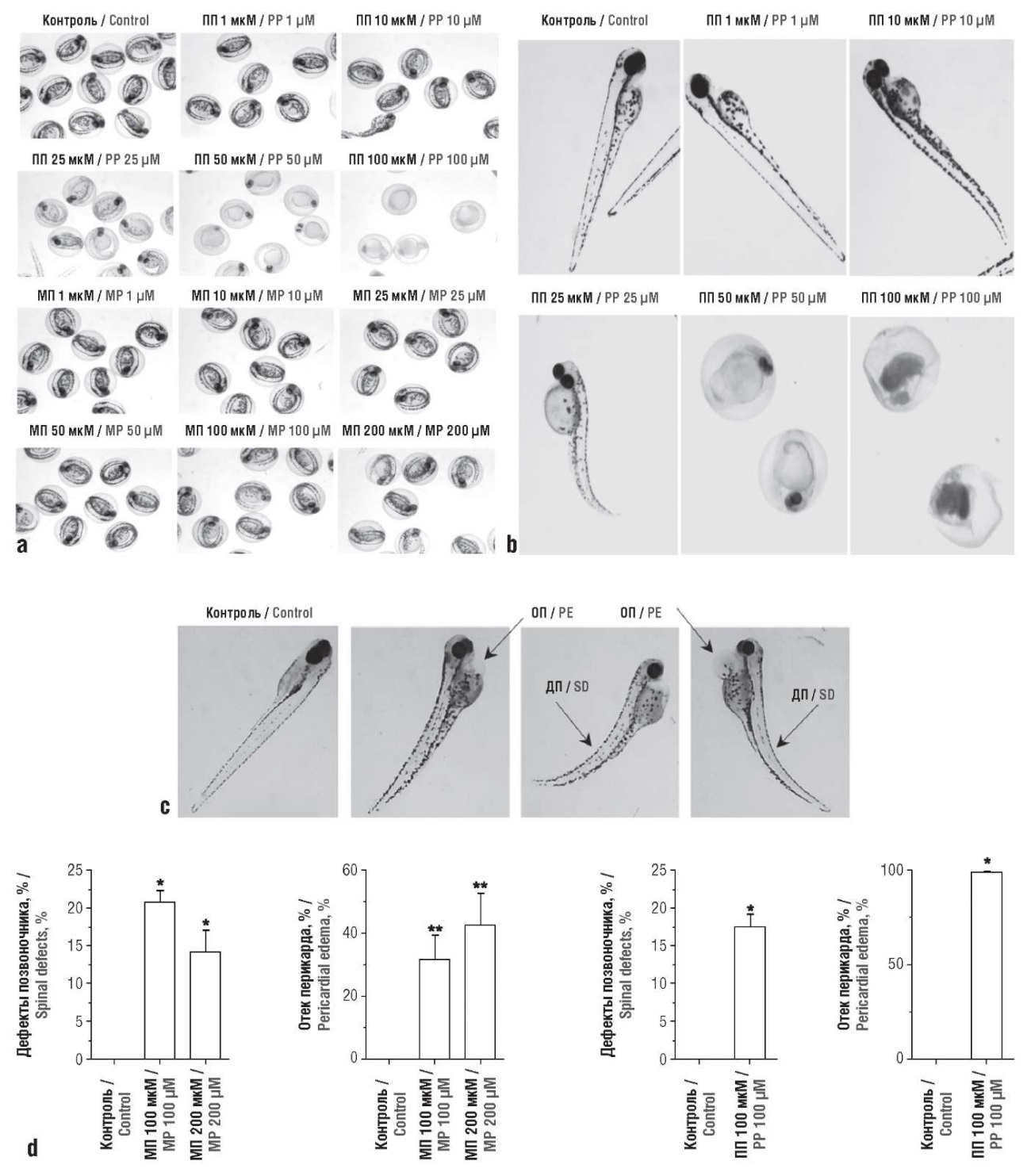
Рисунок 6. Морфология эмбрионов Danio rerio на сроке 72 ч после оплодотворения при воздействии метилпарабена (МП) и пропилпарабена (ПП) [60]:
а – яйца подвергались воздействию различных концентраций МП, и через 72 ч после оплодотворения получены изображения для наблюдения за пороками развития эмбриона; b – эффекты ПП (вещество вызывало фенотипические пороки развития в концентрациях 10 и 25 мкМ, вылупления не наблюдалось при концентрациях 50 мкМ и выше, эмбрионы сокращались при концентрации 100 мкМ); с – репрезентативные пороки развития, вызванные воздействием МП и ПП, – отек перикарда (ОП) и дефект позвоночника (ДП); d – частота развития морфологических аномалий в сравнении с контролем.
* p<0,001. ** p<0,05
Figure 6. Morphology of Danio rerio embryos at 72 hours after fertilization exposed to methylparaben (MP) and propylparaben (PP) [60]:
а – eggs were exposed to various MP concentrations and images were obtained 72 hours after fertilization to observe embryonic malformations; b – PP effects (the substance caused phenotypic developmental defects at concentrations of 10 and 25 µM, no hatching was observed at concentrations of 50 µM and above, embryos contracted at concentration of 100 µM); с – representative malformations caused by exposure to MP and PP – pericardial edema (PE) and spinal defect (SD); d – the rates of morphological anomaly development compared with control.
* p<0,001.** p<0,05
Метил- и бутилпарабены в дозах 100 и 200 мг/кг отрицательно влияют на ферменты антиоксидантной системы, вызывая генотоксичность в семенниках крыс и способствуя развитию мужского бесплодия. Введение парабенов не влияло на потребление воды и пищи, но приводило к статистически значимому снижению массы семенников и семенных пузырьков, особенно в случае бутилпарабена. Отмечено увеличение активности каталазы, супероксиддисмутазы при снижении активности глутатионредуктазы и глутатион-S-трансферазы. Таким образом, наблюдалось увеличение перекисного окисления липидов, которое было наиболее значительным в случае бутилпарабена [61].
Метил-, этил-, пропил- и бутилпарабен генерируют АФК в сперматозоидах человека, дозозависимо ингибируя подвижность и жизнеспособность сперматозоидов. В концентрации, используемой в клинических условиях, метилпарабен ингибировал подвижность сперматозоидов после 2 ч воздействия и, особенно, после 5 ч (p<0,05), снижая жизнеспособность клеток (p<0,01), одновременно увеличивая выработку АФК и окислительное повреждение ДНК [62].
Эпидемиологические исследования показали, что воздействие парабенов на беременную провоцирует развитие избыточного веса у детей. Для бутилпарабена установлена положительная связь с избыточным весом в течение первых 8 лет жизни (особенно у девочек). В эксперименте парабены вызывали более высокое потребление пищи беременными мышами и повышение веса мышат на фоне увеличения размера адипоцитов. Этот эффект сопровождался нарушениями эпигенетического метилирования регуляторных участков промотера гена POMC (проопиомеланокортина), снижая его экспрессию в гипоталамусе (что соответствует нарушению метаболизма энкефалинов и опиоидной нейротрансмиссии) [63].
Использование фенола и парабенов в стабилизации фармацевтических препаратов природного происхождения / The use of phenol and parabens for stabilizing pharmaceuticals of natural origin
Как известно, к препаратам для внутривенного и внутримышечного введения предъявляются особые требования по очистке от тяжелых металлов, содержанию таких консервантов, как хлорид натрия, антигенов животного происхождения, фенолов, парабенов и других ксенобиотических веществ. При производстве препаратов из природного сырья эти требования особенно важны, т.к., например, следы фенола в рыбе указывают на неблагоприятную экологическую среду ее обитания.
Ранее фенол использовался для стабилизации практически всех коммерчески доступных препаратов инсулина, которые, стабилизируя молекулу инсулина, приводили к нежелательной токсичности для тканей печени [10]. Фенол применялся для стабилизации вакцин [64], но вследствие очевидного денатурирующего эффекта, сходного с действием тепла [1], оказывал повреждающее воздействие на их белковые антигены [65].
Современные технологии производства препаратов из животного сырья исключают внесение в них фенола. Степень очистки и способ стабилизации имеют огромное значение для сохранности препарата без потери его эффективности. Например, препарат Церегин® (гидролизат мозга животных) (РУП «Белмедпрепараты», Белоруссия) благодаря стабилизации фенолом (3 мг/мл) и высокому содержанию соли сохраняется в течение 3 лет. Однако именно фенолы и высокая концентрация соли препятствуют его внутривенному введению. Другой препарат, Церебролизин® (ЭВЕР Нейро Фарма ГмбХ, Австрия), также производится на основе гидролизатов мозга животных, но с использованием современных фармацевтических технологий, включая международный стандарт GMP3 и современные методы протеомики. Стандарт обязывает применять не только исходное сырье высокого качества, но и высокоточный протеолиз, стандартизацию белковой фракции, очистку от избытка NaCl и пр. Все эти производственные операции выполняются в щадящих условиях, способствующих сохранности конформаций биологически активных пептидов. В результате препарат сохраняет фармакологическую эффективность в течение всего срока годности (5 лет) без феноловых стабилизаторов, без избытка соли и разрешен для внутривенного введения, в т.ч. детям [66].
Использование фенола/парабенов как стабилизаторов фармпрепаратов может соответствовать более низкому качеству их стандартизации по другим показателям. Например, в пилотное исследование по комплексной оценке качества фармацевтической стандартизации различных экстрактов хондроитина сульфата (ХС) вошли шесть препаратов на экстрактах ХС (табл. 1). Образцы были приобретены в государственных аптеках ГБУЗ «Центр лекарственного обеспечения Департамента здравоохранения г. Москвы». Для каждого экстракта изучено по пять образцов [67]. Оценка качества каждого из препаратов проводилась на основании профилей микроэлементного состава (измеренных атомно-эмиссионной спектрометрией с индуктивно-связанной плазмой), хроматографического анализа, теста на общий белок. Экстракты ХС существенно отличаются друг от друга по суммарному и индивидуальному содержанию токсических микроэлементов. Установлены корреляции между содержанием в них различных химических элементов и степенью очистки от токсических элементов. Показано, что оценки фармацевтического качества исследованных экстрактов ХС по микроэлементному профилю соответствуют оценкам качества по степени очистки от белков и по молекулярно-весовым характеристикам ХС, установленным в результате хроматографических экспериментов [67].
Таблица 1. Исследованные образцы экстрактов хондроитина сульфата (ХС) [67]
Table 1. Studied samples of chondroitin sulfate (CS) extracts [67]
|
Экстракт / Extract |
Краткая характеристика / Brief description |
Стабилизаторы / Stabilizers |
|
ХС-1 / CS-1 |
Экстракт ХС из хрящевой ткани быка / CS extract from bovine cartilage tissue |
Бензиловый спирт, метабисульфит натрия / Benzyl alcohol, sodium metabisulfite |
|
ХС-2 / CS-2 |
Концентрат ХС из морской рыбы / CS concentrate from sea fish |
Фенол / Phenol |
|
ХС-3 / CS-3 |
Экстракт ХС, источник неизвестен / CS extract, unknown source |
Бензиловый спирт / Benzyl alcohol |
|
ХС-4 / CS-4 |
Экстракт ХС, источник неизвестен / CS extract, unknown source |
Бензиловый спирт / Benzyl alcohol |
|
ХС-5 / CS-5 |
Экстракт ХС, источник неизвестен / CS extract, unknown source |
Метилпарабен / Methylparaben |
|
ХС-6 / CS-6 |
Смесь экстрактов ХС животного происхождения / Mixture of CS extracts of animal origin |
Не указаны / Not specified |
Отметим, что в исследовании [67] препарат на основе экстракта ХС-2 (концентрат ХС из морской рыбы) был стабилизирован фенолом, а на основе экстракта ХС-5 – метилпарабеном. Для препарата ХС-6 (смесь экстрактов ХС животного происхождения – гликозаминогликан-пептидный комплекс) стабилизаторы не указаны, жидкость внутри ампулы отличается характерным «фенольным» запахом (гидрокситолуол или другие метилфенолы). Проведенные эксперименты показали, что все три препарата отличались более низким качеством стандартизации и по всем остальным показателям. Например, они не входили в кластер экстрактов, наиболее близких друг к другу по элементному составу и отличающихся лучшим качеством стандартизации микроэлементного состава. Анализ элементного состава экстрактов в осях «эссенциальные – токсические элементы» продемонстрировал наивысшее суммарное содержание токсических микроэлементов именно в этих трех препаратах (ХС-6 – 14,87±1,81 мкг/л, ХС-2 – 9,20 мкг/л, ХС-5 – 8,86 мкг/л, остальные препараты – 1,9–5,5 мкг/л). В координатах «эссенциальные – токсические элементы» экстракты ХС-6, ХС-5 и ХС-2, соответствующие более высокому содержанию токсических элементов, образовывали отдельный кластер. По результатам хроматографического анализа наименьшее количественное содержание ХС отмечено в образцах ХС-2, ХС-5 и ХС-6 на фоне наибольшего содержания белковых примесей, особенно в ХС-6. Экстракту ХС-6, в частности, соответствовал единственный пик калиброванной хроматограммы – 187±22 Да (глюкуроновая кислота или глюкозамин), что соответствует крайне низкому содержанию ХС (см. подробности в работе [67]).
Очевидно, что препараты со столь низким качеством очистки, стандартизации и стабилизации фенолом/парабенами категорически нельзя рекомендовать для внутрисуставного введения (при остеоартрите). Внутренняя выстилка капсулы сустава представлена тонким слоем хондроцитов/синовиоцитов, обеспечивающих скользящую поверхность сустава и чрезвычайно чувствительных к химическим воздействиям. Поэтому повышенное содержание неизвестных белковых примесей и токсических микроэлементов будет провоцировать усиление воспаления. Низкое содержание ХС соответствует практически полному отсутствию лечебного эффекта. Стабилизация такого рода препаратов фенолом и его производными (парабены, гидрокситолуолы и др.) крайне негативно скажется на состоянии синовиоцитов (фенол и его производные даже в малых дозах провоцируют дерматиты у пациентов с химической чувствительностью к этим соединениям – см. выше).
В результате проведения экспериментального исследования [67] стало очевидно, что наилучшим качеством стандартизации (по данным микроэлементного профиля, степени очистки от опасных белковых примесей и молекулярно-весовым характеристикам ХС) отличался экстракт ХС-1, полученный из трахеи быка. Для ХС-1 заявлена степень очистки более 99%. Именно он является действующим началом препарата Хондрогард® (ЗАО «ФармФирма Сотекс», Россия) [67]. Субстанция ХС в этом препарате стабилизирована с использованием стандартных компонентов – бензилового спирта (9 мг) и антиоксиданта метабисульфита натрия (1 мг).
Заметим, что бензиловый спирт используется в качестве стабилизатора многочисленных инъекционных лекарственных средств, включая ингибитор ангиотензинпревращающего фермента Энап® (КРКА д.д., Ново место, Словения), нестероидный противовоспалительный препарат Кетонал® (Сандоз д.д., Словения), антиаритмик Кордарон® (Санофи Винтроп Индустрия, Франция), препараты для лечения заболеваний центральной нервной системы Комплигам B® (ЗАО «ФармФирма «Сотекс», Россия), Витаксон® (ООО «ДЕКО», Россия) и др. [68]. Данное вещество относится к 3-му классу токсичности (LD50 для острой токсичности составляет 1200 мг/кг у крыс), т.е. «умеренно опасные» вещества по ГОСТ 12.1.007-76 «Вредные вещества» (LD50 в диапазоне 151–5000 мг/кг), быстро метаболизируется в еще менее токсичную бензойную кислоту (LD50 1700–3700 мг/кг), конъюгируется с глицином в печени и выводится как гиппуровая кислота [69].
Перспективно дальнейшее изучение эффектов фенола, парабенов, бензилового спирта с использованием новых методов интеллектуального анализа клинических данных, превосходящих методы так называемой биостатистики по чувствительности и воспроизводимости результатов на различных выборках данных [70].
ЗАКЛЮЧЕНИЕ / CONCLUSION
Инъекционные формы препаратов (для подкожного, внутримышечного, внутривенного введения) используются чуть более 100 лет. За это время несколько раз менялся выбор вспомогательных веществ, применяемых как консерванты. От повсеместного применения NaCl и фенола был осуществлен переход к парабенам, а затем к бензиловому спирту, метабисульфиту натрия и другим более безопасным стабилизаторам. Поэтому при анализе препаратов необходимо обращать пристальное внимание не только на действующее вещество, но и на выбор вспомогательных веществ – консервантов, используемых в инъекционных формах.
В настоящее время стабилизация лекарственных средств фенолом или парабенами является устаревшей фармацевтической технологией. В отдельных странах (например, во Франции) запрещено регистрировать препараты, содержащие определенные парабены. Результаты представленного анализа показывают, что на фоне неполной изученности хронической токсичности фенола/парабенов в клинике стало очевидно их негативное влияние на обмен эстрогенов и андрогенов (условно, проэстрогенное и антиандрогенное действие), а также стимулирование патофизиологии онкогенеза (систематические нарушения экспрессии генов), тератогенное действие и эмбриотоксичность. В частности, в клинических исследованиях установлены связи между поступлением парабенов в организм беременной и нарушениями метаболизма с последующим долговременным негативным воздействием на здоровье детей (гиперактивность и синдром дефицита внимания, избыточная масса тела, астма, дисфункция щитовидной железы).
С точки зрения клинической практики патогенетический эффект малых доз токсикантов усиливается с возрастом пациента, в т.ч. вследствие частичного снижения функционирования органов детоксикации (печени и почек) и наличия коморбидных заболеваний. Некоторые лекарственные средства применяются длительно. Например, рекомендованный курс инъекций препаратов на основе ХС при остеоартрите различного генеза составляет 25–30 инъекций с режимом дозирования внутримышечно через день, причем для поддержки ремиссии он может повторяться 2–3 раза в год. Если используемые препараты, содержащие ХС или, предположительно, влияющие на его биосинтез, содержат фенол или парабены (пусть и в малых количествах), то такое «лечение» существенно повышает токсическую нагрузку на различные органы и системы организма. Квазиэстрогенное и антиандрогенное действие фенолов/парабенов даже в малых дозах приводит к повышению онкориска. При попытках внутрисуставного введения такого рода препаратов они будут оказывать прямой раздражающий эффект на ткани сустава.
Отметим также, что отсутствие указания на токсическое действие парабенов и фенолов в отдельных клинических исследованиях может быть всего лишь артефактом неграмотно проведенного анализа данных. Процедуры статистической обработки результатов, используемые в подавляющем большинстве публикаций, основаны на подходах, разработанных более 100 лет назад. Современные методы анализа больших данных, в т.ч. с привлечением математически обоснованных технологий искусственного интеллекта на основе топологической теории распознавания, позволяют выявлять статистически достоверные и прогностически ценные закономерности, игнорируемые большинством методов так называемой биостатистики. Применение новых решений, основанных на интеллектуальном анализе клинических данных, при изучении проблемы выявления эффектов фенола/парабенов является перспективным направлением дальнейших исследований.
1. SDQ (англ. Strengths and Difficulties Questionnaire) – опросник «Сильные стороны и трудности», который применяется для оценки поведения у детей и подростков.
2. K-CPT-2 (англ. Conners Kiddie Continuous Performance Test, 2nd Edition) – тест непрерывной работоспособности Коннерса, который оценивает дефицит внимания у детей 4–7 лет.
3. GMP (англ. good manufacturing practice) – надлежащая производственная практика.
Список литературы
1. Cooper E.A. On the relations of phenol and meta-cresol to proteins; a contribution to our knowledge of the mechanism of disinfection. Biochem J. 1912; 6 (4): 362–87. https://doi.org/10.1042/bj0060362.
2. Reddish G.F. The resistance to phenol of staphylococcus aureus. Am J Public Health. 1925; 15 (6): 534–8. https://doi.org/10.2105/ajph.15.6.534.
3. Berger H., Wyss O. Studies on bacterial resistance to inhibition and killing by phenol. J Bacteriol. 1953; 65 (1): 103–10. doi: https://doi.org/10.1128/jb.65.1.103-110.1953.
4. Slonim D., Diawara S.M., Brázdová R. Effect of 1 percent phenol on several bacterial and viral species. J Hyg Epidemiol Microbiol Immunol. 1969; 13 (3): 313–20.
5. Gwatkin R. Phenol as a preservative of brain tissue. Can J Comp Med Vet Sci. 1942; 6 (7): 191–6.
6. Farrell W.A. The Therapeutic value of phenol. Can Med Assoc J. 1936; 34 (1): 98.
7. Gupta S., Ashrith G., Chandra D., et al. Acute phenol poisoning: a lifethreatening hazard of chronic pain relief. Clin Toxicol. 2008; 46 (3): 250–3. https://doi.org/10.1080/15563650701438888.
8. Reid W. The relief of pain in osteitis deformans (Paget's disease of bone) by phenol injection of the sympathetic chain. Scott Med J. 1960; 5: 71–5. https://doi.org/10.1177/003693306000500204.
9. Lifton R.J. The Nazi doctors: medical killing and the psychology of genocide. Basic Books; 1988: 576 pp.
10. Sykes G., Hooper M.C. Phenol as the preservative in insulin injections. J Pharm Pharmacol. 1954; 6 (8): 552–7. https://doi.org/10.1111/j.2042-7158.1954.tb10986.x.
11. Valkova N., Lépine F., Valeanu L., et al. Hydrolysis of 4-hydroxybenzoic acid esters (parabens) and their aerobic transformation into phenol by the resistant Enterobacter cloacae strain EM. Appl Environ Microbiol. 2001; 67 (6): 2404–9. https://doi.org/10.1128/AEM.67.6.2404-2409.2001.
12. Fransway A.F., Fransway P.J., Belsito D.V., Yiannias J.A. Paraben toxicology. Dermatitis. 2019; 30 (1): 32–45. https://doi.org/10.1097/DER.0000000000000428.
13. Torshin I.Yu. The study of the solvability of the genome annotation problem on sets of elementary motifs. Pattern Recognit Image Anal. 2011; 21: 652–62. https://doi.org/10.1134/S1054661811040171.
14. Журавлёв Ю.И., Рудаков К.В., Торшин И.Ю. Алгебраические критерии локальной разрешимости и регулярности как инструмент исследования морфологии аминокислотных последовательностей. Труды Московского физико-технического института. 2011; 3 (4): 45–54.
15. Bennett I.L. Jr., James D.F., Golden A. Severe acidosis due to phenol poisoning; report of two cases. Ann Intern Med. 1950; 32 (2): 324–7. https://doi.org/10.7326/0003-4819-32-2-324.
16. Mancuso T.F. Industrial poisoning: phenol and related compounds. Ohio State Med J. 1955; 51 (7): 672.
17. Паспорт безопасности. Фенол. Версия 18.0. URL: https://www.borealisgroup.com/storage/Datasheets/PHENOL-MSDS-RU-RU-V18-SDS-RU-5110-10024772.pdf (дата обращения 15.06.2024).
18. Propylparaben safety data sheets. Available at: https://www.echemi.com/sds/propylparaben-pd20150901017.html (accessed 15.06.2024).
19. Ansel H.C., Cadwallader D.E. Hemolysis of erythrocytes by antibacterial preservatives. J Pharm Sci. 1964; 53: 169–72. https://doi.org/10.1002/jps.2600530213.
20. Ceresa C. Professional phenol dermatitis. Med Lav. 1948; 39 (3): 80–2.
21. Lin T.M., Lee S.S., Lai C.S., Lin S.D. Phenol burn. Burns. 2006; 32 (4): 517–21. https://doi.org/10.1016/j.burns.2005.12.016.
22. Warner M.A., Harper J.V. Cardiac dysrhythmias associated with chemical peeling with phenol. Anesthesiology. 1985; 62 (3): 366–7. https://doi.org/10.1097/00000542-198503000-00030.
23. Weber M., Weber M., Kleine-Boymann M. Phenol. In: Ullmann's encyclopedia of industrial chemistry. Wiley; 2003: 589–604. https://doi.org/10.1002/14356007.a19_299.pub2.
24. Castelain F., Castelain M. Parabens: a real hazard or a scare story? Eur J Dermatol. 2012; 22 (6): 723–7. https://doi.org/10.1684/ejd.2012.1835.
25. Vilaplana J., Romaguera C. Contact dermatitis from parabens used as preservatives in eyedrops. Contact Dermatitis. 2000; 43 (4): 248.
26. Veien N.K., Hattel T., Laurberg G. Oral challenge with parabens in paraben-sensitive patients. Contact Dermatitis. 1996; 34 (6): 433. https://doi.org/10.1111/j.1600-0536.1996.tb02252.x.
27. Kajimoto Y., Rosenberg M.E., Kyttä J., et al. Anaphylactoid skin reactions after intravenous regional anaesthesia using 0.5% prilocaine with or without preservative – a double-blind study. Acta Anaesthesiol Scand. 1995; 39 (6): 782–4. https://doi.org/10.1111/j.1399-6576.1995.tb04170.x.
28. Nesbit R.M., Burk L.B., Olsen N.S. Blood level of phenol in uremia. Arch Surg (1920). 1946; 53: 483–8. https://doi.org/10.1001/archsurg.1946.01230060491013.
29. Warres H.L. Blood phenol in renal insufficiency. J Urol. 1954; 71 (2): 134–43. https://doi.org/10.1016/S0022-5347(17)67765-6.
30. Ruedemann R., Deichmann W.B. Blood phenol level after topical application of phenol-containing preparations. J Am Med Assoc. 1953; 152 (6): 506–9. https://doi.org/10.1001/jama.1953.03690060022008.
31. Sun M., Li H., Zhou X.L., et al. Association of urinary phenol concentration and blood biochemical indices in coke oven workers. Zhonghua Lao Dong Wei Sheng Zhi Ye Bing Za Zhi. 2020; 38 (6): 440–3 (in Chinese). https://doi.org/10.3760/cma.j.cn121094-20191212-00561.
32. Karasawa M., Stanfield J.K., Yanagisawa S., et al. Whole-cell biotransformation of benzene to phenol catalysed by intracellular cytochrome P450BM3 activated by external additives. Angew Chem Int Ed Engl. 2018; 57 (38): 12264–69. https://doi.org/10.1002/anie.201804924.
33. Jindrichova J. Relation between the phenol content of the urine and the benzene content of the atmosphere, as verified by field work (in Czech). Prac Lek. 1958; 10 (2): 131–4.
34. Eastmond D.A., Smith M.T., Ruzo L.O., Ross D. Metabolic activation of phenol by human myeloperoxidase and horseradish peroxidase. Mol Pharmacol. 1986; 30 (6): 674–9.
35. Prusakiewicz J.J., Harville H.M., Zhang Y., et al. Parabens inhibit human skin estrogen sulfotransferase activity: possible link to paraben estrogenic effects. Toxicology. 2007; 232 (3): 248–56. https://doi.org/10.1016/j.tox.2007.01.010.
36. Ahn H.J., An B.S., Jung E.M., et al. Parabens inhibit the early phase of folliculogenesis and steroidogenesis in the ovaries of neonatal rats. Mol Reprod Dev. 2012; 79 (9): 626–36. https://doi.org/10.1002/mrd.22070.
37. Chen G., Niu X., Chen Y., et al. Estrogenic disruption effects and formation mechanisms of transformation products during photolysis of preservative parabens. Sci Total Environ. 2024; 924: 171608. https://doi.org/10.1016/j.scitotenv.2024.171608.
38. Pollock T., Weaver R.E., Ghasemi R., deCatanzaro D. Butyl paraben and propyl paraben modulate bisphenol A and estradiol concentrations in female and male mice. Toxicol Appl Pharmacol. 2017; 325: 18–24. https://doi.org/10.1016/j.taap.2017.04.001.
39. Liu X., Matsushima A., Nakamura M., et al. Fine spatial assembly for construction of the phenol-binding pocket to capture bisphenol A in the human nuclear receptor estrogen-related receptor γ. J Biochem. 2012; 151 (4): 403–15. https://doi.org/10.1093/jb/mvs008.
40. Chen J., Ahn K.C., Gee N.A., et al. Antiandrogenic properties of parabens and other phenolic containing small molecules in personal care products. Toxicol Appl Pharmacol. 2007; 221 (3): 278–84. https://doi.org/10.1016/j.taap.2007.03.01541.
41. Handa O., Kokura S., Adachi S., et al. Methylparaben potentiates UV-induced damage of skin keratinocytes. Toxicology. 2006; 227 (1–2): 62–72. https://doi.org/10.1016/j.tox.2006.07.018.
42. Alwadi D., Felty Q., Roy D., et al. Environmental phenol and paraben exposure risks and their potential influence on the gene expression involved in the prognosis of prostate cancer. Int J Mol Sci. 2022; 23 (7): 3679. https://doi.org/10.3390/ijms23073679.
43. Harvey P.W., Everett D.J. Significance of the detection of esters of p-hydroxybenzoic acid (parabens) in human breast tumours. J Appl Toxicol. 2004; 24 (1): 1–4. https://doi.org/10.1002/jat.957.
44. McGrath K.G. An earlier age of breast cancer diagnosis related to more frequent use of antiperspirants/deodorants and underarm shaving. Eur J Cancer Prev. 2003; 12 (6): 479–85. https://doi.org/10.1097/00008469-200312000-00006.
45. Gopalakrishnan K., Teitelbaum S.L., Lambertini L., et al. Changes in mammary histology and transcriptome profiles by low-dose exposure to environmental phenols at critical windows of development. Environ Res. 2017; 152: 233–43. https://doi.org/10.1016/j.envres.2016.10.021.
46. Rosen Vollmar A.K., Weinberg C.R., Baird D.D., et al. Urinary phenol concentrations and fecundability and early pregnancy loss. Hum Reprod. 2023; 38 (1): 139–55. https://doi.org/10.1093/humrep/deac230.
47. Ouidir M., Cissé A.H., Botton J., et al. Fetal and infancy exposure to phenols, parabens, and phthalates and anthropometric measurements up to 36 months, in the longitudinal SEPAGES cohort. Environ Health Perspect. 2024; 132 (5): 57002. https://doi.org/10.1289/EHP1364448.
48. Berger K., Coker E., Rauch S., et al. Prenatal phthalate, paraben, and phenol exposure and childhood allergic and respiratory outcomes: evaluating exposure to chemical mixtures. Sci Total Environ. 2020; 725: 138418. https://doi.org/10.1016/j.scitotenv.2020.138418.
49. Zhao H., Zheng Y., Zhu L., et al. Paraben exposure related to purine metabolism and other pathways revealed by mass spectrometry-based metabolomics. Environ Sci Technol. 2020; 54 (6): 3447–54. https://doi.org/10.1021/acs.est.9b07634.
50. Nakiwala D., Noyes P.D., Faure P., et al. Phenol and phthalate effects on thyroid hormone levels during pregnancy: relying on in vitro assays and adverse outcome pathways to inform an epidemiological analysis. Environ Health Perspect. 2022; 130 (11): 117004. https://doi.org/10.1289/EHP10239.
51. Aker A.M., Johns L., McElrath T.F., et al. Associations between maternal phenol and paraben urinary biomarkers and maternal hormones during pregnancy: a repeated measures study. Environ Int. 2018; 113: 341–9. https://doi.org/10.1016/j.envint.2018.01.006.
52. Guo J., Wu C., Zhang J., et al. Maternal and childhood urinary phenol concentrations, neonatal thyroid function, and behavioral problems at 10 years of age: the SMBCS study. Sci Total Environ. 2020; 743: 140678. https://doi.org/10.1016/j.scitotenv.2020.140678.
53. Oskar S., Balalian A.A., Stingone J.A. Identifying critical windows of prenatal phenol, paraben, and pesticide exposure and child neurodevelopment: findings from a prospective cohort study. Sci Total Environ. 2024; 920: 170754. https://doi.org/10.1016/j.scitotenv.2024.170754.
54. Barkoski J.M., Busgang S.A., Bixby M., et al. Prenatal phenol and paraben exposures in relation to child neurodevelopment including autism spectrum disorders in the MARBLES study. Environ Res. 2019; 179 (Pt A): 108719. https://doi.org/10.1016/j.envres.2019.108719.
55. Tung C.J., Chen M.H., Lin C.C., Chen P.C. Association between parabens exposure and neurodevelopment in children. Environ Int. 2024; 188: 108671. https://doi.org/10.1016/j.envint.2024.108671.
56. Lara-Valderrábano L., Rocha L., Galván E.J. Propylparaben reduces the excitability of hippocampal neurons by blocking sodium channels. Neurotoxicology. 2016; 57: 183–93. https://doi.org/10.1016/j.neuro.2016.09.019.
57. Michałowicz J., Włuka A., Cyrkler M., et al. Phenol and chlorinated phenols exhibit different apoptotic potential in human red blood cells (in vitro study). Environ Toxicol Pharmacol. 2018; 61: 95–101. https://doi.org/10.1016/j.etap.2018.05.014.
58. Merola C., Caioni G., Bertolucci C., et al. Embryonic and larval exposure to propylparaben induces developmental and long-term neurotoxicity in zebrafish model. Sci Total Environ. 2024; 912: 168925. https://doi.org/10.1016/j.scitotenv.2023.168925.
59. Nagar Y., Thakur R.S., Parveen T., et al. Toxicity assessment of parabens in Caenorhabditis elegans. Chemosphere. 2020; 246: 125730. https://doi.org/10.1016/j.chemosphere.2019.125730.
60. Bereketoglu C., Pradhan A. Comparative transcriptional analysis of methylparaben and propylparaben in zebrafish. Sci Total Environ. 2019; 671: 129–39. https://doi.org/10.1016/j.scitotenv.2019.03.358.
61. Martins F.C., Oliveira M.M., Gaivão I., et al. The administration of methyl and butyl parabens interferes with the enzymatic antioxidant system and induces genotoxicity in rat testis: possible relation to male infertility. Drug Chem Toxicol. 2024; 47 (3): 322–9. https://doi.org/10.1080/01480545.2023.2176512.
62. Samarasinghe S.V.A.C., Krishnan K., Naidu R., et al. Parabens generate reactive oxygen species in human spermatozoa. Andrology. 2018; 6 (4): 532–41. https://doi.org/10.1111/andr.12499.
63. Leppert B., Strunz S., Seiwert B., et al. Maternal paraben exposure triggers childhood overweight development. Nat Commun. 2020; 11 (1): 561. https://doi.org/10.1038/s41467-019-14202-1.
64. Sievers O., Jannes L. Chemical control of the phenol contents of vaccines and serum preparations. Acta Pathol Microbiol Scand. 1945; 22 (2): 204. https://doi.org/10.1111/j.1699-0463.1945.tb05043.x.
65. Banic S. Injurious effect of phenol on antirabies vaccine. Z Immun Exp Ther. 1953; 110 (6): 502–5.
66. Инструкция по медицинскому применению препарата Церебролизин®. Государственный реестр лекарственных средств. URL: https://grls.rosminzdrav.ru/Grls_View_v2.aspx?routingGuid=f1b69bf9-f160-48e0-9d08-03cadc1893dd (дата обращения 15.06.2024).
67. Громова О.А., Торшин И.Ю., Зайчик Б.Ц. и др. О различиях в стандартизации лекарственных препаратов на основе экстрактов хондроитина сульфата. ФАРМАКОЭКОНОМИКА. Современная фармакоэкономика и фармакоэпидемиология. 2021; 14 (1): 50–62. https://doi.org/10.17749/2070-4909/farmakoekonomika.2021.083.
68. Budavari S. (Ed.) The Merck Index: an encyclopedia of chemicals, drugs, and biologicals. 11th ed. Merck; 1989.
69. Brühne F., Wright L. Benzyl alcohol. In: Ullmann's encyclopedia of industrial chemistry. Wiley; 2007: 7–8. https://doi.org/10.1002/14356007.a04_001.
70. Торшин И.Ю., Громова О.А., Кобалава Ж.Д. О репрессиях ω-3 полиненасыщенных жирных кислот адептами доказательной медицины. ФАРМАКОЭКОНОМИКА. Современная фармакоэкономика и фармакоэпидемиология. 2019; 12 (2): 91–114. https://doi.org/10.17749/2070-4909.2019.12.2.91-114.
Об авторах
И. Ю. ТоршинРоссия
Торшин Иван Юрьевич – к.ф-м.н., к.х.н.
WoS ResearcherID: C-7683-2018
Scopus Author ID: 7003300274
ул. Вавилова, д. 44, корп. 2, Москва 119334
О. А. Громова
Россия
Громова Ольга Алексеевна – д.м.н., профессор
WoS ResearcherID: J-4946-2017
Scopus Author ID: 7003589812
ул. Вавилова, д. 44, корп. 2, Москва 119334
Что уже известно об этой теме?
► Фенол и парабены проявляют бактерицидные свойства и применяются в качестве стабилизаторов/консервантов
► При анализе препаратов необходимо обращать пристальное внимание не только на действующее вещество, но и на выбор консервантов, используемых в инъекционных формах
► Долговременные эффекты фенолов/парабенов как консервантов не изучены
Что нового дает статья?
► Систематизация исследований указала на сложное эстрогеноподобное и антиандрогенное действие производных фенола (в т.ч. парабенов), стимулирование фенолом/парабенами патофизиологии онкогенеза
► В фундаментальных и клинических исследованиях продемонстрировано тератогенное и другое токсическое воздействие фенола/парабенов на эмбрион и отрицательное влияние на здоровье беременных женщин
► Показаны долговременные негативные последствия воздействия фенола/парабенов для детей
Как это может повлиять на клиническую практику в обозримом будущем?
► Необходимо проведение крупномасштабных клинических исследований продольного и поперечного дизайна для оценки долговременного токсического действия фенола и парабенов
► Стабилизация препаратов фенолом или парабенами является устаревшей фармацевтической технологией, что важно учитывать при анализе врачами состава лекарственных средств
Рецензия
Для цитирования:
Торшин И.Ю., Громова О.А. Проблемы использования фенола (гидроксибензола) и парабенов в качестве стабилизаторов фармацевтических средств: анализ с применением методов машинного обучения. ФАРМАКОЭКОНОМИКА. Современная фармакоэкономика и фармакоэпидемиология. 2025;18(1):125-139. https://doi.org/10.17749/2070-4909/farmakoekonomika.2024.263
For citation:
Torshin I.Yu., Gromova O.A. Problems of using phenol (hydroxybenzene) and parabens as pharmaceutical stabilizers: analysis using machine learning methods. FARMAKOEKONOMIKA. Modern Pharmacoeconomics and Pharmacoepidemiology. 2025;18(1):125-139. (In Russ.) https://doi.org/10.17749/2070-4909/farmakoekonomika.2024.263

Контент доступен под лицензией Creative Commons Attribution-NonCommercial-ShareAlike 4.0 International License.






































