Перейти к:
Хемореактомный анализ антиоксидантных свойств производных витамина В12
https://doi.org/10.17749/2070-4909/farmakoekonomika.2024.239
Аннотация
Актуальность. Синтетические производные витамина В12 проявляют различные физические, химические и фармакологические свойства. Разработка методов прогнозирования свойств этих молекул по их химической структуре важна для направленного органического синтеза корринов с желаемыми свойствами и спектром применения в фармакологии.
Цель: хемореактомная оценка антиоксидантных эффектов витамина В12 и его производных: аквакобаламин, диаквакобинамид, аквациано-формы гептаэтаноламин-, гептаэтилендиамин-, гептаметил- и гептабутилкобиринатов.
Материал и методы. Исследование проведено с помощью метода хемореактомного анализа, реализованного в рамках алгебраической теории распознавания и топологического анализа данных и основанного на теории изоморфизма размеченных графов и современных методах прогнозирования числовых таргетных переменных. Для осуществления хемоинформационного хемореактомного анализа разработана специальная проблемно-ориентированная теория в границах комбинаторной теории разрешимости и проведены оценки антиоксидантных свойств производных витамина В12 (всего 140 активностей).
Результаты. Найдены достоверные различия в свойствах исследованных веществ по отношению к оксидативному стрессу. В тест-системах, основанных на оксиданте 1,1-дифенил-2-пикрилгидразил, при различном времени воздействия молекул (15–60 мин) в различных концентрациях (10–125 мкМ, 50–3000 мкг/мл) аквакобаламин проявлял наиболее выраженные антиоксидантные свойства при более низких концентрациях (до 100 мкМ). При более высоких концентрациях веществ (125 мкМ) антиоксидантная активность других производных витамина В12 была выше. Все исследованные молекулы отличались умеренным антимикронутриентным действием (суммарный балл около 3,0; для большинства синтетических лекарств значение этого балла выше 3,6). Наименее выраженным антимикронутриентным действием характеризовался аквакобаламин (суммарный балл менее 0,8), что указывает на практически полное отсутствие антивитаминного и антиминерального действия – соответствует в среднем увеличению риска выведения того или иного микронутриента не более чем на 5%.
Заключение. Все исследованные соединения в той или иной мере проявляют антиоксидантные свойства. Вне зависимости от выбора моделируемых тест-систем для оценки оксидативного стресса, аквакобаламин демонстрирует антиоксидантные эффекты в наибольшей степени и практически не стимулирует потерь других микронутриентов.
Ключевые слова
Для цитирования:
Торшин И.Ю., Громова О.А., Майорова Л.А. Хемореактомный анализ антиоксидантных свойств производных витамина В12. ФАРМАКОЭКОНОМИКА. Современная фармакоэкономика и фармакоэпидемиология. 2024;17(3):358-367. https://doi.org/10.17749/2070-4909/farmakoekonomika.2024.239
For citation:
Torshin I.Yu., Gromova O.A., Maiorova L.A. Chemoreactomic analysis of the antioxidant properties of vitamin B12 derivatives. FARMAKOEKONOMIKA. Modern Pharmacoeconomics and Pharmacoepidemiology. 2024;17(3):358-367. (In Russ.) https://doi.org/10.17749/2070-4909/farmakoekonomika.2024.239
ВВЕДЕНИЕ / INTRODUCTION
Широкий круг биологических ролей витамина В12 обусловлен, прежде всего, специфичными взаимодействиями с белками протеома [1]. Кроме того, корриновое ядро витамеров В12 является удобным «таргетом» для направленного органического синтеза молекул с желаемыми свойствами, в т.ч. для таргетной доставки лекарств, использования в качестве антидотов, разработки химических сенсоров, молекул с антиоксидантными, нейропротекторными и хелатирующими свойствами [2–10].
Известны многие модификации витамина В12. В частности, четыре его формы – цианокобаламин (CNCbl), гидроксикобаламин (OHCbl), 5’-дезоксиаденозилкобаламин (AdoCbl) и метилкобаламин (MeCbl) разрешены для использования в составе витаминно-минеральных комплексов (ВМК). Они имеют разную биодоступность, стабильность и эффективность при использовании в виде различных лекарственных форм. Лекарства с витамином В12, ВМК и «фортифицированные» продукты питания чаще всего содержат CNCbl из-за его лучшей стабильности по сравнению с другими тремя формами витамина B12 [11].
Биодоступность витамина В12 зависит от молекулярного окружения, в котором молекулы В12 поступают в организм. Общеизвестно, что витамин В12 максимально концентрируется в печени и продуктах из печени. Высокие концентрации витамина В12 отмечаются в мясе, рыбе, а также в цельном молоке, яйцах. Растительные продукты, как правило, содержат малые количества витамина В12 и фолатов, за исключением водорослей нори (так называемые пурпурные водоросли, Neopyro piayezoensis): содержание в них витамина В12 достигает 30–60 мкг на 100 г сухого веса, активных фолатов (5-метилтетрагидрофолат) – 880–1300 мкг на 100 г [12]. Сообщается, что источником фармацевтических субстанций витамина В12 являются особые штаммы дрожжей S. cerevisiae, продуцирующие В12 [13]. У людей с нормальным состоянием желудка биодоступность витамина В12 составляет 42% из мяса рыбы, 89% – из нежирной баранины, 66% – из куриного мяса, 9% – из яиц. В норме биодоступность витамина В12 регулируется системой кишечной абсорбции. При поступлении продуктов, содержащих витамин В12, в течение одного приема пищи всасывается около 1,5–2,0 мкг [14].
Молекулярное окружение витамина В12 может изменять стабильность корринового кольца. Например, антиоксидант аскорбиновая кислота используется для повышения стабильности различных форм витамина В12 [15]. Несмотря на то что аскорбиновая кислота может использоваться в фармацевтике для стабилизации В12, цианокобаламин и его производные и сами проявляют антиоксидантные свойства. Анализ влияния на антиоксидантный статус и на микронутриентный обмен – важный этап в оценке безопасности потенциальных лекарств.
В модели глобальной ишемии/реперфузии мозга у крыс (перевязка сонных артерий на 20 мин) цианокобаламин в дозах 200 и 400 мкг/кг улучшал показатели памяти за счет ингибирования некроза и апоптоза гибели клеток гиппокампа. При этом было показано, что витамин В12 проявлял статистически достоверное антиоксидантное действие: при приеме CNCbl отмечены повышение уровней глутатиона (р<0,01) и супероксиддисмутазы (р<0,05), снижение уровней малонового диальдегида (р<0,05) и провоспалительного фактора некроза опухоли альфа (р<0,05). Параллельно CNCbl существенно ограничивал формирование нарушений пространственной памяти (р<0,05), снижая апоптоз и некроз нейронов в зоне СА1 гиппокампа (р<0,01) [16].
Цианокобаламин показал защитное антиоксидантное действие в модели поражения метотрексатом почек у крыс, сопровождающейся значительным повышением уровней мочевины и креатинина (р<0,05). Дотации CNCbl (0,5, 1, 1,5 мг/кг/сут в течение 2 нед внутрибрюшинно) повышали уровень антиоксидантного фермента глутатионпероксидазы и снижали концентрации прооксидантного малонового диальдегида в крови и почках, также способствуя уменьшению уровней мочевины и креатинина в крови в сторону диапазона нормы (р<0,05) [15].
Важно отметить, что антиоксидантные свойства витамина В12 могут быть связаны как со специфическими взаимодействиями с белками протеома (например, активация белков-антиоксидантов), так и с прямым действием молекул на активные формы кислорода. Оценка интегральных антиоксидантных свойств молекул основана на измерении показателей рН-зависимых реакций переноса электрона: ROO• + [молекула] → ROO– + [молекула]•, [молекула]H• + H2O ↔ [молекула]• + H3O+, ROO– + H3O+ ↔ ROOH + H2O и др. [17].
Самым распространенным подходом к оценке антиоксидантных свойств молекул или природных экстрактов является метод тролоксовых эквивалентов (англ. trolox equivalent antioxidant capacity, TEAC), осуществляемый с использованием оксидантов 2,2'-азино-бис-этилбензтиазолино-6-сульфоната [18], азосоединения 2-гидрокси-5-арилалкилфенон или 1,1-дифенил-2-пикрилгидразила (ДФПГ) [19]. Также применяются тест-системы на основе меди (медь-восстанавливающая антиоксидантная емкость – англ. сupric reducing antioxidant capacity, CUPRAC) [20] с использованием оценки перекисного окисления липидов, реагирующих с тиобарбитуровой кислотой, методы переноса атома водорода с антиоксиданта на субстрат (англ. оxygen radical absorbance capacity, ORAC), а также переноса водорода (англ. total radical-trapping antioxidant parameter, TRAP) и др. [18]. В большинстве вышеперечисленных способов молекулы антиоксиданта вступают в реакцию с флуоресцентной меткой, что приводит к изменениям оптической плотности при заданной длине волны пропорционально концентрации соответствующих активных форм кислорода.
Таким образом, антиоксидантная активность индивидуальных соединений может экспериментально измеряться посредством большого числа методов in vitro и in vivo [21][22]. Перед проведением экспериментальных исследований целесообразно выполнить сканирование молекул-кандидатов in silico, т.е. оценочное моделирование их свойств. Представленная в работе [2] систематизация информации о таргетной модуляции свойств корринов посредством химических модификаций указала на выборку молекул – кандидатов для исследований корринов in silico, in vitro и in vivo (аквакобаламин, аквациано-формы гептаэтаноламин-, гептаэтилендиамин-, гептаметил- и гептабутилкобиринатов).
Ранее нами было показано, что тетрапиррольные макрогетероциклические соединения, к которым относится витамин В12 и его производные, могут образовывать наноструктуры [23][24], а также стабильные наночастицы [25] с улучшенными свойствами, что делает их актуальной группой веществ для изучения в качестве перспективных наноформ лекарственных препаратов. Получены уникальные наночастицы производного витамина В12 – гептабутилового эфира цианоаквакобириновой кислоты с особыми свойствами и активностью [26]. В экспериментах in vivo продемонстрировано, что второе изучаемое в настоящей работе производное витамина В12 (гептаметиловый эфир цианоаквакобириновой кислоты) проявляет биоактивность [27]. Важно отметить, что, поскольку это соединение при загрузке его в белковый наноноситель собирается в наночастицы, оно in vivo демонстрирует такую же эффективность, как и без белкового наноносителя, в отличие от витамина В12 и аквакобаламина, эффективность которых при этом снижается. Антиоксидантные свойства и влияние на обмен витаминов и микроэлементов для производных витамина В12 до настоящего времени не были исследованы.
Цель – хемореактомная оценка антиоксидантных эффектов витамина В12 и его производных: аквакобаламин, диаквакобинамид, аквациано-формы гептаэтаноламин-, гептаэтилендиамин-, гептаметил- и гептабутилкобиринатов.
МАТЕРИАЛ И МЕТОДЫ / MATERIAL AND METHODS
Исследуемые соединения / Studied compounds
В работе представлены результаты сравнительного хемопротеомного анализа витамина В12 и его производных: аквакобаламина, диаквакобинамида (DACbi), аквациано-форм гептаэтаноламин-, гептаэтилендиамин-, гептаметил- и гептабутилкобиринатов (ACEACby, ACEDCby, ACMeCby и ACBuCby соответственно).
Хемореактомный и фармакоинформационный анализ / Chemoreactomic and pharmacoinformatic analysis
Сравнение соединений проводилось методом хемореактомного анализа, основанного на теории изоморфизма размеченных графов и современных методах прогнозирования числовых таргетных переменных [28].
Для осуществления хемоинформационного хемореактомного анализа разработана специальная проблемно-ориентированная теория в границах комбинаторной теории разрешимости [29–31] – современный математический инструментарий для анализа качества порождаемых признаковых описаний различных объектов [32], в т.ч. молекул, представленных в виде хемографов. Хемограф (χ-граф) – особая разновидность графа, т.е. математического объекта, являющегося совокупностью множества вершин и множества ребер – связей между вершинами. Хемографом называется конечный, связный, неориентированный и размеченный граф без петель, с кликовым числом, не превышающим 3 [33]. В соответствии с постулатами специальной комбинаторной теории разрешимости выписывается условие разрешимости, на основании которого определяется функция расстояния между χ-графами dχ. Формула расстояния позволяет вычислять так называемые химические расстояния между парами сравниваемых молекул.
Первым шагом хемореактомного анализа является установление списка молекул, наиболее близких по структуре к оцениваемой молекуле (т.е. вычисление dχ). Второй шаг – извлечение из баз данных экспериментальной информации о молекулах, схожих с заданной. На этом шаге из базы данных PubChem выбирали данные об антиоксидантных активностях, измеренных для различных молекул посредством тест-систем на основе тролоксовых эквивалентов, ДФПГ, CUPRAC, ORAC, TRAP и др. [18]. При проведении фармакоинформационного анализа из PubChem извлекали информацию о негативных взаимодействиях различных молекул с теми или иными микронутриентами. Третий шаг – оценка биологических активностей исследуемой молекулы (в т.ч. моделирование взаимодействия с протеомом), т.е. собственно хемореактомный анализ.
Представленные в проведенных исследованиях оценки значений биологических констант получены как математическое ожидание и дисперсия соответствующих эмпирических функций распределений.
РЕЗУЛЬТАТЫ / RESULTS
Хемореактомный анализ антиоксидантных эффектов молекул / Chemoreactomic analysis of molecules’ antioxidant effects
В рамках хемореактомного моделирования антиоксидантных эффектов производных витамина В12 (профилирования) проведена оценка антиоксидантных свойств, которые экспериментально измеряются посредством различных биохимических технологий (ДФПГ-спектрофотометрия, тролоксовые эквиваленты и др.). Всего получены оценки 140 антиоксидантных активностей для шести молекул. Из сравнения профилей активностей очевидно, что результаты для аквакобаламина заметно отличаются от всех других молекул (табл. 1).
Таблица 1. Показатели схожести профилей антиоксидантного действия исследованных молекул, %*
Table 1. Similarity of proteomic interactions of the studied molecules according to the results of chemoproteomic profiling, %*
|
Соединение / Compound |
Аквакобаламин / Aquacobalamin |
DACbi |
ACEACby |
ACEDCby |
ACMeCby |
ACBuCby |
|
Аквакобаламин / Aquacobalamin |
100 |
53 |
53 |
53 |
54 |
54 |
|
DACbi |
53 |
100 |
99 |
99 |
99 |
99 |
|
ACEACby |
53 |
99 |
100 |
100 |
98 |
98 |
|
ACEDCby |
53 |
99 |
100 |
100 |
98 |
98 |
|
ACMeCby |
54 |
99 |
98 |
98 |
100 |
100 |
|
ACBuCby |
54 |
99 |
98 |
98 |
100 |
100 |
Примечание. DACbi – диаквакобинамид; ACEACby – аквациано-форма гептаэтаноламинкобирината; ACEDCby – аквациано-форма гептаэтилендиаминкобирината; ACMeCby – аквациано-форма гептаметилкобирината; ACBuCby – аквациано-форма гептабутилкобирината. * Процент оценен на основании сравнения 140-мерных векторов, каждый компонент которых соответствует определенному способу оценки антиоксидантной активности молекулы.
Note. DACbi – diaquacobinamide; ACEACby – aquacyano-form of heptaethanolamine cobyrinate; ACEDCby – aquacyano-form of heptaethylenediamine cobyrinate; ACMeCby – aquacyano-form of heptamethyl cobyrinate; ACBuCby – aquacyano-form of heptabutyl cobyrinate. * The percentage was estimated based on a comparison of 140-dimensional vectors, each component of which corresponded to a specific method for evaluating the antioxidant activity of a molecule.
На метрической диаграмме (рис. 1) каждому соединению соответствует та или иная точка, которой, в свою очередь, соответствует 140-мерный вектор, отражающий весь комплекс оцененных антиоксидантных свойств взаимодействий с протеомом. Очевидно существование двух кластеров молекул с близкими протеомными свойствами: аквакобаламин и кластер из трех кобириновых соединений и двух гидрофобных производных.
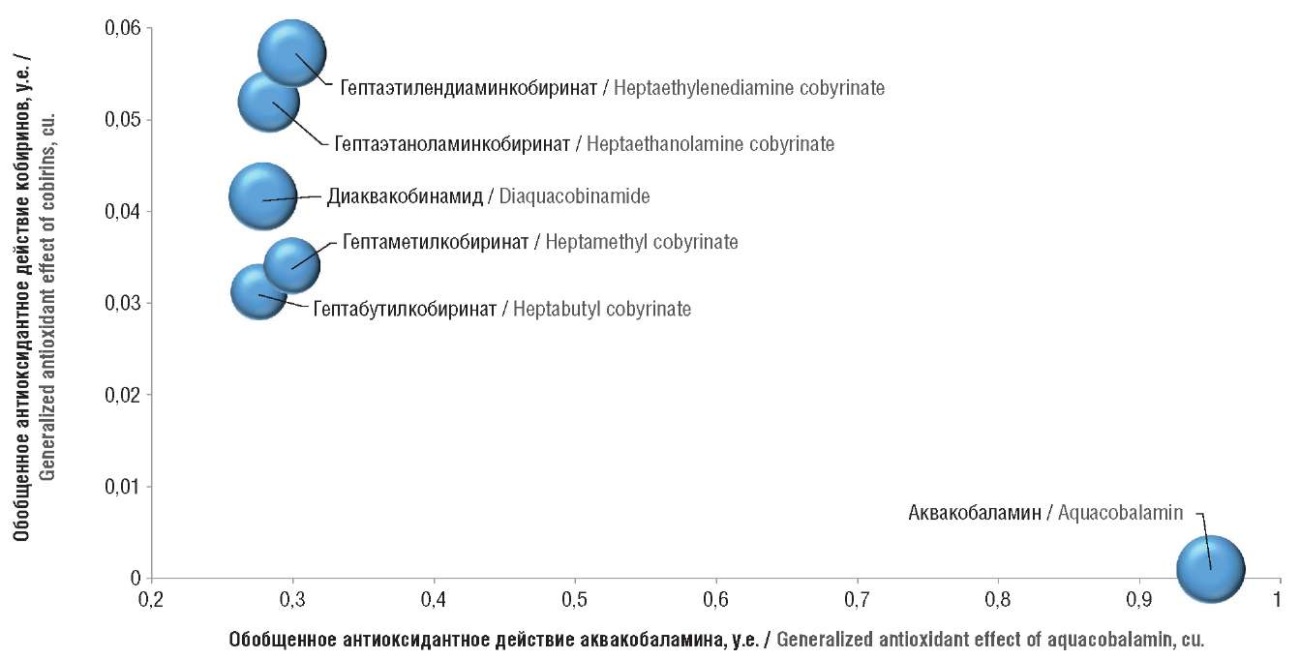
Рисунок 1. Метрическая диаграмма схожести профилей антиоксидантного действия исследованных производных витамина В12. Диаграмма получена посредством проецирования 140-мерных векторов для каждого соединения на плоскость. Чем больше расстояние между точками, тем больше различия в хемопротеомных профилях веществ
Figure 2. Metric diagram of the similarity of antioxidant effect profiles of the studied vitamin B12 derivatives. The diagram was obtained by projecting 140-dimensional vectors for each connection onto a plane. The greater the distance between the points, the greater the differences in the chemoproteomic profiles of the corresponding derivatives
Хемореактомное моделирование антиоксидантных свойств производных витамина В12 в тест-системах, основанных на оксиданте ДФПГ, при различном времени воздействия молекул (15–60 мин) в различных концентрациях (молярные концентрации 10–125 мкМ, 50–3000 мкг/мл) показало, что аквакобаламин проявляет наиболее выраженные антиоксидантные свойства (рис. 2а), причем при более низких молярных концентрациях (до 100 мкМ) (рис. 2b), а при более высоких концентрациях (125 мкМ) антиоксидантная активность других производных витамина В12 была выше.
При дозозависимом анализе антиоксидантных эффектов с оценкой концентраций очень высокие концентрации (3000 мкг/мл) парадоксальным образом приводили к ингибированию антиоксидантных свойств всех молекул. Хемореактомный анализ антиоксидантного действия с использованием тролоксовых эквивалентов показал схожие результаты: нарастание антиоксидантных эффектов соединений, измеренных в тролоксовых эквивалентах, при возрастании концентраций от 5 до 100 мкМ. При этом аквакобаламин отличался более выраженными антиоксидантными свойствами (рис. 2с).
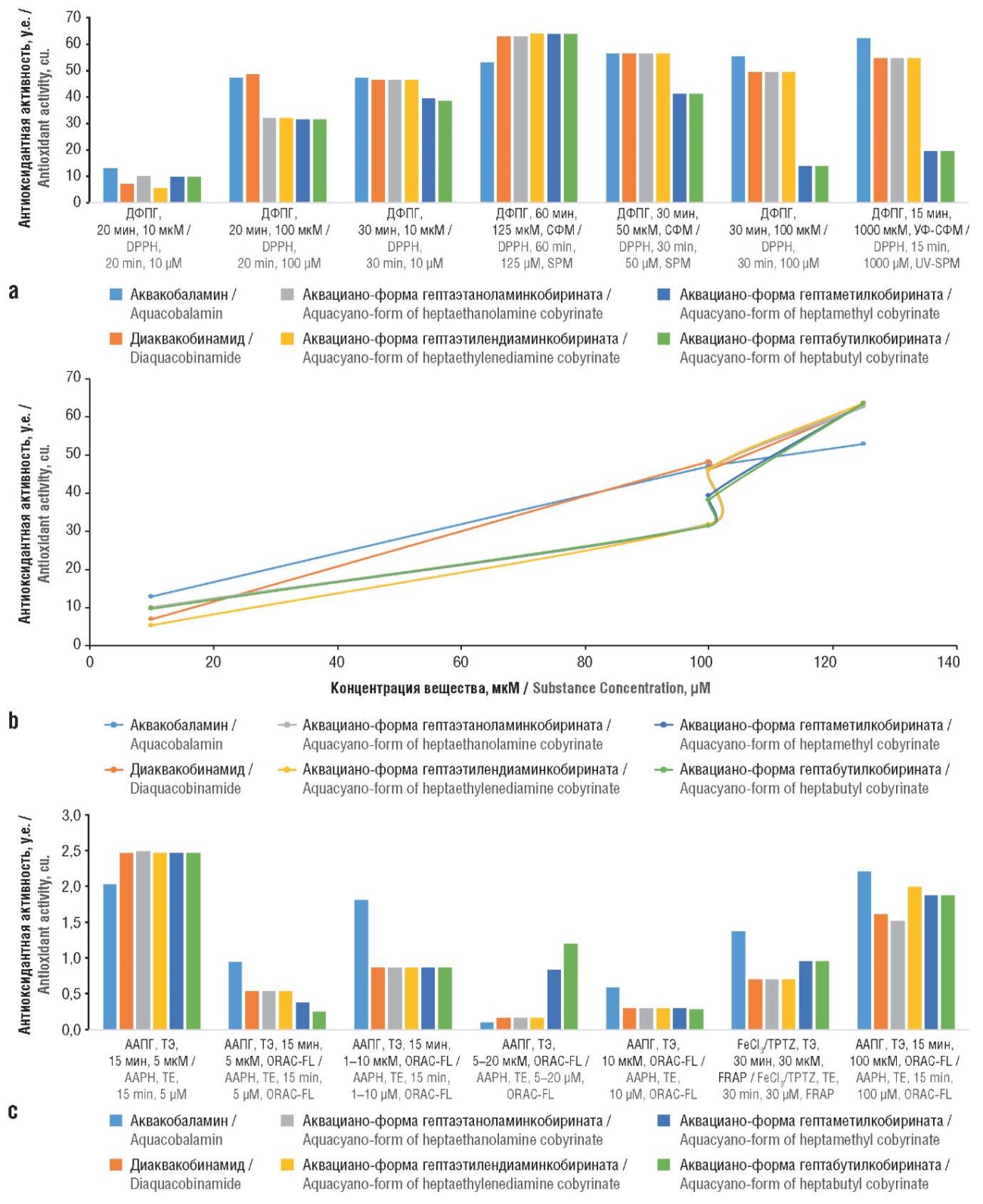
Рисунок 2. Представительные фрагменты профилей антиоксидантного действия производных витамина В12:
a – антиоксидантные активности, оцененные с использованием ДФПГ; b – дозозависимый анализ активности с помощью ДФПГ; c – антиоксидантные активности, оцененные посредством ААПГ и тролоксовых эквивалентов.
ДФПГ – 2,2-дифенил-1-пикрилгидразил; СФМ – спектрофотометрия; УФ-СФМ – спектрофотометрия в ультрафиолетовой области спектра; ААПГ – 2,2'-азобис(2-амидинопропан) гидрохлорид; ТЭ – тролоксовые эквиваленты; ORAC-FL (англ. oxygen radical absorbance capacity assay method using fluorescein) – метод измерения поглощающей способности кислородных радикалов с использованием флуоресцеина; TPTZ (англ. tris(2-pyridyl)-c-triazine) – трис(2-пиридил)-с-триазин; FRAP (англ. fluorescence recovery after photobleaching) – метод восстановления флуоресценции после обесцвечивания
Figure 2. Representative fragments for profiles of antioxidant action of vitamin B12 derivatives:
a – antioxidant activities assessed using DPPH; b – dose-dependent activity analysis using DPPH; c – antioxidant activities assessed by AAPH и trolox equivalents.
DPPH – 2,2-diphenyl-1-picrylhydrazyl; SPM – spectrophotometry; UV – ultraviolet; AAPH – 2,2'-azobis(2-amidinopropane) hydrochloride; ТЕ – trolox equivalents; ORAC-FL – oxygen radical absorbance capacity assay method using fluorescein; TPTZ – tris(2-pyridyl)-c-triazine; FRAP – fluorescence recovery after photobleaching
В таблице 2 приведены результаты хемореактомного моделирования антиоксидантных активностей, которые определяются посредством самых разнобразных биохимических технологий, в т.ч. измерения перекисного окисления липидов с использованием различных оксидантов (CuSO4, FeCl3, ДФПГ, активные формы кислорода: OH-радикалы, H2O2, супероксид-анион), различных физических методов (ультрафиолетовая спектрофотомерия, спектроскопия ядерного магнитного резонанса, нитритный метод, иммунохимия ELISA) в различных тест-системах (тролоксовые эквиваленты, тиобарбитуровая кислота, разложение 2-дезокси-D-рибозы) и в различных биосубстратах (в плазме крови, микросомах, просто in vitro).
Таблица 2. Хемореактомные оценки антиоксидантных активностей, измеренных посредством различных биохимических методов и тестов
Table 2. Chemoreactomic estimates of antioxidant effects measured by various biochemical methods and tests
|
Метод оценки / Evaluation method |
Константа активности / Activity constant |
Единицы / Units |
Аквакобаламин / Aquacobalamin |
DACbi |
ACEACby |
ACEDCby |
ACMeCby |
ACBuCby |
|
CuSO4 ПОЛ ЛПНП, 25 мкМ, 4 ч, TBARS / CuSO4 LPO LDLP, 25 μM, 4 h, TBARS |
Инг. / Inh. |
% |
85,2 |
14,8 |
14,9 |
14,9 |
28,5 |
28,6 |
|
FeCl3, инг. ПОЛ, лецитин, 10 мкг/мл, 1 ч // FeCl3, LPO inh., lecithin, 10 μg/ml, 1 h |
Инг. / Inh. |
% |
20,6 |
4,3 |
4,3 |
4,3 |
11,8 |
11,8 |
|
H2O2, дитиотреитол-эквивалент, 60 мин, 1H-ЯМР-спектроскопия / H2O2, dithiotreitol equivalent, 60 min, 1H-NMR-spectroscopy |
Инг. / Inh. |
% |
26,8 |
19,8 |
26,9 |
26,9 |
15,3 |
15,3 |
|
H2O2, ингибирование ПОЛ в плазме человека, 10 мкМ, 30 мин, TBARS / H2O2, LPO inh. in human plasma, 10 μM, 30 min, TBARS |
Инг. / Inh. |
% |
33,4 |
38,0 |
38,0 |
38,0 |
16,2 |
16,2 |
|
OH-радикалы, FeCl3, разложение 2-дезокси-D-рибозы, 5 мкМ, 1 ч / OH-radicals, FeCl3, 2-deoxy-D-ribose decomposition, 5 μM, 1 h |
Инг. / Inh. |
% |
42,3 |
33,1 |
33,1 |
33,1 |
33,1 |
33,1 |
|
ААПГ, инг. ПОЛ, 100 мкМ / AAPH, LPO inh., 100 μM |
Инг. / Inh. |
% |
65,8 |
57,2 |
57,2 |
57,2 |
46,8 |
46,8 |
|
Супероксид, 10 мкМ / Superoxide, 10 μM |
Инг. / Inh. |
% |
48,9 |
33,7 |
33,7 |
33,7 |
33,7 |
33,7 |
|
Супероксид, инг. ПОЛ, 100 мкМ, СФМ / Superoxide, LPO inh., 100 μM, SPM |
Инг. / Inh. |
% |
76,2 |
61,5 |
62,0 |
62,0 |
61,8 |
52,5 |
|
ДФПГ, инг. ПОЛ, 1 мМ, 30 мин, УФ-СФМ / DPPH, LPO inh., 1 mM, 30 min, UV SPM |
IC50 |
нМ / nM |
96,6 |
364,7 |
364,9 |
364,9 |
174,6 |
174,8 |
|
Супероксид, инг. микросомального ПОЛ / Superoxide, microsomal LPO inh. |
IC50 |
нМ / nM |
1888 |
3607 |
2592 |
2592 |
2926 |
2926 |
|
Супероксид, инг. нитритным методом / Superoxide, inh. by nitrite method |
IC50 |
нМ / nM |
439,1 |
747,7 |
747,7 |
747,7 |
683,8 |
683,8 |
|
ДФПГ, 30 мин, СФМ / DPPH, 30 min, SPM |
IC50 |
мкг/мл // μg/ml |
14,4 |
70,0 |
70,0 |
70,0 |
34,2 |
34,2 |
|
ДФПГ, 30 мин в темноте, СФМ / DPPH, 30 min in dark, SPM |
IC50 |
мкг/мл // μg/ml |
37,0 |
30,8 |
30,8 |
30,8 |
26,9 |
26,9 |
|
ДФПГ, 30 мин, СФМ / DPPH, 30 min, SPM |
IC50 |
мкг/мл// μg/ml |
39,4 |
33,0 |
28,0 |
28,0 |
26,6 |
26,6 |
|
ДФПГ, тест ELISA, 1 мМ / DPPH, ELISA test, 1 mM |
IC50 |
мкМ / μM |
47,7 |
68,0 |
68,0 |
68,0 |
94,4 |
94,4 |
|
ААПГ, тролоксовый эквивалент, 1 мМ, 10 мин., ORAC-FL / AAPH, trolox equivalent, 1 mM, 10 min, ORAC-FL |
IC50 |
мкМ / μM |
4,9 |
3,8 |
3,8 |
3,8 |
4,0 |
4,0 |
Примечание. DACbi – диаквакобинамид; ACEACby – аквациано-форма гептаэтаноламинкобирината; ACEDCby – аквациано-форма гептаэтилендиаминкобирината; ACMeCby – аквациано-форма гептаметилкобирината; ACBuCby – аквациано-форма гептабутилкобирината; TBARS (англ. thiobarbituric acid reactive substances) – вещества, реагирующие с тиобарбитуровой кислотой; ПОЛ – перекисное окисление липидов; ЛПНП – липопротеины низкой плотности; ЯМР – ядерный магнитный резонанс; СФМ – спектрофотометрия; УФ-СФМ – спектрофотометрия в ультрафиолетовой области спектра; ААПГ – 2,2'-азобис(2-амидинопропан) гидрохлорид; ДФПГ – 2,2-дифенил-1-пикрилгидразил; ELISA (англ. enzyme-linked immunosorbent assay) – иммуноферментный анализ; ORAC-FL (англ. oxygen radical absorbance capacity assay method using fluorescein) – метод измерения поглощающей способности кислородных радикалов с использованием флуоресцеина; Инг. – ингибирование; IC50 (англ. half-maximal inhibitory concentration) – концентрация полумаксимального ингибирования.
Note. DACbi – diaquacobinamide; ACEACby – aquacyano-form of heptaethanolamine cobyrinate; ACEDCby – aquacyano-form of heptaethylenediamine cobyrinate; ACMeCby – aquacyano-form of heptamethyl cobyrinate; ACBuCby – aquacyano-form of heptabutyl cobyrinate; TBARS – thiobarbituric acid reactive substances; LPO – lipid peroxidation; LDLP – low-density lipoproteins; NMR – nuclear magnetic resonance; SPM – spectrophotometry; UV SPM – spectrophotometry in ultraviolet region of spectrum; AAPH – 2,2'-azobis(2-amidinopropane) hydrochloride; DPPH – 2,2-diphenyl-1-picrylhydrazyl; ELISA – enzyme-linked immunosorbent assay; ORAC-FL – oxygen radical absorbance capacity assay method using fluorescein; Inh. – inhibition; IC50 – half-maximal inhibitory concentration
Несмотря на существенные различия в подходах к определению антиоксидантных свойств, перечисленных в таблице 2, данные результаты подтверждают более выраженные антиоксидантные свойства аквакобаламина: значения процентов антиоксидантной активности (ингибирования оксидации) для аквакобаламина были, как правило, выше, а значения констант концентрации полумаксимального ингибирования (англ. half-maximal inhibitory concentration, IC50) – ниже по сравнению с другими молекулами. Напомним, что более низкие значения константы IC50 соответствуют более высокой активности вещества, ведь его требуется меньше для достижения того же эффекта – ингибирования оксидативного стресса на 50%.
Фармакоинформационный анализ антимикронутриентных свойств молекул / Pharmacoinformatic analysis of molecules’ antimicronutrient effects
При изучении молекул потенциальных лекарств важно оценить их побочные эффекты, в т.ч. возможное стимулирование интенсивных потерь тех или иных витаминов и микроэлементов (минералов). Анализ соответствующих компонент фармакоинформационных профилей исследуемых соединений указал на существенные различия в антимикронутриентном действии рассмотренных молекул.
Следует отметить, что все исследованные соединения отличались умеренным антимикронутриентным действием (суммарный балл около 3,0; для большинства синтетических лекарств значение этого балла выше 3,6). Наименее выраженным антимикронутриентным действием характеризовался аквакобаламин (суммарный балл менее 0,8, что указывает на практически полное отсутствие антивитаминного и антиминерального действия). Остальные молекулы умеренно влияли на гомеостаз витаминов (за исключением тиамина и витамина D) (рис. 3а) и минералов (за исключением магния и кальция) (рис. 3b).
Высокие значения полученных оценок (0,5 и более) для магния, кальция, витамина В1 и витамина D указывают на то, что исследованные молекулы (кроме аквакобаламина) могут стимулировать выведение и/или снижение всасывания этих микронутриентов. Аквакобаламин характеризовался наименьшим антиминеральным действием: суммарный балл 0,78 (0,33 – антивитаминное действие, 0,45 – антиминеральное) (рис. 3с), что соответствует в среднем увеличению риска выведения того или иного микронутриента не более чем на 5%.
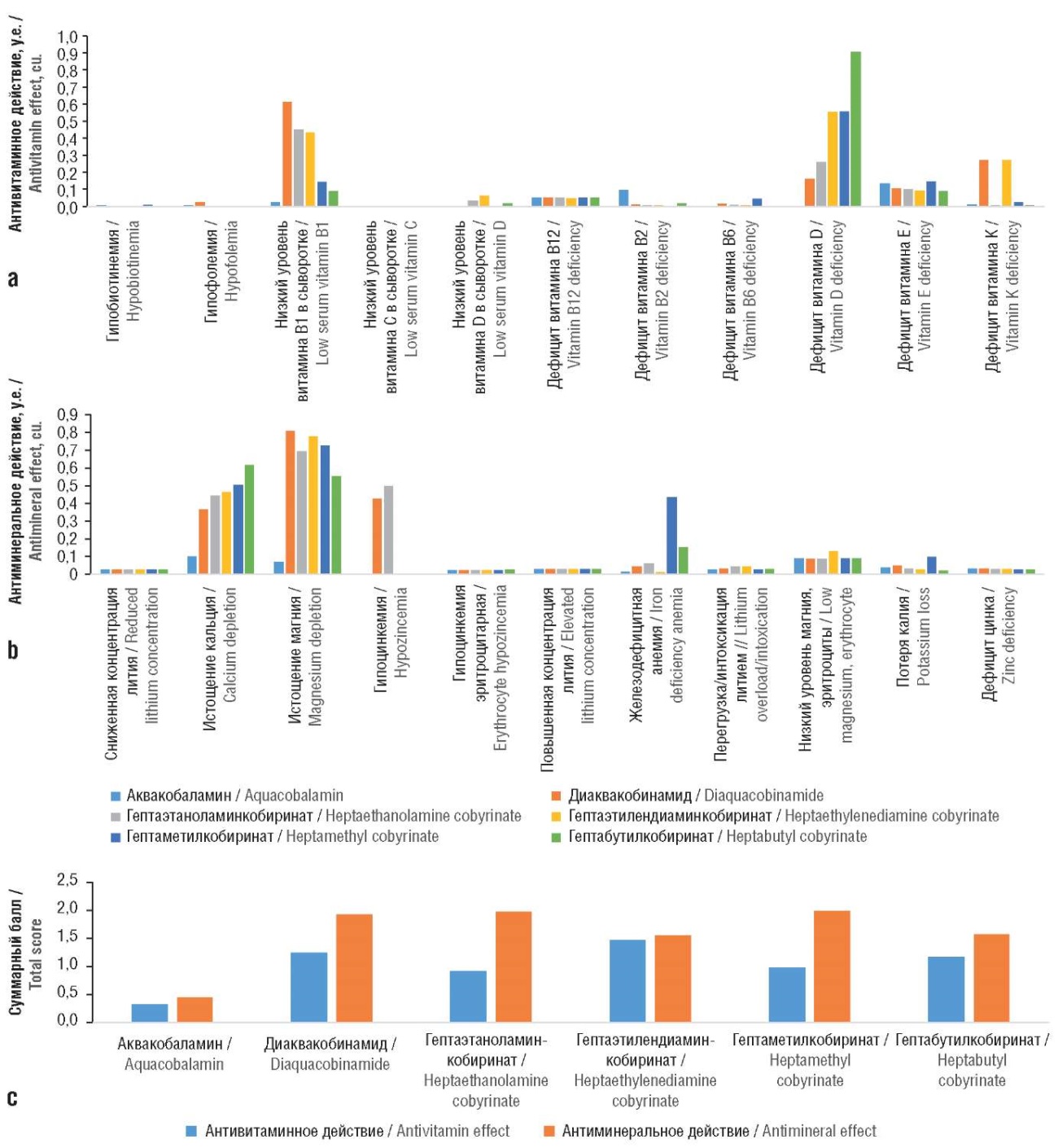
Рисунок 3. Фармакоинформационные оценки антивитаминных и антиминеральных свойств исследованных молекул:
a – антивитаминное действие; b – антиминеральное действие; c – суммарные баллы
Figure 3. Pharmacoinformatic assessments of antivitamin and antimineral properties of the studied molecules:
a – antivitamin effect; b – antimineral effect; c – total scores
ОБСУЖДЕНИЕ / DISCUSSION
Полученные в настоящем исследовании результаты не имеют мировых аналогов, т.к. в литературе неизвестны примеры исследования свойств всех обсуждаемых соединений с использованием хотя бы одной из тест-систем (тролоксовых эквивалентов и др.). Перспективы полученных данных для клинической практики и направления будущих исследований очевидны – аквакобаламин является, по всей видимости, наиболее выраженным антиоксидантом из исследованных молекул.
ЗАКЛЮЧЕНИЕ / CONCLUSION
Синтетические производные витамина В12 проявляют различные физические, химические и фармакологические свойства. Разработка методов прогнозирования свойств этих молекул по их химической структуре важна для направленного органического синтеза корринов. Ранее нами были установлены противоопухолевые и противовоспалительные эффекты производных витамина В12 (аквакобаламин, диаквакобинамид, аквациано-формы гептаэтаноламин-, гептаэтилендиамин-, гептаметил- и гептабутилкобиринатов). Результаты настоящего исследования показывают, что все изученные соединения в той или иной степени проявляют антиоксидантные свойства и умеренно влияют на обмен других микронутриентов. Эти свойства производных витамина В12 могут усиливать их противоопухолевое действие.
Список литературы
1. Громова О.А., Торшин И.Ю., Гусев Е.И. Синергидные нейропротекторные эффекты тиамина, пиридоксина и цианокобаламина в рамках протеома человека. Фармакокинетика и фармакодинамика. 2017; 1: 40–51.
2. Торшин И.Ю., Громова О.А., Майорова Л.А. О перспективах применения производных витамина В12 в фармакологии. ФАРМАКОЭКОНОМИКА. Современная фармакоэкономика и фармакоэпидемиология. 2023; 16 (3): 501–11. https://doi.org/10.17749/2070-4909/farmakoekonomika.2023.198.
3. Maiorova L.A., Vu T.T., Gromova O.A., et al. Nanostructured stable floating М-mono- and bilayers and Langmuir–Schaefer films of 5,10,15-triphenylcorrole. BioNanoScience. 2018; 8 (1): 81–9. https://doi.org/10.1007/s12668-017-0424-0.
4. Громова О.А., Третьяков В.Е., Мошковский С.А. et al. Oлигопептидная мембранная фракция церебролизина. Журнал неврологии и психиатрии им. С.С. Корсакова. 2006; 106 (7): 73–5.
5. Vu T.T., Maiorova L.A., Berezin D.B., Koifman O.I. Formation and study of nanostructured M-monolayers and LS-films of triphenylcorrole. Macroheterocycles. 2016; 9 (1): 73–9. https://doi.org/10.6060/mhc151205m.
6. Hannibal L., Axhemi A., Glushchenko A.V., et al. Accurate assessment and identification of naturally occurring cellular cobalamins. Clin Chem Lab Med. 2008; 46 (12): 1739–46. https://doi.org/10.1515/CCLM.2008.356.
7. Banerjee R., Ragsdale S.W. The many faces of vitamin B12: catalysis by cobalamin-dependent enzymes. Annu Rev Biochem. 2003; 72: 209–47. https://doi.org/10.1146/annurev.biochem.72.121801.161828.
8. Schloss J.M., Colosimo M., Airey C., Vitetta L. Chemotherapy-induced peripheral neuropathy (CIPN) and vitamin B12 deficiency. Support Care Cancer. 2015; 23 (7): 1843–50. https://doi.org/10.1007/s00520-015-2725-6.
9. Wang R., MacGillivray B.C., Macartney D.H. Stabilization of the base-off forms of vitamin B12 and coenzyme B12 by encapsulation of the alpha-axial 5,6-dimethylbenzimidazole ligand with cucurbit[7]uril. Dalton Trans. 2009; 18: 3584–9. https://doi.org/10.1039/b904028e.
10. Verma A., Sharma S., Gupta P.K., et al. Vitamin B12 functionalized layer by layer calcium phosphate nanoparticles: a mucoadhesive and pH responsive carrier for improved oral delivery of insulin. Acta Biomater. 2016; 31: 288–300. https://doi.org/10.1016/j.actbio.2015.12.017.
11. Temova Rakuša Ž., Roškar R., Hickey N., Geremia S. Vitamin B12 in foods, food supplements, and medicines – a review of its role and properties with a focus on its stability. Molecules. 2022; 28 (1): 240. https://doi.org/10.3390/molecules28010240.
12. Koseki K., Yoshimura R., Ido K., et al. Determination of vitamin B12 and folate compounds in commercially available edible seaweed products. Front Biosci. 2023; 15 (2): 10. https://doi.org/10.31083/j.fbe1502010.
13. Lehner S., Boles E. Development of vitamin B12 dependency in Saccharomyces cerevisiae. FEMS Yeast Res. 2023; 23: foad020. https://doi.org/10.1093/femsyr/foad020.
14. Watanabe F. Vitamin B12 sources and bioavailability. Exp Biol Med. 2007; 232 (10): 1266–74. https://doi.org/10.3181/0703-MR-67.
15. Abdulwahhab R.Q., Ali Alabdali S.M. Study of the protective effects of cyanocobalamin on methotrexate induced nephrotoxicity in rats. F1000Res. 2022; 11: 1012. https://doi.org/10.12688/f1000research.124081.2.
16. Khastar H., Garmabi B., ZareMehrjerdi F., et al. Cyanocobalamin improves memory impairment via inhibition of necrosis and apoptosis of hippocampal cell death after transient global ischemia/reperfusion. Iran J Basic Med Sci. 2021; 24 (2): 160–6. https://doi.org/10.22038/IJBMS.2020.48447.11126.
17. Раменская Г.В. (ред.) Сборник тестов по фармацевтической химии. Т. 1. М.: Лаборатория знаний; 2018: 304 с.
18. Re R., Pellegrini N., Proteggente A., et al. Antioxidant activity applying an improved ABTS radical cation decolorization assay. Free Radic Biol Med. 1999; 26 (9-10): 1231–7. https://doi.org/10.1016/s0891-5849(98)00315-3.
19. Huang D., Ou B., Prior R.L. The chemistry behind antioxidant capacity assays. J Agric Food Chem. 2005; 53 (6): 1841–56. https://doi.org/10.1021/jf030723c.
20. Munteanu I.G., Apetrei C. Analytical methods used in determining antioxidant activity: a review. Int J Mol Sci. 2021; 22 (7): 3380. https://doi.org/10.3390/ijms22073380.
21. Гаврилов В.Б., Гаврилова А.Р., Мажуль Л.М. Анализ методов определения продуктов перекисного окисления липидов в сыворотке крови по тесту с тиобарбитуровой кислотой. Вопросы медицинской химии. 1987; 33 (1): 118–22.
22. Müller G., Frühauf A., Mathias B. Thiobarbituric acid positive substances as indicators of lipid peroxidation. Z Gesamte Inn Med. 1986; 41 (24): 673–6 (на нем. яз.).
23. Карлюк М.В., Крыгин Ю.Ю., Майорова-Валькова Л.А. и др. Формирование двумерных (M) и трехмерных (V) наноагрегатов замещенного порфирина кобальта в ленгмюровских слоях и пленках Ленгмюра–Шефера. Известия Академии наук. Серия химическая. 2013; 62 (2): 471–9 (на англ. яз). https://doi.org/10.1007/s11172-013-0066-5.
24. Kharitonova N.V., Maiorova L.A., Koifman O.I. Aggregation behavior of unsubstituted magnesium porphyrazine in monolayers at air–water interface and in Langmuir–Schaefer films. J Porphyrins Phthalocyanines. 2018; 22 (6): 509–20. https://doi.org/10.1142/S1088424618500505.
25. Maiorova L.A., Kobayashi N., Zyablov S.V., et al. Magnesium porphine supermolecules and two-dimensional nanoaggregates formed using the Langmuir–Schaefer technique. Langmuir. 2018; 34 (31): 9322–9. https://doi.org/10.1021/acs.langmuir.8b00905.
26. Maiorova L.A., Kobayashi N., Salnikov D.S., et al. Supermolecular nanoentities of vitamin B12 derivative as a link in the evolution of the parent molecules during self-assembly at the air-water interface. Langmuir. 2023; 39 (9): 3246–54. https://doi.org/10.1021/acs.langmuir.2c02964.
27. Gromova O.A., Maiorova L.A., Salnikov D.S., et al. Vitamin B12 hydrophobic derivative exhibits bioactivity: biomedical and photophysical study. BioNanoSci. 2022; 12: 74–82. https://doi.org/10.1007/s12668-021-00916-4.
28. Torshin I.Yu., Rudakov K.V. On the procedures of generation of numerical features over partitions of sets of objects in the problem of predicting numerical target variables. Pattern Recogni Image Anal. 2019; 29 (4): 654–67. https://doi.org/10.1134/S1054661819040175.
29. Torshin I.Yu. The study of the solvability of the genome annotation problem on sets of elementary motifs. Pattern Recognit Image Anal. 2011; 21 (4): 652–62. https://doi.org/10.1134/S1054661811040171.
30. Torshin I.Yu., Rudakov K.V. On the application of the combinatorial theory of solvability to the analysis of chemographs. Part 1: Fundamentals of modern chemical bonding theory and the concept of the chemograph. Pattern Recognit Image Anal. 2014; 24 (1): 11–23. https://doi.org/10.1134/S1054661814010209.
31. Torshin I.Yu., Rudakov K.V. On the application of the combinatorial theory of solvability to the analysis of chemographs. Part 2: Local completeness of invariants of chemographs in view of the combinatorial theory of solvability. Pattern Recognit Image Anal. 2014; 24 (2): 196–208. https://doi.org/10.1134/S1054661814020151.
32. Рудаков К.В., Торшин И.Ю. Об отборе информативных значений признаков на базе критериев разрешимости в задаче распознавания вторичной структуры белка. Доклады Aкадемии наук. 2011; 441 (1): 24–8.
33. Torshin I.Yu., Rudakov K.V. Topological chemograph analysis theory as a promising approach to simulation modeling of quantum-mechanical properties of molecules. Part II: Quantum-chemical interpretations of chemograph theory. Pattern Recognit Image Anal. 2021; 31 (4): 884–96. https://doi.org/10.1134/S1054661821040258.
Об авторах
И. Ю. ТоршинРоссия
Торшин Иван Юрьевич – к.ф-м.н., к.х.н., старший научный сотрудник
WoS ResearcherID: C-7683-2018;
Scopus Author ID: 7003300274
ул. Вавилова, д. 44, корп. 2, Москва 119334
О. А. Громова
Россия
Громова Ольга Алексеевна – д.м.н., профессор, ведущий научный сотрудник
WoS ResearcherID: J-4946-2017;
Scopus Author ID: 7003589812
ул. Вавилова, д. 44, корп. 2, Москва 119334
Л. А. Майорова
Россия
Майорова Лариса Александровна – д.ф.-м.н., ведущий научный сотрудник
WoS ResearcherID: B-6288-2016;
Scopus Author ID: 58079684100
ул. Вавилова, д. 44, корп. 2, Москва 119334; пр. Шереметевский, д. 7, Иваново 153000
Что уже известно об этой теме?
► Витамин B12 важен для метаболизма фолатов, гомоцистеина, метилирования ДНК, снижения воспаления, противоопухолевой защиты посредством модулирования активности белков протеома
► Таргетная модуляция свойств производных витамина В12 посредством специфических модификаций корринового ядра позволяет получать соединения с разными фармакологическими свойствами
► Для оценки безопасности лекарств важно моделировать in silico фармакологически перспективные молекулы-кандидаты, в т.ч. оценивать их антиоксидантные свойства и влияние на обмен микронутриентов
Что нового дает статья?
► Методом хемопротеомного анализа получены оценки 140 антиоксидантных свойств аквакобаламина, диаквакобинамида, аквациано-форм гептаэтаноламин-, гептаэтилендиамин-, гептаметил- и гептабутилкобиринатов
► Все шесть химических производных витамина В12 проявляют антиоксидантные свойства, оцененные посредством моделирования различных тест-систем (в наибольшей степени – аквакобаламин)
► Аквакобаламин практически не стимулирует потерь других микронутриентов, остальные молекулы умеренно влияют на микронутриентный баланс (выведение магния, кальция, витаминов В1 и D3)
Как это может повлиять на клиническую практику в обозримом будущем?
► Антиоксидантные свойства химически модифицированных форм витамина В12 могут способствовать снижению избыточного воспаления
► Антиоксидантные эффекты производных витамина В12 и их умеренное влияние на обмен микронутриентов могут усиливать их противоопухолевое действие
Рецензия
Для цитирования:
Торшин И.Ю., Громова О.А., Майорова Л.А. Хемореактомный анализ антиоксидантных свойств производных витамина В12. ФАРМАКОЭКОНОМИКА. Современная фармакоэкономика и фармакоэпидемиология. 2024;17(3):358-367. https://doi.org/10.17749/2070-4909/farmakoekonomika.2024.239
For citation:
Torshin I.Yu., Gromova O.A., Maiorova L.A. Chemoreactomic analysis of the antioxidant properties of vitamin B12 derivatives. FARMAKOEKONOMIKA. Modern Pharmacoeconomics and Pharmacoepidemiology. 2024;17(3):358-367. (In Russ.) https://doi.org/10.17749/2070-4909/farmakoekonomika.2024.239

Контент доступен под лицензией Creative Commons Attribution-NonCommercial-ShareAlike 4.0 International License.






































