Перейти к:
Исследование пролиферативных свойств карбоната и аскорбата лития на модели метастазирования перевиваемой карциномы легких Льюис
https://doi.org/10.17749/2070-4909/farmakoekonomika.2024.236
Аннотация
Цель: изучение противоопухолевых эффектов органической соли лития (аскорбат лития) в различных дозах в сравнении с неорганической солью (карбонат лития).
Материал и методы. Проведено две серии экспериментов по влиянию препаратов лития на динамику роста и метастазирование перевиваемой карциномы легких Льюис (КЛЛ) у мышей F1 (CBA × C57Bl/6j). В первой серии осуществляли сравнительное изучение эффектов различных доз аскорбата лития (1 и 10 мг/кг/сут в расчете на элементный литий), а во второй – сравнение эффектов аскорбата и карбоната лития при использовании в одинаковой дозе (5 мг/кг/сут).
Результаты. Достоверные противоопухолевые эффекты найдены для более низких доз аскорбата лития (1 и 5 мг/кг/сут). Статистически достоверный противоопухолевый эффект аскорбата лития отмечался с 10-х суток в течение всего срока наблюдения (индекс торможения роста опухоли (ТРО) 30–40%). Противоопухолевое действие карбоната лития в этом опыте было менее выраженным и стабильным (ТРО 20–30%). Антиметастатического эффекта при воздействии обоих препаратов не наблюдалось.
Заключение. При субхроническом внутрижелудочном введении аскорбата и карбоната лития животным-опухоленосителям в ежедневной дозе 5 мг/кг отмечается противоопухолевый эффект, проявляющийся торможением роста КЛЛ. Эффективные и безопасные противоопухолевые дозы аскорбата лития лежат в диапазоне 1–5 мг/кг/сут.
Для цитирования:
Фролова Д.Е., Торшин И.Ю., Расташанский В.В., Филимонова М.В., Громова О.А. Исследование пролиферативных свойств карбоната и аскорбата лития на модели метастазирования перевиваемой карциномы легких Льюис. ФАРМАКОЭКОНОМИКА. Современная фармакоэкономика и фармакоэпидемиология. 2024;17(2):212-219. https://doi.org/10.17749/2070-4909/farmakoekonomika.2024.236
For citation:
Frolova D.E., Torshin I.Yu., Rastashansky V.V., Filimonova M.V., Gromova O.A. Study of lithium carbonate and ascorbate proliferative properties on transplantable Lewis lung carcinoma metastasis model. FARMAKOEKONOMIKA. Modern Pharmacoeconomics and Pharmacoepidemiology. 2024;17(2):212-219. (In Russ.) https://doi.org/10.17749/2070-4909/farmakoekonomika.2024.236
ВВЕДЕНИЕ / INTRODUCTION
Литий – важнейший ультрамикроэлемент, необходимый для нормального функционирования всех систем организма, в т.ч. для обмена белков, жиров, углеводов. Хорошо исследованы свойства солей лития как нейропротекторов и нейротрофических факторов [1], начинает изучаться противораковое действие органических солей лития [2].
Среди различных солей лития наиболее широко используется карбонат. Практическое применение данного соединения в клинической практике (терапия биполярного расстройства и маний) указало на его заметную нефротоксичность, особенно при приеме в течение длительного времени (месяцы) в высоких дозах (граммы). Для эффективного и безопасного использования препаратов карбоната лития необходимо регулярно измерять концентрацию лития в крови, что является дополнительной инвазивной процедурой [3].
Токсичность карбоната лития стимулирует поиск новых солей для использования в терапии литием. Одним из таких перспективных вариантов является аскорбат лития [4]. Отметим, что аскорбиновая кислота сама по себе проявляет противоопухолевое действие [5]. Дефицит витамина С приводит к усилению инвазии опухолевых клеток [6]. Витамин С характеризуется выраженной противоопухолевой активностью как сам по себе, так и в комбинации с химиотерапией (доксорубицин и др.) [7], имеет противовоспалительное действие, снижая уровни провоспалительных интерлейкинов 1, 2, 6 и фактора некроза опухоли альфа при различных видах рака (простаты, молочной железы и др.) [8]. Внутривенное введение витамина С на протяжении многих десятилетий используется в качестве адъювантной терапии для пациентов со злокачественными новообразованиями [9]. Таким образом, аскорбат лития является интересным объектом для исследования его противоопухолевых свойств.
Цель – изучение противоопухолевых эффектов органической соли лития (аскорбат лития, LiAsc) в различных дозах в сравнении с неорганической солью (карбонат лития, Li2CO3).
МАТЕРИАЛ И МЕТОДЫ / MATERIAL AND METHODS
Серии экспериментов / Experimental series
У аутбредных самцов мышей линии F1 (CBA × C57Bl/6j) (n=90, возраст 2,5–3 мес, масса тела 23–26 г) с перевиваемой карциномой легких Льюис (КЛЛ) проведены две серии экспериментов:
- сравнение эффектов LiAsc в различных дозах (1 и 10 мг/кг/сут);
- сравнение эффектов LiAsc и Li2CO3в дозе 5 мг/кг/сут.
Подсадку КЛЛ проводили введением 2×10⁶ кл/0,1 мл суспензии в поверхность правого бедра после депиляции.
Было сформировано пять групп животных:
- LiAsc в дозе 1 мг/кг/сут (n=20);
- LiAsc в дозе 10 мг/кг/сут (n=20);
- LiAsc в дозе 5 мг/кг/сут (n=20);
- Li2CO3в дозе 5 мг/кг/сут (n=20);
- контрольная группа (n=10).
Продолжительность наблюдений составила 3 нед. После подсадки КЛЛ с 7-х по 20-е сутки проводилось ежедневное зондирование LiAsc или Li2CO3 в указанных дозах с использованием 1% крахмального геля ex temp. Взвешивание животных и измерение размеров опухолевых узлов выполняли на 3-е, 7-е, 10-е, 13-е, 17-е и 21-е сутки от начала эксперимента.
Этические аспекты / Ethical aspects
Животные питомника ФГБУН «Научный центр биомедицинских технологий Федерального медико-биологического агентства» cодержались в условиях естественного освещения при температуре 18–20 °C, влажности воздуха 40–70%, с брикетированным кормом и питьем ad libitum в соответствии с правилами Европейской конвенции о защите позвоночных животных, используемых для экспериментов или в иных научных целях (Страсбург, 1986 г.), и общепринятыми этическими нормами. На 21-е сутки животных выводили из опыта путем цервикальной дислокации под эфирным наркозом, выделяли легкие, фиксировали их 24 ч в жидкости Буэна и далее выполняли подсчет числа крупных и мелких легочных метастазов.
Оценка эффектов / Evaluation of effects
Эффекты применения солей лития оценивали посредством наблюдения за неврологическим статусом и поведением животных, измерения массы тела и количественных оценок динамики роста опухоли и метастазирования.
Объем КЛЛ определяли по формуле:
V = (L × W2) × (π/6),
где L – максимальный диаметр; W – диаметр, ортогональный к L.
Индекс торможения роста опухоли (ТРО) вычисляли по формуле [11]:
ТРО = 100% × (Vк – Vо) / Vк ,
где Vк и Vо – средние объемы узлов в группах контроля и опыта соответственно.
Количественные оценки динамики роста опухоли и метастазирования проводили посредством измерения параметров V и ТРО на 3-е, 7-е, 10-е, 13-е, 17-е и 21-е сутки. Метастазы относили к крупным или малым на основании экспертного анализа гистотопограмм срезов легких и печени, окрашенных по схеме «гематоксилин + эозин». Крупными считались метастазы размером более 200 мкм.
Статистический анализ / Statistical analysis
Для изученных параметров (масса тела, объем опухолевого узла, ТРО и т.д.) проводили подсчет среднего и стандартного отклонения (M±SD). Оценку статистической достоверности осуществляли по критериям Краскела–Уоллиса и Данна в программе Statistica 7.0 (StatSoft Inc., США). Результаты считали статистически значимыми при p<0,05. Тест на нормальность распределения выполняли с помощью визуального анализа наблюдаемых и ожидаемых гистограмм распределения данных с подтверждением тестом χ² нулевой гипотезы об отсутствии отличий между наблюдаемым распределением и ожидаемым нормальным распределением (р>0,05).
РЕЗУЛЬТАТЫ / RESULTS
При выполнении двух серий экспериментов противоопухолевые эффекты установлены для более низких доз LiAsc (1 и 5 мг/кг/сут).
Эффекты аскорбата лития в дозах 1 и 10 мг/кг/сут // Effects of lithium ascorbate at doses of 1 and 10 mg/kg/day
Прием LiAsc в указанных дозах не вызывал неврологических или каких-либо поведенческих нарушений, включая прием пищи. Не установлено статистически значимых отличий в динамике роста массы тела (табл. 1).
Таблица 1. Динамика массы тела животных в экспериментальных группах, % (M±SD)*
Table 1. Dynamics of animal body weight in experimental groups, % (M±SD)*
|
Срок наблюдения, сут / Observation period, days |
Группа / Group |
||
|
Контроль / Control |
Аскорбат лития (1 мг/кг/сут) // Lithium ascorbate (1 mg/kg/day) |
Аскорбат лития (10 мг/кг/сут) // Lithium ascorbate (10 mg/kg/day) |
|
|
3 |
99,2±0,7 |
99,5±0,5 |
99,5±0,8 |
|
7 |
103,6±0,8 |
103,9±0,7 |
101,7±0,9 |
|
10 |
103,3±1,0 |
103,0±0,8 |
101,1±1,1 |
|
13 |
104,9±1,0 |
103,3±0,8 |
102,7±1,2 |
|
17 |
110,2±1,1 |
108,0±1,3 |
108,7±1,4 |
|
21 |
113,8±1,6 |
111,4±1,7 |
114,4±1,7 |
Примечание. * Показатели нормированы на исходную массу тела.
На всех сроках наблюдения сравнение с контрольной группой показало p>0,05.
Note. * Indicators were normalized to the initial body weight.
At all follow-up periods, comparison with the control group showed p>0.05.
Через 7 сут после начала эксперимента опухолевый узел определялся у всех животных. Гибель единичных подопытных отмечена только к 21-м суткам после воспроизведения модели КЛЛ. Исключение составляло одно животное в группе, получавшей LiAsc в дозе 10 мг/кг/сут, у которого до конца эксперимента не определялся первичный опухолевый узел КЛЛ и полностью отсутствовали легочные метастазы. Это наблюдение мы склонны расценивать как неудавшуюся трансплантацию карциномы, и при анализе данные по этому животному были исключены из рассмотрения.
В низкой дозе (1 мг/кг/сут) LiAsc стимулировал умеренное и стабильное ингибирование роста КЛЛ – на 20–30% (табл. 2), хотя этот эффект и ослабевал на поздних сроках наблюдения. При использовании высокой дозы LiAsc (10 мг/кг/сут) не наблюдалось сколько-нибудь значимого влияния на опухолевый рост.
Таблица 2. Динамика роста карциномы легких Льюис
в экспериментальных группах, мм³ (M±SD)*
Table 2. Dynamics of Lewis lung carcinoma growth
in experimental groups, mm³ (M±SD)*
|
Срок наблюдения, сут / Observation period, days |
Группа / Group |
||
|
Контроль / Control |
Аскорбат лития (1 мг/кг/сут) // Lithium ascorbate (1 mg/kg/day) |
Аскорбат лития (10 мг/кг/сут) // Lithium ascorbate (10 mg/kg/day) |
|
|
7 |
98,7±9,8 |
72,2±8,8 |
86,4±5,3 |
|
10 |
236,4±34,7 |
171,0±30,9 |
191,5±16,2 |
|
13 |
667,7±90,5 |
478,9±95,0 |
654,3±58,4 |
|
17 |
1302,9±159,6 |
1034,6±188,2 |
1288,7±114,4 |
|
21 |
2101,9±235,7 |
1784,7±326,8 |
2491,5±214,6 |
Примечание. * На всех сроках наблюдения сравнение с контрольной группой
показало p>0,05.
Note. * At all follow-up periods, comparison with the control group showed p>0.05.
Различалось воздействие LiAsc в использованных дозах и на метастатический прогресс карциномы (табл. 3). Если в низкой дозе (1 мг/кг/сут) изучаемое соединение не оказывало какого-либо влияния на метастазирование КЛЛ, то при высокой дозе (10 мг/кг/сут) наблюдались статистически достоверное усиление процессов метастазирования и стимуляция роста легочных метастазов КЛЛ.
Таблица 3. Метастатическая активность карциномы легких Льюис
в экспериментальных группах – среднее число легочных метастазов
на 21-е сутки роста опухоли, n (M±SD)
Table 3. Metastatic activity of Lewis lung carcinoma
in experimental groups – average number of pulmonary metastases
on Day 21 of tumor growth, n (M±SD)
|
Метастазы / Metastases |
Группа / Group |
||
|
Контроль / Control |
Аскорбат лития (1 мг/кг/сут) // Lithium ascorbate (1 mg/kg/day) |
Аскорбат лития (10 мг/кг/сут) // Lithium ascorbate (10 mg/kg/day) |
|
|
Крупные / Large |
6,3±1,1 |
5,1±1,7 |
14,1±2,2* |
|
Малые / Small |
45,9±7,8 |
47,0±9,4 |
71,5±10,9 |
|
Всего / Total |
52,2±8,5 |
52,1±10,5 |
85,6±12,2* |
Примечание. * Статистически достоверное различие с контролем (p<0,05).
Note. * Significant difference with control group (p<0.05).
Результаты экспериментов с аскорбатом и карбонатом лития в дозах 5 мг/кг/сут // Results of experiments with lithium ascorbate and carbonate at doses of 5 mg/kg/day
Субхроническое внутрижелудочное введение LiAsc и Li2CO3 (5 мг/кг/сут) не приводило к неврологическим нарушениям, изменениям пищевой активности или различиям в динамике массы тела (табл. 4).
Таблица 4. Динамика относительной массы тела в экспериментальных группах, % (M±SD)*
Table 4. Dynamics of relative body weight in experimental groups, % (M±SD)*
|
Срок наблюдения, сут / Observation period, days |
Группа / Group |
||
|
Контроль / Control |
Аскорбат лития (5 мг/кг/сут) // Lithium ascorbate (5 mg/kg/day) |
Карбонат лития (5 мг/кг/сут) // Lithium carbonate (5 mg/kg/day) |
|
|
7 |
100,0 (n=13) |
100,0 (n=14) |
100,0 (n=15) |
|
10 |
102,3±2,2 (n=13) |
100,9±2,6 (n=14) |
102,2±2,1 (n=15) |
|
13 |
106,9±2,2 (n=13) |
103,0±5,7 (n=14) |
104,1±2,7 (n=15) |
|
17 |
113,0±3,2 (n=13) |
109,4±5,3 (n=13) |
109,4±5,2 (n=14) |
|
21 |
118,8±3,7 (n=13) |
115,1±6,2 (n=13) |
114,2±6,0 (n=14) |
Примечание. * На всех сроках наблюдения сравнение с контрольной группой показало p>0,05.
Note. * At all follow-up periods, comparison with the control group showed p>0.05.
Анализ динамики роста опухолевого узла КЛЛ показал, что LiAsc и Li2CO3 уже через 3 сут после начала применения вызывали умеренное торможение роста опухолей – на 10–15% (табл. 5).
Таблица 5. Динамика роста карциномы легких Льюис
в экспериментальных группах – средний объем опухоли, мм³ (M±SD)*
Table 5. Dynamics of Lewis lung carcinoma growth
in experimental groups – average tumor volume, mm³ (M±SD)*
|
Срок наблюдения, сут / Observation period, days |
Группа / Group |
||
|
Контроль / Control |
Аскорбат лития (5 мг/кг/сут) // Lithium ascorbate (5 mg/kg/day) |
Карбонат лития (5 мг/кг/сут) // Lithium carbonate (5 mg/kg/day) |
|
|
7 |
65±25 (n=13) |
99±47 (n=14) |
81±51 (n=15) |
|
10 |
08±123 (n=13) |
363±81 (n=14) |
360±113 (n=15) |
|
13 |
601±188 (n=13) |
598±176 (n=14) |
593±251 (n=15) |
|
17 |
1730±507 (n=13) |
1732±175 (n=13) |
1622±405 (n=14) |
|
21 |
2335±694 (n=13) |
2534±424 (n=13) |
2277±521 (n=14) |
Примечание. * На всех сроках наблюдения сравнение с контрольной группой показало p>0,05.
Note. * At all follow-up periods, comparison with the control group showed p>0.05.
Значительную помеху для детального анализа этого эффекта в данном опыте представлял высокий исходный (на 7-е сутки) межгрупповой разброс. Поэтому для более четкого выделения эффектов изучаемых препаратов на рост КЛЛ исходные данные были нормированы на начальные величины объема опухоли на 7-е сутки. Статистический анализ таким образом преобразованных данных подтвердил, что оба препарата лития в этом опыте оказывали противоопухолевое действие на КЛЛ (табл. 6, рис. 1).
Таблица 6. Динамика относительного роста карциномы легких Льюис
в экспериментальных группах – средний относительный объем опухоли, отн. ед. (M±SD)
Table 6. Dynamics of relative Lewis lung carcinoma growth
in experimental groups – average relative tumor volume, relative units (M±SD)
|
Срок наблюдения, сут / Observation period, days |
Группа / Group |
||
|
Контроль / Control |
Аскорбат лития (5 мг/кг/сут) // Lithium ascorbate (5 mg/kg/day) |
Карбонат лития (5 мг/кг/сут) // Lithium carbonate (5 mg/kg/day) |
|
|
7 |
1,00 (n=13) |
1,00 (n=14) |
1,00 (n=15) |
|
10 |
6,24±1,88 (n=13) |
3,68±0,82* (n=14) |
4,43±1,39* (n=15) |
|
13 |
9,21±2,87 (n=13) |
6,06±1,79* (n=14) |
7,30±3,09 (n=15) |
|
17 |
26,50±7,77 (n=13) |
17,56±1,77* (n=13) |
19,96±4,98* (n=14) |
|
21 |
35,75±10,63 (n=13) |
25,69±4,30* (n=13) |
28,02±6,42* (n=14) |
Примечание. * Статистически достоверное различие с контролем (p<0,05).
Note. * Significant difference with control group (p<0.05).
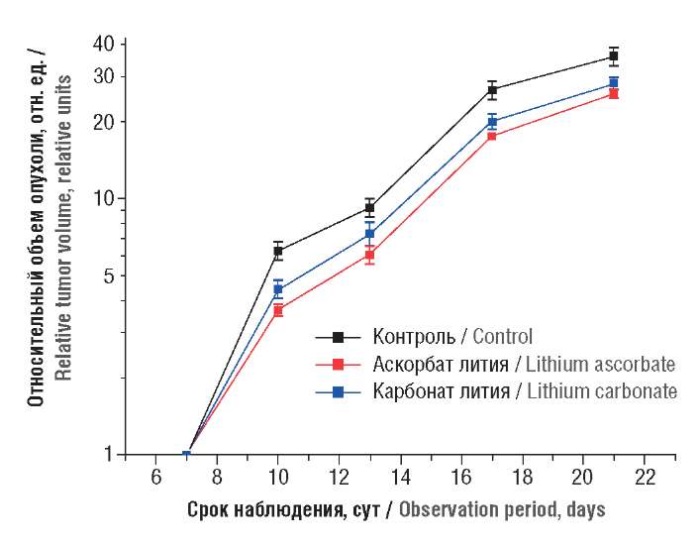
Рисунок 1. Кривые относительного роста карциномы легких Льюис.
Относительный объем опухолевых узлов (по оси Y)
представлен в логарифмической шкале
Figure 1. Lewis lung carcinoma relative growth curves.
The relative tumor node volume (Y axis) is presented on a logarithmic scale
Сравнение эффектов LiAsc и Li2CO3 показало, что действие LiAsc более заметно (наличие статистически достоверного эффекта с 10-х суток наблюдений при значении индекса ТРО 30–40%), чем действие Li2CO3 (ТРО 20–30%). LiAsc и Li2CO3 практически не влияли на формирование метастазов (табл. 7).
Таблица 7. Среднее число легочных метастазов в экспериментальных группах
на 21-е сутки роста карциномы легких Льюис, n (M±SD)
Table 7. The average number of pulmonary metastases in the experimental groups
on Day 21 of Lewis lung carcinoma growth, n (M±SD)
|
Метастазы / Metastases |
Группа / Group |
||
|
Контроль (n=13) / Control (n=13) |
Аскорбат лития (n=13) / Lithium ascorbate (n=13) |
Карбонат лития (n=14) / Lithium carbonate (n=14) |
|
|
Крупные / Large |
4,7±4,2 |
9,6±9,3 |
4,3±4,1 |
|
Малые / Small |
17,3±8,8 |
24,6±9,6 |
22,3±12,7 |
|
Всего / Total |
22,0±12,5 |
34,2±15,7 |
26,6±15,4 |
ОБСУЖДЕНИЕ / DISCUSSION
Соли лития считаются важными молекулами – кандидатами для противоопухолевой терапии. Воздействие ионов Li+ на сигнальные маршруты, вовлеченные в механизмы деления и пролиферации клеток (PKB/Akt, Wnt/catenin, Е-циклин и др.), предоставляет фундаментальную базу, обосновывающую возможность применения литиевых препаратов как противоопухолевых средств [12][13].
В литературе имеются исследования эффектов солей лития на гепатоцеллюлярную карциному [13], рак головы и шеи [14], рак толстой кишки [15][16] и т.д. В частности, неорганический хлорид лития индуцирует мезенхимально-эпителиальный ревертирующий переход в первичных культурах клеток рака толстой кишки. Однако, за редким исключением (например, исследование эффектов соли лития на раковую кахексию [17]), подавляющее большинство таких исследований были проведены in vitro на культурах опухолевых клеток и не были апробированы на животных.
По имеющимся данным отечественной и мировой научной литературы, к настоящему времени нет исследований, в которых бы изучались противоопухолевые эффекты солей лития на модели КЛЛ (которая является, подчеркнем, стандартной моделью для исследования противоопухолевых свойств соединений). В этом смысле в настоящей работе получены уникальные результаты, вносящие существенный вклад в оценку противоопухолевого действия солей лития.
Возможно, отсутствие воспроизводимых и надежных результатов по противоопухолевым эффектам солей лития у животных связано с тем, что практически все исследования такого рода используют только неорганические соли лития (карбонат, хлорид). Между тем неорганические соли лития вообще и карбонат лития в частности характеризуются сниженным всасыванием внутрь клеток (в отличие от солей с органическими анионами, для которых имеются соответствующие транспортные каналы [4]). В настоящем исследовании показано, что противоопухолевые свойства аскорбата лития более выраженны, чем в случае карбоната лития при использовании в том же количестве (в расчете на элементный литий).
Помимо собственно противоопухолевого действия нейропротекторные эффекты таких органических солей лития, как аскорбат [1][4], весьма важны для защиты нервной системы пациентов, проходящих химиотерапию веществами с выраженным нейротоксичным побочным действием. Полученные результаты открывают перспективы для дальнейших доклинических исследований аскорбата лития на других моделях опухолей и использования солей лития в качестве адъювантной терапии у пациентов с онкологическими заболеваниями.
ЗАКЛЮЧЕНИЕ / CONCLUSION
При зондировании мышей с моделью КЛЛ LiAsc в дозах 1 и 5 мг/кг/сут проявляет устойчивую тенденцию к торможению роста КЛЛ при отсутствии антиметастатического действия. При субхроническом введении LiAsc животным-опухоленосителям в ежедневной дозе 10 мг/кг не отмечено торможения роста КЛЛ. При субхроническом введении LiAsc и Li2CO3 животным в ежедневной дозе 5 мг/кг регистрируется противоопухолевый эффект, проявляющийся торможением роста КЛЛ.
Наиболее выраженное и стабильное действие оказывает LiAsc: при его субхроническом воздействии индекс ТРО составляет 30–40%. Антиметастатического эффекта обоих препаратов в дозе 5 мг/кг/сут не наблюдается.
Список литературы
1. Гоголева И.В., Громова О.А., Торшин И.Ю. и др. Нейробиологическая роль солей лития. Журнал неврологии и психиатрии им. С.С. Корсакова. 2022; 122 (11): 17–23. https://doi.org/10.17116/jnevro202212211117.
2. Vidali S., Aminzadeh-Gohari S., Vatrinet R., et al. Lithium and not acetoacetate influences the growth of cells treated with lithium acetoacetate. Int J Mol Sci. 2019; 20 (12): 3104. https://doi.org/10.3390/ijms20123104.
3. Cousins D.A., Squarcina L., Boumezbeur F., et al. Lithium: past, present, and future. Lancet Psychiatry. 2020; 7 (3): 222–4. https://doi.org/10.1016/S2215-0366(19)30365-7.
4. Torshin I.Y., Gromova O.A., Ostrenko K.S., et al. Lithium ascorbate as a promising neuroprotector: fundamental and experimental studies of an organic lithium salt. Molecules. 2022; 27 (7): 2253. https://doi.org/10.3390/molecules27072253.
5. Härtel C., Strunk T., Bucsky P., Schultz C. Effects of vitamin C on intracytoplasmic cytokine production in human whole blood monocytes and lymphocytes. Cytokine. 2004; 27 (4–5): 101–6. https://doi.org/10.1016/j.cyto.2004.02.004.
6. Cha J., Roomi M.W., Ivanov V., et al. Ascorbate supplementation inhibits growth and metastasis of B16FO melanoma and 4T1 breast cancer cells in vitamin C-deficient mice. Int J Oncol. 2013; 42 (1): 55–64. https://doi.org/10.3892/ijo.2012.1712.
7. Kurbacher C.M., Wagner U., Kolster B., et al. Ascorbic acid (vitamin C) improves the antineoplastic activity of doxorubicin, cisplatin, and paclitaxel in human breast carcinoma cells in vitr. Cancer Lett. 1996; 103 (2): 183–9. https://doi.org/10.1016/0304-3835(96)04212-7.
8. Mikirova N., Riordan N., Casciari J. Modulation of cytokines in cancer patients by intravenous ascorbate therapy. Med Sci Monit. 2016; 22: 14–25. https://doi.org/10.12659/MSM.895368.
9. Carr A.C., Cook J. Intravenous vitamin C for cancer therapy – identifying the current gaps in our knowledge. Front Physiol. 2018; 9: 1182. https://doi.org/10.3389/fphys.2018.01182.
10. Kawano K., Hattori Y., Iwakura H., et al. Adrenal tumor volume in genetically engineered mouse model of neuroblastoma determined by magnetic resonance imaging. Exp Ther Med. 2012; 4 (1): 61–4. https://doi.org/10.3892/etm.2012.564.
11. Хабриев Р.У. (ред.) Руководство по экспериментальному (доклиническому) изучению новых фармакологических веществ. 2-е изд. М.: Медицина; 2005: 832 с.
12. Таскаева И.С. Бгатова Н.П., Соли лития в экспериментальной онкологии (обзор литературы). Сибирский научный медицинский журнал. 2019; 39 (5): 12–8. https://doi.org/10.15372/SSMJ20190502.
13. Erdal E., Ozturk N., Cagatay T., et al. Lithium-mediated downregulation of PKB/Akt and cyclin E with growth inhibition in hepatocellular carcinoma cells. Int J Cancer. 2005; 115 (6): 903–10. https://doi.org/10.1002/ijc.20972.
14. Zubčić V., Rinčić N., Kurtović M., et al. GANT61 and lithium chloride inhibit the growth of head and neck cancer cell lines through the regulation of GLI3 processing by GSK3β. Int J Mol Sci. 2020; 21 (17): 6410. https://doi.org/10.3390/ijms21176410.
15. de Araujo W.M., Robbs B.K., Bastos L.G., et al. PTEN overexpression cooperates with lithium to reduce the malignancy and to increase cell death by apoptosis via PI3K/Akt suppression in colorectal cancer cells. J Cell Biochem. 2016; 117 (2): 458–69. https://doi.org/10.1002/jcb.25294.
16. Costabile V., Duraturo F., Delrio P., et al. Lithium chloride induces mesenchymal‑to‑epithelial reverting transition in primary colon cancer cell cultures. Int J Oncol. 2015; 46 (5): 1913–23. https://doi.org/10.3892/ijo.2015.2911.
17. Lee J.H., Kim S.W., Kim J.H., et al. Lithium chloride protects against sepsis-induced skeletal muscle atrophy and cancer cachexia. Cells. 2021; 10 (5): 1017. https://doi.org/10.3390/cells10051017.
Об авторах
Д. Е. ФроловаРоссия
Фролова Дарья Евгеньевна – ассистент кафедры онкологии, акушерства и гинекологии
Шереметевский пр-т, д. 8, Иваново 153012
И. Ю. Торшин
Россия
Торшин Иван Юрьевич – к.ф-м.н., к.х.н., ведущий научный сотрудник
WoS ResearcherID: C-7683-2018;
Scopus Author ID: 7003300274
ул. Вавилова, д. 44, корп. 2, Москва 119334
В. В. Расташанский
Россия
Расташанский Вячеслав Валериевич – аналитик
ул. Нобеля (территория Инновационного центра Сколково), д. 5, Москва 121205
М. В. Филимонова
Россия
Филимонова Марина Владимировна – д.м.н., д.б.н., профессор, заведующая лабораторией радиационной фармакологии
Scopus Author ID: 36894092800
ул. Королева, д. 4, Обнинск 249036
О. А. Громова
Россия
Громова Ольга Алексеевна – д.м.н., профессор, ведущий научный сотрудник
WoS ResearcherID: J-4946-2017;
Scopus Author ID: 7003589812
ул. Вавилова, д. 44, корп. 2, Москва 119334
Что уже известно об этой теме?
- Ионы лития оказывают нейротрофическое, нейропротекторное, противовопалительное и противоопухолевое действие
- Среди различных солей лития наиболее широко используется карбонат
- В клинической практике высокие внутривенные дозы витамина С давно используются в качестве дополнительной терапии у пациентов со злокачественными опухолями
Что нового дает статья?
- Показано, что применение карбоната и аскорбата лития в различных экспериментальных группах животных уже через 3 сут вызывало умеренное торможение роста карциномы легких Льюис (КЛЛ) – на 10–15%
- Субхроническое введение аскорбата лития в низкой дозе (1 мг/кг/сут) животным-опухоленосителям приводило к умеренному (на 20–30%), но достаточно стабильному торможению роста КЛЛ
- При использовании высокой дозы аскорбата лития (10 мг/кг/сут) не отмечено значимого влияния на опухолевый рост
Как это может повлиять на клиническую практику в обозримом будущем?
- При раке легких возможно применение солей лития в сочетании со стандартными методами лечения для усиления их противоопухолевого действия
Рецензия
Для цитирования:
Фролова Д.Е., Торшин И.Ю., Расташанский В.В., Филимонова М.В., Громова О.А. Исследование пролиферативных свойств карбоната и аскорбата лития на модели метастазирования перевиваемой карциномы легких Льюис. ФАРМАКОЭКОНОМИКА. Современная фармакоэкономика и фармакоэпидемиология. 2024;17(2):212-219. https://doi.org/10.17749/2070-4909/farmakoekonomika.2024.236
For citation:
Frolova D.E., Torshin I.Yu., Rastashansky V.V., Filimonova M.V., Gromova O.A. Study of lithium carbonate and ascorbate proliferative properties on transplantable Lewis lung carcinoma metastasis model. FARMAKOEKONOMIKA. Modern Pharmacoeconomics and Pharmacoepidemiology. 2024;17(2):212-219. (In Russ.) https://doi.org/10.17749/2070-4909/farmakoekonomika.2024.236

Контент доступен под лицензией Creative Commons Attribution-NonCommercial-ShareAlike 4.0 International License.






































