Перейти к:
Нормативное правовое регулирование изготовления лекарственных препаратов аптечными организациями: опыт латвийского фармацевтического рынка
https://doi.org/10.17749/2070-4909/farmakoekonomika.2024.189
Аннотация
С целью совершенствования подходов к нормативному правовому регулированию особого и социально значимого вида фармацевтической деятельности аптечных организаций в области изготовления и отпуска лекарственных препаратов в статье изучены технологические, организационные, регуляторные требования по вопросам обеспечения качества и безопасности, а также особенности обращения экстемпоральных лекарственных препаратов на латвийском фармацевтическом рынке. Данная работа является продолжением цикла статей об аптечной практике изготовления лекарственных препаратов в мировых системах здравоохранения.
Ключевые слова
Для цитирования:
Мамедов Д.Д., Юрочкин Д.С., Зеликова Д.Д., Эрдни-Гаряев С.Э., Голант З.М., Наркевич И.А. Нормативное правовое регулирование изготовления лекарственных препаратов аптечными организациями: опыт латвийского фармацевтического рынка. ФАРМАКОЭКОНОМИКА. Современная фармакоэкономика и фармакоэпидемиология. 2024;17(1):106-117. https://doi.org/10.17749/2070-4909/farmakoekonomika.2024.189
For citation:
Mamedov D.D., Yurochkin D.S., Zelikova D.D., Erdni-Garyaev S.E., Golant Z.M., Narkevich I.A. Compounding pharmacy regulations: experience of the Latvian pharmaceutical market. FARMAKOEKONOMIKA. Modern Pharmacoeconomics and Pharmacoepidemiology. 2024;17(1):106-117. (In Russ.) https://doi.org/10.17749/2070-4909/farmakoekonomika.2024.189
ВВЕДЕНИЕ / INTRODUCTION
В настоящее время в Российской Федерации (РФ) активно обсуждаются вопросы, направления и векторы развития деятельности аптечных организаций (АО), имеющих лицензию на фармацевтическую деятельность с правом изготовления лекарственных препаратов (производственных аптек), как одного из видов социально-экономических институтов, который является значимым элементом системы здравоохранения.
Ключевыми направлениями в деятельности производственных аптек являются индивидуальное изготовление лекарственных препаратов (ЛП), в т.ч. в виде внутриаптечной заготовки, и индивидуальная фасовка зарегистрированных ЛП, которые осуще-
ствляются в форме оказания (выполнения) услуг (работ) [1][2]. Технологические процессы этих направлений деятельности должны соответствовать необходимому уровню качества, решать задачи по оптимизации и снижению затрат на фармакотерапию для системы здравоохранения, чего в части случаев невозможно достичь в рамках промышленного производства готовых лекарственных форм. Современные подходы и мировая практика в сфере обес-
печения качества при осуществлении фармацевтической деятельности предъявляют особые требования к инфраструктуре производственных аптек – степени их оснащенности инженерными системами, технологическим и аналитическим оборудованием, уровню квалификации персонала.
Регуляторные системы всех стран мира стремятся к повышению требований для фармацевтических организаций с целью обеспечения безопасности ЛП и персонала, задействованного при производстве и (или) изготовлении. С учетом сложности и трудоемкости разработки технологий изготовления рецептур ЛП и их соответствующих аналитических методик контроля качества, включающих методы экспресс-анализа, фармацевтическая деятельность по изготовлению ЛП будет развиваться в основном специализированными АО, имеющими достаточный инвестиционный и технологический ресурс для соответствия регуляторным требованиям и обеспечения экономической эффективности такой деятельности.
Потребность в повышении эффективности затрат на фармакотерапию ставит вопрос об определении направлений и векторов развития аптечной инфраструктуры в области изготовления ЛП в качестве одного из приоритетов системы лекарственного обес-
печения как в госпитальном, так и в амбулаторном сегментах обращения лекарственных средств (ЛС).
Вместе с тем, говоря об основах формирования единой гармонизированной системы нормативного правового регулирования в области обращения ЛП, изготавливаемых АО на территории РФ, при совершенствовании законодательных и подзаконных нормативных правовых документов в сфере изготовления и отпуска ЛП необходимо рассматривать текущий опыт мировых систем здравоохранения, обращая внимание, прежде всего, на элементы обеспечения качества и безопасности при изготовлении ЛП, а также выявлять лучшие практики, которые доказали свою рациональность и обоснованность или потенциально считаются перспективными для имплементации в национальную систему обращения ЛС. Такие элементы относятся к формированию надлежащей системы обеспечения качества, внедрению институционального подхода к инспектированию и сертификации производственных аптек с учетом особенностей лицензирования фармацевтической деятельности, выработки единых подходов, стандартов, нормативных и методических рекомендаций, применимых к изготовлению и отпуску ЛП, которые в обязательном порядке основываются на структурном понимании особенностей изготовления и отпуска ЛП.
Таким образом, целесообразным является глубокое изучение принципов нормативного правового поля и опыта каждого из региональных фармацевтических рынков стран Европы в отношении деятельности производственных аптек. Настоящая обзорная статья, являясь частью научных изысканий коллектива авторов и продолжением цикла статей об аптечной практике изготовления ЛП в мировых системах здравоохранения, представляет в структурированном виде основные результаты изучения нормативной правовой базы производственных аптек и описывает их роль в латвийской системе здравоохранения [1][3–5].
Цель работы заключалась в выявлении лучших практик и подходов к регулированию деятельности производственных аптек на территории Латвии, возможных к применению на территории РФ.
Для достижения поставленной цели решены следующие задачи:
– проведен обзор, систематизированы и проанализированы нормативные правовые документы Латвии в области изготовления ЛП;
– установлены основные различия и сходства в подходах к регулированию в сравнении с российским законодательством в области изготовления ЛП;
– выработаны предложения, которые могут рассматриваться для совершенствования процессов обращения экстемпоральных лекарственных препаратов (ЭЛП) на территории РФ.
В качестве материалов использованы:
– нормативные правовые акты Европейского союза (ЕС);
– нормативные правовые акты Латвии;
– аналитические данные регуляторных органов ЕС и Латвии;
– научные статьи в рецензируемых изданиях по предмету исследования.
ОСНОВЫЕ ПРИНЦИПЫ НОРМАТИВНОГО ПРАВОВОГО РЕГУЛИРОВАНИЯ ПРОИЗВОДСТВЕННЫХ АПТЕК В СИСТЕМЕ ЗДРАВООХРАНЕНИЯ ЛАТВИИ / BASIC PRINCIPLES OF COMPOUNDING PHARMACIES STATUTORY REGULATION IN LATVIAN HEALTHCARE SYSTEM
Закон о фармацевтике / Pharmaceutical Law
Основным нормативным правовым документом, регулирующим обращение ЛП на территории Латвии, является Закон о фармацевтике от 10 апреля 1997 г. (ред. от 9 декабря 2021 г.; латыш. Farmācijas likums; далее – Закон Латвии) [6]. В соответствии со ст. 1 Закона Латвии установлены следующие понятия:
– фармацевтическая практика – деятельность, осуществляемая фармацевтическими работниками в целях оказания фармацевтической помощи в установленном законодательством порядке в АО;
– фармацевтическая помощь – составная часть (элемент) медицинской помощи, которую осуществляют фармацевтические работники в пределах своей компетенции (в рамках фармацевтической помощи рассматривают реализацию ЛП и других товаров медицинского назначения, фармацевтическое консультирование, фармаконадзор над пациентами АО, изготовление ЛП, популяризацию здорового образа жизни, информирование пациентов о наличии ЛП в других АО);
– фармацевтическая и ветеринарно-фармацевтическая деятельность – лицензируемые виды фармацевтической коммерческой деятельности, связанные с производством, стандартизацией, контролем качества и реализацией ЛС для медицинского, а также ветеринарного применения;
– производство ЛС – деятельность, включающая в себя закупку необходимых сырья и материалов, производство ЛС на одной, нескольких или всех стадиях технологического процесса, контроль качества, хранение и реализацию произведенных ЛС.
Изготовление ЛП осуществляется по рецептам и требованиям медицинских организаций (МО) – данное право закреплено в ст. 33 Закона Латвии. Исходя из положений ст. 34 Закона Латвии, выделяют следующие типы АО:
– общественные аптеки, которые могут осуществлять отпуск зарегистрированных ЛП населению, изготовление и отпуск ЛП, отпуск ЛП в учреждения здравоохранения, социальной защиты, а также Национальным вооруженным силам Латвии (латыш. Latvijas Nacionālie bruņotie spēki);
– аптеки, являющиеся структурными подразделениями МО (далее – больничные аптеки), которые могут осуществлять фасовку, изготовление, распределение ЛП между МО (межбольничная аптека);
– ветеринарные аптеки.
Согласно п. 6 ст. 20 Закона Латвии ЛП, изготавливаемые АО (или ЭЛП), не подлежат государственной регистрации. Следует отметить, что Закон Латвии гармонизирован с Правилами надлежащей аптечной практики на территории ЕС (англ. Good pharmacy practice in Europe), а также с Руководством Международной фармацевтической федерации (франц. Fédération Internationale Pharmaceutique, FIP) и Всемирной организации здравоохранения (ВОЗ; англ. World Health Organization, WHO) по надлежащей аптечной практике (англ. Joint FIP/WHO guidelines on good pharmacy practice: standards for quality of pharmacy services) [3] и рассматривает изготовление ЛП аптечными организациями как один из видов фармацевтических услуг.
Порядок лицензирования / Licensing procedure
Постановлением Кабинета министров Латвии «О порядке лицензирования фармацевтической деятельности» от 27 октября 2011 г. № 800 (ред. от 26 января 2016 г.; латыш. Farmaceitiskās darbības licencēšanas kārtība; далее – Порядок лицензирования) [7] установлен порядок лицензирования следующих видов деятельности:
– производство ЛС (латыш. Licenci zāļu ražošanai), в т.ч. наркотических, психотропных веществ и их прекурсоров, этилового спирта;
– организация оптовой торговли ЛС;
– деятельность больничных, общественных и ветеринарных аптек (латыш. licences aptiekas atvēršanai).
К каждому соискателю лицензии устанавливаются определенные требования в зависимости от перечня выполняемых работ и (или) оказываемых услуг, составляющих деятельность производителей ЛС, организаций оптовой торговли или АО, которые указываются в лицензии.
Лицензирование фармацевтической деятельности, приостановление и продление сроков действия лицензии осуществляет Государственное агентство по регулированию обращения лекарственных средств Латвии (латыш. Zāļu valsts aģentūra).
Вторая глава Порядка лицензирования посвящена требованиям, предъявляемым к заявителям (производителям ЛС, организациям оптовой торговли и АО) и включает перечень документов, которые соискателю необходимо предоставить для получения соответствующей лицензии. Например, для получения лицензии на производство ЛС прикладывают копию GMP-сертификата1, планы производственных зон и систем водоснабжения производственной площадки, организационную структуру производства, перечень используемого оборудования.
Пятой главой Порядка лицензирования предусмотрены дополнительные виды фармацевтических услуг (работ) общественных аптек, которые указываются в лицензии отдельно. В перечень дополнительных услуг (работ) больничной аптеки входят отпуск наркотических и психотропных ЛП и изготовление ЛП. Законодательством Латвии не установлен отдельный вид оказываемых (выполняемых) услуг (работ) АО по фасовке зарегистрированных ЛП. При заполнении заявления на получение лицензии, указанного в Приложении № 5 Порядка лицензирования, в п. 7.3 «Изготовление ЛП» соискатель лицензии указывает должностное лицо, ответственное за изготовление ЛП в АО, его регистрационный номер в реестре Латвийского общества фармацевтов (латыш. Latvijas Farmaceitu biedrības), квалификацию и стаж работы. Также при подаче лицензии соискатель предоставляет план АО, в котором должно быть показано расположение производственных помещений. В Приложении № 5 Порядка лицензирования указан перечень фармацевтических услуг (работ), составляющих деятельность АО, который представлен на рисунке 1.
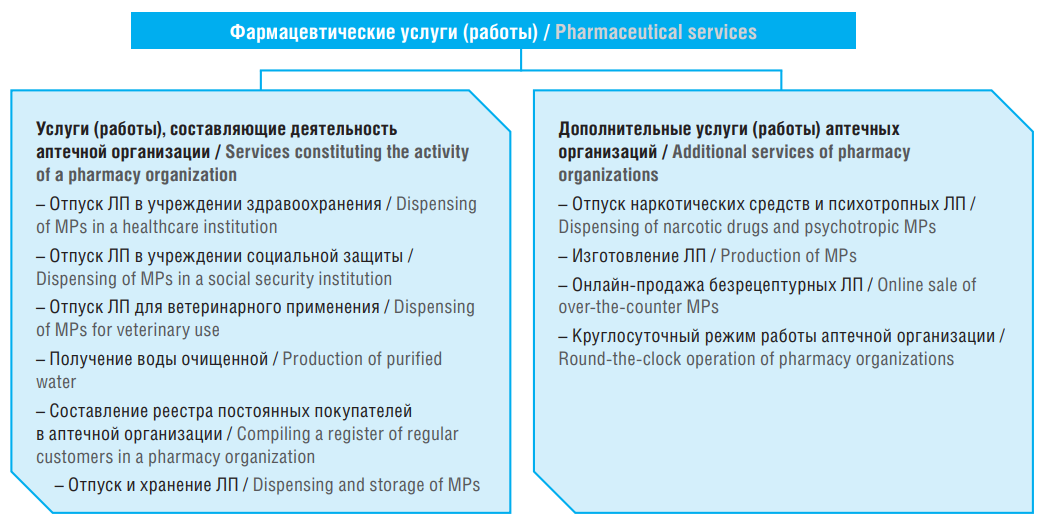
Рисунок 1. Перечень фармацевтических услуг (работ) аптечных организаций в Латвии.
ЛП – лекарственные препараты
Figure 1. List of pharmaceutical services provided by pharmacy organizations in Latvia.
MPs – medicinal products
Вся информация об АО и перечне оказываемых (выполняемых) услуг (работ) размещается на официальном сайте в сети интернет Государственного агентства по регулированию обращения лекарственных средств Латвии [8].
Согласно п. 75 Порядка лицензирования размер государственной пошлины для выдачи лицензии зависит от расположения аптеки (в городе – 284,57 евро, за пределами города – 42,69 евро).
Порядок лицензирования также предусматривает, что АО, не обладающая правом на изготовление и отпуск ЛП, вправе заключить договор оказания (выполнения) аутсорсинговых услуг (работ) со сторонней АО, наделенной указанным правом. Копия договора прикрепляется к заявлению при подаче документов на получение лицензии. Таким образом, на законодательном уровне установлено, что в случае, если АО не имеет возможности изготовить ЛП, фармацевтический работник принимает от пациента рецепт и обеспечивает изготовление ЛП в АО, которая имеет соответствующее право согласно лицензии. При этом изготовленный ЛП доставляется в аптеку, в которой был получен рецепт от пациента.
Правила работы аптек / Rules for pharmacies operation
Общие правила работы и требования к помещениям АО описаны в постановлении Кабинета министров Латвии от 23 марта 2010 г. № 288 «Правила работы аптек» (ред. от 14 декабря 2021 г.; латыш. Aptieku darbības noteikumi; далее – Правила работы аптек) [9]. Во втором разделе Правил работы аптек указан перечень помещений и оборудования, необходимых для аптеки, имеющей право изготавливать ЛП:
– помещение для изготовления нестерильных ЛП;
– помещение для изготовления стерильных ЛП (асептический блок);
– отдельное помещение для получения и хранения воды очищенной или воды для инъекций;
– устройства и оборудование, предназначенные для изготовления и контроля качества ЭЛП;
– отдельное помещение для хранения ЭЛП.
Правилами работы аптек установлено, что в АО, осуществляющей изготовление ЛП для МО, должно быть оборудовано отдельное помещение для хранения ЭЛП для МО.
Согласно третьему разделу Правил работы аптек заведующий аптекой отвечает за разработку политики в области качества АО, а также стандартных операционных процедур и инструкций, в которых должны быть отражены порядок изготовления и контроль качества ЭЛП.
Исходя из положений четвертого раздела Правил работы аптек, в качестве дополнительной услуги в АО Латвии пациенту могут быть предложены измерение уровня сахара, холестерина, давления, проведение вакцинации. Также аптека имеет право формировать (создавать) и вести реестр постоянных посетителей (пациент включается в него только при согласии) в целях:
– проведения фармаконадзора;
– предупреждения пациентов о нежелательных реакциях;
– подбора ЛП с учетом противопоказаний;
– взаимодействия «врач – пациент – фармацевт» (при этом врач имеет доступ к данным о ЛП, которые в течение года приобретал пациент).
Согласно п. 40 Правил работы аптек работа в АО должна быть организована таким образом, чтобы пациент получал необходимый ЛП в кратчайшие сроки. Если ЛП отсутствует в аптеке в виде зарегистрированного ЛП, фармацевтический работник обеспечивает его изготовление (при наличии необходимых фармацевтических субстанций). Таким образом, можно сделать вывод, что Закон Латвии и Правила работы аптек не содержат запрет на изготовление зарегистрированных ЛП [10][11].
Правила выписывания рецептов / Rules for prescribing
Общие правила выписывания рецептов на ЛП описаны в постановлении Кабинета министров Латвии от 8 марта 2005 г. № 175 «Правила изготовления и хранения рецептурных бланков, а также выписки и хранения рецептов» (ред. от 22 августа 2017 г.; латыш. Recepšu veidlapu izgatavošanas un uzglabāšanas, kā arī recepšu izrakstīšanas un uzglabāšanas noteikumi; далее – Правила выписывания рецептов) [12]. Согласно разделу 3.1 Правил выписывания рецептов допускается оформлять электронные рецепты на ЛП, подлежащие изготовлению.
В Приложении № 3 Правил выписывания рецептов установлены требования к заполнению рецептов. В случаях выписывания ЛП, которые необходимо изготовить в АО, медицинский работник (врач или фельдшер) указывает в рецепте наименование каждой фармацевтической субстанции и вспомогательного вещества, запись о которых ведется отдельной строкой с перечислением вначале наркотических, психотропных и других веществ, подлежащих количественному учету, затем остальных веществ особого действия, и в последнюю очередь указываются прочие действующие вещества. Вспомогательные вещества, используемые в процессе изготовления ЛП, указываются в рецепте последними.
К основным требованиям при изготовлении ЛП относят:
– проведение фармацевтическим работником фармацевтической экспертизы рецепта, при этом в соответствии с Правилами выписывания рецептов при наличии в рецепте неточностей или несовместимостей фармацевтический работник обязан связаться с лечащим врачом для корректировки прописи;
– изготовление ЛП в соответствии с утвержденными стандартными операционными процедурами АО;
– проведение контроля качества изготовленных ЛП;
– маркировку ЭЛП, которая осуществляется в соответствии с требованиями нормативных документов.
Согласно п. 42 Правил работы аптек ЭЛП должны быть изготовлены для пациента не позднее 24 ч с момента получения фармацевтическим работником рецепта. Также к аптекам предъявляются требования по количеству сотрудников, которых должно быть не менее двух – провизор-технолог (ответственный и занятый при изготовлении ЛП) и провизор-аналитик (ответственный и осуществляющий контроль качества ЭЛП).
Правила маркировки / Rules for labeling
Требования относительно маркировки ЭЛП указаны в главе 5 «Маркировка лекарственных препаратов, изготовленных в аптеке» постановления Кабинета министров от 25 января 2006 г. № 57 «Правила маркировки лекарственных препаратов» (ред. от 21 декабря 2021 г.; латыш. Noteikumi par zāļu marķēšanas kārtību un zāļu lietošanas instrukcijai izvirzāmajām prasībām; далее – Постановление № 57) [13]. Согласно данным правилам на этикетке должна быть указана следующая информация: название АО, адрес и номер телефона, имя и фамилия пациента или название МО, состав ЛП, способ применения ЛП, дата изготовления и срок годности ЛП, ФИО и подпись провизора, предупредительные надписи, номер рецепта или МО, розничная цена (не распространяется на ЛП, которые изготавливаются по требованию МО).
В зависимости от способа применения ЛП используют специальные сигнальные цвета этикеток и текст:
– «внутрь» – на зеленом фоне белыми буквами;
– «наружно» – на оранжевом фоне белыми буквами;
– «глазные капли», «глазные мази» – на розовом фоне черными буквами.
На всех этикетках для оформления ЭЛП должны быть нанесены соответствующие предупредительные надписи:
– «встряхнуть перед использованием» (для суспензий и эмульсий) – зелеными буквами на белом фоне;
– «хранить в прохладном, защищенном от света месте» (для эмульсий, суспензий, мазей, капель для внутреннего применения) – белыми буквами на синем фоне;
– «детское» (для ЛП, предназначенных для детского населения в возрасте до 14 лет) – черными буквами на зеленом фоне;
– «с осторожностью» (для ЛП, содержащих наркотические, психотропные и другие вещества, подлежащие предметно-количественному учету, в т.ч. атропина сульфата, нитрата серебра, ангидрида мышьяковистой кислоты, арсената натрия, дикаина, эфедрина, псевдоэфедрина, фенобарбитала, тригексифенидила) – красными буквами на белом фоне;
– «беречь от огня» (для ЛП, содержащих легковоспламеняю-
щиеся или взрывоопасные вещества) – белыми буквами на красном фоне.
Принципы формирования цен / Principles of price formation
В постановлении Кабинета министров Латвии от 1 декабря 2015 г. № 803 «О принципах формирования цен на лекарственные препараты» (ред. от 1 сентября 2015 г.; латыш. Noteikumi par zāļu cenu veidošanas principiem) указана формула, по которой производственная аптека рассчитывает стоимость ЭЛП [14]. В Приложении № 3 к данному нормативному правовому документу указаны наценки в зависимости от лекарственной формы (ЛФ) изготовленного ЛП:
C = I + IMI + Z + Н,
где C – стоимость ЭЛП; I – затраты на исходное сырье; IMI – затраты на упаковочные материалы; Z – наценка (указана в Приложении № 3 постановления) (табл. 1); Н – налог.
Следует обратить внимание на то, что действующая методика ценообразования для ЭЛП нацелена на стимулирование изготовления гомеопатических ЛП, а установленные наценки на ЭЛП в зависимости от ЛФ исключают тариф на изготовление парентеральных ЛФ (рис. 2).
Таблица 1. Наценки на экстемпоральные лекарственные препараты в зависимости от лекарственной формы
Table 1. Margins for extemporaneous medicinal products depending on dosage form
|
Лекарственная форма / Dosage form |
Наценка, евро / Margin, euros |
|
Глазные капли / Eye drops |
1,42 |
|
Назальные капли / Nasal drops |
1,42 (≤5 ингредиентов) / 1,42 (≤5 ingredients) 2,13 (>5 ингредиентов) / 2,13 (>5 ingredients) |
|
Гомеопатические формы / Homeopathic forms |
7,11 (C200, разведение) / 7,11 (C200, dilution) 14,23 (С1000, разведение) / 14,23 (C1000, dilution) |
|
Порошок / Powder |
0,07 (простой порошок) / 0,07 (plain powder) 0,71 (сложный дозированный порошок, за каждые 10 единиц) / 2,13 (сложный недозированный порошок) / 2,13 (complex non-dosed powder) |
|
Суппозитории / Suppositories |
1,42 (за каждые последующие 10 единиц) / 1,42 (for every 10 units thereafter) 4,27 (10 единиц в упаковке) / 4,27 (10 units in a package) |
|
Растворы, микстуры, настойки / |
1,42 (≤3 ингредиентов) / 1,42 (≤3 ingredients) 2,13 (>3 ингредиентов) / 2,13 (>3 ingredients) |
|
Мази / Ointments |
1,71 (≤3 ингредиентов) / 1,71 (≤3 ingredients) 2,13 (4–5 ингредиентов) / 2,13 (4–5 ingredients) 2,85 (>5 ингредиентов) / 2,85 (>5 ingredients) |
|
Ароматные воды / Fragrant waters |
1,42 |
|
Суспензии и эмульсии / Suspensions and emulsions |
0,5 |
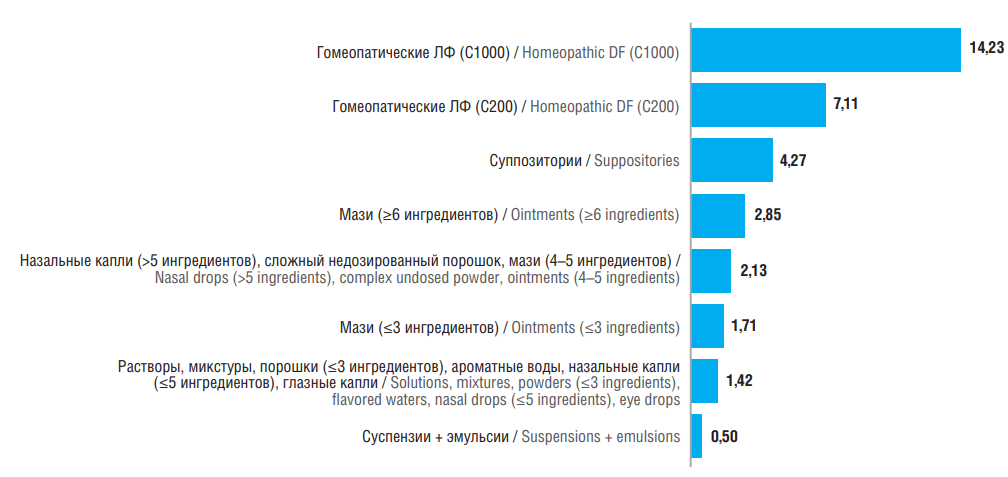
Рисунок 2. Наценки на экстемпоральные лекарственные препараты в зависимости от лекарственной формы (ЛФ). Самые высокие наценки отмечены для гомеопатических ЛФ
Figure 2. Margins for extemporaneous medicinal products depending on dosage form (DF). The highest margins are noted for homeopathic DFs
Если аптека готовых ЛФ заключает договор с производственной аптекой, стоимость закупки ЭЛП будет формироваться по формуле:
C = I + IMI + Z,
где C – стоимость ЭЛП; I – затраты на сырье; IMI – затраты на упаковочные материалы; Z – наценка (не должна превышать 10% стоимости ЭЛП).
Правила надлежащей производственной практики и контроль качества / Rules for good manufacturing practice and quality control
Постановление Кабинета министров Латвии от 1 июля 2006 г. № 304 «Об утверждении правил надлежащей производственной практики и контроле качества лекарственных препаратов» (ред. от 31 января 2022 г.; латыш. Noteikumi par zāļu ražošanas un kontroles kārtību, par zāļu ražošanu atbildīgās amatpersonas kvalifikācijas prasībām un profesionālo pieredzi un kārtību, kādā zāļu ražošanas uzņēmumam izsniedz labas ražošanas prakses sertifikātu, далее – Постановление № 304) устанавливает требования к производству и контролю качества [15] зарегистрированных ЛП, а также требования к контролю качества ЭЛП. Согласно гл. 2 для изготовления ЛП аптечной организации не требуется получение отдельной лицензии на производство ЛС.
В соответствии с гл. 6 Постановления № 304 ЭЛП разделяют на «магистральные ЛП» (ЛП, на которые отсутствует монография в Европейской фармакопее) и «официнальные ЛП» (ЛП, на которые есть монография в Европейской фармакопее). Во всех проанализированных авторами научных статьях и нормативных правовых документах отсутствует упоминание об изготовлении парентеральных ЛФ, а также конкретизация требований к асептическому блоку производственных аптек, из чего следует вывод: изготовление таких видов ЛФ запрещено, несмотря на отсутствие прямого запрета в законодательстве Латвии. Одновременно, как показано ранее, действующая методика ценообразования не преду-
сматривает изготовление парентеральных ЛФ. Дополнительно имеются сведения о том, что производственные аптеки перестали изготавливать парентеральные ЛФ в 2002–2004 гг. [16].
Контроль качества ЭЛП осуществляется посредством следующих видов контроля:
– для всех ЛП обязательными являются:
- письменный (проверка паспорта письменного контроля, в котором указываются: дата изготовления ЛП, номер рецепта или требования, наименования взятых фармацевтических субстанций, вспомогательных веществ и их количества, число доз, подписи лиц, изготовивших, расфасовавших и проверивших ЛП),
- органолептический (проверка внешнего вида, запаха, однородности смешивания, отсутствия механических включений – для жидких ЛФ),
- контроль при отпуске (проверка упаковки, маркировки, реквизитов рецепта, соответствия высших разовых и высших суточных доз, которые указаны в приложении № 8 Постановления № 304);
– выборочно:
- физический, который заключается в проверке общей массы или объема ЛП, количества и массы отдельных доз,
- химический, который заключается в оценке качества ЭЛП по показателям качественного (подлинность) и количественного анализа (количественное определение), одновременно обязательному химическому контролю подвергаются вода очищенная и вода для инъекций, глазные капли и глазные мази, ЛП, предназначенные для новорожденных и детей до 1 года жизни, все концентрированные растворы и полуфабрикаты, спирт этиловый, внутриаптечные заготовки – посерийно (в соответствии с постановлением Министерства здравоохранения Латвии от 1 августа 2007 г. № 416 «Обращение и контроль качества лекарственных средств» (латыш. Zāļu izplatīšanas un kvalitātes kontroles kārtība) [17], при этом Постановлением № 304 не конкретизированы правила отбора проб,
- опросный, при котором фармацевтическим работником, осуществляющим контрольную функцию, называется первое входящее в состав ЛП лекарственное средство, после чего фармацевтом указываются все иные используемые ЛС и их количества.
Согласно п. 53 раздела 6 Постановления № 304 исходное сырье, которое используется для изготовления ЭЛП, подлежит обязательному приемочному контролю, включающему в себя проверку сопроводительных документов, герметичности упаковки и маркировки, а также органолептический контроль (при возможности).
В соответствии с Постановлением № 57 на этикетке ЭЛП должен быть указан срок годности (латыш. derīguma termiņš). Однако в нормативной правовой документации Латвии отсутствует информация о правилах определения сроков годности на ЭЛП. Исходя из доступных исследований [10], они определяются в соответствии с разными источниками научных данных, таких как немецкий формуляр DAC/NRF [18], сборник рецептур USP Compounding Compendium [19], австралийское руководство по препаратам, изготавливаемым в АО [20], формуляр Fargon [21]. Средний срок годности ЭЛП составляет 1–2 мес в зависимости от стабильности ЛП.
Перед открытием аптеки для получения лицензии руководитель составляет список необходимых устройств и оборудования для работы рецептурно-производственного отдела АО, который указан в Приложении № 3 Постановления № 304: фотоколориметр, устройство для контроля растворов на отсутствие механических включений, лабораторный термометр, водяная баня, pH-метр, рефрактометр, ручные весы, штативы, электронные весы, ультрафиолетовая лампа для определения витаминных смесей, сушильный шкаф, спиртовка, ареометр.
Список концентрированных растворов и полуфабрикатов, которые используются при изготовлении ЛП, утверждается руководителем АО. В соответствии с вышеуказанным постановлением фармацевтические субстанции, которые используются для изготовления ЛП, должны быть занесены в специальную базу Eudra GMP [22].
Форма журнала регистрации результатов контроля качества ЛП, очищенной воды, концентратов, полуфабрикатов, спирта, использованных фармацевтических субстанций, вспомогательных веществ и других материалов содержится в Приложении № 4 Постановления № 304. Ежегодно руководитель подает годовой отчет по результатам контроля качества изготовленных ЛП в Государственное агентство лекарственных средств Латвии. В отчете указываются:
– наименование АО, адрес;
– номер лицензии, в которой должно быть указано право аптеки на изготовление ЛП;
– количество контрольных операций (физический контроль, количественный и качественный химический анализ) для оценки качества по каждому объекту – концентрированные растворы, полуфабрикаты, вода очищенная, вода для инъекций, ЭЛП, фармацевтические субстанции, предназначенные для изготовления ЛП;
– дата и подпись руководителя аптеки.
В отдельном столбце отчета должно быть указано количество отрицательных результатов анализа.
Государственное агентство по регулированию обращения лекарственных средств Латвии должно проводить проверки (инспекции) в АО, занимающихся изготовлением ЛП, не реже одного раза в год. Один раз в полгода АО отправляет в лабораторию на исследование образцы изготовленных ЛП, концентратов и полуфабрикатов, а также полученную воду очищенную и воду для инъекций, которые используются при изготовлении ЛП.
Требования к фармацевтическим субстанциям / Requirements for pharmaceutical substances
Во всех проанализированных нормативных правовых документах нет однозначного ответа на вопрос, из чего изготавливают ЛП. В п. 30.1.1 постановления Кабинета Министров от 25 июня 2013 г. № 344 (ред. от 17 декабря 2021 г.; латыш. Aktīvo vielu importēšanas un izplatīšanas kārtība) [23] указано, что к АО, обладающим правом на изготовление ЛП, выставляется требование по закупке фармацевтических субстанций (латыш. аktīvā viela) для изготовления ЛП у производителей, импортеров и дистрибьюторов, зарегистрированных в Государственном агентстве по регулированию обращения лекарственных средств Латвии. Исходя из вышесказанного, можно сделать вывод о том, что изготовление ЭЛП допускается только из фармацевтических субстанций, однако это противоречит проведенным исследованиям [10][24], где в качестве исходного сырья используются зарегистрированные ЛП.
Критерии расположения аптек / Criteria for pharmacies location
В п. 6 постановления Кабинета министров Латвии от 12 августа 2011 г. № 610 «Критерии расположения аптек» (ред. от 7 мая 2016 г.; латыш. Aptieku un aptieku filiāļu izvietojuma kritēriji) [25] указано, что при наличии права на изготовление ЛП в аптеке устанавливается ограничение на расположение других АО в радиусе 500 м, из-за чего выросло количество производственных аптек на территории Латвии. При этом, если аптека не имеет соответствующего права, к ней предъявляются более жесткие требования. Согласно данным Государственного агентства по регулированию обращения лекарственных средств Латвии количество таких аптек составляло 384 в 2017 г. (50,07% аптек Латвии), при этом только 280 аптек предоставили отчет по реализации ЭЛП [10, 26].
Основные этапы развития регулирования производственных аптек / The main stages of production pharmacies regulation development
Схематично основные этапы развития нормативного правового регулирования изготовления ЛП аптечными организациями Латвии представлены на рисунке 3.
В 2011 г. Комитет министров Совета Европы принял Резолюцию о требованиях к качеству и безопасности изготовления лекарственных препаратов в аптечных организациях для особых нужд пациентов (англ. ResAP (2011) 1 on quality and safety assurance requirements for medicinal products prepared in pharmacies for the special needs of patients, далее – Резолюция ResAP), которая была обновлена в 2016 г. и включает положение о разведении (восстановлении) ЛП . Резолюция ResAP устанавливает, что ЭЛП можно классифицировать по двум категориям уровня риска – «препараты с высоким уровнем риска» и «препараты с низким уровнем риска» в связи с различными подходами к обеспечению качества изготавливаемых ЛП, а также уровнем необходимой безопасности при производстве ЛП (токсического воздействия на организм фармацевтических работников, медицинского персонала). Рекомендуется использовать в качестве справочника при изготовлении группы «препаратов с высоким риском» Руководство по надлежащей производственной практике лекарственных препаратов PIC/S или Руководство по надлежащей практике изготовления лекарственных препаратов PIC/S для «препаратов с низким уровнем риска» [3].
Латвия, являясь членом ЕС, начиная с постановления Министерства здравоохранения Латвии от 22 декабря 2017 г. № 259 «Стратегия Государственного агентства по регулированию обращения лекарственных средств Латвии на период 2017–2019 годов» (латыш. Zāļu valsts aģentūras darbības stratēģija 2017–2019 gadam) [10][11][27] декларирует необходимость гармонизации национального законодательства, регулирующего деятельность по изготовлению ЛП в МО, в т.ч. с Резолюцией ResAP. Приоритетные направления в отношении ЭЛП приведены на рисунке 4.
Аналогичные тезисы были указаны в постановлении Министерства здравоохранения Латвии от 27 августа 2020 г. № 168 «Стратегия Государственного агентства лекарственных средств Латвии на период 2020–2022 годов» [28]. Кроме того, в 2017 г. был подготовлен прямой перевод Руководства по надлежащей практике изготовления лекарственных препаратов PIC/S, выпущенного в виде методических рекомендаций [29].
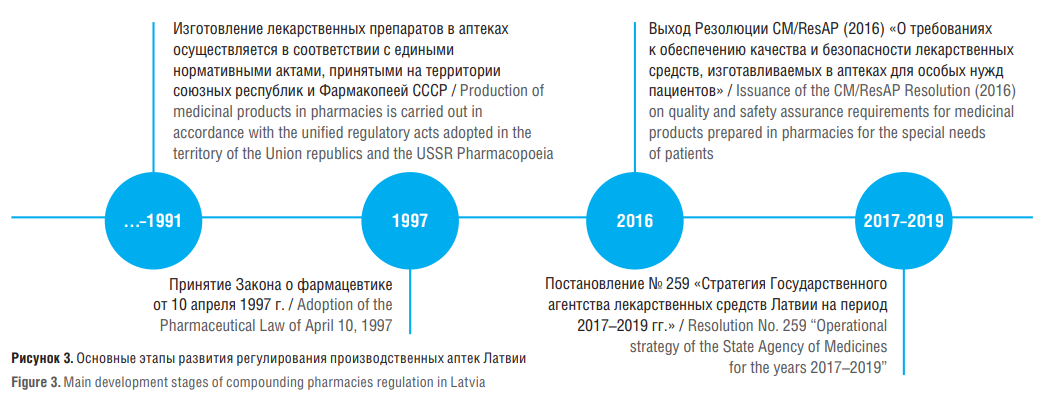
Рисунок 3. Основные этапы развития регулирования производственных аптек Латвии
Figure 3. Main development stages of compounding pharmacies regulation in Latvia

Рисунок 4. Приоритетные направления развития производственных аптек в Латвии.
ЛП – лекарственные препараты
Figure 4. Priority directions of development of compounding pharmacies in Latvia
MPs – medicinal products
СРАВНЕНИЕ С РОССИЙСКИМ ЗАКОНОДАТЕЛЬСТВОМ / COMPARISON WITH RUSSIAN LEGISLATION
По результатам анализа и систематизации нормативного правового поля производственных аптек Латвии отмечается высокая степень сходства с текущим состоянием российского законодательства, а также отстающий уровень технологического развития производственных аптек от других развитых систем здравоохранения (например, США, Германии и др.).
Можно выделить основные схожие с законодательством РФ элементы:
– ЛП, изготавливаемые АО, не подлежат государственной регистрации;
– допускается изготовление ЛП из зарегистрированных препаратов (в РФ стало вновь возможным с 1 сентября 2023 г.);
– наблюдается схожая категоризация видов АО (аптека, осуще-
ствляющая розничную торговлю (отпуск) ЛП, аптека как структурное подразделение МО, ветеринарная аптека);
– отмечается высокий уровень сопоставимости регуляторных подходов ввиду исторического фактора – значительное количество особенностей организации фармацевтической деятельности по изготовлению ЛП в аптеках напрямую соответствует законодательству РФ в части соблюдения единых нормативных актов, принятых на территории союзных республик и Фармакопеей СССР, что говорит об отсутствии приоритета со стороны латвийской системы здравоохранения, а также целенаправленной и системной государственной политики по развитию необходимых компетенций, технологий изготовления ЛП и современной аптечной инфраструктуры.
Говоря об основных различиях, необходимо выделить следующие:
– понятия «фармацевтическая практика» и «фармацевтическая помощь» в Латвии установлены на законодательном уровне;
– фармацевтические услуги (работы) АО Латвии предоставляют пациентам более широкий перечень (например, измерение уровня сахара, холестерина, давления, проведение вакцинации);
– порядок лицензирования фармацевтической деятельности и производства ЛС включены в один нормативный документ;
– порядок лицензирования предусматривает, что АО, не обладающая правом на изготовление и отпуск ЛП, вправе подписать договор оказания (выполнения) аутсорсинговых услуг (работ) со сторонней АО, наделенной указанным правом, что позволяет эффективным образом повысить доступность ЭЛП;
– законодательство Латвии не конкретизирует классы изготавливаемых ЛП (как, например, радиофармацевтические) и, соответственно, не выделяет такой тип производственных аптек, как «аптека производственная с правом изготовления радиофармацевтических лекарственных препаратов»;
– производственные аптеки Латвии не осуществляют изготовление парентеральных ЛФ, в связи с чем отсутствует и тип производственной аптеки как «аптека производственная с правом изготовления асептических лекарственных препаратов» (при этом Закон Латвии гармонизирован с Правилами надлежащей аптечной практики на территории ЕС, а также с Руководством FIP/ВОЗ по надлежащей аптечной практике, что дает все основания производственным аптекам Латвии для повышения уровня обеспечения качества при изготовлении ЛП);
– имеются определенные особенности и требования к производственным помещениям, где основным отличием является требование о наличии отдельного оборудованного помещения для хранения ЭЛП, предназначенных для отпуска в МО, которое предъявляется, соответственно, к аптекам, осуществляющим изготовление ЛП для МО;
– сроки годности на изготавливаемые ЛП не установлены законодательством Латвии и определяются в соответствии с разнообразными источниками научных данных, например немецким формуляром DAC/NRF, сборником рецептур USP Compounding Compendium, австралийским руководством по препаратам, изготавливаемым в АО, формуляром Fargon (средний срок годности изготавливаемых ЛП составляет 1–2 мес в зависимости от стабильности ЛП);
– в законодательстве Латвии сохранена интеграция производственных аптек с государственными контрольно-аналитическими лабораториями и центрами контроля качества ЛС (при этом в конце года руководитель отправляет годовой отчет по результатам контроля качества изготовленных ЛП в Государственное агентство лекарственных средств Латвии, что является качественной отличительной особенностью от российского законодательства, хотя ранее было в нем предусмотрено);
– фасовка ЛС (фармацевтической продукции) допускается только в аптеках, являющихся структурными подразделениями МО.
В качестве предложений, которые могут рассматриваться для совершенствования процессов обращения ЭЛП на территории РФ можно рассматривать:
– имплементацию походов PIC/S по вопросам изготовления ЛП как эффективный путь развития системы обеспечения качества производственных аптек на территории РФ;
– разработку и внедрение механизма заключения договора об оказании аутсорсинговых услуг по изготовлению ЛП между АО, что позволит повысить уровень лекарственного обеспечения и доступности ЭЛП в амбулаторном звене.
Основу дальнейшего развития производственных аптек РФ составляют приоритеты, стоящие перед органами законодательной и исполнительной государственной власти, а также глубокое отраслевое понимание последовательности развития фармацевтической деятельности в области изготовления и отпуска ЛП и взаи-
мосвязанные действия по внесению изменений в нормативные правовые документы РФ. При этом параллельно потребуется дальнейший переход нормативных требований к единой системе обеспечения качества и безопасности изготавливаемых АО препаратов – Правилам надлежащей практики изготовления и отпуска лекарственных препаратов для медицинского применения, которые должны описывать единые подходы к формированию системы обеспечения качества для всех типов АО [30].
ЗАКЛЮЧЕНИЕ / CONCLUSION
При всей объективной сложности современных требований к организации безопасной фармацевтической деятельности по изготовлению ЛП вопрос заключается в решении технологической задачи – создании специализированных АО, обладающих достаточными инвестиционными, организационными, технологическими и квалификационными ресурсами.
Самым главным аспектом в развитии высокотехнологичного аптечного изготовления ЛП является степень востребованности услуг (работ) по изготовлению ЛП и фасовке зарегистрированных ЛП со стороны системы здравоохранения. Цели органов управления системой здравоохранения и оплачивающих медицинскую помощь организаций, в частности страховых компаний – Фонда обязательного медицинского страхования и его территориальных органов, в первую очередь должны заключаться в достижении максимальной эффективности затрат на лекарственную терапию.
Услуги АО по индивидуальному изготовлению ЛП и работы по индивидуальной фасовке зарегистрированных ЛП позволяют существенно повысить эффективность затрат, а также обеспечить практически полную персонификацию лекарственной терапии, что способствует устранению ошибок при планировании закупок ЛП, обеспечивает невозможность повторного ввода в оборот фармацевтической продукции в сравнении с готовыми ЛФ.
По аналогии с эволюцией регуляторных требований к производству ЛП, регуляторные требования к аптечному изготовлению ЛП будут последовательно повышаться и претерпевать изменения. Обеспечение рентабельности аптечного изготовления ЛП с учетом роста расходов на организацию такой фармацевтической деятельности будет достигаться за счет экономического эффекта, который получает в целом система здравоохранения.
Обязательное использование услуг по индивидуальному изготовлению ЛП и работ по индивидуальной фасовке зарегистрированных ЛП должно стать приоритетом для российской системы здравоохранения, поскольку персонификация лекарственной терапии позволяет решить многие организационные и финансовые задачи МО, а также повысить эффективность расходов для всех уровней бюджетов системы здравоохранения, включая индивидуальные средства граждан.
1. GMP (англ. good manufacturing practice) – надлежащая производственная практика.
Список литературы
1. Мамедов Д.Д., Юрочкин Д.С., Голант З.М. и др. Прошлое, текущее и будущее нормативного правового регулирования аптечного изготовления лекарственных препаратов в Российской Федерации. Фармация и фармакология. 2023; 11 (3): 176–92. https://doi.org/10.19163/2307-9266-2023-11-3-176-192.
2. Фисенко В.С., Фаррахов А.З., Мамедов Д.Д. и др. Обзор судебной практики в отношении государственных закупок экстемпоральных лекарственных препаратов за 2012–2022 годы. Вестник Росздравнадзора. 2023; 5: 19–30.
3. Наркевич И.А., Фисенко В.С., Голант З.М. и др. Основы формирования единой гармонизированной системы нормативного правового регулирования в области обращения лекарственных препаратов, изготавливаемых аптечными организациями: монография. СПб.: Медиапапир; 2023: 292 с.
4. Мамедов Д.Д., Юрочкин Д.С., Лешкевич А.А. и др. Нормативное правовое регулирование изготовления лекарственных препаратов аптечными организациями: опыт североамериканского фармацевтического рынка. ФАРМАКОЭКОНОМИКА. Современная фармакоэкономика и фармакоэпидемиология. 2023; 16 (1): 80–6. https://doi.org/10.17749/2070-4909/farmakoekonomika.2022.155.
5. Мамедов Д.Д. Концепция надлежащей практики изготовления лекарственных препаратов в Германии. В кн.: Современный мир, природа и человек: сборник материалов XXII Международной научно-практической конференции (Кемерово, 10 октября 2023 г.). Кемерово: КемГМУ; 2023: 294–302.
6. Pharmaceutical Law. URL: https://likumi.lv/ta/en/en/id/43127 (дата обращения 10.04.2023).
7. Procedures for the licensing of pharmaceutical activity. URL: https://likumi.lv/ta/en/en/id/238458 (дата обращения 10.04.2023).
8. State Agency of Medicines Republic of Latvia. URL: https://www.zva.gov.lv/en (дата обращения 10.04.2023).
9. Regulations regarding operating of pharmacies. URL: https://likumi.lv/ta/en/en/id/207397 (дата обращения 10.04.2023).
10. Kiseļova O., Mauriņa В., Šidlovska V., Zvejnieks J. The extent of extemporaneous preparation and regulatory framework of extemporaneous compounding in Latvia. Medicina. 2019; 55 (9): 531. https://doi.org/10.3390/medicina55090531.
11. Kiseļova O. Availability of extemporaneous preparations in pharmacies in Latvia: a quantitative and qualitative assessment of the situation and future perspectives. URL: https://dspace.rsu.lv/jspui/bitstream/123456789/7730/1/2022-02_Kiseljova-Olga_DTS%2B_IPD-1888.pdf (дата обращения 10.04.2023).
12. Regulations regarding manufacture and storage of prescription forms, as well as writing out and storage of prescriptions. URL: https://likumi.lv/ta/en/en/id/104228 (дата обращения 10.04.2023).
13. Regulations regarding procedures for the labelling of medicinal products and the requirements to be set for the package leaflet of medicinal products. URL: https://likumi.lv/ta/en/en/id/126348 (дата обращения 10.04.2023).
14. Regulations regarding the principles for the determination of the price of medicinal products. URL: https://likumi.lv/ta/en/en/id/120074 (дата обращения 10.04.2023).
15. Regulations regarding the procedures for the manufacture and control of medicinal products, the requirements for the qualification and professional experience of a qualified person and the procedures for the issuance of the certificate of good manufacturing practice to a medicinal product manufacturing undertaking. URL: https://likumi.lv/ta/en/en/id/134261 (дата обращения 10.04.2023).
16. Zariņa O.P. Hopi's statements on the market for medicines in the EU are not true. URL: https://sejas.tvnet.lv/6212030/olita-zarina-papina-izteikumi-par-zalu-tirgu-es-neatbilst-patiesibai (на латыш. яз.) (дата обращения 10.04.2023).
17. Procedures regarding the distribution and quality control of medicinal products. URL: https://likumi.lv/ta/en/en/id/159645 (дата обращения 10.04.2023).
18. DAC/NRF. URL: https://dacnrf.pharmazeutische-zeitung.de/ (на нем. яз.) (дата обращения 10.04.2023).
19. USP Compounding Compendium. URL: https://www.usp.org/products/usp-compounding-compendium (дата обращения 10.04.2023).
20. Australian Pharmaceutical Formulary. URL: https://apf.psa.org.au/ (дата обращения 10.04.2023).
21. Fagron. Formulary. URL: https://fagron.com/formulary/overview/?q= (дата обращения 10.04.2023).
22. EudraGMDP. URL: http://eudragmdp.ema.europa.eu/ (дата обращения 10.04.2023).
23. Procedures for importing and distributing active substances. URL: https://likumi.lv/ta/en/en/id/257857 (дата обращения 10.04.2023).
24. Kiselova O., Maurina B., Sidlovska V., Rogovska I. Trends of extemporaneous drug prescription in Latvia in 2017. Int J Pharm Comp. 2019; 23 (3): 245–9.
25. Criteria for the location of pharmacies and pharmacy branches. URL: https://likumi.lv/ta/en/en/id/234279 (дата обращения 10.04.2023).
26. Official statistics portal. URL: https://stat.gov.lv/en (дата обращения 10.04.2023).
27. Operational strategy of the State Agency of Medicines for the years 2017–2019. URL: https://www.zva.gov.lv/sites/default/files/inline-files/ZVA%20Strategija-2017-2019-20180102.pdf (на латыш. яз.) (дата обращения 10.04.2023).
28. Operational strategy of the State Agency of Medicines for the years 2020–2022. URL: https://www.zva.gov.lv/sites/default/files/inline-files/strategija%202020-2022.pdf (на латыш. яз.) (дата обращения 10.04.2023).
29. PIC/S guide to good practices for the preparation of medicinal products in healthcare establishments. URL: https://www.vvc.gov.lv/lv/starptautiskie-tiesibu-akti/pics-guide-good-practices-preparationmedicinal-products-healthcare-establishments (дата обращения 10.04.2023).
30. Фаррахов А.З., Соломатина Т.В., Мамедов Д.Д. и др. Основы формирования стратегии развития сегмента изготовления и отпуска лекарственных препаратов в Российской Федерации. Вестник Росздравнадзора. 2023; 6: 6–17.
Об авторах
Д. Д. МамедовРоссия
Мамедов Деви Девивич – младший научный сотрудник лаборатории регуляторных отношений и надлежащих практик.
Ул. Профессора Попова, д. 14, лит. А, Санкт-Петербург 197022
Д. С. Юрочкин
Россия
Юрочкин Дмитрий Сергеевич – научный сотрудник лаборатории регуляторных отношений и надлежащих практик.
Ул. Профессора Попова, д. 14, лит. А, Санкт-Петербург 197022
Д. Д. Зеликова
Россия
Зеликова Дарья Дмитриевна – лаборант лаборатории регуляторных отношений и надлежащих практик.
Ул. Профессора Попова, д. 14, лит. А, Санкт-Петербург 197022
С. Э. Эрдни-Гаряев
Россия
Эрдни-Гаряев Сергей Эдуардович – старший преподаватель кафедры физической и коллоидной химии.
Ул. Профессора Попова, д. 14, лит. А, Санкт-Петербург 197022
З. М. Голант
Россия
Голант Захар Михайлович – к.э.н., заведующий лабораторией регуляторных отношений и надлежащих практик.
Ул. Профессора Попова, д. 14, лит. А, Санкт-Петербург 197022
И. А. Наркевич
Россия
Наркевич Игорь Анатольевич – д.фарм.н., профессор, ректор; WoS ResearcherID: C-1131-2014.
Ул. Профессора Попова, д. 14, лит. А, Санкт-Петербург 197022
Рецензия
Для цитирования:
Мамедов Д.Д., Юрочкин Д.С., Зеликова Д.Д., Эрдни-Гаряев С.Э., Голант З.М., Наркевич И.А. Нормативное правовое регулирование изготовления лекарственных препаратов аптечными организациями: опыт латвийского фармацевтического рынка. ФАРМАКОЭКОНОМИКА. Современная фармакоэкономика и фармакоэпидемиология. 2024;17(1):106-117. https://doi.org/10.17749/2070-4909/farmakoekonomika.2024.189
For citation:
Mamedov D.D., Yurochkin D.S., Zelikova D.D., Erdni-Garyaev S.E., Golant Z.M., Narkevich I.A. Compounding pharmacy regulations: experience of the Latvian pharmaceutical market. FARMAKOEKONOMIKA. Modern Pharmacoeconomics and Pharmacoepidemiology. 2024;17(1):106-117. (In Russ.) https://doi.org/10.17749/2070-4909/farmakoekonomika.2024.189

Контент доступен под лицензией Creative Commons Attribution-NonCommercial-ShareAlike 4.0 International License.






































